Лечение народными средствами дирофиляриоза у
Обновлено: 23.04.2024
Местами обитания возбудителя дирофиляриоза являются страны Средней Азии, Армения, Грузия, Азербайджан, южная часть России, Украины, Казахстан. Переносчиками дирофилярий считают комаров, которые кусают животных и заражают человека. Наиболее часто встречается у человека Dirofilaria repens – гельминтоз, для которого характерно длительное хроническое течение болезни.
Случаи дирофиляриоза официально не регистрируются, поэтому распространенность заболевания среди людей неизвестна.
Как распознать заболевание
После укуса комара-носителя, в этом месте появляется уплотнение, размером с просяное зерно, возникает зуд (который никого не настораживает, поскольку является естественной реакцией на комариные ферменты). Вскоре уплотнение и зуд исчезают. А когда спустя некоторое время место поражения снова уплотняется и увеличивается, достигая размеров 0,5-4 см, человек уже не соотносит это явления с комариным укусом и попросту не обращает внимания до проявления болевых симптомов и других характерных признаков. Кожа в этом месте становится отечной и гиперемированной. Возникновение вторичного воспалительного процесса вызывает умеренный (в очень редких случаях, сильный, нестерпимый зуд и расчесы), сопровождается болезненными ощущениями как при покое, так и во время прикосновения.
Дирофиляриозом могут заболеть люди всех возрастных категорий, но большей опасности подвергаются те, которые имеют непосредственный контакт с переносчиками гельминтоза – комарами.
В группу риска входят:
- жители приречной, приозерной, заболоченной местности;
- работники сельского хозяйства, в частности – рыбхоза, лесхоза;
- дачники, рыбаки, охотники;
- владельцы собак (реже – кошек);
- путешественники (особенно, любители зеленого туризма).
Необходимо учитывать, что комары являются основным, но не единственным переносчиком дирофилярий, поэтому после укусов других кровососущих насекомых (слепней, вшей, блох, клещей) так же возможны проявления признаков заражения.
Инкубационный период составляет от 1 месяца до нескольких лет и зависит от состояния иммунной системы организма и скорости развития паразита. В большинстве случаев у человека обнаруживают всего одну особь неполовозрелой самки, поэтому вероятность появления микрофилярий у людей так ничтожно мала. В среднем, требуется около полугода для того, чтобы паразит достиг своих максимальных размеров, располагаясь внутри воспаленного узла. Как правило, местом локализации возбудителя заболевания является соединительно-тканная капсула, заполненная серозно-гнойным экссудатом с повышенным содержанием белка, эозинофильных и нейтрофильных лейкоцитов, которыми пропитана подкожно-жировая клетчатка. Для паразитов типично местонахождение - под кожей или в слизистой оболочкой, однако встречаются случаи, при которых очагом поражения становятся легкие, плевра, сердечная мышца. Гельминт со временем гибнет, постепенно разлагаясь в тканях организма, вызывая воспаления и некрозы близлежащих тканей.
Основные симптомы дирофиляриоза
Для 10-40% людей, инвазированных возбудителем дирофиляриоза, типичным симптомом является миграция уплотнения или самого паразита под кожей. Гельминт может перемещаться на расстояние в несколько десятков сантиметров, при этом скорость его движения может составлять 30 см за 1-2 суток. В каждом новом месте после миграции паразита появляется уплотнение, а на старом месте обитания оно бесследно исчезает. При проведении физиотерапии, под воздействием токов УВЧ на кожу, согревающих мазей или прогревающих компрессов, отмечается увеличение скорости миграции гельминта.
Характерный признак дирофиляриоза – ощущение ползания и шевеления живого паразита внутри подкожного узла, опухоли или уплотнения. У большинства больных отмечается рецидив инвазии с фазами ремиссии и обострения процесса. Если своевременно не удалить гельминт, в месте его локализации может образоваться абсцесс.
Дирофиляриоз глаз – самая распространенная и видимая форма заболевания
В 50% случаев заболевания дирофиляриозом, паразит локализуется под кожей век, под конъюнктивой и слизистой оболочкой, а иногда - в глазном яблоке.
При этой форме заболевания происходит поражение век, конъюнктивы, передней камеры глаза, глазницы и склеры. Поражение кожи век и бровей сопровождается отеком по типу Квинке, причиной которого является паразитирование дирофилярии в подкожно-жировой клетчатке. Клинически это проявляется отечностью, пастозностью век и их малоподвижностью, сопровождается зудом, слезотечением, болезненностью при пальпации. Некоторые пациенты жалуются на ощущение инородного тела в глазу и шевеление в уплотненной области глаза. Кроме этого, типичными признаками являются блефароспазм, гиперемия кожи век. Под кожей появляется гранулема, опухоль или небольшие уплотненные узелки. Иногда можно невооруженным глазом увидеть присутствие дирофилярии в конъюнктиве глаза. Острота зрения при заболевании остается неизменной, однако может отмечаться повышение внутриглазного давления.
Диагностика, лечение и профилактика
Дополнительные меры профилактики: использование репеллентов, москитных сеток для окон, защитной одежды, профилактическая дегельминтация домашних питомцев – все эти нехитрые предосторожности способны уберечь вас от скальпеля хирурга.
Дирофиляриоз — один из гельминтозов, ранее считавшихся исключительно зооспецифическим и до недавнего времени бытовало мнение, что этому заболеванию подвержены исключительно животные. В первую очередь — собаки. Но в последние годы все чаще стали регистрироваться случаи заражения людей.
Дирофиляриоз: симптомы, подкожный и внутренний дирофиляриоз у человека, лечение и профилактика
Дирофиляриоз — один из гельминтозов, ранее считавшихся исключительно зооспецифическим и до недавнего времени бытовало мнение, что этому заболеванию подвержены исключительно животные. В первую очередь — собаки. Но в последние годы все чаще стали регистрироваться случаи заражения людей.
Дирофиляриоз (Dirofilariasis) — относится к ларвальным гельминтозам. То есть, при этом заболевании паразитирует не взрослая особь нематоды, а ее личинка, не достигшая половой зрелости. Разносчиками заразы являются комары, поэтому наиболее часто этот гельминт встречается в теплом климате: от Австралии, Южной Америки и Африки до Юга России и Средней Азии. На протяжении последних лет наибольшее количество заболевших дирофиляриозом регистрировалось в Иране и Греции. Но в последние годы все чаще регистрируют эту болезнь и в умеренном климате.
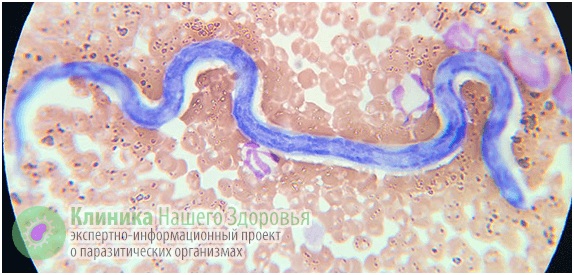
Так, на территории Российской Федерации на протяжении нескольких лет выявляют по 35-40 случаев дирофиляриоза ежегодно. Причем география заражения весьма обширна — от теплого Ростова, умеренных климатических зон Тулы и Рязани, до морозной Сибири. На самом же деле уровень заболеваемости может быть значительно выше. Поскольку этот вид гельминтоза долго считался присущим только животным, то медики его не изучали, и на сегодняшний день о нем мало знают и не сразу могут поставить верный диагноз.
Причины возникновения дирофиляриоза
Как происходит заражение дирофиляриозом?
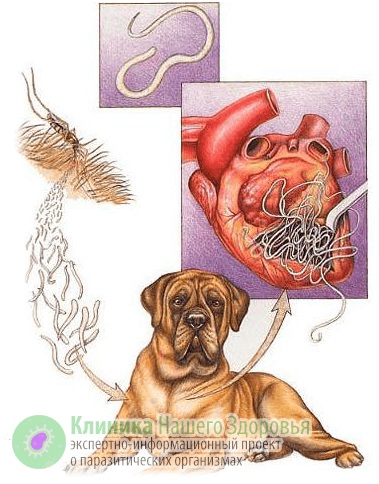
Механизм заражения у людей — трансгемный, то есть инфицирование происходит через кровь. Передается болезнь, зачастую, через укусы комаров. Реже, через укусы блох, слепней и других видов кровососущих насекомых. А источником заразы, как это ни прискорбно, выступают наши домашние животные. В первую очередь собаки, изредка кошки. По данным ветслужбы до 30% собак, живущих в городах, страдают от упомянутой инвазии. В сельской местности этот показатель еще выше. В организме животного взрослые дирофилярии паразитируют в сердце, легких, бронхах и крупных кровеносных сосудах. Самки выделяют в кровь тысячи личинок-микрофилярий, которые имеют микроскопический размер — до 0,3 мм в длину. Именно поэтому они с кровотоком и лимфотоком разносятся по всему организму.
Микрофилярии так микроскопичны, что с кровью и лимфой попадают не только во все органы и ткани человека или животного, но даже преодолевают плацетнарный барьер и внутриутробно инфицируют плод. С кровью животного микрофилярия попадает к промежуточному хозяину — комару. Насекомое, в свою очередь, кусает инвазированное животное, личинки попадают в его брюшную полость, но часть из них остается в хоботке комара. Когда насекомое кусает следующую жертву — часть паразитов из хоботка попадает в кровоток следующего хозяина. Так дифиляриоз передается от животного к животному и к человеку.
У людей тотальная восприимчивость к дирофилриозу – то есть, если человека кусает инфицированный комар, то он заразится со 100% вероятностью. Но в наибольшей зоне риска заражения дирофиляриозом находятся некоторые категории людей, среди которых:
- заводчики собак и кошек;
- люди, проживающие у открытых водоемов;
- те, кто часто бывает на природе — охотники, туристы, огородники, рыбаки.
Этапы развития дирофиляриий
Когда комар (реже другое кровососущее насекомое) заглатывает личинку нематоды с кровью, та около суток остается у него в кишечнике. Затем микрофилярии мигрируют в обратном направлении — к хоботку комара, где дозревают до инвазивной стадии. В этот период, комар, кусает жертву и заражает ее дирофиляриозом.
У нового хозяина около трех месяцев личинки остаются в месте комариного укуса: в коже или в подкожной клетчатке. Именно тут микрофилярии линяет и уже более жизнеспособными попадают в кровоток и разносятся по организму. Паразитировать микрофилярия может около трех лет.
До половозрелости дирофилярия развивается только в организме животных. Человеческий организм для нее тупиковый вариант, так как большинство личинок все же гибнут в крови людей. Это значит, что человек не может быть источник заражения.
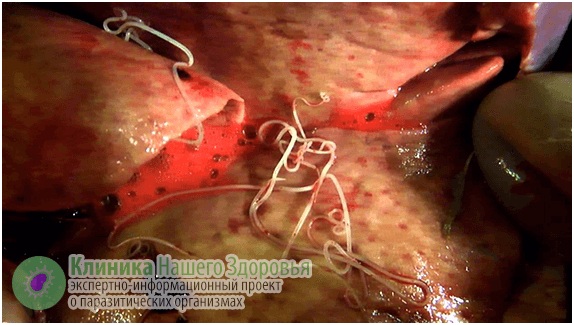
Воздействие дирофилярий на человека
Главная опасность дирофиляриоза — первичные реакции на месте внедрения микрофилярии. Может возникнуть сильная аллергическая реакция. Кроме того, кожа воспаляется, образуются уплотнения (шишки) довольно большого диаметра. Внутри этих уплотнений находится серозная жидкость и/или гной, внутри этого содержимого и обитает какое-то время дирофилярия. Часто паразит погибает, тогда уплотнение постепенно может само рассосаться. Но чаще все же требуется хирургическое вмешательство.
Виды дирофиляриоза
Инвазионное заболевание вызывает червь-паразит. Личинки нитевидной нематоды, вызывающие болезнь, бывают нескольких разновидностей, и поэтому заражение ими приводит к разным формам заболевания.
Dirofilaria repens и Dirofilaria immitis — основные виды, поражающие собак и реже кошек. Именно эти разновидности гельминта являются самыми распространенными среди заболевших людей, ведь в подавляющем большинстве случаев дирофиляриоз у человека появляется при укусе комара-переносчика, контактировавшего до этого с данными животными.
- Dirofilaria repens вызывает подкожную разновидность дирофиляриоза.
- Dirofilaria immitis — висцеральную.
В России и странах ближнего зарубежья встречается в основном подкожный дифиляриоз. Висцеральный дирофиляриоз распространен в жарких странах Азии, Японии, Индии, США, Африке, Канаде, Вьетнаме, Австралии, на юге Европы.
Симптомы и места распространения дирофиляриоза
Скрытая форма дирофиляриоза у человека длится от 1 до 12 месяцев. Основным симптомом является появление под кожей или слизистой, болезненного уплотнения, с покраснением и зудом на месте внедрения. При этом гельминт под кожей может перемещаться (со скоростью до 15 мм в сутки), что может быть заметно для человека, как по ощущениям, так и визуально. Часто, заметив на теле уплотнение похожее на опухоль, пациенты обращаются к хирургу, а тот решает, что это липома, опухоль, фиброма, атерома и т.п., а затем уже в ходе операции обнаруживает гельминта.
У дирофилярий есть любимые места на теле человека — это органы зрения, ноги и руки, шея, лицо, грудь, мошонка. Могут появиться такие симптомы, как слабость, пассивность, тошнота, нервозность, бессонница, повышенная температура, боли в голове и в области поражения паразитом. В 50 % случаев обычно поражаются органы зрения. Человек жалуется на ощущение чего-то ползающего в глазу, у него наблюдается покраснение век и глаз, блефароспазм. При перемещении гельминта возникает боль, слезотечение и зуд. Иногда через конъюнктиву виден сам гельминт.
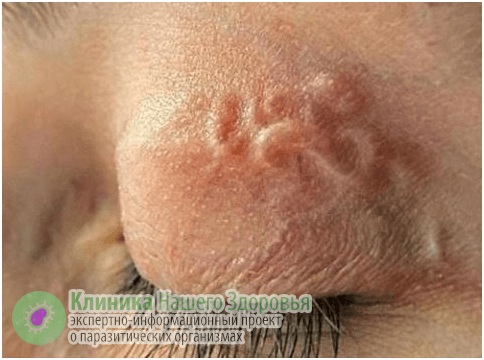
При нахождении дирофилярии в глазу вокруг нее образуется гранулема, что вызывает развитие экзофтальма и диплопии. Поражение глаз приводит к ослаблению зрения. Человек способен увидеть мигрирующего паразита. Наблюдения показали, что его перемещения усиливается под воздействием тепла.
Дифиляриоз обычно носит хронический характер, с рецидивами, характеризующимися периодами вспышек и затихания заболевания. Если вовремя не заняться лечением, вероятны воспаления тканей, и возникновение абсцесса.
Симптомы внутреннего дирофиляриоза
При этой разновидности паразитом поражаются легкие. Личинка живет в левом желудочке сердца и легочных артериях, образуя при этом фиброзную капсулу. Обычно болезнь протекает бессимптомно, реже вызывает боль в груди, кашель и кашель с кровью.
Заболевание часто выявляется случайно, например, при рентгене грудной клетки (видны узелки размером 1-2 см) или при оперировании легких.
Диагностика дирофиляриоза у человека
Диагностика заболевания представляет определенную сложность, так как её симптоматика схожа со многими другими заболеваниями, поэтому врачами часто ставится ложный диагноз и своевременное лечение затягивается. Основными жалобами пациентов являются появление мигрирующих подкожных узлов, ощущения перемещения паразита.
Диагноз дирофиляриоза можно подтвердить, сдав следующие анализы:
- анализ крови;
- после удаления паразита хирургом, проводится его макроскопическое исследование;
- проведение исследования на наличие серологической реакции, позволяющей обнаружить антиген паразита;
- аппаратная диагностика (УЗИ узлов, рентгеновские исследования, эхокардиография и электрокардиография).
Кроме того, перед постановкой диагноза специалист проводит анализ условий проживания больного, времени года, его деятельности. Факторами риска являются наличие домашних и бездомных собак и кошек, комаров, выезд в лес, на рыбалку, на дачу или в сад.
Риск заболевания дирофиляриозом особенно увеличивается в период высокой активности комаров. В связи с чем важны профилактические меры, производимые санитарными службами по ликвидации насекомых на территории водоемов. Известно, что заболевание носит сезонный характер, поэтому основное количество заболевших фиксируется весной и летом. Пики заболеваемости приходятся на периоды июнь-июль и октябрь-ноябрь.
Диагностика дирофиляриоза у животных
Для профилактики заболевания домашним животным необходимо регулярно давать противоглистные препараты. Признаками заболевания паразитами служат различные высыпания, уплотнения, ранки, опухоли на коже.
Больше всего при поражении страдает сердечно-сосудистая система животного. Поведение его становится пассивным, теряется аппетит, отмечается температура, кашель. Собака может прихрамывать и страдать от судорог.
Лечение дирофиляриоза
Форма болезни диктует методы лечения. Обычно у человека паразитирует одна неполовозрелая особь. Основной метод избавления от паразита — хирургический. Чтобы исключить перемещение паразита применяют дитразин. Редко применяется терапия медикаментами с использованием ивермектина или диэтилкарбамазина. Дополнительно при лечении используются успокаивающие и антигистаминные лекарства, нестероидные противовоспалительные средства, глюкокортикостероиды.
При глазном дирофиляриозе основным методом лечения будет удаление гельминта с помощью операции и последующие назначение дезинфицирующих и противовоспалительных препаратов для глаз, иногда также прописываются капли дексаметазона для уменьшения воспаления. Обязательно назначаются антигистаминные средства.
Профилактика дирофиляриоза
В России 4-30% (в зависимости от географии их проживания) домашних и уличных собак являются хозяевами-переносчиками микрофилярий. Самый большой процент зараженных животных в Греции и Иране- 25-60%.
Профилактика заболевания включает в себя истребление комаров и ограничение контакта с ними животных и человека, своевременное выявление дирофилярий животных и их лечение, борьба с бродячими животными, противоглистная профилактика у домашних питомцев.
Так как очагами дирофиляриоза являются водоемы около жилых районов, очевидна эффективность мер, применяемых санитарными органами по борьбе с кровососущими насекомыми. К тому же необходима борьба с комарами в подвалах жилых домов, ведь здесь эти паразиты могут с комфортом обитать весь год. Из подвалов жилых домов комары и другие насекомые попадают по вентиляционной системе в квартиры.
В лесу и около водоемов необходимо использовать репелленты и защищать участки тела с помощью одежды. Животным кроме репеллентов могут быть одеты специальные ошейники. По возможности старайтесь отказаться от прогулок в вечернее и ночное время суток.
Человек сам в ответе за собственное здоровье, а также за здоровье своих детей, родных и близких, поэтому отправляясь в отпуск в теплые страны, будьте бдительны! Легче предотвратить болезнь, соблюдая профилактические меры, чем лечить ее последствия!
Рассмотрены подходы к комплексной терапии инфекции мочевых путей с применением современных комбинированных фитопрепаратов, которые позволяют повышать эффективность антибактериальной терапии за счет преодоления резистентности возбудителя к антибиотикам, со
The article considers approaches to complex therapy of urinary tract infections, using modern combined phyto-preparations, which allow to enhance efficiency of antibacterial therapy due to overcoming the agent’s resistance to antibiotics, and reduce the course of antibiotic therapy.
Инфекция мочевых путей (ИМП; синонимы: инфекция мочевой системы, инфекция мочевыводящих путей) — собирательный термин, обозначающий инфекционно-воспалительный процесс в мочевыделительной системе без указания его локализации и характера течения. По локализации выделяют инфекцию нижних мочевых путей (цистит, уретрит) и верхних мочевых путей (пиелонефрит, абсцесс и карбункул почки, апостематозный пиелонефрит).
По характеру течения ИМП делятся на неосложненную и осложненную. Неосложненная ИМП развивается, как правило, у людей без обструктивных уропатий и структурных изменений в почках и мочевыводящих путях, в отсутствие фоновых заболеваний. Осложненные инфекции возникают у больных с обструктивными уропатиями, мочекаменной болезнью, поликистозом почек, доброкачественной гиперплазией предстательной железы (ДГПЖ), на фоне катетеризации мочевого пузыря и/или при инструментальных (инвазивных) методах исследования, а также у больных с сопутствующими заболеваниями, такими как сахарный диабет, подагра, другими метаболическими нарушениями.
По возникновению выделяют внебольничные (возникающие в амбулаторных условиях) и нозокомиальные (развивающиеся после 48 ч пребывания пациента в стационаре) ИМП. Не менее 40% всех нозокомиальных инфекций обусловлены ИМП, вызванной в большинстве случаев катетеризацией мочевого пузыря [1–3].
В зависимости от выраженности клинических проявлений ИМП часто подразделяют на афебрильную (преимущественно инфекция нижних мочевых путей), фебрильную (преимущественно инфекция верхних мочевых путей) и бессимптомную бактериурию (ББ). ББ — бактериологический диагноз, который устанавливается при исследовании мочи, собранной с максимальным соблюдением стерильности и доставленной в лабораторию в предельно короткие сроки. По определению Американского общества инфекционных болезней (Infectious Diseases Society of America, IDSA), ББ — это изолированная бактериурия в образце мочи, полученном в условиях, исключающих контаминацию, и при отсутствии симптомов мочевой инфекции [4]. Диагноз ББ может быть установлен:
- если в двух последовательных анализах мочи у женщин без клинических признаков ИМП выделен один и тот же штамм микроорганизмов в количестве ≥ 10 5 КОЕ/мл;
- если в анализе мочи у мужчин без симптомов ИМП однократно выделен бактериальный штамм в количестве ≥ 10 5 КОЕ/мл;
- если в анализе мочи, полученном при катетеризации, как у мужчин, так и женщин, выделен бактериальный штамм в количестве ≥ 10 2 КОЕ/мл.
В структуре инфекционной заболеваемости ИМП занимает второе место, уступая лишь респираторным инфекциям. Среди взрослой популяции женщины в 30–50 раз чаще, чем мужчины, страдают от ИМП, а в течение жизни до 60% женщин сталкиваются с эпизодом ИМП. У каждой четвертой пациентки этой возрастной группы в течение года ИМП рецидивирует [5]. В пожилом и старческом возрасте частота ИМП у женщин и мужчин постепенно сравнивается, что обусловлено развивающейся практически в 100% ДГПЖ, нарушающей уродинамику. В целом ИМП, включая пиелонефрит, регистрируется существенно чаще у женщин, чем у мужчин. Распространенность ИМП в детской популяции составляет 20–22 случая на 1000 детей и в возрасте старше одного года жизни у девочек встречается в десятки раз чаще, чем у мальчиков.
В структуре внутрибольничных инфекций доля ИМП может достигать 40%.
Этиология
Основными возбудителями ИМП являются грамотрицательные бактерии из семейства Enterobacteriacеae, а из них преимущественно Escherichia coli (E. сoli). При неосложненных ИМП на долю E. сoli и других представителей семейства Enterobacteriacеae приходится до 90–95% всех случаев, тогда как при осложненных ИМП доля кишечной палочки в этиологической структуре снижается до 30–50% и значительно чаще встречаются Proteus spp., Pseudomonas spp., Klebsiella spp., грибы (преимущественно Candida albicans). Особенностью осложненных ИМП является большая доля микробных ассоциаций в этиологической структуре (табл. 1).
Лечение ИМП
Основой терапии ИМП является антибиотикотерапия. Как и при других бактериальных инфекциях, чувствительность возбудителей к антибиотикам имеет решающее значение при выборе препарата для эмпирической терапии ИМП. Лучше всего поддается лечению неосложненная ИМП.
Одними из наиболее часто используемых препаратов для лечения ИМП являются фторхинолоны (левофлоксацин, норфлоксацин, офлоксацин, пефлоксацин и др.), которые во многих международных руководствах указываются как препараты выбора в терапии ИМП. Однако в настоящее время отмечается быстрый рост резистентности уропатогенной E. coli к препаратам этой группы. Считается, что при уровне резистентности в популяции более 10% на применение препаратов вводятся ограничения. В России уровень устойчивости уропатогенной E. coli к фторхинолонам, по данным различных исследований, колеблется от 4,3% до 12,9%, составляя в среднем около 7–8% [1, 2, 6, 7].
Для лечения ИМП у беременных женщин и детей, а также у других категорий пациентов при непереносимости фторхинолонов препаратами выбора являются амоксициллин/клавуланат, цефалоспорины II–III поколений, фосфомицина трометамол, нитрофурантоин [8]. Преимуществом применения амоксициллина/клавуланата является не только его высокая активность в отношении E. coli (уровень резистентности ниже, чем к фторхинолонам), но и отсутствие тератогенного воздействия, что делает возможным его применение в I триместре беременности [9, 10].
Доказана эффективность и безопасность применения цефалоспоринов III поколения у детей и беременных женщин при лечении неосложненной и осложненной ИМП [7]. Отличительной чертой цефалоспоринов III поколения является высокая активность в отношении микроорганизмов семейства Enterobacteriaceae, устойчивость к действию бета-лактамаз, длительный период полувыведения [11].
Использование налидиксовой кислоты и нитрофурантоинов имеет определенные недостатки в связи с необходимостью применения этих препаратов 3–4 раза в сутки, а также слабой активностью нитрофурантоина в отношении Proteus spp., а налидиксовой кислоты — в отношении S. saprophyticus [12].
Длительность антибактериальной терапии зависит от особенностей ИМП. Как правило, при отсутствии факторов риска антибактериальная терапия назначается на 3–5 дней при острой инфекции нижних мочевых путей, на 10–14 дней — при инфекции верхних мочевых путей. При острой осложненной ИМП или при наличии факторов риска применяются те же антимикробные препараты, что и при неосложненной ИМП, однако длительность терапии увеличивается до 7–14 или более дней [13].
Особенностью лечения ИМП в детском возрасте является более длительная, по сравнению со взрослыми, антибактериальная терапия с обязательным курсом противорецидивного лечения.
Поэтому, несмотря на успехи в создании новых антибактериальных препаратов, лечение ИМП, особенно осложненной и рецидивирующей, остается актуальной задачей, часто требующей в своем решении назначения комбинации препаратов или их последовательной смены, длительных противорецидивных курсов. Это неизбежно приводит к повышению частоты развития нежелательных лекарственных реакций терапии, а также формирует порочный круг, т. к. частое и длительное применение антибиотиков приводит к росту популяции резистентной к ним микрофлоры.
В последние десятилетия возрождается значительный интерес к фитотерапии как компоненту комплексной терапии ИМП. Лечебные свойства растений были хорошо известны врачам древности, народная медицина практически всех народов и стран использует их для лечения различных заболеваний. Действие фитопрепаратов в рамках современных исследований представляется нам в новом свете, прежде всего, с точки зрения преодоления антибиотикорезистентности и способности разрушать микробную биопленку на слизистой оболочке мочевых путей.
В комплексной терапии ИМП применяются фитопрепараты, обладающие противовоспалительным, мочегонным, а также кровоостанавливающим действием, что важно при развитии гематурии.
Растительные препараты можно применять в качестве отдельных настоев или травяных сборов. Компоненты различных растений входят также в состав фабричных лекарственных препаратов.
Наиболее широко применяемые при ИМП лекарственные растения представлены в табл. 2, а также описаны ниже [16, 17].
Золотарник (живительная трава, сердечник) — широко применяется в народной медицине различных стран. В Германии настой золотарника рекомендуют, прежде всего, при хронических воспалительных заболеваниях почек и мочевых путей, кристаллурии и мочекаменной болезни, как мочегонное средство. Препараты травы золотарника обладают гипоазотемическим действием. Трава золотарника содержит флавоноиды, сапонины, органические кислоты и эфирное масло, способствующие разрушению мембран бактериальной клетки, каротин, аскорбиновую и никотиновую кислоты.
Хвощ полевой — обладает противовоспалительным, мочегонным и кровоостанавливающим действием. Применяется при ИМП, кристаллуриях и мочекаменной болезни. Благодаря большому содержанию соединений кремния отвары, настои и экстракты хвоща полевого обладают выраженным заживляющим и сосудоукрепляющим действием, способствуют растворению кристаллов солей в моче, ускоряют выведение свинца из организма.
Листья брусники — обладают антимикробным и мочегонным действием. Последнее связано с наличием в листьях брусники гидрохинона. Применяется в виде отвара (2 столовые ложки на 1,5 стакана воды). Назначается по 2 столовые ложки 5–6 раз в день. Также, как и толокнянка, лучше действует в щелочной среде.
Горец птичий (спорыш) — содержит гликозид авикулярин, дубильные вещества, эфирное масло, каротин, аскорбиновую кислоту. Используется как мочегонное, кровоостанавливающее и вяжущее средство. Обладает спазмолитическим действием на мочевые пути. Широко применяется в народной медицине и входит в состав различных сборов.
Петрушка огородная — богата флавоноидами и эфирными маслами. Оказывает непосредственное действие на почечные канальцы, благодаря чему достигается диуретический эффект. Обладает спазмолитическим действием на гладкую мускулатуру мочевых путей и сосудов.
Любисток лекарственный (приворотное зелье) — с медицинской целью используются в основном корни растения. Содержит эфирные масла, органические кислоты, кумарин, дубильные вещества. Обладает выраженным мочегонным и антибактериальным действием. Используется при воспалениях мочевых путей, нарушениях желудочно-кишечного тракта. Как правило, входит в состав комбинированных препаратов и сборов.
Пырей ползучий — содержит эфирные масла, сапонины, инулин, аскорбиновую кислоту, каротин. Обладает диуретическим эффектом благодаря инулину, эфирное масло обеспечивает антисептическое и противовоспалительное действие.
Клюквенный сок, морс (содержит натрия бензоат) — обладает антисептическим действием (увеличивается синтез в печени из бензоата гиппуровой кислоты, которая, выделяясь с мочой, вызывает бактериостатический эффект). Принимают по 2–4 стакана в день.
Сосна лесная — эфирное (скипидарное) масло сосны обладает выраженным бактерицидным, противовоспалительным и мочегонным действием.
При хронических и рецидивирующих инфекциях мочевых путей применяются различные сборы лекарственных трав. Они назначаются, как правило, на долгий период, с чередованием преимущественно бактерицидных и мочегонных сборов. Однако самостоятельное лечение лекарственными растениями таит в себе некоторые опасности. Компоненты многих лекарственных растений в больших дозировках могут быть потенциально ядовиты, оказывать патологическое воздействие на функционирование отдельных органов. Поэтому с точки зрения безопасности в комплексном лечении ИМП предпочтение отдается лекарственным препаратам фабричного производства, правильная дозировка которых обеспечивает высокую эффективность при соблюдении полной безопасности.
Одним из наиболее широко применяемых фитопрепаратов для лечения ИМП является Фитолизин. Фитолизин содержит экстракт смеси растений (золотарника, хвоща полевого, пырея, горца птичьего, листьев березы, любистока, пырея, петрушки, масла шалфея, мяты, сосны и апельсина, семена пажитника), благодаря чему оказывает мочегонное, противовоспалительное, спазмолитическое действие, уменьшает кристаллообразование, способствует растворению кристаллов и конкрементов и выведению их с мочой.
Препарат имеет форму пасты для приготовления суспензии, что обеспечивает легкость его дозировки и применения. Взрослым назначают внутрь по 1 чайной ложке пасты, растворенной в 1/2 стакана теплой сладкой воды, 3–4 раза в день после еды. Фитолизин может применяться в комплексном лечении ИМП вместе с антибиотиками или после их применения на этапе противорецидивной терапии. Препарат широко применяется в качестве профилактического средства при хронических воспалениях мочевых путей. Курс терапии Фитолизином составляет 2–6 недель и при необходимости может быть продлен.
Эффективность лекарственных растений в терапии ИМП доказана многовековым опытом народов мира. Современные комбинированные фитопрепараты, такие как Фитолизин, занимают важное место в комплексной терапии ИМП и позволяют повышать эффективность антибактериальной терапии за счет преодоления резистентности возбудителя к антибиотикам, сокращают курсы антибиотикотерапии, снижают частоту нежелательных лекарственных реакций их применения.
Литература
А. В. Малкоч 1 , кандидат медицинских наук
Н. Н. Филатова, кандидат медицинских наук
Рассмотрены факторы риска паразитозов у детей, действие паразитов на организм ребенка, подходы к диагностике паразитарной инвазии и принципы комплексного лечения паразитозов с тем чтобы предотвратить дальнейшее развитие функциональных нарушений с формиров
Risk factors of parasitosis in children was considered, as well as the influence of parasites on a child's body, approaches to the diagnostics of parasitic invasions and principles of integrated treatment of parasitic diseases in order to prevent the further development of functional disorders of the formation of organic pathology.
.jpg)
Паразитарное заболевание — развитие болезненных симптомов в результате жизнедеятельности гельминта или простейших в организме человека [1]. Основной фактор выживания и распространения паразитов — их необычайно высокая репродуктивная способность, а также постоянно совершенствующиеся механизмы приспособления к обитанию в теле человека. К сожалению, настороженность медицинских работников в отношении паразитарных заболеваний у населения в настоящее время чрезвычайно низка, а профилактика гельминтозов сведена к лечению выявленных инвазированных пациентов [12, 13]. Вместе с тем многие исследователи отмечают связь широкой распространенности паразитозов у детского населения с развитием функциональной патологии органов пищеварения на фоне нарушений регуляции и высокий риск формирования хронических заболеваний даже при условии естественной санации ребенка с течением времени.
Самые распространенные и изученные заболевания — аскаридоз, энтеробиоз (рис. 1) и лямблиоз — регистрируются повсеместно. В России ежегодно выявляется более 2 млн больных нематодозами. При оценке территориального распределения лямблиоза по России установлено, что самый высокий средний уровень показателей заболеваемости в течение многих лет отмечен в Санкт-Петербурге, причем пораженность детей, посещающих детские учреждения, составляет 35% [2].
Каждый человек в течение жизни неоднократно переносит различные паразитарные заболевания [9]. В детском возрасте паразитозы встречаются чаще. У детей раннего возраста (до 5 лет) этому способствует широкая распространенность репродуктивного материала паразитов (цисты, яйца, личинки (рис. 2)) в окружающей среде и недостаточное развитие гигиенических навыков.
.jpg)
Значимость определенных факторов риска меняется в соответствии с возрастом ребенка. Доказано, что для детей младшего возраста более значимы санитарно-гигиенические условия проживания, а для подростков при сборе анамнеза необходимо уделить внимание социально-экономическим и географическим факторам (пребывание в лагере, туристическая поездка, наличие младшего брата или сестры) (рис. 3).
.jpg)
Транзиторное снижение противоинфекционного иммунитета как фактор риска возникновения паразитоза у детей регистрируется также в период реконвалесценции после вирусных заболеваний, вызываемых вирусами герпетической группы (цитомегаловирус, вирус простого герпеса I и II, вирус Эпштейна–Барр), может возникать в результате ятрогении (применение иммуносупрессивной терапии при аллергических и аутоиммунных заболеваниях). В настоящее время значимая доля детей находится в состоянии дезадаптации, которое также сопровождается снижением иммунной защиты.
Иммунную защиту желудочно-кишечного тракта (ЖКТ) ребенка можно условно разделить на специфическую и неспецифическую. К неспецифической защите относят комплекс условий нормального пищеварения: зрелость ферментативных систем, обеспечение кислотно-щелочного градиента в различных отделах ЖКТ, деятельность нормальной микрофлоры, адекватную моторику.
Отдельно необходимо отметить, что для такого заболевания, как лямблиоз, предрасполагающим фактором инвазии является нерегулярное и недостаточное отделение желчи в кишечник при аномалиях развития желчного пузыря (перетяжки, перегибы). Лямблиоз, выявленный у пациентов педиатрического отделения МОНИКИ, в 100% случаев сопровождался дисфункцией билиарного тракта.
.jpg)
У детей в восстановительном периоде после острых кишечных инфекций, после массивной антибиотикотерапии, а также у пациентов с хронической патологией органов пищеварения сопутствующие нарушения ферментного обеспечения, нормофлоры и моторики кишечника также делают ЖКТ более уязвимым для паразитов (рис. 4).
Специфическая защита слизистой оболочки органов пищеварения зависит от возраста ребенка и его зрелости. Механизм специфической иммунной защиты является одной из наиболее древних систем организма, так как гельминтозы сопровождают человечество в течение многих тысячелетий. Этот механизм представлен прежде всего эозинофилами крови и иммуноглобулином Е.
Классический развернутый антипаразитарный ответ может быть сформирован у ребенка не ранее достижения им 4 лет и тесно связан с качеством и количеством IgE, созревающего к этому возрасту. При контакте организма с паразитом в первую очередь выделяются медиаторы воспаления: интерлейкин, лейкотриен С4, D4, простагландины, тромбоксаны. Увеличивается количество лимфоцитов, продуцирующих IgM и IgG. В клиническом анализе крови отмечается рост уровня эозинофилов и базофилов, связанный с увеличением содержания этих клеток в тканях инвазированного органа. Встречаясь с личинками паразита, тканевые базофилы выделяют гепарин и гистамин, которые в сочетании с лейкотриенами и другими медиаторами воспаления вызывают общие проявления: зуд, реактивный отек, гиперемию, а также могут спровоцировать общие проявления: бронхоспазм, проявления крапивницы или диарею. Аллергическое воспаление при паразитозах развивается по классическому пути и призвано создать условия, приводящие к гибели и/или элиминации паразита [5].
Вместе с тем эозинофилы обладают выраженным цитотоксическим потенциалом, превышающим возможности других клеток крови, что объясняет первостепенное значение эозинофилов в антипаразитарных реакциях и их повреждающую роль при аллергии. Основное действие эозинофилы оказывают в барьерных тканях. В очаге инвазии они дегранулируют, оказывая гельминтотоксическое и цитотоксическое действие. Белки эозинофильных гранул (большой основной протеин, эозинофильная пероксидаза, эозинофильный катионный протеин, эозинофил-производный нейротоксин) токсичны не только для паразита, но и для клеток организма ребенка. Еще одной из важных причин системных и органных поражений, сопутствующих паразитозам, является образование иммунных комплексов [9, 10].
Действие паразитов на организм ребенка осуществляется с вовлечением многих систем. Практически все их виды могут вызывать сдвиг соотношения Th1/Th2 клеток в направлении, благоприятном для их выживания. Описаны случаи, когда продукты выделения паразита оказывали гормоноподобное действие на организм хозяина [5].
Местное влияние паразиты осуществляют, вызывая контактное воспаление слизистой оболочки и стимулируя вегетативные реакции. При этом нарушаются процессы кишечного всасывания, адекватная моторика ЖКТ и его микробиоценоз.
Системное влияние оказывается за счет использования паразитом энергетического и пластического потенциала пищи в ущерб организму ребенка, индукции аллергии и аутоиммунных процессов, целенаправленной иммуносупрессии и эндогенной интоксикации. Проведенными исследованиями показано, что аллергический синдром сопутствует аскаридозу и энтеробиозу в 71,3% случаев. Среди детей с атопическим дерматитом паразитозы выявляются у 69,1%, при этом лямблиоз из числа всех инвазий составляет 78,5% [4].
Особенно узнаваемую клиническую картину формирует токсокароз (рис. 5). Клиническими маркерами этой инвазии являются лейкемоидная реакция эозинофилов (от 20% и выше эозинофилов в формуле крови), сопровождающая ярко и упорно протекающий аллергический синдром в виде атопического дерматита с выраженным зудом и резистентностью к традиционной терапии или тяжелую бронхиальную астму с частыми приступами.
В 75,3% случаев паразитозы сопровождаются разнообразными функциональными нарушениями со стороны ЖКТ. Рядом работ доказано, что паразитарная инвазия способна вызывать нарушения углеводного обмена, а также дисахаридазную недостаточность за счет снижения уровня лактазы [7, 9].
У большинства детей нарушения адаптации являются одним из важных звеньев патогенетического процесса при паразитозе. Следует отметить, что состояние дезадаптации затрагивает в первую очередь лимфоцитарное звено иммуногенеза, что не может не сказываться на созревании и дифференцировке специфического иммунитета.
Диагностика паразитозов
До настоящего времени ведется поиск простого, доступного и надежного метода диагностики паразитозов. Разработанные методики прямого визуального обнаружения требуют минимальной экспозиции диагностического материала, многократных повторных исследований. Известные способы диагностики глистных инвазий и протозоозов, такие как метод толстого мазка фекалий по Като, метод формалин-эфирного осаждения, перианальный соскоб, микроскопия пузырной и печеночной желчи, имеют ряд недостатков, связанных как с особенностями развития паразита, так и с состоянием макроорганизма и его реактивностью.
Непрямые методы исследования (определение специфических антител) обладают недостаточной специфичностью и достоверностью. Известно, например, что, проходя сложный цикл развития от яйца до взрослого состояния, гельминты меняют свой антигенный состав. Антитела в организме хозяина вырабатываются в основном в ответ на поступление экскретов и секретов гельминта, тогда как в иммунодиагностических реакциях используются соматические антитела. Возникающая неспецифическая сенсибилизация организма, общность некоторых антигенов трематод, простейших и человека создают высокий удельный вес ложноположительных серологических реакций в титрах ниже достоверно диагностических. Таким образом, исследование методом иммуноферментного анализа (ИФА) на гельминты является высокочувствительным, но низкоспецифичным методом. Определение паразитов методом полимеразной цепной реакции (ПЦР) является высокоспецифичным и высокочувствительным методом, но из-за дороговизны и сложности не может быть скрининговым, когда, например, нужно обследовать группу детей из детского учреждения.
Не теряет своей актуальности клинический осмотр ребенка и внимательный учет косвенных признаков паразитоза. Важно отметить возможность течения паразитоза при аллергическом и астеническом синдроме, полилимфаденопатии неясного генеза, при нарушениях кишечного всасывания, углеводного обмена, при затяжном и хроническом течении болезней пищеварительного тракта, гепатоспленомегалии неясного генеза. Течение паразитарной инвазии имеет клинические особенности: обычно признаки поражения минимизированы, заболевание носит стертый характер, обострения полиморфны и неярки. Особенностью обострений заболеваний данной группы является их цикличность с периодом в 11–15 дней.
Косвенными лабораторными признаками паразитоза могут быть анемия, базофилия, эозинофилия, увеличение уровня аспартатаминотранферазы (АСТ).
Кроме того, признаки возможной паразитарной инвазии следует учитывать при оценке результатов инструментального исследования. При ультразвуковом исследовании органов брюшной полости у ребенка старше 3 лет косвенными признаками паразитоза являются гепатоспленомегалия, неравномерность паренхимы печени и селезенки за счет мелких гиперэхогенных сигналов, увеличенные лимфатические узлы в воротах селезенки.
Лечение гельминтозов
Лечение гельминтозов должно начинаться с применения специфических антигельминтных препаратов. Современный арсенал лекарственных средств, используемых для лечения кишечных паразитозов, включает значительное количество препаратов различных химических классов [11]. Они применяются как в клинической практике для лечения выявленных больных, так и с целью массовой профилактики.
Определяя препарат для специфической противопаразитарной терапии, следует понимать, что спектр действия этих препаратов не особенно широк. Практически все препараты этой группы применяются многие десятки лет и целесообразно предположить, что паразиты выработали системы приспособления и заболевание может быть резистентным к проводимой терапии. По данным Г. В. Кадочниковой (2004), эффективность такого традиционного препарата, как Декарис, в современных условиях не достигает 57%. Кроме того, эта группа противопаразитарных средств, к сожалению, имеет ряд побочных эффектов: тошноту, рвоту, абдоминальный синдром.
Таким образом, в современных условиях следует отдавать предпочтение более современным препаратам, которые, во-первых, являются универсальными для лечения как нематодозов, так и смешанных глистных инвазий и активны в отношении такого распространенного паразита, как лямблия. Во-вторых, использование одного противопаразитарного препарата, а не их комбинации, ощутимо снижает риск неприятных побочных эффектов. На сегодняшний день единственный представитель этой группы в нашей стране — альбендазол (Немозол).
Для лечения аскаридоза у детей старшего возраста или при рецидивировании заболевания в настоящее время под наблюдением врача может быть применен комбинированный прием антигельминтных средств (например, альбендазол в течение трех дней, затем — Вермокс в течение трех дней). Непременным условием успешной дегельминтизации больных энтеробиозом являются одновременное лечение всех членов семьи (коллектива) и строгое соблюдение гигиенического режима для исключения реинвазии. Следует отметить, что важное значение имеет ежедневная влажная уборка, так как были описаны казуистические случаи распространения репродуктивного материала остриц на частичках пыли на высоту до 1,5 метра.
В педиатрической клинике МОНИКИ разработаны принципы терапии паразитозов, учитывающие особенности патогенеза инвазии и позволяющие качественно и надежно вылечить данную группу заболеваний. Благодаря применению разработанной схемы терапии удается эффективно предотвратить реинвазию и развитие функциональных нарушений органов пищеварения у детей.
Принципы терапии больных паразитозами
1. Прием антипаразитарных препаратов проводится с учетом вида возбудителя инвазии.
Препараты, применяемые в лечениии аскаридоза:
- Вермокс (мебендазол) (для детей с 2 лет) — по 100 мг 2 раза в сутки в течение 3 дней;
- Пирантел — 10 мг/кг однократно;
- Немозол (альбендазол) (для детей с 2 лет) — 400 мг однократно.
Препараты, применяемые в лечении энтеробиоза:
- Вермокс (мебендазол) (для детей с 2 лет) — 100 мг однократно;
- Пирантел — 10 мг/кг однократно;
- Немозол (альбендазол) (для детей с 2 лет) — 400 мг однократно.
Препараты, применяемые в лечении лямблиоза:
- орнидазол 25–30 мг/кг (если масса тела больше 35 кг — 1000 мг) в два приема в течение 5 дней, 1 день — 1/2 дозы, повторный курс через 7 дней;
- Макмирор (нифурател) — по 15 мг/кг 2 раза в сутки в течение 7 дней;
- Немозол (альбендазол) — по 15 мг/кг однократно в течение 5–7 дней.
2. Лечение паразитоза предусматривает измененные в результате жизнедеятельности паразитов свойства пищеварительного тракта ребенка (функциональные нарушения органов пищеварения, ферментопатия, изменение микробиоценоза) и их коррекцию курсами ферментных препаратов и синбиотиков (табл. 1).
3. Обязательное применение энтеросорбентов и комплекса поливитаминов с микроэлементами (табл. 2 и 3).
Таким образом, разработанные в клинике педиатрии МОНИКИ принципы комплексной терапии паразитозов у детей предусматривают поэтапное восстановление функционального состояния ЖКТ, нарушенного в результате местного и системного влияния паразитов. Применение комплексной терапии позволяет предотвратить дальнейшее развитие функциональных нарушений с формированием органической патологии, а также избежать реинвазии.
Литература
Л. И. Васечкина 1 , кандидат медицинских наук
Т. К. Тюрина, кандидат медицинских наук
Л. П. Пелепец, кандидат биологических наук
А. В. Акинфиев, кандидат медицинских наук
Читайте также:

