Лечение острого стрептококкового гломерулонефрита
Обновлено: 25.04.2024
Острый нефритический синдром – синдром, характеризующийся внезапным появлением макроскопической гематурии, олигурии, острой почечной недостаточности, обусловленной резким падением гломерулярной фильтрации, задержкой жидкости и появлением отеков, гипертензии. Протеинурия составляет менее 3 г/сут. Это большая разнородная группа первичных и вторичных гломерулонефритов – острый постинфекционный (диффузный пролиферативный ГН), мембранопролиферативный и экстракапиллярный ГН [1]. Острый постинфекционный гломерулонефрит имеет циклическое течение с благоприятным прогнозом, два других морфологических варианта рано или поздно приводят к развитию терминальной ХПН.
N00.1 – Острый нефритический синдром, очаговые и сегментарные гломерулярные повреждения (Очаговый и сегментарный: гиалиноз, склероз. Очаговый гломерулонефрит)
N00.5 – Острый нефритический синдром, диффузный мезангиокапиллярный гломерулонефрит (Мембранозно-пролиферативный гломерулонефрит, тип 1 и 3 или БДУ)
N00.6 – Острый нефритический синдром, болезнь плотного осадка (Мембранозно-пролиферативный гломерулонефрит, тип 2)
N00.7 – Острый нефритический синдром, диффузный серповидный гломерулонефрит (Экстракапиллярный гломерулонефрит)
Дата разработки протокола: 2013 год.
Классификация
2. Острый нефритический синдром при системных заболеваниях (люпус-нефрит, нефрит Шенлейн-Геноха, др.васкулиты)
• Осложненный (гипертонический криз, острая недостаточность мозгового кровообращения, ОПН, острая левожелудочковая недостаточность)
Диагностика
II. МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
• ИФА на ауто-антитела к ДНК, антинуклеарные аутоантитела, антинейтрофильные цитоплазматические и перинуклеарные антитела, антитела к гломерулярной базальной мембране
• Протеин/креатининовый коэффициент (Отношение уровня протеина к уровню креатинина в общем анализе мочи)
• Осмотр глазного дна
• Иммунологические исследования: АNА, АNCА, антитела к двойной спирали ДНК, факторы комплемента С3, С4, С50, криоглобулины, антитела к кардиолипину, антитела к Стрептолизину-О, антитела к ГБМ (гломерулярная базальная мембрана)
• Мазок из зева для бак.посева и/или содержания антистрептолизина-О
Периферические отёки (на лице, ногах, туловище), расширение границ сердца, АГ, олигоанурия.
При сохранении низкого уровня С3 комплемента в крови в течение 6-8 недель после активного нефритического синдрома, то такая картина может соответствовать МПГН, что является показанием к проведению биопсии почки с последующим патоморфологическим исследованием нефробиоптата, что позволяет выставить нозологический диагноз. Проводят её по строгим показаниям: дифференциальная диагностика с хроническим гломерулонефритом, в том числе при системных заболеваниях соединительной ткани, быстропрогрессирующим гломерулонефритом. а также при атипичном течении заболевания при наличии:
- Отложения в петлях капилляров и мезангии IgG, компонента комплемента СЗ, реже - С1q и С4, IgA, IgM (СКВ).
Если имеет место выраженная протеинурия с отеками, то это соответствует смешанной форме (нефритический/нефротический).
Биопсия почки по показаниям. По результатам биопсии дифференцация пациентов согласно клинической и лабораторной картине. При выявлении нефритического/нефротического синдрома высока вероятность наличие люпус-нефрита, что всегда следует иметь в виду.
Отоларинголог, стоматолог, акушер-гинеколог для санации инфекции носоглотки, полости рта и наружных половых органов, окулист для оценки изменений глазного дна.
Выраженная артериальная гипертензия, нарушения со стороны ЭКГ и др. являются показанием для консультации кардиолога, очаговая мозговая симптоматика - невропатолога.
Дифференциальный диагноз
Лечение
Режим постельный первые сутки, затем палатный, общий.
Диета №7 (7а, 7б): ограничение поваренной соли (главным образом, натрия) и жидкости (объём получаемой жидкости рассчитывают с учётом диуреза за предыдущий день + 300 мл) при достаточном калораже и содержании витаминов. При наличии отеков, особенно в период их нарастания, содержание поваренной соли в пище ограничивается до 0,2-0,3 г в сутки, содержание белка в суточном рационе ограничивается до 0,5-0,6 г/кг массы тела в основном за счет белков животного, происхождения.
1. С целью улучшения микроциркуляции в почках применяются антиагреганты – дипиридамол таблетки по 25 мг, покрытые пленочной оболочкой, 75 мг/сут В, таб; пентоксифиллин 100 мг/сут С амп.
2. С антигипертензивной и нефропротективной целью применяются ингибиторы ангиотензин-превращающего фермента – фозиноприл 20 мг/сут, эналаприл 20 мг/сут, рамиприл 10 мг/сут В, таб; блокаторы кальциевых каналов – амлодипин 10 мг/сут, нифедипин таблетки, покрытые оболочкой 10 и 20 мг, 40 мг/сут С, таб; блокаторы бета-адренорецепторов – бисопролол 10 мг/сут, блокаторы альфа- и бета-адренорецепторов карведилол 25 мг/сут С, таб, антагонисты рецепторов ангиотензина II (лозартан 100 мг/сут, телмисартан 80 мг/сут Втаб. и др.)
3. Для борьбы с отеками и гипергидратацией и связанными с ними осложнениями назначаются диуретики – петлевые А(фуросемид раствор для инъекций 10мг/мл по 2 мл в ампуле, 2-3 мг/кг, гидрохлортиазид (50-100 мг/сут) А таб, при неэффективности – ультрафильтрация.
4. Антибактериальное лечение проводят при наличии очага инфекции или острого инфекционного заболевания с целью устранения очага и эрадикации возбудителя. При постстрептококковом ОГН (мазок из зева, повышение титра антистрептококковых АТ) – бензилпенициллин по 1,0 млн ЕД 6 раз/сут 10 дней).
5. При синуситах, пневмонии препараты выбора (перечислены последовательно в соответствии с приоритетом выбора) — Амоксициллин, клавулановая кислота таблетки 500 мг внутрь 2 раза в сутки 7-10 дней, цефаклор порошок для приготовления суспензии 125мг/5мл, 250-500 мг/сут в 2 приёма 7-10 дней В.
6. При аллергии на β-лактамные антибиотики назначают ЛС из группы макролидов: азитромицин 500 мг 1 раз в сутки 5 дней, спирамицин таблетки, покрытые оболочкой, 1,5 млн МЕ и 3,0 млн МЕ, 6 млн МЕ в сутки 7 дней В.
7. При выраженной азотемии и гиперкалиемии проводится гемодиализ.
При сохранении экстраренальных признаков более чем 2 месяца (артериальная гипертензия, отеки), выраженного мочевого синдрома или утяжелении их необходимо проведение биопсии почки, так как вероятны неблагоприятные морфологические варианты ГН, требующие иммуносупрессивной терапии.
Индикаторы эффективности лечения и безопасности методов диагностики и лечения, описанных в протоколе:
Выведение из острого состояния; ликвидация азотемии; олигоурии; отеков; судорог, уменьшение/исчезновение протеинурии, гематурии; нормализация функции почек и артериального давления; верификация диагноза.
Последняя четверть прошедшего века принесла с собой ряд важных достижений в лечении прогрессирующих почечных заболеваний, в том числе гломерулонефрита, остающегося одной из главных причин хронической почечной недостаточности (ХПН). Это касается
Последняя четверть прошедшего века принесла с собой ряд важных достижений в лечении прогрессирующих почечных заболеваний, в том числе гломерулонефрита, остающегося одной из главных причин хронической почечной недостаточности (ХПН). Это касается методов воздействия на начальные иммунно-воспалительные механизмы повреждения почечной ткани и еще в большей степени — на механизмы дальнейшего прогрессирования (развития склероза), так называемые неиммунные, часто уже не связанные с начальными путями повреждения. В связи с этим было создано новое направление в нефрологии, получившее название ренопротективной терапии.
Особенность этого периода — внедрение новых требований к качеству результатов исследований, касающихся разработки и оценки новых направлений и методов лечения (это характерно и для других областей медицины — кардиологии, гепатологии, онкологии, гематологии и т. д.), создание так называемой доказательной медицины (evidence-based medicine) — медицины, основанной на доказательствах. Суть этого подхода — организация исследований в соответствии с принципами клинической эпидемиологии. В ходе таких исследований, проводимых с использованием методов математической статистики, планируются и осуществляются клинические и экспериментальные работы, в первую очередь — контролируемые клинические исследования, посвященные роли этиологических и патогенетических факторов или эффективности лекарственной терапии.
Сегодня уже частично выявлены клинические и морфологические признаки, определяющие неблагоприятный прогноз, среди них быстрое развитие ХПН или тяжелые осложнения основных проявлений гломерулонефрита — нефротический синдром и артериальная гипертензия. Это позволило определить, каким пациентам в первую очередь следует проводить иммунодепрессивную терапию активными (агрессивными) методами.
Хотя арсенал иммунодепрессивных препаратов, применяемых для лечения гломерулонефрита, с начала 70-х годов практически не изменился (это по-прежнему глюкокортикоиды и две группы цитостатических препаратов: алкилирующие соединения — циклофосфамид и хлорбутин — и антиметаболиты — азатиоприн), появились новые методы и схемы их применения — так называемая ударная или пульс-терапия (pulse-therapy) — периодическое внутривенное введение сверхвысоких доз глюкокортикоидов или циклофосфамида. Одно из преимуществ этих методов — снижение частоты тяжелых осложнений, характерных для длительной пероральной терапии этими препаратами (гиперкортицизм, инфекции, токсическое повреждение гонад и т. д.).
Минимальные изменения. Это заболевание исключительно редко приводит к развитию ХПН, тем не менее пациенты с таким диагнозом подвержены высокому риску тяжелых осложнений нефротического синдрома, которые могут стать причиной смерти. Это — гипергидратация (с анасаркой, водянкой полостей, отеком мозга и легких), тромбозы, белковая дистрофия, инфекции
(в том числе пневмококковый перитонит), от которых больные в прошлом нередко погибали, и, наконец, особое осложнение тяжелого нефротического синдрома — так называемый нефротический (или кининовый) криз у больных с выраженной гипоальбуминемией (с альбумином сыворотки менее 1,9 — 1,5 г%). Нефротический криз заканчивается быстронарастающей гиповолемией, приводящей к коллапсу (часто летальному) и развитию острой почечной недостаточности. Последняя также может быть следствием отека интерстиция почек, нередкого при любом тяжелом нефротическом (отечном) синдроме. Именно тяжестью и опасностью этих осложнений и обусловлена необходимость быстрой ликвидации (достижения ремиссии) нефротического синдрома.
Фокально-сегментарный гломеруло-склероз (ФСГС). Разработке методов лечения этой формы нефрита в последнее 10-летие уделялось особое внимание, что позволило несколько изменить традиционное представление о неизбежно плохом прогнозе у этих больных.
ФСГС встречается не так уж редко — 7 — 20% случаев, в половине из них проявляется нефротическим синдромом (в том числе в сочетании с артериальной гипертензией и гематурией), который при отсутствии лечения у 2/3 больных приводит к развитию ХПН. Такой же исход ожидает больных, не ответивших на лечение. Отличительная особенность ФСГС — высокая частота (до 50%) рецидивов болезни в пересаженной, донорской почке, что еще раз подчеркивает необходимость достижения ремиссии уже в самом начале заболевания.
В прошлом (в 70-е годы) в результате первых попыток оценить возможности лечения ФСГС это заболевание стали классифицировать как форму нефрита, плохо поддающуюся терапии. И даже сейчас, несмотря на определенные достижения, ФСГС по-прежнему рассматривается как один из наиболее резистентных к лечению и прогностически неблагоприятных вариантов гломерулонефрита.
Результаты большого числа клинических исследований 1980 — 1990-х годов, которые включают и контролируемые клинические испытания, позволили сформулировать ряд требований к лечению больных ФСГС.
- Длительное лечение большими дозами иммунодепрессантов - более длительное, чем при "минимальных изменениях" и многих других формах гломерулонефрита. В начале заболевания основным препаратом выбора является преднизолон, который в больших дозах (60 мг в сутки) применяется в течение 4 - 6 месяцев. Только после этого больной ФСГС может быть признан резистентным к стероидной терапии. У ответивших на лечение прогноз становится благоприятным (10-летняя почечная выживаемость возрастает с 58 до 86%). У части ответивших на терапию больных, как и при "минимальных изменениях", наблюдаются рецидивы нефротического синдрома и кортикостероидная зависимость.
- Резистентным к стероидам больным назначают циклоспорин (5 мг/кг), вызывающий ремиссию у 30 - 40% из них. Еще более эффективен циклоспорин у стероидозависимых больных. Однако вероятность рецидива после отмены препарата или развития циклоспориновой зависимости (напоминающей стероидную зависимость) при снижении дозы очень высока. Ремиссия может поддерживаться длительным приемом циклоспорина, но продолжительность лечения оказывается ограничена из-за нефротоксичности препарата - способности вызывать интерстициальный фиброз с прогрессирующим ухудшением функции почек.
- Альтернативой циклоспорину являются алкилирующие препараты (циклофосфамид и хлорбутин), вызывающие у больных ФСГС (30% стероидорезистентных и 70% стероидозависимых) длительную стойкую ремиссию.
Мембранозная нефропатия (МН). МН, или мембранозный нефрит, — одна из самых распространенных форм гломерулонефрита (до 30% случаев нефротического синдрома у взрослых), разработке методов лечения которой посвящено наибольшее число исследований. Однако оценка эффективности методов иммунодепрессивной терапии МН значительно затруднена из-за большой вариабельности клинического течения заболевания — частого развития спонтанных ремиссий (до 40% случаев), иногда спустя месяцы и годы после начала нефротического синдрома.
За последние 25 лет в этой области было проведено множество исследований, предложено несколько вариантов иммунодепрессивной терапии МН. Однако обобщение и интерпретация их результатов крайне затруднены из-за разнообразия видов исследований, использующихся препаратов и схем их применения, критериев включения в исследование и оценки исходов, длительности наблюдения, а главное — из-за частой несопоставимости между собой больных, участвовавших в этих испытаниях, по прогностическим признакам — имеется в виду преобладание в ряде случаев больных с исходно хорошим прогнозом, что влияет на оценку эффективности иммунодепрессивной терапии. Поэтому одной из важнейших задач стало выявление больных, имеющих наибольший риск прогрессирования заболевания, у которых затем и должна была оцениваться эффективность различных видов терапии. Факторами, связанными с высоким риском прогрессирования заболевания, в ряде исследований оказались: тяжелый нефротический синдром, артериальная гипертензия, возраст старше 50 лет, мужской пол и исходное снижение функции почек. Наконец, в последние годы исследователями из Канады (группа проф. D. Cattran) была разработана математическая модель, с вероятностью 86% позволяющая предсказывать развитие ХПН и в то же время основанная на простых и доступных клинических параметрах — тяжести и длительности протеинурии и скорости изменения функции почек.
Нам удалось сформулировать ряд обоснованных положений по лечению МН.
- Поскольку положительное влияние стероидной терапии на частоту ремиссий и сохранение функции почек при МН не доказано, нет оснований начинать лечение МН с длительного приема одних кортикостероидов.
- В то же время, несмотря на доказанное положительное действие алкилирующих препаратов на частоту ремиссий и скорость прогрессирования почечной недостаточности, вероятность спонтанных ремиссий оправдывает назначение цитостатиков (в сочетании с кортикостероидами) только у пациентов с высоким риском прогрессирования заболевания, который может быть оценен на основании целого комплекса клинических и гистологических данных. При этом циклофосфамид и хлорбутин обладают одинаковой эффективностью. Оба препарата также имеют высокую ближайшую и отдаленную токсичность.
- Ряд крупных исследований подтвердили эффективность циклоспорина (4 - 6 мг/кг в течение 12 месяцев) в отношении нефротического синдрома и прогрессирования МН, благодаря чему циклоспорин может рассматриваться как альтернатива алкилирующим препаратам, особенно из-за связанного с ними риска развития онкологических заболеваний.
Нефропротективная терапия. Подавляющее большинство хронических диффузных заболеваний почек характеризуются неуклонным прогрессированием, которое постепенно приводит к потере массы действующих нефронов, развитию ХПН и в итоге — к терминальной почечной недостаточности, требующей дорогостоящих методов заместительной терапии (хронический диализ или трансплантация почки).
Сегодня механизмы прогрессирования почечной недостаточности рассматриваются с учетом ведущей роли следующих факторов: гемодинамических нарушений (гиперперфузии почечных клубочков с развитием внутрикапиллярной гипертензии и гиперфильтрации); большой протеинурии; комплекса метаболических нарушений (в первую очередь липидного и пуринового обмена).
Особо пристальное внимание протеинурия, как важный фактор прогрессирования паренхиматозных заболеваний почек, начала вызывать после демонстрации прямой связи между величиной протеинурии и риском прогрессирования почечной недостаточности, почти не зависящей от морфологии почечного процесса. С другой стороны, степень замедления потери клубочковой фильтрации (под воздействием малобелковой диеты или ингибиторов АПФ — ИАПФ) соответствовала степени одновременного снижения протеинурии. Хотя факт наличия тубулоинтерстициального воспаления одновременно с гломерулярным у больных с протеинурическими формами нефритов давно известен, до последнего времени не было ясно, является ли это следствием ишемической облитерации перитубулярных капилляров или же альбумин и другие белки, накапливаясь в просвете почечных канальцев, действительно могут вызывать воспаление интерстиция. В последние годы удалось доказать, что выраженная и длительная протеинурия оказывает на эпителий канальцев токсическое действие. Процесс реабсорбции профильтрованных белков активирует эпителий проксимальных канальцев, что заканчивается экспрессией генов воспалительных и вазоактивных веществ (таких, как TGF-β, МСР-1 и эндотелины). Молекулы этих веществ, вырабатываемых почечными канальцами в избыточных количествах, секретируются через базальные отделы клеток в интерстиций, приводя к развитию воспалительной реакции, которая при большинстве форм нефрита предшествует развитию нефросклероза.
Действие ИАПФ при ГН не ограничивается снижением системного АД. Ингибиция АПФ блокирует системный и органный синтез ангиотензина II (АII) и накапливает в циркуляции и тканях кинины. Блокада локально-почечного АII уменьшает внутриклубочковую гипертензию — одну из главных причин неиммунного прогрессирования ГН, сокращает пролиферацию мезангиальных и канальцевых клеток, тормозит развитие склероза клубочков и интерстиция.
Кроме того, в последние годы доказана способность ИАПФ снижать протеинурию, проявляющаяся при ограничении приема натрия. Перечисленные свойства позволяют ИАПФ при длительном применении тормозить прогрессирование ГН. С этих позиций ИАПФ могут назначаться почти всем больным ХГН (не имеющим противопоказаний к их назначению), как с гипертензией, так и с нормальным уровнем АД, тем более при наличии существенной протеинурии.
Блокаторы рецепторов АII (козаар, диован и др.) обеспечивают более полную блокаду локально-почечного АII. За последний год опубликованы данные первых контролируемых исследований, подтверждающие их нефропротективные свойства.
Гепарин в нефрологической практике используется не только в связи с его способностью подавлять процессы внутрисосудистой (в том числе внутриклубочковой) коагуляции; он оказывает (по предварительным данным) диуретическое, натрийуретическое, гипотензивное, а также гиполипидемическое действие. Кроме того, он уменьшает протеинурию, снижает пролиферацию мезангиальных клеток. Широкому применению гепарина препятствуют непостоянство его клинического эффекта и частота побочных проявлений — риск кровотечений. Изучается эффективность низкомолекулярных гепаринов, обладающих меньшей антикоагулянтной и геморрагической активностью.
Дипиридамол был предложен для лечения нефрологических больных с учетом его антиагрегантного, антитромбоцитарного действия. В дальнейшем была показана способность дипиридамола умеренно снижать протеинурию и гематурию, а также тормозить ухудшение функции почек. В последние годы объектом изучения стали новые нефропротективные свойства дипиридамола, в том числе его антиоксидантное действие. Дипиридамол назначается при ГН как в сочетании с другими препаратами (ацетилсалициловой кислотой, гепарином и иммунодепрессантами), так и в виде монотерапии. Широкому его применению способствуют достаточно хорошая переносимость (хотя возможны сильные головные боли, покраснение лица) и отсутствие серьезных побочных явлений.
Наконец, у больных с гиперлипидемией (обычно наблюдающейся при НС) изучается влияние на прогрессирование процесса гиполипидемических препаратов, уменьшающих отложения липидов в ткани почек с последующим снижением пролиферации мезангиальных клеток и замедлением склерозирования почечной ткани. Лучше изучены статины, снижающие синтез холестерина в печени, — ловастатин (мевакор), флювастатин (лескол). Многочисленные экспериментальные работы подтверждают благоприятное действие статинов при различных нефропатиях, однако клинические наблюдения в этой области немногочисленны.
Что такое гломерулонефрит острый (нефритический синдром)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Застело Е. С., детского нефролога со стажем в 15 лет.
Над статьей доктора Застело Е. С. работали литературный редактор Вера Васина , научный редактор Кирилл Лелявин и шеф-редактор Маргарита Тихонова

Определение болезни. Причины заболевания
Острый гломерулонефрит (Acute glomerulonephritis) — это группа заболеваний почек, которые отличаются по своей структуре, подходам к лечению и причинам, но все они в первую очередь приводят к повреждению почечных клубочков. Клубочками, или гломерулами, называют пучки кровеносных сосудов с мелкими порами, через которые в почках фильтруется кровь.
При развитии болезни в моче внезапно появляется кровь и выявляется белок, повышается артериальное давление, возникают отёки и может временно нарушиться работа почек.

Распространённость
Острый гломерулонефрит встречается у пациентов всех возрастов, но выделяют два пика заболеваемости: в 5–12 лет и после 60 лет [3] [4] . Чаще гломерулонефритом болеют мужчины.
Ежегодно выявляют около 470 000 случаев острого гломерулонефрита, уровень заболеваемости колеблется от 9 до 29 случаев на 100 000 населения [3] [4] .
В России гломерулонефрит — это ведущая причина терминальной стадии хронической болезни почек. Эта болезнь несовместима с жизнью и требует дорогостоящей почечной заместительной терапии: диализа и трансплантации донорской почки [19] .
Причины острого гломерулонефрита
Острый гломерулонефрит зачастую возникает после перенесённой инфекции, вызванной бета-гемолитическим стрептококком группы А (БГСА).
К болезням почек могут приводить следующие штаммы:
- 1, 4, 12 (вызывают болезнь после фарингита);
- 2, 49, 55, 57, 60 (после кожных инфекций) [16] .
Такой гломерулонефрит называют острым постстрептококковым гломерулонефритом (ОПСГН) [2] . Риск развития ОПСГН зависит от локализации инфекции: после фарингита он возникает в 5–10 % случаев, после кожной инфекции, например стрептодермии, — в 25 % случаев [5] [6] . В последнее время ОПГСН в развитых странах встречается всё реже.
Стрептококк может также вызывать ангину, тонзиллит и скарлатину, поэтому эти заболевания часто предшествуют острому гломерулонефриту. Однако в большинстве случаев точную причину гломерулонефрита установить не удаётся: в посевах мочи и крови возбудитель отсутствует, в истории болезни нет перенесённых инфекций [1] [3] [11] [15] .
Помимо стрептококка, к развитию острого гломерулонефрита могут приводить:
- токсические факторы — отравление свинцом и ртутью, употребление органических растворителей и алкоголя, приём некоторых лекарств (Амикацина, рентгеноконтрастных препаратов);
- другие инфекции — бактерии (стафилококк, энтерококк, диплококк, бледная трепонема и др.), вирусы (цитомегаловирус, вирусы простого герпеса, гепатита В, Эпштейна — Барр, коронавирус).
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы острого гломерулонефрита
Острый гломерулонефрит может около трёх недель протекать без симптомов [2] [4] [10] . Затем развивается характерный острый нефритический синдром, включающий основные проявления болезни:
- отёки;
- гематурию (кровь в моче);
- гипертонию [12][15] .
Отёки возникают у 80–90 % пациентов [16] . Появление отёков при остром гломерулонефрите вызвано задержкой натрия и замедленной фильтрацией крови в клубочках [16] . У детей отёки распространяются по всему телу, у взрослых, как правило, отекают только ноги и лицо. В 10–50 % случаев отёки сопровождаются тупыми болями в пояснице, которые возникают из-за воспаления и растяжения капсулы почки.

Гипертония развивается у 50–90 % пациентов, из них более чем у 75 % больных давление сильно повышено [16] [19] . Гипертония может протекать бессимптомно или проявляться головными болями. Основные причины высокого давления при остром гломерулонефрите — это увеличение объёма циркулирующей крови, связанное с задержкой жидкости и натрия, а также повышение сердечного выброса и периферического сосудистого сопротивления.
С первых дней болезни уменьшается объём выделяемой мочи (диурез). При лечении он восстанавливается через 4–7 дней, после чего исчезают отёки и нормализуется артериальное давление (гипертония обычно наиболее выражена в разгар заболевания [16] ). Однако ещё в течение полугода отдельные симптомы могут сохраняться.
Острый постстрептококковый гломерулонефрит может протекать в двух формах:
- циклически — типичный вариант;
- ациклически — только с одним симптомом, атипичный вариант.
Циклическое течение
Болезнь начинается остро: состояние резко ухудшается, появляется выраженная слабость, тошнота, рвота и повышается температура.
Затем развивается нефритический синдром:
- с почечными симптомами — уменьшается объём выделенной мочи, в ней появляется кровь, белок и цилиндрические тельца;
- с внепочечными симптомами — болит голова, живот или поясница, возникает слабость, астения, снижается или пропадает аппетит.
Пациент, как правило, вспоминает, что этим симптомам предшествовала ангина, тонзиллит, скарлатина или другая бактериальная инфекция. Скрытый период после ангины и обострения хронического тонзиллита составляет 2–4 недели, после стрептодермии — 8–12 недель.
Ациклическое течение
Снижается диурез, появляется гематурия, но внепочечные симптомы не возникают, поэтому заболевание обычно переносится легче. Предугадать, как будет развиваться гломерулонефрит, невозможно — течение болезни зависит от состояния иммунной системы.
Патогенез острого гломерулонефрита
Известно, что гломерулонефрит развивается под действием бактериальных и токсических факторов, однако патогенез заболевания до конца не изучен. Выделяют три основных механизма развития болезни: иммунный, гемодинамический и метаболический. Наибольшее значение имеет первый фактор [16] [18] [19] [21] .
К иммунным механизмам развития гломерулонефрита относятся:
- образование иммунных комплексов в клубочках;
- захват клубочками циркулирующих иммунных комплексов;
- перекрёстная реакция между антигенами;
- прямая активации системы комплемента антигенами в клубочках [7][8][9] .
Рассмотрим эти механизмы более подробно на примере острого постстрептококкового гломерулонефрита (ОПСГН). Антиген нефритогенного, т. е. опасного для почек штамма, откладывается в клубочках, что запускает иммунные реакции.
Иммунная система состоит из гуморального и клеточного иммунитета. Клетки гуморального иммунитета — это B-лимфоциты, которые первыми встречают антигены. К антигенам относятся, например, вещества, которые содержатся в микроорганизмах или выделяются ими. Эти вещества организм рассматривает как чужеродные или потенциально опасные и начинает вырабатывать против них антитела. При остром гломерулонефрите клетки гуморального иммунитета вырабатывают нефритогенные антистрептококковые антитела. Эти антитела связываются с антигенами и образуются иммунные комплексы.

Затем активируется клеточный иммунитет. Его агенты — это макрофаги и Т-лимфоциты: Т-хелперы, Т-киллеры и Т-супрессоры [10] . При этом запускается система комплимента по классическому типу, из-за чего вырабатываются дополнительные медиаторы воспаления и привлекаются провоспалительные клетки. Система комплемента — это комплекс белков, которые защищают организм от действия чужеродных агентов. Из-за активации этой системы почечные клубочки начинают разрушаться [7] .
Повреждённые клетки вырабатывают провоспалительные цитокины: IL-1, IL-6, TNF-a, из-за чего клубочки пропитываются лейкоцитами и моноцитами, а макрофаги вызывают отёк тканей.
Стрептококковые М-белки и пирогенные экзотоксины (токсины, которые вызывают повышение температуры) выступают в качестве суперантигенов, т. е. могут массово активировать Т-лимфоциты, вырабатывающие провоспалительные цитокины. В активный период гломерулонефрита образуются специфические антитела и криоглобулины, что приводит к аутоиммунному воспалению [11] .
Согласно последним исследованиям, гломерулонефрит развивается из-за генетических нарушений Т-клеточного звена иммунитета [19] .
Классификация и стадии развития острого гломерулонефрита
По характеру течения гломерулонефрит бывает:
- острым;
- подострым (с бурным, часто злокачественным течением и развитием острой почечной недостаточности); .
По этиологическому фактору:
- Инфекционный — бактериальный, вирусный и паразитарный.
- Токсический — вызванный действием органических растворителей, лекарств, алкоголя, свинца и ртути.
- Гломерулонефриты при системных заболеваниях:
- Люпус-нефрит — осложнение системной красной волчанки.
- IgA-нефропатия — вид гломерулонефрита, который может длительно проявляться только микрогематурией, артериальное давление при этом не повышается. Макрогематурия развивается при присоединении респираторной инфекции или воспалении других слизистых оболочек.
- Пурпура Шенлейна — Геноха — воспаление мелких сосудов, проявляется геморрагической сыпью, артритом и болью в животе.
По морфологической картине:
- минимальные изменения;
- фокальный сегментарный гломерулосклероз;
- мембранозный гломерулонефрит (нефропатия);
- мезангиопролиферативный гломерулонефрит (IgA-нефропатия);
- мембранопролиферативный гломерулонефрит;
- полулунный гломерулонефрит;
- фибропластический гломерулонефрит (диффузный склероз) [4][10] .
Морфологические данные выявляются при биопсии почек. Их интерпретацией занимаются морфолог и клиницист.
Осложнения острого гломерулонефрита
Заболевание опасно следующими осложнениями:
- Острое почечное повреждение, острая или хроническая почечная недостаточность.
- Острая сердечная недостаточность — нарушается ритм сердца, его способность сокращаться и расслабляться, меняется степень напряжения сердечной мышцы перед и во время сокращения (преднагрузка и постнагрузка). Может возникать как у людей, страдающих болезнями сердца, так и у здоровых пациентов. Осложнение опасно для жизни и требует срочного лечения [13] .
- Энцефалопатия — накопление в головном мозге токсических органических кислот. Сопровождается неврологическими симптомами, уменьшить которые можно при помощи гемодиализа или перитонеального диализа. К ранним признакам уремической энцефалопатии относятся снижение внимания, быстрая утомляемость и апатия. В дальнейшем эти симптомы усиливаются, ухудшается память, возникает дезориентация в пространстве и неустойчивость настроения, нарушается режим сна и бодрствования [16][18] . — может возникать при беременности.
Без своевременной диагностики и лечения острого гломерулонефрита пациент может погибнуть [15] .
Диагностика острого гломерулонефрита
При подозрении на острый гломерулонефрит проводится лабораторная и инструментальная диагностика.
Лабораторная диагностика
Инструментальная диагностика
- Ультразвуковая диагностика почек — оцениваются размеры почек, структурные нарушения, наличие пороков и аномалий развития. Исследование проводится для дифференциальной диагностики с другими болезнями почек.
- Биопсия почек — показана в тех случаях, когда назначенная терапия оказалась неэффективной. С помощью биопсии можно уточнить тип гломерулонефрита, определить прогноз и тактику лечения [15] . Показания к биопсии: отягощённая наследственность по заболеваниям почек, нетипичные симптомы, высокая концентрация белка в моче и прогрессирующее снижение СКФ.
Основным критерием диагностики гломерулонефритов является морфологическая картина (т. е. состояние клеток и тканей почечных клубочков), так как она индивидуальна для каждого типа заболевания [16] [18] [19] [20] .
Дифференциальная диагностика острого и хронического гломерулонефритов
Лечение острого гломерулонефрита
При лечении острого гломерулонефрита применяют немедикаментозную, антибактериальную, симптоматическую и иммуносупрессивную терапию. В тяжёлых случаях может потребоваться заместительная терапия.
Лечение может проходить как амбулаторно, так и в больнице.
Показания к госпитализации:
- возраст до 18 лет;
- нарушение работы почек (как с уменьшением диуреза, так и без этого симптома);
- сохраняющаяся или нарастающая гипертония;
- признаки острой сердечной недостаточности;
- нефротический синдром.
Немедикаментозная терапия
- При тяжёлом течении болезни показаны покой и постельный режим. К признакам тяжёлого течения относятся кровь в моче, заметная визуально, отёки по всему телу и симптомы сердечной недостаточности.
- Следует потреблять до 1–2 г соли в сутки. Если появились отёки, особенно если они нарастают, нужно сократить потребление соли до 0,2–0,3 г в сутки [16] .
- При снижении функции почек рекомендуется есть менее 0,5 г/кг белка в сутки. Его количество нужно сократить за счёт животных белков, сохранив при этом калорийность рациона и содержание витаминов [15] .
- В острый период болезни следует меньше пить, необходимый объём жидкости рассчитывают с учётом диуреза за предыдущий день + 300 мл.
Диета и постельный режим помогают жидкости не задерживаться в организме. Питание и режим можно скорректировать после того, как исчезнут отёки и давление придёт в норму [16] .
Антибактериальная терапия
Всем пациентам с подтверждённой стрептококковой инфекцией (положительные результаты посевов с кожи, зева и высокие титры антистрептококковых антител в крови) рекомендуется проводить антибактериальную терапию. Её назначают с учётом чувствительности возбудителя. Наиболее часто применяются препараты пенициллинового ряда. Макролиды II и III поколений являются препаратами второй линии терапии [16] .
Симптоматическая терапия
Чтобы уменьшить отёки и предотвратить связанные с ними осложнения, назначаются мочегонные средства (диуретики) [16] . Для снижения артериального давления применяются блокаторы медленных кальциевых каналов. При выраженных изменениях со стороны крови, например повышенной свёртываемости, врач может назначить антикоагулянты. Продолжительность терапии зависит от различных факторов: тяжести заболевания, длительности почечных изменений по данным анализов, возраста и т. д.
Иммуносупрессивная терапия
При быстром развитии заболевания, сильных отёках и артериальном давлении выше 130/90 мм рт. ст. назначаются глюкокортикостероиды.
Заместительная почечная терапия
Заместительная терапия показана при развитии почечной недостаточности [15] .
Основные методы заместительной терапии:
- гемодиализ;
- перитонеальный диализ;
- трансплантация почки.

Прогноз. Профилактика
Прогноз в большинстве случаев благоприятный [7] . Как правило, отёки уменьшаются в течение 10 дней, уровень креатинина в сыворотке нормализуется за 3–4 недели [16] .
Среди детей осложнения встречаются редко. У пожилых пациентов может развиться острая сердечная и почечная недостаточность [14] . Тяжёлая почечная недостаточность возникает менее чем у 1 % больных [16] [18] .
Большинство пациентов полностью выздоравливают в течение 1–2 лет. В это период нужно соблюдать диету, терапия показана только при ухудшении клинических и лабораторных показателей.
Критический период после перенесённого острого гломерулонефрита составляет 1,5–2 месяца. В это время часто возникают рецидивы. Если симптомы сохраняются более полугода, такое течение называется затяжным. Симптомы, которые не проходят более года, указывают на развитие хронического гломерулонефрита.
Профилактика острого гломерулонефрита
Чтобы предотвратить развитие гломерулонефрита, нужно своевременно выявлять и лечить хронические заболевания. Для этого рекомендуется раз в год проходить осмотр у стоматолога, оториноларинголога и гинеколога.
Острый гломерулонефрит – это заболевание иммуновоспалительного характера, характеризующееся вовлечением структурных единиц почек – нефронов и преимущественным поражением клубочкового аппарата. Патология протекает с развитием экстраренальных синдромов (отечного и гипертонического) и ренальных проявлений (мочевого синдрома). В диагностике применяется исследование мочи (общий анализ, проба Реберга, Зимницкого, Нечипоренко), УЗИ почек, биохимическое и иммунологическое исследование крови, биопсия почечной ткани. Лечение требует соблюдения постельного режима и диеты, назначения стероидных гормонов, гипотензивных, диуретических средств.
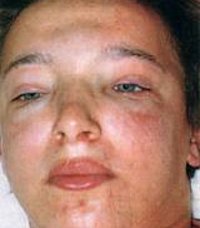
Общие сведения
Острый гломерулонефрит развивается преимущественно у детей в возрасте 2-12 лет и взрослых до 40 лет. Мужчины заболевают в 15,2 раза чаще, чем женщины. Пик заболеваемости приходится на влажное и холодное время года. При болезни происходит преимущественное поражение клубочков (почечных телец), кроме этого в патологический процесс вовлекаются канальца и межуточная ткань обеих почек. Поражение почек связано со специфической иммунной реакцией, обусловленной инфекционным или аллергическим процессом.

Причины
В большинстве случаев развитие острого гломерулонефрита сопряжено с перенесенной стрептококковой инфекцией – фарингитом, ангиной, обострением тонзиллита, скарлатиной, рожистым воспалением кожи. Этиологическим агентом в этих случаях, как правило, выступает b-гемолитический стрептококк группы А. О стрептококковой этиологии острого гломерулонефрита свидетельствует определение повышенного титра антител к стрептококковой гиалуронидазе и стрептолизину-О, увеличение ЦИК, содержащих антигены к стрептококку.
Иногда развитию болезни предшествует вирусная инфекция – грипп, эпидемический паротит, ветряная оспа, краснуха, инфекционный мононуклеоз, герпес, гепатит. Реже патология возникает после дифтерии, стафилококковых и пневмококковых пневмоний, малярии, бруцеллеза, инфекционного эндокардита, брюшного и сыпного тифа и других инфекций.
Кроме инфекционно-иммунных острых гломерулонефритов встречаются неинфекционно-иммунные формы заболевания, вызванные введением сывороток и вакцин, индивидуальной непереносимостью пыльцы растений, приемом нефротоксичных лекарственных препаратов, укусом насекомых или змей, алкогольной интоксикацией и др. причинами. Предрасполагающими факторами служат переохлаждение, анатомо-физиологическая незавершенность строения нефронов у детей.
Патогенез
Специалисты в сфере современной урологии придерживаются мнения, что острый гломерулонефрит - это иммунокомплексная патология. После инфекционного или аллергического воздействия происходит изменение реактивности организма, что проявляется образованием антител к чужеродным антигенам. Взаимодействуя с комплементом, иммунные комплексы откладываются на поверхностях базальных мембран капилляров клубочков. Изменяется структура капиллярных стенок, увеличивается проницаемость сосудов, создаются условия для тромбообразования.
Расстройство трофики почечной ткани ведет к тому, что в ишемической почке активизируется функция ренин-ангиотензин-альдостероновой системы, что приводит к спазму периферических сосудов и, как следствие, повышению АД. На этом фоне нарушаются процессы фильтрации и реабсорбции, происходит задержка Na и воды, в моче появляются патологические элементы.
Классификация
По вызывающим поражение причинам различают первичный, идиопатический и вторичный гломерулонефрит. Первичный гломерулонефрит связан с инфекционным, аллергическим или токсическим воздействием на почечную ткань; вторичный – служит проявлением системной патологии (геморрагического васкулита, СКВ и др.); идиопатический гломерулонефрит развивается по неопределенным причинам. В зависимости от этиофакторов гломерулонефриты могут быть инфекционно-иммунными и неинфекционно–иммунными.
Симптомы острого гломерулонефрита
Классическая картина включает триаду симптомокомплексов: почечный (ренальный) – мочевой синдром и внепочечные (экстраренальные) – отечный и гипертензивный синдромы. Патология обычно манифестирует спустя 1-2 недели после имевшего место этиологического воздействия (инфекции, аллергической реакции и т. д.).
Появление отеков – наиболее ранний и частый признак острого гломерулонефрита, встречается у 70-90% пациентов, у половины из них отеки бывают значительными. Отеки располагаются преимущественно в области лица: наиболее выражены по утрам и спадают днем, сменяясь отечностью лодыжек и голеней. В дальнейшем отечный синдром может прогрессировать до анасарки, гидроперикарда, гидроторакса, асцита. В некоторых случаях видимые отеки могут отсутствовать, однако ежедневное увеличение массы тела пациента свидетельствует о задержке жидкости в тканях.
Артериальная гипертензия обычно выражена умеренно: у 60-70% пациентов АД не превышает 160/100 мм рт. ст. Однако стойкая длительная гипертензия имеет неблагоприятный прогноз. Для острого гломерулонефрита характерно сочетание артериальной гипертензии с брадикардией менее 60 уд. в мин., которая может держаться на протяжении 1-2 недель. При остро развивающейся гиповолемии возможны явления недостаточности левого желудочка, выражающейся сердечной астмой и отеком легких.
Течение патологии может сопровождать болевой синдром различной степени выраженности: боли в пояснице чаще симметричны и обусловлены растяжением почечных капсул и нарушением уродинамики. Мочевой синдроме характеризуется ранним развитием олигурии и даже анурии в сочетании с сильной жаждой. При этом отмечается повышение относительной плотности мочи, появление в моче гиалиновых и зернистых цилиндров, эритроцитов, большого количества белка.
Диагностика
При диагностике острого гломерулонефрита учитывается наличие типичных клинических синдромов, изменений в моче, биохимическом и иммунологическом анализе крови, данные УЗИ и биопсии почки. Общий анализ мочи характеризуется протеинурией, гематурией, цилиндрурией. Для пробы Зимницкого типично уменьшение количества суточной мочи и повышение ее относительной плотности. Проба Реберга отражает снижение фильтрационной способности почек.
Изменения биохимических показателей крови могут включать гипопротеинемию, диспротеинемию (уменьшение альбуминов и увеличение концентрации глобулинов), появление СРБ, и сиаловых кислот, умеренную гиперхолестеринемию и гиперлипидемию, гиперазотемию. При исследовании коагулограммы определяются сдвиги в свертывающей системе – гиперкоагуляционный синдром. Иммунологические анализы позволяют выявить нарастание титра АСЛ-О, антистрептокиназы, антигиалуронидазы, антидезоксирибонуклеазы В; повышение содержания IgG, IgM, реже IgА; гипокомплементемию СЗ и С4.
УЗИ почек обычно показывает неизмененные размеры органов, уменьшение эхогенности, снижение скорости клубочковой фильтрации. Показаниями к проведению биопсии почки служат необходимость дифференциации острого и хронического гломерулонефрита, быстропрогрессирующего нефрита. При острой форме болезни в нефробиоптате определяются признаки клеточной пролиферации, инфильтрация клубочков моноцитами и нейтрофилами, наличие плотных депозитов иммунных комплексов и др. При гипертензивном синдроме необходимо проведение исследования глазного дна и ЭКГ.
Лечение острого гломерулонефрита
При выраженных отеках и артериальной гипертензии одновременно назначаются диуретические и гипотензивные средства. Антибиотикотерапия проводится при имеющихся признаках инфекции (тонзиллите, пневмонии, эндокардите и др.). При острой почечной недостаточности может потребоваться назначение антикоагулянтов, проведение гемодиализа. Курс стационарного лечения составляет 1-1,5 месяца, после чего пациента выписывают под наблюдение врача-нефролога.
Прогноз и профилактика
В большинстве случаев патология хорошо поддается терапии кортикостероидными гормонами и заканчивается выздоровлением. В 1/3 случаев возможен переход в хроническую форму; смертельные исходы крайне редки. На этапе диспансерного наблюдения пациенту требуется динамическое исследование мочи.
Профилактика развития первичного острого гломерулонефрита и его рецидивов заключается в лечении острых инфекций, санации хронических очагов в носоглотке и полости рта, повышении сопротивляемости организма, недопущении охлаждения и длительного нахождения во влажной среде. Лицам с повышенным аллергическим фоном (крапивницей, бронхиальной астмой, сенной лихорадкой) профилактические вакцинации противопоказаны.
Читайте также:

