Лечение респираторная микоплазменная инфекция
Обновлено: 19.04.2024
О.А. Мубаракшина, Ю.М. Дронова
Воронежская государственная медицинская академия им. Н.Н. Бурденко, Воронеж
В обзоре рассмотрены актуальные вопросы этиологии, диагностики и лечения микоплазменных инфекций дыхательных путей. Отражены особенности клинического течения, основные подходы к лекарственной терапии, показания к назначению антибактериальных средств. Продемонстрирована высокая эффективность и безопасность макролидов в лечении респираторного микоплазмоза. Обосновано применение рокситромицина как одного из препаратов выбора. Указаны механизмы его действия, спектр антибактериальной активности и фармакокинетические особенности. Отражены фармакоэкономические преимущества препарата Эспарокси в лечении внебольничных инфекций дыхательных путей, в том числе микоплазменной этиологии.
Микоплазменная инфекция дыхательных путей (ДП), или респираторный микоплазмоз, – антропонозное инфекционное заболевание, протекающее по типу инфекции верхних (риносинусит, назофарингит, ларингит, тонзиллит, трахеит) и нижних ДП (бронхит, пневмония) [1].
Респираторный микоплазмоз является одной из наиболее частых внебольничных инфекций ДП. Так, его частота при острых респираторных заболеваниях составляет 10–16% во внеэпидемический период, а во время эпидемических вспышек может достигать 25–50% [1]. Распространенность респираторного микоплазмоза зависит от возраста. Наиболее часто острые респираторные инфекции, обусловленные Mycoplasma. pneumoniae, встречаются у детей старше 5 лет, подростков и в возрасте до 40 лет. Поражение ДП микоплазмами может происходить по типу моноинфекции, но нередко встречаются ассоциации микоплазм с вирусами (гриппа, парагриппа, аденовируса, респираторно-синцитиального вируса) и бактериями (Streptococcus pneumoniae, Haemophilus influenzae, Chlamydia рneumonia, Moraxella catarrhalis) [1, 2].
Респираторная микоплазменная инфекция, как правило, имеет легкое и среднетяжелое течение. Осложнения и случаи летальных исходов отмечаются обычно редко. В частности, летальность при микоплазменной пневмонии составляет 1,4%. Более тяжелое течение микоплазмоза ДП наблюдается при наличии микробных ассоциаций [3]. Кроме того, наличие иммунодефицитных состояний в отсутствие специфической антибактериальной терапии могут приводить к генерализации инфекции, хронизации воспалительного процесса и микробному носительству. Установлено, что микоплазмы могут быть причиной иммунных нарушений в организме человека [4].
Микробиологическая характеристика возбудителя Возбудителем респираторного микоплазмоза является M. pneumoniae – бактерия, относящаяся к роду Mycoplasma семейства Mycoplasma-taceae класса Mollicutes. Данный микроорганизм представляет собой прокариот, занимающий промежуточное положение между вирусами и бактериями, характеризующийся выраженной полиморфностью строения и очень мелкими размерами – от 125 до 250 мкм. Микоплазма не имеет клеточной стенки, что обусловливает пластичность клетки, а также высокую чувствительность к воздействию факторов внешней среды и природную устойчивость к бета-лактамным антибиотикам. Данный микроорганизм не способен синтезировать стерины, необходимые для образования липидных слоев цитоплазматической мембраны. В результате этого восполнение потребностей в стеринах возбудитель осуществляет за счет утилизации их из инфицированных тканей макроорганизма. M. pneumoniae является мембранным паразитом, способным персистировать во внутриклеточных инвагинатах. Это приводит к тому, что клиническое улучшение, наступающее после активной антибактериальной терапии, не всегда сопровождается гибелью M. pneumoniae, что может способствовать переходу острой формы инфекции в хроническую [5, 6].
Эпидемиология респираторного микоплазмоза
Считается, что источником инфекции являются больные люди с манифестной и субклинической формой заболевания. Передача инфекции обычно осуществляется воздушно-капельным путем при тесных контактах между людьми, что обусловлено нестойкостью возбудителя в окружающей среде. Возможен также контактно-бытовой путь через контаминированные возбудителем руки или предметы обихода. Для M. pneumoniae типичны семейные очаги инфекции, при этом наибольший уровень заболеваемости отмечают в организованных коллективах закрытого типа (школьники, студенты, военнослужащие и др.). Наибольшая распространенность инфекции отмечается в осенне-зимний период [4, 5, 7].
Многие авторы отмечают генетическое детерминирование чувствительности организма человека к микоплазмам, причем человеческая популяция по этому признаку неоднородна. Лица с иммунодефицитами на фоне системных, лимфопролиферативных и соматических заболеваний, ВИЧ-инфекции, лица с синдромом Дауна чаще подвергаются инфицированию M. pneumoniae. Постинфекционный иммунитет обычно длится 5–11 лет и более [8].
Патогенез микоплазменной инфекции ДП
Инфицирование организма человека M. pneumoniaе и развитие клинически манифестных форм респираторного микоплазмоза обусловлены снижением активности иммунной системы. Возбудитель способен поражать эпителий слизистой оболочки всех отделов ДП с развитием в них перибронхиальных и периваскулярных воспалительно-инфильтративных процессов, тромбозов артериол и венул. Микоплазмы активируют процессы перекисного окисления липидов, вызывают блокаду механизмов мукоцилиарного клиренса и в итоге – гибель эпителиоцитов. Позднее происходит вовлечение в воспалительный процесс альвеолоцитов. Иммунные клеточные реакции в очагах повреждений, вызванных M. pneumonia, позволяют относить их к изменениям, протекающим по типу гиперчувствительности замедленного типа. Исходами тяжелого респираторного микоплазмоза нередко являются интерстициальный легочный фиброз, деформирующий бронхит и бронхоэктазы [9]. Присутствие в организме микоплазм негативно влияет на работу самой иммунной системы, вызывая супрессию Т-клеточного и фагоцитарного звеньев иммунитета. Параллельно происходят сдвиги в гуморальном звене, о чем свидетельствуют увеличение В-лимфоцитов (CD20+), повышение уровней IgM и циркулирующих иммунных комплексов [10]. Клинически это может выражаться развитием нереспираторных аутоиммунных проявлений микоплазмоза – миокардитом, менингоэнцефалитом, артритом, нефритом, гепатитом, иммунными цитопениями, бронхиальной астмой, синдромом Стивенса–Джонсона [8, 11].
Клиническая картина и диагностика респираторного микоплазмоза
Инкубационный период заболевания составляет от 1 до 4 недель. Период, когда возможно заражение при поражении микоплазменной инфекцией верхних ДП, – 5–7 дней, при микоплазменной пневмонии – до 2–3 недель. Выраженность клинических проявлений инфекций, вызванных M. рneumonia, достаточно вариабельна и может характеризоваться субклиническим или манифестным течением. Основным симптомом болезни является длительный, изнуряющий малопродуктивный кашель. Манифестные формы респираторного микоплазмоза могут проявляться острыми воспалительными изменениями верхних ДП: риносинусит, назофарингит, ларингит, тонзиллит, трахеит. Следует отметить, что симптоматика микоплазменных поражений верхних ДП имеет мало специфических черт и практически не отличается от респираторных инфекций другой этиологии [12, 13].
Микоплазменная инфекция нижних отделов органов дыхания сопровождается развитием воспаления бронхов и легких. Клинический дебют микоплазменного бронхита и пневмонии напоминает развитие микоплазменной инфекции верхних ДП, однако в этих случаях более длительно сохраняется фебрильная лихорадка. При этом симптомы интоксикации обычно выражены умеренно. Через несколько дней от начала заболевания появляется приступообразный, сухой и навязчивый кашель, который обычно сохраняется достаточно длительно – от нескольких недель до нескольких месяцев. Кашель обычно с течением времени усиливается и постепенно увлажняется, появляется вязкая и скудная слизисто-гнойная мокрота. При аускультации легких выслушиваются рассеянные сухие и разнокалиберные влажные хрипы [14].
Особенностью МП является скудность физикальных данных и несоответствие их выраженным рентгенологическим изменениям в легких [15].
В формуле крови лейкоцитоз отсутствует или незначительный, может определяться лейкопения, обнаруживаются умеренный лимфоцитоз, увеличение СОЭ. В подавляющем большинстве случаев пневмония протекает нетяжело, характеризуется отсутствием дыхательной недостаточности или слабой ее выраженностью. Нарушения со стороны сердечно-сосудистой системы обычно не выражены. При этом у пациентов с иммунодефицитами имеется риск развития осложнений – экссудативный плеврит, миокардит, перикардит, менингоэнцефалит, миелит, нефрит, полиартрит. Опираясь только на клинические данные, диагноз МП поставить практически невозможно, но рентгенологически данная пневмония диагностируется легко [16]. Особенностью ее является также отсутствие эффекта от традиционной стартовой антибактериальной терапии, проводимой антибиотиками группы пенициллинов или цефалоспоринов [8, 13, 15, 16].
На рентгенограммах при микоплазменном поражении бронхов отмечаются характерные признаки бронхита. Особенностью рентгенологической картины микоплазменной пневмонии являются двусторонние интерстициальные изменения, иногда сочетающаяся с лимфаденопатией средостения. При своевременной адекватной этиотропной терапии микоплазменная пневмония довольно быстро регрессирует клинически, но рентгенологическая картина сохраняется в течение 4–6 недель [16, 17].
Решающую роль в выявлении микоплазменной инфекции отводится лабораторной диагностике. Для достоверной этиологической идентификации необходимо проведение серологического исследования (иммуноферментный анализ парных образцов сыворотки крови) в комплексе с методами, основанными на выявлении ДНК микроорганизма с помощью полимеразной цепной реакции [4, 5, 8, 15, 17].
Лечение микоплазменной инфекции ДП
Центральное место в лечении респираторного микоплазмоза занимает антибактериальная терапия. Однако если инфекция ограничивается верхними ДП, можно не прибегать к антибиотикам, ограничившись только симптоматическими средствами: противокашлевыми препаратами при наличии сухого навязчивого кашля, отхаркивающими препаратами при кашле с трудноотделяемой мокротой, местными сосудосуживающими средствами при рините, антисептиками для полоскания горла, физиотерапевтическими процедурами в период реконвалесценции. Антибактериальные препараты показаны прежде всего пациентам, имеющим факторы риска осложненного течения: иммунодефицитные состояния, серповидно-клеточную анемию, синдром Дауна. Антибиотики также необходимы в случае тяжелого течения инфекции, сопровождающегося выраженными симптомами интоксикации, дыхательной недостаточностью, высокой температурой, значительным лейкоцитозом и нейтрофильным сдвигом влево при наличии гнойной мокроты. Микоплазменная пневмония является абсолютным показанием к проведению антибактериальной терапии [3, 8, 15-17].
Продолжительность антибактериальной терапии при микоплазменной пневмонии не имеет каких-либо отличительных особенностей и определяется общепринятыми критериями. При нетяжелом течении заболевания терапия антибиотиками может быть завершена по достижении стойкой нормализации температуры тела в течение 48–72 часов, при таком подходе она составляет обычно не более 7–10 дней. При тяжелой пневмонии, наличии осложнений, внелегочных очагов инфекции продолжительность применения антибактериальных средств определяется индивидуально [18].
Внелегочные проявления респираторного микоплазмоза, такие как полиморфная эритема, миелит, энцефалит, гемолитическая анемия, являются показанием к назначению препаратов группы кортикостероидных гормонов. При наличии брнхообструктивного синдрома показаны бронхолитические препараты [17].
Роль макролидов в лечении респираторного микоплазмоза
Микробиологические характеристики M. pneumoniae объясняют отсутствие эффекта от стандартной терапии β-лактамными антибиотиками, действующими на клеточную стенку бактерии, и приводят к необходимости использования препаратов, способных проникать в пораженные клетки, накапливаться в них и блокировать внутриклеточный синтез белка. Из всего арсенала антимикробных средств такими свойствами обладают макролиды, тетрациклины и фторхинолоны. Тем не менее макролиды являются средством выбора, поскольку обладают рядом положительных свойств, выгодно отличающих их от других антибиотиков. Это особенности спектра действия, удачные фармакокинетические и фармакодинамические характеристики, благоприятный профиль безопасности. Макролиды являются самой безопасной группой антибактериальных препаратов. В отличие от тетрациклинов и фторхинолонов они могут быть назначены детям, беременным и лактирующим женщинам. Использование фторхинолонов детьми возможно только по жизненным показаниям. Тетрациклины назначают детям старше 8 лет, по антимикоплазменной активности они существенно уступают другим классам антибиотиков [15, 17–19].
В то же время макролиды обладают высокой эрадикационной активностью в отношении M. pneumoniae. Их спектр антибактериальной активности включает и другие возбудители, часто находящиеся в ассоциации с микоплазмами – S. pneumoniae, включая пенициллинорезистентные штаммы, H. influenzae, C. pneumoniae, M. catarrhalis [19]. К преимуществам макролидов относятся небольшая кратность применения, возможность более коротких курсов лечения, редкое проявление нежелательных реакций. При использовании макролидов минимален риск неблагоприятного влияния на функцию почек, кроветворение, хрящевую ткань, центральную нервную систему. Тяжелые токсико-аллергические синдромы, анафилактические реакции и антибиотик-ассоциированная диарея, свойственные другим классам антимикробных препаратов, при лечении макролидными антибиотиками встречаются крайне редко [20].
Известны иммуномодулирующие свойства макролидов. Положительное влияние препаратов на показатели иммунной системы отмечается у рокситромицина, кларитромицина и азитромицина [21].
Рокситромицин – эффективный макролид в лечении микоплазменных инфекций ДП
В настоящее время для лечения инфекций верхних и нижних ДП, в т.ч. микоплазменной этиологии, успешно применяется макролидный антибиотик рокситромицин [22]. Данный препарат представляет собой полусинтетическое производное природного эритромицина, относится к 14-членным макролидам. Модификация лактонного кольца макролида привела к появлению преимуществ у рокситромицина по сравнению с эритромицином, в частности к расширению спектра антибактериальной активности за счет грамотрицательной флоры (H. influenzae, Neisseria spp., М. сatarrhalis) и улучшению показателей фармакокинетики [23].
Рокситромицин, как и все макролиды, оказывает бактериостатическое действие за счет нарушения синтеза белка микробной клеткой путем связывания молекулы препарата с 50S-субъединицей рибосомы. При этом рокситромицин способен создавать более высокие внутриклеточные концентрации по сравнению с эритромицином, что обеспечивает большую активность препарата против внутриклеточных бактерий – микоплазм. По сравнению с другими макролидами, в частности азитромицином и кларитромицином, рокситромицин не уступает им по антимикоплазменной активности [24].
Заслуживает внимания также эффективность рокситромицина в отношении других бактерий, нередко сочетающихся с M. pneumoniae. Рокситро-мицин высокоактивен в отношении S. рneumoniae, М. сatarrhalis, С. рneu-moniae, Legionella spp. По активности в отношении данных возбудителей рокситромицин не отличается от азитромицина и кларитромицина [25]. Несмотря на то что in vitro рокситромицин проявляет относительно невысокую активность в отношении H. influenzae, клиническая эффективность антибиотика у больных с инфекциями респираторного тракта, вызванными данным микроорганизмом, по данным мета-анализа контролируемых исследований составляет около 80% [26].
По данным некоторых авторов, рокситромицин обладает противовоспалительной активностью. Считается, что она может быть связана с его способностью ингибировать выработку цитокинов и антиоксидантными свойствами [27]. Согласно данным экспериментальных исследований, по выраженности противовоспалительного эффекта рокситромицин превосходит кларитромицин и азитромицин [28]. По сравнению с эритромицином при приеме внутрь рокситромицин имеет более высокую биодоступность. Он является более устойчивым к действию кислоты желудочного сока, быстрее и полнее всасывается в желудочно-кишечном тракте. Пища, как правило, не влияет на полноту абсорбции рокситромицина, но может понижать ее скорость [29].
Стандартной суточной дозой рокситромицина являются 300 мг. Причем, по данным рандомизированного исследования, которое включило 1588 пациентов с различными инфекциями, эффективность антибиотика одинаково высока вне зависимости от того, назначался ли он однократно в дозе 300 мг или в два приема по 150 мг [30]. Благодаря улучшенным параметрам абсорбции и распределению рокситромицин имеет более высокие концентрации в тканях и жидкостях организма по сравнению с другими макролидами. Высокие концентрации препарата, превышающие МПК90 для чувствительных микроорганизмов, создаются в миндалинах, придаточных пазухах носа, легких, а также в других органах и средах [31].
Рокситромицин способен в значительной степени проникать внутрь клеток, особенно в нейтрофильные лейкоциты и моноциты, стимулируя их фагоцитарную активность. Отношение концентрации антибиотика в цитоплазме нейтрофилов к концентрации во внеклеточной жидкости для рокситромицина составляет 21,9, а для эритромицина – около 6,6 [32].
Важным достоинством рокситромицина является его хорошая переносимость. Нежелательные реакции развиваются лишь у 3–4% пациентов, причем 75–80% этих случаев – легкие диспепсические явления [33]. Рокситромицин в меньшей степени, чем эритромицин, угнетает систему цитохромов Р450. Это имеет важное клиническое значение, поскольку данный препарат имеет небольшую вероятность взаимодействия с лекарственными средствами, метаболизирующимися в печени при участии микросомальных ферментов. В исследованиях не выявлено клинически значимого взаимодействия данного антибиотика с теофиллином, варфарином, оральными контрацептивами и карбамазепином [34].
На сегодняшний день российский фармацевтический рынок предлагает несколько торговых наименований препарата рокситромицин. Следует помнить о том, что эффективность и безопасность фармакотерапии во многом определяются качеством производства лекарственного средства. Одним из наиболее качественных генериков рокситромицина является немецкий препарат Эспарокси, биоэквивалентный оригинальному средству и находит широкое применение в Европе. Необходимо отметить выгодные фармакоэкономические характеристики данного препарата. При западноевропейском качестве стоимость Эспарокси ниже, чем у оригинального препарата и других генериков, поэтому лечение им инфекций ДП различной, в т.ч. микоплазменной, этиологии является эффективным, безопасным и экономически оправданным.
Литература
Об авторах / Для корреспонденции
Микоплазменная пневмония – атипичная легочная инфекция, возбудителем которой является Мycoplasma pneumoniae. Заболевание сопровождается катаральными и респираторными проявлениями (заложенностью носа, першением в горле, приступами навязчивого малопродуктивного кашля), интоксикационным синдромом (субфебрилитетом, слабостью, головной болью, миалгией), явлениями диспепсии (дискомфортом в ЖКТ). Микоплазменная этиология пневмонии подтверждается данными рентгенографии и КТ легких, серологического и ПЦР исследований. При микоплазменной пневмонии показаны макролиды, фторхинолоны, бронходилататоры, отхаркивающие средства, иммуномодуляторы, физиолечение, массаж.
МКБ-10
Общие сведения
Микоплазменная пневмония – заболевание из группы атипичных пневмоний, вызываемое патогенным агентом – микоплазмой (М. pneumoniae). В практике пульмонологии частота микоплазменных пневмоний варьирует, составляя от 5 до 50% случаев внебольничных воспалений легких или около трети пневмоний небактериального генеза. Заболевание регистрируется в виде спорадических случаев и эпидемических вспышек. Характерны сезонные колебания заболеваемости с пиком в осенне-зимний период. Микоплазменная пневмония наблюдается преимущественно у детей, подростков и молодых пациентов до 35 лет, намного реже – в среднем и зрелом возрасте. Легочная инфекция чаще встречается в организованных коллективах с тесными контактами (в дошкольных, школьных и студенческих группах, у военнослужащих и др.), возможны семейные случаи инфекции.
Причины
Микоплазменную пневмонию вызывают высоковирулентные штаммы анаэробных микроорганизмов рода Мycoplasma – M. pneumoniae. Возбудитель представлен мелкими (по размеру сравнимыми с вирусными частицами), не имеющими клеточной стенки (аналогично L-формам бактерий), прокариотическими организмами. Микоплазмы легко адсорбируются на поверхностных рецепторах клеток-мишеней (эпителиоцитов трахеи и бронхов, альвеолоцитов, эритроцитов и др.) и паразитируют на мембране или внутри клетки-хозяина. Интеграция микоплазмы в клеточную мембрану или ее проникновение внутрь клетки превращает последнюю в иммунологически инородную, что провоцирует развитие аутоиммунных реакций. Именно аутоантителообразование служит причиной нереспираторных проявлений микоплазменной инфекции.
Микоплазмы способны длительно персистировать в эпителиальных клетках и лимфоглоточном кольце; легко передаются воздушно-капельным путем от больных и бессимптомных носителей со слизью из носоглотки и респираторного тракта. Микоплазмы малоустойчивы во внешних условиях: чувствительны к перепаду pH, нагреванию и высушиванию, ультразвуку и УФО, не растут на недостаточно влажных питательных средах.
Кроме микоплазменной пневмонии, микроорганизмы также могут стать причиной острого воспаления верхних дыхательных путей (фарингита), бронхиальной астмы, обострений хронического обструктивного бронхита и развития нераспираторной патологии (перикардита, отита, энцефалита, менингита, гемолитической анемии) у практически здоровых людей.
Отсутствие клеточной оболочки обеспечивает микоплазмам резистентность к β-лактамным антибиотикам – пенициллинам, цефалоспоринам. При микоплазменной инфекции отмечается развитие локального воспаления с выраженной иммуноморфологической реакцией, местным антителогенезом (всех классов иммуноглобулинов - IgM, IgA, IgG), активацией клеточного иммунитета. Симптомы микоплазменной пневмонии обусловлены преимущественно агрессивной ответной воспалительной реакцией макроорганизма (постинфекционной гиперсенситивностью, опосредованной Т-лимфоцитами).
Симптомы микоплазменной пневмонии
Инкубационный период при микоплазменной пневмонии может длиться 1-4 недели (обычно 12-14 дней). Начало заболевания, как правило, постепенное, но может быть подострым или острым. Выделяют респираторные, нереспираторные и генерализованные проявления микоплазменной пневмонии.
В начальном периоде возникает поражение верхних дыхательных путей, которое протекает в виде катарального назофарингита, ларингита, реже острого трахеобронхита. Отмечается заложенность носа, сухость в носоглотке, першение в горле, осиплость голоса. Ухудшается общее состояние, постепенно нарастает температура до субфебрильных значений, появляется слабость, потливость. В острых случаях симптомы интоксикации возникают в первые сутки заболевания, при постепенном развитии - только на 7-12 день.
Характерен продолжительный (не менее 10-15 дней) малопродуктивный пароксизмальный кашель. Во время приступа кашель очень сильный, изнурительный с выделением незначительного количества вязкой слизистой мокроты. Кашель может приобретать хронический характер, сохраняясь на протяжении 4-6 недель из-за обструкции дыхательных путей и гиперреактивности бронхов. Спектр проявлений микоплазменной пневмонии может включать признаки острой интерстициальной пневмонии.
Из внелегочной симптоматики для микоплазменной пневмонии наиболее характерны высыпания на коже и барабанных перепонках (по типу острого мирингита), миалгия, дискомфорт в ЖКТ, нарушение сна, умеренная головная боль, парестезии. Присоединение нереспираторных проявлений утяжеляет течение микоплазменной пневмонии.
Может возникать умеренный фибринозный или экссудативный плеврит, иногда - плевритическая боль. При наличии сопутствующей хронической обструкции микоплазменная пневмония способствует обострению обструктивного синдрома. Для детей младше 3-летнего возраста характерно малосимптомное течение.
В неосложненных случаях симптомы микоплазменной пневмонии в течение 7-10 дней постепенно исчезают, заболевание разрешается самостоятельно. Имеется риск перехода в смешанную (микоплазменно-бактериальную) форму пневмонии вследствие присоединения вторичной инфекции (обычно, пневмококка). Осложнениями микоплазменной пневмонии выступают синдром Стивенса-Джонсона, синдром Гийена-Барре, миелит, энцефалит, менингит.
Диагностика
При постановке диагноза микоплазменной пневмонии учитываются данные клинической картины, рентгенографии и КТ легких, серологического и ПЦР-исследований. Установление этиологии на первой неделе заболевания затруднено из-за первоначальной невыраженности физикальных проявлений. Рано отмечается гиперемия задней стенки глотки, гипертрофия миндалин, постепенно может появиться очаговое ослабленное везикулярное дыхание, крепитация, редкие средне- и мелкопузырчатые хрипы, укорочение перкуторного звука. Для микоплазменной пневмонии типично присутствие внелегочной симптоматики.
На рентгенограмме легких заметно двустороннее усиление легочного рисунка с типичными для пневмонии неоднородными, нечеткими очаговыми инфильтратами в нижних сегментах, в 50% случаев – интерстициальные изменения, перибронхиальная и периваскулярная инфильтрация. Обширная лобарная инфильтрация отмечается редко.
Лабораторные сдвиги – лейкоцитоз и подъем СОЭ в периферической крови при микоплазменной пневмонии менее выражены, чем у больных бактериальным воспалением легких. Микробиологическое исследование с выделением культуры M.pneumoniae из мокроты, ткани легких и плевральной жидкости практически не используется, так как требует продолжительных сроков инкубации и высокоселективных сред. При обычной микроскопии мокроты микоплазмы не выявляются.
Для этиологической верификации микоплазменной пневмонии и установления активной и персистирующей форм инфекции проводится комплекс анализов, включающих серотипирование (ИФА, РСК, РНИФ) и молекулярно-биологическое исследование (ПЦР). Показательно 4-кратное повышение титров IgA и IgG в парных сыворотках (в острую стадию и в период реконвалесценции). Для микоплазменной пневмонии свойственно заметное угнетение Т-клеточного и фагоцитарного звеньев иммунитета, гуморальные сдвиги (повышение количества В-лимфоцитов, уровней IgM и ЦИК).
ЭКГ-изменения могут возникать у больных при появлении миокардита и перикардита. Необходимо дифференцировать микоплазменную пневмонию от ОРВИ, бактериальной пневмонии, орнитоза, легионеллеза, туберкулеза легких.
Лечение микоплазменной пневмонии
При острой микоплазменной пневмонии с выраженным респираторным синдромом лечение проводится в стационарных условиях. На время лихорадки рекомендован постельный режим с обеспечением хорошей аэрации палаты; диета, употребление слегка подкисленной воды, клюквенного морса, компотов и соков, настоя плодов шиповника.
В качестве основной эрадикационной терапии при микоплазменной пневмонии назначаются макролиды (азитромицин), фторхинолоны (офлоксацин, ципрофлоксацин) и тетрациклины. Предпочтительность макролидов обусловлена безопасностью для новорожденных, детей и беременных. Целесообразно проведение ступенчатой антибиотикотерапии – сначала (2-3 дня) внутривенное введение, затем - пероральный прием того же препарата или другого макролида.
Для профилактики рецидива микоплазменной пневмонии курс антибиотиков должен длиться не менее 14 дней (обычно 2–3 недели). Также показаны бронходилататоры, отхаркивающие препараты, анальгетики и антипиретики, иммуномодуляторы. В период реконвалесценции используется немедикаментозная терапия: ЛФК, дыхательная гимнастика, физиопроцедуры, массаж, водолечение, аэротерапия, санаторно-курортное лечение в условиях сухого и теплого климата.
Диспансерное наблюдение у пульмонолога в течение 6 месяцев показано часто болеющим пациентам с хроническими заболеваниями бронхолегочной системы. Прогноз микоплазменной пневмонии обычно благоприятный, летальность может достигать 1,4%.
1. Особенности внебольничной пневмонии, вызванной Mycoplasma pneumoniae: обзор литературы и результаты собственных исследований/ Рачина С.А, Бобылев А.А., Козлов Р.С., Шаль Е.П., Яцышина C.Б., Шелякина О.Г.// Клиническая микробиология и антимикробная химиотерапия. – 2013 – Т.13, №1.
2. Клинико-иммунологическая характеристика микоплазменной пневмонии: Автореферат диссертации/ Меньщикова И.В. – 2007.
3. Пневмония с атипичной (микоплазменной и хламидийной) инфекцией. Особенности клиники, течения, исходы: Диссертация/ Полякова И.Г. – 2006.
Микоплазмоз и Уреаплазмоз – заболевания, преимущественно мочеполовой системы, вызываемые разными возбудителями, но имеющие сходную клиническую картину. У мужчин проявляются симптомами уретрита. У женщин вызывают симптомы парауретрита и вульвита, образование псевдоэрозии шейки матки. При отсутствии лечения воспаление быстро переходит в хроническую форму с периодическими обострениями. В воспалительный процесс могут вовлекаться внутренние половые органы, что постепенно приводит к развитию бесплодия. Возможно развитие микоплазменного цистита и пиелонефрита. Встречается микоплазменное поражение кожных покровов, внутренних органов и суставов.
Общие сведения
Уреаплазмоз и микоплазмоз – заболевания, возбудителями которых являются мельчайшие микроорганизмы семейства микоплазм - промежуточное звено между вирусами и бактериями (не имеют ДНК и клеточной оболочки). Паразитируют на мембранах других клеток, в частности на клетках эпителия слизистой мочеполового, дыхательного, кишечного трактов человека, могут прикрепляться к эритроцитам, сперматозоидам, макрофагам, фибробластам. Семейство Mycoplasmataceal включает: род Mycoplasma (~ 100 видов) и род Ureaplasma (2 вида). Большинство микоплазм не являются болезнетворными. В организме человека выделяют 14 сапрофитных (неболезнетворных) видов микоплазм, а инфекцию вызывают 4 вида - Ureaplasma urealyticum (уреаплазма), Mycoplasma hominis, Mycoplasma pneumoniae, Mycoplasma genitalium.
Уреаплазмы – особый род микоплазм, свое название получили из-за способности расщеплять мочевину. Могут приводить к воспалительному процессу в мочеполовой системе – уреаплазмозу. Не всегда наличие уреаплазм ведёт к развитию уреаплазмоза. Это происходит при определенных условиях, обычно совместно с другими болезнетворными микроорганизмами (гонококки, хламидии, трихомонады, гарднереллы, вирус герпеса) или при дисбактериозе (75-80% случаев). Это, так называемые, микст-инфекции - сообщества микроорганизмов, которые видоизменяют картину заболевания и помогают друг другу защититься от действия лекарственных средств.
Уреаплазмоз считают заболеванием, передающимся, главным образом, половым путем. Обычно уреаплазмоз протекает как хроническая инфекция. Активация бессимптомного течения уреаплазмоза возможна при ослаблении иммунитета (переохлаждение, стресс, операции, хронические болезни, беременность), когда создаются оптимальные условия для заселения урогенитального отдела уреаплазмами и их активного размножения. В свою очередь, уреаплазмы активно поглощая кислород, провоцируют усиленный рост анаэробных бактерий (гарднерелла, мобилинкус).
У мужчин риску развития уреаплазмоза подвержены мочевой пузырь, уретра, простата, яички; у женщин – влагалище, матка и придатки. При уреаплазмозе сперматозоиды могут утрачивать свою двигательную активность (ферменты уреаплазмы изменяют текучесть спермы, при контакте уреаплазмы и сперматозоида происходит растворение его мембраны).
Как воспалительный процесс, уреаплазмоз может служить причиной бесплодия, нарушения овуляции и сперматогенеза. Уреаплазмоз часто приводит к осложнениям, невынашиванию беременности, преждевременным родам. Возбудители уреаплазмоза могут провоцировать развитие острого воспаления в матке (эндометрита) после родов, хирургического прерывания беременности, кесарева сечения. Частота встречаемости уреаплазмоза у беременных женщин составляет 25-30%. Уреаплазмоз провоцирует воспаление суставов (ревматоидный артрит).
Уреаплазмоз диагностируется чаще всего у пациентов 14 – 29 лет. Обычно в этом возрасте наблюдается наибольшая сексуальная активность. Факторами риска развития уреаплазмоза являются раннее начало сексуальной жизни, беспорядочные половые контакты, перенесенные ранее венерические заболевания, гинекологические проблемы. Уреаплазмоз передаётся, в основном, половым путем или при тесном бытовом контакте (через бельё, средства личной гигиены). Внутриутробный путь заражения плода уреаплазмозом происходит через околоплодные воды больной матери или в родах. Инкубационный период уреаплазмоза при передаче инфекции – в среднем 2-3 недели.
Протекает уреаплазмоз в форме острой, хронической инфекции и носительства. Женщины чаще являются бессимптомными носителями уреаплазмоза, для некоторых уреаплазма является нормальной микрофлорой влагалища.
Симптомы уреаплазмоза
Проявления уреаплазмоза могут мало беспокоить больного, а часто не беспокоить совсем (при носительстве у женщин). Симптоматика уреаплазмоза сходна с проявлениями некоторых других урогенитальных инфекций.
У мужчин уреаплазмозом поражаются уретра и мочевой пузырь, яички с придатками, предстательная железа. При этом отмечаются следующие симптомы:
- жалобы на выделения из мочеиспускательного канала (обычно по утрам);
- болезненные ощущения при мочеиспускании (боль и жжение);
- некоторые проявления простатита;
- орхоэпидимит (воспаление яичка и его придатков).
Уреаплазмоз у мужчин наиболее часто проявляется негонококковым уретритом, склонным к длительному, вялотекущему течению (выделения из уретры могут самопроизвольно пропадать на некоторое время и снова появляться). Проявлениями уреаплазмоза у женщин служат:
- симптомы хронического кольпита, цервицита: наличие незначительных прозрачных или мутных выделений;
- частое мочеиспускание (иногда с болью, жжением);
- боль при половом акте;
- боли внизу живота - могут периодически усиливаться, уменьшаться, совсем исчезать.
В связи с часто бессимптомным течением, уреаплазмоз диагностируется поздно, способствуя развитию осложнений.
Предварительный диагноз уреаплазмоза нельзя поставить только на основании симптомов (они незначительны и мало беспокоят больного). Необходимым является проведение диагностических исследований.
Диагностика уреаплазмоза
Поставить диагноз исключительно по симптоматике и внешнему осмотру нельзя, так как не наблюдается клинической картины, специфической для данного заболевания – уреаплазмоза. В настоящее время под уреаплазмозом подразумевают воспалительный процесс урогенитальной системы, когда при обследовании выявлена уреаплазма уреалитикум и не обнаружен другой возбудитель.
Не смотря на то, что сегодня клиническая венерология обладает широким перечнем современных диагностических методов, диагностика уреаплазмоза остается затруднительной из-за сложности обнаружения уреаплазм в ассоциации присутствующих микроорганизмов. По результатам микроскопии можно только предположить наличие уреаплазм (число лейкоцитов в мазке может быть несколько повышено или в норме). Для выявления уреаплазм венерологи применяют различные диагностические методики:
- микробиологические;
- серологические;
- ПЦР-диагностика (наиболее информативна);
- метод генетических зондов;
- метод прямой иммунофлуоресценции (РИФ), иммуноферментный анализ (ИФА).
Обследование и лечение по поводу уреаплазмоза нужно пройти и половому партнеру, даже если у него нет никаких жалоб. Необходимость лечения при обнаружении уреаплазм может определить только врач.
Лечение уреаплазмоза
В процессе лечения уреаплазмоза очень важно восстановить нормальную микрофлору органов мочеполовой системы и ликвидировать микст-инфекцию (анаэробную флору и простейших). Особенность уреаплазм в том, что они нечувствительны к некоторым антибактериальным препаратам - пенициллинам, цефалоспоринам и т. д.
Большинство уреаплазм проявляют чувствительность к следующим антибиотикам:
- Тетрациклины: тетрациклин, доксициклин (при неосложненных формах уреаплазмоза – уретрит, цервицит, носительство при отсутствии симптомов).
- Макролиды: макропен, рокситромицин, кларитромицин, азитромицин, эритромицин обладают высокой эффективностью в отношении возбудителей уреаплазмоза.
- Линкозамиды: линкомицин, клиндамицин.
- Иммуномодуляторы (экстракт тимуса, лизоцим, левамизол, метилурацил). Применяют также пантокрин, экстракт элеутерококка, настойку аралии.
При лечении уреаплазмоза используют противопротозойные и противогрибковые препараты. Для восстановления нормальной микрофлоры необходим прием препаратов, содержащих бифидо - и лактобактерии. Важное значение имеет ведение беременности у больных уреаплазмозом женщин. Чтобы свести к минимуму риск заражения уреаплазмозом ребенка, обязательно проводят лечение женщины антибактериальными препаратами (после 22 недель).
Во время курса лечения уреаплазмоза обязательно соблюдение диеты, богатой молочнокислыми продуктами, витаминами, ограничение жирной, копченой, жареной пищи, острых приправ и кетчупов, запрет алкоголя. Во время лечения уреаплазмоза половая жизнь исключается. Очень полезно провести курс очищения кишечника сорбентами, затем курс витаминов группы В и С, прием гепатопротекторов (препаратов, улучшающих функции печени), желчегонных трав.
Лечение уреаплазмоза проводится только под контролем врача, всегда индивидуально и зависит от стадии процесса и пораженного органа. Курс длится примерно 2 недели. Уреаплазмоз считается излеченным, если в результатах лабораторных анализов после проведенного лечения (в течение 1-2 месяцев) уреаплазмы не обнаруживаются.
Лечение уреаплазмоза антибиотиками весьма эффективно, но нарушает баланс нормальной микрофлоры человека, поэтому можно рекомендовать противомикробный аппарат "Уро-Биофон", гомеопатические методы лечения уреаплазмоза.
Без лечения уреаплазмоз может возобновляться время от времени. Обострения могут быть связаны с простудой, стрессом, употреблением большого количества алкоголя и т. п. Хронический уреаплазмоз (как постоянно присутствующий воспалительный процесс) при отсутствии лечения может со временем вызывать стриктуру (патологическое сужение) уретры, провоцировать воспаление предстательной железы.
У женщин хронический уреаплазмоз без лечения при ослабленном иммунитете может вызвать воспаление, спайки в маточных трубах (угроза бесплодия, внематочной беременности). У беременных заражение уреаплазмозом может привести к патологии беременности, инфицированию плода. Прогноз при правильном и своевременном лечении уреаплазмоза – вполне благоприятный.
Что такое острые респираторные заболевания (ОРЗ)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Елена Бережная , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Острые респираторные заболевания (ОРЗ) — группа острых инфекционных заболеваний, при которых возбудители проникают в организм человека через дыхательные пути и вызывают синдром поражения респираторного тракта и общей инфекционной интоксикации. Употребление термина ОРВИ (острое респираторное вирусное заболевание) при отсутствии лабораторно подтверждённой этиологической расшифровки является некорректным.
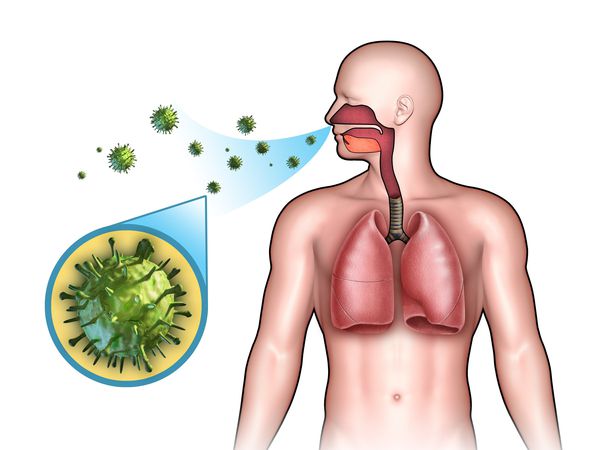
Этиология
ОРЗ — полиэтиологический комплекс заболеваний, т. е. они могут быть вызваны различными видами возбудителей:
- бактерии (стафилококки, стрептококки, пневмококки, гемофильная палочка, моракселла катаралис и др.);
- вирусы (риновирусы, аденовирусы, респираторно-синцитиальный вирус, реовирусы, коронавирусы, энтеровирусы, герпесвирусы, вирусы парагриппа и гриппа);
- хламидии (х ламидия пневмония , хламидия пситаки, хламидия трахоматис );
- микоплазмы (м икоплазма пневмония ).
Чаще всего возбудителем ОРЗ являются вирусы, поэтому термин ОРВИ используют небезосновательно. В последнее время иногда встречается употребление термина ОРИ (острая респираторная инфекция) [2] [4] .
Эпидемиология
ОРЗ — это преимущественно антропонозы, т. е. болезни, способные поражать только человека . Являются самой многочисленной и частой группой заболеваний у человека (до 80 % всех болезней у детей). Поэтому они представляют серьёзную проблему для здравоохранения различных стран вследствие наносимого ими экономического ущерба.
Источник инфекции — больной человек с выраженными или стёртыми формами заболевания. Восприимчивость всеобщая, иммунитет к некоторым возбудителям (аденовирусы, риновирусы) стойкий, но строго типоспецифичный. Это значит, что заболеть ОРЗ, вызванным одним видом возбудителя, но разными серотипами (их могут быть сотни), можно многократно. Заболеваемость повышается в осенне-зимний период, может принимать вид эпидемических вспышек, довлеет к странам с прохладным климатом. Чаще болеют дети и лица из организованных коллективов (особенно в период адаптации).
Основной механизм передачи — воздушно-капельный (аэрозольный, в меньшей степени воздушно-пылевой путь), но может также играть роль контактно-бытовой механизм (контактный — при поцелуях, бытовой — через загрязнённые руки, предметы или воду) [2] [7] .
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы острых респираторных заболеваний (ОРЗ)
Инкубационный период различен и зависит от вида возбудителя, может варьироваться от нескольких часов до 14 дней (аденовирус).
Для каждого возбудителя ОРЗ имеются свои специфические особенности протекания заболевания, однако все их объединяет наличие синдромов общей инфекционной интоксикации (СОИИ) и поражения дыхательных путей в той или иной степени. СОИИ проявляется общей слабостью, адинамией, быстрой утомляемостью, повышенной температурой тела, потливостью и др.
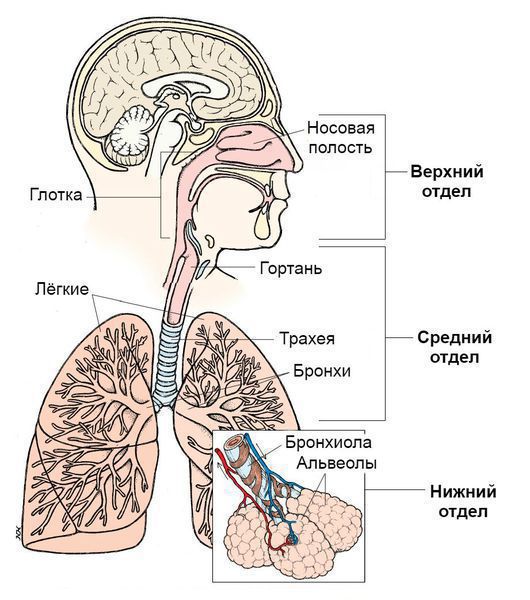
Синдром поражения респираторного тракта (СПРТ) — основной синдром для данных заболеваний, он включает:
- Ринит — воспаление слизистой оболочки носа. Характеризуется заложенностью носа, снижением обоняния, чиханием, выделениями из носа — сначала прозрачными слизистыми, затем слизисто-гнойными (более плотные выделения жёлто-зелёного цвета появляются в результате присоединения вторичной бактериальной флоры). — воспаление слизистой оболочки глотки. Основные симптомы: першение и боли в горле различной интенсивности, сухой кашель — "горловой".
- Ларингит — воспаление слизистых оболочек гортани. Проявляется осиплостью голоса, иногда афонией (отсутствием голоса), кашлем и болью в горле.
- Трахеит — воспаление трахеи. Сопровождается мучительным, преимущественно сухим кашлем, саднением и болями за грудиной.
- Бронхит — воспаление слизистой оболочки бронхов. При этом возникает кашель с наличием мокроты и без, сухие хрипы, редко крупнопузырчатые хрипы при аускультации (выслушивании).
- Бронхиолит — воспаление бронхиол (мелких бронхов). Характеризуется наличием кашля различной интенсивности и хрипов разных калибров.
Дополнительными синдромами могут быть:
- синдром экзантемы (высыпания на кожных покровах);
- тонзиллита (воспаления миндалин);
- лимфаденопатии (ЛАП) — увеличения лимфатических узлов ; ( воспаления слизистой оболочки глаза) ;
- гепатолиенальный синдром (увеличение печени и селезёнки);
- геморрагический синдром ( повышенная кровоточивость) ;
- синдром энтерита (воспаления слизистой оболочки тонкого кишечника) .
Алгоритм по распознаванию ОРЗ различной этиологии:
Наиболее распространенным заболеванием, имеющим тяжёлое течение и высокий риск развития осложнений является грипп. Инкубационный период гриппа длится от нескольких часов до 2-3 дней. В отличие от других острых респираторных заболеваний, при гриппе сначала появляется синдром общей инфекционной интоксикации (высокая температура, озноб, сильная головная боль, слезотечение, боль при движении глазных яблок, ломота в мышцах и суставах). На 2-3-день присоединяются симптомы поражения респираторного тракта: першение в горле, насморк, сухой надсадный кашель.
Типичное ОРЗ начинается с чувства дискомфорта, першения в носу и горле, чихания. В течение непродолжительного периода симптоматика нарастает, першение усиливается, появляется чувство интоксикации, повышается температура тела (обычно не выше 38,5 ℃), появляется насморк, неярко-выраженный сухой кашель. В зависимости от вида возбудителя и свойств микроорганизма могут последовательно появляться все перечисленные синдромы ОРЗ в различных сочетаниях и степени выраженности. Возможно появление осложнений и неотложных состояний [6] [7] .
Патогенез острых респираторных заболеваний (ОРЗ)
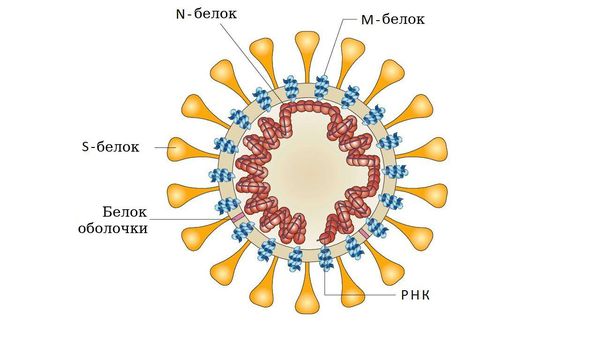
- у аденовирусов — гликопротеином (фибриллы);
- у парамиксо- или ортомиксовирусов шипами гемагглютинина;
- у коронавирусов — S-белком соединения и гликолипидами.
Взаимодействие болезнетворного агента с клеточными рецепторами необходимо не только для прикрепления его к клетке, но и для запуска клеточных процессов, подготавливающих клетку к дальнейшей инвазии. Т. е. наличие соответствующих рецепторов на поверхности клеток — это один из важнейших факторов, определяющих возможность или невозможность возникновения инфекционного процесса. Внедрение возбудителя в клетку хозяина вызывает поток сигналов, активирующих целый ряд процессов, с помощью которых организм пытается от него освободиться, например, ранний защитный воспалительный ответ, а также клеточный и гуморальный иммунный ответ. Повышение метаболизма клеток представляет собой защитный процесс, но с другой стороны в результате накопления свободных радикалов и факторов воспаления запускается патологический процесс:
- нарушается липидный слой клеточных мембран эпителия верхних отделов респираторного тракта и лёгких;
- нарушаются матричные и барьерные свойства внутриклеточных мембран, увеличивается их проницаемость;
- развивается дезорганизация жизнедеятельности клетки вплоть до её гибели.
Второй этап инфицирования характеризуется вирусемией — попаданием вируса в кровь и распространением по всему организму. В совокупности с повышением деятельности защитных механизмов и появлением в крови продуктов распада клеток этот процесс вызывает интоксикационный синдром.
Третий этап характеризуется усилением выраженности реакций иммунной защиты, элиминацию (выведение) микроорганизма и восстановление строения и функции поражённой ткани хозяина [5] [7] .
Классификация и стадии развития острых респираторных заболеваний (ОРЗ)
По вовлечению отдельных частей дыхательной системы:
- Инфекции верхних дыхательных путей. Верхние дыхательные пути начинаются с носа и включают голосовые связки в гортани, придаточные пазухи носа и среднее ухо.
- Инфекции нижних дыхательных путей. Нижние дыхательные пути начинаются с трахеи и бронхов и заканчиваются бронхиолами и альвеолами.
По клинической форме:
- Типичная.
- Атипичная:
- акатаральная (отсутствие признаков поражения дыхательных путей при наличии симптомов общей инфекционной интоксикации);
- стёртая (маловыраженная клиника);
- бессимптомная (полное отсутствие клинической симптоматики).
По течению:
По степени тяжести:
По длительности течения:
- острое (5-10 дней);
- подострое (11-30 дней);
- затяжное (более 30 дней) [8] .
Осложнения острых респираторных заболеваний (ОРЗ)
Если острое респираторное заболевание не пролечить вовремя, могут появиться различные более серьёзные заболевания:
- Связанные с ЛОР-органами: отит, синуситы, бактериальный ринит, ложный круп.
- Связанные с лёгочной тканью: вирусные пневмонии, вирусно-бактериальные и бактериальные пневмонии, абсцесс лёгкого ( ограниченный очаг гнойного воспаления в лёгочной ткани) , эмпиема плевры ( скопление гноя в плевральной полости) . Пневмония проявляется значимым ухудшением общего состояния, выраженным кашлем, усиливающимся на вдохе, при аускультации звуком крепитации ( потрескиванием или похрустыванием) , влажными мелкопузырчатыми хрипами, иногда одышкой и болями в грудной клетке.

- Связанные с поражением нервной системы: судорожный синдром, неврит ( воспаление нерва) , менингит ( воспаление оболочек головного и спинного мозга) , менингоэнцефалит (воспаление оболочек и вещества головного мозга), синдром Гийена—Барре и др. [10]
- Связанные с поражением сердца: миокардит (воспаление сердечной мышцы).
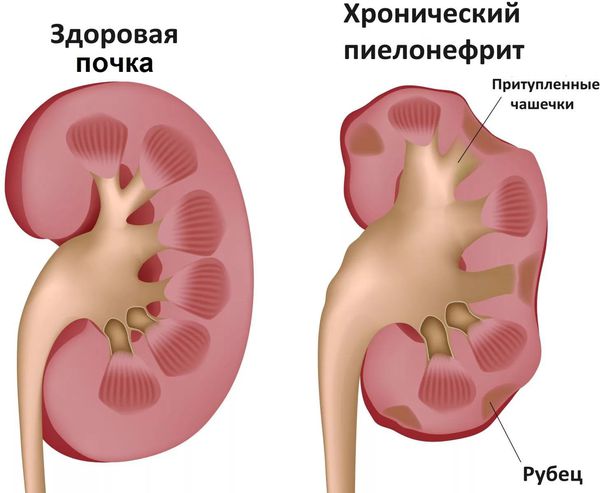
- Связанные с обострением хронических заболеваний: обострение ревматизма, тонзиллита, туберкулёза, пиелонефрита (воспаление почки) и др. [7]
Диагностика острых респираторных заболеваний (ОРЗ)
В широкой рутинной практике лабораторная диагностика ОРЗ (особенно при типичном неосложнённом течении) обычно не проводится. В отдельных случаях могут использоваться:
- Развёрнутый клинический анализ крови. При этом может обнаружиться лейкопения ( снижение количества лейкоцитов) и нормоцитоз ( нормальный размер эритроцитов) , лимфо- и моноцитоз ( увеличение числа лимфоцитов и моноцитов) , при наслоении бактериальных осложнений — нейрофильный лейкоцитоз со сдвигом влево (увеличение количество нейтрофилов и появление их незрелых форм );
- Общеклинический анализ мочи (изменения малоинформативны, указывают на степень интоксикации).
- Биохимические анализы крови. Может выявляться С-реактивный белок (указывает на наличие инфекции). При некоторых системных возбудителях, например аденовирусной инфекции, характерно повышение АЛТ.
- Серологические реакции. Возможна ретроспективная диагностика методами РСК, РА, ИФА, однако она редко используется в практической деятельности. В настоящее время широко применяется ПЦР-диагностика мазков-отпечатков, но её применение ограничено в основном стационарами и научно-исследовательскими группами.
При подозрении на развитие осложнений проводят соответствующие лабораторные и инструментальные исследования (рентген придаточных пазух носа, органов грудной клетки, КТ и др.) [3] [5] .
Лечение острых респираторных заболеваний (ОРЗ)
ОРЗ встречается очень часто и в большинстве случаев протекает в лёгкой и средней степени тяжести, поэтому обычно больные проходят лечение дома. При тяжёлых формах (с риском развития или развившимися осложнениями) пациенты должны проходить терапию в условиях инфекционного стационара до нормализации процесса и появления тенденций к выздоровлению. В домашних условиях лечением ОРЗ занимается терапевт или педиатр (в некоторых случаях инфекционист).
Пища должна быть разнообразной, механически и химически щадящей, богатой витаминами, рекомендуются мясные нежирные бульоны (идеально подходит негустой куриный бульон и т. п.), обильное питьё до — 3 л/сут. (тёплая кипячёная вода, чай, морсы). Хороший эффект оказывает тёплое молоко с мёдом, чай с малиной, отвар брусничных листьев.
Медикаментозная терапия ОРЗ включает в себя этиотропную (т. е. воздействующую на возбудителя заболевания), патогенетическую (дезинтоксикация) и симптоматическую (уменьшение беспокоящих симптомов) терапию.
Этиотропная терапия имеет смысл лишь при назначении в раннем периоде и лишь при ограниченном спектре возбудителей (в основном при гриппе). Использование средств отечественной фарминдустрии ("Арбидол", "Кагоцел", "Изопринозин", "Амиксин", "Полиоксидоний" и т. п.) не обладают никакой доказанной эффективностью и могут иметь эффекта, лишь в качестве плацебо.
В качестве симптоматической терапии могут быть использованы препараты следующих групп:
- жаропонижающие при температуре у взрослых свыше 39,5, у детей — свыше 38,5 ℃ (парацетамол, ибупрофен);
- противовирусные и антибактериальные глазные капли при конъюнктивите;
- сосудосуживающие капли в нос при заложенности носа и насморке (не более 5 дней);
- солесодержащие капли в нос при рините для разжижения слизи;
- противоаллергические препараты при аллергическом компоненте ОРЗ;
- средства противовоспалительного и противомикробного действия местного действия (таблетки, пастилки и др.);
- средства для улучшения образования, разжижения и выделения мокроты (муколитики);
- антибиотики широкого спектра действия (при отсутствии улучшения в течении 4-5 дней, присоединении вторичной бактериальной флоры и развитии осложнений) [2][6] .
Прогноз. Профилактика
Прогноз при ОРЗ — положительный. Больные обычно выздоравливают в течение 5-10 дней без неблагоприятных последствий. Осложнения респираторных заболеваний могут возникнуть при гриппе, другие возбудители менее агрессивны. Также неблагоприятные последствия возможны у пациентов с ослабленным иммунитетом. После выздоровления организмом вырабатывается иммунитет к той инфекции, которой человек переболел .
Ведущую роль в профилактике распространения ОРЗ (исключая грипп) является:
Читайте также:

