Лечение ротавирусной инфекции бактериофагом
Обновлено: 25.04.2024
Представлены современные данные об этиологии острых кишечных инфекций, патогенетических механизмах инфекционной диареи, подходах к лечению. Обсуждаются вопросы пробиотической терапии, обосновывается антимикробное, антитоксическое, ферментативное действие
Modern data on etiology of acute intestinal infections, pathogenic mechanisms of infectious diarrhea, approaches to treatment are presented. Questions of probiotic therapy in acute intestinal infections are discussed. Antimicrobial, anti-toxic, enzymatic effects of concentrate of metabolism products of еру saccharolytic and proteolytic representatives of the indigenous microflora, are based. The proofs of efficiency of therapy of infectious diarrhea of different etiology including in children are represented.
Острые кишечные инфекции (ОКИ) являются распространенными заболеваниями во всем мире и в разных возрастных группах. В развитых странах у каждого человека наблюдается в среднем, как минимум, один эпизод острой диареи в течение года. Среди детей заболеваемость выше и болезнь течет манифестнее. Во всем мире ежегодно регистрируется примерно 1,5 млрд случаев и 1,5–2,5 млн летальных исходов от ОКИ, преимущественно среди детей до 5 лет и в развивающихся странах [1]. Высокая заболеваемость, повсеместная распространенность и тяжесть в группах риска определяют актуальность проблемы ОКИ, кроме того, перенесенная ОКИ является одним из факторов формирования хронической патологии желудочно-кишечного тракта (ЖКТ), в том числе синдрома раздраженного кишечника, снижения иммунологической резистентности.
Этиология ОКИ
Неполным остается понимание причины ОКИ. В лучших лабораториях мира расшифровать их этиологию удается только в 67–85% случаев [2]. Важная этиологическая роль бактерий и простейших в развитии ОКИ была установлена много лет назад, а кампилобактерий и криптоспоридий была пересмотрена недавно. Основными возбудителями ОКИ бактериальной природы являются микроорганизмы семейства Enterobacteriaceae. Известна роль около 50 сероваров рода Salmonella в развитии патологии у людей, преимущественно сальмонелл группы В. Наибольшее распространение в последние годы получила S. enteritidis. Шигеллезы, или дизентерию, вызывают бактерии рода Shigella, включающего более 40 серологических вариантов с наибольшим распространением шигелл Флекснера и Зонне. В последние годы отмечается рост удельного веса дизентерии, вызванной Shigella Flexneri 2a, для которой характерен выраженный деструктивный компонент при воспалении толстой кишки. Характерным свойством шигелл стала высокая полирезистентность к основным, наиболее употребляемым антибактериальным средствам. Из других бактериальных агентов существенное значение как возбудители ОКИ имеют иерсинии (Iersinia enterocolitica, из известных 30 сероваров которой в патологии человека основное значение имеют О3, 4, 5, 8), вибрионы холеры и НАГ-вибрионы, а также патогенные эшерихии. Известны 5 групп патогенных бактерий рода Escherichia как возбудителей эшерихиозов: 1) энтеропатогенные кишечные палочки (ЭПКП) являются возбудителями колиэнтерита у детей; 2) энтероинвазивные кишечные палочки (ЭИКП) обусловливают дизентериеподобные заболевания детей и взрослых. Наибольшее значение имеют штаммы О124 и О151; 3) энтеротоксигенные кишечные палочки (ЭТКП) вызывают холероподобные заболевания у детей и взрослых, к их числу относят следующие серогруппы О6, О8, О15, О20, О25, О27, О63, О78, О115, О148, О159 и др.; 4) энтерогеморрагические кишечные палочки (ЭГКП) являются возбудителями дизентериеподобных заболеваний как у детей, так и у взрослых. К ним относятся штаммы О157: Н7, О141, продуцирующие шигаподобный токсин (SLT-Shigalike-toxin); 5) энтероаггрегативные кишечные палочки (ЭАгКП) обусловливают длительно протекающие диареи у детей и взрослых, что связано с прочной адгезией бактерий на поверхности эпителия слизистой оболочки тонкой кишки.
Важную роль в развитии ОКИ у детей играет условно-патогенная микрофлора, основные представители которой являются в обычных условиях безобидным компонентом микробиоты здорового ребенка. Заболевания, обусловленные условно-патогенными бактериями, чаще являются результатом активации собственной эндогенной флоры в результате несостоятельности иммунитета, что объясняет связанное с этим нередко тяжелое течение болезни и проблемы в лечении. В числе наиболее актуальных условно-патогенных возбудителей — бактерии рода Citrobacter, Staphylococcus aureus, Klebsiella, Hafnia, Serratia, Proteus, Margonella, Providensia, Bacillus cereus, Clostridium perfringence и др. Clostridium difficile обусловливают возникновение псевдомембранозного колита у детей, получавших интенсивную антибактериальную терапию [2, 3].
Из числа возбудителей госпитальных инфекций, определяющих наиболее тяжелые проявления болезни и особо устойчивых к терапии, актуальны такие грамположительные бактерии, как Enterococcus faecalis, Enterococcus faecium, из числа грамотрицательных бактерий — Proteus mirabilis, Enterobacter spp., E. coli, Pseudomonas aerugenosa и др. Формирование новых факторов патогенности и резистентности возбудителей бактериальных кишечных инфекций к препаратам может быть обусловлено приобретением новой генетической информации (через мобильные генетические структуры — плазмиды, фаги) или изменением уровня экспрессии собственных генов [4].
Из числа протозойных ОКИ наиболее актуальными являются лямблиоз, амебиаз, изоспороз, криптоспоридиоз, балантидиаз, часто имеющие характер оппортунистических инфекций, возникающих на фоне любой патологии, связанной с разного рода иммунной недостаточностью [9].
Патогенетические механизмы инфекционной диареи
Диарея инвазивного (экссудативного) типа развивается при шигеллезе, сальмонеллезе, эшерихиозе, вызванном энтероинвазивной кишечной палочкой (штаммы О124 и О15), кишечном иерсиниозе, кампилобактериозе, клостридиозе. Инвазия шигелл и энтероинвазивных эшерихий отмечается преимущественно в подвздошной и толстой кишке. Сальмонеллы, кампилобактерии и кишечные иерсинии, проникая в слизистую оболочку главным образом подвздошной кишки, не оказывают выраженного деструктивного действия на эпителий, а вызывают воспаление собственного слоя слизистой оболочки и лимфоидной ткани кишечника.
Секреторные (неинвазивные) ОКИ вызываются возбудителями, способными прикрепляться к поверхности эпителиальных клеток слизистой оболочки кишечника и образовывать экзотоксины, среди которых различают энтеротоксины (холероген), проникающие через рецепторные зоны в энтероциты и вызывающие активацию в них аденилатциклазной системы с последующим накоплением циклических нуклеотидов (цАМФ, цГМФ), а также цитотоксины. Секреторная диарея может развиваться при холере, холероподобных заболеваниях, сальмонеллезах, эшерихиозах, возбудителями которых являются энтеротоксигенные эшерихии (О6, О8, О15, О20, О25, О27, О63, О78, О115, О148, О159 и др.), шигеллезах, ОКИ, вызываемых условно-патогенными бактериями (протей, клебсиелла и др.), пищевых токсикоинфекциях.
Однако энтерогеморрагические эшерихии О157: Н7 и другие эшерихии, продуцирующие шига-подобный токсин, C. difficile, C. perfringens типа С, а также представители условно-патогенных бактерий при размножении на слизистой оболочке кишечника, как и шигеллы, вырабатывают цитотоксины, которые у некоторых больных вызывают ее тяжелые морфологические повреждения, сопровождающиеся интоксикацией и лихорадкой.
Осмолярный тип диареи встречается при вирусных гастроэнтеритах и некоторых паразитозах (лямблиоз, криптоспоридиоз) вследствие снижения выработки пищеварительных ферментов (функциональная ферментопатия), образования в кишечнике осмолярно активных веществ, удерживающих жидкость в его просвете, нарушения всасывания воды и электролитов.
Смешанный тип диареи имеет место, как правило, при микст-инфекциях (бактериальной или вирусно-бактериальной), Эта классификация ВОЗ диарейных заболеваний имеет важное значение на начальном этапе ведения больного ОКИ, до получения результатов лабораторных исследований, для построения рациональной этиопатогенетически обоснованной терапии.
Место пробиотиков в терапии острых кишечных инфекций
Необходимость в применении антимикробных препаратов признается большинством авторов лишь при развитии инвазивной диареи, а также при холере [4]. В остальных случаях рекомендуется проведение патогенетической терапии, основными направлениями которой, наряду с диетотерапией, являются применение энтеросорбентов, оральная или парентеральная регидратация и использование препаратов для коррекции микрофлоры желудочно-кишечного тракта.
Все большее число научных данных подтверждает исключительно важную роль нормальной микрофлоры кишечника в поддержании здоровья человека, в том числе в защите организма от патогенов [11]. При известном количественном содержании и соотношении основных ее представителей (бифидо- и лактобактерий, кишечной палочки, бактероидов, энтерококков и др.) обеспечивается ее ингибирующее действие на патогенные и условно-патогенные микроорганизмы посредством конкуренции с ними за рецепторы адгезии и питательные вещества, продукции бактериоцинов (активных метаболитов, обладающих антибиотикоподобным действием), органических кислот, снижающих рН толстой кишки. Защитная роль нормальной микрофлоры определяется и ее иммуномодулирующим действием за счет стимуляции лимфоидного аппарата кишечника, коррекции синтеза иммуноглобулинов, уровней пропердина, комплемента и лизоцима, снижением проницаемости сосудистых тканевых барьеров для токсических продуктов микроорганизмов. Нормальная микрофлора участвует в процессах переваривания пищи, синтезе витаминов, незаменимых аминокислот, метаболизме желчных кислот, холестерина, в обезвреживании эндо- и экзотоксинов бактерий [12].
Известно, что при ОКИ практически у всех больных отмечается дисбаланс биоценоза ЖКТ разной степени выраженности. Это ставит вопрос о целесообразности применения препаратов, называемых пробиотиками, в лечении больных с ОКИ как способа коррекции системы защиты организма, поддержания кишечного микробиоценоза, непосредственного и опосредованного действия на возбудителя заболевания [13]. К числу пробиотиков относятся различные препараты, содержащие как живые микроорганизмы, так и их структурные компоненты и метаболиты, стимуляторы роста кишечной микрофлоры.
Исследованиями последних десятилетий было показано, что специфические пробиотики эффективны в лечении и предотвращении острого вирусного гастроэнтерита, антибиотико-ассоциированной диареи и других воспалительных заболеваний кишечника [13]. Однако подчеркивается, что пробиотики могут быть полезны, если они используются в соответствии с научными знаниями, основанными на результатах правильно проведенных клинических испытаний. Их эффективность зависит от специфического вида и определенной дозы пробиотического микроорганизма, что не может быть экстраполировано на другие, даже родственные виды микроорганизмов. Принципиально новой группой препаратов являются пробиотики метаболитного типа, или метабиотики. Сами метабиотики, будучи компонентами пробиотических микроорганизмов (метаболиты, сигнальные молекулы известной структуры и т. д.), при их использовании представляют собой типичную заместительную терапию. Лечение пробиотиками метаболитного типа является физиологичным, так как способно оптимизировать экологические условия кишечника для развития собственной микрофлоры. Поскольку активность микробиоты во многом определяет здоровье или болезнь человека, регуляция симбионтных отношений макроорганизма и его микрофлоры является актуальной проблемой медицины и биологии [14, 15].
Одним из первых метаболитных препаратов-пробиотиков, влияющих на обмен веществ через воздействие на колонизационную резистентность ЖКТ, является Хилак форте. Препарат представляет собой водный субстрат продуктов обмена сахаролитических (L. acidophilus, L. helveticus и E. faecalis) и протеолитических (E. coli) представителей индигенной микрофлоры, содержащей короткоцепочечные жирные кислоты. Дополнительно в состав препарата входят биосинтетическая молочная, фосфорная и лимонная кислоты, сорбит калия, сбалансированный комплекс буферных солей (фосфорнокислый натрий и калий), лактоза и ряд аминокислот. Позитивное действие Хилак форте определяется комплексом входящих в его состав бактерийных метаболитов, характеризующихся рядом индивидуальных регуляторных эффектов, что позволяет использовать его как профилактическое и терапевтическое средство при заболеваниях кишечника [16].
В исследовании Л. Н. Мазанковой и соавт. с использованием простого, контролируемого дизайна со сравнительной оценкой эффективности Хилак форте и Бифидумбактерина в лечении детей, больных ОКИ вирусной этиологии с осмотическим механизмом диареи, отмечено преимущество включения в комплекс средств терапии Хилак форте. Оно заключалось в достоверном сокращении продолжительности интоксикации, диарейного синдрома, рвоты, в отличие от группы сравнения, получавшей Бифидумбактерин [20]. С использованием метода газожидкостной хроматографии было установлено, что 7-дневный курс терапии Хилак форте способствовал улучшению метаболической активности индигенной флоры с тенденцией к нормализации уровня летучих жирных кислот и их соотношений без существенных изменений в структуре индигенной флоры [21, 22]. Авторы указывают, что терапия ОКИ пробиотиком метаболитного типа физиологична, поскольку регулирует симбионтные отношения хозяина и его микрофлоры и не имеет побочных эффектов, что важно в педиатрии.
В работе Н. М. Грачевой и соавт. у 60 больных ОКИ и хроническими заболеваниями желудочно-кишечного тракта с признаками дисбактериоза установлена сходная клиническая эффективность Хилак форте. В группе сравнения, состоящей из больных с аналогичными болезнями, исследовалась эффективность комбинации Бифидумбактерина и Лактобактерина. После лечения нормализация биоценоза кишечника отмечена у 43% реконвалесцентов, получавших Хилак форте, и только у 14% из группы сравнения. Проведенное бактериологическое исследование позволило установить, что основные условно-патогенные микроорганизмы (гемолизирующие штаммы эшерихий, протей, Staphylococcus spp., грибы рода Candida) оказались чувствительны к Хилак форте. Высокая терапевтическая эффективность препарата Хилак форте выражалась и в укорочении сроков репарации слизистой оболочки толстой кишки, при этом он ускорял процессы обновлений эпителиальных клеток, а также снижал степень выраженности воспаления [23].
В последнее время отмечается расширение спектра патогенных микроорганизмов, связанных с развитием ОКИ. В частности, очевидную тенденцию к росту имеют протозойные инвазии, среди которых важное место занимает криптоспоридиоз. Н. М. Грачева и соавт. провели исследование эффективности пробиотика Хилак форте, действия на процессы репарации слизистой оболочки желудочно-кишечного тракта и эрадикацию криптоспоридий, а также коррекцию нарушений кишечной микрофлоры у 323 взрослых больных ОКИ, в том числе 100 с криптоспоридиозом. После проведенной терапии Хилак форте во всех случаях отмечено исчезновение криптоспоридий из фекалий на фоне общей коррекции дисбиотических нарушений в кишечнике. Одновременно у всех больных с клиническими проявлениями криптоспоридиоза быстро наступало улучшение общего состояния и обратное развитие основных клинических симптомов болезни. Так, средние сроки исчезновения (в днях) составили соответственно для интоксикации 3,1 ± 0,14, для диспепсических явлений 4,2 ± 0,27, для нормализации стула 4,1 ± 0,35. Результаты клинико-морфологического анализа показали, что в слизистой оболочке толстой кишки у всех больных до лечения Хилак форте обнаруживался катаральный колит с выраженной активностью патологического процесса и умеренной атрофией кишечных желез. Назначение комплексной терапии с включением Хилак форте приводило к устранению атрофических процессов в слизистой оболочке толстой кишки, исчезновению дистрофических изменений эпителиального пласта и восстановлению его функциональной способности, а также снижению степени активности патологического процесса в ней и санации пристеночной микробиоты от криптоспоридий [24].
Поскольку Хилак форте действует лишь в просвете кишечника, он обладает высоким профилем безопасности для приема даже новорожденными, не обладает токсическим эффектами и прекрасно переносится.
Хилак форте принимают внутрь до приема пищи в небольшом количестве жидкости (исключая молоко).
Препарат назначают 3 раза в сутки:
- взрослым: по 40–60 капель на прием;
- детям старше года: по 20–40 капель на прием;
- детям грудного возраста: по 15–20 капель на прием.
После улучшения состояния суточная доза может быть уменьшена наполовину. Препарат выпускается во флаконах по 30 и 100 мл и с осени 2016 года в индивидуальных саше по 1,1 и 2,2 мл.
Литература
Е. И. Краснова 1 , доктор медицинских наук, профессор
Н. И. Хохлова, кандидат медицинских наук
В. В. Проворова, кандидат медицинских наук
В. Г. Кузнецова, доктор медицинских наук

Наименование лекарственного средства: Пиобактериофаг комплексный.
Группировочное наименование: Пиобактериофаг.
Лекарственная форма
раствор для приёма внутрь, местного и наружного применения.
Форма выпуска
Раствор для приема внутрь, местного и наружного применения во флаконах по 20 или 100 мл. 8 флаконов по 20 мл или 1 флакон по 100 мл в пачке из картона с инструкцией по применению.
Состав
Описание
Прозрачная жидкость желтого цвета различной интенсивности, возможен зеленоватый оттенок.
Фармакологическая группа лекарственного препарата
Фармокологические свойства
Препарат вызывает специфический лизис бактерий Staphylococcus, Enterococcus, Streptococcus, энтеропатогенных Escherichia coli, Proteus vulgaris, Proteus mirabilis, Pseudomonas aeruginosa, Klebsiella pneumoniae, Klebsiella oxytoca.
Показания для применения
Лечение и профилактика гнойно-воспалительных и кишечных заболеваний, вызванных стафилококками, энтерококками, стрептококками, синегнойной палочкой, клеб- сиеллами, патогенной кишечной палочкой различных серогрупп, протеем при внутреннем, ректальном и наружном применении.
- заболевания уха, горла, носа, дыхательных путей и легких - воспаления пазух носа, среднего уха, ангина, фарингит, ларингит, трахеит, бронхит, пневмония, плеврит;
- хирургические инфекции - нагноения ран, ожоги, абсцесс, флегмона, фурункулы, карбункулы, гидроаденит, панариции, парапроктит, мастит, бурсит, остеомиелит;
- урогенитальные инфекции - уретрит, цистит, пиелонефрит, кольпит, эндометрит, сальпингоофорит;
- посттравматические конъюнктивиты, кератоконъюнктивиты, гнойные язвы роговицы и иридоциклиты;
- энтеральные инфекции - гастроэнтероколит, холецистит, дисбактериоз;
- генерализованные септические заболевания;
- гнойно-воспалительные заболевания новорожденных - омфалит, пиодермия, конъюнктивит, гастроэнтероколит, сепсис и др.;
- другие заболевания, вызванные бактериями стафилококков, стрептококков, энтерококков, протея, клебсиелл пневмонии и окситока, синегнойной и кишечной палочек.
С профилактической целью препарат используют для обработки операционных и свежеинфицированных ран, а также для профилактики внутрибольничных инфекций по эпидемическим показаниям.
Противопоказания
Гиперчувствительность к компонентам препарата.
Режим дозирования и способ введения.
Лечение гнойно-воспалительных заболеваний с локализованными поражениями должно проводиться одновременно как местно, так и через рот, 7-20 дней (по клиническим показаниям).
В зависимости от характера очага инфекции бактериофаг применяют:
- Местно в виде орошения, примочек и тампонирования жидким фагом в количестве до 200 мл в зависимости от размеров пораженного участка. При абсцессах бактериофаг вводят в полость очага после удаления гноя с помощью пункции. Количество вводимого препарата должно быть несколько меньше объема удаленного гноя. При остеомиелите после соответствующей хирургической обработки в рану вливают бактериофаг по 10-20 мл.
- Введение в полости - плевральную, суставную и другие ограниченные полости до 100 мл бактериофага, после чего оставляют капиллярный дренаж, через который в течение нескольких дней повторно вводят бактериофаг.
- При циститах, пиелонефритах, уретритах препарат принимают внутрь. В случае, если полость мочевого пузыря или почечной лоханки дренированы, бактериофаг вводят через цистостому или нефростому 1-2 раза в день по 20-50 мл в мочевой пузырь и по 5-7 мл в почечную лоханку.
- При гнойно-воспалительных гинекологических заболеваниях препарат вводят в полость вагины, матки в дозе 5-10 мл ежедневно однократно.
- При гнойно-воспалительных заболеваниях уха, горла, носа препарат вводят в дозе 2-10 мл 1-3 раза в день. Бактериофаг используют для полоскания, промывания, закапывания, введение смоченных турунд (оставляя их на 1 час).
- При конъюнктивитах и кератоконъюнктивитах препарат закапывают по 2-3 капли 4-5 раз в день, при гнойной язве роговицы - по 4-5 капель, при гнойных иридо- циклитах препарат применяют по 6-8 капель каждые 3 часа в сочетании с приемом внутрь.
- При лечении стоматитов и хронических генерализованных пародонтитов препарат используют в виде полосканий полости рта 3-4 раза в день в дозе 10-20 мл, а также введением в пародонтальные карманы турунд, пропитанных пиобактериофагом, на 5-10 минут.
- При кишечных формах заболевания, заболеваниях внутренних органов, дисбактериозе бактериофаг применяют через рот и в клизме. Через рот бактериофаг дают 3 раза в сутки натощак за 1 час до еды. В виде клизм назначают 1 раз в день вместо одного приема через рот.
Рекомендуемые дозировки препарата
Доза на 1 приём (мл)
при различных способах введения препарата
Применение бактериофагов не исключает использования других антибактериальных препаратов. В случае, если до применения бактериофага для лечения ран применялись химические антисептики, рана должна быть тщательно промыта стерильным 0,9 % раствором натрия хлорида.
Применение бактериофага у детей (до 6 месяцев).
При сепсисе, энтероколите новорожденных, включая недоношенных детей, бактериофаг применяют в виде высоких клизм (через газоотводную трубку или катетер) 2-3 раза в сутки (см. табл.). При отсутствии рвоты и срыгивания возможно применение препарата через рот. В этом случае он смешивается с грудным молоком. Возможно сочетание ректального (в клизмах) и перорального (через рот) применения препарата. Курс лечения 5-15 дней. При рецидивирующем течении заболевания возможно проведение повторных курсов лечения. С целью профилактики сепсиса и энтероколита при внутриутробном инфицировании или опасности возникновения внутрибольничной инфекции у новорожденных детей бактериофаг применяют в виде клизм 2 раза в день в течение 5-7 дней.
При лечении омфалитов, пиодермий, инфицированных ран препарат применяют в виде аппликаций ежедневно двукратно (марлевую салфетку смачивают бактериофагом и накладывают на пупочную ранку или на пораженный участок кожи).
Побочное действие
Особые указания
Важным условием эффективной фаготерапии является предварительное определение чувствительности возбудителя к бактериофагу и раннее применение препарата.
Не пригоден к применению препарат во флаконах с нарушенной целостностью или маркировкой, при истекшем сроке годности, при помутнении.
Вследствие содержания в препарате питательной среды, в которой могут развиваться бактерии из окружающей среды, вызывая помутнение препарата, необходимо при вскрытии флакона соблюдать следующие правила:
- тщательно мыть руки;
- обработать колпачок спиртсодержащим раствором; снять колпачок не открывая пробки;
- не класть пробку внутренней поверхностью на стол или другие предметы;
- не оставлять флакон открытым;
- вскрытый флакон хранить только в холодильнике.
Перед использованием флакон с бактериофагом необходимо встряхнуть и просмотреть. Препарат должен быть прозрачным.
Вскрытие флакона и извлечение необходимого объема препарата может проводиться стерильным шприцем путем прокола пробки. Препарат из вскрытого флакона при соблюдении условий хранения, вышеперечисленных правил и отсутствии помутнения, может быть использован в течение всего срока годности.

Е.Г. ДОДОВА 1 , Е.А. ГОРБУНОВА 1 , И.А. АПОЛИХИНА 1, 2 , д.м.н., профессор
1 Научный центр акушерства, гинекологии и перинатологии им. акад. В. И. Кулакова Минздрава России
2 Первый Московский государственный медицинский университет им. И.М. Сеченова, кафедра акушерства, гинекологии, перинатологии и репродуктологии
В условиях тотальной антибиотикорезистентности микроорганизмов поиск новых способов борьбы с возбудителями инфекционно-воспалительных заболеваний становится жизненно важным. В создавшихся условиях использование бактериофагов является чрезвычайно перспективным. В данном обзоре проведен анализ научных исследований, посвященных применению бактериофагов при лечении инфекций в акушерской, гинекологической и урологической практике. Накопленный клинический опыт демонстрирует высокую эффективность и безопасность лечебно-профилактических препаратов с бактериофагами. Кроме того, чувствительность основных возбудителей урогенитальных инфекций к фагам все еще остается высокой, что обуславливает широкие возможности и перспективы фаготерапии при инфекционно-воспалительных урогинекологических заболеваниях.
После открытия антибактериальных препаратов, обладающих селективным действием на микроорганизмы, сложилось впечатление, что наступила эпоха окончательной победы человека над инфекционно-воспалительными заболеваниями (ИВЗ). Но уже вскоре было обнаружено, что по мере расширения масштабов практического применения антибиотиков нарастало и число штаммов микроорганизмов, устойчивых к бактерицидному действию препаратов в результате адаптации и формирования устойчивых ассоциаций микроорганизмов в виде биопленок [1, 2]. Антибиотикорезистентность явилась важной социально-экономической проблемой, т. к. ИВЗ, вызванные устойчивыми штаммами, отличаются более длительным течением, частыми рецидивами, чаще требуют госпитализации и превышения срока пребывания в стационаре на 6--13 суток [3, 4].
В 2013 г. Всемирная организация здравоохранения (ВОЗ) заявила о критической ситуации: резком увеличении скорости распространения госпитальных инфекций, устойчивых к противомикробным препаратам, на фоне дефицита новых классов антибиотиков. По современным данным, более 60% возбудителей априори резистентны к большинству антибиотиков, а через 10--20 лет эта цифра будет близка к 100%. Особое беспокойство вызывает распространение внутрибольничных инфекций и рост частоты рецидивирующих или не поддающихся терапии заболеваний. Катастрофически нарастающая лекарственная невосприимчивость возбудителей негативно влияет на эффективность уже разработанных схем, приводит к повышению длительности заболевания и высокой вероятности осложнений [5]. За последние 20 лет разработки новых антибиотиков, что требует внушительных экономических затрат, практически не проводились.
Распространенность грамотрицательных бактерий, в частности Klebsiella spp, E. coli и Proteus spp., становится чрезвычайно актуальной для клинической практики, т. к. их плазмидные ферменты способны разрушать цефалоспорины III и даже IV поколения. Особенно большую опасность представляет возбудитель инфекций мочевыводящих путей E. coli, устойчивый ко многим антибактериальным препаратам: фторхинолонам, ампициллину, ко-тримоксазолу, гентамицину [6]. Кроме того, в развитии осложненных форм течения воспалительных процессов в акушерской и гинекологической патологии возросла роль Enterobacteriacea, Enterococcus faecium и P. aeruginosa. Устойчивость к фторхинолонам является ненадуманной проблемой при лечении мочеполовых инфекций в России. Использование макролидов (азитромицина и кларитромицина) в качестве препаратов выбора при лечении инфекций в гинекологической практике привело к тому, что к ним выработалась устойчивость у метициллинорезистентного золотистого стафилококка (MRSA). Кроме того, в мире отмечается четкая тенденция роста резистентности к макролидам у S.pyogenes и S.pneumoniae, что ставит под угрозу этот жизненно важный класс АМП [3]. ИППП возникают чаще на фоне активизации условно-патогенной микрофлоры, и число таких случаев неуклонно растет, особенно в условиях агрессивной антибактериальной терапии инфекций и нацеленности на абсолютную стерильность нижнего отдела половых путей. По данным ВОЗ 2014 г., наблюдается крайне высокий уровень резистентности N.gonorrhoeae к антибактериальным препаратам, в т. ч. к пенициллинам, что обусловлено продукцией β-лактамаз, а также к цефтриаксону, являющемуся последним резервом лечения гонореи, в т. ч. при беременности. В мире люди погибают от метициллинрезистенного золотистого стафилококка (MRSA), Klebsiella pneumoniae, N. gonorrhoeae. Частота устойчивости к тетрациклинам среди наиболее клинически значимых микроорганизмов настолько высока, что уже не позволяет рассматривать их как средства выбора для лечения большинства инфекций [7, 8, 9]. Именно поэтому проблема антибиотикорезистентности стала одной из самых актуальных для человечества [10--12].
Кроме устойчивости к бактерицидному действию, причинами низкой эффективности антибиотиков является также недостаточная избирательность действия, из-за чего происходит гибель не только патогенных микроорганизмов, но и резкое угнетение лактобацилл и другой физиологической флоры. В результате этого процесс самоочищения слизистых урогенитального тракта нарушается, что приводит к росту патогенных и условно-патогенных микроорганизмов и рецидивированию заболевания. Также отмечается низкая комплаентность в лечении у пациенток из-за возникновения неприятных побочных эффектов антибиотиков -- диареи, тошноты, аллергических реакций и т. д. [13, 14].
Стремительно развивающиеся современные технологии секвенирования микробных геномов фагов и молекулярно-биологические методы способствовали более рациональному подходу к отбору и применению лечебных бактериофагов. В США бактериофаги одобрены для использования с 2007 г. [9], однако, в Польше, Франции, бывшем Советском Союзе, а сейчас в России и Грузии использование лечебных фагов в клинической практике никогда полностью не прекращалось и исследовательские работы продолжаются до настоящего времени [15, 16].
По данным американских исследований (Kutter E., 2008), успех борьбы с бактериальной резистентностью обеспечивается соблюдением двух условий: первое -- в грамотном отборе строго специфичных фагов против каждого вида бактерий и второе -- в систематическом типировании патогенных бактерий с выявлением их фагочувствительности для своевременной коррекции состава фаговых коктейлей. Часто фаготерапия в комбинации с антибиотиками демонстрирует более эффективный результат, чем каждый вид лечения в отдельности. Поэтому применение бактериофагов не только в качестве монотерапии, но и совместно с антибиотиками является одним из перспективных направлений современной терапии ИВЗ [17].
В зарубежной практике фаги используют в лечении ожоговой и хирургической инфекции, а также при ИВЗ лор-органов. Особенно эффективны бактериофаги при ИВЗ, вызванных резистентными к антибиотику штаммами стафилококков и синегнойной палочки, в отличие от лечения антибиотиками, где эффективность не превышает 64%, при назначении бактериофагов эффективность терапии достигает 82%. При этом наибольшая эффективность фаготерапии наблюдается при внутривенном введении -- 95% в сравнении с местной аппликацией препарата. Это свидетельствует о высокой чувствительности штаммов S. aureus и P. aeruginosa, в т. ч. устойчивых к антибиотикам, к гомологичным фагам. При тщательном подборе фаговых препаратов их действие сопоставимо и даже в некоторых случаях превосходит эффективность антибиотиков [18].
Данных об использовании бактериофагов в акушерской, гинекологической и урологической практике в зарубежной литературе в настоящее время крайне мало. Совершенно другая тенденция прослеживается в российских исследованиях, в которых имеется широкая доказательная база о клинической эффективности бактериофагов, которые активно используются для лечения патологии репродуктивной системы. Многолетнее клиническое использование препаратов с бактериофагами при инфекционных заболеваниях свидетельствует об их эффективности в 77--93% случаев [8, 10]. Часто встречающийся микст из возбудителей ИВЗ требует проведения комбинированной терапии, и в этом аспекте фаготерапия также имеет значимые преимущества, ведь комбинация бактериофагов не сопровождается их взаимодействием между собой и не ведет к изменению схем их применения.
В российской литературе описан огромный опыт эффективного лечения бактериофагами урологических больных. Еще в 90-х гг. доказана эффективность перорального применения комплексного пиобактериофага и его дополнительного введения по дренажам, что позволяет санировать мочевые пути в 87,5% случаев и достичь клинико-лабораторного улучшения уже на 4--5-е сутки [22--24]. При сравнении путей введения бактериофагов для лечения гнойно-воспалительных заболеваний (пиелонефрит, цистит, мочекаменная болезнь, хронический простатит) выявилось, что бактериологическая эффективность фаготерапии была более выраженной при пероральном приеме препаратов, достигая 77--93%, в отличие от локального применения фагов через дренажи, где эффективность не превышала 73--77%. Кроме того, эффективность пероральной фаготерапии была сопоставима с положительными результатами лечения ципрофлоксацином и намного выше, чем при антибиотикотерапии традиционными препаратами (гентамицин, налидиксовая кислота, цефазолин, ампиокс), что делает перспективным использование фаговых препаратов в лечении резистентных госпитальных инфекций [21].
Отдельную нишу фаготерапия занимает в борьбе с инфекционными заболеваниями в акушерстве и гинекологии. В исследованиях Ю.А. Захаровой в соавт. (2013) Секстафаг использовался в комплексной терапии пиелонефрита у беременных перорально и в виде вагинальных тампонов в течение 7--14 дней. При исследовании микрофлоры выяснилось, что самыми частыми возбудителями пиелонефрита являются E. Coli, S. pyogenes и другие аэробные микроорганизмы, которые были высокочувствительны к фагам, содержащимся в данном препарате (74,9--90%), и сопоставимы с чувствительностью к антибиотикам -- 52,7--96%. Положительная динамика клинико-лабораторных показателей наблюдалась у всех пациенток. При этом фаготерапия снизила лекарственную нагрузку на организм беременной женщины в виде дополнительного назначения антибиотиков на 23,5% по сравнению со стандартным лечением. Необходимо особо отметить, что рецидив пиелонефрита перед родами наблюдался только у 9,4% беременных, получавших бактериофаги, что было значительно ниже, чем в группе лечения антибиотиками (33,3%). Преимуществом использования бактериофагов у женщин с пиелонефритом в период беременности явилось не только снижение на 15% частоты гнойно-септических осложнений в послеродовом периоде, но и более редкое выявление инфекционной и соматической патологии у новорожденных [25].
В исследованиях Е.Л. Макаровой [26] изучалась эффективность лечения бактериофагами пиелонефрита у беременных с анемией. В результате было установлено, что при добавлении бактериофага к основному лечению риск преждевременных родов и осложнений родовой деятельности снижался в 2 раза. Кроме этого, улучшались показатели обмена железа и меди в сыворотке, которые приближались к нормальным значениям у здоровых беременных. Полученные результаты указывали на то, что бактериофаги опосредованно влияют на биохимический состав крови и механизмы антиоксидантной защиты организма, поэтому было рекомендовано исследовать данные показатели для оценки эффективности проведенного лечения [26].
Работы по изучению методов профилактики инфекционно-воспалительных осложнений после кесарева сечения расширили возможности применения фагов в акушерстве и гинекологии. Например, по данным А.Г. Трушкова (2003), комплексный препарат бактериофагов Секстафаг, предварительно адаптированный к штаммам микрофлоры родильного отделения, применяли в виде интраоперационного орошения полости матки и перорального приема после операции. В результате было получено статистически значимое снижение гнойно-воспалительных осложнений у пациенток, получавших фагопрофилактику (18,7%), чем в группе стандартной антибиотикопрофилактики (26,7%), при этом сократилась длительность пребывания женщин в стационаре на 3,6 суток. Авторы также отмечают отсутствие негативного влияния на состояние физиологической микрофлоры биотопов влагалища и кишечника, что несомненно улучшает состояние больных [27]. Современные данные показывают, что орошение полости матки и ушиваемой раны Секстафагом и интравагинальное применение после операции обуславливает отсутствие послеоперациооных осложнений (субинволюция матки, послеродовый эндометрит и др.) и сопоставимо по эффективности со стандартной антибиотикопрофилактикой, но при этом безопасно для женщин с аллергическими реакциями на антибиотики, не влияет на лактацию и не обладает побочными эффектами [28].
Успешные результаты демонстрирует ряд исследований по применению фагов в комплексном лечении инфекционно-воспалительных заболеваний нижних отделов половых путей и ВЗОМТ. Бактериофаги не только позволяют добиться бактериостатического эффекта путем направленного действия на широкий спектр возбудителей без оказания системного влияния, но и, по зарубежным данным [29], активизирует факторы специфического и неспецифического иммунитета, что особенно важно при лечении длительнотекущих и хронических заболеваний. Так, в исследовании М.М. Падруль в соавт. (2003) при лечении хронического эндометрита, после определения чувствительности выделенных из полости матки возбудителей, проводились внутриматочные инстилляции Секстафаг в течение 5 дней, после которого клиническое и микробиологическое выздоровление было достигнуто в 75% случаев. Эффект лечения был достигнут вследствие высокой чувствительности выделенной микрофлоры к фагам -- более 80%, тогда как только к 2-м антибиотикам она была выше 50% [30]. Интересно исследование сочетанного применения бактериофагов и инфракрасного лазера для лечения хронического неспецифического эндометрита, которое позволяет добиться элиминации возбудителей и стимулировать рецепторную активность эндометрия за счет физиотерапевтического воздействия. Особенно значимым для клинического результата является то, что литическая активность фаговых частиц под воздействием низкоинтенсивного инфракрасного лазерного спектра имеет выраженную тенденцию к усилению. После лечения, проведенного по данному алгоритму, купирование жалоб и клинических симптомов заболевания произошло у 84,4% женщин. Кроме этого, у 71,8% больных в течение 2 мес. по окончании лечения регистрируется снижение уровня ИЛ-6 в цервикальной слизи, которое достигается за счет сочетанного иммуномодулирующего действия бактериофагов и преформированного физического фактора. Данный метод хорошо зарекомендовал себя как этап подготовки и планирования беременности у пациенток с хроническим эндометритом [31].
По некоторым данным, хороший эффект в терапии ВЗОМТ достигается при совместном использовании озонированного раствора и бактериофагов. Проведенные российские исследования [32, 33] показали, что сочетанное лечение озоном и бактериофагами сопровождается не только выраженным клиническим эффектом и сокращением частоты рецидивов в течение года в 2,6 раза, но и нормализует показатели местного и системного иммунитета (повышение иммунорегуляторного индекса на 30%, снижение иммуноглобулинов крови, нормализация секреторного IgA и снижение ИЛ-6). При озонотерапии в комбинации с бактериофагами не оказывается влияния на лизирующую способность фагов, восстанавливается баланс антиоксидантной системы и снижаются сроки госпитализации на 4 дня, что экономически выгодно [32, 33].
Одним из перспективных направлений в гинекологии является фаготерапия рецидивирующих инфекций нижних отделов половых путей. Нарушения микроценоза влагалища и вагинит являются значимой проблемой, т. к. служат ко-фактором развития папилломавирусной инфекции, причиной осложнений родов и послеродового периода, невынашивания беременности и др. Поэтому поиск новых методов лечения данных состояний является актуальной проблемой современной гинекологии [2]. В исследованиях Ж.Д. Новаховой в соавт. (2014) при рецидивирующих нарушениях микроценоза и воспалительных заболеваний органов малого таза применялся хорошо зарекомендовавший себя поливалентный препарат Секстафаг. Было установлено, что клиническая и микробиологическая эффективность монотерапии в виде интравагинального введения полифага составила 85,7% по сравнению с 71,4% при интравагинальном введении метронидазола. Важно отметить, что при лечении бактериофагами частота рецидивов бактериального вагиноза и неспецифического вагинита на протяжении 6 мес. наблюдения после терапии снизилась в 4,2 раза. Авторы также отмечают высокую комплаентность пациенток к лечению и отсутствие аллергических реакций во время терапии фагами [34]. Кроме лечения ИВЗ нижних отделов половых путей, препараты с бактериофагами высокоэффективны в профилактике рецидивов воспаления, что демонстрирует отсутствие рецидива бактериального вагиноза и вагинита у 87,5% пациенток в течение 7 мес. после проведения фагопрофилактического курса [14].
На данном этапе накопленных знаний фундаментальной науки и имеющегося клинического опыта можно выделить следующий ряд преимуществ бактериофагов:
• строгое селективное действие, в т. ч. при наличии биопленок;
• отсутствие влияния на физиологическую микрофлору;
• стимуляция факторов специфического и неспецифического иммунитета (что особенно значимо при лечении рецидивирующих воспалительных заболеваний);
• возможность применения у пациентов с аллергическими реакциями к антибиотикам;
• полная совместимость с любыми лекарственными средствами;
• отсутствие токсических и тератогенных эффектов;
• безопасность приема во время беременности;
• отсутствие побочных эффектов;
• сокращению длительности лечения за счет быстрого действия и глубокого проникновения в очаг инфекции [14, 17].
Необходимо отметить, что наиболее приемлемым является использование комплексных препаратов, содержащих фаги к нескольким штаммам возбудителей, что дает возможность проводить терапию с учетом полимикробной этиологии урогенитальных инфекций.
На основании анализа данных, имеющихся в настоящее время, становятся очевидными широкие возможности и перспективы использования бактериофагов в акушерстве, гинекологии и урологии. Дальнейшие исследования в этом направлении будут способствовать повышению эффективности лечения инфекционно-воспалительных заболеваний урогенитального тракта.
Внешний вид вирусных частиц напоминает колесо с широкой ступицей, короткими спицами и четко очерченным ободком, поэтому их стали называть ротавирусами (лат. rotа — колесо). Рисунок 1. Слизистая оболочка толстой кишки при ротавирусном гаст
Внешний вид вирусных частиц напоминает колесо с широкой ступицей, короткими спицами и четко очерченным ободком, поэтому их стали называть ротавирусами (лат. rotа — колесо).
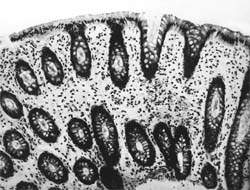 |
| Рисунок 1. Слизистая оболочка толстой кишки при ротавирусном гастроэнтерите. Минимально выраженный катаральный колит. х 100. |
Ротавирусы представляют собой род семейства Reoviridae, который объединяет большое количество сходных по морфологии и антигенной структуре вирусов, вызывающих гастроэнтерит у человека, млекопитающих и птиц. Систематическое изучение ротавирусов человека началось с 1973 года, когда они были обнаружены при электронной микроскопии ультратонких срезов биоптатов слизистой оболочки двенадцатиперстной кишки, полученных от больных острым гастроэнтеритом детей Австралии (Р. Бишоп и соавторы). В том же году Т. Флеветт обнаружил сходный вирус в копрофильтратах больных гастроэнтеритом методом электронной микроскопии при негативном контрастировании препаратов.
Вирусные частицы имеют диаметр от 65 до 75 нм. При проникновении контрастирующего вещества в вирион выявляется электронно-плотный центр диаметром 38 — 40 нм, который представляет собой так называемую сердцевину, окруженную электронно-прозрачным слоем. Внешний вид вирусных частиц напоминает колесо с широкой ступицей, короткими спицами и четко очерченным ободом, поэтому их стали называть ротавирусами (лат. rota — колесо).
Ротавирусы имеют две белковые оболочки — наружный и внутренний капсиды. Сердцевина содержит внутренние белки и генетический материал, представленный двунитчатой фрагментированной РНК. Геном ротавирусов человека и животных состоит из 11 фрагментов, которые могут быть разделены при электрофорезе в полиакриламидном геле (ПААГ) или агарозе. В составе ротавирусов обнаружено четыре антигена; основной из них — это групповой антиген, обусловленный белком внутреннего капсида. С учетом группоспецифических антигенов все ротавирусы делятся на пять групп: A, B, C, D, E. Ротавирусы одной группы имеют общий групповой антиген, который выявляется иммунологическими реакциями: иммуноферментный анализ, иммунофлюоресценция, иммунная электронная микроскопия и др. Большинство ротавирусов человека и животных относятся к группе A.
| Источником инфекции при ротавирусном гастроэнтерите является инфицированный человек — больной манифестной формой заболевания или бессимптомно выделяющий ротавирусы с фекалиями |
Источником инфекции при ротавирусном гастроэнтерите является инфицированный человек — больной манифестной формой заболевания или бессимптомно выделяющий ротавирусы с фекалиями. Вирусы в фекалиях заболевших появляются одновременно с развитием клинических симптомов, наибольшая концентрация их в кале (до 109 — 1011 вирусных частиц в 1 г) регистрируется в первые 3 — 5 дней болезни. В эти дни больные представляют наибольшую эпидемиологическую опасность для лиц, контактирующих с ними. Наиболее частым источником заболевания для детей первого года жизни являются инфицированные ротавирусом матери; для взрослых и детей более старшего возраста — дети, в основном из детских коллективов. Возможность заражения человека от животных не доказана.
Патогенез ротавирусной инфекции характеризуется проникновением вируса в эпителиоциты слизистой оболочки желудочно-кишечного тракта, преимущественно тонкой кишки, что приводит к их повреждению и отторжению от ворсинок. Вследствие этого на ворсинках тонкой кишки появляются функционально и структурно незрелые энтроциты с низкой способностью синтезировать пищеварительные ферменты. При ротавирусном гастроэнтерите это проявляется снижением уровня дисахаридаз, развивается вторичная дисахаридазная недостаточность, при которой в просвете тонкой кишки накапливаются нерасщепленные дисахариды, что создает повышенное осмотическое давление и приводит к выводу в просвет кишечника воды и электролитов из тканей организма. Это является основной причиной диареи и дегидратации и определяет основные клинические проявления болезни.
Ротавирусный гастроэнтерит как инфекционное заболевание имеет циклическое течение. Инкубационный период продолжается чаще всего от 12 — 24 часов до двух суток. Клиническая картина ротавирусного гастроэнтерита характеризуется в основном острым началом, однако в ряде случаев может иметь место продромальный период длительности от 12 до 48 — 72 часов. В этот период больные отмечают недомогание, общую слабость, повышенную утомляемость, снижение аппетита, головную боль, познабливание, урчание и неприятные ощущения в животе, умеренно выраженные катаральные явления: заложенность носа, першение в горле, легкий кашель.
В клинической картине ротавирусного гастроэнтерита в период развернутых клинических проявлений ведущими являются синдромы гастроэнтерита и интоксикации. Выраженность диареи и обусловленной ею той или иной степени дегидратации организма, а также токсикоза, продолжительность этих симптомов в значительной мере определяет тяжесть течения заболевания.
Синдром гастроэнтерита характеризуется развитием диареи, снижением аппетита, появлением урчания и болей в животе, тошноты и рвоты. Наиболее типичен для ротавирусного гастроэнтерита обильный водянистый пенистый стул желтого или желто-зеленого цвета. У больных с легким течением заболевания стул может быть кашицеобразным. Как правило, патологические примеси в стуле отсутствуют. Боль локализуется преимущественно в верхней половине живота или является диффузной, она может быть разной интенсивности. Почти всегда она сопровождается громким урчанием в животе.
Синдром интоксикации появляется в самом начале заболевания. Слабость, зачастую резкая, является наиболее частым проявлением этого синдрома; реже отмечается головная боль. При более тяжелом течении имеют место головокружение, обморочное состояние, коллапс. Обращает на себя внимание следующая особенность ротавирусного гастроэнтерита: два ведущих в клинической картине болезни синдрома развиваются в процессе заболевания не всегда однонаправленно; у некоторых больных на фоне сравнительно слабо выраженных диспепсических явлений могут наблюдаться резко выраженные симптомы общей интоксикации, особенно слабость.
Повышение температуры тела не всегда может отмечаться при ротавирусном гастроэнтерите, особенно у взрослых. У некоторых больных может быть озноб без повышения температуры. В то же время нередко в разгар заболевания выраженность лихорадочной реакции варьируется от субфебрильных цифр и выше и может достигать 38 — 39°С как у детей, так и у взрослых.
Важным в диагностическом плане для ротавирусного гастроэнтерита считается сочетание двух ведущих клинических синдромов с симптомами поражения верхних дыхательных путей. Катаральный синдром встречается приблизительно у 50% больных и проявляется в виде гиперемии и зернистости слизистых оболочек мягкого неба, небных дужек, язычка, задней стенки глотки, а также насморка, заложенности носа, кашля, болей в горле. В ряде случаев катаральные симптомы наблюдаются уже в продромальном периоде, до проявления симптомов гастроэнтерита.
В разгар болезни отмечается изменение функционального состояния сердечно-сосудистой системы, чаще у пациентов с более тяжелым течением и при наличии сопутствующих заболеваний органов кровообращения. У большинства пациентов отмечается тенденция к артериальной гипертензии, тахикардия, определяется глухость сердечных тонов при аускультации. У больных с тяжелым течением заболевания, как правило, возникают обмороки и коллапсы из-за выраженных расстройств гемоциркуляции, в генезе которых наряду с токсическими воздействиями существенное значение имеет гиповолемия. Потери жидкости и электролитов вследствие рвоты и диареи могут быть значительными и приводят к развитию дегидратации. Клинические проявления дегидратации зависят от ее степени. При легком и среднетяжелом течении ротавирусного гастроэнтерита отмечается жажда, сухость во рту, слабость, бледность (дегидратация I — II степени), при тяжелом течении наряду с этими симптомами наблюдаются также осиплость голоса, судороги мышц конечностей, акроцианоз, снижение тургора кожи, уменьшение диуреза (дегидратация III степени).
В связи с развитием при ротавирусном гастроэнтерите возможных осложнений, главным образом циркуляторных расстройств, острой сердечно-сосудистой недостаточности, нарушений гомеостаза, выделяют группы больных повышенного риска, в которые включают новорожденных, детей младшего возраста, лиц пожилого возраста, а также больных с тяжелыми сопутствующими заболеваниями. Описанные в литературе и наблюдавшиеся нами случаи ротавирусного заболевания с летальным исходом относятся именно к этим группам.
Выделяются две основные клинические формы ротавирусного заболевания — гастроэнтерическая и энтерическая. Симптомы только острого гастрита (гастритический вариант) встречаются в 3 — 10% случаев. Функциональные и морфологические нарушения со стороны желудочно-кишечного тракта, возникающие при ротавирусном гастроэнтерите в случае наличия у пациентов фоновой гастроэнтерологической патологии, нередко способствуют развитию таких осложнений основного заболевания, как обострение сопутствующих болезней: хронического гастрита, энтероколита, панкреатита, часто в сочетании с выраженными явлениями дисбактериоза кишечника, требующими коррекции при лечении.
Методы диагностики ротавирусной инфекции
При ротавирусном гастроэнтерите гемограмма изменяется следующим образом: в остром периоде заболевания с высокой частотой выявляются лейкоцитоз с нейтрофилезом и повышенная СОЭ. В периоде реконвалесценции картина крови обычно нормализуется полностью. Изменения урограммы у большинства больных имеют кратковременный характер и проявляются чаще всего небольшой протеин-, лейкоцит- и эритроцитурией; в редких случаях в моче появляются гиалиновые цилиндры в незначительном количестве. При тяжелом течении заболевания нарушения функции почек могут быть более выраженными, с повышением уровня мочевины крови, олигоурией или анурией, снижением клубочковой фильтрации. На фоне проводимой терапии указанные изменения быстро исчезают и при повторных обследованиях не отмечаются.
В качестве примера, иллюстрирующего особенности клинического течения ротавирусного гастроэнтерита, приводим выписку из истории болезни.
Лечение: обильное питье солевых растворов, парентеральная регидратационная и дезинтоксикационная терапия — трисоль 1000 мл внутривенное капельное введение, внутрь ферментные препараты: абомин, панкреатин, тансол, карболен. Течение заболевания без осложнений. На третий день болезни — субфебрильная температура, оставалась слабость; боли в животе прекратились. Стул кашицеобразный до пятого дня от начала заболевания. Полное выздоровление наступило на седьмой день болезни.
Дифференциальный диагноз у больных ротавирусным гастроэнтеритом проводят с другими острыми кишечными инфекциями как вирусной так и бактериальной этиологии, прежде всего в тех случаях, когда в клинической картине на первый план выступает синдром гастроэнтерита: с вирусными диареями различной этиологии (аденовирусы, коронавирусы, астровирусы, калицивирусы, вирус Норфолк, энтеровирусы Коксаки и ЕСНО); с гастроинтестинальной формой сальмонеллеза, с гастроэнтеритическим и гастроэнтероколитическим вариантами острой дизентерии, с пищевыми токсикоинфекциями, вызванными условно-патогенными бактериями; с холерой.
Обнаружение специфических антител и нарастание их титра в сыворотке крови больных и переболевших ротавирусным гастроэнтеритом при помощи серологических реакций с целью текущей диагностики на практике в настоящее время широкого распространения не получило и используется в основном для ретроспективного анализа различных эпидемиологических ситуаций.
Методы обнаружения вирусспецифической РНК, которые можно назвать высокочувствительными и специфичными, имеют, однако, ряд недостатков, ограничивающих их практическое применение (необходимость наличия специальной аппаратуры, реактивов, квалифицированного персонала и др.) Наиболее простой метод в этой группе — электрофорез ротавирусной РНК в полиакриламидном геле. Этот метод, позволяющий идентифицировать штаммы вирусов, вызвавшие заболевание, и дать характеристику штаммов, циркулирующих на данной территории, в основном применяется при эпидемиологических исследованиях.
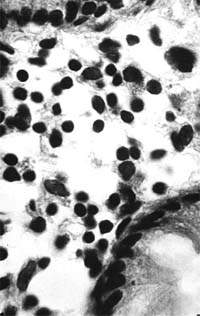 |
| Рисунок 2. Слизистая оболочка толстой кишки при ротавирусном гастроэнтерите. Минимальное содержание плазматических клеток в собственной пластинке, увеличение в ней числа макрофагов. х 400 |
В клинической практике врач нередко сталкивается с обстоятельствами (сомнительные результаты вирусологических и серологических исследований, случаи микст-инфекций), когда возникает необходимость в применении дополнительных методов для верификации диагноза. С этой целью может быть использован доступный для практического здравоохранения интрументальный метод исследования — ректороманоскопия с аспирационной биопсией слизистой оболочки толстой кишки. При гистологическом, морфометрическом и гистохимическом исследованиях биоптатов при ротавирусном гастроэнтерите выявляются характерные изменения в виде поверхностного минимально выраженного катарального колита с незначительной дистрофией эпителия (рис. 1), снижения числа серотонинсодержащих желудочно-кишечных эндокриноцитов (ЕС-клетки) в эпителиальном пласте кишечных желез, умеренной инфильтрацией собственной пластинки плазматическими клетками и увеличением в ней числа макрофагов (рис. 2). Эти особенности имеют дифференциально-диагностическое значение, поскольку отличаются указанным показателем от других острых кишечных инфекций, что может быть использовано в диагностически сложных случаях.
Здравоохранение в настоящее время не располагает препаратами, обладающими специфическим антиротавирусным действием, поэтому терапия ротавирусного гастроэнтерита является патогенетической. Основные ее цели — борьба с дегидратацией, токсикозом и связанными с ними наиболее часто встречающимися при ротавирусном гастроэнтерите нарушениями функции жизненно важных органов — сердечно-сосудистой системы и органов мочевыделения, степень выраженности которых во многом определяет тяжесть течения заболевания и его прогноз.
Для правильного выбора характера и объема проводимой регидратационной терапии в первую очередь необходимо установить степень дегидратации у того или иного пациента. При эксикозе I — II степени следует ограничиваться пероральной регидратационной терапией (препараты регидрон, глюксолан и др.). При дегидратации III степени целесообразно прибегать к комбинированной парентеральной и пероральной регидратации. Для парентеральной регидратации применяют растворы трисоль, квартасоль, ацесоль и др. С целью дезинтоксикации и улучшения гемодинамики при среднетяжелом и тяжелом течении заболевания показаны коллоидные растворы (гемодез, полиглюкин и др.).
| Для ротавирусной инфекции характерно сочетание гастроэнтерита, интоксикации и симптомов поражения верхних дыхательных путей |
Современными представлениями о патогенезе диарейного синдрома при ротавирусном гастроэнтерите обусловлено и назначение соответствующих средств, способствующих нормализации состояния пищеварительного тракта, а также диеты. Учитывая нарушения активности ряда пищеварительных ферментов, в частности лактазы, рекомендуется исключить в острый период заболевания из пищевого рациона больных молоко и молочные продукты. Кроме того, по этой же причине целесообразно ограничивать и пищу, богатую углеводами. В связи с вышеизложенным, в острый период необходимы энзимные препараты (панзинорм-форте, фестал и др). Кроме того, в остром периоде заболевания могут быть использованы адсорбирующие и вяжущие средства, способствующие ускоренному формированию стула (смекта, карболен и др.) также возможно применение хилака-форте. Высокой частотой дисбактериозов кишечника различной степени выраженности у больных ротавирусным гастроэнтеритом обусловлена необходимость применения в комплексной терапии бактерийных биологических препаратов. Лучшая терапевтическая эффективность при ротавирусном гастроэнтерите отмечена при применении лактосодержащих бактерийных биологических препаратов (ацилакт, лактобактерин и др.), что, по-видимому, связано с заместительным действием бактериальной лактазы, содержащейся в лактобактериях. В последние годы в комплексной терапии ротавирусного гастроэнтерита начал применяться комплексный иммуноглобулиновый препарат (КИП), который разработан и выпускается в МНИИЭМ им. Г. Н. Габричевского. Это первый отечественный иммуноглобулиновый препарат для энтерального применения. КИП характеризуется повышенной концентрацией антител к микроорганизмам, возбудителям острых кишечных инфекций, в том числе ротавирусам, сальмонеллам, шигеллам, эшерихиям и др. Применение КИП в комплексной терапии больных ротавирусным гастроэнтеритом оказывает отчетливый положительный терапевтический эффект, существенно сокращая продолжительность интоксикации и диареи, что открывает новые возможности в лечении этого заболевания.
Литература
1. Букринская А. Г., Грачева Н. М., Васильева В. И. Ротавирусная инфекция. М., 1989.
2. Дроздов С. Г., Покровский В. И., Шекоян Л. А., Машилов В. П. и др. Ротавирусный гастроэнтерит. М., 1982.
3. Новикова А. В. и др. Архив патологии, 1989, №6.
4. Щербаков И. Т. и др. Архив патологии, 2995, №3.
5. Юшук Н. Д., Царегородцев А. Д.. Лекции по инфекционным болезням. М., 1996.
Читайте также:

