Лечение септического шока у новорожденного
Обновлено: 19.04.2024
Неонатальный сепсис – системное инфекционное заболевание у ребенка первых 28 дней жизни, проявляющееся характерными клиническими симптомами и/или подтвержденной положительной культурой крови [9].
Пользователи протокола: неонатологи, педиатры, врачи общей практики, врачи скорой и неотложной медицинской помощи.
Класс I - польза и эффективность диагностического метода или лечебного воздействия доказана и/или общепризнаны
Класс III - имеющиеся данные или общее мнение свидетельствуют о том, что лечение неполезно/неэффективно и, в некоторых случаях может быть вредным
В - результаты одного рандомизированного клинического исследования или крупных нерандомизированных исследований
С – общее мнение экспертов и/или результаты небольших исследований, ретроспективных исследований, регистров
Классификация
Ранний неонатальный сепсис – реализация процесса происходит в возрасте 0 - 72 часа после рождения; [1.2]
Поздний сепсис новорожденных – инфекция новорожденного в возрасте> 72 часов после рождения, обусловленная горизонтальным переносом микроорганизмов из окружающей среды или реже через плаценту, во время родов [3,4].
Диагностика
II. МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
Минимальный перечень обследования, который необходимо провести при направлении на плановую госпитализацию: не проводится.
• определение газов крови и электролитов.
Диагностические мероприятия, проводимые на этапе скорой помощи: не проводятся.
• плохое мытье рук медицинского персонала.
• изменения со стороны ЦНС – раздражительность, летаргия, гипотония, гипорефлексии, вялость, тремор, набухание большого родничка, судороги
• изменения со стороны ЖКТ - плохо сосет, теряет в массе тела, срыгивания, рвота, метеоризм, гепатоспленомегалия, диарея;
Лабораторные исследования:
• Общий анализ крови: анемия, лейкоцитоз или лейкопения, тромбоцитопения. ЛИ -> 0,2- 0,3, нейтропения, ускоренное СОЭ;
• Биохимический анализ крови: увеличение СРБ, гипогликемия, повышение АЛТ и АСТ, билирубина за счет прямой фракции, повышение мочевины, креатинина, азотемия;
• Бактериологическое исследование крови: рост бактерий для раннего – СГБ; грамм отрицательные бактерии, энтерококки и др., и для позднего: стафилококк золотистый, грамм отрицательные бактерии (клебсиелла, псевдомонас, ацинетобактер), грибы.
• рентгенография сустава при остеомиелите/остеоартрите: утолщение надкостницы, признаки разрушения кости, отек мягких тканей, накопление жидкости;
Категории МКБ: Гиповолемический шок (R57.1), Гипотензия неуточненная (I95.9), Гипотензия, вызванная лекарственными средствами (I95.2), Другие виды гипотензии (I95.8), Другие виды шока (R57.8), Идиопатическая гипотензия (I95.0), Кардиогенный шок (R57.0), Септицемия неуточненная (A41.9), Шок неуточненный (R57.9), Шок, не классифицированный в других рубриках (R57)
Общая информация
Краткое описание
Российское общество неонатологов
Клинические рекомендации
Диагностика и лечение шока у новорожденных детей
Год создания: 2019

По мере своего развития шок сопровождается снижением артериального давления. Однако, изолированное снижение артериального давления ниже нормативных значений для данного возраста и срока гестации без нарушения перфузии органов и тканей, не является шоком и требует принципиально иных терапевтических подходов.
Классификация
Выделяют несколько основных видов шока: дистрибутивный шок, кардиогенный шок и гиповолемический шок, который в практике неонатолога, как правило, связан с кровопотерей. В соответствии с этиологической классификацией существует также болевой шок, анафилактический шок, ожоговый шок и другие, однако эти виды шока редко встречаются в неонатальной практике. Особенностью новорожденных является возможность развития некоторых видов шока, нехарактерных для взрослых и детей более старшего возраста (шок на фоне закрытия ОАП при дуктус-зависимом ВПС, шок при фиброэластозе, шок фето-фетальном синдроме, шок при персистирующей легочной гипертензии и др). Кроме того, некоторые врожденные нарушения метаболизма, сопровождающиеся гипераммониемией или гипергликемией, могут также симулировать клинику септического шока.
Наиболее тяжёлым, молниеносно развивающимся, имеющим высокую летальность и наибольшую частоту осложнений является септический шок. В основе диагностического поиска и планирования тактики всегда нужно в первую очередь исключить развитие септического шока.
Особенности наиболее часто встречающихся видов неонатального шока.
Классически выделяют три стадии шока – стадия компенсации, стадия декомпенсации и необратимая стадия. В неонатальной практике четкое выделение стадий шока не всегда возможно.
Лечение следует начинать вне зависимости от подозреваемой стадии шока.


Этиология и патогенез
ЭТИОЛОГИЯ ШОКА
В основе развития шока лежит снижение сердечного выброса и/или снижение периферического сосудистого сопротивления. Сердечный выброс определяется:
Любой из факторов (низкая преднагрузка и сократительная способность или высокая постнагрузка) может привести к снижению сердечного выброса.

Патологические состояния, которые приводят к описанным изменениям, перечислены в таблице.
Клиническая картина
Cимптомы, течение
В отличие от артериальной гипотонии, которая может протекать бессимптомно, при шоке отмечаются следующие клинические симптомы:
- Со стороны сердечно-сосудистой системы: Нарушения сердечного ритма. Наиболее частый признак развивающегося шока – нарастающая тахикардия. Учащая сердечный ритм, ребенок компенсирует падающий сердечный выброс, не имея возможности адекватно увеличить силу сокращения. У недоношенных детей признаком развивающегося шока, напротив, может быть брадикардия. Нарушения частоты сердечных сокращений – ранний признак развития шока у новорожденного.
- Со стороны дыхательной системы: Тахипное характерно для септического и кардиогенного шока, в частности на фоне ацидоза и повышения уровня лактата. При наличии патологии легких возможно быстрое прогрессирование дыхательных нарушений. Периодическое дыхание и апноэ являются следствием сниженной перфузии головного мозга, что может отмечаться при всех видах шока.
- Со стороны ЦНС: Неврологические нарушения могут быть различными – от резкого угнетения вплоть до отказа от кормления до двигательного возбуждения с быстрым истощением. Как правило, развивается мышечная гипотония в покое, сниженная спонтанная двигательная активность с постепенным нарастанием неврологических нарушений.
- Артериальная гипотония. Следует помнить, что артериальная гипотония – это относительно поздний признак шока. В идеальном варианте диагностика и терапия шока должна быть начата раньше развития тяжелой гипотонии. Нижней допустимой границей среднего артериального давления в мм рт ст эмпирически принято считать ГВ в неделях. Однако нижняя граница артериального давления вне зависимости от ГВ не должна опускаться ниже 30 мм рт ст [1] Только для новорожденных с весом 600г и менее – нижняя допустимая граница среднего артериального давления может быть 28 мм рт ст
- Со стороны мочевыделительной системы: Может отмечаться олигурия вплоть до анурии. Однако, при высокой осмолярности (например, в условиях гипергликемии), а также при массивной диуретической терапии нормальные показатели диуреза могут сохраняться достаточно долго.
- Низкая корреляция между АД и тканевой перфузией
- Низкая специфичность симптома белого пятна. Для новорожденных ≤ 30 недель гестации выявлена незначительная специфичность только при длительности заполнения капилляров более 5 сек
- На фоне шока часто отмечается брадикардия. Характерна клиническая ситуация, когда эпизоды выраженной брадикардии чередуются нормальным или учащенным сердечным ритмом. Нарушения сердечного ритма практически всегда предшествуют снижению АД.
- У глубоконедоношенных детей следует различать артериальную гипотонию, (связанную с незрелостью регуляторных механизмов, относительной адреналовой недостаточностью) и собственно шок. Терапевтические подходы к этим двум состояниям кардинально отличаются.
Диагностика
Сердечный выброс (СВ) – это количество крови, выброшенной сердцем за минуту – величина, характеризующая системный кровоток, синоним - минутный объем кровообращения.
Величина СВ зависит от ЧСС. При значительных нарушениях сердечного ритма – тахикардии или брадикардии – данные могут быть недостоверны.
В педиатрической практике, как правило, под СВ подразумевается СВ левого желудочка. В неонатологии и, в особенности у недоношеннных новорожденных, актуально измерение СВ левого и правого желудочков. Измеряется в мл/кг/мин.
• Недоношенные (без ГЗФАП) - 221 ± 56 мл/кг/мин. У недоношенных новорожденных со значимым шунтированием крови через ОАП СВ левого желудочка не характеризует системный кровоток, так как к его значение может достигать 300 мл/кг/мин и более, характеризуя при этом кровоток в малом круге кровообращения. В такой гемодинамической ситуации для оценки системного кровотока используется СВ правого желудочка.
СВ правого желудочка. Объем крови, выброшенной правым желудочком за минуту. Величина кровотока оценивается на уровне бифуркации легочной артерии. Нормальные показатели соответствуют показателям СВ левого желудочка. В связи с тем, что на сердечный выброс ПЖ не влияет ГЗФАП, этот показатель рекомендуется использовать в первые 24 часа после рождения, а также у недоношенных новорожденных с ГЗФАП. Однако, при значительном шунтировании крови через овальное окно СВ ПЖ также не будет характеризовать системный кровоток. В этой ситуации для косвенной оценки системного кровотока используют данные о возврате крови к сердцу – кровоток в верхней полой вене.
Кровоток в верхней полой вене (ВПВ). Объем крови, проходящий через верхнюю полую вену на уровне ее впадения в правое предсердие. Характеризует кровоток в верхней половине туловища, 70-80% которого составляет кровоток в головном мозге. Измеряется в мл/кг/мин. Составляет 30-50% выброса правого желудочка. Кровоток значительно возрастает в первые 48 часов жизни – от 70 мл/кг/мин в возрасте 5 часов жизни до 90 мл/кг/мин в возрасте 48 часов. Таким образом, с учетом данных о значительном приросте в первые 48 часов, нормальные значения: 40-120 мл/кг/мин.
Ударный объем (УО) - объем крови, который выбрасывается сердцем за одно сокращение. Таким образом, у новорожденного с нормальным сердечным ритмом без значимого шунтирования крови через фетальные коммуникации для оценки уровня системного кровотока используется СВ левого желудочка и кровоток в ВПВ. При наличии значимого шунтирования – используют данные о СВ правого желудочка и кровоток в ВПВ.
Для оценки функции миокарда используются данные о фракции выброса и фракции укорочения. Основной проблемой достоверности этих измерений у недоношенных новорожденных является традиционное использование для этого М-режима, при котором оценивается движение задней стенки ЛЖ и межжелудочковой перегородки. Особенностью недоношенных является малая подвижность межжелудочковой перегородки при сокращении. Для недоношенных новорожденных предпочтительно измерение ФУ методом Симпсона.
Фракция укорочения (ФУ) - отношение конечного систолического размера ЛЖ к конечному диастолическому. Величина, характеризующая способность волокон миокарда сокращаться. Нормальные значения: 35% (26-40%).
Для оценки значимости шунтирования используются данные о диаметре ОАП и признаки переполнения легочного и обеднения системного кровотока.
• Индекс сосудистой резистентности (Ri) передней мозговой артерии >0,8
Оценка давления в ЛА по шунтированию через ОАП. Метод может быть использован при наличии шунтирования через ОАП и данных о системном АД. Для оценки используется модифицированная формула Bernoulli : 4 ∗ 𝑉𝑉ОАПP 2 , где 𝑉𝑉ОАП – скорость кровотока в ОАП.
Например, при шунтировании крови слева-направо и скорости кровотока в ОАП 2м/с (4*22) давление в ЛА будет ниже системного АД на 16 мм рт ст, а при право- левом шунтировании давление в ЛА будет на 16 мм выше системного АД.
Оценка давления в ЛА по степени недостаточности на трикуспидальном клапане. При отсутствии обструкции выходного тракта ПЖ давление в ПЖ рано давлению в ЛА. Давление в правом предсердии на 5-10 м м р т с т н иже д авления в Л А. М етод м ожет б ыть и спользован при наличии недостаточности трикуспидального клапана, так как отсутствие регургитации на клапане будет говорить о том, что давление в ПЖ равно давлению в ПП. Таким образом, если градиент на трикуспидальном клапане равен 36 мм рт ст, давление в ЛА будет равным 42 мм рт ст (36мм рт ст +5мм рт ст).
Оценка давления в ЛА по отношению времени ускорения кровотока в ЛА к времени изгнания. Метод основан на том, что по мере роста давления в ЛА сокращается время достижения пиковой скорости в момент изгнания крови из ПЖ. На основании отношения времени достижения максимальной скорости кровотока в ЛА к полному времени изгнания (TPV/RVET) можно судить о легочной гипертензии.
Лечение
1. В первую очередь следует обеспечить адекватную респираторную терапию. Как правило, требуется перевод на ИВЛ.
2. Обеспечение сосудистого доступа (если отсутствует). Желательно катетеризировать две вены (одну центральную и одну периферическую или две центральных вены) для исключения вероятности изменения скорости введения инотропных препаратов при одновременном назначении других инфузий. В исключительных случаях при наличии жизненных показаний в отсутствие возможности катетеризации центральной вены допустима непродолжительная инфузия вазоактивных препаратов (допамин, адреналин) в периферическую вену. Задержка с назначением инотропных препаратов связана с 20-кратным увеличением риска летальности.
3. Если ребенок получал энтеральное питание, оно должно быть отменено, содержимое желудка эвакуировано. Парентеральное питание должно быть продолжено с учетом клинической картины и особенностей новорожденного (см. протокол проведения парентерального питания).
3. Непосредственно после катетеризации вены, как можно скорее, вводится 10–20 мл/кг физиологического раствора медленно болюсно или капельно. На ранней стадии дистрибутивного шока (септического шока) предпочтительно в первую очередь использовать волюм-эспандерный раствор (физиологический раствор) для поддержания внутрисосудистого пространства. Инотропные препараты назначаются одновременно или немногим позднее. При отсутствии эффекта возможны повторные введения еще 10-15 мл/кг за 15-20 мин, с одновременным назначением инотропного препарата. Волюм-эспандерная терапия при септическом (дистрибутивном) шоке может достигать 40 и более мл/кг в течение первого часа терапии шока.
4. Инотропные препараты. Допамин – вазоактивный препарат первой линии в начальной дозе 5 мкг/кг/мин с повышением дозы по мере необходимости. Повышение дозы производят пошагово, шаг - 2,0-2,5 мкг/кг/мин до 10 мкг/кг/мин каждые 10- 15 мин. Исключение составляет состояние персистирующей легочной гипертензии, когда препаратом первой линии может стать добутамин с 5 мкг/кг/мин, увеличивая дозу с шагом 2,0 -5,0 мкг/кг/мин каждые 10-15 мин. Добутамин (как стартовый препарат) может назначаться при персистирующей легочной гипертензии как изолированно, так и одновременно с допамином
5. Предварительная оценка вида шока (гиповолемический, дистрибутивный (септический), кардиогенный). Начальные мероприятия направлены на поддержание сосудистого пространства и обеспечение поддержки тонуса миокарда и стенок сосудов, коррекцию гипоперфузии органов и тканей. Дальнейшие действия будут зависеть от полученных результатов обследования.
6. Анализ крови на КОС, электролиты, глюкозу, лактат, посев крови (другие исследования, предусмотренные при ухудшении состояния, в соответствии с внутренним протоколом отделения). Подсчет диуреза за предыдущие часы. В случае необходимости – коррекция анемии, ацидоза, дисэлектолитных нарушений, смена антибактериальной терапии.
7. Эхокардиография* для исключения ВПС с оценкой сократительной способности миокарда, системного кровотока (сердечный выброс ЛЖ, кровоток в ВПВ), гемодинамической значимости фетальных коммуникаций:
а. При нормальной сократительной способности миокарда и низком АД - продолжить увеличение дозы допамина до 15-20 мкг/кг/мин.
б. При сниженной сократительной способности миокарда и/или высокой легочной гипертензии – добутамин с 5 мкг/кг/мин до 20 мкг/кг/мин, увеличивая на 2 - 5 мкг/кг/мин каждые 15 мин.
Если у новорожденного сохраняется гиповолемия, высокие дозы инотропных препаратов могут вызвать тахикардию. В этом случае следует увеличить волемическую нагрузку.
а. Для детей с ЭНМТ – назначаются кортикостероиды - гидрокортизон (в дозе 1-2 мг/кг каждые 6 ч, при необходимости доза увеличивается до 2-2,5 мг/кг каждые 4 часа). Возможно также использование дексаметазона (0,5 мг/кг, при необходимости повторное введение каждые 2-6 часов). При отсутствии эффекта от введения кортикостероидов или кратковременном эффекте – в терапию включается адреналин 0,05-0,3 мкг/кг/мин. Каждые 15 мин увеличение дозы на 0,1 мкг/ кг/мин, максимальные дозы при шоке могут достигать 3-5 мкг/кг/мин.
У детей с ЭНМТ оправдано использование нескольких инотропных препаратов одновременно с целью снижения необходимой дозы адреналина, так как использование адреналина сопряжено с рядом побочных эффектов (повышение тонуса мезентериальных сосудов, гипергликемия, увеличение тонуса легочных сосудов, развитие гипертрофии миокарда, лактат-ацидоз)
б. Для детей с весом более 1000г – назначается адреналин (0,1-0,5 мкг/кг/мин). Каждые 15 мин увеличение дозы на 0,1 мкг/кг/мин. При отсутствии эффекта от увеличения дозы адреналина – назначаются кортикостероиды – гидрокортизон (в дозе 1-2 мг/кг каждые 6 ч, при необходимости доза увеличивается до 2-2,5 мг/ кг каждые 4 часа).
Возможно также использование дексаметазона (0,5 мг/кг, при необходимости повторное введение каждые 2-6 часов). После назначения адреналина возможен переход на монотерапию адреналином или сочетание нескольких инотропных препаратов.
9. При неэффективности описанной терапии и подтвержденной нормальной сократимости миокарда возможно использование норадреналина.
Норадреналин в большей степени увеличивает общее периферическое сопротивление сосудов, что приводит к увеличению постнагрузки. При условии здорового миокарда это может привести к увеличению сократимости. При пораженном миокарде повышение постнагрузки сопровождается снижением сердечного выброса. Эффективное и безопасное применение норадреналина возможно после эхокардиографического исследования с оценкой сократительной способности миокарда. Применяется при артериальной гипотонии на фоне сохранной сократительной способности миокарда, только после волемической нагрузки, обычно в комбинации с другими инотропными препаратами. Рекомендована начальная доза и скорость введения от 0,1 до 0,3 мкг/кг/мин. Максимальная доза и скорость введения может достигать 3–5 мкг/кг/мин.
10. Решение о необходимости продолжения введения повышенного объема инфузии принимается на основании клинических данных и данных эхокардиографии:

* Функциональная эхокардиография является основой эффективной терапии шока у новорожденных. В жизнеугрожающей ситуации (например, септический шок) эхокардиографическая оценка может проводиться обученным неонатологом. В случае отсутствия возможности ЭХО-исследования, после проведения начальных мероприятий по стабилизации больного с шоком, возможен выбор любой тактики в рамках предложенных алгоритмов.
При использовании высоких доз адреналина возможна как отмена других инотропных препаратов (допамин, добутамин), так и использование нескольких инотропных препаратов одновременно.
При стабилизации состояния в первую очередь снижают дозу и отменяют норадреналин, затем, по возможности, адреналин, затем добутамин, инфузия допамина в невысоких дозах может потребоваться в течение нескольких суток. Кортикостероиды отменяются сразу после стабилизации АД, в том числе на фоне использования инотропных препаратов.
Следствием шокового состояния может быть повреждение и дисфункция многих органов и систем. В связи с этим после стабилизации состояния необходимо:
b. своевременная коррекция объема вводимой жидкости, состава парентерального питания, дозировки нефротоксичных препаратов в зависимости от функции почек.
d. УЗИ головного мозга
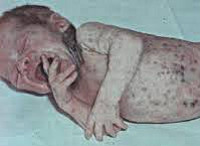
Сепсис новорожденных – генерализованная гнойно-септическая инфекция, характеризующаяся наличием первичного очага и циркуляцией инфекции в крови. Сепсис новорожденных проявляется признаками инфекционного токсикоза (температурной реакцией, вялостью, диспепсией, землистой окраской кожных покровов) и образованием гнойных метастатических очагов в различных органах (мозговых оболочках, легких, костях, печени и пр.). Диагноз сепсиса у новорожденных устанавливается на основании клинических критериев и выделения возбудителя при бактериологическом посеве крови. Лечение сепсиса новорожденных включает системную антибиотикотерапию, санацию первичного и метастатических гнойных очагов, посиндромную терапию.
Общие сведения
Сепсис новорожденных – общий инфекционный процесс, обусловленный попаданием условно-патогенной и гноеродной микрофлоры из локальных очагов в кровяное русло и сопровождающийся тяжелыми системными проявлениями. По данным зарубежной педиатрии, частота сепсиса новорожденных составляет 0,1-0,8%; среди недоношенных и детей с перинатальной патологией, находящихся в ОРИТ, - 14%. Неонатальная смертность, обусловленная сепсисом новорожденных, высока и стабильна – около 30-40%. Развитию сепсиса способствуют недостаточная сформированность барьерных механизмов и иммунитета у новорожденных, пограничные состояния периода новорожденности, патологическое протекание перинатального периода, сложность ранней диагностики септических состояний.

Причины
В настоящее время доминирующее место (около 50%) среди возбудителей сепсиса новорожденных принадлежит грамположительной флоре (главным образом, стафилококкам, гемолитическому стрептококку группы А). Чуть реже (до 40% случаев) выявляется грамотрицательная микрофлора (кишечная палочка, синегнойная палочка, клебсиелла и др.); в 10% этиологическими агентами выступает смешанная флора (часто ассоциация стафилококка с грибами Candida).
Со стороны матери факторами, способствующими бактериальной контаминации новорожденного, выступают бактериальный вагиноз, кольпиты, эндометрит. Большое значение имеет степень и характер иммуносупрессии у новорожденного, которые могут быть связаны с неполноценным питанием или приемом лекарств беременной, наследственным иммунодефицитом или ВИЧ-инфекцией. В отдельных случаях причиной вспышек сепсиса новорожденных становится несоблюдение санитарного режима в родильных или детских отделениях.
Классификация
По времени развития выделяют внутриутробный и постнатальный (ранний неонатальный и поздний неонатальный) сепсис новорожденных. Внутриутробный сепсис предполагает антенатальное или интранатальное инфицирование плода; при этом первичный гнойно-септический очаг располагается вне организма ребенка (чаще всего в его роли выступает плацентит, хорионит, хориоамнионит и т. д.). В случае постнатального сепсиса первичный гнойно-воспалительный очаг всегда располагается в организме самого новорожденного.
Ранний неонатальный сепсис новорожденных развивается в первые 4-ро суток жизни ребенка. Клинические течение заболевания обычно молниеносное, с быстрым развитием полиорганнной недостаточности, летальным исходом в 5-20% случаев. Поздний неонатальный сепсис новорожденных манифестирует на 5-й день и позднее. Характеризуется медленно прогрессирующим течением, возникновением вторичных септических очагов, 5-10%-ной летальностью.
Течение сепсиса новорожденных может быть молниеносным (3-7 дней), острым (до 4-8 недель), подострым (до 1,5-3 месяцев), затяжным (более 3 месяцев). С учетом локализации первичного септического очага и входных ворот различают: пупочный, кожный, легочный, ринофарингеальный, отогенный, риноконъюнктивальный, кишечный, урогенный, катетеризационный и др. виды сепсиса новорожденных. Сепсис новорожденных может протекать в форме септицемии или септикопиемии.
Симптомы сепсиса новорожденных
Септицемия или сепсис новорожденных без метастазов обычно развивается на фоне предшествующего мокнущего пупка, конъюнктивита, гнойничковой сыпи, опрелостей, стоматита. Предвестниками сепсиса новорожденных могут выступать вялость или беспокойство, снижение аппетита, обильные частые срыгивания, плохая прибавка в весе. В период разгара развивается температурная реакция (гипер- или гипотермия), отечный синдром или эксикоз, гипотрофия. Характерным признаком сепсиса новорожденных является грязновато-серый (землистый) оттенок кожных покровов, желтушность, мраморность кожи, сыпь.
Вследствие токсического поражения различных органов возникают гепатоспленомегалия, пневмопатия (тахипноэ, цианоз), кардиопатия (тахикардия или брадикардия, артериальная гипотензия), диспепсия, мочевой синдром (олигурия, анурия, ОПН), геморрагический синдром, надпочечниковая недостаточность. Чаще всего септицемия осложняется присоединением пневмонии, которая выступает как самостоятельное интеркуррентное заболевание.
Септикопиемия или сепсис новорожденных с гнойными метастазами характеризуется возникновением на фоне интоксикации вторичных очагов отсева в мозговых оболочках, легких, костях, печени, других органах. Чаще всего септикопиемия протекает с развитием гнойного менингита, абсцедирующей пневмонии, остеомиелита; реже – с формированием абсцесса печени, гнойного артрита, панофтальмита, медиастинита, флегмоны желудка или кишечника. В восстановительном периоде происходит санация пиемических очагов, стихание токсикоза, постепенное восстановление нарушенных функций.
Молниеносная форма сепсиса новорожденных протекает с развитием септического шока: стремительным ухудшением состояния ребенка, снижением температуры тела, брадикардией, кровоточивостью, отеком легких, острой почечной недостаточностью. Летальный исход при молниеносном течении сепсиса новорожденных наступает в течение 3-5 суток.
Диагностика сепсиса новорожденных
Диагноз сепсиса новорожденного может быть заподозрен неонатологом или педиатром на основании лихорадки свыше 3 дней или прогрессирующей гипотермии; гиперлейкоцитоза, сменяющегося лейкопенией; повышением содержания в крови маркеров инфекционного процесса (СРБ, интерлейкина-8, прокальцитонина).
Факт бактериемии при сепсисе новорожденных подтверждается путем посева крови на стерильность. Важное значение имеет выявление первичного гнойного очага и метастатических очагов, микробиологического исследование отделяемого из них (бактериологическое исследование мазка с конъюнктивы, мочи на микрофлору, соскоба/отделяемого с кожи на микрофлору, мазка из глотки, кала на дисбактериоз и т. п.).
Дифференциальная диагностика сепсиса новорожденных осуществляется с локализованными гнойно-воспалительными заболеваниями (пневмонией, медиастинитом, перитонитом, менингитом, энтероколитом), генерализованными вирусными инфекциями (цитомегалией, герпесом, энтеровирусной инфекцией) и микозами (кандидозом, аспергиллезом) и др. Для этого используются дополнительные лабораторные методы – ПЦР, ИФА, микроскопия.
Лечение сепсиса новорожденных
Терапия при сепсисе новорожденных проводится одновременно в нескольких направлениях и включает санацию септического и пиемических очагов, подавление циркуляции возбудителя в крови, коррекцию нарушенных функций.
Основу этиологического лечения сепсиса новорожденных составляет антибиотикотерапия: эмпирическая комбинированная до уточнения характера микрофлоры) и целенаправленная после получения антибиотикограммы. Противомикробные препараты вводятся внутривенно, в максимальных возрастных дозировках в течение 10-15 суток с последующей сменой. Чаще всего в клинической практике для лечения сепсиса новорожденных в различных сочетаниях используются цефалоспорины, аминогликозиды, аминопенициллины, карбапенемы и др.
С целью местного лечения гнойных очагов производится вскрытие фурункулов и абсцессов, перевязки с антибактериальными и ферментными препаратами; назначается УВЧ, СВЧ, электрофорез.
Патогенетическая терапия сепсиса новорожденных включает иммунокоррекцию (плазмаферез, гемосорбцию, введение иммуноглобулинов), проведение дезинтоксикационной терапии (внутривенной инфузии глюкозо-солевых растворов и свежезамороженной плазмы), адекватную кислородотерапию и т. д. При сепсисе новорожденных обязательно проводится мониторинг состояния жизненно-важных функций: АД, ЧСС, ЭКГ, КОС и газового состава крови, биохимических показателей (сахара крови, креатинина, электролитов), гематокрита.
В остром периоде сепсиса целесообразно пребывание новорожденных в кувезе, кормление материнским молоком, тщательный уход. В восстановительном периоде к лечению подключается гимнастика, массаж, лечебные ванны.
Прогноз и профилактика сепсиса новорожденных
Прогноз сепсиса новорожденных серьезный: летальность составляет от 30-40% до 60% среди глубоко недоношенных детей. У выздоровевших детей в отделенном периоде могут отмечаться частые ОРВИ, пиелонефрит, анемия, перинатальная энцефалопатия.
Профилактика сепсиса новорожденных включает выявление и санацию инфекций мочеполовой сферы у беременной, соблюдение противоэпидемических мероприятий медперсоналом родильных домов и отделений новорожденных, тщательный гигиенических уход за новорожденным, естественное вскармливание. Вопрос о сроках вакцинации новорожденных с сепсисом против туберкулеза и против гепатита В , проводимой в первые дни жизни, решается в индивидуальном порядке.
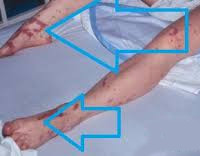
Септический шок – это тяжелое патологическое состояние, возникающее при массивном поступлении в кровь бактериальных эндотоксинов. Сопровождается тканевой гипоперфузией, критическим снижением артериального давления и симптомами полиорганной недостаточности. Диагноз ставится на основании общей клинической картины, сочетающей в себе признаки поражения легких, сердечно-сосудистой системы (ССС), печени и почек, централизации кровообращения. Лечение: массивная антибиотикотерапия, инфузия коллоидных и кристаллоидных растворов, поддержание деятельности ССС за счёт введения вазопрессоров, коррекция респираторных нарушений путем ИВЛ.
МКБ-10
Общие сведения
Септический шок (СШ) также называют инфекционно-токсическим (ИТШ). Как самостоятельная нозологическая единица патология впервые была описана в XIX веке, однако полноценное изучение с разработкой специфических противошоковых мер началось не более 25 лет назад. Может возникать при любом инфекционном процессе. Наиболее часто встречается у пациентов хирургических отделений, при менингококковой септицемии, брюшном тифе, сальмонеллезе и чуме. Распространен в странах, где диагностируется наибольшее количество бактериальных и паразитарных заболеваний (Африка, Афганистан, Индонезия). Ежегодно от ИТШ погибает более 500 тысяч человек по всему миру.

Причины
В абсолютном большинстве случаев патология развивается на фоне ослабления иммунных реакций. Это происходит у пациентов, страдающих хроническими тяжелыми заболеваниями, а также у людей пожилого возраста. В силу физиологических особенностей сепсис чаще диагностируется у мужчин. Список самых распространенных заболеваний, при которых могут возникать явления ИТШ, включает в себя:
- Очаги гнойной инфекции. Признаки системной воспалительной реакции и связанных с ней нарушений в работе внутренних органов отмечаются при наличии объемных абсцессов или флегмоны мягких тканей. Риск генерализованного токсического ответа повышается при длительном течении болезни, отсутствии адекватной антибактериальной терапии и возрасте пациента старше 60 лет.
- Длительное пребывание в ОРИТ. Госпитализация в отделение реанимации и интенсивной терапии всегда сопряжена с риском возникновения сепсиса и инфекционного шока. Это обусловлено постоянным контактом с резистентной к антибактериальным препаратам микрофлорой, ослаблением защитных сил организма в результате тяжёлой болезни, наличием множественных ворот инфекции: катетеров, желудочных зондов, дренажных трубок.
- Раны. Нарушения целостности кожных покровов, в том числе возникшие во время операции, существенно повышают риски инфицирования высококонтагиозной флорой. ИТШ начинается у больных с загрязненными ранами, не получивших своевременной помощи. Травматизация тканей в ходе оперативного вмешательства становится причиной генерализованной инфекции только при несоблюдении правил асептики и антисептики. В большинстве случаев септический шок возникает у пациентов, перенесших манипуляции на желудке и поджелудочной железе. Еще одна распространенная причина – разлитой перитонит.
- Приём иммунодепрессантов. Лекарственные средства, угнетающие иммунитет (меркаптопурин, кризанол), используются для подавления реакции отторжения после трансплантации органов. В меньшей степени уровень собственной защиты снижается при употреблении химиотерапевтических средств – цитостатиков, предназначенных для лечения онкологических заболеваний (доксорубицина, фторурацила).
- СПИД.ВИЧ-инфекция в стадии СПИДа приводит к развитию нетипичного сепсиса, спровоцированного не бактериальный культурой, а грибком рода Candida. Клинические проявления болезни характеризуется малой степенью выраженности. Отсутствие адекватного иммунного ответа позволяет патогенной флоре свободно размножаться.
Возбудитель сепсиса – грамположительные (стрептококки, стафилококки, энтерококки) и грамотрицательные (Enterobacter cloacae, Clostridium pneumoniae) бактерии. Во многих случаях культуры нечувствительны к антибиотикам, что затрудняет лечение пациентов. Септический шок вирусного происхождения в настоящее время вызывает споры специалистов. Одни представители научного мира утверждают, что вирусы неспособны стать причиной патологии, другие – что внеклеточная форма жизни может спровоцировать системную воспалительную реакцию, являющуюся патогенетической основой ИТШ.
Патогенез
В основе симптомов лежит неконтролируемое распространение медиаторов воспаления из патологического очага. При этом происходит активация макрофагов, лимфоцитов и нейтрофилов. Возникает синдром системного воспалительного ответа. На фоне этого снижается периферический сосудистый тонус, объем циркулирующей крови падает за счет повышения проницаемости сосудов и застоя жидкости в микроциркуляторном русле. Дальнейшие изменения обусловлены резким уменьшением перфузии. Недостаточное кровоснабжение становится причиной гипоксии, ишемии внутренних органов и нарушения их функции. Наиболее чувствителен головной мозг. Кроме того, ухудшается функциональная активность легких, почек и печени.
Помимо СВР в формировании септического шока важную роль играет эндогенная интоксикация. В связи со снижением работоспособности экскреторных систем в крови накапливаются продукты нормального обмена веществ: креатинин, мочевина, лактат, гуанин и пируват. Во внутренних средах повышается концентрация промежуточных результатов окисления липидов (скатол, альдегиды, кетоны) и бактериальных эндотоксинов. Всё это вызывает тяжелые изменения гомеостаза, расстройства кислотно-щелочного баланса, нарушения в работе рецепторных систем.
Классификация
Симптомы септического шока
90% случаев СШ сопровождается дыхательной недостаточностью различной степени тяжести. Пациенты с декомпенсированным и терминальным течением болезни нуждаются в аппаратной респираторной поддержке. Печень и селезенка увеличены, уплотнены, их функция нарушена. Может отмечаться атония кишечника, метеоризм, стул с примесью слизи, крови и гноя. На поздних стадиях возникают симптомы диссеминированного внутрисосудистого свертывания: петехиальная сыпь, внутреннее и наружное кровотечения.
Осложнения
Септический шок приводит к ряду тяжелых осложнений. Наиболее распространённым из них считается полиорганная недостаточность, при которой нарушается функция двух и более систем. В первую очередь страдает ЦНС, легкие, почки и сердце. Несколько реже встречается поражение печени, кишечника и селезенки. Летальность среди пациентов с ПОН достигает 60%. Часть из них погибает на 3-5 сутки после выведения из критического состояния. Это обусловлено органическими изменениями во внутренних структурах.
Еще одним распространенным последствием ИТШ являются кровотечения. При формировании внутримозговых гематом у пациента развивается клиника острого геморрагического инсульта. Скопление экстравазата в других органах может приводить к их сдавлению. Уменьшение объема крови в сосудистом русле потенцирует более значимое снижение артериального давления. ДВС на фоне инфекционно-токсического шока становится причиной гибели пациента в 40-45% случаев. Вторичное поражение органов, спровоцированное микротромбозами, возникающими на начальном этапе формирования коагулопатии, отмечается практически у 100% больных.
Диагностика
- Осмотр и физикальное исследование. Реализуется непосредственно лечащим врачом. Специалист обнаруживает характерные клинические признаки шокового состояния. Для этого проводится тонометрия, визуальная оценка цвета кожных покровов, особенностей дыхательных движений, подсчет пульса и ЧДД, аускультация сердца и легких. При подозрении на наличие осложнений необходима оценка неврологического статуса на предмет симптоматики кровоизлияния в мозг.
- Аппаратное исследование. Имеет вспомогательное значение. Пациенту показан контроль состояния с использованием анестезиологического монитора. На экран устройства выводится информация о величине артериального давления, частоте сердечных сокращений, степени насыщения крови кислородом (при легочной недостаточности SpO2<90%) и коронарном ритме. На фоне нарушений дыхания и токсического поражения миокарда может отмечаться тахикардия, аритмия и блокады внутрисердечной проводимости.
- Лабораторное исследование. Позволяет выявить имеющиеся нарушения гомеостаза, сбои в работе внутренних органов. У пациентов с шоком септического происхождения обнаруживается повышенный уровень креатинина (> 0,177 ммоль/л), билирубина (>34,2 мкмоль/л), лактата (>2 ммоль/л). О нарушении коагуляции свидетельствует тромбоцитопения (
Лечение септического шока
Пациентам показана интенсивная терапия. Лечение проводят в отделениях ОРИТ с использованием методов аппаратной и медикаментозной поддержки. Лечащий врач – реаниматолог. Может потребоваться консультация инфекциониста, кардиолога, гастроэнтеролога и других специалистов. Требуется перевод больного на искусственную вентиляцию лёгких, круглосуточное наблюдение среднего медицинского персонала, парентеральное кормление. Смеси и продукты, предназначенные для введения в желудок, не используются. Все методы воздействия условно делятся на патогенетические и симптоматические:
- Патогенетическое лечение. При подозрении на наличие сепсиса больному назначают антибиотики. Схема должна включать в себя 2-3 препарата различных групп, обладающих широким спектром действия. Подбор медикамента на начальном этапе проводят эмпирическим путем, в соответствии с предполагаемой чувствительностью возбудителя. Одновременно с этим производят забор крови на стерильность и восприимчивость к антибиотикам. Результат анализа готовится в течение 10 дней. Если к этому времени подобрать эффективную лекарственную схему не удалось, следует использовать данные исследования.
- Симптоматическое лечение. Подбирается с учетом имеющейся клинической картины. Обычно больные получают массивную инфузионную терапию, глюкокортикостероиды, инотропные средства, антиагреганты или гемостатики (в зависимости от состояния свертывающей системы крови). При тяжелом течении болезни используют препараты крови: свежезамороженную плазму, альбумин, иммуноглобулины. Если пациент находится в сознании, показано введение анальгетических и седативных лекарств.
Прогноз и профилактика
Септический шок имеет неблагоприятный прогноз для жизни. При субкомпенсированном течении погибает около 40% больных. Декомпенсированная и терминальная разновидности оканчиваются гибелью 60% пациентов. При отсутствии своевременной медицинской помощи смертность достигает 95-100%. Часть больных умирает через несколько дней после устранения патологического состояния. Профилактика ИТШ заключается в своевременном купировании очагов инфекции, грамотном подборе антибиотикотерапии у хирургических больных, соблюдении антисептических требований в отделениях, занимающихся инвазивным манипуляциями, поддержке адекватного иммунного статуса у представителей ВИЧ-инфицированной прослойки населения.
2. Тактика ведения пациентов с сепсисом и септическим шоком в многопрофильном стационаре/ Сапичева Ю.Ю., Лихванцев В.В. – 2015.
Читайте также:

