Лечение туберкулеза легких барсучьим жиром отзывы
Обновлено: 17.04.2024
Какие возможны варианты туберкулеза легких по отношению к лекарственному лечению? Какова роль фторхинолонов в лечении туберкулеза легких?
Какие возможны варианты туберкулеза легких по отношению к лекарственному лечению?
Какова роль фторхинолонов в лечении туберкулеза легких?
Таблица. Стандартные концентрации ПТП, используемые для выявления лекарственной устойчивости МБТ
Первый этап характеризуется проведением интенсивной насыщенной химиотерапии четырьмя-пятью ПТП в течение 2-3 месяцев, что ведет к подавлению размножающейся микобактериальной популяции, уменьшению ее количества и предотвращению развития лекарственной резистентности. На первом этапе используется комбинация препаратов, состоящая из изониазида, рифампицина, пиразинамида, стрептомицина и/или этамбутола.
Второй этап — менее интенсивной химиотерапии — проводится, как правило, двумя-тремя ПТП. Цель второго этапа — воздействие на оставшуюся бактериальную популяцию, в большинстве своем находящуюся внутриклеточно в виде персистирующих форм микобактерий. Здесь главной задачей является предупреждение размножения оставшихся микобактерий, а также стимуляция репаративных процессов в легких с помощью различных патогенетических средств и методов лечения.
Такой методический подход к лечению ЛЧТЛ позволяет к концу первого этапа комбинированной химиотерапии под непосредственным медицинским наблюдением абациллировать 100%, а к завершению всего курса лечения — закрыть каверны в легких у более чем 80% больных с впервые выявленным и рецидивным туберкулезом легких [5].
Намного сложнее вопрос о проведении этиотропного лечения второго варианта, к которому мы относим ЛУТЛ, вызванный лекарственно резистентными (ЛР) МБТ к одному и более ПТП и/или их сочетанию. Особенно тяжело протекает ЛУТЛ у больных с множественной ЛР МБТ к изониазиду и рифампицину, то есть к основным и самым эффективным ПТП. Поэтому поиск новых концептуальных путей повышения эффективности лечения ЛУТЛ и разработка современной методологии специфического воздействия на ЛР МБТ является одним из важнейших и приоритетных направлений современной фтизиатрии.
Развитие ЛР у МБТ к ПТП — одна из главных причин недостаточно эффективной этиотропной химиотерапии. Больные туберкулезом, выделяющие ЛР-штаммы МБТ, длительное время остаются бактериовыделителями и могут заражать окружающих ЛР-возбудителем. Чем больше число больных, выделяющих ЛР МБТ, тем выше риск распространения инфекции среди здоровых лиц и появления новых случаев заболевания туберкулезом с первичной резистентностью не только к основным, но и к резервным ПТП.
Феномен ЛР МБТ имеет важное клиническое значение. Существует тесная взаимосвязь количественных изменений микобактериальной популяции и изменения ряда биологических свойств МБТ, одним из которых является ЛР. В активно размножающейся бактериальной популяции всегда имеется небольшое количество ЛР-мутантов, которые практического значения не имеют, но по мере уменьшения бактериальной популяции под влиянием химиотерапии изменяется соотношение между количеством ЛР и устойчивых МБТ [5]. В этих условиях происходит размножение главным образом устойчивых МБТ, эта часть бактериальной популяции увеличивается. Следовательно, в клинической практике необходимо исследовать ЛР МБТ и результаты этого исследования сопоставлять с динамикой туберкулезного процесса в легких [5].
По определению экспертов ВОЗ [3], ЛУТЛ — это случай туберкулеза легких с выделением МБТ, резистентных к одному и более ПТП. По данным Центрального НИИ туберкулеза РАМН, у каждого второго впервые выявленного и ранее не леченного противотуберкулезными препаратами больного в мокроте выявлялись ЛР к ПТП МБТ, при этом у 27,7% из них наблюдалась устойчивость к двум основным противотуберкулезным препаратам — изониазиду и рифампицину. При хроническом фиброзно-кавернозном туберкулезе частота вторичной ЛР МБТ возрастает до 95,5%.
По нашему мнению, и это составляет основу нашей концепции, для повышения эффективности лечения туберкулеза, вызванного ЛР МБТ, необходимо в первую очередь использовать ускоренные методы выявления ЛР МБТ, что позволяет своевременно изменять режим химиотерапии.
Исследование лекарственной устойчивости МБТ в настоящее время возможно по прямому и непрямому методам.
Непрямой метод определения лекарственной чувствительности МБТ требует от 30 до 60, а иногда до 90 суток, ввиду того что вначале производится посев мокроты на твердые питательные среды и только после получения культуры МБТ производят ее пересев уже на среды с добавлением ПТП. При этом коррекция химиотерапии носит отсроченный характер, как правило, уже на конечном этапе интенсивной фазы химиотерапии.
В последнее время для ускоренного определения лекарственной устойчивости нами применялся радиометрический метод с использованием автоматической системы ВАСТЕС-460 ТВ (Becton Dickinson Diagnostic Systems, Sparks, MD), которая позволяет выявлять лекарственную резистентность МБТ на жидкой среде Middlebrook 7H10 через 6-8 дней.
Не менее важно правильное лечение впервые выявленных больных туберкулезом легких и применение современных режимов химиотерапии с использованием в начале лечения комбинации из четырех-пяти основных противотуберкулезных препаратов до получения результатов лекарственной устойчивости МБТ [2]. В этих случаях существенно повышается вероятность того, что даже при наличии первичной ЛР МБТ бактериостатическое действие окажут два или три химиопрепарата, к которым чувствительность сохранена. Именно несоблюдение фтизиатрами научно обоснованных комбинированных режимов химиотерапии при лечении впервые выявленных и рецидивных больных и назначение ими только трех ПТП является грубой врачебной ошибкой, что в конечном счете ведет к формированию наиболее трудно поддающейся лечению вторичной ЛР МБТ.
Наличие у больного туберкулезом легких ЛР МБТ существенно снижает эффективность лечения, приводит к появлению хронических и неизлечимых форм, а в ряде случаев и летальных исходов. Особенно тяжело протекают специфические поражения легких у больных с полирезистентными МБТ, которые обладают множественной ЛР, как минимум к изониазиду и рифампицину, т. е. к основным и самым активным противотуберкулезным препаратам. ЛР МБТ имеет не только чисто клиническое и эпидемиологическое, но и экономическое значение, так как лечение таких больных резервными ПТП обходится намного дороже, чем больных с чувствительными МБТ к основным химиопрепаратам.
В этих условиях расширение списка резервных ПТП, воздействующих на ЛР МБТ, является актуальным и крайне важным для повышения эффективности лечения больных с ЛУТЛ. Кроме того, присоединение к ЛУТЛ неспецифической бронхолегочной инфекции существенным образом утяжеляет течение специфического процесса в легких, требуя назначения дополнительных антибиотиков широкого спектра. В этом плане применение антибиотиков, воздействующих как на МБТ, так и на неспецифическую патогенную бронхолегочную микрофлору, является научнообоснованным и целесообразным.
В этом плане хорошо себя зарекомендовал в России такой препарат из группы фторхинолонов, как офлоксацин (таривид) [3]. Мы же свой выбор остановили на ломефлоксацине, как препарате, который еще не столь широко применяется при лечении туберкулеза и у которого, судя по имеющимся данным, практически не выявляются побочные эффекты и крайне редко формируется ЛР возбудителей инфекционных заболеваний [2].
Ломефлоксацин (максаквин) — антибактериальный препарат из группы фторхинолонов. Как и все представители производных оксихинолонкарбоновой кислоты, максаквин обладает высокой активностью против грамположительных (включая метициллин-устойчивые штаммы Staphylococcus aureus и Staphylococcus epidermidis) и грамотрицательных (включая Pseudomonas) микроорганизмов, в том числе по отношению к различным типам Micobacterium tuberculosis).
Механизм действия максаквина заключается в ингибировании хромосомной и плазмидной ДНК-гиразы, фермента, ответственного за стабильность пространственной структуры микробной ДНК. Вызывая деспирилизацию ДНК микробной клетки, максаквин ведет к гибели последней.
Максаквин обладает иным механизмом действия, нежели другие антибактериальные средства, поэтому к нему не существует перекрестной устойчивости с другими антибиотиками и химиотерапевтическими препаратами [2].
Основной целью настоящего исследования явилось изучение клинической и микробиологической эффективности максаквина при комплексном лечении больных деструктивным ЛУТЛ, выделяющих ЛР МБТ к изониазиду, рифампицину и другим ПТП, а также при сочетании туберкулеза с неспецифической бронхолегочной инфекцией.
Под наблюдением находилось 50 больных деструктивным ЛУТЛ, выделяющих с мокротой ЛР МБТ к изониазиду, рифампицину и ряду других ПТП. Эти люди в возрасте от 20 до 60 лет составили основную группу.
В контрольную группу вошли также 50 больных деструктивным ЛУТЛ легких в той же возрастной группе, выделяющие ЛР МБТ к изониазиду, рифампицину и другим ПТП. Эти пациенты лечились только протионамидом, амикацином, пиразинамидом и этамбутолом.
У 47 больных основной группы и 49 контрольной в мокроте микробиологическими методами были выявлены различные возбудители неспецифической бронхолегочной инфекции.
Среди больных основной группы диссеминированный туберкулез был установлен у 5 человек, инфильтративный — у 12, казеозная пневмония — у 7, кавернозный — у 7 и фиброзно-кавернозный туберкулез — у 17 человек. Большинство больных (45 пациентов) имели распространенный туберкулез легких с поражением более двух долей, у 34 больных был двусторонний процесс. У всех больных основной группы в мокроте были обнаружены МБТ, как методом микроскопии по Цилю — Нильсену, так и методом посева на питательные среды. При этом у них МБТ были устойчивы как минимум к изониазиду и рифампицину. Необходимо отметить, что все пациенты уже ранее неоднократно и неэффективно лечились основными ПТП, и специфический процесс у них приобрел рецидивирующий и хронический характер.
В клинической картине преобладали симптомы интоксикации с высокой температурой тела, потливостью, адинамией, изменениями в крови воспалительного характера, лимфопенией, увеличенной СОЭ до 40-50 мм в час. Следует отметить наличие грудных проявлений болезни — кашель с выделением мокроты, подчас значительного количества, слизисто-гнойной, а у половины больных — гнойной, с неприятным запахом. В легких выслушивались обильные катаральные явления по типу мелко-, средне-, а подчас и крупнопузырчатых влажных хрипов.
У большинства больных преобладали клинические проявления, которые скорее укладывались в картину неспецифического бронхолегочного поражения (бронхита, острой пневмонии, абсцедирования) с частыми и практически не стихающими обострениями.
Основным возбудителем неспецифической инфекции был Streptococcus hemoliticus — у 15,3% и Staphilococcus aureus — у 15% больных. Среди грамотрицательной микрофлоры преобладал Enterobacter cloacae в 7,6% случаев. Следует отметить высокую частоту ассоциации возбудителей неспецифической бронхолегочной инфекции.
МБТ были обнаружены у всех 50 больных. У 42 человек определялось обильное бактериовыделение. У всех пациентов выделенные штаммы МБТ были устойчивы к изониазиду и рифампицину. При этом у 31 больного лекарственная устойчивость МБТ к изониазиду и рифампицину сочеталась с другими ПТП.
Определение минимальной ингибирующей концентрации (МИК) максаквина проводили на лабораторных штаммах H37Rv и Academia, а также клинических штаммах (изолятах), выделенных от 30 больных, из которых 12 изолятов были чувствительны ко всем основным химиопрепаратам и 8 обладали резистентностью к изониазиду, рифампицину и стрептомицину. В опытах in vitro подавление роста лабораторных штаммов МБТ наблюдалось в зоне 57,6±0,04 до 61,8±0,02 мкн/мл, что почти в семь раз больше, чем показатели, характерные для остальных ПТП .
Таким образом, в ходе микробиологических исследований было установлено выраженное бактериологическое действие максаквина на МБТ, при этом более выраженный эффект наблюдался при его воздействии на лекарственно чувствительные штаммы и изоляты. Однако при повышенных концентрациях максаквина эффект также заметен при воздействии на полирезистентные МБТ, устойчивые к основным ППТ.
Лечение максаквином проводилось у всех 50 больных основной группы в разработанной нами комбинации с другими резервными препаратами: протионамидом, амикацином, пиразинамидом и этамбутолом.
Максаквин назначали в дозе 800 мг в сутки перорально однократно в утренние часы сразу вместе с другими противотуберкулезными препаратами для создания максимальной суммарной бактериостатической концентрации в крови и очагах поражения. Доза максаквина выбрана с учетом микробиологических исследований и соответствовала МИК, при которой отмечалось существенное подавление роста МБТ. Терапевтический эффект определяли через месяц — для оценки воздействия его на неспецифическую патогенную бронхолегочную микрофлору и через два месяца — для оценки воздействия на полирезистентные МБТ. Длительность курса лечения резервными химиопрепаратами в сочетании с максаквином составляла два месяца.
Через месяц комплексного лечения было отмечено значительное улучшение состояния больных основной группы, что проявлялось в уменьшении количества мокроты, кашля и катаральных явлений в легких, снижении температуры тела, при этом более чем у двух третей больных — до нормальных цифр.
У всех больных к этому сроку в мокроте перестал определяться рост вторичной патогенной бронхолегочной микрофлоры. К тому же у 34 больных значительно уменьшилась массивность выделения микобактерий туберкулеза. Практически у всех больных нормализовались анализы крови.
Следует отметить, что у 28 пациентов рентгенологически через месяц лечения максаквином в сочетании с протионамидом, амикацином, пиразинамидом и этамбутолом отмечалось частичное рассасывание специфических инфильтративных изменений в легких, а также существенное уменьшение перикавитарной воспалительной реакции. Это позволило применить на данном этапе искусственный пневмоторакс, который является обязательным методом в лечении ЛУТЛ и составляет вторую и не менее важную часть нашей концепции повышения эффективности лечения больных деструктивным туберкулезом легких, выделяющих полилекарственнорезистентные МБТ.
При анализе эффективности специфического действия комбинации резервных противотуберкулезных препаратов в сочетании с максаквином на полирезистентные МБТ при лечении 50 больных основной группы мы делали основной акцент на показатель прекращения бактериовыделения, как по микроскопии мокроты по Цилю — Нильсену, так и по посеву на питательные среды через два месяца после химиотерапии.
Анализ частоты прекращения бактериовыделения у больных основной и контрольной группы через два месяца лечения показал, что у пациентов, получавших максаквин в сочетании с протионамидом, амикацином, пиразинамидом и этамбутолом, прекращение бактериовыделения было достигнуто в 56% случаях. В контрольной группе больных, не получавших максаквина, — только в 30% случаев.
Следует отметить, что у остальных больных основной группы за этот период времени существенно уменьшилась массивность выделения МБТ.
Инволюция локальных изменений в легких у 50 больных контрольной группы также шла более замедленными темпами, и только у 25 больных к концу второго месяца удалось достичь частичного рассасывания перикавитарной инфильтрации и применить к ним искусственный пневмоторакс. К 39 из 50 пациентов основной группы был применен искусственный пневмоторакс в течение 1,5-2 месяцев, и 17 из них удалось достигнуть закрытия каверн в легких. 11 оставшихся больных, имеющих противопоказания к проведению искусственного пневмоторакса, в этот период были подготовлены к плановому оперативному вмешательству.
При определении лекарственной устойчивости МБТ к максаквину через два месяца лечения у больных основной группы только в 4% случаев была получена вторичная лекарственная устойчивость, сформировавшаяся в процессе двухмесячной химиотерапии, что в конечном итоге потребовало его отмены и замены на другой химиопрепарат, к которому МБТ сохранили свою чувствительность.
К концу второго месяца у 4% больных отмечались явления непереносимости максаквина — в виде диспепсических явлений и диареи, связанной с дисбактериозом, аллергических кожных проявлений и эозинофилии до 32%, что привело к полной отмене препарата. Во всех остальных случаях при двухмесячном ежедневном применении максаквина в суточной дозе 800 мг побочных явлений не отмечалось.
Проведенная после окончания курса лечения максаквином комбинированная химиотерапия резервными препаратами и динамическое наблюдение за этими же больными показали, что достигнутый ко второму месяцу положительный результат в абациллировании мокроты оказал положительное влияние и на конечный результат излечения больных с ЛУТЛ.
Таким образом, применение максаквина в дозе 800 мг в сутки в сочетании с протионамидом, амикацином, пиразинамидом и этамбутолом у больных деструктивным ЛУТЛ с сопутствующей неспецифической бронхолегочной инфекцией показало его достаточную эффективность как антибиотика широкого спектра, воздействующего на грамотрицательную и грамположительную микрофлору, и препарата, действующего на туберкулезное воспаление.
Максаквин с полной уверенностью может быть отнесен к группе резервных ПТП. Он эффективно действует не только на МБТ, чувствительные ко всем ПТП, но и на ЛУ МБТ к изониазиду и рифампицину, что и обусловливает целесообразность его назначения таким больным. Тем не менее максаквин не следует рассматривать как основной препарат в схемах лечения больных с впервые выявленным туберкулезом легких, он должен оставаться в резерве и применяться только при ЛУТЛ и сопутствующей неспецифической бронхолегочной инфекции.
Для изониазида это составляет 1 мкг/мл, для рифампицина — 40 мкг/мл, стрептомицина — 10 мкг/мл, этамбутола — 2 мкг/мл, канамицина — 30 мкг/мл, амикацина — 8 мкг/мл, протионамида (этионамида) — 30 мкг/мл, офлоксацина (таривида) — 5 мкг/мл, циклосерина — 30 мкг/мл и для пиразинамида — 100 мкг/мл.
Литература
1. Лечение туберкулеза. Рекомендации для национальных программ. ВОЗ. 1998. 77 с.
2. Мишин. В. Ю., Степанян И. Э. Фторхинолоны в лечении туберкулеза органов дыхания // Русский медицинский журнал. 1999. № 5. С. 234-236.
3. Рекомендации по лечению резистентных форм туберкулеза. ВОЗ. 1998. 47 с.
4. Хоменко А. Г., Мишин В. Ю., Чуканов В. И. и др. Эффективность применения офлоксацина в комплексном лечении больных туберкулезом легких, осложненным неспецифической бронхолегочной инфекцией // Новые лекарственные препараты. 1995. Вып. 11. С. 13-20.
5. Хоменко А. Г. Современная химиотерапия туберкулеза // Клиническая фармакология и терапия. 1998. № 4. С. 16-20.
Ларингофарингеальный рефлюкс (ЛФР) — это заброс желудочного содержимого (кислоты и таких ферментов, как пепсин) в гортань, приводящий к появлению охриплости, ощущению кома в горле, затруднению глотания, кашлю, ощущению слизи в гортаноглотке.
Рефлюкс, как причина вышеописанных симптомов без гастроэзофагеальной рефлюксной болезни (ГЭРБ), постоянно ставится под сомнение. Руководства, выпущенные специализированными обществами в области ларингологии и гастроэнтерологии, представляют разные точки зрения. Обе группы признают, что интерпретация существующих исследований затрудняется из-за неопределенных диагностических критериев ЛФР, различных показателей ответа на лечение и значительного эффекта плацебо при проводимом лечении.
Имеются относительно ограниченные данные о распространенности ЛФР: примерно у 30% здоровых людей могут фиксироваться эпизоды рефлюкса на суточной pH-метрии или обнаруживаться характерные изменения в гортани.
ЛФР может прямо или косвенно вызывать гортанные симптомы. Прямой механизм включает раздражение слизистой оболочки гортани едкими веществами — рефлюксатами (кислота, пепсин). Косвенный механизм включает раздражение пищевода, что приводит к гортанным рефлексам и появлению симптомов.
Инфекция Helicobacter pylori также может вносить свой вклад. Распространенность H. pylori среди пациентов с ЛФР составляет около 44%.
Ларингофангеальный рефлюкс и ГЭРБ
Хотя кислота желудка является общей как для ЛФР, так и для ГЭРБ, существует много различий, что делает ЛФР отдельным клиническим объектом.
- Обязательным условием ГЭРБ является изжога, которая достоверно наблюдается только у 40% пациентов с ЛФР.
- Большинство пациентов с ГЭРБ имеют признаки эзофагита при биопсии, в то время как пациенты с ЛФР только в 25% случаев.
- Считается, что ГЭРБ является проблемой нижнего сфинктера пищевода и возникает в основном в положении лежа. Напротив, ЛФР рассматривается в первую очередь как проблема верхнего сфинктера пищевода, и возникает в основном в вертикальном положении во время физических нагрузок.
- Для формирования ЛФР необходимо гораздо меньшее воздействие кислоты, чем при ГЭРБ.
Между слизистой оболочкой пищевода и гортани есть существенные различия.
- Верхним пределом нормы для кислотного рефлюкса в пищевод считается до 50 эпизодов в день, при этом 4 эпизода заброса рефлюксата в гортань уже не является вариантом нормы.
- В гортани, в отличие от пищевода, который при перистальтике устраняет кислоту, рефлюксат сохраняется намного дольше, вызывая дополнительное раздражение.
- Эпителий гортани тонкий и плохо приспособлен для борьбы с едкими химическими повреждениями от того же пепсина и кислоты.
Симптомы ларингофарингеального рефлюкса
- Дисфония или охриплость; ;
- ощущение кома в горле;
- дискомфорт и ощущение слизи в горле;
- дисфагия (нарушение глотания).
Некоторые исследователи считают, что хроническое раздражение гортани может приводить к развитию карциномы у пациентов, не употребляющих алкоголь или не курящих, хотя данных, подтверждающих это, нет.
Симптомы, характерные для ЛФР, также могут быть обусловлены следующими состояниями:
- постназальный синдром;
- аллергический ринит;
- вазомоторный ринит;
- инфекции верхних дыхательных путей;
- привычное покашливание;
- употребление табака или алкоголя;
- чрезмерное использование голоса;
- изменение температуры или климата;
- эмоциональные проблемы;
- раздражители окружающей среды;
- блуждающая нейропатия.
Диагностика
Существуют значительные разногласия по поводу подходящего способа диагностики ЛФР.
При ларингоскопии (осмотре гортани) отмечается отечность и гиперемия (краснота) различной степени. Однако относительно слабая корреляция между симптомами и эндоскопическими данными является аргументом против использования эндоскопических методов диагностики.
Шкала рефлюксных признаков и индекс рефлюксных симптомов хорошо подходят как для диагностики, так и для мониторинга ответа на терапию.
Суточная Ph-метрия зондом с двойным сенсором, несмотря на превосходную чувствительность и специфичность, ставится под сомнение, так как результаты этого диагностического метода зачастую не коррелируют с тяжестью симптомов.
Еще одним вариантом диагностики может быть эмпирическое назначение терапии ИПП.
Лечение ларингофарингеального рефлюкса
Изменение образа жизни и диета являются основным подходом при лечении ЛФР и ГЭРБ. Роль медикаментозной терапии более противоречива. Нуждаются ли в лечении пациенты без симптомов заболевания, со случайно выявленными признаками ЛФР, неизвестно. Существуют теоретические опасения, что ЛФР может увеличить риск злокачественных новообразований, но это пока не доказано. В любом случае, пациентам с бессимптомный ЛФР рекомендуется соблюдение диеты.
Пациентам рекомендуется отказаться от курения, алкоголя, исключить продукты и напитки, содержащие кофеин, шоколад, мяту. К запрещенным продуктам также относятся большинство фруктов (особенно цитрусовых), помидоры, джемы и желе, соусы для барбекю и большинство заправок для салатов, острая пища. Питание рекомендуется дробное.
Следует избегать физических упражнений в течение как минимум двух часов после еды, воздерживаться от еды и питья за три часа до сна.
Медикаментозная терапия обычно включает ингибиторы протонной помпы (ИПП), блокаторы H2 и антациды. ИПП рекомендуется принимать в течение шести месяцев для большинства пациентов с ЛФР. Данная цифра основана на результатах эндоскопических исследований (именно это время необходимо для уменьшения отека гортани), а также высоком проценте рецидива в случае трехмесячного курса терапии. Прекращение терапии следует проводить постепенно.
Если терапия ИПП и блокаторами Н2 оказалась безуспешна, следует рассмотреть вариант лечения трициклическими антидепрессантами, габапентином и прегабалином, так как один из возможных механизмов развития рефлюкса — повышенная чувствительность гортани.
Как проходит лечение ларингофарингеального рефлюкса в клинике Рассвет?
Все пациенты с жалобами на охриплость, ощущение кома в горле, затруднение глотания, кашель, ощущение слизи в гортаноглотке осматриваются оториноларингологом и гастроэнтерологом.
Проводится эндоскопическое исследование полости носа, носоглотки и гортани для исключения других заболеваний, которые, помимо ЛФР, могут провоцировать эти симптомы. Гастроэнтеролог также назначает весь необходимый спектр обследований, в том числе исключает инфекцию H. Pylori.
Залог успешной терапии — совместное ведение пациента оториноларингологом, гастроэнтерологом, в ряде случаев психиатром и психотерапевтом.
Туберкулез — это инфекционное заболевание, вызываемое бактериями Mycobacterium tuberculosis (M. tuberculosis) и передающееся от человека к человеку воздушно-капельным путем.
При туберкулезе (ТБ) в основном поражаются легкие, однако могут затрагиваться и другие органы и ткани (почки, печень, позвоночник, мозг).
Известны две формы туберкулеза — латентная (скрытая) и активная. При латентном туберкулезе человек инфицирован M. tuberculosis (туберкулиновая проба или анализ крови показывают положительный результат), но его иммунитет справляется с инфекцией, не позволяя бактериям расти и размножаться. Он не заразен, никаких симптомов и характерных изменений в легких не наблюдается. Однако без профилактического лечения у него сохраняется риск заболеть активной формой ТБ позднее в жизни (вследствие активизации и размножения инфекционных агентов — из-за ослабления иммунитета или имеющихся хронических заболеваний).
Заражение туберкулезом при контакте с носителем инфекции происходит не всегда. Нельзя заразиться через рукопожатие, поверхности, к которым прикасался больной, его вещи.
При активном туберкулезе микобактерии в организме человека быстро растут и размножаются, у него проявляются характерные симптомы заболевания, включая кашель, потерю веса и повышенную утомляемость. При отсутствии противотуберкулезного лечения носитель способен заразить туберкулезом всех, кто его окружает: близких, друзей, коллег — все, кто находится в его окружении, подвержены этой опасности.
По оценке Американской ассоциации легких (American Lung Association), около 2 млрд человек или четверть населения мира больны латентным туберкулезом, около 10 млн — активным. Россия — страна с высоким уровнем заболеваемости туберкулезом.
Симптомы
- Сильный кашель в течение 3 недель и дольше;
- кашель с кровью в мокроте;
- боль при вдохе и кашле;
- затрудненное дыхание;
- плохой аппетит;
- потеря веса;
- сильная утомляемость, слабость;
- повышенное потоотделение ночью;
- озноб; .
Когда туберкулез развивается вне легких, клиническая картина различается — в зависимости от того, какой орган поражен. Для туберкулеза позвоночника характерны боли в спине, при туберкулезе почек может наблюдаться кровь в моче.
Группы и факторы риска
Обследование людей с повышенным риском туберкулеза — приоритет систем здравоохранения во всем мире. Лечение пациентов с выявленным ТБ не только помогает сохранить их здоровье, но и контролировать распространение инфекции.
В группу риска по туберкулезу входят:
- люди с ослабленным иммунитетом — пациенты с ВИЧ / СПИД, диабетом;
- пациенты, которые проходят химиотерапию, принимают иммуносупрессоры и другие лекарства для лечения псориаза, ревматоидного артрита, болезни Крона, после трансплантации органа;
- пожилые люди, дети младшего возраста, люди с недостаточным питанием;
- использующие инъекционные наркотические вещества;
- контактирующие с больным туберкулезом;
- проживающие в странах с высоким распространением туберкулеза (Россия, Восточная Европа, Азия, Африка, Латинская Америка);
- врачи определенных специальностей.
Глобальной проблемой здравоохранения во всем мире остается увеличение числа штаммов микобактерий, устойчивых к антибиотикам. Резистентность возникает в случаях, когда антибактериальный препарат, использующийся при лечении ТБ, не может уничтожить все бактерии, на которые он нацелен. Выжившие бактерии становятся устойчивыми не только к конкретному виду антибиотика, но и к другим препаратам этого класса.
Некоторые штаммы туберкулеза устойчивы не только к антибиотикам первого ряда (изониазид, рифампицин), но и к фторхинолонам, амикацину, капремиоцину.
Вместе с тем без действенного лечения туберкулез может приводить к следующим осложнениям: туберкулезу позвоночника, туберкулезному артриту, туберкулезному менингиту, нефротуберкулезу, туберкулезу печени, туберкулезу сердца (чаще наружной соединительной оболочки органа, перикарда).
Диагностика
Диагноз туберкулез устанавливается на основании физикального осмотра, включающего выслушивание дыхательных путей и легких, пальпацию лимфатических узлов, проверку показателей общего состояния.
Рентгенография органов грудной клетки (или КТ) назначается при положительном результате туберкулиновой кожной пробы или иммунологического анализа. Для проверки на лекарственно-устойчивые штаммы ТБ врач может назначить цитологическое исследование мокроты.
Лечение туберкулеза у взрослых и детей
Лечение латентного туберкулеза является профилактическим, его цель — не допустить активации и размножения микобактерий. Препаратами выбора здесь являются изониазид, рифапентин и рифампицин. Монотерапия изониазидом в течение 6-9 месяцев используется все реже, предпочтительны краткосрочные курсы лечения: трехмесячный курс изониазида и рифапентина (1 раз в неделю), четырехмесячный курс рифампицина (ежедневно), трехмесячный курс изониазида и рифампицина (ежедневно). Они эффективны, менее токсичны и имеют более высокий процент завершения лечения по сравнению с длительным курсом монотерапии изониазидом.
Вместе с тем, если краткосрочные схемы недоступны пациенту, назначается лечение изониазидом в течение 6-9 месяцев. Оно эффективно, но сопровождается более высоким риском побочных эффектов. Если пациент контактировал с больным лекарственно-устойчивым туберкулезом, подбирается индивидуальная схема лечения.
При лечении активной формы туберкулеза назначается комбинация антибактериальных препаратов на период от 6 до 12 месяцев. Наиболее распространена следующая схема: изониазид, рифампицин, пиразинамид и этамбутол. Важно: несоблюдение рекомендаций врача и отказ от полного курса лечения могут спровоцировать у пациента развитие лекарственно-устойчивого туберкулеза. Множественная лекарственная устойчивость (МЛУ) при туберкулезе очень опасна и связана с фатальными исходами у пациентов. Лечение МЛУ ТБ может занять от 20 до 30 месяцев, причем нужно понимать, что риск побочных эффектов принимаемых лекарств для пациента возрастает многократно.
Во время лечения пациент периодически должен посещать врача для контроля состояния. Находясь на терапии, в течение нескольких недель (при активной форме ТБ) пациент не должен контактировать с другими людьми.
Беременные женщины с выявленным латентным туберкулезом могут отложить лечение и приступить к нему через 2-3 месяца после родов. Однако женщинам с высоким риском прогрессирования инфекции в активную форму не следует откладывать терапию на основании беременности даже в первом триместре. Для матери и плода отказ от лечения опаснее, чем последствия противотуберкулезной терапии. Хотя используемые препараты проникают через плаценту, их вредное воздействие на плод не доказано. Концентрация лекарств в грудном молоке минимальна, поэтому, если речь идет о препаратах первого ряда, грудное вскармливание не является противопоказанием. Беременным противопоказаны некоторые противотуберкулезные препараты (фторхинолоны, стрептомицин, канамицин, амикацин, капреомицин), поэтому особенности лечения нужно обязательно обсудить с врачом. Особо обсуждается терапия женщин с лекарственно-устойчивым туберкулезом.
Профилактика туберкулеза
Вакцинация — самый надежный метод профилактики инфекционных заболеваний, туберкулез не исключение. Вакцинировать от туберкулеза рекомендуют во всех странах, где распространен ТБ (от нескольких десятков случаев на 100 000 населения и более). Наиболее эффективна вакцинация новорожденных, однако ее можно провести и в более старшем возрасте.
Особенности и преимущества лечения туберкулеза в клинике Рассвет
Обращение к фтизиатру или другим специалистам клиники, которые занимаются диагностикой и лечением туберкулеза, необходимо, если есть подозрение на развитие инфекции. В Рассвете консультируют и родителей детей с измененными кожными пробами — им важно убедиться, что тест ложноположительный и проверить здоровье у всех членов семьи; и пациентов с хроническими заболеваниями — при определенной тактике лечения для них важно исключение активного туберкулезного процесса; и пациентов с диагностированной активной формой туберкулеза, которым необходим подбор адекватной и эффективной схемы терапии или второе мнение по диагнозу.
Врачи Рассвета являются профессионалами высокого уровня, методы диагностики и лечения заболеваний, которые они используют, одобрены во всем мире, их эффективность многократно проверена и доказана. Наши фтизиатры быстро и точно проведут диагностику туберкулеза, подберут оптимальную тактику лечения, разработают индивидуальную схему профилактики осложнений заболевания, при необходимости быстро подключат к вашему лечению коллег других специальностей.
Лечение туберкулеза — процесс длительный и сложный, с высоким риском побочных эффектов, поэтому, к сожалению, не все пациенты заканчивают назначенный врачом курс. Мы бережно поддержим вас на этом трудном пути, постараемся убедить в важности приема необходимых лекарств — во избежание неудачи лечения или формирования антибиотикорезистентности и повышенного риска осложнений.
Иммунотерапия – это новое слово в лечении онкологических заболеваний. В ее основе лежит более детальное понимание взаимодействия организма и опухоли.
В последние несколько лет в лечении онкологии происходит революция, где на помощь традиционной химиотерапии приходит более узконаправленное и эффективное лечение.
Если коротко проследить эволюцию лекарственной терапии злокачественных опухолей, то химиотерапия – это воздействие специальными цитостатическими препаратами на клетки опухоли. Эти препараты поражают в первую очередь клетки, которые быстро делятся. Отсюда прямое следствие, что поражаются не только опухолевые, но и здоровые ткани. Но химиотерапия универсальна и может быть назначена практически при любой опухоли на всех этапах лечения. Следующим ключевым этапом было появление таргетной терапии, которая избирательно воздействует на сигнальные пути межклеточных взаимодействий. Таргетная терапия бьет в определенную мишень, но опухолевые клетки со временем приобретают возможность находить новые пути для своего развития. Возможности применения таргетной терапии ограничены наличием этих мишеней, что в большинстве случаев удается выяснить при проведении иммуногистохимического исследования. Примером таргетной терапии является добавление трастузумаба пациентам с Her-позитивным раком молочной железы.
Лечение рака иммунотерапией
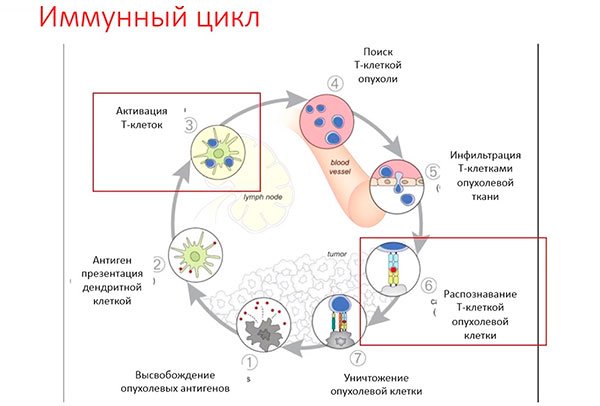
Ответ иммунной системы на опухоль представляет собой цепь реакций, где дефект одного звеньев блокирует весь цикл. В целом этот цикл можно описать так:
Множество опухолевых клеток уничтожается еще до появления клинических признаков рака, а некоторые опухоли находятся в состоянии равновесия с иммунной системой до тех пор, пока какое–либо событие не изменит баланс в ту или иную сторону. Однако опухолевые клетки адаптируются и меняются путем своего естественного развития, чтобы ускользнуть от иммунного ответа.
Сегодня мы можем воздействовать на как минимум 2 звена, запуская этот цикл заново:
Данная терапия сегодня активно изучается и используется в лечении метастатической меланомы, немелкоклеточного рака легких, рака мочевого пузыря, колоректального рака, лимфомы Ходжкина, карциномы Меркеля, рака головы и шеи, печени и некоторых других опухолях в определенных обстоятельствах.
Но, к сожалению, пока она работает лишь в ограниченном числе случаев - 10-30%.
Но в большинстве случаев (более 70%) по тем или иным причинам иммунный ответ не реализуется. В настоящее время ведется множество исследований, направленных на моделирование иммунного ответа.
Одной из отличительных особенностей является то, что если на иммунотерапию возникает ответ, то он часто может быть очень длительным.
-
и витилиго
- энтероколит
- гепатит
- тиреоидит
- пневмонит
- гипофизит
- увеит
- надпочечниковую недостаточность
- нефрит
- артрит и дерматомиозит , аутоиммунный диабет
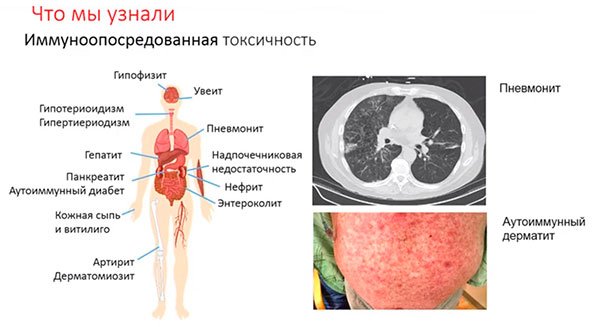
Очень важно, чтобы проведение этой терапии осуществлялось врачами-онкологами, имеющими опыт как проведения данной терапии, так и выявления на ранней стадии этих осложнений и их лечения. Раннее распознавание осложнений позволяет провести эффективное лечение коротким курсом глюкокортикостероидов, однако ряд побочных эффектов может длиться постоянно и требовать заместительной терапии (например, при аутоиммунном поражении щитовидной железы).
Что вы получите от иммунотерапии в клинике Рассвет
В клинике Рассвет проводятся все виды противоопухолевого лечения, в том числе и иммуноонкологичекими препаратами. Наличие у нас врачей практически всех специальностей позволяет привлекать их для решения сложных случаев и совместно обеспечивать лучший контроль над побочными действиями.
Читайте также:

