Лекарство от малярии на основе полыни
Обновлено: 25.04.2024
Артемизинин и его полусинтетические производные представляют собой группу препаратов, используемых против малярии, вызванной паразитом Plasmodium falciparum. Препарат был открыт китайским фармакологом Ту Юю, получившей за это открытие в 2015 году половину Нобелевской премии по медицине и физиологии. Использование лекарств, содержащих производные артемизинина (артемизинин-комбинированные препараты), в настоящее время является стандартом лечения тропической малярии во всем мире.
Артемизинин выделяют из полыни однолетней (Artemisia annua), используемой в традиционной китайской медицине. Соединение-предшественник может быть получено с использованием генетически модифицированных дрожжей.
Механизм действия
Большинство используемых сегодня артемизининов являются химически модифицированными формами биологически активного метаболита дигидроартемизинина, который является активным на стадии, когда паразит находится внутри красных кровяных клеток. Артемизинин оказывают своё действие на паразитов посредством образования свободных радикалов, за счёт наличия у артемизининов эндопероксидного мостика. Когда паразит, который вызывает малярию, заражает эритроцит, он потребляет гемоглобин в пределах своей пищеварительной вакуоли, и этот процесс вызывает оксидативный стресс. В первоначальной теории механизма действия железо непосредственно восстанавливает пероксидную связь артемизинина, генерируя высоко валентные виды оксида железа и в результате происходит целый каскад реакций, которые производят реактивные кислородные радикалы, повреждающие паразитов и приводящие к их смерти. Однако после широкого обсуждения этого механизма появились и другие гипотезы. Одним из вариантов является то, что артемизинин нарушает клеточные окислительно-восстановительные процессы. Артесунат эффективно ингибирует важный для паразита белок — мембранную глутатион S-трансферазу. Недавно был предложен свободно-радикальный механизм, в котором артемизинин активируется вследствие наличия железа в пищевой вакуоли, который, в свою очередь ингибирует кальциевый АТФ-фермент PfATP6 путём прекращения фосфорилирования и нуклеотидного связывания, приводя к потере функции АТФ-фермента PfATP6 паразита и его гибели.
История открытия
Описание
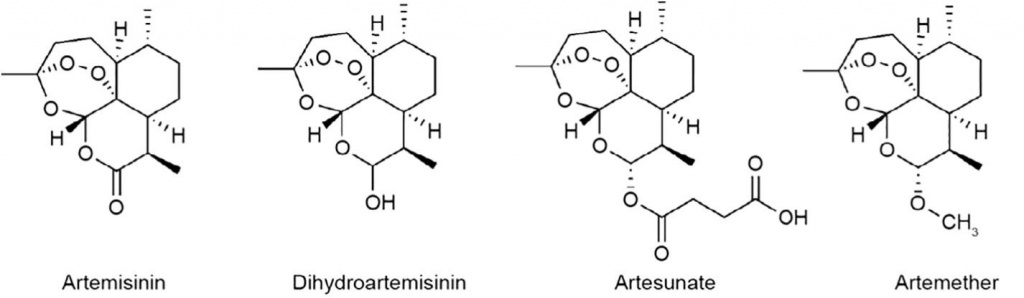
С точки зрения химии артемизинин — это сесквитерпеновый лактон, содержащий необычный пероксидный мостик. Этот пероксидный мостик считается ответственным за механизм действия препарата. Известно очень немного других природных соединений с таким пероксидным мостиком. Наиболее известные производные артемизинина, обладающие ещё большей активностью, чем исходный артемизинин — это дигидроартемизинин, артеметер (жирорастворимый метиловый эфир артемизинина) и артесунат (водорастворимый гемисукцинат дигидроартемизинина).
Артемизинин и его эндопероксидные производные используются для лечения малярии, но их низкая биологическая усвояемость, плохие фармакокинетические характеристики и высокая стоимость препаратов стали основными препятствиями для их использования в качестве монотерапии. Использование препарата в качестве монотерапии не одобряется Всемирной организации здравоохранения, поскольку есть признаки того, что у малярийных паразитов развивается устойчивость к этому препарату. Применение артемизинина или его производных в комбинации с другими противомалярийными препаратами является намного более предпочтительным методом лечения малярии, поскольку оно более эффективно и легче переносится пациентами. Препарат все чаще используется и при лечении трёхдневной малярии, вызванной паразитом Plasmodium vivax. Также ведутся исследования по использованию этого препарата для лечения рака.
Неосложнённая малярия
Артемизинины могут быть использованы в качестве монотерапии, но это приводит к высокой вероятности рецидива заболевания, и для того чтобы очистить организм от всех паразитов и не допустить повторения заболевания, необходимы другие препараты. Всемирная организация здравоохранения (ВОЗ) оказывает давление на производителей лекарств, запрещая им выпускать некомбинированные препараты артемизинина для широкого потребления, понимая, что если у малярийного паразита разовьётся устойчивость к артемизинину и его производным, то это приведёт к катастрофе.
ВОЗ рекомендует использовать артемизинин-комбинированные препараты в качестве приоритетной терапии при лечении тропической малярии во всем мире. Комбинации препаратов являются более эффективными, потому что их компонент артемизинин убивает большинство паразитов в начале лечения, в то время как второй, более медленно выводящийся из организма компонент препарата убивает оставшихся паразитов.
В настоящий момент доступны несколько лекарственных препаратов, содержащих в себе кроме артемизинина и второй компонент, который имеет длительный период полувыведения, например мефлохин, люмефантрин, амодиахин, пиперахин и пиронаридин. Все чаще эти комбинации делаются с использованием стандарта GMP ввиду зачастую низкого качества некоторых продающихся в Африке и Юго-Восточной Азии артемизинин-содержащих препаратов.
Осложнённая малярия
Артесунат, введённый внутривенно или внутримышечно, показал себя более эффективным, чем хинин в больших, случайных, контролируемых испытаниях как у взрослых, так и у детей. В результате этих испытаний выяснилось, что применение артесуната снижает смертность примерно на 30 % по сравнению с хинином. Причины этого различия заключаются в меньшем количестве случаев гипогликемии, более лёгком введении препарата и более быстром действии как против циркулирующих, так и изолированных паразитов. На данный момент артесунат рекомендован ВОЗ для лечения всех случаев осложнённой малярии. Эффективное лечение с применением артемизинин-комбинированных препаратов привело к снижению заболеваемости и смертности от малярии в течение двух лет примерно на 70 %.
Лечение рака
Артемизинин проходит испытания в качестве лекарства для лечения рака. Артемизинин показал противоопухолевый эффект в экспериментальных моделях на гепатоцеллюлярной карциноме. Он имеет пероксидно-лактонную группу в своей структуре, и считается, что, когда пероксид вступает в контакт с высокими концентрациями железа (которые часто встречаются в раковых клетках), молекула становится нестабильной и образуются активные формы кислорода. Было показано, что происходит снижение ангиогенеза и экспрессия фактора роста эндотелия сосудов в некоторых культурах тканей. Последние фармакологические данные свидетельствуют о том, что дигидроартемизинин (производное артемизинина) способен поражать метастатические клетки меланомы человека в пробирке, вызывая митохондриальный апоптоз, что приводит к снижению железо-зависимой генерации цитотоксического окислительного стресса. Экспериментальные исследования по использованию артесуната (производное артемизинина) дали многообещающие результаты для лечения колоректального рака.
Паразитические гельминты
В поисках новых противогельминтных средств для лечения шистосомоза в Китае было сделано открытие, связанное с тем, что артемизинин эффективен против шистосом, человеческих кровяных сосальщиков, которые являются второй наиболее распространённой паразитарной инфекцией после малярии. Артемизинин и все его производные эффективно действует на гельминтов. Позже было обнаружено, что артемизинины обладают широким спектром активности против многих видов трематод, в том числе Schistosoma japonicum, Schistosoma mansoni, Schistosoma haematobium, Clonorchis sinensis, Fasciola hepatica и Opisthorchis viverrini. В Кот-д’Ивуаре и Китае были успешно проведены клинические испытания артемизинина на пациентах с шистосомозом.
Способ применения и дозы
Производные артемизинина имеют период полувыведения порядка одного часа. Таким образом, они требуют по крайней мере многократного ежедневного введения препарата в течение нескольких дней. Например, одобренная ВОЗ доза для взрослых составляет по четыре таблетки артемизин-люмефантрина каждые 12 часов.
Побочные действия
Артемизинины, как правило, хорошо переносятся в дозах, используемых для лечения малярии. Побочные эффекты от препаратов артемизининового класса схожи с симптомами малярии: тошнота, рвота, анорексия, головокружение и лёгкие нарушения крови. Редким, но серьёзным побочным эффектом является аллергическая реакция. Уже сообщалось об одном случае значительного воспаления печени в связи с длительным использованием относительно высоких доз артемизинина.
Меры предосторожности
Устойчивость к артемизинину
Клинические данные относительно устойчивости к артемизинину впервые появились в 2008 году в юго-восточной Азии. В впоследствии они были подтверждены после детального изучения в западной Камбодже. В 2012 году сообщалось об устойчивости к артемизинину в соседнем Таиланде, а в 2014 году такие же данные появились в Камбодже, Вьетнаме, Лаосе, Мьянме и в юго-восточной Азии.
Потенциальная активность против COVID-19
Изучается как потенциальный препарат для лечения пациентов с инфекцией, вызванной коронавирусом SARS-CoV-2 (COVID-19).
Подробнее о лечении COVID-19
Временные методические рекомендации профилактики, диагностики и лечения новой коронавирусной инфекции (COVID-19)*
В список возможных к назначению лекарственных средств для лечения COVID-19 у взрослых включены:
В список препаратов упреждающей противовоспалительной терапии COVID-19 у взрослых включены:
В список возможных к назначению антикоагулянтов для лечения COVID-19 у взрослых включены:
1) антикоагулянты для парентерального введения:
- нефракционированный гепарин: нефракционированный гепарин.
- низкомолекулярные гепарины: далтепарин натрия, надропарин кальция, эноксапарин натрия, парнапарин натрия, бемипарин натрия.
- синтетические антикоагулянты: фондапаринукс натрия.
2) пероральные антикоагулянты:
Смотрите также код МКБ 10:
* См. Версия 15 (22.02.2022) — Временные методические рекомендации профилактики, диагностики и лечения новой коронавирусной инфекции (COVID-19) — Минздрав России.
Лекарства для лечения малярии
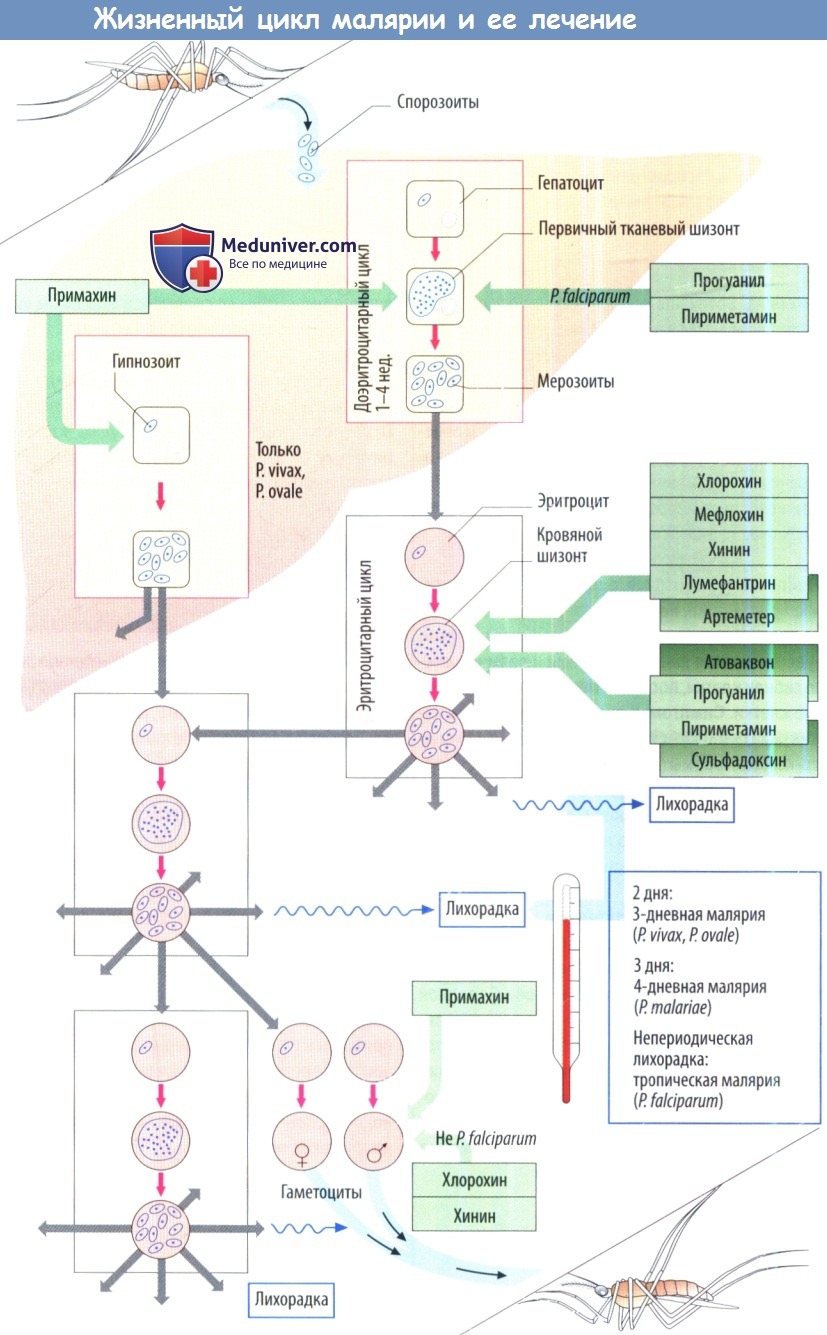
При выборе противомалярийного препарата учитывают переносимость и резистентность плазмодия. Возбудителями малярии являются плазмодии, одноклеточные организмы (отряд Hemosporidia, класс Protozoo).
Заразная форма, спорозоит, проникаете кожные капилляры, когда инфицированная самка москита Anopheles сосет кровь у человека. Спорозоиты проникают в паренхиматозные клетки печени, где развиваются до первичных тканевых шизонтов. При попадании в кровь они превращаются во множество мерозоитов. Доэритроцитарная стадия протекает бессимптомно.
В крови паразит проникает в эритроциты (эритроцитарная стадия), где снова размножается путем шизогонии, что приводит к увеличению числа мерозоитов. При разрыве инфицированных эритроцитов из них высвобождаются мерозоиты и пирогенные вещества. Это вызывает приступ лихорадки, и инфицируется еще больше эритроцитов.
Период образования следующей волны мерозоитов определяет интервал между приступами лихорадки. При Plasmodium vivax и Р. ovale происходит одновременное размножение в печени (параэритроци-тарная стадия). Более того, некоторые спорозоиты могут находиться длительное время в латентном (спящем) состоянии в печени в виде гипнозоитов перед их вступлением в стадию шизогонии.
а) Различные противомалярийные препараты избирательно убивают различные формы паразита на разных стадиях его развития. Хлорохин и хинин накапливаются в закисленных вакуолях кровяных шизонтов и ингибируют полимеризацию гема из захваченного гемоглобина, т. к. свободный гем токсичен для шизонтов.
Пириметамин ингибирует ДГФ-редуктазу простейших, как и хлоргуанид (прогуанил), через активный метаболит циклогуанил. Сульфаниламид сульфадоксин ингибирует синтез дигидрофолиевой кислоты. ДГФ-редуктаза тоже блокируется циклогуанилом, активной формой прогуанила. Атоквавон подавляет синтез пиримидиновых оснований, вероятно, за счет нарушения транспорта электрона в митохондрии. Производные артемесинина (артеметер, артесунат) получают из растения Восточной Азии Qjnghao-su (Artemisia sp.).
По-видимому, антишизонтный эффект включает в себя реакцию междужелезом гема и эпоксидной группой компонентов.
При выборе противомалярийного препарата руководствуются его переносимостью и резистентностью к нему плазмодиев.
б) Переносимость. Самый старый противомалярийный препарат хинидин имеет наименьший терапевтический спектр. Все новые препараты довольно хорошо переносятся.
Для Plasmodium falciparum, вызывающего самую опасную форму малярии, особенно характерно развитие лекарственной резистентности.
Распространенность резистентных штаммов увеличивается при росте частоты использования препарата. Сообщается о резистентности к хлорохину, а также сочетанию пириметамина/сульфадоксина.
При наличии резистентности к классическим противомалярийным препаратам часто эффективен артеметер, вероятно, из-за отличающегося механизма действия.
в) Выбор препарата для противомалярийной профилактики. На территориях с риском малярии постоянный прием противомалярийных препаратов обеспечивает лучшую защиту от заболевания, ноне от инфицирования. Примахин эффективен против первичных тканевых шизонтов всех видов плазмодиев. Однако он не используется для длительной профилактики из-за плохой переносимости и риска резистентности плазмодия.
Вместо него в профилактических схемах используются препараты против гематошизонтов. В зависимости от наличия резистентных штаммов применяют хлорохин, и/или прогуанил, мефлоксин, тетрациклин доксициклин, а также сочетание атоквавона и прогуанила.
Эти препараты не предупреждают (бессимптомное) заражение печени, а защищают только от поражения эритроцитов, вызывающего симптомы заболевания (супрессивная терапия). При возвращении человека из эндемичной по малярии территории достаточно будет провести 2-недельный курс для эрадикации поздних печеночных стадий возбудителя (Р. vivax и Р. ovale).
Защита от укусов москитов (сетками, укрывающими кожу вещами, и т. д.) является очень важной профилактической мерой.
г) Лечение. В противомалярийном лечении используютсяэти жепрепараты.а такжедополнительныеих комбинации: артеметер + лумефантрин или пириметамин + сульфадоксин.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Преамбула:
Артемизинин и его производные представляют собой наиболее важный и действенный класс лекарств среди средств борьбы с малярией. Со времени открытия артемизинина в начале 1970-х годов мировое сообщество добилось больших успехов в характеристике и понимании этого замечательного фитохимического и его уникальных химических и фармакологических свойств. Сегодня, даже несмотря на то, что артемизинин продолжает служить основой для противомалярийной терапии, возникли многочисленные проблемы в продолжающемся применении и разработке этого семейства лекарств. Эти проблемы включают появление отсроченных ответных реакций на лечение артемизининами при малярии и увеличене количества случаев применения артемизининов по показаниям, не связанным с малярией. Здесь мы даем обзор истории артемизинина с точки зрения его прошлого, настоящего и будущего. В частности, мы комментируем современное понимание механизма действия (МОА) артемизининов и подчеркиваем важность связи механистических исследований с терапевтическими исходами как в малярийном, так и в немалярийном контекстах.
2. Путь исследования

3. Поиск механизма воздействия.
Прошло более десяти лет с момента внедрения ACT как официального средства для лечения малярии первой линии и более трех десятилетий с момента открытия артемизинина. За это время клинические и фармакологические характеристики терапии артемизинином были тщательно изучены и опубликованы. Хотя характеристики различных производных могут различаться, артемизининовые препараты характеризуются быстрым действием и эффективностью, низкой токсичностью и коротким периодом полувыведения, что делает комбинированную терапию противомалярийными препаратами пролонгированного действия идеальной и рекомендованной. Помимо его фармакологических свойств, выяснение MOA лекарственного средства является важным для оптимизации схем лечения. Дозировки, комбинации лекарств и даже соображения лекарственной устойчивости тесно связаны с молекулярной основой активности лекарства. Поэтому удивительно, что, несмотря на десятилетия широкого применения, наше понимание МОА артемизинина остается довольно неполным. Здесь мы даем краткий обзор преобладающего понимания, а также последних достижений в механистических исследованиях артемизинина. В целом, выдающиеся терапевтические свойства артемизинина можно рассматривать как результат двух основных процессов: его уникального механизма активации и его последующей активности и мишеней для лекарств. Эти механизмы в совокупности дают высокоэффективный, но в то же время высокоспецифичный препарат.
3.1. Активация лекарства
Артемизинин и его производные представляют собой сесквитерпеновые лактоны, которые несут 1,2,4-триоксановый фрагмент в качестве фармакофора. В частности, хорошо известно, что эндопероксидный мостик в этой группе необходим для фармакологической активности артемизинина. Артемизинины являются пролекарствами в двух смыслах: во-первых, многие производные быстро превращаются в DHA in vivo, и, во-вторых, их MOA зависит от активации путем расщепления эндопероксидного мостика. Механизм этого расщепления остается проблемой в активных исследованиях. Малярийные паразиты характеризуются обширным поглощением и перевариванием гемоглобина на эритроцитарной стадии их жизненного цикла. Это высвобождает обильное количество свободного окислительно - восстановительного гема и свободного двухвалентного железа (Fe2+), которые, как считается, лежат в основе противопаразитарного действия Артемизинина. Действительно, усвоение гемоглобина было тесно связано с восприимчивостью к артемизинину у паразитов. Было предложено несколько моделей в отношении механизма расщепления эндопероксида свободным окислительно-восстановительным гемом или свободным двухвалентным железом, а также последующих молекулярных событий, которые следуют за расщеплением. Эти предложения различаются с точки зрения природы расщепления и идентичности реакционноспособных интермедиатов, продуцируемых активацией лекарственного средства. В общих чертах, однако, они объясняют специфическую для паразитов активацию лекарственного средства, посредством которой образуются реактивные виды, что приводит к повреждению клеток и уничтожению паразита. Последние данные свидетельствуют о том, что свободный редокс - активный гем может играть доминирующую роль в активации лекарств. Исследование 2008 года предоставило данные in vitro, которые показали, что железистый гем может быть более сильным активатором артемизинина, чем другие железосодержащие вещества, включая гемин, свободное железное железо и непереваренный гемоглобин. Аналогичные наблюдения были сделаны на живых паразитах, у которых активация артемизинина блокировалась путем ингибирования переваривания гемоглобина, но не путем хелатирования свободного двухвалентного железа. Таким образом, процесс усваивания гемоглобина в инфицированных эритроцитах, необходимый для роста паразитов, является ключом к специфичности активации артемизинина. Интересно, что в исследованиях с использованием дрожжевых клеток в качестве посредника для малярийных паразитов было обнаружено, что митохондрии непосредственно участвуют как в активации, так и при действии артемизинина, таким образом, дополнительно связывая действие артемизинина с реактивными окислительными видами (АФК) производственный и окислительный ущерб. Также возможно, что множественные избыточные пути активации могут существовать в разных средах или местах, где условия и величина активации могут отличаться. Заглядывая в будущее, будет крайне важно рассмотреть основную роль активации лекарств в активности артемизинина и дополнительно выяснить его механизмы в различных условиях.
3.2. Нижерасположенный механизм
Перепрофилирование артемизинина
Артемизинины - это класс замечательных лекарств, которые изменилиландшафт противомалярийной терапии. Сочетание выдающегося потенциала, безопасности и доступности поставило артемизинин в авангарде продолжающейся борьбы с малярией, где он уже повлиял на миллионы жизней. С момента своего открытия совместными усилиями мирового сообщества была собрана картина действия лекарства с уникальным набором свойств, которые делают его почти идеальным противомалярийным препаратом. Активные исследования в других областях также выявили широкий спектр многообещающих применений для артемизинина за пределами малярии. Мы полагаем, что логично стремиться максимизировать полезность этого препарата в различных областях. В контексте малярии это означает дальнейшее выяснение механизмов активации и действия артемизинина при одновременном улучшении его фармакологических свойств как в отдельности, так и в сочетании. В сочетании с четким пониманием принципов активности артемизинина это может стать ключом к устранению неопределенности в отношении устойчивости к артемизинину. Такие усилия гарантируют, что лекарство может продолжать работать в аналогичном или даже более высоком качестве в той роли, которую оно выполняло так долго. Забегая вперед, повторное использование исследований, основанных на четком понимании различий МОА при различных заболеваниях и системах, также будет способствовать определению будущего артемизинина. В конечном счете, мы искренне надеемся, что этот дар китайской медицины может продолжать служить достижению здоровья для людей во всем мире на многие годы вперед.

1. Винюков Д.Д., Коновалов Д.А. Количественное определение суммы сесквитерпеновых лактонов в траве полыни однолетней// Научные ведомости Белгородского государственного университета. Серия: Медицина. Фармация. – 2011. – №15. – С. 233–236.
2. Войткевич С.А. Эфирные масла для парфюмерии и ароматерапии. – М.: Пищевая промышленность, 1999. – 282 с.
3. Жигжитжапова С.В., Соктоева Т.Э., Раднаева Л.Д. Состав эфирного масла полыни однолетней// Вестник Бурятского государственного университета. – 2012. – № 4. – С. 93–95.
5. Песяк С.В. Действие селективного света на рост клеточных культур растения Artemisia annua L. // Вестник Томского государственного университета. Биология. – 2010. – № 2(10). – С. 29–36.
6. Рандалова Т.Э. Сравнительный анализ состава эфирных масел, полученных гидродистилляцией, и эфирномасличной фракции со2-экстракта artemisia sieversiana willd. и artemisia annua l. / Т.Э. Рандалова, Г.Л. Рыжова, К.А. Дычко, В.В. Хасанов, С.В. Жигжитжапова, Л.Д. Раднаева // Химия растительного сырья. – 2013. – № 4. – С. 61–64.
7. Сулейменов Е.М. Компоненты липофильных фракций Artemisia annua L. / Е.М. Сулейменов, А.Т. Кулыясов, Т. Озек, Б. Демирчи, С.М. Адекенов, К.Х.Ч. Башер // Новые технологии получения и применения биологически активных веществ: тезисы докл. междунар. научно-практ. конф. (Алушта, Крым, Украина, 20–25 мая 2002 г.) – Симферополь: изд-во КНЦ, 2002. – С. 93.
9. Шатар С., Алтанцэцэг Ш. Монгол нутгийн шарилжны эфирийн тосны химийн бурэлдэхуун, технологи чанар ач холбогдол. – Уланбааатар, 2011. – 226 с.
10. Шретер А.И. Содержание артемизинина в Artemisia annua L. / А.И. Шретер, К.С. Рыбалко, О.А. Коновалова и др.// Растительные ресурсы. – 1989. – Вып. 1. – С. 66–72.
11. Baraldia R., Isacchib B., Predieria S. Distribution of artemisinin and bioactive flavonoids from Artemisia annua L. during plant growth// Biochemical Systematic and Ecology. – 2008. Vol. 36, № 5. – P. 340–348.
12. Bhakuni R.S. Secondary metabolites of Artemisia annua and their biological activity / R.S. Bhakuni, D.C. Jain, R.P. Sharma, S. Kumar // Current science. – 2001. – Vol. 80, № 1. –P. 35–48.
13. Brown G.D. The Biosynthesis of Artemisinin (Qinghaosu) and the Phytochemistry of Artemisia annua L. (Qinghao) // Molecules. – 2010. – Vol. 15. – р. 7603–7698.
14. Cafferata L. F.R., Gatti W.O., Mijailosky S. Secondary gaseous metabolites analyses of wild Artemisia annua L. // Molecular Medicinal Chemistry. – 2010. – Vol. 21, January-April. – p. 48–52.
15. Сavar S. Chemical composition and antioxidant and antimicrobial activity of essential oil of Artemisia annua L. from Bosnia / S. Сavar, M. Maksimoviс, D. Vidic, A. Pariс // Industrial Crops and Products. – 2012. – Vol. 37, № 1. – P. 479–485.
16. Charles D.J., Cebert E., Simon J.E. Characterizatoin of essential oil of Artemisia annua L. // Journal of Essential Oil Research. – 1991. – № 3. – р. 33–39.
17. Ferreira J.F.S. Cultivation and genetics of Artemisia annua L. for increased production antimalarial artemisinin / J.F.S. Ferreira, J.C. Laughlin, N. Delabays, P.M. Magalhaes // Plant Genetic Resources. – 2005. – Vol.3, № 2. – р. 206–229.
18. Ferreira J.F., Luthria D.L Drying affects artemisinin, dihydroartemisinic acid, artemisinic acid, and the antioxidant capacity of Artemisia annua L. leaves // J. Agric. Food Chem. – 2010. – № 58. – P. 1691–1698.
19. Firestone G.L., Sundar S.N. Anticancer activities of artemisinin and its bioactive derivatives// Expert Rev. Mol. Med. – 2009. – Vol.11. – P. 32–34.
20. Goel D. Essential oils of petal, leaf and stem of the antimalarial plant Artemisia annua / D. Goel, V. Singh, M. Ali, g.R. Mallavarupu, S. Kumar// Journal Nature medicine. – 2007. – Vol. 61. – P. 187–191.
21. Goel D. Composition of the essential oil from the root of Artemisia annua / D. Goel, R. Goel, V. Singh, M. Ali, g.R. Mallavarupu, S. Kumar // Journal Nature medicine. – 2007. – Vol. 61. – p. 458–461.
22. haider F. Influence of transplanting time on essential oil yield and composition in Artemisia annua plants grown under the climatic conditions of sub-tropical north India / F. haider, P. Dwivedi, S. Singh, A.A. Naqvi., G. Bagchi // Flavour and Fragrance Journal. – 2004. – Vol. 19. – P. 51–53.
23. Hethelyi E.B. Chemical Composition of the Artemisia annua essential oils from Hungary / E.B. Hethelyi, I.B. Cseko, M. Grosz, G. Mark, J.J. Palinkas // Journal of Essential Oil Research. – 1995. – № 7. – р. 45–48.
24. Holm Y. Variations in the essential oil composition of Artemisia annua L. of different origin cultivated in Finland / Y. Holm, I. Laakso, R. Hiltunen, B. Galambosi // Flavour and Fragrance Journal. – 1997. – Vol. 12. – p. 241–246.
25. Juteau F. Antibacterial and antioxidant activities of Artemisia annua essential oil / F. Juteau, V. Masotti, J.M. Bessiere, M. Dherbomez, J. Viano // Fitoterapia. – 2002. – Vol. 73. – p. 532–535.
26. Keng C.L., Singaram N., Lim B.P. Production of artemisinin from cell suspension culture of Artemisia annua L. // Asia pacific Journal of Molecular Biology and Biotechnology. – 2010. – Vol. 18, № 1. – P.139–141.
27. Khodakov G.V., Kotikov I.V. Component composition of essential oil from Artemisia annua and A. scoparia // Chemistry of natural compounds. – 2009. – Vol.45, № 6. – p. 909–912.
28. Kooy F., Sullivan S.E. The complexity of medicinal plants: The traditional Artemisia annua formulation, current status and future perspectives // Journal of Ethnopharmacology. – 2013. – Vol. 150, № 1. – P. 1–13.
29. Lapkin A.A. Comparative assessment of technologies for extraction of artemisinin / A.A. Lapkin, P.K. Plucinski, M. Cutler // J. Nat. Prod. – 2006. – № 69. – P. 1653–1666.
30. Lawrence B.M. Progress in essential oils// Perfumer and Flavorist. – 1992. – Vol. 17, January/Febrary. – p. 52–53.
31. Lawrenсe B.M. Progress in essential oils // Perfumer and Flavorist. – 1995. – Vol. 20, March/April. – p. 52–53.
32. Lawrence B.M. Progress in essential oils//Perfumer and Flavorist. – 1996. – Vol. 21, March/April. – p. 32.
33. Libbey L.M., Sturtz G. Unusual essential oils grown in Oregon II. Artemisia annua L. // Journal of Essential Oil Research. – 1989. – № 1. – р. 201–202.
34. Malik A.A. Influence of chemical and biological treatments on volatile oil composition of Artemisia annua Linn. / A.A. Malik, J. Ahmad, S.R. Mirb, M. Ali, M.Z. Abdin // Industrial Crops and Products. – 2009. – Vol. 30. – p. 380–383.
35. Perazzo F.F. Central properties of the essential oil and the crude ethanolextract from aerial parts of Artemisia annua L. / F.F. Perazzo, J.C.T. Carvalho, J.E. Carvalho, V.L.G. Rehder // Pharmacological Research. – 2003. – Vol. 48. – p. 497–502.
36. Raduloviс N.S. Toxic essential oils. Part II: Chemical, toxicological, pharmacological and microbiological profiles of Artemisia annua L. volatiles / N.S. Raduloviс, P.J. Randjeloviс, N.M. Stojanoviс, P.D. Blagojeviс, Z.Z. Stojanoviс-Radiс, I.R. Iliс, V.B. Djordjeviс // food and chemical toxicology. –2013. – № 58. – P. 37–49.
37. Ram M. Effect of planting time on the yield of essential oil and artemisinin in Artemisia annua under subtropical conditions / M. Ram, M.M. Gupta, A.A. Naqvi, S. Kumar // Journal of Essential Oil Research. – 1997. – № 9. – р. 193–197.
38. Rajeswara R.B.R. Effect of method of distillation on the yield and chemical composition of Artemisia annua essential oil / R.B.R. Rajeswara; K.V. Syamasundar, R.P. Patel // Journal of Essential Oil Research. – 2014. – Vol. 26, № 6. – P. 486–491.
39. Ridder S., Kooy F., Verpoorte R. Artemisia annua as a self-reliant treatment for malaria in developing countries // Journal of Ethnopharmacology. – 2008. – Vol. 120, № 2. – р. 302–314.
40. soktoeva t.e artemisinin content in artemisia annua l. extracts obtained by different methods / t.e. Soktoeva, g.l. Ryzhova, k.a. Dychko, v.v. Khasanov, s.v. Zhigzhitzhapova, l.d. Radnaeva // Russian Journal of Bioorganic chemistry. – 2013. vol. 39, №7. – p. 761–764.
41. Soylu E.M. Chemical composition and antifungal activity of the essential oil of Artemisia annua L. against foliar and soil-borne fungal pathogens / E.M. Soylu., H. Yigitbas, F.M. Tok, S. Soylu, S. Kurt, O. Baysal, A.D. Kaya // Journal of Plant Diseases and Protection. – 2005. – Vol. 112 (3). – p. 229–239.
42. Tzenkova R. Composition of Artemisia annua essential oil obtained from species growing wild in Bulgaria / R. Tzenkova, Z. Kamenarska, A. Draganov, A. Atanassov // Biotechnology and Biotechnological Equipment. – 2010. – Vol. 24(2). – р.1833–1835.
43. Verma R.K. Influence of planting date on growth, artemisinin yield, seed and oil yield of Artemisia annua L. under temperate climatic conditions / R.K. Verma, A. Chauhana, R.S. Verma, A.K. Gupta// Industrial Crops and Products. – 2011. – Vol. 34. – p. 860–864.
44. WHO monograph on good agricultural and collection practices (GACP) for Artemisia annua L. – World Health Organization, 2006. – 48 p.
45. Woerdenbag H.J. Volatile constituents of Artemisia annua L. (Asteraceae) / H.J. Woerdenbag, R. Bos, M.C. Salomons, H. Hendriks, N. Pras, T.M. Malingre // Flavour and Fragrance Journal. – 1993. – Vol. 8. – P. 131–137.
46. Yang S.-L. Flavonoids and Chromenes from Artemisia annua L. / S.-L. Yang, M.F. Roberts, M.J. O’Neill, F. Bucar, J.D. Phillipson // Phytochemistry. – 1995. – Vol. 38, № 1. – P. 255–257.
Настоящий обзор посвящен биологически активным соединениям полыни однолетней и связан с поиском новых источников растительного сырья во флоре России, а также их химическим изучением с целью создания новых лекарственных средств отечественного производства.
Сесквитерпеновые лактоны полыни однолетней
Основные производные артемизинина в растениях – это артеаннуин В, артемизининовая кислота, содержащиеся в листьях растений, из которых примерно 42 % от общего объема артемизинина, содержатся в верхних листьях [18]. Общая сумма артемизинина, выделенного из разных частей Аrtemisia annua, составляет около 0,01 и 1,4 % от сухой массы листьев. В некоторых частях растения артемизининовая кислота, является основным предшественником артемизинина, и находится в значительных концентрациях, при этом ее содержание почти на порядок выше, чем концентрация самого артемизинина [29]. Поэтому химическое преобразование артемизининовой кислоты является обязательным пунктом разработки полусинтетического маршрута получения артемизинина, увеличивая тем самым общий объем производства из биомассы [8]. В России разработана и валидирована методика количественного определения суммы секвитерпеновых лактонов в траве полыни однолетней в пересчете на артемизинин [1].
В 80-х годах ХХ века группой российских ученых было изучено содержание артемизинина в полыни однолетней и предприняты попытки его культивирования в ВИЛР (г. Москва) [10]. Из полыни однолетней, произрастающей на территории Бурятии (Россия), различными методами в ыделены экстракты, и показано, что содержание артемизинина в них может доходить до 0,054 % [40].
Эфирное масло полыни однолетней
Химическое исследование полыни однолетней в нашей стране было начато как исследование эфиромасличного растения. Никитский ботанический сад в Крыму провел серьезные работы по созданию промышленных сортов однолетней полыни для получения эфирного масла [2]. Выход масла составляет до 2,35 % [16], 0,49–0,81 % [23], 1,4–4,0 % [24], 0,05–0,4 % [8].
Читайте также:

