Ленточный паразит и токсоплазма лечение
Обновлено: 18.04.2024
Странное дело: о мире простейших практически невозможно рассказать в двух словах – писать приходится много. Вопреки своему названию, эти микроорганизмы весьма сложны, разнообразны, неисчерпаемо интересны, а порой уникальны.
Некоторые смертельно опасны.
Но дело даже не в миграционных потоках. Сам мир изменился, став совсем маленьким, тесным и круглым. Расстояний больше нет. Приходится узнавать о болезнях, которые раньше не всякому-то специалисту были известны, и читать о возбудителях этих инфекций, уповая на всемогущество антибиотиков да на собственный иммунитет.
Иммунитет у Homo Sapiens хоть и силен, да не абсолютен; к тому же подрываем мы его сами, подрываем на каждом шагу, прекрасно зная, – чем. Жизнь у нас такая, и такая уж у нас цивилизация…
В подцарство простейших (protozoa) выделены одноклеточные эукариоты, т.е. микроорганизмы, имеющие в строении одно или несколько клеточных ядер. Этим они отличаются от бактерий (прокариотов, доядерных и безъядерных одноклеточных) и от вирусов, которые являются неклеточной формой органики (если считать органикой упакованные сгустки рибонуклеиновых молекул).
Большинство простейших отличается также:
- сложным многофазным жизненным циклом;
- способностью размножаться как бесполым делением с рекомбинацией ДНК (подобно бактериям), так и более совершенным, с генетической точки зрения, гаметогенезом (с образованием предзародышевых половых клеток-гамет);
- наличием органоидов (ложноножки-псевдоподии, жгутики, цитостомы, реснички, мембраны и т.д.);
- гетеротрофным питанием (могут паразитировать в макроорганизме, поглощая его клетки; или питаются детритными, разлагающимися органическими массами, т.е. ведут сапротрофный образ жизни; либо же охотятся и пожирают другие микроорганизмы);
- способностью как к одиночному, так и колониальному существованию;
- размерами (эта характеристика широко варьирует у всех мельчайших, но в среднем протозоа в тысячи раз больше вирусов и на порядок больше бактерий; некоторые простейшие видны невооруженным глазом, достигая нескольких миллиметров в размерах, а отдельные гигантские многоядерные виды вырастают до 10-15 см, оставаясь при этом одноклеточными и соответствуя всем критериям протозойного подцарства).
Впадать в тоскливо-обреченный ужас, конечно, не стоит. Все-таки Homo Sapiens неизмеримо сложнее (в этом его слабость), изобретательнее и умнее – в этом сила. Знать, понимать, соблюдать разумную осторожность и принимать адекватные меры – необходимо. Ниже перечислены и очень кратко описаны лишь самые распространенные протозойные паразитозы. Большинству из них на сайте Лахта Клиники посвящены также отдельные статьи; остальные заболевания этой категории, если понадобится, подробно рассмотрим в будущем.
Малярия, она же болотная лихорадка. Исторически первое заболевание, в отношении которого была установлена протозойная этиология. По уровню летальности занимает пятое место среди всех инфекционных болезней и первое место среди паразитарных (от малярии погибает примерно три миллиона человек в год). Вызывается плазмодиями класса Sporozoa; на сегодняшний день патогенность обнаружена у пяти видов из более чем двухсот.
Распространяется промежуточными хозяевами, – комарами-анофелесами; передается также через зараженный шприц, при переливании крови и трансплацентарно (плоду от инфицированной матери). Помимо собственно лихорадки, приводит к тяжелым, жизнеугрожающим полиорганным осложнениям. Иммунитет вырабатывается лишь частично. Вакцины и средства профилактики в настоящее время находятся на стадии разработки, лабораторных экспериментов и клинических испытаний.
Амебиаз. Вызывается несколькими видами внутритканных паразитов рода амеб. Встречается в тяжелых церебральных, легочных, печеночных, кожных и других клинических формах, однако наиболее распространенным является кишечный амебиаз (амебная дизентерия, амебный колит), вызываемый Entamoeba histolytica. Второе по летальности протозойное заболевание. Распространяется фекально-оральным путем, через зараженную воду и немытые руки. Иммунитет к амебным инвазиям не формируется. Инфицировано не менее полумиллиарда человек, у каждого десятого из заражаемых развивается клинически значимая симптоматика.
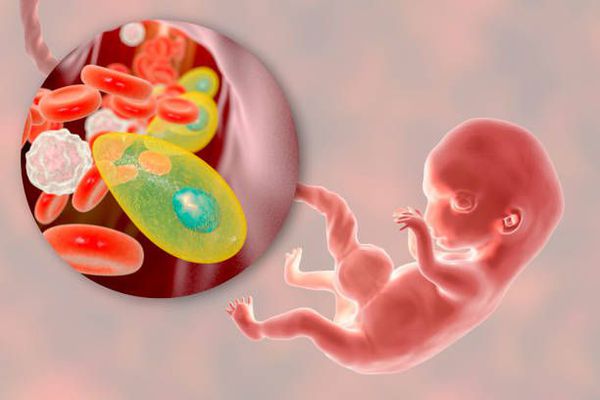
Токсоплазмоз. Вызывается единственным известным на сегодняшний день представителем рода токсоплазмы – Toxoplasma Gondii, мелким внутриклеточным паразитом. Окончательный хозяин, в организме которого токсоплазма размножается гаметогенезом и образует способные к активизации цисты, – семейство кошачьих. Человечество как один из промежуточных носителей инфицировано на 40-70%. Подавляющее большинство случаев острого токсоплазмоза протекает бессимптомно, с формированием стойкого пожизненного иммунитета. Вместе с тем, для лиц с выраженным иммунодефицитом токсоплазма смертельно опасна. Кроме того, при первичном заражении беременной женщины инфицируется и плод: в этом случае со стопроцентной вероятностью нарушается внутриутробное развитие, что приводит к тяжелейшим поражениям центральной нервной и других систем организма, – либо врожденным, либо проявляющимся в детском возрасте. Даже в случае своевременной диагностики на этапе гестации – лечение малоэффективно.
Трихомониаз. Вызывается видом Trichomonas vaginalis, урогенитальным паразитом из рода трихомонад класса жгутиковых. Реальная распространенность неизвестна, оценивается на уровне трехсот миллионов человек, однако с учетом пассивного носительства мужчинами доля инфицированных, по-видимому, гораздо больше. Передается половым путем или от беременной матери к плоду. Является наиболее частым ЗППП в мире, при этом наиболее контагиозным и наиболее вирулентным. Чаще всего обнаруживается в составе комбинированных инфекций, потенцирует патогенность папилломавируса и других вирусных инвазий. При хронизации и длительном течении вызывает ряд тяжелых осложнений со стороны репродуктивной системы. Повышает риск рака шейки матки, преждевременных родов и, даже если роды происходят в срок, дефицита массы тела у новорожденного.
Условным патогеном является также кишечная трихомонада, способная при определенных условиях вызывать соответствующую симптоматику.
Лямблиоз (гиардоз, жиардоз). Вызывается кишечным паразитом Giardia intestinalis из класса жгутиковых. Распространяется преимущественно фекально-оральным путем, а также бытовым и через воду, в том числе водопроводную (поскольку возбудитель устойчив к хлору). Инфицирована, как минимум, треть человечества, в большинстве бессимптомно или малосимптомно. Иммунитет не вырабатывается. Лямблии (жиардии) колонизируют тонкий кишечник, вызывая клинику гастроэнтерита, астенический синдром, снижение массы тела. Способы паразитирования изучены не полностью, равно как не до конца прояснены этиопатогенетические механизмы: способность вызывать осложнения в желчевыводящих путях опровергнута, риск осложнений со стороны кожи, иммунной системы и т.д. в настоящее время изучается и обсуждается.
Бабезиоз (бабезиеллёз). Вызывается внутриклеточным паразитом Babesia из отряда пироплазмид (в той или иной степени патогенны более 100 видов). Клинически проявляется лихорадочным симптомокомплексом, нарушениями состава крови, поражением печени. Инфицируется, в основном, крупный рогатый скот, однако во второй половине ХХ века стали регистрироваться случаи заболевания у человека. Точная распространенность неизвестна, этиопатогенез изучен недостаточно. Распространяется через укусы клещей.
Лейшманиоз. Эндемичное (регионально-зависимое) протозойное заболевание, распространенное в тропиках и субтропиках. Вызывается более чем 20 видами внутриклеточного паразита Leishmania, передается, в основном, через укусы москитов. Инфицировано не менее 12 млн человек. Встречается в кожной, кожно-слизистой и висцеральной (поражение внутренних органов) формах; при осложненном хроническом или тяжелом остром течении заболевание результирует фатально.
Что такое токсоплазмоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, паразитолога со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Токсоплазмоз — это острое и хроническое паразитарное заболевание человека в виде манифестных форм или носительства, вызываемое простейшими внутриклеточными паразитами — токсоплазмами, которые попадая в организм человека могут при условиях иммунодефицита поражать нервную ткань, среды глаза, сердечно-сосудистую и ретикулоэндотелиальную системы, вызывая поражение организма той или иной степени тяжести. Болезнь относится к группе TORCH-комплекса, т. е. вызывает врождённую патологию.
Этиология
Таксономия:
Вид — Toxoplasma gondii
Токсоплазмы обитают в мире в трёх формах:
- трофозоиты (тахизоиты);
- цисты (брадизоиты);
- ооцисты.
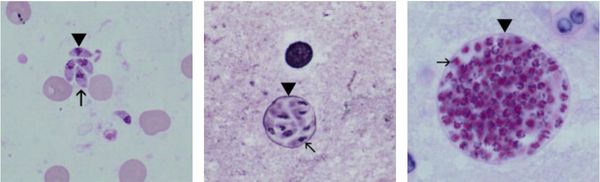
Трофозоиты достигают 4-7 мкм в длину и 2-4 мкм в ширину. Их тело по форме напоминает полумесяц с заострённым передним и закруглённым задним концами, состоит из пелликулы (покровной ткани) и различных органелл. Такие паразиты обитают во всех клетках млекопитающих кроме эритроцитов, размножаются путём деления. Могут создавать движение, активно проникая в клетки хозяина через клеточную мембрану или посредством фагоцитоза (захвата и переваривания клетки). Обнаруживаются в тканях в острой стадии инфекции. Их скопление внутри одной клетки называют псевдоцистой. Трофозоиты неустойчивы вне клетки и во внешней среде, быстро погибают при высушивании, прогревании и применении дезинфицирующих средств. Хорошо окрашиваются по Романовскому. Чувствительны к различным химиопрепаратам (сульфаниламидам, некоторым макролидам и другим).
Цисты размерами до 100 мкм отличаются плотной оболочкой, через которую не могут проникнуть антитела или лекарственные препараты. Внутри оболочки сосредоточено 3000-5000 паразитов, со временем они увеличиваются. Цисты формируются в организме хозяина (в основном в скелетных мышцах, миокарде и ЦНС) и живут там десятки лет. Чрезвычайно устойчивы к воздействиям внешних факторов. При адекватной иммунной системе могут пожизненно находиться в состоянии функционального покоя и не приносить никакого вреда организму человека.
Ооцисты играют основную роль в передаче инфекции. Они представляют собой овальные образования 10-12 мкм в диаметре. Их развитие и формирование длится 3-24 дня и проходит в слизистой оболочке тонкой кишки кошек. Затем в течение 7-20 дней паразиты выделяются с испражнениями, после этого срока новые фекалии кошки уже не заразны. За сутки с испражнениях животного выделяется до 10 миллионов ооцист. Спустя 2-3 дня при температуре 24 °C происходит споруляция ооцист — образование спор. При благоприятных условиях микроорганизмы сохраняются во внешней среде до года и дольше.
Существует множество штаммов токсоплазм, одни из которых отличаются высокой вирулентностью, а другие относительно маловирулентны. [1] [2] [7] [9]
Эпидемиология
Учитывая большое количество латентных форм, заболевание не поддаётся общему исчислению — им может быть заражено не менее 1,5 миллиардов человек. Только ежегодно регистрируется около 200 тысяч случаев внутриутробного инфицирования.
Распространение возбудителя повсеместное — токсоплазма обнаружена на всех материках. После заражения паразиты способны пожизненно сохранятся в организме большинства животных и птиц. Количество случаев приобретённого токсоплазмоза в разных странах колеблется: от 85 % во Франции и Мадагаскаре до 15 % в США и Англии.
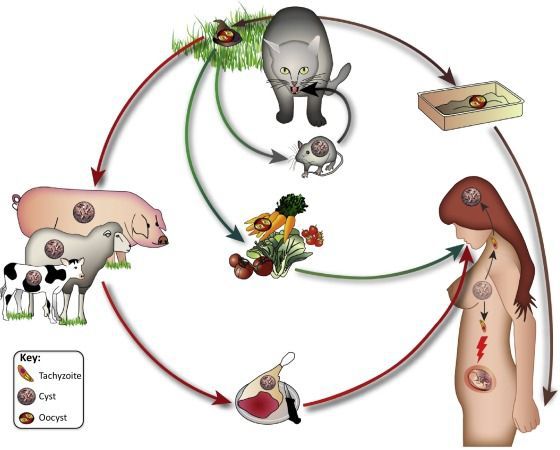
- Фекально-оральный:
- водный и пищевой путь — при недостаточной термической обработке, чаще при употреблении сырого мяса и фарша;
- контактно-бытовой путь — при несоблюдении санитарных норм в повседневной жизни, например, при общении с кошками.
- Вертикальный путь (от матери к плоду) — преимущественно при первичном заражении матери во время беременности, часто у ВИЧ-инфицированных в стадии СПИДа.
- Артифициальный путь — при пересадке органов, в которых расположены цисты, пациенту с плохим иммунитету.
- Аэрогенный путь — при попадании инфицированной ооцистами пыли в рот человека.
- Контактный путь — при повреждении целостности кожных покровов. Встречается крайне редко, в основном у работников лабораторий и скотобоен, отмечен лишь в некоторых источниках, явного практического значения не имеет.
От человека к человеку заболевание не предаётся (кроме случаев каннибализма). Нельзя заразиться посредством укуса насекомых и при половом контакте.
Инфицирование токсоплазмой вызывает устойчивый пожизненный иммунитет к повторному заражению, однако известны случаи рецидива первичной инфекции при заражении другим высоковирулентным штаммом (у беременных, заразившихся при употреблении сырого мяса с другого континента). [1] [3] [5] [8] [9]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы токсоплазмоза
Инкубационный период при манифестных формах (явных проявлениях болезни) длится от двух недель до двух месяцев.
Специфичных симптомов, характерных именно для токсоплазмоза, не существует.
В большинстве случаев приобретённого токсоплазмоза заболевание протекает бессимптомно или со стёртой клиникой, напоминающей нетяжёлое ОРЗ: кратковременная лихорадка, слабость, недомогание, повышение температуры до 38,0 °C, увеличение периферических лимфоузлов, небольшое увеличение печени и селезёнки.
Доказано, что токсоплазма может оказывать влияние на психику человека. Это выражается в учащении рискованных действий, снижении концентрации внимания, повышенной нервозности, у лиц с тяжёлым острым или длительным хроническим активным течением повышен риск развития шизофрении.
Иногда заболевание проявляется изолированной глазной формой — длительно текущие увеиты, иридоциклиты и хориоретиниты. Как правило, эти нарушения являются поздними проявлениями нераспознанного ранее врождённого процесса.
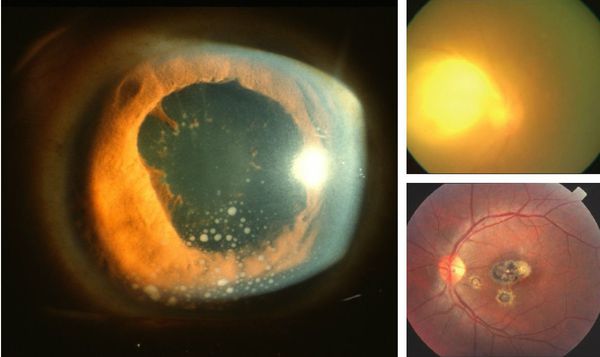
У людей с выраженным иммунодефицитом (ВИЧ, пересадка органов с последующей цитостатической терапией) возможно развитие генерализованного процесса с поражением нескольких органов (головного мозга, сердца, печени, почек, лёгких), нередко очень тяжёлого течения, проявляющегося в виде синдрома полиорганной недостаточности.
Токсоплазмоз у беременных может протекать в различных клинических вариантах и представляет опасность не столько для самой беременной (исключая тяжело протекающие патологии у беременных со СПИДом), сколько для плода.
При первичном заражении беременной токсоплазмозом имеет значение срок гестации:
- При инфицировании в первом триместре передача возбудителя плоду происходит лишь в 4 % случаев (к 13 неделе — в 6 %), но заканчивается, как правило, гибелью плода и выкидышем на ранних сроках. Если первичная инфекция у матери в первом триместре доказано, но выкидыш до 13 недели беременности не произошёл, то крайне высока вероятность, что внутриутробной передачи не было и ребёнок будет здоров.
- При инфицировании во втором триместре (особенно на 24-26 неделях) риск внутриутробной передачи резко возрастает и достигает 30-40 %, причём сопровождается развитием тяжёлых проявлений заболевания — одновременное увеличение селезёнки и печени, воспаление сосудистой оболочки и сетчатки глаза, поражения ЦНС в виде гидроцефалии, кальцификация, сыпь, миокардит, пневмония и другие.
- При заражении матери в третьем триместре передача инфекции ребёнку происходит с частотой до 90 %, однако проявления заболевания являются латентными или субклиническими и могут появиться спустя годы после рождения (отставание в развитии, нарушения зрения). [1][2][4][9]
Патогенез токсоплазмоза
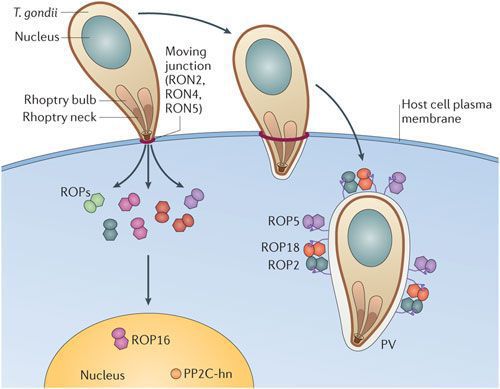
По мере развития и размножения токсоплазм поражённые клетки разрушаются, происходит заражение новых здоровых клеток, и при попадании возбудителя в кровоток паразиты разносятся по всему организму. Образуются некрозы с формированием фиброзной ткани и кальцификацией (отложение солей кальция в организме).
Под воздействием иммунитета безоболочечные трофозоиты превращаются в брадизоиты (оболочечные скопления токсоплазм), т.е. в тканевые цисты, которые сохраняются десятками лет в неактивном состоянии и при значительном снижении иммунитета способны к обратной трансформации с развитием обострения.
При первичной инфекции у беременных возбудитель проникает в ткани плода и вызывает воспалительный процесс, причём в разные периоды развития наблюдается различный характер воспаления: у эмбриона происходит лишь альтерация (дистрофия и некроз ткани без фиброза), в раннем фетальном периоде дополняется повышенным образованием соединительной ткани (фиброзом), а в позднем фетальном периоде присоединяется сосудистый компонент. Отсюда вытекают различные по характеру и тяжести поражения плода, которые зависят от сроков инфицирования матери. [1] [2]
Классификация и стадии развития токсоплазмоза
По течению процесса токсоплазмоз бывает:
- острым — до одного месяца;
- подострым - 1-3 месяц;
- хроническим — более трёх месяцев.
По клиническим признакам выделяют пять форм заболевания:
- Врождённый острый токсоплазмоз:
- манифестная форма (с указанием ведущих проявлений);
- субклиническая форма (с указанием способа верификации диагноза).
- Врождённый хронический токсоплазмоз:
- обострение / ремиссия;
- с резидуальными (остаточными) явлениями / без резидуальных явлений.
- Врождённый латентный токсоплазмоз.
- Приобретённый острый токсоплазмоз.
- Приобретённый хронический токсоплазмоз.
По степени тяжести заболевание бывает:
- лёгким;
- среднетяжёлым;
- тяжёлым (врождённая инфекция, токсоплазмоз при СПИДе).
По наличию осложнений выделяют:
- осложнённый токсоплазмоз;
- неосложнённый токсоплазмоз.
В Международной классификации болезней 10 пересмотра выделены шесть типов заболевания:
- B58.0 Токсоплазмозная окулопатия;
- B58.1 Токсоплазмозный гепатит (K77.0*);
- B58.2 Токсоплазмозный менингоэнцефалит (G05.2*);
- B58.3 Легочный токсоплазмоз (J17.3*);
- B58.8 Токсоплазмоз с поражением других органов;
- B58.9 Токсоплазмоз неуточнённый. [1][2][3]
Осложнения токсоплазмоза
При врождённой форме может возникнуть гидроцефалия, микроцефалия, задержка психомоторного развития и слепота. Эти осложнения сопровождаются увеличением или уменьшением размеров черепа, различными неврологическими расстройствами — косоглазием, судорогами, трудностью с сидением и держанием головы, рвотой и другими.
При глазной форме заболевания развивается слепота, снижение остроты зрения и воспалительные явления всех сред глаза. Причём возможно как рождение с грубыми дефектами зрения, так и появление воспалительных явлений и нарушения зрения спустя много лет после рождения.
Токсоплазмоз у иммунокомпрометированных людей осложняется шизофренией, токсоплазменный энцефалитом и полиорганной недостаточностью — тяжёлой патологией различных органов при выраженном иммунодефиците. При этом свойственна картина тяжёлого энцефалита. Прогноз, как правило, неблагоприятный. [1] [5] [8] [9]
Диагностика токсоплазмоза
Лабораторная диагностика:
- Клинический анализ крови: снижение уровня тромбоцитов, увеличение количества лимфоцитов и эозинофилов.
- Биохимический анализ крови: возможно повышение уровня трансаминаз и билирубина.
- Иммуноферментный анализ (ИФА):
- Выявление специфических антител класса M — острая инфекция или её реактивация. Имеет ряд недостатков — низкая специфичность, длительная циркуляция в организме, иногда до года после острого процесса. В сложных случаях уточнение следует производить при помощи метода "двойной сэндвич" или "иммунозахват" IgM ELISA.
- Выявление специфических антител класса G (клеток памяти) — носительство, инфицированность — появляются в среднем со второй недели заболевания и достигают пика на 1-2 месяце, сохраняются пожизненно, за исключением СПИД-ассоциированных заболеваний.
- Авидность IgG — уточнение давности заболевания. Недостатком является отсутствие стандартизации результатов, что зачастую приводит к различным ошибкам интерпретации. Наибольшее значение имеет высокая авидность, остальные результаты низкой и слабой авидности могут быть ошибочными и не должны трактоваться как недавно перенесённое заболевание при отсутствии других подтверждающих этот факт тестов.
- ПЦР-диагностика: выявление ДНК токсоплазмы в крови, других жидкостях и тканях человеческого организма. Особенно информативна в диагностике генерализованного, глазного и врождённого токсоплазмоза, в т. ч. в антенатальном периоде путём проведения амнио (не ранее 16 недель) и кордоцентеза (с 18 недели беременности).
- УЗИ-диагностика: внутриутробное выявление гидро- и микроцефалии, кальцификатов, гепатоспленомегалии и выраженной задержки развития. [1][2][4][5][6]
Дифференциальная диагностика
Токсоплазмоз — это инфекция с необычайно разнообразными проявлениями, поэтому ввиду неспецифичности проявлений основное место в дифференциальной диагностике отводиться лабораторному обследованию, а именно специфическим серологическим тестам.
Необходимо исключить следующие заболевания:
-
(ВЭБ-инфекцию) — боли в горле, преимущественное увеличение затылочных и заднешейных лимфоузлов, характерные изменения гемограммы (появление большого количества атипичных мононуклеаров и отсутствие столь выраженных изменений при врождённом течении), положительные IgM и ПЦР крови; — лимфоцитарный характер гемограммы, частое поражение слюнных желёз, положительные IgM, ПЦР крови;
- туберкулёз — длительное постепенное начало, лёгкий субфебрилитет (до 38,0 °C), ночная потливость, нездоровый румянец на щеках, кашель, специфические изменения в лёгких, положительные пробы на туберкулёз, выявление бациллы Коха в мокроте;
- лимфопролиферативные заболевания (лимфома Ходжкина, неходжкинские лимфомы) — специфические изменения при биопсии поражённой ткани (лимфоузлов);
- ВИЧ-инфекция — наличие факта возможного заражения, увеличение всех групп лимфоузлов, положительная серология;
- саркоидоз — специфические изменения в лёгких, положительные результаты гистологического исследования. [1][2][5]
Лечение токсоплазмоза
Большинство случаев приобретённого токсоплазмоза протекают в лёгкой или бессимптомной форме, они не регистрируются и, по-видимому, не нуждаются в каком-либо лечении.
Необходимость проведения специфической этиотропной терапии возникает лишь у некоторых групп пациентов:
- беременные с доказанным первичным инфицированием (в ряде случаев при реактивации хронической инфекции);
- дети с врождённой формой токсоплазмоза (при наличии явных клинических и лабораторных проявлений заболевания, субклинических и инаппарантных формах) — сроки и объём терапии зависят от конкретных данных;
- иммунокомпрометированные люди, у которых токсоплазмоз (острый или в фазе реактивации хронического процесса) протекает с выраженными клинико-лабораторными проявлениями. Основное направление воздействия в этом случае должно быть на устранение причины иммунодефицита, повышение уровня СД4 клеток.
Проведение лечения может осуществляться как в стационаре, так и амбулаторно в зависимости от выраженности процесса, реакции пациента на вводимые препараты, необходимости тех или иных вариантов патогенетического и симптоматического обеспечения. [1] [4] [7]
Прогноз. Профилактика
При приобретённом токсоплазмозе у иммунокомпетентных лиц прогноз благоприятный, у иммунокомпрометированных лиц (СПИД) прогноз серьёзен, нередки летальные исходы.
При врождённом токсоплазмозе исход заболевания зависит от сроков инфицирования плода:
- при инфицировании в первом триместре, как правило, происходит выкидыш;
- в более поздние сроки последствия варьируются от тяжёлых до резидуальных форм.
Основным методом профилактики приобретённого и врождённого токсоплазмоза является соблюдение санитарно-гигиенических правил, особенно беременными, не имеющими антител класса G к токсоплазмам:
- ограничение контакта с кошками;
- запрет на употребление сырого мяса, фарша и морепродуктов;
- тщательная промывка зелени, фруктов и овощей;
- мытьё рук перед едой;
- работа на приусадебном участке только в перчатках.
Для беременных особенно важен скрининг антител к токсоплазме, позволяющий выявить активно протекающее заболевание или риск его возникновения, а также вовремя провести медикаментозную профилактику острого токсоплазмоза беременной и снизить риск врождённой инфекции на 60 %. При отсутствии антител класса G в первом триместре необходимо отслеживать антитела IgM и IgG не только в тертьем, но и во втором триместре беременности.
В очаге токсоплазмоза противоэпидемические мероприятия не проводятся, вакцина на разработана. [2] [3]
Токсоплазмоз — широко распространенная зоонозная паразитарная инфекция, характеризующаяся полиморфизмом клинических проявлений и значительной вариабельностью течения процесса: от здорового, бессимптомного носительства до тяжелых, летальных форм болезни.
.jpg)
Токсоплазмоз — широко распространенная зоонозная паразитарная инфекция, характеризующаяся полиморфизмом клинических проявлений и значительной вариабельностью течения процесса: от здорового, бессимптомного носительства до тяжелых, летальных форм болезни.
Этиология. Возбудитель токсоплазмоза Toxoplasma gondii относится к царству Protozoa, классу Coccidia, отряду Eucoccidiorida, типу Apicomplexa. T. gondii — условно патогенный внутриклеточный паразит, поражающий в организме промежуточных хозяев, в том числе человека, любые ядерные клетки гистеофагоцитарной системы.
Эпидемиология. Пораженность или инфицированность токсоплазмами населения Российской Федерации в среднем составляет около 20,0%. Показатели пораженности выше в регионах с теплым климатом; среди лиц ряда профессиональных групп: рабочие мясокомбинатов и звероводческих ферм, животноводы, ветеринарные работники и др. Инфицированность женщин, как правило, в 2–3 раза выше, чем у мужчин.
Заболеваемость токсоплазмозом во много раз ниже показателей инфицированности, однако трудности диагностики, несмотря на обязательную регистрацию, не позволяют судить об истинном уровне инфекции.
Восприимчивость к токсоплазмозу — практически поголовная. Распространение инфекции — повсеместное в виде носительства и спорадических заболеваний. Основной источник инфекции — дикие и домашние кошки.
Основной фактор передачи токсоплазм — сырое или недостаточно термически обработанное мясо, мясные продукты с находящимися в нем цистами токсоплазм. К дополнительным факторам передачи инфекции относятся плохо вымытая зелень, овощи, фрукты (с земли), грязные руки с находящимися на них ооцистами возбудителя.
Основные пути передачи:
- пищевой — связанный с употреблением в пищу термически плохо обработанного мяса, содержащего цисты паразита;
- контактный — ассоциированный с больными кошками, выделяющими токсоплазмы с фекалиями;
- трансплацентарный — при котором становится возможным проникновение токсоплазм в плод, с последующим развитием врожденного токсоплазмоза у новорожденного;
- парентеральный — при котором не исключается передача инфекции реципиенту при переливании крови, пересадке органов и тканей.
Беременная с токсоплазмозом не представляет эпидемиологической опасности ни для окружающих, ни для медицинского персонала, что делает возможным лечение этих пациентов как в амбулаторных условиях, так и в любом соматическом стационаре.
Патогенез. Вышедшие из цист или ооцист возбудители внедряются в эпителиальные клетки тонкого кишечника, где они размножаются, образую первичный аффект и проникая затем в региональные лимфатические узлы, а из них с током лимфы — в кровь. Диссеминация возбудителя приводит к поражению самых различных органов и тканей.
При беременности, в условиях сниженного иммунитета, наряду с первичным заражением токсоплазмами, опасным является и реактивация паразита (при инфицировании до беременности), что в значительной степени определяет течение и исход беременности.
При выходе токсоплазм из цист происходит диссеминация возбудителей. Их концентрация в тканях ассоциирована со способностью токсоплазм проникать трансплацентарно, что приводит к развитию внутриутробной патологии на любом сроке беременности.
Заражение плода наблюдается у беременных как с первичным инфицированием токсоплазмами, так и реактивацией возбудителя во время беременности у серопозитивных женщин. Поражение плода может возникать на любом сроке гестации, но особую опасность представляет его инфицирование в первом и втором триместрах. При заражении в третьем триместре беременности преобладают бессимптомные формы течения заболевания, а поздние клинические признаки проявляются через месяцы и годы.
Заражение на ранних сроках эмбриогенеза заканчивается спонтанным выкидышем, мертворождением, вызывает тяжелые нарушения развития — анэнцефалию, анофтальмию, гидроцефалию, гепатоспленомегалию и др. (табл.).
Формирование иммунитета приводит к исчезновению возбудителя из крови, прекращается его размножение в клетках. Образуются истинные тканевые цисты, которые могут длительно, десятилетиями, в интактном состоянии сохраняться в организме (носительство токсоплазм).
Клиника. Приобретенный токсоплазмоз по характеру течения делится на острый и хронический. Кроме того, в зависимости от длительности болезни и выраженности клинических симптомов возможно подострое, а также инаппарантное (субклиническое) течение инфекции, которое характеризуется определенной динамикой либо высоким уровнем специфических антител в крови, при отсутствии клинических проявлений болезни. Таким образом, наиболее удобной для практического здравоохранения, с нашей точки зрения, является следующая классификация приобретенного токсоплазмоза: острый, подострый, хронический, инаппарантный и носительство.
Клинические проявления токсоплазмоза у беременных не имеют каких-либо существенных отличий от уже известной клинической картины заболевания.
Лабораторная диагностика. Для лабораторной диагностики токсоплазмоза чаще всего применяют серологические методы: реакцию непрямой иммунофлюоресценции (РНИФ) и иммуноферментный анализ (ИФА). Диагноз подтверждается достоверно нарастающей динамикой показателей этих тестов, их высоким уровнем либо наличием антител класса IgM. Существенное значение в диагностике токсоплазмоза, особенно в дифференциации острого и хронического процессов, имеет определение классов иммуноглобулинов, в частности антител класса IgM. Надежно диагностировать токсоплазменную инфекцию можно лишь при сравнении результатов серологических реакций в динамике. Антитела всех классов существенно повышаются к концу второй — началу третьей недели от момента инфицирования и достигают диагностического уровня. Диагноз токсоплазмоза при наличии соответствующей клиники может быть поставлен при положительной серологической конверсии, когда второй анализ сыворотки становится положительным.
Диагностика токсоплазмоза у беременных женщин включает в себя весь комплекс необходимых клинических, параклинических и специальных (иммунобиологических) исследований, которые применяются для диагностики токсоплазмоза вообще.
Обязательным условием обследования беременной на токсоплазмоз должна быть консультация врача-инфекциониста для подтверждения либо исключения текущего инфекционного манифестного или бессимптомного (инаппарантного) токсоплазменного процесса.
Учитывая исключительную важность результатов иммунологического обследования в диагностике токсоплазмоза у беременных, необходимо правильно интерпретировать полученные данные.
Вариант 3: клинические проявления инфекции отсутствуют; серологические реакции положительные в низких, средних, иногда высоких титрах (РНИФ 1:640, ИФА IgG ≥ 200 Ед/мл; ИФА IgM — положительно). При исследовании парных сывороток (через 3–4 недели) регистрируется достоверное нарастание уровня специфических антител класса IgM.
Заключение: инаппарантный токсоплазмоз — реальная угроза инфицирования плода.
Вариант 4: имеются клинические проявления токсоплазмоза; серологические реакции положительные в низких и средних (иногда высоких) титрах: РНИФ 1:1280, ИФА IgG ≥ 200 Eд/мл; ИФА IgM — положительно, при исследовании парных сывороток в динамике регистрируется достоверное нарастание уровня специфических антител; выявляются специфические антитела класса IgM-класса. Заключение: острый токсоплазмоз.
Рекомендации: экстренная превентивная этиотропная терапия (не ранее чем со II триместра беременности); в I триместр — рассмотреть вопрос о прерывании беременности; проводят кордо- и амниоцентез на 22–23 неделях беременности; новорожденный обследуется на токсоплазмоз, и при подтверждении диагноза проводится этиотропная терапия (диспансерное наблюдение 5 лет).
Вариант 5: имеются клинические проявления инфекции; серологические реакции положительные в высоких или средних показателях; при исследовании парных сывороток в динамике регистрируется снижение уровня специфических антител (РНИФ ≤ 1:1280, ИФА IgG — 200 Eд/мл; ИФА IgM — положительно). Заключение: подострый токсоплазмоз. Рекомендации: этиотропная терапия (не ранее чем со II триместра); в I триместр — ставится вопрос о прерывании беременности; новорожденный обследуется на токсоплазмоз и при подтверждении диагноза проводится этиотропная терапия (диспансерное наблюдение 5 лет).
Вариант 6: имеются клинические проявления токсоплазмоза; серологические реакции положительны в низких или средних показателях (РНИФ 1:640, ИФА IgG — 200 Eд/мл; ИФА IgM — отрицательно); при исследовании парных сывороток (через 3–4 недели) динамики уровня антител нет; антитела класса IgM отсутствуют. Заключение: хронический приобретенный токсоплазмоз. Рекомендации: этиотропная терапия не проводится; при необходимости специфическая терапия вне беременности; прерывание беременности не показано.
Лечение. Показанием к назначению этиотропной терапии у беременных женщин являются острый, подострый и инаппарантный токсоплазмоз. Лечение хронического токсоплазмоза следует проводить строго по клиническим показаниям либо до, либо после беременности. При отсутствии жалоб и клинических показаний не нуждаются в лечении женщины, переболевшие токсоплазмозом до беременности. Эти женщины расцениваются как практически здоровые лица, не требующие специального медицинского наблюдения. Лечение беременных женщин следует проводить не ранее 12–16 недель беременности (со II триместра беременности).
Назначаются препараты группы пириметамина (Фансидар, Ровамицин).
Фансидар содержит сульфадоксин 500 мг и пириметамин 25 мг. Этиотропная терапия состоит из 2–3 циклов. Назначается 1 таблетка 1 раз в 3 дня № 8 таблеток на цикл. Учитывая возможность угнетения кроветворения под действием этиотропных препаратов, рекомендуется назначение фолиевой кислоты (в средних терапевтических дозах), а также проведение общих анализов крови и мочи. При непереносимости препаратов группы пириметаминов назначают Ровамицин, 1 таблетка которого содержит спиромицина 3 млн МЕ. Назначают по 3 млн МЕ 3 раза в день с семидневным перерывом. Хорошая переносимость Ровамицина больными, отсутствие лекарственного взаимодействия, высокая эффективность позволяют назначать его для лечения токсоплазмоза у беременных. При непереносимости пириметаминов возможна замена на антибиотики, например, эритромицин.
Противопоказаниями для назначения Фансидара и его аналогов, а также сульфаниламидных препаратов и антибиотиков являются: нарушения эритропоэза с анемией, заболевания почек с нарушением их функций, заболевания печени, декомпенсация сердечной деятельности.
В зависимости от сроков беременности целесообразно проведение не менее двух полных курсов этиотропной терапии с перерывами между ними 1–1,5 месяца.
Как показала практика, у пациенток с инаппарантным течением острого токсоплазмоза хороший эффект дает комплексное применение Фансидара с иммуномодуляторами (Галовит, Полиоксидоний). Уже после первого цикла лечения наблюдается значительное снижение IgM.
Профилактика врожденного токсоплазмоза. Профилактика врожденного токсоплазмоза должна строиться с учетом того факта, что только первичное заражение женщины во время беременности может привести к инфицированию плода. Оптимально профилактика врожденного токсоплазмоза должна включать в себя обследование женщин детородного возраста на токсоплазмоз до или, в крайнем случае, во время беременности. Неиммунные беременные женщины должны быть обязательно взяты на диспансерное наблюдение и обследоваться на токсоплазмоз 1 раз в триместр.
Литература
- О выявлении и профилактике токсоплазмоза в Москве. Методические рекомендации (№ 25). М., 2007.
- Лысенко А. Я. Клиническая паразитология. Женева, 2002.
- Hill D., Dubey J. P. Toxoplasma gondii: transmission, diagnosis and prevention // Clin. Microbiol. Infect. 2002. № 10.
- Desmonts G., Couvreur J. Toxoplasmosis in pregnancy and its transmission to the fetus // Bull. N. Y. Acad. Med. 1974. № 2.
Ф. К. Дзуцева*
Г. Ю. Никитина**
Ю. В. Борисенко*
Л. П. Иванова***, кандидат медицинских наук, доцент
С. Х. Зембатова***
*Городской центр по токсоплазмозу, **ГКБ им. С. П. Боткина, ***РМАПО, Москва
Возбудитель
На сегодняшний день общая распространенность носительства токсоплазмы в мире оценивается в пределах 40-70%; иногда приводятся и более высокие проценты. Однако статистика обнаруживает выраженную региональную зависимость, что отчасти обусловлено неравномерностью распределения самой токсоплазмы в земной экосистеме (в Южной Корее, например, ее почти совсем нет, а в Южной Америке очень много – в некоторых областях заражено до 90% населения). Частота встречаемости в России оценивается на уровне 20%, то есть каждый пятый из нас является, как минимум, носителем.
В течение активного, острого периода течения токсоплазмоза (2-3 недели) больная кошка с фекалиями выделяет порядка двух миллиардов цист.
Жизнеспособность их сохраняется, в зависимости от условий, до двух и более лет.
Заражение
Кроме того, возможно внутриутробное трансплацентарное заражение от первично инфицированной матери. Обратим на это особое внимание.
Патогенез
Опасность для человека, симптоматика
Крайне важно отметить: доля инфицированных токсоплазмой людей, у которых развивается клинически значимый токсоплазмоз, очень мала – по разным оценкам, она варьирует от долей процента до нескольких процентов. Животные и птицы болеют токсоплазмозом гораздо чаще (см. ниже). Человек же практически всегда переносит токсоплазменную инвазию бессимптомно, поскольку иммунная система мгновенно распознает этот микроорганизм как враждебный – и реагирует настолько мощно, что инфицированный обычно даже не узнаёт о том, что был чем-то заражен. Кроме того, исключена опасность заразиться от инфицированного, даже если он переживает острый период токсоплазмоза (как правило, не подозревая об этом).
Таким образом, нет никаких оснований создавать лепрозории для носителей, повсеместно истреблять диких кошек и избавляться от кошек домашних, а ребенка выпускать на улицу лишь в скафандре высшей эпидемиологической защиты. Можно сказать, что мы, взрослые люди, если и были когда-то инфицированы, то эта проблема давным-давно решена, причем раз и навсегда: к токсоплазме вырабатывается устойчивый пожизненный иммунитет, и даже если человек попадает в незначительный процент переболевших в клинически значимой степени (лихорадка, легкое общее недомогание, мышечные боли, лимфаденопатия, спленогепатомегалия), то это уже не повторяется ни при каких обстоятельствах.
Как показано выше, токсоплазма способна проникать через плаценту в организм плода. Единственный вариант и единственное стечение обстоятельств, при которых это представляет реальную угрозу, – первичное инфицирование токсоплазмой в период беременности, т.е. первое в жизни заражение женщины, у которой ранее не было иммунитета к возбудителю. В этом случае действуют следующие статистические риски и клинические закономерности.
Чем больше срок беременности, тем выше проницаемость плаценты и вероятность инфицирования плода: в зависимости от триместра, этот риск оценивается как 15%, 25% и 70%.
Если внутриутробное заражение все же произошло, то тяжесть последствий для плода тем больше, чем меньше срок беременности. Вероятности того, что внутриутробный токсоплазмоз в дальнейшем ничем себя не проявит, – не существует. Надеяться на то, что произойдет уникальное чудо и последствий удастся избежать, к несчастью, не приходится даже в том случае, когда инвазия сразу же диагностирована и подвергнута интенсивному квалифицированному лечению. На практике внутриутробный токсоплазмоз означает смерть плода со спонтанным абортом, рождение с гидро- либо микроцефалией, или же развитие, в дальнейшем, тяжелейших поражений центральной нервной, зрительной и других систем организма. Интеллектуальная недостаточность характеризуется глубокой степенью выраженности.
В подобной ситуации, – когда происходит первичное заражение беременной женщины, – приходится ставить вопрос об искусственном прерывании беременности.
На последующие беременности вышеописанные риски не распространяется: речь, повторим, идет лишь о ситуациях, когда первичная инвазия токсоплазмы приходится на гестационный период.
Частота врожденного токсоплазмоза на сегодняшний день варьирует в пределах от 1:1000 до 1:10000 новорожденных.
Диагностика
Стандартом диагностики токсоплазмоза, в том числе на этапе внутриутробного развития, является серологическое исследование: реакция непрямой флюоресценции или ИФА (иммуноферментный анализ). Дополнительно назначают УЗИ и другие исследования по показаниям.
Лечение
Профилактика
Учитывая вышесказанное, женщине при планировании или наступлении беременности чрезвычайно важно пройти все назначенные обследования, ни в коем случае не игнорируя какие бы то ни было анализы и процедуры. Если обнаружено отсутствие иммунитета к токсоплазме, или же имеет место выраженный иммунодефицит, необходимо принимать все меры предосторожности, особенно при наличии в доме кошки: животное не должно гулять на улице и питаться сырым мясом. Санитарную обработку туалетного лотка следует производить регулярно, и лучше бы к нему не прикасаться человеку, для которого токсоплазма представляет опасность. Кошку желательно обследовать в ветеринарной клинике и, если выявлен паразитоз, качественно пролечить. Возможно, наилучшим решением является, – как бы тяжело это ни было для большинства семей, – расстаться с домашним питомцем, по крайней мере временно, на период вынашивания беременности.
Овощи и фрукты необходимо тщательно отмывать; любые мясные продукты должны проходить достаточную термическую обработку, а столы и доски, на которых разделывается мясо, – очищаться с применением моющих средств. Все гигиенические процедуры, особенно после любого контакта с землей, овощами, фруктами, ягодами и т.д., лица из группы риска должны выполнять сразу же, с мылом, самым тщательным образом.
Читайте также:

