Лептоспироз у человека какие анализы сдать
Обновлено: 24.04.2024
Лептоспироз Лептоспирозы – группа природноочаговых нетрансмиссивных зоонозов, сходных по этиологии и клиническим проявлениям. Возбудителями лептоспироза являются микроорганизмы рода Leptospira, семейства Leptospiracea, порядка Spirohaetales. Род Leptospira объединяет патогенные и сапрофитные виды лептоспир. В основу систематики как патогенных, так и сапрофитных лептоспир положены антигенные различия. Основным таксоном у лептоспир является серовар, серовары с родственной антигенной структурой объединены в серогруппы. В этиологической структуре лептоспирозов человека преобладают возбудители серогрупп Grippotyphosa, Icterohaemorrhagiae, Canicola, Pomona, Sejroe.
В России лептоспироз регистрируется во всех федеральных округах, наиболее высокая заболеваемость приходится на Центральный федеральный округ (Москва и Московская область, Смоленская, Тульская области), Северо-западный ФО (Вологодская область, Санкт-Петербург), Южный ФО (Краснодарский край), Приволжский ФО (Республика Мордовия, Республика Удмуртия, Кировская область, Пермский край). Резервуарными хозяевами лептоспир в природных очагах являются грызуны: серые крысы, обыкновенные полевки, полевые и домовые мыши и насекомоядные: ежи и землеройки. В антропургических очагах лептоспиры циркулируют среди свиней, крупного и мелкого рогатого скота, лошадей, собак, в популяциях крыс и домовых мышей.
Заражение человека может происходить через воду пресных естественных и искусственных водоемов (при купании, рыбной ловле, питье воды и т.д.), при употреблении инфицированных лептоспирами пищевых продуктов, прямом контакте с больными животными. Для лептоспироза свойственна осенне-летняя сезонность, но от домашних животных-лептоспироносителей можно заразиться в любое время года. Регистрируется как спорадическая заболеваемость, так и эпидемические вспышки.
Инкубационный период длится от 7 до 20 дней, во время которого развивается кратковременная бессимптомная лептоспиремия, вслед за ней происходит паренхиматозная диффузия лептоспир в печень, почки, надпочечники, селезенку, легкие, возможно проникновение в ткани мозга. Вторая фаза, или начальный период заболевания, длящийся, как правило, 3–7 дней, заключается в развитии клинической картины заболевания: высокая лихорадка, головная боль, тошнота, то есть проявлений интоксикации организма, вызванной эндотоксинами лептоспир при повторном выходе лептоспир в кровь; вторая фаза заканчивается повторной паренхиматозной диффузией. В разгар заболевания отмечается максимальный уровень токсемии и поражения внутренних органов: печени, почек, легких, эндокарда; заболевание может осложниться геморрагическими явлениями различной степени выраженности (геморрагическая сыпь на коже и слизистых оболочках, мелкие диапедезные органные кровоизлияния, внутренние и наружные кровотечения), развитием инфекционно-токсического шока, острой почечной или острой печеночно-почечной недостаточности. Через месяц остается возможным развитие осложнений со стороны почек, сердца, ЦНС; через 1,5 месяца, как, правило, наступает стадия реконвалесценции и формирование длительного серогруппспецифического иммунитета.
Дифференциальная диагностика
- Инфекционные заболевания: ГЛПС, геморрагические лихорадки, вирусные гепатиты, иерсиниозы, менингококковая инфекция, инфекционный мононуклеоз, клещевой энцефалит, боррелиоз, острые кишечные инфекции, пневмонии и серозные менингиты иной этиологии;
- соматические заболевания: пиелонефрит, панкреатит, почечная колика, заболевания крови;
- отравления.
Показания к обследованию
Лихорадка с общеинтоксикационным синдромом у лиц, находившихся в последние 1,5 месяца на территории, эндемичной по лептоспирозу, особенно при наличии симптомов: острое начало болезни, высокая лихорадка, боли в икроножных мышцах, гиперемия лица, инъекция склер и гиперемия конъюнктивы, экзантема, множественные геморрагические высыпания на различных участках тела, боли в пояснице, микро- и макрогематурия, олиго- или анурия, увеличение размеров печени, развитие желтухи.
Материал для исследований
- Кровь, СМЖ, моча – обнаружение ДНК, культуральные исследования;
- сыворотка крови – определение АТ;
- кровь – микроскопические исследования.
Этиологическая лабораторная диагностика включает визуальное выявление лептоспир с использованием микроскопии, изоляцию микроорганизма методом посева на специальных средах, обнаружение ДНК лептоспир, определение АТ IgM и IgG или суммарных АТ к АГ лептоспир.
Сравнительная характеристика методов лабораторной диагностики
Диагностическая чувствительность выявление ДНК лептоспир методом ПЦР в крови пациентов, взятой на первой неделе заболевания, составляет 55–90%, на второй неделе заболевания – 30–40%, на третьей неделе заболевания ДНК лептоспир в крови обнаруживается у 15–25% больных. Специфические АТ при использовании методов микроагглютинации (РМА) или реакции макроагглютинации на стекле (слайд-агглютинация) на первой неделе заболевания выявляются у 18–30% заболевших, на второй-третьей неделе заболевания – у 70–80%, на 4-й неделе – у 90%. При использовании метода ИФА АТ IgM и IgА можно определить на первой неделе болезни, максимальных значений эти АТ достигают к третьей неделе. Начало обнаружения АТ IgG – 5–6 дни болезни, их максимальная концентрация наблюдается на 5-й неделе заболевания. При тяжелом течении лептоспироза отмечается подавление иммуногенеза, следствием чего является замедление первичного появления АТ или их отсутствие.
При использовании для лабораторного подтверждения лептоспироза результатов определения АТ необходимо исследовать образцы крови, взятые с интервалом в 7–10 дней (парные сыворотки). При применении РМА с использованием панели лептоспир различных серогрупп, актуальных для территории, где произошло заражение больного, возможно определение серогрупповой принадлежности выявленных АТ, что важно для последующего эпидобследования очага.
Для визуального обнаружения лептоспир методом микроскопии и их изоляции с использованием культуральных методов, пробы крови рекомендуется исследовать на 1-й неделе заболевания, СМЖ (при развитии серозных менингитов) – на 2-й, мочу – на 3-й неделе.
Обнаружение лептоспир в пробах биологического материала при использовании микроскопии является достаточно простым методом раннего подтверждения лептоспирозной этиологии заболевания. Использование микроскопических исследований ограничивает низкая аналитическая чувствительность: 106 клеток/мл. Ограничение на использование данного метода накладывает также короткий период выживания лептоспир в моче: при температуре 20–25°С материал должен быть исследован в течение 6–8 часов с момента взятия пробы.
Особенности интерпретации результатов лабораторных исследований
Клинический диагноз лептоспироз считают подтвержденным при выделении инфекционного агента, идентифицированного как патогенный для человека вид лептоспиры; при выявлении методом ИФА АТ IgM или IgA и роста титров IgG при исследовании образцов крови, взятых в динамике; при выявлении методами РМА, слайд-агглютинации нарастания титров АТ в образцах крови, взятых в динамике. Обнаружение ДНК лептоспир в крови и СМЖ пациента является основанием для предварительной постановки диагноза.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Целиакия: причины появления, симптомы, диагностика и способы лечения.
Определение
Целиакия, или глютеновая энтеропатия (ГЭ) — это аутоиммунное заболевание тонкой кишки, характеризующееся непереносимостью протеинов клейковины (глютенов) пшеницы и других злаков и сопровождающееся развитием гиперрегенераторной атрофии слизистой оболочки тонкой кишки, которая проявляется синдромом мальабсорбции (нарушения всасывания).
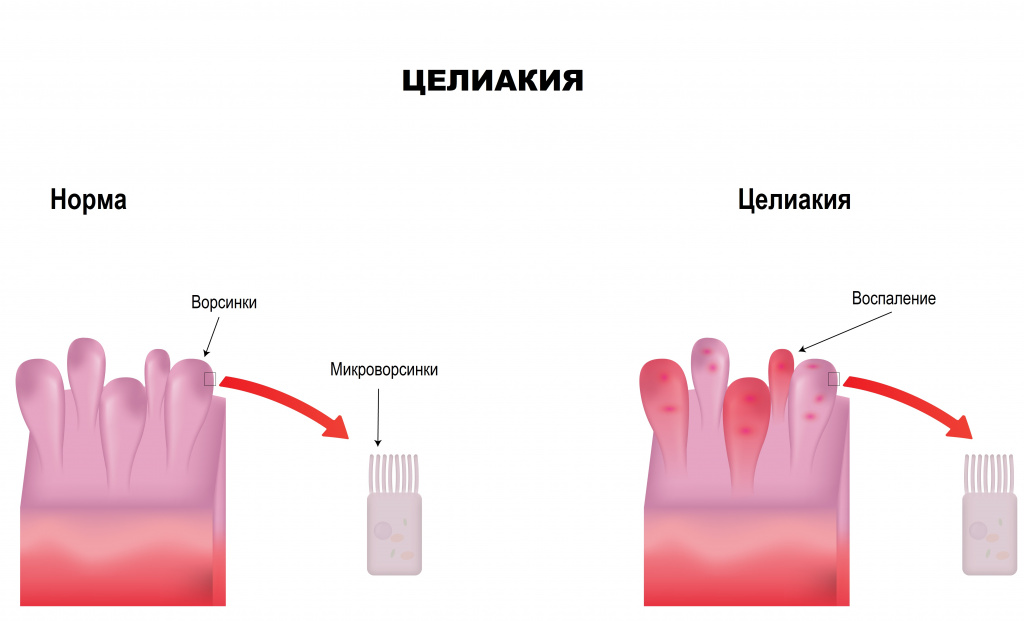
Причины появления целиакии
Целиакия передается по наследству (90% больных целиакией являются носителями гена HLA-DQ2, еще 10% – гена HLA-DQ8), а также сопутствует некоторым другим заболеваниям. В группу риска входят люди, у близких родственников которых диагностированы следующие заболевания:
- целиакия,
- герпетиформный дерматит;
- сахарный диабет 1 типа;
- аутоиммунный тиреоидит;
- микроскопический колит (лимфоцитарный или коллагенозный колит);
- болезнь Эддисона.
- беременность, роды, грудное вскармливание,
- бактерии и вирусы,
- операции,
- сильный стресс.
Систематизацию клинических форм целиакии в 2005 году провели российские ученые А.И. Парфенов, Л.М. Крумс, Е.А. Сабельникова и предложили выделять типичную, атипичную, латентную, рефрактерную и бессимптомную целиакию.
Типичная форма манифестирует, как правило, в раннем детском возрасте и протекает с синдромом нарушенного всасывания (СНВ) II–III степени тяжести. Для этой формы характерны следующие проявления: диарея, полифекалия, метеоризм, анемия, истощение, гипопротеинемические отеки, полигиповитаминоз, отставание в развитии и др.
Атипичная форма проявляется внекишечными симптомами, связанными с нарушением всасывания или иммунными нарушениями (геморрагический синдром, остеомаляция, миопатия, аутоиммунный гепатит, полиартралгии и др.). Назначение аглютеновой диеты у этих больных ведет к выздоровлению или значительному улучшению состояния.
Латентная форма целиакии протекает субклинически. Как правило, заболевание впервые проявляется во взрослом или пожилом возрасте, преимущественно у женщин, и характеризуется тяжелым течением с СНВ II–III степени или малосимптомным течением с СНВ I степени тяжести. Для данной формы болезни характерна хроническая диарея, аменорея, железодефицитная анемия, остеопороз.
Рефрактерная форма — вариант глютеновой энтеропатии, отличающийся тяжелым течением и отсутствием стойкого эффекта от безглютеновой диеты. Предполагают, что данный вид целиакии может быть латентной формой Т-клеточной лимфомы тонкой кишки.
Бессимптомная форма целиакии может протекать в двух вариантах:
- скрытом: симптомы мальабсорбции отсутствуют, но в слизистой оболочке кишки есть признаки гиперрегенераторной атрофии;
- потенциальном: слизистая оболочка тонкой кишки не изменена, но увеличено количество некоторых форм межэпителиальных лимфоцитов, число митозов в клетках крипт. Наблюдается обычно у близких родственников больных целиакией.
Многоликость глютеновой энтеропатии объясняется разной чувствительностью пациентов к глиадину, состоянием иммунной системы и выраженностью гистологических изменений кишечника.
Симптомы целиакии
Классическим проявлением целиакии является синдром мальабсорбции (нарушенного всасывания), проявляющийся в виде хронической диареи, чаще всего со стеатореей (избыточным количеством жира в кале), полифекалией (аномально большим объемом кала), вздутием живота, болью в животе. Реже отмечаются гипопротеинемические отеки, признаки дефицита электролитов и витаминов, потеря массы тела.

У некоторых пациентов кишечная симптоматика при целиакии может отсутствовать либо отходить на второй план, а преобладают внекишечные проявления:
1. Заболевания эндокринной системы:
- сахарный диабет 1-го типа;
- аутоиммунный тиреоидит;
- гиперпаратиреоидизм.
- церебральная атаксия;
- невропатия;
- эпилепсия;
- головная боль;
- депрессия;
- периферическая полинейропатия.
- первичный билиарный цирроз печени;
- аутоиммунный гепатит;
- стеатогепатит;
- холангит;
- панкреатическая недостаточность.
- бесплодие;
- задержка менструаций;
- апоплексия яичников;
- невынашивание беременности.
- аутоиммунный миокардит;
- идиопатическая кардиомиопатия.
- лимфомы тонкой кишки;
- неходжкинская лимфома;
- аденокарцинома тонкой кишки.
- остеопения;
- остеомаляции;
- остеопороз;
- переломы;
- аномалии зубной эмали.
- дерматит Дюринга;
- язвенный стоматит;
- псориаз;
- гнездная алопеция.
- латентный,
- активный,
- неполной ремиссии,
- полной ремиссии.
Для диагностики целиакии обязательными являются лабораторные исследования:
Синонимы: ОАК. CBC without differential. Краткая характеристика исследования Общий анализ крови Кровь состоит из жидкой части (плазмы) и клеточных, форменных элементов (эритроциты, лейкоциты, тромбоциты). Состав и концентрация клеточных элементов в крови меняются при различных физио.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Определение
Энцефалит – это группа заболеваний, для которых характерно воспаление вещества головного мозга. В настоящее время энцефалитом называют не только инфекционное, но и инфекционно-аллергическое, аллергическое и токсическое поражения мозга.
Причины возникновения энцефалитов
Первичные энцефалиты, к которым относятся клещевой энцефалит, герпетический энцефалит, энцефалит, вызванный вирусом Коксаки (А9, В3, В6), ЕСНО (2, 11, 24) и некоторые другие, возникают в результате проникновения вируса через гематоэнцефалический барьер, по причине чего повреждаются нейроны головного мозга и развивается воспалительный процесс.
Вторичные энцефалиты рассматриваются как осложнение перенесенных инфекционных заболеваний: гриппа, краснухи, кори, ветряной оспы, лептоспироза и др., а также поствакцинальные энцефалиты.
Гриппозный энцефалит вызывают вирусы гриппа А1, А2, А3, В. Патогенетическими механизмами при гриппозной инфекции становятся токсическое поражение головного мозга и недостаточность мозгового кровообращения.
Возбудителем энцефалита при краснухе становится РНК-содержащий вирус семейства Togaviridae.
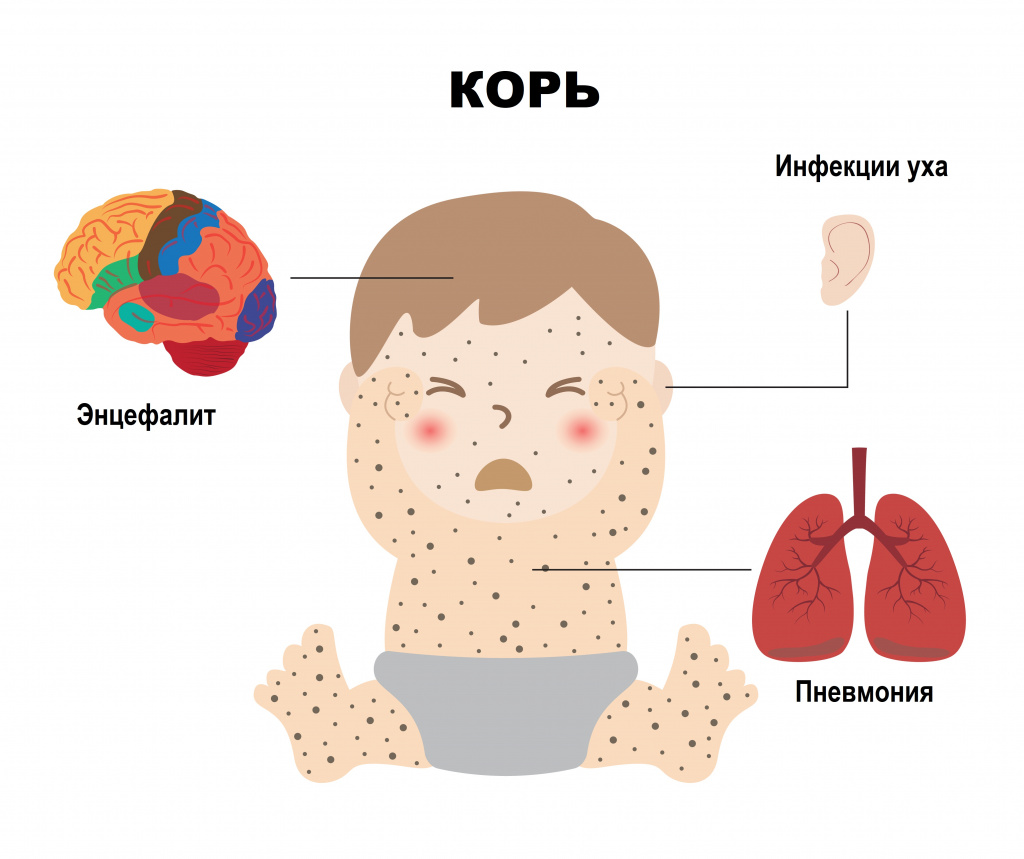
Коревой энцефалит вызывается вирусом кори – это форма поражения головного (иногда и спинного) мозга (энцефаломиелит). Энцефалит считается самым распространенным неврологическим осложнением кори (более 95% всех случаев неврологических осложнений). Он наблюдается с частотой 1:1000 случаев кори, чаще у детей старше 2 лет - как у мальчиков, так и у девочек.
Поствакцинальные энцефалиты могут развиваться после вакцинации, особенно после введения некоторых антирабических прививок. В основе поствакцинальных энцефалитов лежит перекрестная аутоиммунная реакция на антигены вакцины и антигены мозга, морфологически выражающаяся в воспалительном поражении мозговых сосудов и окружающего вещества мозга.
Лептоспирозные энцефалиты вызывается Leptospira interrogans. Источником заражения являются домашние инфицированные животные. Наиболее распространен лептоспироз в южных регионах. В развитии заболевания большое значение имеют аутоиммунные реакции.
В группу подострых склерозирующих лейкоэнцефалитов входят формы хронических и подострых энцефалитов с прогрессирующим тяжелым течением (энцефалит с включениями Даусона, подострый склерозирующий лейкоэнцефалит Ван-Богарта, узелковый панэнцефалит Петте Деринга).
В развитии болезни большую роль играют персистирующие вирусные инфекции: коревая, энтеровирусная, вирус клещевого энцефалита. У больных подострым склерозирующим панэнцефалитом обнаруживают в крови и ликворе очень высокие титры коревых антител (не отмечаемые даже у больных с острой коревой инфекцией). Кроме того, значимое место занимают аутоиммунные механизмы, а также приобретенный или врожденный дефект иммунной системы.
Классификация заболевания
Классификация энцефалитов отражает факторы, приводящие к развитию заболевания, и связанные с ними клинические проявления и особенности течения.
По срокам возникновения различают:
- первичные энцефалиты - самостоятельные заболевания, вызываемые преимущественно нейротропными вирусами:
- вирусные: полисезонные (герпетический, энтеровирусный, гриппозный, цитомегаловирусный, вирус бешенства и др.); арбовирусные, или трансмиссивные (клещевой, комариный (японский), австралийский долины Муррея, американский Сент-Луис); вызванные неизвестным вирусом (эпидемический);
- микробные и риккетсиозные (при сифилисе, болезни Лайма, сыпном тифе и др.);
- коревые, краснушные, ветряночные;
- поствакцинальные;
- бактериальные и паразитарные (стафилококковый, стрептококковый, туберкулезный, токсоплазменный, хламидийный, малярийный и др.)
Заболевание может протекать в острой, подострой, хронической и рецидивирующей форме и поражать различные отделы головного мозга.
Различают среднее, тяжелое и крайне тяжелое течение энцефалита.
Симптомы энцефалита
Первичные полисезонные энцефалиты
Инкубационный период может варьировать от 2-3 дней до нескольких недель. Наблюдаются продромальные явления в виде сниженного аппетита, вялости, субфебрилитета. Начало заболевания происходит на фоне резкого подъема температуры. Выраженность клинических проявлений и их течение могут быть разными - от легких стертых форм до тяжелых молниеносных, при которых летальный исход наступает на 1-2-е сутки заболевания. Продолжительность острого периода составляет от 3-5 дней до нескольких недель. Тяжелое течение с выраженным и быстро прогрессирующим отеком головного мозга отмечается в основном при энцефалитах герпетической этиологии.На первый план выходит общемозговая симптоматика: рвота, судорожные пароксизмы, вялость, расстройства сознания, возможны дыхательные и сердечно-сосудистые нарушения. Преобладание общемозговых проявлений, нарушения сознания и выраженные менингеальные симптомы (т. е. вовлечение в воспалительный процесс церебральных оболочек) более характерны для детей младшего возраста.
Очаговая симптоматика зависит от локализации патологических изменений в головном мозге - выделяют стволовую, мозжечковую, полушарную формы.
Мозжечковый синдром характеризуется острым расстройством координации, тремором, мышечной гипотонией. Имеет наиболее благоприятное течение с полным регрессом указанной симптоматики и без последующей задержки психомоторного развития даже у маленьких детей.
Стволовой синдром проявляется поражением проходящих в стволе черепных нервов и пирамидных путей. Возникает специфическое нарушение походки и координации движений, вызванное патологической работой вестибулярного аппарата, присутствуют глазодвигательные нарушения (косоглазие, парез взора, двоение в глазах), резкая мышечная гипотония, сменяющаяся затем спастическим парезом рук и ног. Реже развиваются расстройство глотания, сосания, фонации. Возможны нейроэндокринные нарушения, а в тяжелых случаях - сердечные и дыхательные расстройства центрального генеза, которые могут стать причиной летального исхода.
Полушарный синдром чаще сопровождается расстройствами сознания, нарушениями ориентации в пространстве и во времени, вялостью. Возможны эпизоды психомоторного возбуждения, галлюцинаторный синдром. В первые дни возникают эпиприступы, которым, как правило, предшествуют парезы, развивающиеся остро и инсультоподобно.
Типичные симптомы начала герпетического энцефалита - лихорадка, головная боль, нарушение психических функций, эпилептические припадки, мышечная слабость, снижение памяти. Далее присоединяется нарушение поведения, речи и расстройство координации движений.
Вторичные энцефалиты при общих инфекциях
Клиническая картина гриппозного энцефалита развивается чаще в конце заболевания и даже через 1-2 недели после выздоровления: самочувствие больного снова ухудшается, повышается температура тела, возникают общемозговые симптомы (головная боль, рвота, головокружение). Возможно поражение периферической нервной системы в виде невралгии тройничного и большого затылочного нервов, пояснично-крестцового и шейного радикулита, поражения симпатических узлов. В крови определяют лейкоцитоз или лейкопению. Течение благоприятное. Заболевание продолжается от нескольких дней до месяца и заканчивается полным выздоровлением.
Коревой энцефалит развивается остро, чаще на 3-5-й день после появления сыпи. К этому моменту температура тела может уже нормализоваться, но нередко снова поднимается до высоких значений. Выявляют менингеальные симптомы, проявляющиеся головной болью, головокружением, тошнотой, рвотой, нарушением сознания (возбуждением, бредом, галлюцинациями); наблюдают поражение черепно-мозговых нервов; нарушение двигательной функции конечностей и функции тазовых органов. При тяжелом течении летальность достигает 25%, причем тяжесть энцефалита не зависит от течения кори.
![Коревой энцефалит.jpg]()
Энцефалит при ветряной оспе - тяжелое инфекционно-аллергическое заболевание. Его клиническая картина развивается на 3-7-й день после появления высыпаний (редко в более поздние сроки или до периода высыпаний) и проявляется гипертермией, коматозным состоянием, судорогами, менингеальными симптомами (головной болью, головокружением, тошнотой, рвотой, нарушением сознания), нарушением двигательных функций. Рано появляются признаки отека мозга. Течение обычно благоприятное и лишь в единичных случаях - очень тяжелое с риском летального исхода. После выздоровления могут длительно сохраняться парезы, гиперкинезы, судорожные припадки.
Энцефалит при краснухе может развиться через 1-10 (чаще 2-5 дней) после появления сыпи. Известны случаи манифестации острого энцефалита за несколько дней до появления сыпи, а также без высыпаний, что осложняет постановку диагноза. Чаще всего энцефалит развивается у детей в возрасте 3-15 лет, у взрослых случаи энцефалита описываются в качестве казуистики. Редко неврологическая симптоматика сопровождается вторичными высыпаниями.
Лептоспирозные энцефалиты характеризуются острым началом и протекают как респираторно вирусная инфекция. Наблюдается волнообразная лихорадка с болями в мышцах. В последующем в клинической картине могут преобладать симптомы поражения печени и почек, а со 2–3-й недели - поражения нервной системы в виде энцефалита или энцефаломиелита с вовлечением черепных нервов. Течение заболевания, как правило, благоприятное, иногда возможно спонтанное выздоровление.
Подострым склерозирующим лейкоэнцефалитам подвержены в основном дети и подростки до 15 лет, однако иногда болезнь регистрируется и у взрослых. Начало заболевания подострое: появляются симптомы, расцениваемые как неврастенические - рассеянность, раздражительность, утомляемость, плаксивость.
Различают 4 стадии склерозирующего лейкоэнцефалита:
- 1-я стадия продолжается до 6 месяцев: возможны изменения личности, перепады настроения или депрессия, могут присутствовать лихорадка и головная боль;
- 2-я стадия может включать судороги, мышечные спазмы, потерю зрения и слабоумие;
- 3-я стадия характеризуется быстрым прогрессированием деменции, усилением тонуса мышц при ослаблении судорожного синдрома. На этой стадии осложнения могут привести к летальному исходу;
- 4-я стадия характеризуется нарушениями дыхания, частоты сердечных сокращений и кровяного давления, что приводит к коме и смерти.
В 80% случаев заболевание длится 1–3 года, 10% больных живут дольше (до 10 лет), у 10% описано молниеносное течение, когда смерть наступает менее чем через 3 месяца. Специфического лечения нет.
Диагностика энцефалитов
Цель диагностики первичных полисезонных энцефалитов - установление вида возбудителя. Для этого проводится серия серологических исследований. Диагностическое значение имеет многократное нарастание титра антител к определенному вирусу при сравнении результатов исследования сыворотки пациента, взятой в начале заболевания и спустя 2 недели.
Энцефалит, вызванный вирусом простого герпеса, выявляют с помощью определения повышения уровня специфических антител IgM и Ig G в крови.
Синонимы: Анализ крови на антитела к герпесу 1, 2; IgM антитела к вирусу простого герпеса первого и второго типа; Антитела класса M к ВПГ-1, ВПГ-2. Нerpes simplex virus type 1 (HSV-1), Нerpes simplex virus type 2 (HSV-2), IgM; Anti-HSV-1, 2 IgM antibodies; IgM to HSV-1 and HSV-24 HSV-1, 2-speci.
Выявление возбудителя лептоспироза (Leptospira) – инфекционного заболевания, которому подвержены многие животные (в том числе собаки, кошки, домашний скот, крысы) и которое может передаваться человеку. Распространяясь с мочой и калом, микроскопического размера лептоспиры поражают органы и ткани, отравляя организм продуктами своей жизнедеятельности.
Синонимы русские
Лептоспира, ДНК [ПЦР].
Синонимы английские
Leptospira, PCR (DNA).
Метод исследования
Полимеразная цепная реакция (ПЦР).
Какой биоматериал можно использовать для исследования?
Венозную кровь, ликвор.
Как правильно подготовиться к исследованию?
Подготовки не требуется.
Общая информация об исследовании
Начиная со второй недели заболевания лептоспиры накапливаются преимущественно в извитых почечных канальцах и исчезают из крови и других тканей. Такая избирательная концентрация в эпителии и межклеточном пространстве почечной ткани приводит к тяжелым повреждениям канальцев почек и нарушению мочеобразования, а в тяжелых случаях вызывает анурию (отсутствие мочеиспускания) и уремию (накопление в крови токсических продуктов азотистого обмена, нарушение концентрации электролитов крови и др.).
При персистенции лептоспир в почках признаков острой инфекции, как правило, нет, заболевание часто протекает в латентной форме.
Решающими для подтверждения диагноза "лептоспироз" в любой фазе заболевания, в том числе и на более поздних сроках инфекционного процесса, являются результаты лабораторных исследований: бактериологического (посева), серологического (определения титров специфических антител в сыворотке крови), молекулярно-генетического (определения ДНК лептоспир методом ПЦР).
Недостатком бактериологического метода является длительность проведения исследования из-за медленного роста лептоспир на питательных средах.
Серологическое исследование теряет свою значимость после 19-20-го дня болезни в связи с постепенным снижением титра сывороточных антител вследствие прекращения циркуляции лептоспир в крови. Кроме того, при тяжелом течении лептоспироза, особенно на фоне интенсивной терапии антибактериальными препаратами, антитела могут выявляться лишь спустя 2-3 месяца от начала болезни.
Полимеразная цепная реакция (ПЦР) – это молекулярно-генетический метод исследования, в ходе которого выявляется генетический материал (ДНК) лептоспиры в образце биоматериала. Методу свойственна высокая специфичность (100 %), чувствительность (от 10 до 1000 копий ДНК в пробе) и высокая диагностическая эффективность, даже на фоне проводимого лечения антибактериальными препаратами.
Одним из основных достоинств ПЦР является то, что она позволяет выявить возбудителя даже при условии присутствия последнего в организме в очень малых количествах.
Вместе с тем отрицательный результат ПЦР не должен быть основанием для прекращения диагностики, так как определить точно конкретную фазу заболевания не всегда возможно. Чувствительность лабораторной диагностики при лептоспирозах может быть значительно повышена за счет параллельного использования серологических тестов (определения титров антител в сыворотке крови) и метода ПЦР вне зависимости от фазы заболевания.
Для чего используется исследование?
- Для диагностики лептоспироза.
- Для дифференциальной диагностики лептоспироза с другими заболеваниями.
Когда назначается исследование?
- При диагностике лептоспироза.
- При подозрении на персистенцию лептоспир в почках.
Что означают результаты?
Референсные значения: отрицательно.
Причины положительного результата:
Причины отрицательного результата:
- период полного выздоровления, когда формируется стойкий иммунитет и лептоспиры в организме уже отсутствуют.
Что может влиять на результат?
- Применение некоторых противовирусных препаратов – ингибиторов полимераз – иногда приводит к ложноотрицательному результату.
Также рекомендуется
Кто назначает исследование?
Инфекционист, нефролог, уролог, терапевт, врач общей практики, хирург, реаниматолог.
Читайте также: