Листериоз птиц санитарная оценка
Обновлено: 19.04.2024
При установлении листериоза куриное мясо и мясопродукты отправляют на проварку, а позже отправляют на мясные хлеба или консервы. Внутренние органы подлежат утилизации (Казакова Е.Е., 2017).
В нашем случае были проведены исследования такие как:
-органолептическое исследование: во всех трех пробах были показатели свежего мяса, а это: беловато-желтый цвет поверхности, в некоторых случаях с розоватым оттенком, во всех случаях при проведении пробы варкой был ароматный прозрачный бульон, в бульоне под номером три было незначительное количество хлопьев. рН мяса всех проб не превышает значения 6.5, что говорит о том, что мясо свежее;
-при микроскопировании мазков-отпечатков во всех трех случаях в 5 полях зрения были обнаружены единичные грамположительные кокки;
-в исследовании реакции на пероксидазу так же показало, что все образцы проб прошли успешно, все вытяжки согласно методике поменяли цвет с сине-зеленого на бурый. Реакция на аммиак и соли аммония пробы куриных бедер прошли так же успешно, при добавлении реактива Несслера помутнение не образовалось ни в одной пробирке с вытяжкой.
-при исследовании на сальмонеллез и листериоз на чашках Петри со средами XLD, ПАЛ и RVS роста бактерий рода salmonella и listeria не обнаружены
Поэтому, в связи с выше описанным можно сделать вывод, что тушка и внутренние органы соответствуют свежему мясу.
Ветеринарно-санитарная оценка мяса и внутренних органов цыплят-бройлеров при гепатозах
При наружном осмотре наличие патологических изменений (опухолей, травм и т.д.) не выявлено. Внешний вид клюва глянцевый, цвет слизистой оболочки ротовой полости бледно-розового цвета, незначительно увлажненная, блестящая; глазное яблоко выпуклое, роговица, блестящая. Поверхность тушек при осмотре сухая, бледно-желтого цвета с розовым оттенком; подкожная и внутренняя жировая ткань бледно-желтого цвета; серозные оболочки грудобрюшной полости влажные, блестящие, без патологических образований. Мышцы на разрезе слегка влажные, бледно-розового цвета; по консистенции плотные, упругие. Запах мяса специфический, свойственный свежему мясу птицы, посторонних запахов в мясе не установлено (рис. 22)
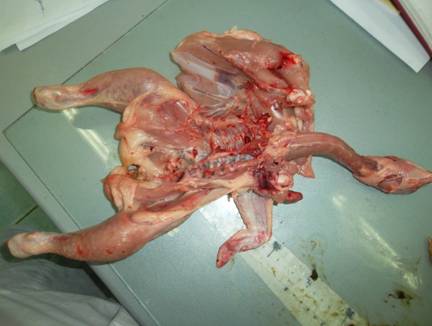
Рис. 22. Наружный осмотр тушки цыпленка – бройлера
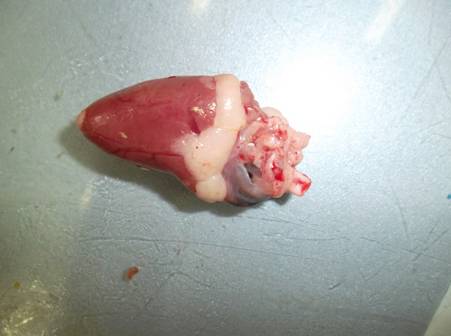
Осмотр внутренних органов проводили с кишечника и брыжейки: наличие кровоизлияний, воспалительных явлений, гельминтов не выявлены (рис 23).
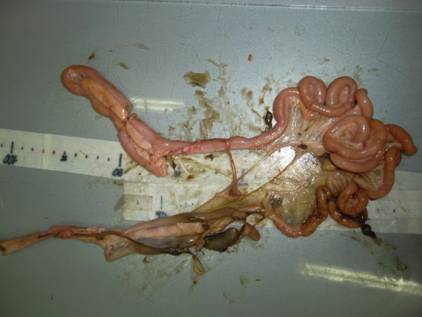
Рис 23. Осмотр кишечника и брыжейки
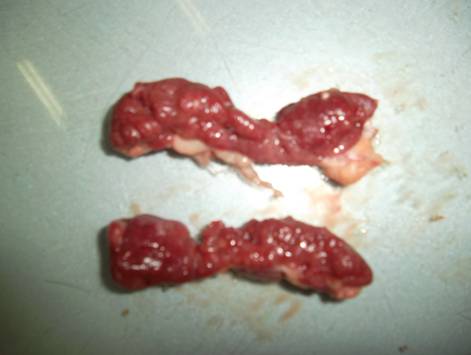
Затем в процессе полного потрошения исследуют желудок, селезенку, сердце, почки и легкие. Патологических образований не обнаружено, плотные по консистенции; наличие узелков, паразитов, гельминтов не выявлены. В результате исследований все органы по органолептическим показателям соответствовало свежему мясу как в норме, так и при патологии печени (рис.10).
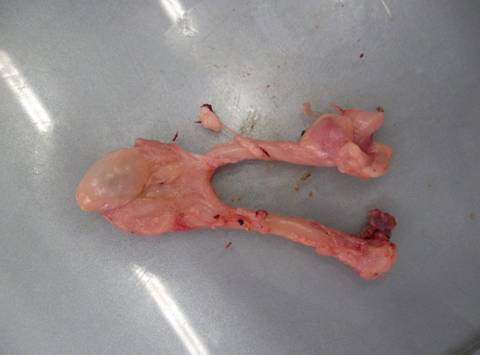
а) мышечный и железистый желудок

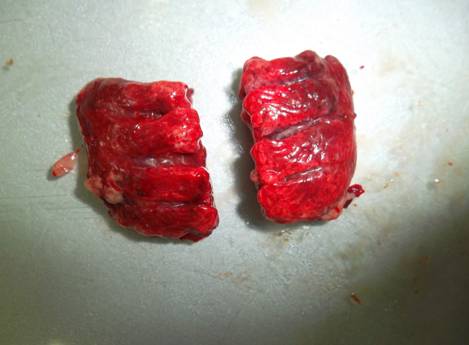
При гепатозах особое внимание обращали на состояние печени. Изменяется ее цвет, становится глинисто-желтым, увеличена в размерах.
Размеры: I) Левая доля:
1) - длина 21,7 мм
2) – длина 36,4 мм
По консистенции дряблая, матовая (рис. 25)
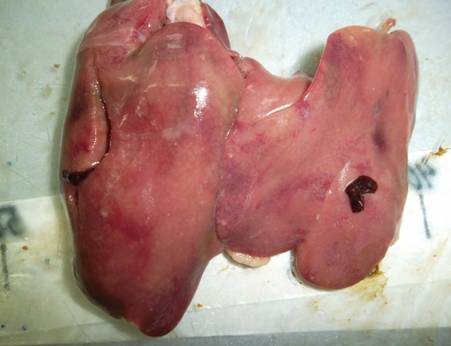
Рис 25. Печень цыпленка-бройлера при гепатозе
Санитарная оценка. Пораженную печень утилизируют, тушки выпускают без ограничений.
Выводы
1. В общей структуре болезней незаразной этиологии большой удельный вес занимают гепатозы. Этиология гепатозов существенно не изменилась.
2. За период исследования соотношение количества образцов к требованиям НД существенно не изменилось.
Потенциальным фактором распространения гепатозов является нарушение кормления птицы.
Печень имеет рыхлую консистенцию, желтовато-коричневого цвета.
3. Органолептические, физико-химические и микробиологические показатели, а также содержание тяжелых металлов (ртути, мышьяка, свинца) мяса и печени цыплят-бройлеров находились в пределах норм, установленных ГОСТом 51944-2002, СанПиНом 2.3.2. – 1078 – 01.
4. Показатели минерального состава мышечной ткани и печени цыплят опытной группы отличались от контрольной уменьшением содержания кальция, цинка, железа.
5. Мышечная ткань и печень характеризовались увеличением процента влаги на 5,86 и 4,59%, снижением белка в мясе на 14,18% и увеличением его в печени – на 39,46%; увеличением процента жира в печени контрольной группы на 28,09%, а в мышечной ткани - уменьшением на 31,17%.
6. При ветеринарно-санитарной оценке тушек и внутренних органов цыплят-бройлеров при гепатозах печень, как правило, утилизируют, а тушку выпускают без ограничений.
7. Были изучены требования нормативно-технической документации при проведении ветеринарно-санитарной экспертизы мяса птицы при листериозе.
8. Провели бактериологическое исследование мяса птицы.При исследовании на сальмонеллез и листериоз на чашках Петри со средами XLD, ПАЛ и RVS роста бактерий рода salmonella и listeria не обнаружены.
Список использованной литературы:
1. Антипов, Л. В.Методы исследования мяса и мясных продуктов / Л. В. Антипов, И. А. Глотов, И. А. Рогов. М. :Колос С, 2004. - 571с.
2. Алиева З.Б. Импортозависимость - угроза продовольственной безопасности России // Нац. интересы: приоритеты и безопасность. - 2010. - N 14. - С.66-70.
4.Бессарабов Б.Ф. Инфекционные болезни животных / Б.Ф.Бессарабов, Е.С. Воронин и др. // Под ред. А.А. Сидорчука - Москва: КолосС, 2008. – 671с.
6. Буяров В.С. Технологические и экономические аспекты производства мяса бройлеров // Комбикорма, 2012. - №4. с. 3-8.
8. Буярова Е.А. Изыскание новых путей повышения производства мяса цыплят у бройлеров //Птицеводческое хозяйство. Птицефабрика, 2011. - №5. с.32-35.
9. Бобровник В.С. Анализ рынка мяса и инкубационного яйца бройлеров // Птицеводство, 2013. – с.16-35.
10. Боровков М.Ф.Ветеринарно-санитарная экспертиза с основами технологии и стандартизации продуктов животнодства /В. П. Фролов, С.А. Серко. М.: КолосС, 2007. - 432с.
11. Вылегжанин А.Ф., БахтияроваЗ.Г., Ветеринарно-санитарная экспертиза с основами технологиии стандартизации продуктов животнодства. М.: КолосС 1989. – 235 с.
12. Густомесова Е.Н. Терапевтическая эффективность применения антигомотоксических препаратов //Материалы по антигомотоксической терапии заболеваний, разной этиологии и патогенеза//Биологическая медицина, 2008 № 5. - С.32 – 36.
13. Доктрина продовольственной безопасности Российской Федерации, 2010. - №120. - С. 101-106.
14. Демченко П.В. Биологические закономерности повышения продуктивности животных. М.: Колос, 1972. – с.234-241.
15. Дроздова Л.И. Печень птицы – живая лаборатория оценки качества кормления и содержания // Птицеводство. – 2013. - №6. – с.32-34.
16. Егоров И.А. Достижения и перспективы в области питания высокопродуктивной птицы. Всероссийский научно-исследовательский институт птицеводства – Сергиев Посад, 2000. – Т.75 – с.105-111.
18. Казакова Е.Е. Ветеринарно-санитарная экспертиза при листериозе / Е.Е. Казакова // В сборнике: Актуальные проблемы инфекционной патологии и биотехнологии Материалы Х-й Международной студенческой научной конференции.2017. С.
19. Ковалев Ю.Н. Птицеводство. Учебное пособие для 10-11 классов; Академия – Москва, 2012. – с.146-165.
22. Мальцев А.А. Технологические аспекты производства мяса бройлеров // Птица и ее переработка, 2012. – №3. с. 10-11.
23. Позняковский В. М. Экспертиза мяса и мясопродуктов: Учебно-справочное пособие. – 2-е изд., стер. – Новосибирск: Сиб. унив. издательство, 2002. – 526с.
24. Пасынкевич Т.М. Альтернативная терапия. Современные методы профилактики и лечения при нарушениях обмена веществ в организме птицы. М.: Колос, 2013. – с.246-278.
25. Подобед Л.И. Ожирение печени у курицы - путь к быстрой потере яичной продуктивности // Птицеводство. – 2011. - №2. – с.22-24.
27. Спиридонов И.А. Крупный бройлер - возможный сегмент рынка мяса птицы // Птицеводство, 2012. - №10.- с.6-9.
28. В.Н.Скурихин. Методы анализа витаминов А, Е, Д и каротина в кормах, биологических объектах и продуктах животноводства, 1996 г. – 95 с.
29. СтентонГланц. Медико-биологическая статистика, 1999 г. – 462 с.
30. Фисинин В.И. Промышленное птицеводство – М: Агропромиздат, 1991. с.145-178.
31. Хохлов И.В. Автореферат диссертации на соискание ученой степени кандидата ветеринарных наук. – Екатеринбург: УрГСХА,2007. - С. 3 – 5.
33. Юшкова Л.Я.Мероприятия по улучшению качества и безопасности пищевой продукции / Л.Я. Юшкова, Б.Н.Балыбердин, О.В. Галенпольских //Сборник научных трудов Всероссийского научно-исследовательского института овцеводства и козоводства. 2016. Т. 1. № 9. С. 344-347.
34. Яковлева Н.Д. Инновации и мировые тренды в производстве и реализации мяса бройлеров // Птица и птицепродукты. – 2001. - №2 – с.25.
35. Правила ветеринарного осмотра убойных животных и ветеринарно-санитарной экспертизы мяса и мясных продуктов: утв. М-вом сельского хозяйства СССР 27.12.83.
36. ГОСТ 28825-90. Мясо птицы. Приемка. – Введ. 1990-27-12. – М.: Изд-во стандартов, 1990.
37. ГОСТ Р 51944-2002. Мясо птицы. Методы определения органолептических показателей, температуры и массы. – Введ. 2002-03-10. – М.: Изд-во стандартов, 2001.
38. ГОСТ 7702.2.1-95. Мясо птицы, субпродукты и полуфабрикаты птичьи. Метод определения количества мезофильных аэробных и факультативно-анаэробных микроорганизмов. – Введ. 1994-01-01. - М.: Изд-во стандартов, 1993.
39. ГОСТ Р 50396.1-92. Мясо птицы, субпродукты и полуфабрикаты из мяса птицы. Метод определения количества мезофильных аэробных и факультативно-анаэробных микроорганизмов. – Введ. 1994-01-01. – М.: Изд-во стандартов, 1993.
40. ГОСТ 7702.2.4-93.Мясо птицы, субпродукты и полуфабрикаты птичьи. Методы выявления и определения количества Staphylococcusaureus. – Введ. 1993-21-10. – М.: Изд-во стандартов, 1994.
41. ГОСТ 7702.2.2-93.Мясо птицы, субпродукты и полуфабрикаты птичьи. Методы выявления и определения количества бактерий группы кишечных палочек. – Введ. 1993-21-10. – М.: Изд-во стандартов, 1994.
42. ГОСТ Р 52816-2007. Продукты пищевые. Методы выявления и определения количества бактерий группы кишечных палочек (колиформных бактерий). – Введ. 2007-01-01. – М.: Изд-во стандартов, 2007.
43. ГОСТ 7702.2.3-93.Мясо птицы, субпродукты и полуфабрикаты птичьи. Метод выявления сальмонелл. – Введ. 1993-21-10. – М.: Изд-во стандартов.
Заболевание животных, вызываемое мелкой палочковидной бактерией и характеризующееся поражением нервной системы, септическими явлениями, абортами и маститами. Восприимчивы к заболеванию крупный рогатый скот, овцы, козы, свиньи, лошади, кролики, а также куры, гуси, утки и индейки. Болеет и человек.
Возбудитель — Listeria monocytogenes. Это бесспоровая, грамположительная, слабо подвижная палочка. Листерии являются факультативным аэробом, в мазках из культур располагаются поодиночке, парами и цепочками, в мазках из патологического материала (паренхиматозных органов) похожи на возбудителя рожи свиней.
Листерии при температуре 70°С погибают через 30 минут, при 100°С — спустя 15 минут. Едкий натр и формалин в 2,5%-ных растворах обезвреживают их в течение 20 минут, 70-90° винный спирт — за 5 минут.
Предубойная диагностика. У крупного рогатого скота признаками этого заболевания является слабость, общее угнетение, отказ от корма, конъюнктивит, ринит, повышение температуры, тяжелые нервные поражения в виде нарушения координации движений (движения вперед боком с запрокинутой головой, круговые движения), неподвижный, тупой взгляд с пучеглазием, потеря зрения, приступы буйства, дрожание тела, судороги шейных и затылочных мышц, паралич ушей, губ нижней челюсти, у овец — одной или обеих задних конечностей. Овцы, особенно ягнята, после круговых движений останавливаются и стоят неподвижно с широко расставленными ногами, низко опустив голову и упираясь головой или всем телом в стенку.
У свиней при заболевании наблюдают признаки септицемии (общее угнетение, отказ от корма, зарывание в подстилку, повышение температуры), а в конце болезни — понижение температуры, затрудненное дыхание, одышка, изредка кашель, серозное истечение из носовой полости либо признаки поражения центральной нервной системы (мышечная дрожь, нарушение координации движения, своеобразная ходульная походка, особенно передних ног), парезы и полупараличи задних конечностей и задней части тела — передвижение ползком, су дорожные движения челюстей.
Послеубойная диагностика. У крупного рогатого скота обнаруживают расширение и переполнение кровью кровеносных сосудов и отечность мозговой оболочки, местами размягчение мозга. У молодняка находят кровоизлияния и дистрофические изменения в паренхиматозных органах.
У свиней при септической форме обнаруживают кровоизлияния на слизистой оболочке трахеи и на эпикарде, иногда дистрофические изменения и некроз в печени и селезенке, катаральное воспаление легких, гиперемию слизистой оболочки желудка и кишок.
Лабораторная диагностика. Для уточнения диагноза необходимо провести бактериологическое исследование: посевы из мозговой ткани вначале на простые, а затем на специальные среды. Из пораженных участков мозга и селезенки рекомендуется делать мазки и окрашивать их по Романовскому.
Ветеринарно-санитарная оценка. Туши и продукты убоя от животных, больных и подозрительных по заболеванию листериозом, выпускать в сыром виде запрещается. При наличии дистрофических или других патологических изменений в мускулатуре тушу и внутренние органы направляют на утилизацию.
При отсутствии дистрофических изменений в мышцах тушу, шпик и неизмененные органы разрешается перерабатывать на вареные, варено-копченые колбасы или консервы. При невозможности такой переработки их можно использовать на изготовление варено-копченых грудинок и кореек.
Патологически измененные внутренние органы, кишки и кровь, а также головы от больных листериозом животных направляют на утилизацию. Шкуры, снятые с больных животных, дезинфицируют.
Листериоз. Остропротекающая инфекционная болезнь, поражающая крупньш рогатый скот, овец, коз, свиней, лошадей, кроликов, птиц, зайцев, лисиц, других диких животных. Восприимчив к листериозу и человек.
Возбудитель - бактерия Listeria monocytogenes. Это аэробная грам-положительная подвижная палочка
Предубойная диагностика. Клиническая картина проявляется в трех формах: в виде поражения центральной нервной системы (нейролистериоз); в виде желудочно-кишечной септицемии с поражением внутренних органов; в виде воспаления плаценты (плацентит) с последующим абортом. На мясокомбинатах постановка диагноза затруднена из-за сходства клинических признаков болезни с другими заболеваниями. У крупного рогатого скота и овец преобладает энцефалитная форма с выраженным симптомокомплексом энцефалита и менингита. У овец она напоминает ценуроз. У животных повышается температура тела, нарушается координация движений, угнетение сменяется буйством, наступают параличи отдельных частей тела (ушная раковина, верхнее веко, конечности), животное дрожит, овцы часто упираются головой или телом в стенку, у свиней, кроме перечисленных признаков, появляются кашель, истечение из носовой полости, одышка.
Послеубойная диагностика. Значительных изменений в тушах и внутренних органах не обнаруживают. Они проявляются очаговыми размягчениями мозгового вещества с образованием участков некроза (очаговый гнойный энцефаломиелит и менингит с наличием лимфоцитов, одноядерных макрофагов, нейтрофилов). В отдельных пораженных нейронах видны листерии. Мозговые оболочки в зоне поражения воспалены, вокруг кровеносных сосудов скопление лимфоцитов в виде клеточных муфт.
Септическая форма характеризуется обычно мелкоочаговым коагуля-ционным некрозом печени, почек, легких, селезенки, лимфатических узлов с явлениями кариорексиса и скоплением вокруг омертвевшей ткани гистиоцитов, лимфоидных элементов. На слизистых и серозных оболочках застойные явления, кровоизлияния. У свиней обнаруживают отек легких, катаральное воспаление слизистой желудка и тонких кишок.
Окончательный диагноз ставят на основании лабораторных исследований и биопробы животных.
Ветеринарно-санитарная оценка и мероприятия. Голова, кишечник и все патологически измененные органы направляют на утилизацию. Подлежат утилизации также туши со всеми внутренностями при дистрофических или других патологических изменениях в мускулатуре. При отсутствии патологических изменений тушу и внутренние органы выпускают для переработки на вареные и варено-копченые изделия или проваривают.
Молоко больных листериозом животных после пастеризации в течение 30 мин. при 80° С можно использовать в пищу.
Помещение, в котором производился убой листериозных животных, дезинфицируют горячим (70° С) 3%-ным раствором едкой щелочи или раствором хлорной извести, содержащей не менее 2% активного хлора.
Какова вет – санитарная оценка туши при туляремии.
Туляремия. Болеют туляремией грызуны, пушные звери, овцы, козы, менее восприимчивы свиньи, крупный рогатый скот и лошади. Человек очень восприимчив к этому заболеванию.
Возбудитель - F. tularensis - маленькая, неподвижная, аэробная, с нежной капсулой, грамотрицательная палочка.
Устойчивость знашггельная в охлажденном мясе сохраняется до 35 сут., в замороженном - до 75, в паренхиматозных органах - до 120 сут. Нагревание до 60°С убивает его за 5 мин., до 100°С - за несколько секунд.
Предубойная диагностика. Клиническое проявление наблюдается только у овец. У остальных животных протекает латентно. У овец отмечают повышение температуры до 41,6° С, угнетение, шаткость походки, а позже -волочение зада, параличи, диарею, анемию слизистых, кому.
Послеубойная диагностика. Явления бактериемии с поражением сосудов легких, селезенки, сердца, лимфоузлов. Лимфоузлы резко увеличены, с некротическими узелками или абсцессами.
Бактериологический диагноз сочетают с серологической реакцией (агглютинирующая сыворотка).
Ветеринарно-санитарная оценка и мероприятия. Больных животных к убою не допускают. При обнаружении туляремии после убоя все продукты убоя со шкурой уничтожают. Туши и органы, подозреваемые в обсеменении возбудителями туляремии, направляют на утилизацию.
Для дезинфекции мест убоя применяют 2%-ный раствор едкого натра или калия (70°С), 3%-ный раствор ксилонафита-5, 2%-ный раствор формальдегида.
Рабочие по убою животных неблагополучных хозяйств должны соблюдать правила личной профилактики, им делают предохранительные прививки.
Туши и продукты убоя от животных, больных и подозрительных по заболеванию указанными болезнями, выпускать в сыром виде запрещается. Свиньи, привитые против чумы и имевшие перед убоем повышенную температуру или у которых после убоя обнаружены патологоанатомические изменения внутренних органов, при санитарной оценке рассматриваются так же, как больные чумой.
При наличии дегенеративных или других патологических (абсцессы и др.) изменений в мускулатуре тушу с внутренними органами направляют на утилизацию.
При отсутствии патологических изменений в туше и во внутренних органах решение об использовании их принимают после бактериологического исследования (за исключением листериоза) на сальмонеллы.
При отсутствии сальмонелл тушу, шпик и внутренние органы разрешается перерабатывать на вареные, варено-копченые колбасы и консервы или направлять на проварку. При роже, пастереллезе и листериозе мясо, кроме того, разрешается использовать и на изготовление вареных колбас, варено-копченых грудинок и кореек.
Патологически измененные внутренние органы, кишки и кровь, а также головы от больных листериозом животных во всех случаях направляют на утилизацию с обработкой при температуре не менее 100 °C или проварку при этой же температуре в течение 1 ч.
46. Всэ продуктов убоя животных при колибактериозе и иерсиниозе.
Колибактериоз. При наличии патологоанатомических изменений в мышцах и внутренних органах (перикардит, перигепатит, аэросаккулит, перитонит) тушки с органами утилизируют. При наличии изменений только во внутренних органах тушки проваривают или направляют на изготовление консервов, а внутренние органы утилизируют.
Иерсиниоз. Туши и внутренние органы при наличии истощения и множественного поражения лимфатических узлов направляют на утилизацию. При отсутствии истощения и поражения только внутренних органов или лимфатических узлов их направляют на утилизацию, а тушу – на выработку вареных колбасных изделий, колбасных хлебов или на проварку.
47. Всэ продуктов убоя животных при гемофилезном полисерозите и гемофилезной плевропневмонии свиней.
При наличии дистрофических или других патоморфологических изменений в мышечной ткани тушу, внутренние органы и другие продукты убоя направляют на утилизацию.
При отсутствии патоморфологических изменений в тушах и наличии изменений в отдельных органах решение об использовании принимают после бактериологического исследования. При обнаружении в мясе или внутренних органах сальмонелл, внутренние органы утилизируют, а туши используют после проварки или направляют на выпуск консервов, колбасных хлебов. При отсутствии сальмонелл туши и внутренние органы перерабатывают на вареные, варено-копченые сорта колбас с соблюдением принятых технологических режимов и положений настоящих Правил.
48. Всэ продуктов убоя животных при некробактериозе и дерматомикозах.
Дерматомикозы. Туши и внутренние органы от больных животных при отсутствии патоморфологических изменений используют без ограничений. При наличии патоморфологических изменений решение об использовании принимают после бактериологического исследования на сальмонеллы. При этом в случае обнаружения в мясе или внутренних органах сальмонелл внутренние органы направляют на утилизацию или уничтожают, а туши используют после проварки или направляют на изготовление консервов. При отсутствии сальмонелл тушу, шпик и внутренние органы разрешается перерабатывать на вареные, варено-копченые колбасы и консервы или направляют на проварку. Туши истощенных животных с наличием дистрофических изменений в органах и тканях (гидремия, отечность лимфоузлов и др.) направляют на утилизацию. Шкуры дезинфицируют, а при генерализованном поражении – утилизируют.
В соответствии с правилами ветеринарного осмотра убойных животных и ветеринарно-санитарной экспертизы мяса и мясных продуктов
Некробактериоз.
При местном патологическом процессе (поражение зева, носа, гортани, внутренних органов или конечностей) тушу выпускают без ограничений, а пораженные части направляют на утилизацию. При септическом процессе тушу и субпродукты направляют на утилизацию. При поражении нескольких органов удовлетворительной упитанности туши решение о возможности использования мяса и внутренних органов принимают после проведения бактериологического исследования (на наличие патогенной кокковой микрофлоры, сальмонелл и др.).






При подозрении на листериоз бактериологическая диагностика включает микроскопическое исследование исходного материала, посевы на питательные среды, идентификацию выделенных культур по культурно-биохимическим и серологическим свойствам, а также постановку биологической пробы на лабораторных животных.
Морфологические и культуральные свойства. Микроскопическому исследованию подвергают тонкие мазки-отпечатки из головного мозга, внутренних органов и тканей. При приготовлении мазков-отпечатков - чистым предметным стеклом 3—4 раза прикасаются к поверхности среза органа. Мазки готовят непосредственно из материала, а также после выдержки (подращивания) проб в термостате в течение 4—6 часов. Мазки окрашивают по Граму, а также методами флуоресцирующих антител.
Возбудитель листериоза — полиморфная, чаще палочковидная бактерия длиной 0,5—2,0 мкм; она хорошо окрашивается всеми анилиновыми красками, грамположительна (однако в старых культурах могут встречаться единичные грамотрицательные палочки).
Люминесцентно-серологическое исследование проводят с использованием прямого и непрямого методов флуоресцирующих антител в соответствии с Наставлением по лабораторной диагностике листериоза животных (от 1971 г. с изменением от 31 июля 1974 г)*. С помощью двух методов можно идентифицировать возбудителя в культурах, обнаружить листерии в органах и тканях, а также определить их серогрупповую принадлежность.
Для выделения культуры листерий из органов и обязательно из головного мозга проводят обильные множественные посевы или предварительно готовят суспензию из головного мозга и паренхиматозных органов на физиологическом растворе в соотношении 1 : 5 и из нее делают посевы. Для культивирования листерий используют обычный или печеночный агар и бульон с добавлением 1% глюкозы и 2—3% глицерина (pH среды 7,2—7,4), а также кровяной агар и специальные среды.
При хранении патологического материала в холодильнике при +4 °С происходит размножение и накопление листерий. Поэтому в качестве дополнительного метода рекомендуется часть исследуемого материала помещать в холодильник и сохранять в течение 30 дней для проведения повторных исследований через каждые 10 дней при отрицательном результате первичного посева. Посевы инкубируют в термостате при 37 °С с ежедневным просмотром в первые 3—4 дня. При отсутствии роста наблюдение за посевами проводят в течение 2 недель.
Характерным для возбудителя листериоза является легкое помутнение бульона и появление мелких росинчатых колоний на агаре, наличие бетта-гемолиза на кровяном агаре. Просмотр посевов на плотных средах целесообразнее проводить с использованием осветителя ОИ-19 с голубым фильтром в проходящем свете: колонии листерий имеют в отличие от колоний других микроорганизмов голубую окраску с зеленоватым оттенком и мелкозернистую структуру. Выделенные культуры изучают микроскопически с окраской мазков по Граму, а также с применением прямого и непрямого методов флуоресцирующих антител.
При получении смешанной культуры ее очищают общепринятыми методами, а также путем заражения молодых белых мышей массой до 16 г. Определение подвижности проводят методом висячей или раздавленной капли. На подвижность исследуют 6 — 12-часовую бульонную культуру, выращенную при комнатной температуре. Листерии, выращенные при данной температуре, обладают активной подвижностью.
Для определения ферментативных свойств чистую культуру пересевают на пестрый ряд (глюкоза, мальтоза, рамноза, салицин, трегалоза, дульцит, инулин, раффиноза). Листерии разлагают с образованием кислоты (без газа) глюкозу, мальтозу, рамнозу, салицин, трегалозу и не разлагают дульцит, инулин, раффинозу.
Ставят пробу на каталазу. К суточной бульонной культуре добавляют равный объем свежеприготовленного 5%-ного пероксида водорода, при исследовании агаровой культуры в пробирку вносят несколько капель пероксида водорода. При наличии фермента каталазы пероксид водорода разлагается с образованием пузырьков газа (пены). Способность выделять фермент каталазу является характерным признаком листерий.
Для дифференциации листерий от возбудителя рожи свиней можно использовать индикаторные среды, метод основан на редукции и оксидации красок в средах при выращивании листерий.
Исследуемую бульонную культуру или смыв агаровой культуры засевают в объеме 2—4 капель не менее чем на 2 индикаторные среды: например, с нейтральным красным в смеси с метиленовой синью, метиловым красным. Пробирки встряхивают и помещают в термостат при температуре 37—38 °С вместе с контрольными (незасеянными) средами. Результат учитывают через 3; 6; 24 и 48 ч.
Возбудитель листериоза через 3—6 ч обесцвечивает среду с нейтральным красным в смеси с метиленовой синью до цвета бульона, лишь у поверхности на границе с воздухом остается окрашенный ободок. При встряхивании цвет частично восстанавливается, поэтому посевы просматривают, не встряхивая пробирки. Среда с метиловым красным обесцвечивается через 3—6 ч, но восстановления цвета среды не происходит, Контролем служат незасеянные индикаторные среды. Возбудитель рожи свиней не обесцвечивает ни одну из вышеуказанных сред.
Серотипизация. Серологическая идентификация листерий проводится с поливалентной листериозной агглютинирующей сывороткой, представляющей собой смесь кроличьих листериозных агглютинирующих сывороток и содержащей факторы (антитела) Н-АВ и О-II, V, VII, IX. Поливалентная сыворотка в капельной реакции агглютинации на стекле агглютинирует все известные серотипы и подтипы листерий. Типовые сыворотки агглютинируют культуры листерий соответствующих типов ("серогрупп"). Сыворотка 1-го серотипа (серогруппы) содержит 0-фактор II, а сыворотка 2-го серотипа (серогруппы) — О-факторы V, VI. Серологическая типизация листерий осуществляется в соответствии с Наставлением по лабораторной диагностике листериоза.
Постановка биологической пробы. Для определения вирулентных свойств ставят биопробу. Биологическое исследование проводят на 2—3 белых мышах массой 18 г. Суспензию из головного мозга и внутренние органов или культур вводят животным под кожу или внутрибрюшинно в дозе 0,3—0,5 см3. Для повышения эффективности биопробы мышам за 3 —4 ч до заражения инъецируют внутримышечно кортизон в дозе 5 мг. При положительной биопробе животные погибают через 2—6 сут после заражения. При вскрытии отмечают множественные некротические очажки в печени, селезенке, почках. В отдельных случаях этих поражений может не быть.
Очень чувствительны к подкожному заражению 5 - 6-дневные мыши-сосуны, которые гибнут через 18—36 ч. К заражению листериями восприимчивы и кролики при внутривенном заражении культурой листерий в дозе 0,5 — 1 млрд. микробных тел .
Из внутренних органов павших животных делают мазки-отпечатки и высевы на питательные среды. Срок наблюдения за подопытными животными - 14 сут.
Дифференциация листерий от возбудителя рожи.
При бактериологическом исследовании мяса на листериоз и рожу свиней (срок исследования — 7 лет) проводят дифференциацию выделенных культур по морфологическим, биохимическим признакам и вирулентности (данные представлены в табл.).
Таблица. Дифференцирующие признаки листерий и возбудителя рожи свиней
Таблица. Дифференцирующие признаки листерий и возбудителя рожи свиней
| Признак | Возбудидель листериоза | Возбудитель рожи свиней |
| Морфология в мазках - отпечатках | Неспорообразующие короткие палочка с закругленными концами. Располагаются поодиночке, попарно, в форме римской цифры V . | Неспорообразующие, тонкие, прямые или слегка изогнутые палочки, иногда нити. |
| Рост на МПА | Мелкие росинчатые, прозрачные колонии. Через 2-3 суток наблюдается помутнение колоний. | Мелкие росинчатые, прозрачные колонии. |
| Рост на МПБ | Небольшое помутнение с образованием слизистого осадка, поднимающегося при встряхивании в виде косички. | Легкое помутнение, поднимающегося при встряхивании осадок в виде облака. |
| Морфология в мазках из культуры | Короткие, прямые, овоидные палочки, иногда почти кокки, располагаются поодиночке или кучками. | Короткие, прямые или слегка изогнутые палочки; При хроническом течении инфекции- как короткие, тонкие палочки, так и удлиненные цепочки и нити. |
| Окраска по Граму | Положительная | Положительная |
| Подвижность | Подвижен в молодой 6-12 часовой культуре, выращенной при комнатной температуре. | Неподвижен |
| Салицин | Разлагает | Не разлагает |
| Проба на каталазу | Положительная | Отрицательная |
| Индикаторные среды | Обесцвечивает | Не обесцвечивает |
| РА с позитивной листериозной сывороткой | Положительная | Отрицательная |
| Коньюктивальная проба на морских свинках | Положительная | Отрицательная |
| Внутрикожная проба | Положительная | Отрицательная |
При необходимости дополнительной дифференциации бактерий листериоза от бактерий рожи свиней применяют посевы: на питательный желатин, на углеводную среду с салицином, на мясо-пептонный печеночный агар с 0,01 % теллурита калия, на мясо-пептонный агар с кровью, а также ставят конъюнктивальную пробу на морских свинках.
Бактерии листериоза в отличие от бактерий рожи свиней на желатине дают медленный рост в виде узловатой нити с неровными краями и пушистыми отростками, желатин не разжижают, ферментируют салицин, вызывают гемолиз на агаре с кровью, растут на мясо-пептонном печеночном агаре с 0,5 % глюкозы, 3 % глицерина и 0*01 % теллурита калия в виде мелких черных колоний и вызывают кератоконъюнктивит у морских свинок.
Ветеринарно-санитарная оценка при пастереллезе, роже свиней и листериозе.
Туши и все субпродукты от больных и подозрительных по заболеванию животных выпускать в сыром виде запрещается.
При истощении и наличии дегенеративных или других патологических (абсцессы) изменений в мускулатуре - туша со всеми внутренними органами подлежит утилизации.
При отсутствии патологических изменений в туше и внутренних органах решение об использовании их принимают после бактериологического исследования (за исключением листериоза) на сальмонеллы; при обнаружении в мышцах или внутренних органах сальмонелл внутренние органы направляют на утилизацию или уничтожают, а туши выпускают после проварки или перерабатывают на консервы.
При отсутствии патологических изменений в мускулатуре туши, но отрицательном результате бактериологического исследования на сальмонеллы туши обезвреживают действием высокой температуры (проварка, изготовление мясных хлебов и консервов) по установленным режимам, а внутренние органы направляют на утилизацию или уничтожение. При отсутствии сальмонелл тушу, шпик и внутренние органы разрешается перерабатывать на вареные или варено-копченые колбасы, а также на варено-копченые грудинки и корейки или консервы с соблюдением установленного термического режима или направляют на проварку.
Внутренние органы, кишки и кровь, имеющие патологические изменения, а также головы от больных листериозом животных во всех случаях направляют на утилизацию с обезвреживанием при температуре не ниже 100 °С или проварку при этой же температуре в течение 1 ч.
Шкуры дезинфицируют согласно наставлению по их дезинфекции. При пастереллезе птицы внутренние органы утилизируют, тушки направляют на проварку, прожарку или на переработку на консервы. При листериозе — голову и пораженные органы утилизируют. Тушки и непораженные органы проваривают. При рожистой септицемии внутренние органы утилизируют, а тушку при отсутствии изменений в мышцах проваривают, при наличии дегенеративных изменений утилизируют.
И в заключение - фильм, созданый специалистами ВНИИМП, о пищевом листериозе и методах его определения в продуктах питания:
Читайте также:

