Лямблии у детей лечение бадами
Обновлено: 18.04.2024
Лямблия — наиболее распространенный кишечный протозойный паразит в мире. Показатели распространенности лямблиоза варьируют от 4 до 42 %. В промышленно развитых странах носителями инфекции являются 2–5 % населения, причем 15–20 % зараженных — это дети младше десяти лет.
Этиология лямблиоза
Возбудитель заболевания — простейшие Giardia intestinalis (более привычное название Giardia lamblia). Путь передачи заболевания фекально-оральный в результате приема загрязненной воды и гораздо реже — продуктов. Инфекция легко передается от человека к человеку: 25 % членов семей, дети которых инфицированы, также заболевают лямблиозом.
Инфекция передается при проглатывании цист лямблий. Инфицирующая доза человека очень невысока — всего 10–25 цист способны вызвать заболевание у 8 из 25 человек. Употребление в пищу более 25 цист приводит к развитию инфекции в 100 % случаев.Передача лямблий от человека к человеку наиболее вероятна при несоблюдении санитарно-гигиенических норм, например, недостаточной обработке рук перед едой. Достоверно более высокий риск инфицирования у работников и воспитанников детских дошкольных учреждений. Кроме того, важной причиной вспышек лямблиоза среди людей оказываются домашние животные, которые зачастую являются носителями G. intestinalis.
Патогенез
Механизм, посредством которого лямблии вызывают диарею и мальабсорбцию, по всей вероятности, многофакторный и полностью пока не раскрыт. Предполагается, что он включает повреждение щеточной каемки эпителия верхних отделов тонкого кишечника, выделение энтеротоксинов, иммунологические реакции, а также изменение моторики кишечника и увеличение секреции жидкости за счет увеличения активности аденилатциклазы.
Жизненный цикл лямблий состоит из двух этапов — трофозоита, который существует свободно в тонком кишечнике человека, и цисты, передаваемой в окружающую среду. Промежуточные хозяева для осуществления полного цикла не нужны.При проглатывании цист в желудке под действием соляной кислоты и в двенадцатиперстной кишке при участии ферментов поджелудочной железы происходит эксцистирование. Образовавшиеся трофозоиты перемещаются в тонкий кишечник, где они быстро размножаются, время удвоения составляет 9–12 часов. После перемещения трофозоита в толстый кишечник происходит инцистирование, для которого необходим нейтральный pH и присутствие вторичных желчных солей. Цисты передаются в окружающую среду вместе с калом, и цикл повторяется.
Адгезия трофозоитов лямблий к кишечному эпителию увеличивает его проницаемость, что сопровождается уплощением кишечных ворсинок, ингибированием активности дисахаридаз и в конечном итоге разрастанием кишечной бактериальной флоры. Частичная атрофия ворсинок в двенадцатиперстной и тощей кишке наблюдается и в гистологических срезах бессимптомных носителей лямблий. Кроме того, Giardia Lamblia может выделять цитопатические вещества, повреждающие эпителий кишечника. Повреждение эпителия слизистой оболочки кишечника способствует нарушению всасываемости и развитию диареи. Тем не менее диарея может развиваться и в случаях сохранения целостности эпителия тонкого кишечника.
Симптомы лямблиоза
Нередко заболевание протекает бессимптомно. Однако в некоторых случаях — по разным данным, от 5 до 70 % — лямблиоз сопровождается клиническими проявлениями. Факторы, предрасполагающие к симптоматической инфекции: гипохлоргидрия, иммунодефицит, группа крови А, недоедание. Инкубационный период составляет 1–2 недели, средняя продолжительность фазы клинических проявлений длится 3–10 недель.
Клинические признаки лямблиоза:
- диарея;
- недомогание, слабость;
- вздутие живота;
- тошнота;
- жирный стул с резким неприятным запахом;
- анорексия;
- потеря веса;
- рвота;
- редко — субфебрильная температура;
- неврологические симптомы (раздражительность, нарушение сна, депрессия, неврастения);
- крапивница.
Выраженность клинической симптоматики зависит от множества факторов, в том числе от инфекционной нагрузки, вирулентности возбудителя и иммунного ответа хозяина. Наиболее распространенное проявление, которое регистрируется в 90 % случаев симптоматического лямблиоза, — это диарея. Немного реже — в 70–75 % случаев — развиваются метеоризм и спастические боли в животе.
Симптомы хронической инфекции включают хроническую диарею, общее недомогание, тошноту, анорексию и потерю аппетита. У 66 % симптоматических пациентов снижается вес. Хроническая спорадическая диарея может продолжаться в течение нескольких месяцев.
Внекишечные проявления заболевания
Достаточно редки и включают аллергические симптомы (крапивницу, эритему, бронхоспазм, реактивный артрит, заболевания желчевыводящих путей). Этиология внекишечных симптомов, скорее всего, — результат активации иммунной системы.
Желудочно-кишечные проявления
У некоторых детей лямблиоз начинается остро взрывной водянистой диареей, спазмами в животе, рвотой, лихорадкой и общим недомоганием. Длительность острой фазы не превышает 3–4 дней, после чего заболевание переходит в подострый период. Однако, как правило, лямблиоз манифестирует постепенно. В таких случаях стул приобретает неприятный запах и мягкую жирноватую консистенцию. С мягким стулом или даже запором чередуется водянистая диарея. Тошнота, раннее насыщение, вздутие живота, изжога — характерные признаки подострого лямблиоза — чаще всего усугубляются после еды.
Осложнением лямблиоза может стать задержка развития у детей, замедление роста и дефицит цинка у школьников (данные мексиканских ученых под руководством Луиса Квихви (Luis Quihui), опубликованные в BMC Public Health в 2010 году).
Лечение
Как правило, бессимптомные пациенты не нуждаются в лечении, так как через несколько недель после заражения происходит самоизлечение. Исключение составляют случаи, когда требуется предотвратить заражение окружающих, например, инфицирование беременных женщин от детей.
Кроме того, лечению подлежат дети с острой и хронической диареей, мальабсорбцией или другими желудочно-кишечными симптомами, ассоциированными с инфицированием Giardia intestinalis.
Основа лечения лямблиоза — антипротозойная терапия. Решающее значение, особенно у пациентов с большим объемом диарейных потерь, имеет достаточная регидратация и восстановление электролитного баланса.
В качестве антимикробных агентов используются препараты трех групп: нитроимидазолы, бензимидазолы и нитрофураны.
Нитроимидазолы
В этот класс препаратов входят метронидазол, тинидазол, орнидазол и секнидазол. Наиболее изучен механизм противопротозойного действия метронидазола. Препарат проникает внутрь трофозоита и запускает процесс повреждения ДНК, в результате которого трофозоит погибает. Если образуются тканевые цисты — конгломераты из большого количества трофозоитов, объединенных оболочкой, — эффективность метронидазола снижается из‑за недостаточного проникновения препарата внутрь цисты.
Тинидазол, орнидазол и секнидазол имеют более длительный период полураспада, чем метронидазол, что позволяет применять их для однодневной терапии. Доказано, что клиническая эффективность тинидазола, введенного однократно в педиатрической дозировке 50 мг/кг массы тела, составляет от 80 до 100 % (средняя эффективность 92 %). Однако следует учитывать, что тинидазол запрещен к применению у детей младше 12 лет. Эффективность орнидазола сравнима с тинидазолом (92–100 %). Педиатрическая однократная дозировка составляет 40 мг/кг веса.
Секнидазол по эффективности близок к тинидазолу и орнидазолу — согласно данным клинических испытаний, препарат эффективен в 85 % случаев. Обычно его назначают однократно, детская доза составляет 30 мг/кг.
Бензимидазолы
Для лечения лямблиоза используются два бензимидазола: альбендазол и гораздо реже — мебендазол. Препараты этой группы ингибируют полимеризацию цитоскелета лямблий и необратимо подавляют утилизацию глюкозы в организме паразита.
In vitro восприимчивость лямблий к бензимидазолам ниже, чем к нитроимидазолам (исследование австралийских ученых, опубликованное в International Journal for Parasitology в 1995 году). Результаты лечения мебендазолом расходятся. Некоторые источники сообщают о 90 %-ной эффективности препарата, другие оценивают ее не выше 60 %. Поэтому мебендазолу чаще всего предпочитают альбендазол, эффективность которого 94–100 %.
Одно из преимуществ альбендазола в педиатрической практике — высокая эффективность в отношении многих гельминтов. Кроме того, препарат очень хорошо переносится. Дозировка альбендазола у детей составляет 15 мг/кг веса в день в течение 5–7 дней. Комбинация альбендазола и метронидазола показала 100 %-ную эффективность у пациентов, устойчивых к монотерапии метронидазолом (данные итальянских ученых под руководством Бруно Какопардо, опубликованные в журнале Clinical Therapeutics в 1995 году).
Нитрофураны
Среди обширной группы нитрофуранов для лечения лямблиоза используются только два препарата: фуразолидон и нифурател.
Механизм действия фуразолидона в отношении лямблий изучен не полностью. В исследованиях in vitro фуразолидон показывает эффективность, сравнимую с метронидазолом, и демонстрирует неизменную активность у детей. In vivo эффективность фуразолидона в целом считается несколько ниже, чем эффективность метронидазола. Курсы лечения фуразолидоном длительностью 7–10 дней эффективны в 80–96 % случаев (данные египетских ученых под руководством Самира Бассили, публикация в The American Journal of Tropical Medicine and Hygiene, 1970 год). При лечении менее 5 дней эффективность фуразолидона значительно ниже.
Детская доза фуразолидона составляет 1,5–2 мг/кг веса дважды в день. Следует учитывать, что у 10 % пациентов прием фуразолидона сопровождается побочными эффектами — тошнотой, рвотой и диареей. Препарат противопоказан детям младше 1 месяца из‑за риска развития гемолитической анемии.
Рассмотрены особенности диагностики и лечения лямблиоза у детей. Определена роль диетотерапии и возможности применения энтеросорбентов в комплексном лечении пациентов с лямблиозом и сопутствующим дисбактериозом кишечника.
Peculiarities of diagnostics and treatment of lambliosis with children were considered. The meaning of dietary therapy and the possibilities of interosorbents use in complex therapy of patients with lambliosis and satellite intestine dysbacteriosis were specified.
Лямблиоз является одним из самых распространенных и часто встречающихся протозоозов, протекающим как в виде латентного паразитоносительства, так и в виде манифестных форм с преимущественным поражением тонкого кишечника. Основным источником инвазии является зараженный человек. Механизм передачи заболевания фекально-оральный. Пути распространения — водный, контактный, пищевой.
Воздействие лямблий на организм хозяина многообразно. Вегетативные формы, фиксируясь на поверхности энтероцитов, не только перекрывают всасывательную поверхность кишки и потребляют готовые питательные вещества, но и вызывают механическое и токсическое повреждение поверхности кишечника, запуская целый ряд патологических механизмов: сенсибилизацию организма продуктами распада лямблий и формирование аллергодерматозов, нарушение синтеза ферментов и развитие вторичного синдрома мальабсорбции, формирование абдоминального синдрома, нарушение функции печени, снижение синтеза иммуноглобулинов, формирование дисбиотических нарушений в кишечнике [1, 3–5].
Полиморфизм клинических признаков лямблиоза зачастую затрудняет диагностику данного заболевания [1, 12]. Согласно классификации ВОЗ нами ежегодно регистрируются: лямблиоз без клинических проявлений (латентный) в 2% случаев, лямблиоз с клиническими проявлениями (манифестный) в 98% случаев. Из манифестных форм кишечную форму заболевания мы наблюдаем в 15% случаев, билиарно-панкреатическую форму — в 9%, форму с внекишечными проявлениями — в 30%, смешанную форму — в 44% случаев соответственно.
Наши исследования показали, что в целом кишечный синдром при различных формах лямблиоза проявляется: болью в животе у 30% больных, диареей у 57%, запорами у 29%, тошнотой и анорексией у 70% пациентов соответственно. У 20–40% детей в зависимости от формы заболевания имеет место лактазная недостаточность. Дисбактериоз кишечника при лямблиозе мы регистрируем у всех детей и подростков — 100% [6].
Под дисбактериозом кишечника понимают клинико-лабораторный синдром, связанный с изменением качественного и/или количественного состава микрофлоры кишечника с последующим развитием метаболических и иммунологических нарушений и возможным развитием желудочно-кишечных расстройств [9]. Многими исследователями доказано, что дисбактериоз кишечника является не только сопутствующим клинико-лабораторным синдромом основной соматической патологии желудочно-кишечного тракта, но и может самостоятельно являться дебютом многих патологических состояний, особенно у детей раннего возраста.
Терапия лямблиоза преследует цель полной эрадикации лямблий из кишечника, поэтому ее успешность во многом зависит от комплексного подхода к лечению, включающего назначение: противолямблиозных средств, энтеросорбентов, препаратов, восстанавливающих функцию желчного пузыря, пробиотиков, пребиотиков, при необходимости антигистаминных средств, гепатопротекторов и иммунокорректоров [4, 5]. Очень важно при лечении лямблиоза правильно назначить диету, соответствующую возрасту ребенка, форме заболевания, сопутствующей патологии. Хорошо себя зарекомендовала диета, богатая мягкими пищевыми волокнами-энтеросорбентами, а также поддерживающая фитотерапия, оказывающая противовоспалительное, обволакивающее, регенерирующее действие на слизистую желудочно-кишечного тракта [3].
В настоящее время в медицинской практике используется большое количество энтеросорбентов, различающихся по лекарственной форме, по химической структуре, по механизму сорбции, селективности. Диапазон клинических эффектов энтеросорбции достаточно широк. Наиболее значимыми являются: дезинтоксикационный, антидиарейный, противовоспалительный, метаболический, цитопротекторный эффекты. Помимо этого энтеросорбенты (особенно пищевые волокна) обладают способностью поддерживать микробиоценоз кишечника [13].
Ввиду неоднородности кишечного синдрома при лямблиозе энтеросорбенты специалистами назначаются индивидуально: при запорах предпочтительны препараты, содержащие лигнин с лактулозой, при диарейном синдроме — препараты, содержащие смектит. Но, к сожалению, практика показывает, что не всегда наши пациенты при назначении энтеросорбентов чувствуют себя комфортно: в одних случаях усиливается газообразование и боль в животе, в других — происходит резкая смена диареи на запор, в-третьих — не всегда возможен длительный курс выбранного сорбента. Поиск альтернативных методов лечения привел к изучению клинико-лабораторной эффективности препарата Мукофальк у детей с лямблиозом и сопутствующим дисбактериозом кишечника.
1) оценить переносимость Мукофалька у детей;
2) изучить клиническую и лабораторную эффективность Мукофалька при лямблиозе у детей с диарейным синдромом и синдромом запора;
3) изучить лабораторную эффективность Мукофалька при сопутствующем дисбактериозе кишечника у детей.
В литературе имеются данные об успешном использовании Мукофалька в лечении пациентов с различными синдромами в гастроэнтерологической и гепатологической практике [2, 11, 15], при инфекционных болезнях: иерсиниозе, эшерихиозе и сальмонеллезной инфекции. Исследователями доказано, что Мукофальк не только адсорбирует бактерии, снижает эозинофильно-клеточную инфильтрацию слизистой, но и приводит к выраженному сдвигу рH в кислую сторону, ингибируя рост патогенных энтеробактерий [7, 8, 14].
Материалы и методы
Основная группа: 30 детей 3–14 лет с лямблиозом и сопутствующим дисбактериозом кишечника, получающие Мукофальк в комплексном лечении. Кишечный синдром проявлялся болями в животе, метеоризмом, 15 из 30 детей страдали синдромом диареи, 15 детей — запорами.
Контрольная группа: 60 детей 3–14 лет с лямблиозом и сопутствующим дисбактериозом кишечника, не получающие Мукофальк: 30 детей с синдромом диареи получали сорбенты, содержащие лигнин или смектит, 30 детей с запорами получали кремний- или лактулозосодержащие препараты.
По клиническому анализу крови анемия I–II степени выявлена у 30% наблюдаемых детей, повышенное СОЭ у 6,6%, увеличение в лейкоформуле эозинофилов у 30%, моноцитов — у 40% детей соответственно.
При копрологическом исследовании фекалий слизь наблюдали у 40% всех пациентов, количество лейкоцитов до 5–15 в поле зрения — у 26,6%, нейтральный жир — у 30%, жирные кислоты — у 20%, крахмал — у 43,3%, дрожжевые клетки — у 66,6% пациентов. В ряде случаев определяли повышенное содержание углеводов в кале.
Дефицит облигатной микрофлоры наблюдали у 60% детей основной и 58,3% детей контрольной групп. У детей 3–6 лет дисбактериоз кишечника был обусловлен условно-патогенными бактериями преимущественно одного-двух, редко трех видов, у детей старше 6 лет и подростков регистрировали в основном дефицитный дисбактериоз кишечника. Но во всех возрастных группах наблюдали тенденцию к росту клебсиелл, стафилококка, гемолитических эшерихий и грибов рода Candida (табл. 1).
Способ применения и дозы: дети 3–6 лет получали Мукофальк в дозе 1/4 пакета 2–3 раза в день, 6–12 лет 1/2 пакета 2–3 раза в день, старше 12 лет 1 пакет 2–3 раза в день. При запорах препарат рекомендовался предпочтительно между приемами пищи с достаточным количеством жидкости, при диарейном синдроме — предпочтительно с приемом пищи. После купирования кишечного синдрома Мукофальк был рекомендован 1 раз в день с пребиотической целью в течение 2–4 недель параллельно со следующими этапами лечения лямблиоза.
Критериями оценки эффективности были:
1) клиническая эффективность при кишечном синдроме;
2) лабораторная эффективность: клинические анализы (крови, мочи, исследование кала на копрограмму, простейшие), бактериологические анализы кала на дисбактериоз.
Результаты исследования
На фоне терапии Мукофальком ни у одного ребенка не было аллергических реакций и побочных явлений в виде усиления метеоризма, запоров или диареи. При неэффективности Мукофалька при запорах у детей назначение было увеличено на одну рекомендуемую нами дозу (1 прием).
После проведенного курса лечения у детей с диарейным синдромом основной и контрольной групп жалобы на жидкий стул, боли в животе и метеоризм купированы: в основной группе, получающей Мукофальк, у 13 из 15 больных (86,6%), в контрольной группе — у 22 из 30 больных (73,3%).
У детей же с синдромом запора после лечения жалобы на задержку стула, плотные каловые массы, боли в животе и метеоризм купированы в основной группе, получающей Мукофальк, у 14 из 15 детей, что составило 93,3% наблюдений и было достоверно выше (р < 0,05), чем в контрольной группе — у 19 из 30 детей (63,3%). Данные представлены в табл. 2.
Клинические показатели крови и мочи у детей после лечения были в пределах нормы у 28 детей основной (93,3%) и 54 детей контрольной группы (90%). Копрологические показатели нормализовались у 27 детей основной (90%) и 49 детей контрольной группы (81,6%).
Контроль эффективности лечения лямблиоза по рекомендациям разных авторов проводится через 5–6, 10–14 дней после лечения. Существует мнение, что при выделении лямблий в срок до трех недель после химиотерапии можно говорить о рецидиве заболевания, а в более поздние сроки — о реинфекции [12], хотя в некоторых источниках отмечено, что рецидивы лямблиоза могут возникать спустя 7 недель после окончания лечения [10].
По результатам паразитологических исследований пациентов через 10 дней после лечения санация кишечника от лямблий отмечена у 90% больных основной (27 детей) и 86,6% детей контрольной группы (52 ребенка). Через 20 дней в основной группе, продолжающей получать Мукофальк в пребиотической дозе, показатели не изменились (90%), в контрольной группе — несколько ухудшились, санация кишечника отмечена у 80% больных (48 детей).
По результатам собственных исследований и литературным данным эффективность первого курса комплексного лечения лямблиоза составляет 70–96,8% [1, 5, 6] и зависит от многих факторов: интенсивности инвазии, реактивности организма, выбранных препаратов для лечения, развивающейся резистентности лямблий к специфическим противолямблиозным средствам.
Всем наблюдаемым пациентам с рецидивом заболевания был назначен второй курс лечения, включающий противолямблиозные препараты, симптоматическую и патогенетическую терапию. Энтеросорбенты были рекомендованы соответственно поставленным целям исследования: основная группа получала Мукофальк в рекомендуемых дозировках, контрольная — сорбенты, содержащие лигнин или смектит в зависимости от кишечного синдрома. Через 4 недели после второго курса лечения в основной группе санация от лямблий была отмечена у 100% детей (30 человек), что было достоверно выше (р < 0,05), чем в контрольной группе — у 85% детей (51 ребенок). Результаты наблюдений представлены в табл. 3.
У детей основной группы, продолжающих получать Мукофальк после основных этапов эрадикации лямблий из кишечника в качестве пребиотика параллельно с пробиотиками, было отмечено улучшение бактериологических показателей каловых масс: повышение роста бифидумбактерий у 90% детей, лактобактерий — у 75% детей, кишечной палочки — у 75% детей. Максимальный санирующий эффект наблюдался при эшерихиозном дисбактериозе кишечника (обусловленном гем+ E. coli) — в 100%, кандидозном — в 91%, клебсиеллезном — в 90%, стафилококковом дисбактериозе кишечника — в 87,5% случаев соответственно. Результаты исследований представлены в табл. 4.
Исследования показали, что в основной группе пациентов после курса лечения сравнительно чаще, чем в контрольной, в кишечнике регистрировали рост бифидумбактерий (р < 0,05) и снижение роста гемолизирующей кишечной палочки (р < 0,05) и грибов рода Candida (р < 0,05).
Выводы
- При условии индивидуального терапевтического подхода переносимость препарата Мукофальк у детей начиная с 3-летнего возраста была хорошей. Отмечены приятные вкусовые качества, отсутствие аллергических реакций, удобство в применении.
- Главный критерий эффективности — клинический эффект по исследуемому кишечному синдрому наблюдался в целом у 90% пациентов (86,6% — при диарейном синдроме, 93,3% — при синдроме запора).
- Изучение микробного пейзажа фекалий после курса лечения выявило: повышение роста бифидумбактерий у 90% детей, лактобактерий — у 75% детей, кишечной палочки — у 75% детей, санацию желудочно-кишечного тракта от гемолизирующей кишечной палочки — в 100%, грибов рода Candida — в 91%, клебсиелл — в 90%, золотистого стафилококка — в 87,5% случаев. В основной группе пациентов после курса лечения сравнительно чаще, чем в контрольной, в кишечнике регистрировали рост бифидумбактерий (р < 0,05) и снижение роста гемолизирующей кишечной палочки (р < 0,05) и грибов рода Candida (р < 0,05).
- После окончательного курса лечения в основной группе пациентов санация от лямблий была отмечена у 100% детей, в контрольной группе — у 85% детей.
Заключение
Литература
Е. Е. Хасанова, кандидат медицинских наук
ГАУЗ РКИБ им. проф. А. Ф. Агафонова Минздрава Республики Татарстан, Казань
Рассмотрены факторы риска паразитозов у детей, действие паразитов на организм ребенка, подходы к диагностике паразитарной инвазии и принципы комплексного лечения паразитозов с тем чтобы предотвратить дальнейшее развитие функциональных нарушений с формиров
Risk factors of parasitosis in children was considered, as well as the influence of parasites on a child's body, approaches to the diagnostics of parasitic invasions and principles of integrated treatment of parasitic diseases in order to prevent the further development of functional disorders of the formation of organic pathology.
.jpg)
Паразитарное заболевание — развитие болезненных симптомов в результате жизнедеятельности гельминта или простейших в организме человека [1]. Основной фактор выживания и распространения паразитов — их необычайно высокая репродуктивная способность, а также постоянно совершенствующиеся механизмы приспособления к обитанию в теле человека. К сожалению, настороженность медицинских работников в отношении паразитарных заболеваний у населения в настоящее время чрезвычайно низка, а профилактика гельминтозов сведена к лечению выявленных инвазированных пациентов [12, 13]. Вместе с тем многие исследователи отмечают связь широкой распространенности паразитозов у детского населения с развитием функциональной патологии органов пищеварения на фоне нарушений регуляции и высокий риск формирования хронических заболеваний даже при условии естественной санации ребенка с течением времени.
Самые распространенные и изученные заболевания — аскаридоз, энтеробиоз (рис. 1) и лямблиоз — регистрируются повсеместно. В России ежегодно выявляется более 2 млн больных нематодозами. При оценке территориального распределения лямблиоза по России установлено, что самый высокий средний уровень показателей заболеваемости в течение многих лет отмечен в Санкт-Петербурге, причем пораженность детей, посещающих детские учреждения, составляет 35% [2].
Каждый человек в течение жизни неоднократно переносит различные паразитарные заболевания [9]. В детском возрасте паразитозы встречаются чаще. У детей раннего возраста (до 5 лет) этому способствует широкая распространенность репродуктивного материала паразитов (цисты, яйца, личинки (рис. 2)) в окружающей среде и недостаточное развитие гигиенических навыков.
.jpg)
Значимость определенных факторов риска меняется в соответствии с возрастом ребенка. Доказано, что для детей младшего возраста более значимы санитарно-гигиенические условия проживания, а для подростков при сборе анамнеза необходимо уделить внимание социально-экономическим и географическим факторам (пребывание в лагере, туристическая поездка, наличие младшего брата или сестры) (рис. 3).
.jpg)
Транзиторное снижение противоинфекционного иммунитета как фактор риска возникновения паразитоза у детей регистрируется также в период реконвалесценции после вирусных заболеваний, вызываемых вирусами герпетической группы (цитомегаловирус, вирус простого герпеса I и II, вирус Эпштейна–Барр), может возникать в результате ятрогении (применение иммуносупрессивной терапии при аллергических и аутоиммунных заболеваниях). В настоящее время значимая доля детей находится в состоянии дезадаптации, которое также сопровождается снижением иммунной защиты.
Иммунную защиту желудочно-кишечного тракта (ЖКТ) ребенка можно условно разделить на специфическую и неспецифическую. К неспецифической защите относят комплекс условий нормального пищеварения: зрелость ферментативных систем, обеспечение кислотно-щелочного градиента в различных отделах ЖКТ, деятельность нормальной микрофлоры, адекватную моторику.
Отдельно необходимо отметить, что для такого заболевания, как лямблиоз, предрасполагающим фактором инвазии является нерегулярное и недостаточное отделение желчи в кишечник при аномалиях развития желчного пузыря (перетяжки, перегибы). Лямблиоз, выявленный у пациентов педиатрического отделения МОНИКИ, в 100% случаев сопровождался дисфункцией билиарного тракта.
.jpg)
У детей в восстановительном периоде после острых кишечных инфекций, после массивной антибиотикотерапии, а также у пациентов с хронической патологией органов пищеварения сопутствующие нарушения ферментного обеспечения, нормофлоры и моторики кишечника также делают ЖКТ более уязвимым для паразитов (рис. 4).
Специфическая защита слизистой оболочки органов пищеварения зависит от возраста ребенка и его зрелости. Механизм специфической иммунной защиты является одной из наиболее древних систем организма, так как гельминтозы сопровождают человечество в течение многих тысячелетий. Этот механизм представлен прежде всего эозинофилами крови и иммуноглобулином Е.
Классический развернутый антипаразитарный ответ может быть сформирован у ребенка не ранее достижения им 4 лет и тесно связан с качеством и количеством IgE, созревающего к этому возрасту. При контакте организма с паразитом в первую очередь выделяются медиаторы воспаления: интерлейкин, лейкотриен С4, D4, простагландины, тромбоксаны. Увеличивается количество лимфоцитов, продуцирующих IgM и IgG. В клиническом анализе крови отмечается рост уровня эозинофилов и базофилов, связанный с увеличением содержания этих клеток в тканях инвазированного органа. Встречаясь с личинками паразита, тканевые базофилы выделяют гепарин и гистамин, которые в сочетании с лейкотриенами и другими медиаторами воспаления вызывают общие проявления: зуд, реактивный отек, гиперемию, а также могут спровоцировать общие проявления: бронхоспазм, проявления крапивницы или диарею. Аллергическое воспаление при паразитозах развивается по классическому пути и призвано создать условия, приводящие к гибели и/или элиминации паразита [5].
Вместе с тем эозинофилы обладают выраженным цитотоксическим потенциалом, превышающим возможности других клеток крови, что объясняет первостепенное значение эозинофилов в антипаразитарных реакциях и их повреждающую роль при аллергии. Основное действие эозинофилы оказывают в барьерных тканях. В очаге инвазии они дегранулируют, оказывая гельминтотоксическое и цитотоксическое действие. Белки эозинофильных гранул (большой основной протеин, эозинофильная пероксидаза, эозинофильный катионный протеин, эозинофил-производный нейротоксин) токсичны не только для паразита, но и для клеток организма ребенка. Еще одной из важных причин системных и органных поражений, сопутствующих паразитозам, является образование иммунных комплексов [9, 10].
Действие паразитов на организм ребенка осуществляется с вовлечением многих систем. Практически все их виды могут вызывать сдвиг соотношения Th1/Th2 клеток в направлении, благоприятном для их выживания. Описаны случаи, когда продукты выделения паразита оказывали гормоноподобное действие на организм хозяина [5].
Местное влияние паразиты осуществляют, вызывая контактное воспаление слизистой оболочки и стимулируя вегетативные реакции. При этом нарушаются процессы кишечного всасывания, адекватная моторика ЖКТ и его микробиоценоз.
Системное влияние оказывается за счет использования паразитом энергетического и пластического потенциала пищи в ущерб организму ребенка, индукции аллергии и аутоиммунных процессов, целенаправленной иммуносупрессии и эндогенной интоксикации. Проведенными исследованиями показано, что аллергический синдром сопутствует аскаридозу и энтеробиозу в 71,3% случаев. Среди детей с атопическим дерматитом паразитозы выявляются у 69,1%, при этом лямблиоз из числа всех инвазий составляет 78,5% [4].
Особенно узнаваемую клиническую картину формирует токсокароз (рис. 5). Клиническими маркерами этой инвазии являются лейкемоидная реакция эозинофилов (от 20% и выше эозинофилов в формуле крови), сопровождающая ярко и упорно протекающий аллергический синдром в виде атопического дерматита с выраженным зудом и резистентностью к традиционной терапии или тяжелую бронхиальную астму с частыми приступами.
В 75,3% случаев паразитозы сопровождаются разнообразными функциональными нарушениями со стороны ЖКТ. Рядом работ доказано, что паразитарная инвазия способна вызывать нарушения углеводного обмена, а также дисахаридазную недостаточность за счет снижения уровня лактазы [7, 9].
У большинства детей нарушения адаптации являются одним из важных звеньев патогенетического процесса при паразитозе. Следует отметить, что состояние дезадаптации затрагивает в первую очередь лимфоцитарное звено иммуногенеза, что не может не сказываться на созревании и дифференцировке специфического иммунитета.
Диагностика паразитозов
До настоящего времени ведется поиск простого, доступного и надежного метода диагностики паразитозов. Разработанные методики прямого визуального обнаружения требуют минимальной экспозиции диагностического материала, многократных повторных исследований. Известные способы диагностики глистных инвазий и протозоозов, такие как метод толстого мазка фекалий по Като, метод формалин-эфирного осаждения, перианальный соскоб, микроскопия пузырной и печеночной желчи, имеют ряд недостатков, связанных как с особенностями развития паразита, так и с состоянием макроорганизма и его реактивностью.
Непрямые методы исследования (определение специфических антител) обладают недостаточной специфичностью и достоверностью. Известно, например, что, проходя сложный цикл развития от яйца до взрослого состояния, гельминты меняют свой антигенный состав. Антитела в организме хозяина вырабатываются в основном в ответ на поступление экскретов и секретов гельминта, тогда как в иммунодиагностических реакциях используются соматические антитела. Возникающая неспецифическая сенсибилизация организма, общность некоторых антигенов трематод, простейших и человека создают высокий удельный вес ложноположительных серологических реакций в титрах ниже достоверно диагностических. Таким образом, исследование методом иммуноферментного анализа (ИФА) на гельминты является высокочувствительным, но низкоспецифичным методом. Определение паразитов методом полимеразной цепной реакции (ПЦР) является высокоспецифичным и высокочувствительным методом, но из-за дороговизны и сложности не может быть скрининговым, когда, например, нужно обследовать группу детей из детского учреждения.
Не теряет своей актуальности клинический осмотр ребенка и внимательный учет косвенных признаков паразитоза. Важно отметить возможность течения паразитоза при аллергическом и астеническом синдроме, полилимфаденопатии неясного генеза, при нарушениях кишечного всасывания, углеводного обмена, при затяжном и хроническом течении болезней пищеварительного тракта, гепатоспленомегалии неясного генеза. Течение паразитарной инвазии имеет клинические особенности: обычно признаки поражения минимизированы, заболевание носит стертый характер, обострения полиморфны и неярки. Особенностью обострений заболеваний данной группы является их цикличность с периодом в 11–15 дней.
Косвенными лабораторными признаками паразитоза могут быть анемия, базофилия, эозинофилия, увеличение уровня аспартатаминотранферазы (АСТ).
Кроме того, признаки возможной паразитарной инвазии следует учитывать при оценке результатов инструментального исследования. При ультразвуковом исследовании органов брюшной полости у ребенка старше 3 лет косвенными признаками паразитоза являются гепатоспленомегалия, неравномерность паренхимы печени и селезенки за счет мелких гиперэхогенных сигналов, увеличенные лимфатические узлы в воротах селезенки.
Лечение гельминтозов
Лечение гельминтозов должно начинаться с применения специфических антигельминтных препаратов. Современный арсенал лекарственных средств, используемых для лечения кишечных паразитозов, включает значительное количество препаратов различных химических классов [11]. Они применяются как в клинической практике для лечения выявленных больных, так и с целью массовой профилактики.
Определяя препарат для специфической противопаразитарной терапии, следует понимать, что спектр действия этих препаратов не особенно широк. Практически все препараты этой группы применяются многие десятки лет и целесообразно предположить, что паразиты выработали системы приспособления и заболевание может быть резистентным к проводимой терапии. По данным Г. В. Кадочниковой (2004), эффективность такого традиционного препарата, как Декарис, в современных условиях не достигает 57%. Кроме того, эта группа противопаразитарных средств, к сожалению, имеет ряд побочных эффектов: тошноту, рвоту, абдоминальный синдром.
Таким образом, в современных условиях следует отдавать предпочтение более современным препаратам, которые, во-первых, являются универсальными для лечения как нематодозов, так и смешанных глистных инвазий и активны в отношении такого распространенного паразита, как лямблия. Во-вторых, использование одного противопаразитарного препарата, а не их комбинации, ощутимо снижает риск неприятных побочных эффектов. На сегодняшний день единственный представитель этой группы в нашей стране — альбендазол (Немозол).
Для лечения аскаридоза у детей старшего возраста или при рецидивировании заболевания в настоящее время под наблюдением врача может быть применен комбинированный прием антигельминтных средств (например, альбендазол в течение трех дней, затем — Вермокс в течение трех дней). Непременным условием успешной дегельминтизации больных энтеробиозом являются одновременное лечение всех членов семьи (коллектива) и строгое соблюдение гигиенического режима для исключения реинвазии. Следует отметить, что важное значение имеет ежедневная влажная уборка, так как были описаны казуистические случаи распространения репродуктивного материала остриц на частичках пыли на высоту до 1,5 метра.
В педиатрической клинике МОНИКИ разработаны принципы терапии паразитозов, учитывающие особенности патогенеза инвазии и позволяющие качественно и надежно вылечить данную группу заболеваний. Благодаря применению разработанной схемы терапии удается эффективно предотвратить реинвазию и развитие функциональных нарушений органов пищеварения у детей.
Принципы терапии больных паразитозами
1. Прием антипаразитарных препаратов проводится с учетом вида возбудителя инвазии.
Препараты, применяемые в лечениии аскаридоза:
- Вермокс (мебендазол) (для детей с 2 лет) — по 100 мг 2 раза в сутки в течение 3 дней;
- Пирантел — 10 мг/кг однократно;
- Немозол (альбендазол) (для детей с 2 лет) — 400 мг однократно.
Препараты, применяемые в лечении энтеробиоза:
- Вермокс (мебендазол) (для детей с 2 лет) — 100 мг однократно;
- Пирантел — 10 мг/кг однократно;
- Немозол (альбендазол) (для детей с 2 лет) — 400 мг однократно.
Препараты, применяемые в лечении лямблиоза:
- орнидазол 25–30 мг/кг (если масса тела больше 35 кг — 1000 мг) в два приема в течение 5 дней, 1 день — 1/2 дозы, повторный курс через 7 дней;
- Макмирор (нифурател) — по 15 мг/кг 2 раза в сутки в течение 7 дней;
- Немозол (альбендазол) — по 15 мг/кг однократно в течение 5–7 дней.
2. Лечение паразитоза предусматривает измененные в результате жизнедеятельности паразитов свойства пищеварительного тракта ребенка (функциональные нарушения органов пищеварения, ферментопатия, изменение микробиоценоза) и их коррекцию курсами ферментных препаратов и синбиотиков (табл. 1).
3. Обязательное применение энтеросорбентов и комплекса поливитаминов с микроэлементами (табл. 2 и 3).
Таким образом, разработанные в клинике педиатрии МОНИКИ принципы комплексной терапии паразитозов у детей предусматривают поэтапное восстановление функционального состояния ЖКТ, нарушенного в результате местного и системного влияния паразитов. Применение комплексной терапии позволяет предотвратить дальнейшее развитие функциональных нарушений с формированием органической патологии, а также избежать реинвазии.
Литература
Л. И. Васечкина 1 , кандидат медицинских наук
Т. К. Тюрина, кандидат медицинских наук
Л. П. Пелепец, кандидат биологических наук
А. В. Акинфиев, кандидат медицинских наук
Что такое лямблиоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Лямблиоз — это острое и хроническое паразитарное заболевание человека в виде манифестных форм или носительства, вызываемое кишечными лямблиями, которые колонизируют слизистую оболочку преимущественно тонкого кишечника, нарушают процессы пристеночного пищеварения и способствуют развитию и усугублению поражения желудочно-кишечного тракта и других заболеваний.
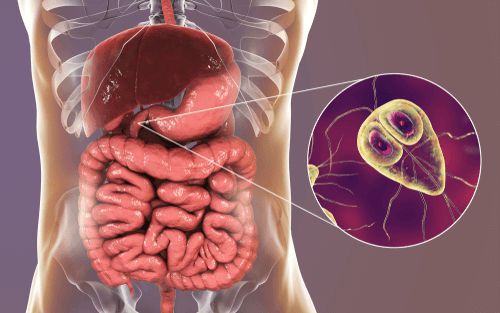
Этиология
Возбудитель — лямблия. Данный род паразитов включает в себя шесть типов, но заболевание человека вызывает только один тип — кишечная лямблия (Giardia duodenalis, Giardia lamblia, Giardia intestinalis). Это жгутиковое микроскопическое простейшее, впервые описанное чешским медиком-анатомом Д.Ф. Лямблем в 1859 году. Оно имеет до восьми генетических подтипов, но для человека патогенны только А и В (также имеют подтипы).
Вид — Giardia lamblia
Возбудитель лямблиоза (кишечная лямблия) существует в виде двух жизненных форм:
- вегетативная (трофозоиты) — стадия активного размножения внутри организма;
- цистная — образуется при неблагоприятных условиях среды.
Трофозоиты — это анаэробные, грушевидные микроорганизмы размерами 9-18 мкм. Они обитают в верхних отделах тонкого кишечника. Подвижны (имеют характерное движение в виде вращения вокруг продольной оси — боковое движение), тело спереди расширено и закруглено, сзади сужено и заострено. Имеют в составе два ядра (между ними пролегают опорные нити — аксостили) и парные органоиды — четыре жгутика и два медиальных тела.
Трофозоиты не имеют цитостома — органа заглатывания пищи и пищеварительной вакуоли, поэтому они всасывают пищу, переваренную хозяином (в основном, углеводы), всей поверхностью тела. Это называется осмотическим питанием.
Как выглядят лямблии:
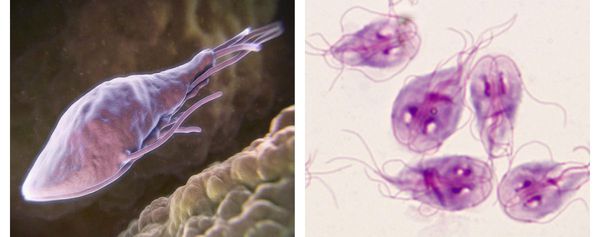
В передней их трети тела расположен присасывательный диск в виде специального углубления. С его помощью лямблии прикрепляются к ворсинкам слизистой оболочки тонкого кишечника. Цитоплазматическая мембрана задней поверхности имеет по краям булавовидные выросты, что также создаёт дополнительную прикрепляющую составляющую.
Размножаются путём продольного деления. Слабо устойчивы в условиях окружающей среды при покидании организма хозяина: при комнатной температуре даже в отсутствии агрессивных факторов быстро погибают.
Цистная форма неподвижна. Паразиты имеют овальную форму, лишены свободных жгутиков (сложно свёрнутые), их размеры достигают 10-14 мкм, окружены толстой, несколько отделённой от тела оболочкой (данная особенность имеет значение при распознавании вида).
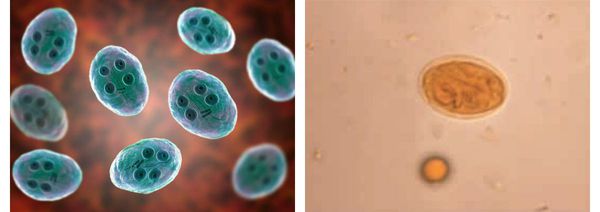
Зрелые цисты внутри имеют четыре ядра, незрелые — два ядра. Образуются в нижних отделах кишечника в процессе выхода из организма с фекалиями. Очень устойчивы во внешней среде: могут сохраняться месяцами в воде при температуре 4-20°C, при хорошей влажности способны сохраняться на контаминированных (обсеменённых) продуктах питания до недели. При кипячении цисты погибают мгновенно, а при высушивании и низкой влажности гибель наступает в течении суток. Устойчивы к бытовому хлорированию воды, действию щелочей и кислот, ультрафиолетовому излучению. Низкие температуры переносит относительно хорошо, но при этом снижая свою жизнеспособность. [1] [3] [6] [9]
Эпидемиология
Распространение заболевания повсеместное, преимущественно в странах с влажным тёплым климатом. Только официально выявляемые случаи в России приближаются к 150 тысячам в год.
Сезонность выражена неярко, некоторый всплеск заболеваемости отмечается в тёплое время года. Возрастной состав больных склоняется в сторону детей.
Источник заражения — люди (больные различными формами лямблиоза и паразитоносители), причём наибольшая заразность наблюдается в подостром периоде заболевания, когда в 1 г фекалий может содержаться до нескольких десятков миллионов цист. Лямблии животных (нечеловеческие типы паразитов) не имеют доказательной базы в плане распространения и заражения человека.
Факторами передачи паразитов выступает загрязнённая цистами термически не обработанная питьевая вода, пища, грязные руки (возможна прямая передача от человека к человеку). Определённую роль в передаче лямблий играют насекомые (тараканы, мухи) и животные (собаки, кошки) — они являются механическими переносчиками (паразиты располагаются на их теле, шерсти, лапках, транзитом в кишечнике).
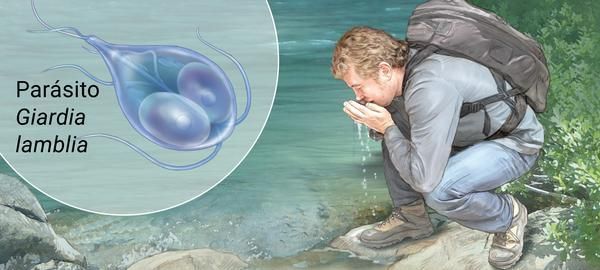
Механизм передачи — фекально-оральный (водный, пищевой и контактно-бытовой пути). Наиболее часто передача осуществляется:
- через водопроводную воду;
- при употреблении плохо промытых зелени и овощей (или промытых под водопроводной водой без последующей термической обработки);
- при нарушении правил санитарной гигиены, особенно в детских коллективах.
Доза заражения — от 10 до 100 цист (в зависимости от индивидуальных свойств иммунной реактивности кишечника). Возможны случаи невосприимчивости к паразитам: цисты лямблий, встречая агрессивно настроенную среду кишечника, проходят транзитом и выделяются в окружающую среду в неизменённом виде.
Иммунитет после лямблиоза нестойкий и ненапряжёный, возможно повторное заражение. Повышенный риск заболевания имеют лица с патологией иммунитета кишечника и дефицитом IgA. [2] [3] [5] [8] [10]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы лямблиоза
Инкубационный период длится от нескольких дней до месяца и более. Чаще всего при заболевании не наблюдается вообще никаких клинических проявлений, особенно у взрослых.
К основным возможным симптомам лямблиоза относятся:
- Симптомы интоксикации и вегетативных изменений — повышенная утомляемость, плаксивость, раздражительность, нарушение ритма сна, головокружения, аритмии, субфебриллитет и другие.
- Симптомы поражения ЖКТ — дискомфорт и боли различной интенсивности и характера в различных отделах живота, тошнота, снижение аппетита, появление чувства горечи во рту, нарушения стула (запоры и поносы), налёт на языке и неприятный запах изо рта, снижение массы тела и другое.
- Симптомы поражения кожи — аллергические высыпания различного характера и локализации, атопический дерматит, бледность и шероховатость кожи, повышенная сухость покровов, хейлит (воспалительные изменения кожи губ и их слизистой), заеды (трещинки в уголках рта), нетипичное/неконтролируемое течение хронических патологий кожи.
- Усиление развития и обострения заболеваний, прямо не связанных с лямблиозом — бронхиальная астма, псевдоаллергические явления, гастриты, язвы желудка и двенадцатиперстной кишки, холецистит, неспецифический язвенный колит, артриты и другое.
- Симптомы мальабсорбции (потери питательных веществ) — авитаминозы, отставание в физическом и умственном развитии, дистрофия (эти проявления более характерны для детей).
Лямблиоз у детей
Как правило, у детей первыми симптомами лямблиоза становится появление субфебрильной или фебрильной температуры (37,1–38,0°C или 38,0–39,0°C), болей в животе, тошноты, иногда рвоты, метеоризма, жидкого стула. Живот при этом болезнен, вздут, урчит по ходу кишечника. Грудные дети становятся беспокойными, кричат, нарушается сон, симптомы лямблиоза усиливаются во время и после кормления, возможно появление аллергодерматозов и опрелостей. В динамике при отсутствии лечения это может приводить к нарушению роста и психоэмоционального развития, частым простудным или аллергическим заболеваниям, развитию хронических проблем органов ЖКТ.
У детей более позднего возраста и взрослых яркие симптомы лямблиоза наблюдаются редко — на первый план выходит постепенное развитие диспепсических явлений со стороны ЖКТ умеренного характера:
- метеоризм;
- дискомфорт и боли в животе преимущественно в околопупочной области и правом подреберье;
- нарушения стула в различных сочетаниях;
- появление налёта на языке;
- иногда горечь во рту и кожные проявления (усиление выраженности угревой сыпи, хронических полиэтиологических заболеваний, например, псориаза и дерматитов);
- возможны вегетативные расстройства, головные боли, головокружения, неустойчивость артериального давления, повышения температуры тела, чувствительность лимфоузлов.
Лямблиоз у беременных
Лямблиоз у беременных не имеет каких-либо специфичных отличий от лямблиоза у остальных людей, но может приводить к повышению риска развития у беременной В-12 дефицитной анемии и снижению веса плода (гипотрофии). [1] [3] [5] [7] [10]
Патогенез лямблиоза
Характерен так называемый "симптом манной крупы" — белёсые полусферические выбухания слизистой оболочки двенадцатиперстной кишки, представляющие собой зоны очагового отёка со скоплением увеличенного количества лейкоцитов.
Посредством механического раздражения и выделения паразитами продуктов жизнедеятельности (токсическое влияние) происходит стимуляция образования слизи, повышение регенераторной функции кишечника, нарушение выработки факторов нейрогуморальной регуляции пищеварения (холецистоцикин и других) и двигательной активности гепатогастродуоденальной области. Это ведёт к дезорганизации висцеро-висцеральных связей области двенадцатиперстной кишки, поджелудочной железы и желчевыводящей системы, а также к нарушению функционирования органов ЖКТ, нарушению микробиоценоза кишечника, активизации анаэробной флоры, расстройствам расщепления и всасывания белков, жиров, углеводов, витаминов и микроэлементов.
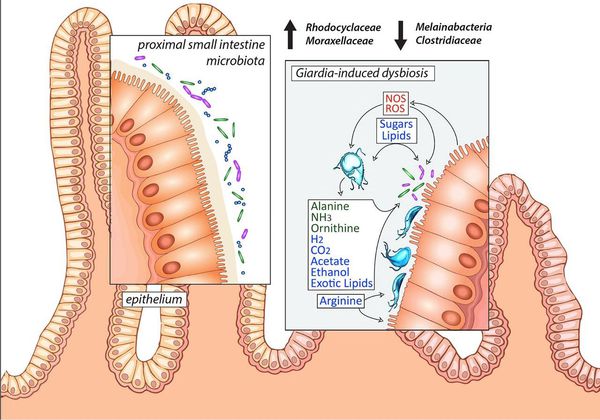
Возникает воспаление слизистой кишечника по типу реакций гиперчувствительности замедленного типа, происходит воздействие на иммунорегуляторные белки (мимикрия), снижение выработки иммуноглобулинов (в частности IgA) из-за нарушения всасывания белков и снижение фагоцитарной активности. Всё это в совокупности со всасываемыми продуктами жизнедеятельности лямблий становится причиной истощения иммунной системы (как кишечника, так и общего иммунитета), развития хронического поражения кишечника, провоцирует длительное обострение имеющихся хронических заболеваний и усугубление ряда аллергозависимых дерматозов. [1] [4] [7] [8]
Классификация и стадии развития лямблиоза
По клинической форме лямблиоз бывает:
- бессимптомным (носительство);
- кишечным — преимущественно симптомы кишечной формы, но можгут быть и гастритические проявления (дискомфорт в животе, неустойчивый стул, тошнота);
- билиарно-панкреатическим (рефлекторный) — дискомфорт в эпигастрии и правом подреберье, привкус горечи во рту, повышенная частота развития плохо контролируемых гастродуоденитов и панкреатитов;
- астено-невротическим — слабость, вялость, повышенная утомляемость, раздражительность, эмоциональная неустойчивость;
- токсико-аллергическим — периодические высыпания на теле, обострение хронических кожных заболеваний и бронхиальной астмы, эозинофилия;
- смешанным.
Течение лямблиоза бывает трёх типов:
- острым — до одного месяца;
- подострым — 1-3 месяца;
- хроническим — более трёх месяцев.
По наличию осложнений лямблиоз бывает:
Выделяют три степени заболевания:
Осложнения лямблиоза
Возможны специфические и неспецифические осложнения лямблиоза.
К специфическим относятся:
-
— зудящие обширные высыпания на теле;
- отёк Квинке — выраженный отёк подкожной клетчатки, иногда сопровождающийся зудоим и чувством удушья;
- офтальмопатия — нарушения восприятия органом зрения;
- артрит — дискомфорт и боли в суставах;
- гипокалиемическая миопатия — слабость определённых групп мышц.
К неспецифическим осложнениям относятся:
- наслоение интеркуррентных заболеваний (вторичная флора);
- белково энергетическая недостаточность (гипо- и авитаминоз, снижение веса, анемия и другие). [1][2][8][10]
Диагностика лямблиоза
Лабораторная диагностика лямблиоза включает в себя:
- Клинический анализ крови — в остром периоде наблюдается эозинофилия, базофилия и повышение СОЭ; в последующие периоды — умеренная эозинофилия или нормальное значение эозинофилов, иногда незначительная базофилия.
- Биохимический анализ крови — иногда отмечается повышение уровня общего билирубина и амилазы.
- Копроовоскопическое исследование кала — "золотой стандарт" диагностики. Оно позволяет выявить цисты (наиболее часто) и вегетативные формы лямблий (в редких случаях). В виду прерывистого цистообразования показано неоднократное исследование с некоторым интервалом (семь дней). Существует широко распространённое заблуждение о том, что кал нужно сдавать "тёплым" (свежим). На самом деле, в этом нет никакой необходимости. Так как данное исследование предполагает обнаружение цист лямблий, которые очень устойчивы во внешней среде, период от дефекации до исследования никоим образом не влияет на информативность результата анализа.
- Иммунохроматографический метод и ПЦР-диагностика кала (выявление антигенов и нуклеиновых кислот паразита) — имеет хорошую информативность и вполне может применяться в комплексе с другими методами исследований.
- ИФА-диагностика — малоинформативное исследование, так как локализация лямблий в просвете кишечника не создаёт условий для полноценного иммунного ответа, который наблюдается в основном у детей при остром заболевании, что создаёт значительное число ошибочных результатов как гипо-, так и гирпедиагностики.
- Дуоденальное зондирование (выявление вегетативных форм лямблий в двенадцатиперстной кишке) — может применяться в сложных диагностических случаях и при подозрении на коинвазирование (например, описторхами при описторхозе).
- УЗИ органов брюшной полости и ФГДС — позволяют выявить признаки нарушения моторики гепатобилиарной области. [2][3][5][6][9]
Дифференциальная диагностика предполагает исключение следующих заболеваний:
- паразитарные заболевания другой этиологии (как кишечной, так и внекишечной локализации);
- хронический гастродуоденит (симптомосходная симптоматика);
- кишечные инфекции (сальмонеллёз, дизентерия, ротавирус и другие);
- дисбиоз кишечника (сборное понятие, характеризующееся неустойчивостью стула, дискомфортом в животе различного характера, снижением веса и другими симптомами). [1][5][9]
Лечение лямблиоза
Лечение острой формы лямблиоза, которая возникает в основном у детей, должно осуществляться в стационаре и включать в первую очередь дезинтоксикационную и дегидратационную терапию, а также щадящее питание.
Медикаментозная терапия
При подтверждении диагноза проводится этиотропное лечение одним из противолямблиозных препаратов (нитрогруппа) в сочетании с желчегонными средствами, и лекарствами, улучшающими микрофлору кишечника.
При длительном хроническом течении в виду персистирующей колонизации лямблиями слизистой оболочки тонкого кишечника и местным иммунодефицитом курс лечения должен быть комплексным, включающим:
- диета (потреблять меньше углеводов);
- средства этиотропного воздействия (химиопрепарат);
- приём желчегонных препаратов;
- иммунотерапию (усиление фагоцитоза и восполнение дефицита IgA);
- устранение дисбиоза кишечника (пробиотики).
К сожалению, в последнее время всё чаще встречаются штаммы лямблий, устойчивых к различным видам противопаразитарной терапии, поэтому средняя вероятность успешной эрадикационного лечения не превышает 85%.
Гигиена при лечении лямблиоза
Лямблиоз редко передаётся между членами семьи, если соблюдать простейшие гигиенические правила: мыть руки после посещения уборной, перед едой и после контакта с животными.
Лечение народными средствами
Эффективность и безопасность методов народной медицины научно не доказана. Без адекватного лечения лямблиоз может привести к различным осложнениям: крапивнице, отёку Квинке, нарушениям зрения, артриту и слабости мышц.
Лечение лямблиоза у детей
Новорождённых от лямблиоза, как правило, не лечат, так как нет подходящих препаратов. В основном рекомендуется улучшать микрофлору и работу кишечника.
Детей старшего возраста лечат так же, как и взрослых, но подбирают необходимую дозировку и форму препарата.
Лечение лямблиоза у беременных
Беременным лечение, как правило, противопоказано (потенциальный вред препаратов превышает пользу от лечения), в основном предпочтение отдаётся улучшению флоры и работы кишечника.
Контроль излеченности
После курса лечения проводится паразитологический контроль методом копроовоскопии или ПЦР не ранее двух недель после завершения курса лечения длительностью в три месяца со сдачей анализа раз в месяц. [1] [3] [4] [5]
Прогноз. Профилактика
При назначении адекватного лечения прогноз благоприятен, осложнения редки.
Специфической профилактики не разработано. Основной упор следует делать на меры соблюдения санитарных норм:
Читайте также:

