Лжвс что за инфекции
Обновлено: 24.04.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Цитомегаловирус: причины появления, симптомы, диагностика и способы лечения.
Определение
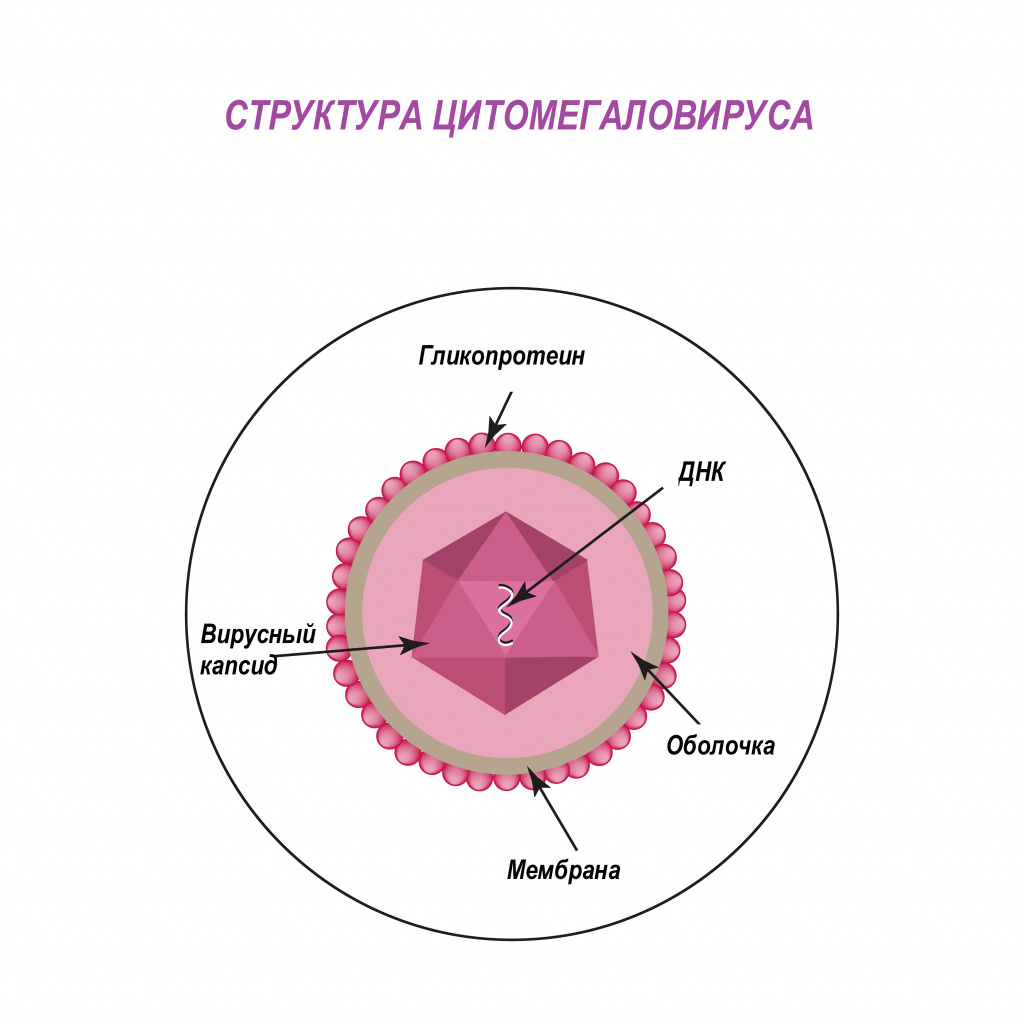
Цитомегаловирус (ЦМВ, или цитомегаловирусная болезнь) – хроническое инфекционное заболевание вирусной этиологии, характеризующееся многообразием клинических форм и проявлений - от бессимптомного течения до тяжелого поражения внутренних органов и центральной нервной системы. Возбудитель ЦМВ – представитель семейства герпесвирусов (вирус герпеса человека 5-го типа).
Попадая в клетки организма, цитомегаловирус способен оставаться в них пожизненно. У лиц с нормально функционирующей иммунной системой в подавляющем большинстве случаев инфекция протекает по типу вирусоносительства. При угнетении иммунитета вирус активизируется, вызывая клинические симптомы болезни.
По различным данным доля носителей цитомегаловируса в России составляет порядка 73-90% - то есть именно у такого количества людей выявляются антитела к ЦМВ.
Причины появления цитомегаловирусной болезни
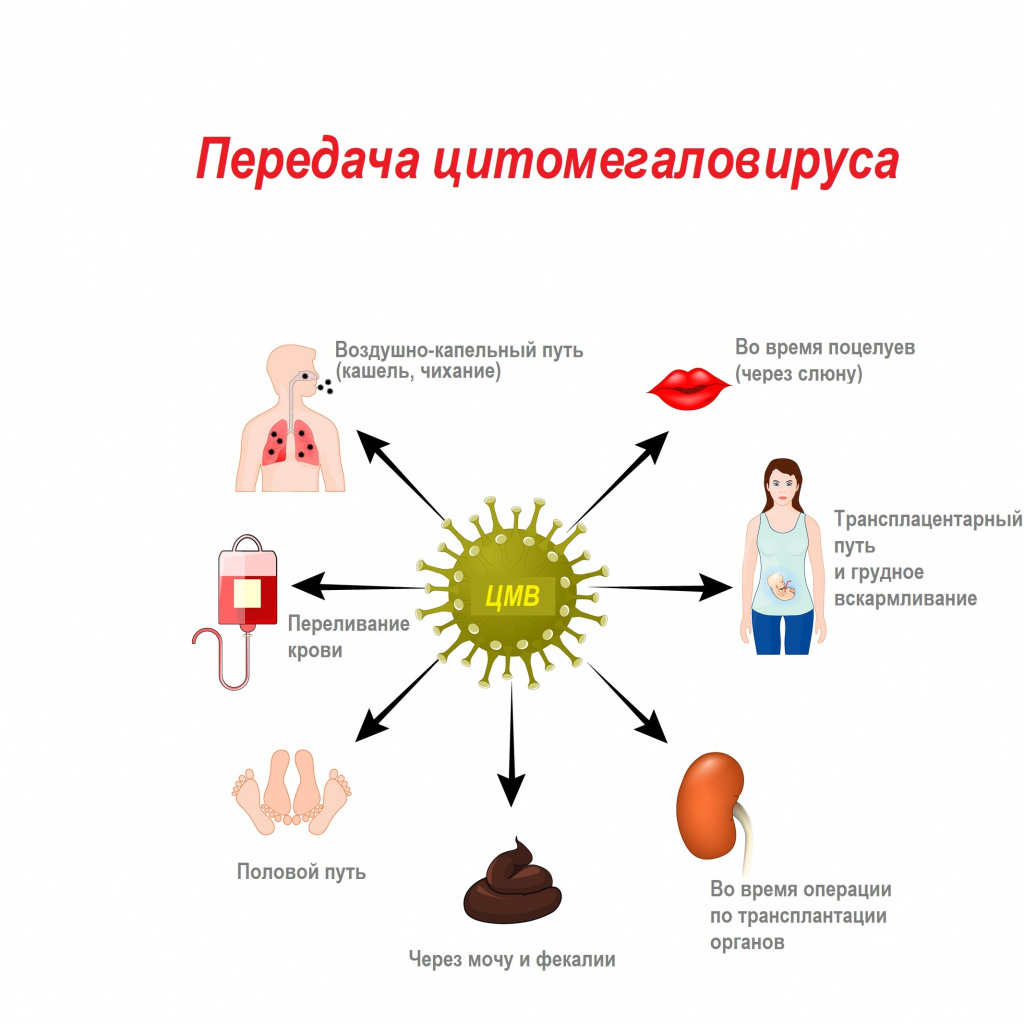
Цитомегаловирус передается через биологические жидкости: слюну, мочу, кровь, вагинальный секрет, слезы, сперму, фекалии, грудное молоко.
Из-за лабильности возбудителя и низкой концентрации вируса в выделениях для передачи инфекции необходим длительный, частый и тесный контакт с носителем.
Механизмы передачи вируса — воздушно-капельный (аэрозольный путь), контактный (контактно-бытовой и половой), гемоконтактный (парентеральный, а также при пересадке органов), вертикальный (от матери к плоду), фекально-оральный (алиментарный — через грудное молоко).
Заражение плода реализуется за счет трансплацентарной передачи от матери к плоду, которая возможна в течение всей беременности. Наибольшую опасность для плода представляет первичная инфекция на ранних сроках беременности, поскольку часто вызывает формирование врожденных пороков развития.
Особое свойство ЦМВ — способность вызывать депрессию практически всех звеньев иммунитета, резко угнетать продукцию интерферонов, в первую очередь ИНФ-α. При острой инфекции вирус поражает преимущественно эпителиальные клетки легких, печени, кишечника, почек, мочевого пузыря, молочных и слюнных желез, генитального тракта. Цитомегаловирус может инфицировать нервные клетки, клетки гладкой мускулатуры, костного мозга.
Классификация заболевания
По характеру инфицирования:
- врожденное (внутриутробное),
- постнатальное (приобретенное).
- латентная инфекция,
- персистирующая инфекция,
- активная (низкой, средней, высокой степени тяжести) инфекция.
- острая инфекция,
- реактивация вируса,
- реинфекция.
Инкубационный период цитомегаловирусной болезни составляет от 15 дней до трех месяцев (при манифестной, выраженной форме заболевания). Однако чаще первичное инфицирование протекает или бессимптомно, или по типу легкой формы ОРЗ – у пациента наблюдаются незначительная слабость, лихорадка (температура 37,1-38,0°С), дискомфорт в мышцах, першение в горле, иногда насморк, увеличение шейных лимфатических узлов, болезненность слюнных желез, головная боль, отсутствие аппетита.
У беременных острая первичная инфекция протекает, как правило, бессимптомно (25–50%) или с неспецифическими проявлениями (с лихорадкой, астенией и головной болью).
В редких случаях развиваются гепато- и спленомегалия, гепатит с минимальной степенью активности цитолитического синдрома, дерматиты, васкулиты, интерстициальный пневмонический процесс, тромбоцитоз или тромбоцитопения, лимфоцитоз.
У больных с иммунодефицитом цитомегаловирусная инфекция протекает тяжело - вирус быстро распространяется по организму и вызывает серьезные осложнения.
Диагностика цитомегаловируса
Диагностические мероприятия начинаются со сбора жалоб и анамнеза, в том числе акушерско-гинекологического анамнеза матери.
Затем врач проводит объективное обследование (физикальное, неврологическое и антропометрическое).
Лабораторные исследования - общие и специфические:
-
общий анализ крови;
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Синонимы: Анализ крови на антитела к цитомегаловирусу; АТ-ЦМВ-IgМ; цитомегаловирусная инфекция; ЦМВ-инфекция; специфические иммуноглобулины класса М к цитомегаловирусу. Cytomegalovirus; CMV Antibody; IgM; CMV infection; CMV-specific IgM. Краткое описание исследования Anti-CMV.
Синонимы: Анализ крови на антитела к цитомегаловирусу; АТ-ЦМВ-IgG; Цитомегаловирусная инфекция; ЦМВ-инфекция; Специфические иммуноглобулины класса G к цитомегаловирусу. Cytomegalovirus; CMV Antibody, IgG; CMV infection; CMV-specific IgG. Краткое описание исследования Anti-CMV-IgG .
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирус – широко распространённый вирус семейства герпесвирусов. После окончания острого периода инфекция цитомегаловирусом обычно переходит в латентную форму, из которой может реактивироваться. Цитомегаловирус относят к так называемым оппортунистическим инфекциям: выраженные клинич.
Цитомегаловирусная инфекция входит в группу репродуктивно значимых инфекций, обозначаемых как TORCH-комплекс (название образовано начальными буквами в латинских наименованиях - Toxoplasma, Rubella, Cytomegalovirus, Herpes); первичное инфицирование данными возбудителями, либо обострение .
К каким врачам обращаться
С первичными жалобами пациенты обращаются к врачу-терапевту или врачу общей практики (семейному врачу), детей ведет врач-педиатр . Могут потребоваться консультации инфекциониста - для верификации диагноза, стоматолога - при поражениях слизистой оболочки рта, кардиолога - при наличии врожденного порока сердца, нейрохирурга - при пороках центральной нервной системы, невропатолога - для оценки неврологической патологии, гематолога - при выраженных гематологических изменениях и геморрагическом синдроме, окулиста - для исследования глазного дна, отоларинголога - для исследования слухового аппарата.
Лечение цитомегаловирусной болезни
Субклинические формы ЦМВ-инфекции и латентное носительство крайне распространены, поэтому в большинстве случаев не требуют специфической терапии даже при выявлении антител. Их лечение направлено на усиление защитных сил организма при помощи иммуномодуляторов и профилактику факторов риска, которые приводят к обострению заболевания.
Для терапии клинически активных форм инфекции применяют:
- комплекс патогенетической (противовирусной) терапии, который разрабатывается профильными специалистами и включает препараты прямого противовирусного действия для минимизации риска осложнений, сокращения времени течения заболевания, а также профилактики рецидивов;
- иммунотерапию – антицитомегаловирусный иммуноглобулин назначают преимущественно детям при манифестных формах заболевания и беременным;
- дезинтоксикационную терапию, которая направлена на купирование синдрома интоксикации;
- метаболическую терапию - для восстановления обмена веществ в организме;
- симптоматическую терапию - для купирования воспалительных и токсических проявлений заболевания.
Проблема клинически выраженной инфекции актуальна для лиц, имеющих иммуносупрессию иной природы, в частности, онкогематологических пациентов, больных лучевой болезнью, лиц, длительно принимающих кортикостероидную, туберкулостатическую терапию, а также перенесших ожоговую травму.
Острое течение ЦМВ может привести к развитию гепатита с повышением уровня аминотрансфераз и атипичным лимфоцитозом.
Ученые предполагают роль цитомегаловируса как одного из кофакторов в развитии системных васкулитов, хронических диссеминированных заболеваний легких (в частности, фиброзирующего альвеолита), криоглобулинемии, опухолевых процессов (аденокарциномы предстательной железы, аденокарциномы толстой кишки, рака шейки матки), атеросклероза, кардиомиопатии, детского церебрального паралича, эпилепсии, синдрома Гийена-Барре, синдрома хронической усталости, аутизма.
Первичное инфицирование цитомагаловирусом у беременных женщин существенно повышает риск преждевременных родов, самопроизвольного выкидыша, многоводия, замершей беременности, внутриутробного инфицирования и даже гибели плода. Врожденная ЦМВ-инфекция может стать триггерным фактором развития тяжелых генерализованных форм и инвалидизирующих исходов заболевания, таких как потеря слуха, зрения, умственная отсталость, микроцефалия, судорожный синдром и пр. Такие пожизненные проблемы со здоровьем развиваются примерно у каждого пятого ребенка с врожденной цитомегаловирусной инфекцией.
Профилактика цитомегаловирусной болезни
Женщинам, планирующим беременность, необходимо пройти обследование на наличие ЦМВ. При обнаружении вируса важно получить консультацию врача-иммунолога.
Профилактика или превентивное лечение (активный мониторинг пациентов по уровню вирусной нагрузки и назначение противовирусных препаратов пациентам с признаками инфекции) являются эффективными способами предотвращения развития цитомегаловирусной инфекции после трансплантации органов.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Вирус Эпштейна-Барр относится к семейству герпесвирусов, подсемейство g-герпесвирусов - вирус герпеса человека IV типа. Вирусная частица состоит из нуклеоида, капсида и оболочки.
Нуклеоид содержит двухцепочечную ДНК, он окружен капсидом, состоящим из белковых субъединиц. Нуклеоид и капсид (нуклеокапсид) окружены липидсодержащей внешней оболочкой, образующейся из ядерной или наружной мембраны клетки-хозяина, в которую ещё до начала сборки вирусной частицы встраиваются некоторые вирусные белки.
При инфицировании вирус проникает в эпителий ротоглотки и слюнных желёз человека и вызывает активную инфекцию с лизисом клеток и высвобождением вирусных частиц, в результате чего вирус обнаруживается в слюне. Кроме того, он может проникать в В-лимфоциты и эпителий носоглотки и вызывать латентную инфекцию. Вирус Эпштейна-Барр можно обнаружить в оральных секретах здоровых, но латентно инфицированных людей. Вирус тропен к В-лимфоцитам, Т-лимфоциты он не поражает. Проникнув в лимфоциты, вирус Эпштейна-Барр может вызывать их трансформацию, в результате которой образуются способные к неограниченной пролиферации клоны атипичных лимфоцитов, содержащие кольцевую вирусную ДНК в виде плазмиды. Рецептором вируса на эпителиальных клетках и В-лимфоцитах служит молекула CD21, которая служит также рецептором фрагмента комплемента C3d. Вирус запускает как гуморальный, так и клеточный ответ. Среди образующихся антител есть специфические к антигенам вируса и неспецифические, гетерофильные. Последние появляются в результате поликлональной активации В-лимфоцитов (это может быть причиной интерференции при проведении ряда серологических исследований у людей с активной инфекцией вирусом Эпштейна-Барр). Главную роль в элиминации данной инфекции играет клеточный иммунитет. При острой инфекции первичная репродукция вируса в В-лимфоцитах сменяется выраженной пролиферацией Т-лимфоцитов с соотношением CD4/CD8 меньше 1.
Острая инфекция вирусом Эпштейна-Барр известна под названиями инфекционный мононуклеоз, болезнь Филатова, моноцитарная ангина, идиопатическая железистая лихорадка, болезнь Афейффера, острый доброкачественный лимфобластоз.
Вирус Эпштейна-Барр - главная причина мононуклеоподобного синдрома (хотя острая первичная инфекция, вызванная этим вирусом, и инфекционный мононуклеоз не являются синонимами). Для острой инфекции характерно повышение температуры, боли в горле и увеличение заднешейных лимфоузлов (реже – переднешейных и локтевых, встречается генерализованное увеличение лимфоузлов). В 50% случаев выявляется увеличение селезенки, в 10 - 30% случаев – увеличение печени. Другими проявлениями инфекции могут быть сыпь и периорбитальный отек. Изредка наблюдаются осложнения, в том числе, неврологические, изменения со стороны системы крови в виде гемолитической или апластической анемии, нейтропении, тромбоцитопении. После перенесённого заболевания иногда подолгу сохраняется фарингит, увеличение лимфоузлов, утомляемость и неспособность концентрации внимания.
Заболевание малоконтагиозно. Инкубационный период (период активного размножения и распространения вируса по всей лимфоидной ткани) может длиться от 30 до 50 суток. Инфицирование данным вирусом в любом возрасте, а у детей особенно, в большинстве случаев может протекать бессимптомно или как респираторная инфекция. Доля серопозитивных лиц (имеющих специфические антитела к антигенам вируса) уже среди подростков в разных странах составляет от 50 до 90%, среди взрослых людей серологические признаки инфекции обнаруживаются почти в 100% случаев. Вирус выделяется со слюной, передается через поцелуи и другие контакты слизистой со слюной или загрязнёнными ею предметами. Трансплацентарная передача вируса происходит редко. Иммунитет при инфекционном мононуклеозе стойкий.
Хотя канцерогенность вируса окончательно не доказана, есть основания полагать, что он может играть роль в развитии ряда злокачественных новообразований – лимфомы Беркитта, рака носоглотки, лимфогранулематоза и ряда посттрансплантационных лимфопролиферативных синдромов. На фоне нарушения клеточного иммунитета (СПИД, иммуносупрессия при трансплантации и пр.) вирус Эпштейна - Барр может вызывать инфекционный мононуклеоз с летальным исходом или лимфопролиферативные синдромы с развитием В-клеточных лимфом.
Диагностика инфекционного мононуклеоза основывается на клинической картине, характерных изменениях в клиническом анализе крови:
Синонимы: ОАК. CBC without differential. Краткая характеристика исследования Общий анализ крови Кровь состоит из жидкой части (плазмы) и клеточных, форменных элементов (эритроциты, лейкоциты, тромбоциты). Состав и концентрация клеточных элементов в крови меняются при различных физио.
ВЭБ вирус, или вирус Эпштейна-Барра – это вирус герпеса 4 типа, который вызывает высококонтагиозное инфекционное заболевание у взрослых и детей. По данным ВОЗ, вирус персистирует в организме 75-90% взрослого и детского населения. До 5% случаев заканчивается малигнизацией новообразований.
Рассказывает специалист ЦМРТ
Дата публикации: 25 Августа 2021 года
Дата проверки: 30 Ноября 2021 года
Содержание статьи
Причины Эпштейн-Барра
Вирус Эпштейна-Барра относится к группе герпесвирусов 4 типа.
В отличие от простого герпеса Эпштейн Барр приводит к пролиферации, или патологическому разрастанию, пораженных тканей с развитием образований. Вирус персистирует не в нервных клетках, а в клетках иммунной системы. Еще одно отличие – его постоянная трансформация.
Передаваться вирус Эпштейн Барр может:
- трансплацентарно
- контактно-бытовым путем
- половым способом
- воздушно-капельным путем
Заражение происходит только в острой стадии заболевания.
После перенесенной инфекции человек в течение 2 лет может оставаться возможным источником заражения. До 30% переболевших людей остаются вирусоносителями.
При воздушно-капельном типе заражения после выделения больным человеком ВЭБ попадает на слизистые оболочки дыхательной системы здоровых людей. Далее с током лимфы вирус попадает в организм.
Протекать болезнь может бессимптомно или по типу простуды. Острая фаза встречается при снижении иммунного ответа. Чаще развивается хронический процесс.
Симптомы Эпшетйна Барра
Ведущими признаками инфекции являются:
Симптомами вируса Эпштейна Барр у взрослых могут быть:
- слабость
- головокружение
- снижение работоспособности
- высокая температура
- боли в горле, насморк, кашель
- тяжесть в правом подреберье
- потемнение мочи
- желтушность кожного покрова и слизистой глаз
Характерные признаки заболевания длятся в среднем 7-14 дней, после чего наступает выздоровление. Слабость и увеличенные лимфоузлы сохраняются до 21 дня.
Для хронического течения заболевания характерно появление новообразований различной локализации.
Стадии развития болезни Эпштейн Барра
В стадии развития болезни Эпштейн Барра выделяют фазы: острую, или инфекционный мононуклеоз и хроническую.
Острая фаза занимает до 3 недель. Далее заболевание переходит в хронический процесс, который протекает с периодами обострения и ремиссий.
По тяжести течения выделяют 3 степени: легкая, средняя, тяжелая.
Эпштейн Барр при беременности
При первичном заражении вирусом Эпштейна Барр во время беременности могут развиваться осложнения со стороны матери и плода:
- самопроизвольный выкидыш
- преждевременные роды
- внутриутробное заражение плода
- поражение печени и селезенки матери.
Если будущая мать ранее имела контакт с возбудителем, то возможен переход инфекции из латентного состояния в период обострения.
Лечение инфекционного мононуклеоза у беременной обязательно проводится в стационаре под наблюдением специалистов.
Как диагностировать
Диагностика болезни Эпштейн Барра комплексная и состоит из сбора жалоб, осмотра и анализов.
При обращении пациентки к врачу отмечается характерная для простудных заболеваний симптоматика. При этом развивается регионарная лимфаденопатия и гепатоспленомегалия.
При осмотре определяются увеличенные до 2 см подвижные умеренно болезненные лимфоузлы. Поражаются обычно несколько групп лимфоузлов. При шейной лимаденопатии может возникать одутловатость лица.
Назначается общий анализ крови, для которого характерно повышение числа лейкоцитов, лимфоцитов и моноцитов, ускоренное СОЭ
В биохимическом анализе отмечается повышение значений печеночных ферментов: АлАТ, АсАТ, ЛДГ, билирубина.
Для верификации возбудителя используется серологическая диагностика:
- ПЦР: позволяет определить ДНК вируса
- ИФА: определяются количество и класс иммуноглобулинов, или антитела к Эпштейн Барру
- Для определения степени поражения печени и селезенки назначается УЗИ органов брюшной полости
- Дополнительно может назначаться иммунологическое исследование при тяжелых формах болезни.
К какому врачу обратиться
Лечением острой вирусной инфекции Эпштейн Барр занимается врач-инфекционист, терапевт или ВОП. Хроническую форму с развитием новообразований лечит онколог. При наличии показаний пациент направляется к смежным специалистам: ЛОР, иммунолог, гематолог.
Как лечить болезнь Эпштейн Барр
Лечение неспецифическое. Инфекционный мононуклеоз необходимо лечить в стационарных условиях.
Для снижения вирусной активности назначаются противовирусные препараты. По показаниям назначаются антибиотики, иммуномодуляторы.
Обязательно проводится симптоматическая терапия:
- при температуре назначаются жаропонижающие
- при кашле – отхаркивающие
- при заложенности носа – сосудосуживающие капли
Лечение патологии занимает от 2 недель до нескольких месяцев.
Последствия
Вирус Эпштейн Барра может приводить к развитию осложнений в виде:
- отита
- дыхательной недостаточности
- гепатита
- гемолитической анемии
- тромбоцитопенической пурпуры
- панкреатита
- малигнизации опухолей
Профилактика
Специфической профилактики заболевания не существует. Проводятся мероприятия по защите слизистых оболочек от проникновения вируса от больного человека: ношение маски при наличии симптомов простудной болезни, своевременное обращение к врачу для определения тактики ведения и лечения.
Лечение болезни Эпштейн Барра в клиниках ЦМРТ
В клинике ЦМРТ ведет прием терапевт. Специалист назначает необходимые виды лабораторно-диагностических исследований. При наличии жалоб можно записаться на прием по телефону, через онлайн-форму на сайте.
Источники
Инфекционные болезни: Уч. Пос / И.А. Бережнова. - М.: Риор, 2015.
Инфекционные болезни / Б.П. Богомолов. - М.: МГУ, 2006
Вирусные инфекционные заболевания и их этиотропная терапия: Метод. рек. для врачей, клин. ординаторов, интернов, студ. мед. вузов. / В. Л. Кокорев, Н. П. Куприна, Л. М. Коноплина и др.; Воронеж.мед.акад.;Сост.С.П.Кокорева и др. - Воронеж, 2003.
Внутриутробные инфекции – группа заболеваний плода и новорожденного, развивающихся вследствие заражения в дородовом периоде или в родах. Внутриутробные инфекции могут приводить к гибели плода, самопроизвольному аборту, задержке внутриутробного развития, преждевременным родам, формированию врожденных пороков, поражению внутренних органов и ЦНС. Методы диагностики внутриутробных инфекций включают микроскопические, культуральные, иммуноферментные, молекулярно-биологические исследования. Лечение внутриутробных инфекций проводится с использованием иммуноглобулинов, иммуномодуляторов, противовирусных, антибактериальных препаратов.
Общие сведения
Внутриутробные инфекции – патологические процессы и заболевания, обусловленные антенатальным и интранатальным инфицированием плода. Истинная распространенность внутриутробных инфекций не установлена, однако, согласно обобщенным данным, с врожденными инфекциями рождается не менее 10% новорожденных. Актуальность проблемы внутриутробных инфекций в педиатрии обусловлена высокими репродуктивными потерями, ранней неонатальной заболеваемостью, приводящей к инвалидизации и постнатальной гибели детей. Вопросы профилактики внутриутробных инфекций лежат в плоскости рассмотрения акушерства и гинекологии, неонатологии, педиатрии.

Причины внутриутробных инфекций
Внутриутробные инфекции развиваются в результате инфицирования плода в дородовом периоде или непосредственно во время родов. Обычно источником внутриутробной инфекции для ребенка выступает мать, т. е. имеет место вертикальный механизм передачи, который в антенатальном периоде реализуется трансплацентарным или восходящим (через инфицированные околоплодные воды) путями, а в интранатальном - аспирационным или контактным путями.
Реже происходит ятрогенное инфицирование плода в период беременности при проведении женщине инвазивной пренатальной диагностики (амниоцентеза, кордоцентеза, биопсии ворсин хориона), введении плоду препаратов крови через сосуды пуповины (плазмы, эритроцитарной массы, иммуноглобулинов) и т. д.
В антенатальном периоде инфицирование плода обычно связано с вирусными агентами (вирусами краснухи, герпеса, цитомегалии, гепатита В и С, Коксаки, ВИЧ) и внутриклеточными возбудителями (токсоплазмоза, микоплазмоза).
В интранатальном периоде чаще происходит микробная контаминация, характер и степень которой зависит от микробного пейзажа родовых путей матери. Среди бактериальных агентов наиболее распространены энтеробактерии, стрептококки группы В, гонококки, синегнойная палочки, протей, клебсиелла и др. Плацентарный барьер непроницаем для большинства бактерий и простейших, однако при повреждении плаценты и развитии фетоплацентарной недостаточности, может произойти антенатальное микробное инфицирование (например, возбудителем сифилиса). Кроме этого, не исключается и интранатальное вирусное заражение.
Факторами возникновения внутриутробных инфекций служат отягощенный акушерско-гинекологический анамнез матери (неспецифические кольпиты, эндоцервициты, ЗППП, сальпингофориты), неблагополучное течение беременности (угроза прерывания, гестозы, преждевременная отслойка плаценты) и инфекционная заболеваемость беременной. Риск развития манифестной формы внутриутробной инфекции существенно выше у недоношенных детей и в том случае, когда женщина инфицируется первично во время беременности.
Известно, что тяжесть проявлений инфекционного процесса у беременной и у плода может не совпадать. Бессимптомное или малосимптомное течение инфекции и у матери может вызвать тяжелые поражения плода, вплоть до его гибели. Это связано с повышенным тропизмом вирусных и микробных возбудителей к эмбриональным тканям, преимущественно ЦНС, сердца, органа зрения.
Классификация
Этиологическая структура внутриутробных инфекций предполагает их деление на:
- вирусные (вирусный гепатит, герпес, краснуха, ОРВИ, цитомегалия, эпидемический паротит, энтеровирусная инфекция)
- бактериальные (туберкулез, сифилис, листериоз, сепсис)
- паразитарные и грибковые (микоплазмоз, токсоплазмоз, хламидиоз, кандидоз и др.)
Для обозначения группы наиболее распространенных внутриутробных инфекций используется аббревиатура TORCH-синдром, объединяющий токсоплазмоз (toxoplasmosis), краснуху (rubella), цитомегалию (cytomegalovirus), герпес (herpes simplex). Буквой О (other) обозначаются другие инфекции, в числе которых - вирусные гепатиты, ВИЧ-инфекция, ветряная оспа, листериоз, микоплазмоз, сифилис, хламидиоз и др.).
Симптомы внутриутробных инфекций
Наличие внутриутробной инфекции у новорожденного может быть заподозрено уже во время родов. В пользу внутриутробного инфицирования может свидетельствовать излитие мутных околоплодных вод, загрязненных меконием и имеющих неприятный запах, состояние плаценты (полнокровие, микротробозы, микронекрозы). Дети с внутриутробной инфекцией часто рождаются в состоянии асфиксии, с пренатальной гипотрофией, увеличенной печенью, пороками развития или стигмами дисэмбриогенеза, микроцефалией, гидроцефалией. С первых дней жизни у них отмечается желтуха, элементы пиодермии, розеолезных или везикулезных высыпаний на коже, лихорадка, судорожный синдром, респиратрные и кардиоваскулярные расстройства.
Ранний неонатальный период при внутриутробных инфекциях нередко отягощается интерстициальной пневмонией, омфалитом, миокардитом или кардитом, анемией, кератоконъюнктивитом, хориоретинитом, геморрагическим синдромом и др. При инструментальном обследовании у новорожденных могут обнаруживаться врожденная катаракта, глаукома, врожденные пороки сердца, кисты и кальцификаты мозга.
В перинатальном периоде у ребенка отмечаются частые и обильные срыгивания, мышечная гипотония, синдром угнетения ЦНС, серый цвет кожных покровов. В поздние сроки при длительном инкубационном периоде внутриутробной инфекции возможно развитие поздних менингитов, энцефалитов, остеомиелита.
Рассмотрим проявления основных внутриутробных инфекций, составляющих TORCH-синдром.
Врождённый токсоплазмоз
Внутриутробное инфицирование одноклеточным протозойным паразитом Toxoplasma Gondii приводит к тяжелым поражениям плода – задержке развития, врожденным порокам развития мозга, глаз, сердца, скелета.
После рождения в остром периоде внутриутробная инфекция проявляется лихорадкой, желтухой, отечным синдромом, экзантемой, геморрагиями, диареей, судорогами, гепатоспленомегалией, миокардитом, нефритом, пневмонией. При подостром течении доминирую признаки менингита или энцефалита. При хронической персистенции развивается гидроцефалия с микроцефалией, иридоциклит, косоглазие, атрофия зрительных нервов. Иногда встречаются моносимптомные и латентные формы внутриутробной инфекции.
К числу поздних осложнений врожденного токсоплазмоза относятся олигофрения, эпилепсия, слепота.
Врождённая краснуха
Внутриутробная инфекция возникает из-за заболевания краснухой при беременности. Вероятность и последствия инфицирования плода зависят от гестационного срока: в первые 8 недель риск достигает 80%; последствиями внутриутробной инфекции могут служить самопроизвольное прерывание беременности, эмбрио- и фетопатии. Во II триместре риск внутриутробного инфицирования составляет 10-20%, в III – 3-8%.
Дети с внутриутробной инфекцией обычно рождаются недоношенными или с низкой массой тела. Для периода новорожденности характерна геморрагическая сыпь, длительная желтуха.
Классические проявления врожденной краснухи представлены триадой Грега: поражением глаз (микрофтальмией, катарактой, глаукомой, хориоретинитом), ВПС (открытым артериальным протоком, ДМПП, ДМЖП, стенозом легочной артерии), поражением слухового нерва (сенсоневральной глухотой). В случае развития внутриутробной инфекции во второй половине беременности у ребенка обычно имеется ретинопатия и глухота.
Кроме основных проявлений врожденной краснухи, у ребенка могут выявляться и другие аномалии: микроцефалия, гидроцефалия, расщелины нёба, гепатит, гепатоспленомегалия, пороки развития мочеполовой системы и скелета. В дальнейшем внутриутробная инфекция напоминает о себе отставанием ребенка в физическом развитии, ЗПР или умственной отсталостью.
Врождённая цитомегалия
Внутриутробное заражение цитомегаловирусной инфекцией может приводить к локальному или генерализованному поражению многих органов, иммунодефициту, гнойно-септическим осложнениям. Врожденные дефекты развития обычно включают микроцефалию, микрогирию, микрофтальмию, ретинопатию, катаракту, ВПС и др. Неонатальный период врожденной цитомегалии осложняется желтухой, геморрагическим синдромом, двусторонней пневмонией, интерстициальным нефритом, анемией.
К отдаленным последствиям внутриутробной инфекции относятся слепота, нейросенсорная глухота, энцефалопатия, цирроз печени, пневмосклероз.
Врождённая герпетическая инфекция
Внутриутробная герпес-инфекция может протекать в генерализованной (50%), неврологической (20%), слизисто-кожной форме (20%).
Генерализованная внутриутробная врожденная герпетическая инфекция протекает с выраженным токсикозом, респираторным дистресс-синдромом, гепатомегалией, желтухой, пневмонией, тромбоцитопенией, геморрагическим синдромом. Неврологическая форма врожденного герпеса клинически проявляется энцефалитом и менингоэнцефалитом. Внутриутробная герпес-инфекция с развитием кожного синдрома сопровождается появлением везикулярной сыпи на кожных покровах и слизистых оболочках, в т. ч. внутренних органов. При наслоении бактериальной инфекции развивается сепсис новорожденных.
Внутриутробная герпес-инфекция у ребенка может приводить к формированию пороков развития - микроцефалии, ретинопатии, гипоплазии конечностей (кортикальной карликовости). В числе поздних осложнений врожденного герпеса - энцефалопатия, глухота, слепота, задержка психомоторного развития.
Диагностика
В настоящее время актуальной задачей является пренатальная диагностика внутриутробных инфекций. С этой целью на ранних сроках беременности проводится микроскопия мазка, бактериологический посев из влагалища на флору, ПЦР-исследование соскоба, обследование на TORCH-комплекс. Беременным из группы высокого риска по развитию внутриутробной инфекции показана инвазивная пренатальная диагностика (аспирация ворсин хориона, амниоцентез с исследованием амниотической жидкости, кордоцентез с исследованием пуповинной крови).
Возможно выявление эхографических маркеров внутриутробных инфекций с помощью акушерского УЗИ. К косвенным эхографическим признакам внутриутробного инфицирования относятся маловодие или многоводие; наличие гиперэхогенной взвеси в околоплодных водах или амниотических тяжей; гипоплазия ворсин хориона, плацентит; преждевременное старение плаценты; отечный синдром плода (асцит, перикардит, плеврит), гепатоспленомегалия, кальцификаты и пороки развития внутренних органов и др. В процессе допплерографического исследования кровотока выявляются нарушения плодово-плацентарного кровотока. Кардиотокография обнаруживает признаки гипоксии плода.
После рождения ребенка с целью достоверной верификации этиологии внутриутробной инфекции используются микробиологические (вирусологические, бактериологические), молекулярно-биологические (ДНК-гибридизация, ПЦР), серологические (ИФА) методики обследования. Важное диагностическое значение имеет гистологическое исследование плаценты.
По показаниям новорожденные с внутриутробными инфекциями в первые сутки жизни должны быть осмотрены детским неврологом, детским кардиологом, детским офтальмологом и др. специалистами. Целесообразно провести ЭхоКГ, нейросонографию, офтальмоскопию, исследование слуха методом вызванной отоакустической эмиссии.
Лечение внутриутробных инфекций
Общие принципы лечения внутриутробных инфекций предполагают проведение иммунотерапии, противовирусной, антибактериальной и посиндромной терапии.
Иммунотерапия включает применение поливалентных и специфических иммуноглобулинов, иммуномодуляторов (интерферонов). Противовирусная терапия направленного действия осуществляется, главным образом, ацикловиром. Для противомикробной терапии бактериальных внутриутробных инфекций используются антибиотики широкого спектра действия (цефалоспорины, аминогликозиды, карбапенемы), при микоплазменной и хламидийной инфекциях – макролиды.
Посиндромная терапия внутриутробных инфекций направлена на купирование отдельных проявлений перинатального поражения ЦНС, геморрагического синдрома, гепатита, миокардита, пневмонии и т. д.
Прогноз и профилактика
При генерализованных формах внутриутробных инфекций летальность в неонатальном периоде достигает 80%. При локальных формах возникают серьезные поражения внутренних органов (кардиомиопатии, ХОБЛ, интерстициальный нефрит, хронический гепатит, цирроз и т. д.). Практически во всех случаях внутриутробные инфекции приводят к поражению ЦНС.
Профилактика внутриутробных инфекций заключается в проведении предгравидарной подготовки, лечении ЗППП до наступления беременности, исключении контактов беременной с инфекционными больными, коррекции программы ведения беременности у женщин групп риска. Женщины, ранее не болевшие краснухой и не получавшие прививки против краснухи, должны быть вакцинированы не позднее, чем за 3 месяца до предполагаемой беременности. В ряде случаев внутриутробные инфекции могут являться основанием для искусственного прерывания беременности.
Читайте также:

