Макролиды при стрептококковой инфекции
Обновлено: 19.04.2024
Макролиды представляют собой класс антибиотиков, основу химической структуры которых составляет макроциклическое лактонное кольцо. В зависимости от числа атомов углерода в кольце макролиды подразделяются на 14-членные (эритромицин, рокситромицин, кларитромицин), 15-членные (азитромицин) и 16-членные (мидекамицин, спирамицин, джозамицин). Основное клиническое значение имеет активность макролидов в отношении грамположительных кокков и внутриклеточных возбудителей (микоплазмы, хламидии, кампилобактеры, легионеллы). Макролиды относятся к числу наименее токсичных антибиотиков.
Классификация макролидов
| 14-членные | 15-членные (азалиды) | 16-членные |
|---|---|---|
| Природные | ||
| Эритромицин | Спирамицин | |
| Джозамицин | ||
| Мидекамицин | ||
| Полусинтетические | ||
| Кларитромицин | Азитромицин | Мидекамицина ацетат |
| Рокситромицин | ||
Механизм действия
Антимикробный эффект обусловлен нарушением синтеза белка на рибосомах микробной клетки. Как правило, макролиды оказывают бактериостатическое действие, но в высоких концентрациях способны действовать бактерицидно на БГСА, пневмококк, возбудителей коклюша и дифтерии. Макролиды проявляют ПАЭ в отношении грамположительных кокков. Кроме антибактериального действия макролиды обладают иммуномодулирующей и умеренной противовоспалительной активностью.
Спектр активности
Макролиды активны в отношении грамположительных кокков, таких как S.pyogenes, S.pneumoniae, S.aureus (кроме MRSA). В последние годы отмечено нарастание резистентности, но при этом 16-членные макролиды в некоторых случаях могут сохранять активность в отношении пневмококков и пиогенных стрептококков, устойчивых к 14- и 15-членным препаратам.
Макролиды действуют на возбудителей коклюша и дифтерии, моракселлы, легионеллы, кампилобактеры, листерии, спирохеты, хламидии, микоплазмы, уреаплазмы, анаэробы (исключая B.fragilis).
Азитромицин превосходит другие макролиды по активности в отношении H.influenzae, а кларитромицин - против H.pylori и атипичных микобактерий (M.avium и др.). Действие кларитромицина на H.influenzae и ряд других возбудителей усиливает его активный метаболит - 14-гидроксикларитромицин. Спирамицин, азитромицин и рокситромицин активны в отношении некоторых простейших (T.gondii, Cryptosporidium spp.).
Микроорганизмы семейства Enterobacteriaceae, Pseudomonas spp. и Acinetobacter spp. обладают природной устойчивостью ко всем макролидам.
Фармакокинетика
Всасывание макролидов в ЖКТ зависит от вида препарата, лекарственной формы и присутствия пищи. Пища значительно уменьшает биодоступность эритромицина, в меньшей степени - рокситромицина, азитромицина и мидекамицина, практически не влияет на биодоступность кларитромицина, спирамицина и джозамицина.
Макролиды относятся к тканевым антибиотикам, так как их концентрации в сыворотке крови значительно ниже тканевых и варьируют у различных препаратов. Наиболее высокие сывороточные концентрации отмечаются у рокситромицина, самые низкие - у азитромицина.
Макролиды в различной степени связываются с белками плазмы крови. Наибольшее связывание с белками плазмы отмечается у рокситромицина (более 90%), наименьшее - у спирамицина (менее 20%). Они хорошо распределяются в организме, создавая высокие концентрации в различных тканях и органах (в том числе в предстательной железе), особенно при воспалении. При этом макролиды проникают внутрь клеток и создают высокие внутриклеточные концентрации. Плохо проходят через ГЭБ и гематоофтальмический барьер. Проходят через плаценту и проникают в грудное молоко.
Метаболизируются макролиды в печени при участии микросомальной системы цитохрома P-450, метаболиты выводятся преимущественно с желчью. Один из метаболитов кларитромицина обладает антимикробной активностью. Метаболиты выводятся преимущественно с желчью, почечная экскреция составляет 5-10%. Период полувыведения препаратов колеблется от 1 ч (мидекамицин) до 55 ч (азитромицин). При почечной недостаточности у большинства макролидов (кроме кларитромицина и рокситромицина) этот параметр не изменяется. При циррозе печени возможно значительное увеличение периода полувыведения эритромицина и джозамицина.
Нежелательные реакции
Макролиды являются одной из самых безопасных групп АМП. НР в целом встречаются редко.
ЖКТ: боль или дискомфорт в животе, тошнота, рвота, диарея (чаще других их вызывает эритромицин, оказывающий прокинетическое действие, реже всего - спирамицин и джозамицин).
Печень: транзиторное повышение активности трансаминаз, холестатический гепатит, которые могут проявляться желтухой, лихорадкой, общим недомоганием, слабостью, болью в животе, тошнотой, рвотой (чаще при применении эритромицина и кларитромицина, очень редко при использовании спирамицина и джозамицина).
ЦНС: головная боль, головокружение, нарушения слуха (редко при в/в введении больших доз эритромицина или кларитромицина).
Сердце: удлинение интервала QT на электрокардиограмме (редко).
Местные реакции: флебит и тромбофлебит при в/в введении, вызванные местнораздражающим действием (макролиды нельзя вводить в концентрированном виде и струйно, они вводятся только путем медленной инфузии).
Аллергические реакции (сыпь, крапивница и др.) отмечаются очень редко.
Показания
Инфекции ВДП: стрептококковый тонзиллофарингит, острый синусит, ОСО у детей (азитромицин).
Инфекции НДП: обострение хронического бронхита, внебольничная пневмония (включая атипичную).
Дифтерия (эритромицин в сочетании с антидифтерийной сывороткой).
ИППП: хламидиоз, сифилис (кроме нейросифилиса), мягкий шанкр, венерическая лимфогранулема.
Тяжелая угревая сыпь (эритромицин, азитромицин).
Кампилобактерный гастроэнтерит (эритромицин).
Эрадикация H.pylori при язвенной болезни желудка и двенадцатиперстной кишки (кларитромицин в сочетании с амоксициллином, метронидазолом и антисекреторными препаратами).
Профилактика и лечение микобактериоза, вызванного M.avium у больных СПИДом (кларитромицин, азитромицин).
профилактика коклюша у людей, контактировавших с больными (эритромицин);
санация носителей менингококка (спирамицин);
круглогодичная профилактика ревматизма при аллергии на пенициллин (эритромицин);
профилактика эндокардита в стоматологии (азитромицин, кларитромицин);
деконтаминация кишечника перед операцией на толстой кишке (эритромицин в сочетании с канамицином).
Противопоказания
Аллергическая реакция на макролиды.
Беременность (кларитромицин, мидекамицин, рокситромицин).
Кормление грудью (джозамицин, кларитромицин, мидекамицин, рокситромицин, спирамицин).
Предупреждения
Беременность. Имеются данные о нежелательном влиянии кларитромицина на плод. Информация, доказывающая безопасность рокситромицина и мидекамицина для плода, отсутствует, поэтому их также не следует назначать во время беременности. Эритромицин, джозамицин и спирамицин не оказывают отрицательного действия на плод и могут назначаться беременным. Азитромицин применяется при беременности в случае крайней необходимости.
Кормление грудью. Большинство макролидов проникает в грудное молоко (по азитромицину данные отсутствуют). Информация о безопасности для ребенка, находящегося на грудном вскармливании, имеется только для эритромицина. Применения других макролидов женщинам, кормящим грудью, следует по возможности избегать.
Педиатрия. Безопасность кларитромицина у детей до 6 мес не установлена. Период полувыведения рокситромицина у детей может увеличиваться до 20 ч.
Гериатрия. Каких-либо ограничений для применения макролидов у людей пожилого возраста не существует, однако надо учитывать возможные возрастные изменения функции печени, а также повышенный риск нарушений слуха при использовании эритромицина.
Нарушение функции почек. При понижении клиренса креатинина менее 30 мл/мин период полувыведения кларитромицина может увеличиваться до 20 ч, а его активного метаболита - до 40 ч. Период полувыведения рокситромицина может возрастать до 15 ч при понижении клиренса креатинина до 10 мл/мин. В таких ситуациях может потребоваться коррекция режима дозирования этих макролидов.
Нарушение функции печени. При тяжелых заболеваниях печени макролиды следует применять с осторожностью, поскольку может увеличиваться период полувыведения и возрастать риск их гепатотоксичности, в особенности таких препаратов, как эритромицин и джозамицин.
Заболевания сердца. С осторожностью использовать при удлинении интервала QT на электрокардиограмме.
Лекарственные взаимодействия
Большинство лекарственных взаимодействий макролидов основывается на угнетении ими цитохрома Р-450 в печени. По степени выраженности его ингибирования макролиды можно распределить в следующем порядке: кларитромицин > эритромицин > джозамицин = мидекамицин > рокситромицин > азитромицин > спирамицин. Макролиды ингибируют метаболизм и повышают концентрацию в крови непрямых антикоагулянтов, теофиллина, карбамазепина, вальпроевой кислоты, дизопирамида, препаратов спорыньи, циклоспорина, что повышает риск развития НР, свойственных этим препаратам, и может потребовать коррекции режима их дозирования. Не рекомендуется сочетать макролиды (кроме спирамицина) с терфенадином, астемизолом и цизапридом ввиду опасности развития тяжелых нарушений сердечного ритма, обусловленных удлинением интервала QT.
Макролиды могут увеличивать биодоступность дигоксина при приеме внутрь за счет ослабления его инактивации кишечной микрофлорой.
Антациды уменьшают всасывание макролидов, особенно азитромицина, в ЖКТ.
Рифампицин усиливает метаболизм макролидов в печени и понижает их концентрацию в крови.
Макролиды не следует сочетать с линкозамидами ввиду сходного механизма действия и возможной конкуренции.
Эритромицин, особенно при в/в введении, способен усиливать всасывание алкоголя в ЖКТ и повышать его концентрацию в крови.
Информация для пациентов
Большинство макролидов следует принимать внутрь за 1 ч до или через 2 ч после еды и лишь кларитромицин, спирамицин и джозамицин можно принимать независимо от приема пищи.
Эритромицин при приеме внутрь следует запивать полным стаканом воды.
Жидкие лекарственные формы для приема внутрь готовить и принимать в соответствии с прилагаемой инструкцией.
Строго соблюдать режим и схему лечения в течение всего курса терапии, не пропускать дозу и принимать ее через равные промежутки времени. В случае пропуска дозы принять ее как можно скорее; не принимать, если почти наступило время приема следующей дозы; не удваивать дозу. Выдерживать длительность терапии, особенно при стрептококковых инфекциях.
Не использовать препараты с истекшим сроком годности.
Проконсультироваться с врачом, если улучшение не наступает в течение нескольких дней или появляются новые симптомы.
В настоящее время среди макролидов наибольшей клинической популярностью пользуются кларитромицин и азитромицин.
Динамика назначения антибиотиков в США
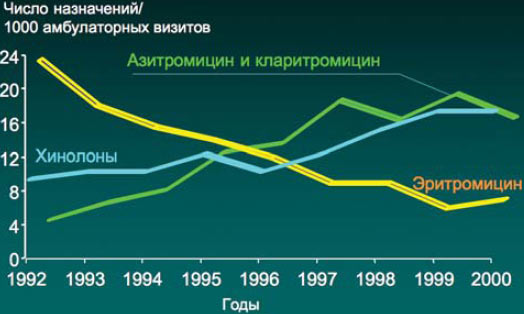
McCaigetai., 2003
Активность макролидов in vitro*
| Эритромицин | Кларитромицин | Азитромицин | |
| Грамположительные кокки | |||
| S. pneumoniae PS | 0,06 | 0,06 | 0,12 |
| S.pneumoniae PR | >32 | 32 | 32 |
| S.pyogenes | 0,12 | 0,12 | 0,12 |
| S.aureus MS | 2 | 1 | 2 |
| Грамотрицательные бациллы | |||
| M. catharrhalis | 0,25 | 0,25 | 0,25 |
| H. influenzae | 8 | 4 | 2 |
| Внутриклеточные возбудители | |||
| С. pneumoniae | 0,12 | 0,03 | 0,25 |
| M. pneumoniae | 0,012 | ||
| L. pneumophila | 2 | 0,25 | 2 |
* МПК, мг/л
Dorca et al, 2004
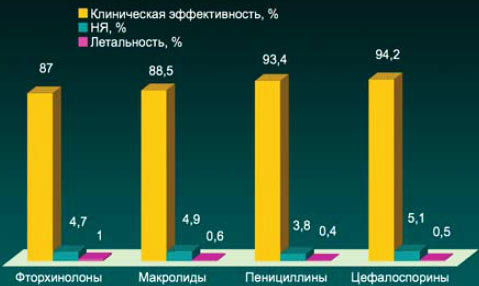
3. Макролиды имеют благоприятный профиль безопасности и остаются одними из наиболее хорошо переносимых антибактериальных препаратов.
Частота отмены антибактериальных препаратов из-за нежелательных явлений при инфекциях дыхательных путей
| Антибиотик | Частота отмены |
| Азитромицин | 0,8% |
| Амоксициллин/клавуланат | 2,3% |
| Кларитромицин | 1,0% |
| Эритромицин | 1,9% |
| Цефаклор | 1,3% |
| Пенициллин/амоксициллин | 0,6% |
*Достоверно чаще по сравнению с макролидами встречались НЯ, требовавшие преждевременного прекращения терапии
Iоаnnidis, et al., 2001
Антибактериальная терапия при ВП у амбулаторных больных
*13 РКИ, n=4314
N Malmon et al. ERJ 2008; 31:1068
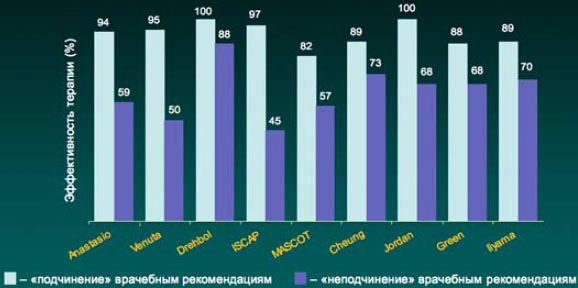
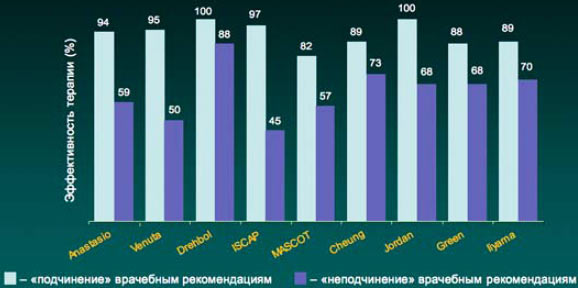
5. В настоящее время имеются доказательства связи между кратностью приема лекарственного средства и приверженностью пациента врачебным рекомендациям (комплаентность). Так, в частности, при однократном приеме препарата комплаентность составляет 98,3%, в то время как при 2–3-кратном приеме в сутки комплаентность составляла 75 и 63,3% соответственно (J Cockburn et al. BMJ 1987; 295: 814).
Прием антибиотика 1 раз в сутки позволяет достичь наибольшей комплаентности, что особенно важно при лечении пациента в амбулаторных условиях.
Комплаентность и эффективность антибактериальной терапии инфекций дыхательных путей
Cheung R et al. 198Bt Drebobl et al 1991, Venuta et al, 1998, Green et al 1969. Jordan et al. 1981, Ilyama et al. 2002, MASCOT 2002, ISCAF 2004
6. Новая лекарственная форма кларитромицина для приема внутрь с замедленным высвобождением характеризуется более длительным поддержанием терапевтических концентраций антибиотика в крови и тканях в отношении респираторных возбудителей, что позволяет принимать препарат 1 раз в сутки, а также лучшим профилем безопасности. На сегодняшний день привлекательность этой лекарственной формы в большинстве стран Европы столь очевидна, что частота назначения кларитромицина с замедленным высвобождением превосходит таковую традиционную форму антибиотика, которую необходимо принимать 2 раза/сут.
Лекарственные формы кларитромицина: частота применения, %
Data on file, Abbot. 2002
7. Если, как уже говорилось выше, при лечении нетяжелой ВП в амбулаторных условиях, как правило, не удается продемонстрировать очевидные преимущества в клинической эффективности между различными классами антибиотиков, то при лечении ВП в условиях стационара комбинированная терапия β-лактамами и макролидами превосходит монотерапию β-лактамами (уменьшение риска летального исхода, сокращение госпитального этапа лечения).
Имеются также доказательства того, что комбинированная терапия (β-лактам + макролид) более эффективна, чем монотерапия β-лактамами, в лечении тяжелой пневмококковой пневмонии, осложненной вторичной бактериемией.
Моно- vs. комбинированная антибактериальная терапия ВП в стационаре*
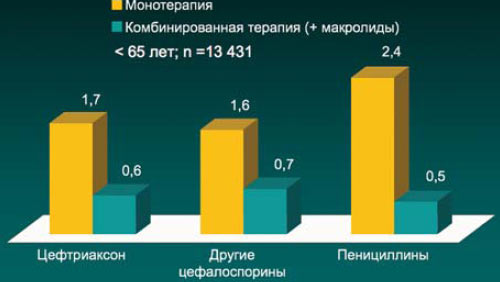
Различия летальности в сравниваемых группах достоверны
RB Brown et al. Chest 2003; 123; 1503
8. Согласно рекомендациям Российского респираторного общества и Межрегиональной ассоциации по клинической микробиологии и антимикробной химиотерапии (2009 г.), макролиды (кларитромицин, азитромицин) наряду с амоксициллином рассматриваются как препараты выбора при лечении нетяжелой ВП в амбулаторных условиях у пациентов без сопутствующих заболеваний и не принимавших в течение последних 3 мес. антибиотики. В случае госпитализации (по медицинским показаниям) больного с ВП макролиды в комбинации с β-лактамами также рассматриваются как одно из приоритетных направлений эмпирической антибактериальной терапии.
Эмпирическая антибактериальная терапия ВП у взрослых
Лечение в амбулаторных условиях
Лечение в условиях стационара
9. Ключевое место в развитии инфекционных обострений ХОБЛ занимают такие бактериальные возбудители, как Haemophilus influenzae и Streptococcus pneumoniae, удельный вес которых составляет 30–59 и 15–25% соответственно. Вопрос о целесообразности антибактериальной терапии инфекционных обострений ХОБЛ был окончательно решен в 1987 г., когда N.R.Anthonisen и соавт. было показано, что антибактериальная терапия эффективнее плацебо при лечении инфекционных обострений ХОБЛ. Авторами были выделены 3 типа обострения заболевания. Для І типа характерным являлось наличие трех ключевых клинических критериев обострения ХОБЛ: появление или усиление одышки, увеличение объема мокроты, появление гнойной мокроты или усиление ее гнойного характера. Именно для этой категории пациентов эффективность антимикробной терапии (по сравнению с плацебо) оказалась наиболее демонстративной. Наличие любых двух клинических признаков соответствует ІІ типу обострения заболевания. Наличие же только одного из перечисленных признаков соответствует ІІІ типу обострения ХОБЛ, при котором эффект от приема антибактериальных препаратов сопоставим с таковым плацебо.
Обострение ХОБЛ: антибиотики vs. плацебо
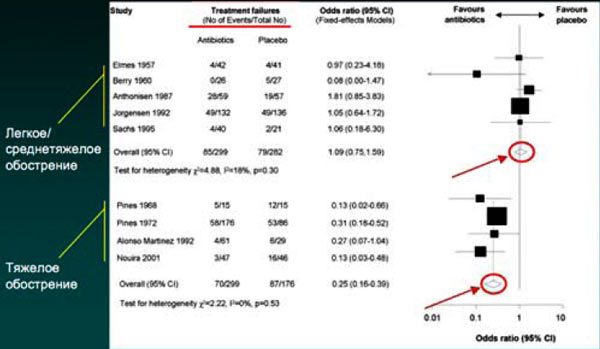
Puhan et al, 2007
10. В тех случаях, когда применение антибиотиков при обострении ХОБЛ признается целесообразным, при выборе того или иного препарата следует учитывать фенотип обострения ХОБЛ. С этой целью выделяют пациентов с простым (неосложненным) обострением ХОБЛ, для лечения которых рекомендуются амоксициллин или макролиды, активные в отношении H. influenzae (азитромицин, кларитромицин). В противоположность этому, при так называемом осложненном обострении заболевания, характеризующимся тяжелыми/крайне тяжелыми нарушениями бронхиальной проходимости, частыми обострениями (≥ 4 в год), наличием серьезных сопутствующих заболеваний и пр., рекомендуются респираторные фторхинолоны или ингибиторозащищенные β-лактамы.
Антибиотики при обострении ХОБЛ
| Фенотип обострения | Вероятные патогены | Антибиотики выбора |
| Простое | Haemophilus influenzae Haemophilus spp. Moraxetla catanbalts Streptococcus pneumoniae | Амоксициллин Макролиды** Цефалоспорины II-III поколения (в алфавитном порядке) |
| Осложненное" | + Klebsiella spp. Другие Enterobactariaceae Возрастание устойчивости к b-лактамам Pseudomonas spp, | Фторхинолоны b-лактамы/ингибиторы b-лактамаз (в порядке предпочтения) |
Примечание. * Наличие ≥ 1 признака (ОФВ,Guidelines Canadian Tnomcic Society, 2008 update (с изменениями)
11. Дискуссионным моментом в определении места макролидов при инфекциях дыхательных путей является наличие уникальных неантимикробных эффектов этого класса антибиотиков, к которым относятся подавление смешанной инфекции и факторов вирулентности возбудителей, снижение адгезии бактерий к слизистой оболочке дыхательных путей, уменьшение продукции и улучшение реологических свойств бронхиального секрета, иммуномодулирующее действие.
Сегодня сложно достоверно оценить вклад многообразных иммуномодулирующих эффектов макролидов в достижение реального клинического эффекта, но и игнорировать их не следует.
Макролиды — большая группа антибиотиков (природных и полусинтетических), основу химической структуры которых составляет макроциклическое лактонное кольцо с одним или несколькими углеводными остатками. В зависимости от числа атомов углерода в кольце макролиды подразделяются на 14-членные (эритромицин, кларитромицин, рокситромицин), 15-членные (азитромицин) и 16-членные (джозамицин, мидекамицин, спирамицин).
По спектру и степени антибактериальной активности представители этой группы близки, исключение составляют новые полусинтетические макролиды (азитромицин и кларитромицин), которые проявляют большую активность в отношении многих внутриклеточных бактерий, некоторых возбудителей опасных инфекций (бруцеллы, риккетсии), грамположительных и грамотрицательных неспорообразующих анаэробов и др. По механизму действия макролиды являются ингибиторами синтеза белка. Как правило, макролиды оказывают бактериостатическое действие, но в некоторых условиях: при изменении рН среды, снижении плотности инокулума, высоких концентрациях в среде могут действовать бактерицидно [1].
Большинство клинически значимых представителей макролидов относится к 14- или 16-членным макролидам. Азитромицин является полусинтетическим производным эритромицина А, в котором метильная группа замещена атомом азота, образуя новую 15-членную структуру, выделенную в новую подгруппу, получившую название азалиды. По ряду свойств (большая активность против некоторых грамотрицательных бактерий, наибольшая пролонгированность действия, клеточная направленность фармакокинетики и др.) азитромицин отличается от своих предшественников [2].
Спектр антимикробного действия
Спектр действия базового антибиотика группы макролидов эритромицина во многом соответствует спектру других представителей этой группы. Эритромицин обладает преимущественной активностью против грамположительных кокков: он активен против стрептококков групп А, В, С, G, Streptococcus pneumoniae. Штаммы последних, устойчивые к бензилпенициллину, устойчивы и к макролидам. Штаммы Staphylococcus aureus обычно чувствительны к макролидам, однако возросшая их устойчивость к беталактамам не позволяет рекомендовать макролиды при стафилококковой инфекции как альтернативную группу антибиотиков без данных лабораторного исследования. Эритромицин активен против коринебактерий, сибиреязвенного микроба, клостридий, листерий, внутриклеточных бактерий (хламидий, микоплазм, легионелл) и атипичных микобактерий туберкулеза. К нему чувствительны некоторые спорообразующие грамположительные и грамотрицательные неспорообразующие анаэробы (табл. 1) [2].
Таблица 1.
Антимикробный спектр эритромицина [1]
Минимальная подавляющая концентрация, мг/л
Streptococcus pyogenes (гр. А) (чувствительные к бензилпенициллину)
Streptococcus pneumoniae (чувствительные к бензилпенициллину)
Streptococcus agalactiae (гр. В)
Streptococcus гр D (Enterococcus)
Примечание. * Среди макролидов азитромицин обладает наибольшей эффективностью в отношении частых возбудителей респираторных инфекций, таких как H.influenzae, M.catarrhalis, С.pneumoniae, M.pneumoniae.
Отличительным свойством азитромицина является активность в отношении многих энтеробактерий (Salmonella spp., Shigella spp., Escherichia coli). Значение МПК азитромицина для них колеблется в пределах 2—16 мг/л [7].
Современные макролиды (особенно полусинтетические) по широте и особенностям спектра действия превосходят антибиотики других групп. В пределах терапевтических концентраций они активны в отношении практически всех групп возбудителей внебольничных инфекций дыхательных путей (при необходимости — в комбинации с антибиотиками широкого спектра действия) [9]. Они высокоэффективны при внутрибольничных инфекциях, вызываемых многими грамотрицательными бактериями (табл. 3). В спектр их действия входят многие внутриклеточные возбудители таких тяжелых инфекций, как боррелиоз, риккетсиозы; а также микобактериозы, вызываемые атипичными микобактериями. Азитромицин активен в отношении энтеробактерий in vitro и в клинике при заболеваниях ими вызываемых; наряду с кларитромицином эффективно применяется при лечении геликобактериоза, кампилобактериоза. Азитромицин, эффективен при острых и хронических инфекциях, передаваемых половым путем (C.trachomatis, Ureaplasma urealyticum); при гонококковом уретрите и цервиците в сочетании с фторхинолонами. Азитромицин и кларитромицин широко применяются и являются основными средствами профилактики и лечения (в сочетании с другими химиотерапевтическим средствами) микобактериозов при ВИЧ-инфекции [10].
Таблица 3.
Активность новых макролидов в отношении основных респираторных патогенов [9]
Минимальная подавляющая концентрация, мг/л
Streptococcus pneumoniae (частота выделения 20—50%)
Таблица 4.
Рекомендации по эмпирической терапии ВВП, разработанные научными сообществами стран Европы, США и Канады ([модифицированная])
Контингент больных, степень тяжести заболевания
Препараты выбора для эмпирической терапии
Северная Америка (Infectious Diseases Society of America)
Амбулаторные больные Госпитальные больные (тяжелые формы ВВП)
Макролиды, фторхинолоны или доксициклин Беталактамы + макролиды или фторхинолоны
США (American Thoracic Society)
Макролиды или тетрациклины, беталактамы или ко-тримоксазол + макролиды
Беталактамы или ко-тримоксазол +
с сопутствующими заболеваниями
Тяжелое течение ВВП
Беталактамы + макролиды; имипенем или фторхинолоны
Канада (Canadian Consensus Conference Group)
Больные ВВП без сопутствующих заболеваний
Макролиды или тетрациклины (доксициклин)
Больные ВВП с сопутствующими заболеваниями
Беталактамы, ко-тримоксазол + фторхинолоны
Больные с тяжелым течением ВВП (ОРИТ)
Беталактамы + макролиды/фторхинолоны; фторхинолоны + беталактамы
ВВП средней тяжести
Беталактамы (амоксициллин) или макролиды
Тяжелое течение ВВП
ВВП средней тяжести
Макролиды или аминопенициллины
Тяжелое течение ВВП
Макролиды или фторхинолоны + беталактамы
ВВП средней тяжести
Тяжелое течение ВВП
При профилактике ревматической лихорадки в случаях аллергии к беталактамам азитромицин является средством выбора, что обусловлено бактерицидностью его действия и эффективностью коротких курсов применения (1 раз в сутки в течение 5 дней) [3].
Проблема резистентности и возможности макролидов
Несмотря на это научными сообществами многих стран (США, Канада, Германия, Франция и др.) были разработаны рекомендации по эмпирической терапии ВВП, основу которых составили макролиды в монотерапии, в сочетании с беталактамами, тетрациклинами, фторхинолонами в зависимости от формы и тяжести заболевания (табл. 4) [10—12]. Все рекомендации включают макролиды как препараты первоочередного выбора при лечении ВВП у больных < 60 лет без сопутствующих заболеваний.
В настоящее время в большинстве регионов мира резистентность к макролидам сохраняется на низком уровне (обычно не превышает 25%). Следует отметить, что в большинстве случаев распространение устойчивости пневмококков к макролидам было связано с их неоправданно частым назначением, без достаточных показаний. Ограничение применения эритромицина лишь строгими показаниями сопровождается снижением уровня резистентности к применяемому препарату и к новым макролидам. Следует отметить, что по спектру действия и степени активности в отношении большинства видов микроорганизмов in vitro макролиды — природные и полусинтетические — отличаются мало. Различия в химиотера-певтической эффективности новых макролидов in vivo и в клинике обусловлены, в основном, особенностями фармакокинетики и связанными с нею фармакодинамическими показателями.
Фармакокинетика и фармакодинамика макролидов
Если оптимизация схем лечения эритромицином осуществляется на основе оценки времени (Т), в течение которого уровень концентрации антибиотика в крови превышает значение его МПК для выделенного патогена (т. е. Т > МПК), то такой подход неприемлем для азитромицина. Это обусловлено тем, что клиническая эффективность азитромицина определяется в основном соотношением площади под фармакокинетической кривой AUC и чувствительностью возбудителя к нему в значениях МПК антибиотика (т. е. AUC/МПК). В связи с низкими концентрациями азитромицина в крови (Стах 0,4—0,7 мг/л, в зависимости от дозы), показатель Т > МПК не может служить мерой измерения его эффективности in vivo (т. е. быть предиктором эффективности). Для кларитромицина оцениваемым показателем, как и в случае эритромицина, остается Т > МПК. Значения Сmax кларитромицина в зависимости от величины принимаемой дозы — 250 и 500 мг колебались от 0,6—1 мг/л до 2—3 мг/л соответственно, превышая значения МПК90 для основных возбудителей ВВП (S.pneumoniae, H.infleuenzae, M.catarrhalis) при условии двухкратного введения препарата в сутки (каждые 12 часов) [17, 18].
Сопоставление результатов клинической эффективности азитромицина с данными in vivo (при экспериментальных инфекциях) показывает, что они являются более значимыми, чем получаемые при определении чувствительности выделенного возбудителя in vitro. Наиболее важную роль при прогнозе эффективности азитромицина (в меньшей степени кларитромицина, рокситромицина) играет продолжительность экспозиции возбудителя с высокими внутриклеточными концентрациями антибиотика в очаге инфекции, в нейтрофилах, моноцитах периферической крови. Причем концентрации антибиотика в тканях значительно превышают значение его МПК90 практически для всех возбудителей ВВП в течение 8 дней и более после однократного приема внутрь в сутки в стандартном режиме дозирования [19].
Высокий уровень тканевого проникновения новых макролидов, особенно азитромицина, и длительное их пребывание в очаге инфекции позволяют оптимизировать режимы их применения на основе фармакодинамических показателей [20].
Тканевая и клеточная кинетика макролидов
Таблица 5.
Отличительные характеристики азалидов и макролидов [24]
15-членное кольцо содержит азот, кислород и углерод Двухосновное соединение
14 и 16-членные кольца содержат углерод и кислород Одноосновные соединения
Интенсивное внутриклеточное проникновение Пролонгированный период полувыведения (однократное введение в сутки)
Слабая или умеренная тканевая и клеточная пенетрация T1/2 средней продолжительности (2-кратное введение в сутки)
Грамположительные микроорганизмы и некоторые грамотрицательные аэробы Атипичные бактерии Анаэробы
Рис. 1.
Концентрация макролидов в сыворотке крови.
Здесь и на рис. 2, 3: — азитромицин (Az), — кларитромицин (Clar).
Рис. 2. Концентрация макролидов в гранулоцитах.
Рис. 3.
Концентрация макролидов в моноцитах.
В противоположность кларитромицину концентрация азитромицина в крови редко превышала средние значения его МПК даже в отношении чувствительных к антибиотику штаммов S.pneumoniae, что приводило к выводу о его недостаточной клинической эффективности при пневмококковой инфекции. Однако, в связи с определяющей ролью высоких клеточных концентраций новых макролидов в реализации клинического эффекта, становится понятным отсутствие корреляции между выявляемой резистентностью S.pneumoniae к макролидам in vitro и проявлением их клинической эффективности. Несмотря на низкие значения концентраций азитромицина в крови, обнаруживаемые после завершения введения, резистентность возбудителей к нему не развивается. Больной полностью излечивается клинически и бактериологически при полной эрадикации возбудителя благодаря бактерицидному действию высоких внутриклеточных концентраций антибиотика (рис. 1—3) [23].
В противоположность низким уровням азитромицина и умеренным кларитромицина в сыворотке крови, содержание их в гранулоцитах, моноцитах, лимфоцитах и фибробластах обнаруживается в концентрациях, многократно превышающих значения МПК антибиотиков для многих микроорганизмов.
Макролиды проникают и концентрируются в кислых органеллах фагоцитов, причем азитромицин в наиболее высоких концентрациях. Более высокие уровни азитромицина в клетках обусловлены особенностями его химической структуры — наличием в его 15-членном кольце, наряду с кислородом и углеродом, атома азота, отсутствующего в 14- и 16-членных макролидах (рис. 4). В результате модификации молекулы азитромицин ведет себя как двухосновное соединение в отличие от моноосновных макролидов (табл. 5) [13]. Для него характерна продолжительная задержка в клетках в высоких концентрациях в течение 7—10 и более дней после окончания лечения и пролонгированный Т1/2 (68 ч). Более высокие внутриклеточные концентрации азитромицина по сравнению с 14- и 16-членными макролидами обусловлены его прочной связью с кислыми органеллами клеток [24]. При этом клеточная кинетика имитирует подъемы и падение концентраций в крови перед каждым повторным введением, как это имеет место при лечении кларитромицином [25].
Рис. 4.
Структура макролидов.
Низкие концентрации современных азалидов, обнаруживаемые в сыворотке крови, являются причиной опасений неудач при лечении бактериемии. Однако все макролиды, особенно азитромицин, присутствуют в высоких концентрациях в очаге инфекции, в циркулярующих ПМЯЛ, которые фагоцитируют и освобождают организм от возбудителя при его контакте с высокими бактерицидными концентрациями антибиотика в клетке. Высокие концентрации азитромицина в ПМЯЛ обеспечивают его присутствие в них в высоких концентрациях в течение нескольких дней после завершения курса лечения [24]. С точки зрения активности азитромицина в очаге инфекции важными являются данные о зависимости накопления его от наличия воспаления в тканях. Сравнительное изучение интерстициальной жидкости очага воспаления на модели инфицированного или интактного блистеров у волонтеров показало, что концентрация азитромицина в инфицированном блистере значительно выше, чем в неинфицированном (рис. 5) [26]. Показано также, что концентрация азитромицина в ткани легких при воспалении в 5—10 раз выше, чем обнаруживаемая при биопсии здоровой легочной ткани в диагностических целях.
Рис. 5.
Значения AUC 0- 24 азитромицина в сыворотке крови и блистере при воспалении и его отсутствии.
В отсутствие воспаления — I, при воспалении — II.
Длительное сохранение в высоких концентрациях азитромицина внутриклеточно в воспаленных тканях важно с клинической точки зрения, поскольку позволяет оптимизировать его активность в очаге инфекции за счет максимальных показателей AUC/МПК и Т > МПК.
ПМЯЛ, другие клетки крови и тканей участвуют в клиренсе бактерий из очагов инфекции или крови. Лизосомы с накопленным в них антибиотиком и фагосомы с фагоцитированными бактериями формируют в клетке фаголизосомы, где происходит контакт возбудителя с очень высокими концентрациями препарата (см. рис. 2, 3). Здесь активность азитромицина максимальная не только в отношении чувствительных патогенов, но и умеренно чувствительных, МПК антибиотика для которых составляет 32 мг/л. Высокий пиковый уровень азитромицина в ПМЯЛ (> 80 мг/л), в моноцитах (100 мг/л) и длительное его сохранение (> 12 дней) на уровне 16— 32 мг/л обеспечивают быстрое освобождение клеток от возбудителей. В пределах этих концентраций возможна оптимизация режимов применения антибиотика по фармакодинамическим критериям AUC/МПК и Т > МПК.
Максимальные внутриклеточные концентрации кларитромицина значительно ниже, обнаруживаемых при приеме азитромицина, его пиковые концентрации составляют 20—25 мг/л, снижаясь до 5 мг/л перед повторным введением (через 8—12 ч). При значениях МПК этого антибиотика до 4—8 мг/л в отношении S.pneumoniae фармакодинамические показатели могут быть неблагоприятными и сопровождаться клиническими неудачами.
Анализ фармакодинамических критериев устойчивости к макролидам и азитромицину свидетельствует о наибольшем значении в реализации клинического эффекта концентраций этих антибиотиков в ПМЯЛ и других клетках. Ошибки и просчеты при лечении макролидами наблюдаются при низких внутриклеточных концентрациях таких препаратов, как эритромицин и другие природные макролиды, причем применение первого из них с наибольшей частотой сопровождается развитием резистентности. Наиболее благоприятными Ф/К и Ф/Д показателями характеризуется азитромицин, который обладает наилучшим внутриклеточным проникновением, наибольшим временем сохранения в клетке в высоких концентрациях, что обусловливает быстрый клиренс возбудителя из организма больного, и предупреждает развитие резистентности. То есть тканевая и клеточная направленность фармакокинетики макролидов и аза л ид ов является важным отличием их от других групп антибиотиков. Если для беталактамов основным параметром, определяющим их клиническую эффективность, является степень чувствительности бактерий к их действию (выраженная в значениях МПК), то для новых макролидов предиктором эффективности являются Ф/Д показатели: время (Т) и площадь под фармакокинетической кривой (AUC), превышающие значения МПК антибиотиков для выделенных возбудителей (Т > МПК и AUC/МПК). Простое определение степени превышения МПК в отношении возбудителя и сопоставление ее значения с концентрацией антибиотика в крови, как это имеет место для беталактамов и аминогликозидов, в случае макролидов является недостаточным. Для них необходимо рассчитывать Ф/Д критерии с учетом концентраций препаратов в иммунокомпетентных клетках, обнаруживаемых при стандартных режимах применения, позволяющие гарантировать клиническую эффективность или положительную клиническую динамику заболевания и эрадикацию возбудителя [25].
Выводы
2. Новые макролиды (особенно азитромицин) обладают улучшенными фармакокинетическими свойствами: пролонгированной фармакокинетикой (Т1/2 азитромицина, в зависимости от дозы, составляет 48—60 часов), способностью накапливаться и длительно задерживаться в иммунокомпетентных клетках в течение 8—12 суток после завершения 3—5-дневных курсов приема внутрь в стандартной дозе.
3. Тканевая и клеточная направленность кинетики, пролонгированное действие новых макролидов, возможность их эффективного применения короткими курсами без опасности развития серьезных побочных реакций обусловливают невысокий риск развития и распространения антибиотикоустойчивости.
4. Полусинтетические макролиды характеризуются высокой комплаентностью, улучшенными показателями стоимость эффективность (меньшая стоимость койко-дня, меньшие затраты на лекарственное и лабораторное обеспечение, на зарплату персонала и др.)
Макролиды оказывают бактериостатическое действие и преимущественно активны в отношении внутриклеточных возбудителей (хламидии, микоплазмы, легионеллы) и грамположительных кокков (кроме MRSA и энтерококков). В последние годы резко снизилась активность в отношении пневмококков и стрептококков, что необходимо учитывать при выборе ЛС для респираторных инфекций. Грамотрицательные микроорганизмы семейства Enterobacteriaceae, Р. aeruginosa и грамотрицательные анаэробы к макролидам природно резистентны. Из других грамотрицательных бактерий определенную чувствительность к макролидам проявляют моракселлы, бордетеллы, нейссерии, кампилобактеры и хеликобактеры. Практически важное значение имеет активность некоторых макролидов в отношении атипичных микобактерий и простейших (токсоплазм). Среди макролидов умеренной активностью против Н. influenzae in vitro обладают только азитромицин и кларитромицин.
Макролиды удовлетворительно всасываются при пероральном приеме (пища снижает биодоступность) и распределяются во многих тканях и секретах (плохо проникают через ГЭБ). Создают высокие тканевые и внутриклеточные концентрации. Метаболизируются в печени, выводятся в основном через ЖКТ. При почечной недостаточности коррекцию доз не проводят (исключение — кларитромицин).
Наиболее частые нежелательные реакции — диспептические явления. Аллергические реакции наблюдаются редко. При в/в введении может развиваться флебит. Эритромицин у новорожденных может способствовать развитию пилоростеноза.
Преимущества спирамицина, кларитромицина, азитромицина, рокситромицина, мидекамицина и джозамицина перед эритромицином: улучшенная фармакокинетика, переносимость и меньшая кратность применения. 16-членные макролиды (спирамицин, джозамицин и мидекамицин) в меньшей степени ингибируют изоферменты цитохрома Р450, не обладают прокинетическими свойствами и активны в отношении некоторых штаммов стрептококков и пневмококков, устойчивых к 14- и 15-членным макролидам.
Антибиотик группы макролидов. Продуцируется актиномицетами Streptomyces narbonensis var. josamyceticus. Хорошо растворим в метаноле и этаноле, растворим в эфире и очень слабо в воде.
Фармакологическое действие
Фармакология
Обратимо связывается с 50S субъединицей рибосом, тормозит синтез белка и размножение микробных клеток (бактериостатический эффект). При создании в очаге воспаления высоких концентраций оказывает бактерицидное действие. Обладает широким спектром действия, включающим грамположительные (Staphylococcus spp., продуцирующие и не продуцирующие пенициллиназу, Streptococcus spp., в т.ч. Streptococcus pyogenes и Streptococcus pneumoniae, Bacillus anthracis, Corynebacterium diphtheriae) и грамотрицательные (Neisseria gonorrhoeae, Neisseria meningitidis, некоторые виды Shigella, Haemophilus influenzae, Bordetella pertussis) бактерии, внутриклеточные микроорганизмы (Mycoplasma spp., в т.ч. Mycoplasma hominis, Mycoplasma pneumoniae, Chlamydia spp., в т.ч. Chlamydia trachomatis, Chlamydia pneumoniae, Ureaplasma urealyticum, Legionella pneumophila) и некоторые анаэробы (Peptococcus, Peptostreptococcus, Clostridium perfringens, Bacteroides fragillis). Незначительно влияет на энтеробактерии, поэтому мало изменяет естественную бактериальную флору ЖКТ . Эффективен при резистентности к эритромицину. Резистентность к джозамицину развивается реже, чем к другим антибиотикам из группы макролидов.
При введении беременным самкам мышей и крыс в период органогенеза в высокой дозе (3 г/кг) увеличивал показатели смертности и вызывал задержку роста плодов без признаков тератогенного действия.
После приема внутрь быстро и полностью всасывается из ЖКТ , прием пищи не влияет на биодоступность. Cmax в сыворотке достигается через 1–2 ч и составляет при однократной дозе 400 мг — 0,33 мг/л, 500 мг — 0,67–0,71 мг/л, 1000 мг — 2,4 мг/л, 1250 мг — (2,08±1,13) мг/л, 2000 мг — (5,79±2,47) мг/л. Связывание с белками плазмы — около 15%. Хорошо растворяется в жирах и мало ионизируется при обычных значениях рН крови и тканевых жидкостей, хорошо проникает через гистогематические барьеры в различные органы и ткани. Объем распределения — 300,56 л. Особенно высокие концентрации обнаруживаются в легких, миндалинах, слюне, поте и слезной жидкости. Концентрация в мокроте превышает концентрацию в плазме крови в 8–9 раз. Накапливается в костной ткани. Способен проникать и накапливаться в аденоидах, экссудате среднего уха, секрете околоносовых пазух, деснах, предстательной железе. Практически не проникает в спинно-мозговую жидкость, проходит через плаценту и секретируется в грудное молоко. Биотрансформируется в печени с образованием менее активных метаболитов. Обнаружено не менее трех метаболитов: 14-гидроксиджозамицин, гидроксиджозамицин и деизовалерилджозамицин. T1/2 — 4 ч. Экскретируется в основном с желчью, менее менее 20% — с мочой.
Применение вещества Джозамицин
Острые и хронические инфекции, вызванные чувствительными микроорганизмами — инфекции верхних дыхательных путей и лор-органов (ангина, фарингит, паратонзиллит, ларингит, средний отит, синусит, дифтерия — дополнительно к лечению дифтерийным анатоксином, скарлатина в случае повышенной чувствительности к пенициллину); инфекции нижних дыхательных путей (острый бронхит, обострение хронического бронхита, пневмония, в т.ч. вызванная атипичными возбудителями, коклюш, пситтакоз); стоматологические инфекции (гингивит и болезни пародонта); инфекции в офтальмологии (дакриоцистит, блефарит); инфекции кожных покровов и мягких тканей (пиодермия, фурункулез, сибирская язва, рожа — при повышенной чувствительности к пенициллину, угри, лимфангит, лимфаденит, венерическая лимфогранулема); инфекции мочеполовой системы (простатит, уретрит, гонорея, сифилис — при повышенной чувствительности к пенициллину, хламидийные, микоплазменные, в т.ч. уреаплазменные, и смешанные инфекции).
Противопоказания
Гиперчувствительность (в т.ч. к другим макролидам), тяжелые нарушения функции печени, недоношенность детей.
Применение при беременности и кормлении грудью
Разрешено применение при беременности и в период грудного вскармливания по показаниям. Европейское отделение ВОЗ рекомендует джозамицин в качестве препарата выбора при лечении хламидийной инфекции у беременных женщин.
Категория действия на плод по FDA — не определена.
Побочные действия вещества Джозамицин
Со стороны органов ЖКТ: отсутствие аппетита, тошнота, изжога, рвота, дисбактериоз и диарея, метеоризм, обложенность языка, спазмы в животе, нарушение функции печени, транзиторное повышение активности печеночных трансаминаз (АСТ, АЛТ), нарушение оттока желчи и желтуха.
Прочие: отек стоп, дозозависимое преходящее нарушение слуха, кандидоз, кожные аллергические реакции (крапивница, сыпь), очень редко — лихорадка, общее недомогание.
Взаимодействие
Передозировка
Симптомы: усиление выраженности побочных эффектов.
Лечение: симптоматическая терапия.
Способ применения и дозы
Внутрь, между приемами пищи. Покрытые оболочкой таблетки следует проглатывать целиком, запивая небольшим количеством воды. Диспергируемые таблетки можно принимать двумя способами: проглатывать целиком, запивая водой, или предварительно перед приемом разводить водой (не менее 20 мл), образовавшуюся суспензию тщательно перемешивать. Взрослым и детям старше 14 лет — 1–2 г/сут (в случае необходимости доза может быть увеличена до 3 г/сут) в 2–3 приема, начальная рекомендуемая доза — 1 г. Суточную дозу для детей устанавливают из расчета 40–50 мг/кг, разделенные на 3 приема.
В случае, если пропущен один прием, необходимо немедленно принять дозу препарата. Если пришло время приема следующей дозы, не надо принимать предыдущую дозу, не увеличивать и не удваивать дозу. Перерыв в лечении или преждевременное прекращение приема препарата уменьшают вероятность успеха лечения.
Обычно продолжительность лечения определяется врачом. В соответствии с рекомендациями ВОЗ по применению антибиотиков длительность лечения стрептококковых инфекций должна составлять не менее 10 дней.
Лечение обыкновенных и шаровидных угрей — по 500 мг 2 раза в сутки в течение 2–4 нед, далее — 500 мг 1 раз в сутки в течение 8 нед.
Меры предосторожности
При назначении джозамицина следует учитывать возможность перекрестной устойчивости к различным антибиотикам-макролидам (микроорганизмы, устойчивые к лечению родственными по химической структуре антибиотиками, могут также быть резистентны к джозамицину).
Во время терапии необходим мониторинг ЭКГ (особенно у больных, одновременно получающих дигоксин). С осторожностью под контролем функции почек следует назначать на фоне почечной недостаточности.
В случае стойкой тяжелой диареи следует иметь в виду возможность развития на фоне антибиотиков опасного для жизни псевдомембранозного колита.
Людям пожилого возраста назначают в меньших дозах и проводят лечение под контролем врача.
Читайте также:

