Малярия лихорадка западного нила
Обновлено: 22.04.2024
Рассмотрены этиология, пути передачи, патогенез и клинические признаки лихорадки Зика, методы диагностики, профилактики и контроля заболеваемости.
Aetiology, ways of transmission, pathogenesis and clinical signs of Zika virus were considered, as well as the methods of diagnostics, prevention and morbidity control.
Лихорадка Зика — быстро распространяющаяся острая зооантропонозная арбовирусная инфекционная болезнь с трансмиссивным механизмом передачи возбудителя. Распространена в странах тропического и субтропического пояса. В настоящее время заболевание мало изучено [1, 2].
Возбудителем заболевания является вирус Зика (англ. Zika virus, ZIKV), относящийся к арбовирусам семейства Flaviviridae рода Flavivirus [3]. Следует отметить, что флавивирусы являются возбудителями целого ряда инфекционных болезней: желтой лихорадки, лихорадки Денге, клещевого энцефалита, омской геморрагической лихорадки, энцефалита Повассан, японского энцефалита, энцефалита Сент-Луис, энцефалита Долины Муррея и лихорадки Западного Нила.
Структура вируса схожа со структурой других флавивирусов, имеет нуклеокапсид сферической формы диаметром около 50 нм с мембраной, являющейся гликопротеиновой оболочкой, поверхностные белки которой располагаются в иксоаэдрической симметрии. Внутри нуклеокапсида содержится одноцепочечная линейная РНК, содержащая 10 794 нуклеотида, кодирующая 3 419 аминокислот, составляющих белковые структуры вируса. Прикрепление вируса к цитоплазматическим клеточным мембранам и его проникновение внутрь клетки обусловлено наличием специального мембранного белка Е [4] (рис. 1).
.jpg)
Репликация вирусной РНК происходит на поверхности эндоплазматического ретикулума в цитоплазме клеток-мишеней. Для синтеза собственного полипротеина вирус использует белки зараженных им клеток хозяина. Далее в процессе репликации РНК в клеточную мРНК производится синтез собственных структурных и неструктурных нуклеопротеидов, сборка вирусной клетки и выход вируса посредством лизиса клетки хозяина.
Следует также отметить высокую способность флавивирусов к мутациям, обусловленным несовершенством механизма копирования генетической информации, что может приводить к изменению антигенных свойств и вирулентности вируса.
Впервые вирус был выделен от макак-резусов (лат. Macaca mulatta) 18 апреля 1947 г. в ходе работы по мониторингу за лесной формой желтой лихорадки в лесу Зика (Уганда), в рамках исследовательской программы Рокфеллера, откуда и берет начало название возбудителя. Двумя днями позже лихорадящие обезьяны были доставлены в лабораторию, где их сывороткой были заражены мыши. Через 10 дней у всех мышей были отмечены симптомы заболевания. В дальнейшем возбудитель был выделен из мозга зараженных животных. В 1948 г. вирус впервые выделен из организма самки комара рода Aedes aegipti, а в 1968 — из биоматериалов представителей коренного населения Нигерии. С 1951 по 1981 г. были зафиксированы спорадические случаи заболевания на территории Африки — в Уганде, Танзании, Египте, Центральной Африканской Республики, Сьерра Леоне, Габоне, Сенегале, а также в некоторых странах Азии, включая Индию, Малайзию, Филиппины, Таиланд, Вьетнам и Индонезию. В апреле 2007 г. на островах Яп на территории Федеральных Штатов Микронезии впервые была зафиксирована вспышка лихорадки Зика с лабораторно подтвержденными случаями заболевания (выделена РНК вируса Зика в биоматериалах от пациентов в острой фазе болезни). В 2013 г. вспышка на территории Французской Полинезии. В 2015 г. началось активное распространение вируса на территории Центральной и Южной Америки.
_575.jpg)
Источник возбудителя — больные люди, здоровые вирусоносители, обезьяны, зараженные вирусом. От человека к человеку и от животных вирус передается с укусами комаров рода Aedes (A. aegipti и А. albopictus), которые также являются переносчиками возбудителей лихорадки Денге, желтой лихорадки и чикунгуньи. Наибольшую эпидемическую опасность представляет комар A. aegipti, который распространен в тропических и субтропических районах, но не выживает при более низких температурах. А. albopictus также способен переносить вирус, но может впадать в состояние спячки и выживать в регионах с более низкой температурой. Комары инфицируются вирусом от зараженных людей и животных [5]. Не исключена возможность адаптации вируса к организму комаров других видов.
Для самок комаров A. aegipti и А. albopictus характерно прерывистое питание, вследствие чего они кусают нескольких человек за цикл питания. Через 3 дня после завершения цикла питания самка комара откладывает яйца, которые могут сохраняться до года при отсутствии воды. В водной среде яйца превращаются в личинки, а далее в половозрелые особи. Для цикла развития нужно очень небольшое количество воды. Комары вышеописанных видов могут пролетать расстояние не более 400 м, но часто неумышленно заносятся людьми, например в багажниках машины, с вещами, растениями, на большие расстояния. При возможности выживания и размножения в новом температурном климате комары могут приводить к распространению вируса в регионах, куда были завезены [5].
Основной механизм передачи возбудителя — трансмиссивный. В настоящий момент описаны случаи заражения половым путем и при переливании крови [6–8]. Также, по данным бразильских ученых, вирус проникает через гематоплацентарный барьер, вызывая внутриутробное инфицирование плода с последующим развитием тяжелой врожденной патологии [9–12].
Естественный резервуар вируса пока остается неизвестным [5].
Патогенез болезни на данный момент также мало изучен. В ходе недавних исследований было доказано, что в первую очередь вирус поражает дермальные фибробласты, кератиноциты эпидермиса, незрелые дендритные клетки в месте внедрения, затем достигает лимфатических узлов с последующим гематогенным распространением. За адгезию и проникновение вируса внутрь клеток-мишеней отвечает фосфатидилсериновый рецептор AXL, находящийся на поверхности иммунных клеток кожи. В этих клетках были обнаружены пораженные ядра в месте предполагаемого внедрения вируса. Повышение репликации вируса вызывает в клетках продукцию интерферона I типа и аутофагосом. Доказана высокая чувствительность вируса к интерферонам I и II типа. На протяжении болезни отмечается стойкое повышение активности Т-клеток (в основном Th1, Th2, Th9 и Th17) выражающееся в увеличении уровня соответствующих цитокинов с четким возрастанием к периоду реконвалесценции [1, 13, 14].
Манифестация заболевания, по данным Всемирной организации здравоохранения, происходит в 1 из 5 случаев заражения, что характерно и для других флавивирусных инфекций.
Инкубационный период заболевания неизвестен. По некоторым данным составляет от 2 до 7 дней, по другим — может длиться до двух месяцев (в связи с чем в США введен запрет на донорство в течение двух месяцев для всех вернувшихся из эндемичных районов).
Клиническая картина заболевания многообразна, сходна с таковой при лихорадке Денге и чикунгунья. Длительность болезни составляет от 2 до 7 суток. Чаще заболевание начинается с появления лихорадки, хотя в некоторых случаях может протекать на фоне нормотермии. Характерны головная боль, боли в мышцах и суставах, конъюнктивит. Обычно на 2–3 день болезни на коже туловища, шеи, верхних и нижних конечностей (иногда включая ладони и стопы) появляется пятнисто-папулезная сыпь (рис. 3). Часто отмечается развитие конъюнктивита. В редких случаях заболевание может сопровождаться головокружением, рвотой, диареей, болями в животе. В целом заболевание протекает доброкачественно и, в отличие от лихорадки Денге, развитие геморрагического синдрома не отмечается [1, 4, 6, 11, 15]. Известны случаи проявления заболевания изолированным конъюнктивитом. Имеются данные, что особую опасность заражение представляет для беременных женщин в первом триместре беременности, что обусловлено проникновением вируса через гематоплацентарный барьер с последующим развитием внутриутробной инфекции, приводящей к серьезной патологии развития плода (микроцефалия) [9–12]. В 2015 г. описан случай заражения беременной женщины в конце первого триместра беременности. На момент перенесения заболевания, сопровождавшегося лихорадкой и сыпью, женщина проживала на территории Бразилии. На 29?й неделе беременности ультразвуковым методом была выявлена микроцефалия плода. После экстренного искусственного родоразрешения пациентки была проведена аутопсия плода, подтвердившая наличие микроцефалии с компонентами гидроцефалии, агирии и наличием очагов мультифокального воспаления, петрификатов. В веществе головного мозга плода методом полимеразной цепной реакции (ПЦР) и электронной микроскопии был обнаружен вирус Зика. Существуют данные связи лихорадки Зика с развитием синдрома Гийена–Барре, а также различных аутоиммунных реакций [1, 4, 16].
.jpg)
В настоящее время нет никаких свидетельств того, что вирус Зика у переболевших женщин представляет опасность инфицирования плода при будущих беременностях. Вирус Зика обычно остается в крови инфицированного человека в течение приблизительно недели [12].
Ввиду легкого течения заболевания специфического лечения не требуется. Рекомендуется соблюдение постельного режима, применение любых доступных нестероидных противовоспалительных средств. С целью дезинтоксикации рекомендовано обильное питье. В случае усугубления симптомов — обращение за медицинской помощью. Особое внимание следует уделять беременным пациенткам [2, 5].
В связи с клиническим сходством с другими тропическими лихорадками клиническая диагностика малоинформативна.
Для лабораторной диагностики лихорадки Зика методом выбора является ПЦР и выделение вируса из образцов крови. Серологическая диагностика малоинформативна в силу перекрестных реакций с другими флавивирусами, такими как вирус лихорадки Денге, вирус Западного Нила и вирус желтой лихорадки [2, 5, 6].
Профилактика и контроль заболеваемости заключается в сокращении численности комаров путем преобразования и/или уничтожения мест их размножения, снижении вероятности их контакта с населением путем использования репеллентов, москитных сеток на дверях и окнах, противомоскитного полога для сна. Следует помнить, что для размножения комарам рода Aedes требуется очень малое количество воды, поэтому нужно опорожнять сельскохозяиственные резервуары с водой (ведра, бочки, горшки для растений и т. д.). Также большую роль играет санпросветработа с населением. Особую осторожность следует соблюдать при поездках в эндемичные по заболеванию районы: использовать средства индивидуальной защиты (репелленты, закрытую форму одежды), а также избегать мест распространения комаров [2, 3, 5].
В США предостерегают от половых контактов лиц, вернувшихся их эндемичных районов по лихорадке Зика: совсем воздержаться при наличии беременной партнерши и соблюдать осторожность во всех остальных случаях [17].
Всемирная организация здравоохранения оказывает помощь странам в осуществлении контроля над болезнью, вызванной вирусом Зика, следующим образом:
- сделать приоритетными научные исследования в области болезни, вызванной вирусом Зика, путем созыва экспертов и партнеров;
- усилить эпиднадзор за вирусом Зика и потенциальными осложнениями;
- усилить потенциал для передачи информации о риске распространения в целях содействия странам в выполнении их обязательств по Международным медико-санитарным правилам;
- обеспечить специальную подготовку в области клинического ведения, диагностики и борьбы с переносчиками, в том числе с помощью ряда сотрудничающих центров Всемирной организации здравоохранения;
- усилить потенциал лабораторий для выявления вируса;
- поддерживать органы здравоохранения в осуществлении стратегии борьбы с переносчиками, ориентированной на уменьшение популяций комаров Aedes, таких как предоставление ларвицидов для обработки стоячей воды в местах, которые не могут быть обработаны иным образом, то есть путем мытья, опорожнения, накрывания;
- подготовить рекомендации в отношении клинической помощи и последующего наблюдения за людьми, инфицированными вирусом Зика, в сотрудничестве с экспертами и другими организациями здравоохранения [2, 5, 18, 19].
Пациентка находится в боксированном отделении инфекционной больницы в удовлетворительном состоянии. У обследованных контактных членов семьи результаты исследований на вирус Зика отрицательные.
Перед развитием заболевания больная вернулась из туристической поездки в Республику Доминиканы. Через несколько дней после возвращения было зафиксировано ухудшение самочувствия, появление лихорадки, сыпи.
Пациентка была незамедлительно госпитализирована с рекомендацией обследования на геморрагические лихорадки. По результатам лабораторного исследования отечественной тест-системой в биологических жидкостях заболевшей выявлена РНК вируса Зика.
На борту рейса, на котором прибыла больная, проведен комплекс противоэпидемических мероприятий, опасность для прилетевших этим рейсом отсутствует.
С начала 2016 г. Роспотребнадзором начат еженедельный мониторинг лиц, прибывающих из стран, неблагополучных по трансмиссивным лихорадкам. На 15 февраля 2016 г. в аэропортах и морских пунктах пропуска, принимающих рейсы из стран Южной и Центральной Америки и Карибского бассейна, Бразилии, Юго-Восточной Азии и Океании и Африки, досмотрено более 50 тысяч лиц на наличие признаков инфекционных заболеваний.
Роспотребнадзор также сообщает, что в климатических условиях Российской Федерации риска распространения лихорадки Зика нет. Также обращено внимание на планирование отдыха в странах тропического и субтропического регионов: предпочтительно выбирать страны, благополучные в эпидемиологическом отношении.
При появлении одного или нескольких симптомов заболевания (жар, сыпь, конъюнктивит, боли в мышцах и суставах, озноб, общая слабость) в течение 2–3 недель после возвращения из стран, эндемичных по вирусу Зика, необходимо незамедлительно обратиться к врачу.
Литература
Ю. Я. Венгеров, доктор медицинских наук, профессор
О. В. Парфенова 1
ГБОУ ВПО МГМСУ им. А. И. Евдокимова МЗ РФ, Москва
Лихорадка долины Рифт – это острая арбовирусная инфекция. Основными симптомами заболевания являются поражения центральной нервной системы, глаз и печени, разнообразные геморрагические проявления. Болезнь сопровождается выраженной интоксикацией и лихорадкой. Основу диагностики составляют методы выделения вируса из биологических субстратов больного и обнаружение антител к возбудителю в крови пациента. Лечение патогенетическое и симптоматическое, направленное на облегчение течения патологии, коррекцию нарушенных висцеральных функций. Этиотропные средства не разработаны.
МКБ-10
Общие сведения

Причины
Возбудитель заболевания – одноименный вирус. Резервуарами и источниками инфекции служат дикие и домашние животные: слоны, носороги, летучие мыши, газели, коровы, козы, овцы, буйволы, верблюды. Передача вируса осуществляется при контакте с биологическим материалом – в процессе разделывания туш, приготовления пищи, ухода за животными. Описано аэрогенное инфицирование при работе с вирусом в лабораториях. Прямая передача от человека к человеку не доказана. Трансмиссивный путь передачи реализуется комарами, некоторыми кровососущими мухами.
Основные факторы риска – детский возраст, проживание в сельской местности. Наиболее часто инфицируются фермеры, ветеринары и пастухи, лица, трудящиеся на скотобойнях и мясоперерабатывающих заводах. Опасность представляют территории с обширными ирригационными системами, являющимися местами выплода комаров. При крупных вспышках характерно появление новых вторичных очагов болезни, связанных с перемещением скота, пассивной миграцией переносчиков. Доказана трансовариальная передача вируса среди комаров рода Aedes.
Патогенез
После проникновения через поврежденные кожные покровы и слизистые либо укуса комара вирус попадает в регионарные лимфатические узлы, где активно размножается и накапливается. Распространение гематогенным путем приводит к поражению органов и тканей, возникают мононуклеарные инфильтраты, фокальные некрозы, обусловленные как прямым воздействием вируса, так и особенностями иммунологического ответа организма. Отмечается связь между повышением уровня IL-8, IP-10, IL-10 и летальным исходом; цитокиновая дисрегуляция является предиктором тяжелого течения.
Наибольший тропизм возбудитель проявляет к ткани печени, почечным клубочкам, эпителиоцитам почечных канальцев; именно для печени и почек характерны выраженные дистрофические и некротические преобразования. Эндотелиоциты также являются вирусной мишенью. Патоморфологические изменения, приводящие к истончению сосудистой стенки, усиленному проникновению сквозь нее жидкости и клеток крови, обусловлены иммунопатологическими процессами. Выраженные васкулиты в зоне сетчатки практически всегда приводят к угрозе отслойки и слепоте.
Классификация
Современные инфекционисты выделяют субклиническое, легкое, среднетяжелое и тяжелое течение болезни. Частота встречаемости тяжелых форм составляет не более 1%. Лихорадку долины Рифт также классифицируют в зависимости от поражаемого органа. Для данной инфекции характерно вовлечение головного мозга и его оболочек, а также печени, глаз и системы гемостаза.
- Глазная форма. Встречается у 0,5-2% больных, как изолированное состояние смертельных исходов не вызывает. Основные симптомы связаны со снижением остроты и качества зрения. Описаны случаи спонтанного выздоровления через 10-12 недель.
- Менингоэнцефалитическая форма. Страдает около 1% пациентов. Дебют происходит не ранее 4-й недели болезни. Несмотря на тяжесть течения, летальность низкая. Опасность представляют остаточные неврологические симптомы, появляющиеся через 2 и более месяца после острого периода.
- Геморрагическая форма. Развивается через несколько дней от начала болезни. В патогенезе – печеночный некроз, дефицит факторов свертывания, ДВС-синдром. Смерть наступает у 50% пациентов с данной формой, обычно – в течение 3-6 дней.
Симптомы лихорадки долины Рифт
Инкубационный период составляет 3-6 суток. Начало болезни острое на фоне нормального самочувствия. Возникает выраженный озноб, мышечные и суставные боли, слабость. Движения глазными яблоками болезненны, отмечается светобоязнь, покраснение лица и склер, гипертермия более 39° C. Встречается кратковременное снижение температуры тела практически до нормальных значений, через 1-2 суток вновь наступает период гиперпирексии. В большинстве случаев иных симптомов не наблюдается, в течение недели наступает полное выздоровление.
Тяжелая геморрагическая форма лихорадки дебютирует после 2-4 дня болезни с возникновения желтухи и точечных кровоизлияний. В дальнейшем развиваются профузные желудочно-кишечные, маточные и другие кровотечения. Пациенты могут предъявлять жалобы на прогрессирующие снижение, нечеткость зрения на 7-14 сутки инфекции. На 7-30-й день заболевания возможно поражение головного мозга, сопровождающееся головокружениями, спутанностью сознания, галлюцинациями, сильными головными болями с рвотой на высоте приступа, не купирующимися анальгетиками.
Осложнения
К наиболее частым осложнениям относят последствия патологических процессов в печени. Арбовирус способен вызывать полный гепатонекроз, особенно у детей. У взрослых поражения печени приводят к дефициту факторов свертывания, кровотечениям, токсической энцефалопатии. Сосудистые вирусные инвазии усугубляют течение геморрагического синдрома. Васкулит, окклюзия сосудов вблизи макулы в половине случаев являются причиной отека желтого пятна и необратимой слепоты. Неврологические последствия энцефалита (параличи, парезы) могут сохраняться пожизненно.
Диагностика
В современной клинической инфектологии верификация диагноза осуществляется на основании консультации профильного специалиста, в некоторых случаях – офтальмолога и других врачей. Необходимо строгое соблюдение правил транспортировки и исследований образцов, полученных от больного – работать с ними разрешается только в лаборатории особо опасных инфекций. Основными диагностическими исследованиями являются:
- Физикальный осмотр. Изменения часто отсутствуют. Можно обнаружить желтушность склер и кожи, геморрагическую сыпь (петехии, пурпуры, экхимозы), неврологические изменения: ригидность затылочных мышц, менингеальные знаки. Требуется активно выявлять зрительные нарушения, эпизоды десневых и носовых кровотечений.
- Осмотр глазного дна.Офтальмоскопия показана всем больным с подозрением на лихорадку долины Рифт, особенно при наличии ухудшения зрения. При глазной форме острота зрения снижена, во время периметрии возможно обнаружение скотом. На глазном дне определяется отек желтого пятна, кровоизлияния в стекловидное тело, сетчатку, признаки васкулита.
- Лабораторные исследования. Общеклинический анализ крови характеризуется лейкоцитозом, сменяющимся лейкопенией и тромбоцитопенией. Наблюдается повышение активности биохимических показателей: АЛТ, АСТ, общего и прямого билирубина, мочевины, креатинина. В общем анализе мочи – микрогематурия, цилиндрурия. В ликворограмме – умеренный лимфоцитарный цитоз.
- Выявление инфекционных агентов. Изоляция вируса в клеточной культуре – сложный и дорогостоящий способ. Выделение возбудителя лихорадки из крови больного производится методом ПЦР с обратной транскрипцией. Серологическая диагностика проводится с помощью ИФА, позволяет ретроспективно установить диагноз, применяется в эндемичных районах при эпидемиологических исследованиях.
- Инструментальные методики. Рентгенография ОГК назначается в ходе дифференциальной диагностики. Рекомендовано УЗИ органов брюшной полости, забрюшинного пространства, орбит, глазных яблок. Для исключения сосудистых очаговых и опухолевых поражений осуществляется ЭЭГ, КТ, МРТ головного мозга, отделов зрительного аппарата с контрастным усилением.
Лечение лихорадки долины Рифт
Пациенты с лихорадкой Рифт-Валли должны лечиться в стационаре. Постельный режим показан в период повышения температуры тела до ее нормализации в течение 4-5 суток и в случае развития осложнений. Диетические рекомендации заключаются в щадящем режиме питания с исключением трудноперевариваемой пищи, алкоголя. Водная нагрузка при отсутствии противопоказаний должна быть увеличена.
Консервативная терапия
Этиотропное лечение не разработано. Большое значение придается дезинтоксикационной и противовоспалительной терапии, использование ацетилсалицилатов и их аналогов не рекомендуется. Проводится коррекция печеночно-клеточной недостаточности, воспалительных изменений вещества головного мозга, тромбогеморрагического синдрома. По показаниям осуществляются инфузии тромбомассы, свежезамороженной плазмы и раствора альбумина. Симптоматические средства назначаются с учетом возникающих проявлений, имеющихся осложнений.
Экспериментальное лечение
Кандидатом на роль препарата, активного в отношении вируса Рифт-Валли является сорафениб. Средство первоначально было разработано для лечения почечно-клеточной и гепатоцеллюлярной карцином. Исследования in vitro показали эффективность сорафениба как ингибитора синтеза вирусной РНК, а также как медикамента, препятствующего выходу вирионов из клетки. Воздействие на вирусную репликацию в основном протекает путем ингибирования белков теплового шока, необходимых для образования новых копий возбудителя.
Прогноз и профилактика
Прогноз при типичном течении благоприятный. Летальность с учетом формы колеблется от 0,25% до 50%, большая часть смертей приходится на детский возраст. Продолжительность болезни при отсутствии осложнений обычно не превышает 4-7 дней. Необходимо помнить о доказанной особенности эпидемиологии вируса долины Рифт – при укусе комаров рода Culex, пораженных филярией Wuchereria bancrofti, передача возбудителя Рифт-Валли протекает легче. При этом остается высокая вероятность инвазии гельминтом и, как следствие, сочетанного заболевания вухерериозом.
Разработаны убитые, векторные и рекомбинантные вакцины для ветеринарной практики. С 60-х годов ХХ века инактивированные культуры вируса используются для специфической профилактики у групп риска. Неспецифические меры предотвращения болезни включают борьбу с переносчиками в формате осушения болот и применения инсектицидов, а также своевременную изоляцию больных людей, строгий ветеринарный контроль в животноводстве. Необходимо избегать употребления в пищу сырого молока, плохо термически обработанного мяса, субпродуктов.
2. Sorafenib Impedes Rift Valley Fever Virus Egress by Inhibiting Valosin-Containing Protein Function in the Cellular Secretory Pathway/Ashwini Brahms, Rajini Mudhasani, Chelsea Pinkham// J Virol. - 2017 - №21.
Лихорадка Западного Нила – это острое инфекционное вирусное заболевание с преимущественно трансмиссивным заражением человека. Специфическими симптомами являются поражение центральной нервной системы, сосудов, слизистых оболочек. Характерны цефалгии, длительная лихорадка с потрясающими ознобами, выраженные мышечные боли, артралгии. Диагностика предусматривает обнаружение возбудителя и антител к нему в крови и ликворе больного. Специфическое этиотропное лечение не разработано, проводится симптоматическая терапия (жаропонижающие средства, инфузионная, оральная дезинтоксикация, вазопротекторы и др.).
МКБ-10
Общие сведения
Лихорадка Западного Нила является патологией с частым бессимптомным течением и воспалительным поражением оболочек головного мозга. Реже сопровождается менингоэнцефалитом. Открытие вируса и описание болезни датируются 1937 годом, стали результатом исследования в Уганде. Сезонность заболевания обусловлена временем выплода переносчиков (комаров и клещей), который приходится на конец июля – октябрь. Гендерные особенности отсутствуют. Отмечается тенденция к большей восприимчивости у детей в эндемичных районах (Северо-Восточная Африка, Азия, Израиль, Египет), у взрослых – на территориях с низкой распространенностью (южные регионы России, Украина, Европа, США).

Причины
Возбудителем является РНК-содержащий одноименный флавивирус. Выделяют 7 видов вируса, наиболее распространен первый генотип. Источниками и резервуарами инфекции в природе служат птицы (врановые, воробьиные), реже – млекопитающие (грызуны, непарнокопытные). Переносчиками возбудителя становятся кровососущие комары рода Culex, Aedes, иксодовые и аргасовые клещи. В организме переносчика (обычно – комара) вирус поражает нервную систему и слюнные железы, поэтому при укусе передается вместе со слюной. Гораздо реже встречается гемоконтактный путь передачи лихорадки, связанный с переливанием зараженной крови, трансплантацией органов зараженного донора, работой с культурой вируса в исследовательских лабораториях, грудным вскармливанием, совместным использованием нестерильных шприцов для внутривенного введения наркотиков, разделкой туш умерших животных.
В группу риска по заболеванию (особенно развитию менингита) входят пациенты с делецией в гене CCR5, лица старше 60 лет, больные сахарным диабетом, артериальной гипертензией, хроническим вирусным гепатитом С, почечной, сердечно-сосудистой патологией, ВИЧ-инфекцией, проходящие курс химиотерапии по поводу злокачественных новообразований, злоупотребляющие алкоголем, реципиенты донорских органов. К потенциально подверженным заражению профессиям можно отнести медицинских работников, лаборантов, ветеринаров, служащих скотобоен, егерей, фермеров. Возбудитель погибает при кипячении, воздействии обычных доз дезинфицирующих веществ.
Патогенез
После проникновения вируса в организм во время укуса комара возбудитель поражает дендритные клетки кожи, попадая с ними в лимфатические узлы. При последующей виремии флавивирус диссеминирует в паренхиматозные органы (в том числе почки и селезенку). После 6 дня от момента заражения инфекционный агент исчезает из периферической крови и аксональным путем проникает через гематоэнцефалический барьер в нервную ткань головного мозга. Данное явление наблюдается не всегда, при нормальном состоянии иммунной системы виремия купируется без поражения ЦНС. Возбудитель инфицирует нейроны, запуская процессы апоптоза, в результате формируются участки некроза. Размножение и накопление вируса происходит преимущественно в гиппокампе, стволе и мозжечке, передних рогах мотонейронов спинного мозга.
Установлено, что мутации гена CCR5 CD8 + -лимфоцитов приводят к замедленной миграции лейкоцитов в пораженные участки ЦНС, поскольку их направленное движение регулируется данным хемокиновым рецептором. В нейронах, лишенных рецепторов к интерферону-альфа и бета (белкам противовирусной защиты), практически сразу после интракраниального проникновения вируса запускается апоптоз. Эти факторы в экспериментах на мышах приводили к повышению вероятности летального исхода. Вирус проявляет тропность к эндотелию сосудов, может персистировать в организме 1-2 месяца и более.
Классификация
Клиническая систематизация подразумевает деление на группы с учетом наличия тех или иных проявлений лихорадки. Возможно трехволновое течение заболевания с последовательным преобладанием поражения головного мозга и сердца, воспалительных явлений в области респираторного тракта. Считается, что на долю нейроинвазивных форм приходится до 50% клинически выраженных случаев инфекции. Практическое значение с учетом необходимости проведения лечебных мероприятий имеет классификация, включающая две формы:
- Бессимптомная. По данным ВОЗ, в 80% случаев патология протекает без каких-либо проявлений, может быть выявлена только ретроспективно при наличии антител к определенному штамму возбудителя.
- Манифестная. Подразделяется на лихорадку Западного Нила с вовлечением ЦНС (менингит, менингоэнцефалит) и гриппоподобную форму. Среди иммунокомпетентных лиц преобладает последняя. Нейроинвазивные симптомы могут включать хориоретинит, окклюзивный васкулит и неврит глазного нерва.
Симптомы
Для нейроинвазивной формы лихорадки характерно нарастание температуры и головной боли, фонтанирующая рвота на пике болевых ощущений, не приносящая облегчения, усугубляющиеся нарушения сознания, повышенная сонливость или, напротив, возбуждение, фото- и фонофобия, судороги, затруднение контакта с больным, прогрессирующая мышечная слабость (до полного отсутствия произвольных движений при сохраненной чувствительности), поперхивание жидкой пищей, асимметрия глазных щелей, двоение в глазах. Сыпь и катаральные явления при данной форме почти всегда отсутствуют.
Осложнения
Наиболее частыми причинами осложнений являются коморбидная патология и позднее обращение за медицинской помощью. Основными угрожающими состояниями, развивающимися при лихорадке, считаются отек и набухание головного мозга, церебральные кровоизлияния, острая сердечно-сосудистая недостаточность, гипостатическая пневмония и другие вторичные бактериальные гнойные осложнения. Активная репликация вируса в стволе головного мозга может приводить к острой дыхательной недостаточности, остановке сердечной деятельности, неконтролируемой гиперпирексии. После перенесенного заболевания могут наблюдаться атаксические явления.
Диагностика
Требуется консультация инфекциониста. При наличии симптомов поражения ЦНС показан осмотр невролога, при высыпаниях – дерматовенеролога. Существенную роль в диагностике играет сбор эпидемиологического анамнеза с обязательным уточнением эпизодов посещения эндемичных зон России и мира. Методы лабораторно-инструментальной диагностики данной лихорадки включают:
- Объективный осмотр. Физикально определяется гиперемия кожных покровов, сыпь, инъекция сосудов склер, увеличение лимфоузлов, печени и селезёнки, зернистость зева. Может выявляться снижение остроты зрения, артериальная гипотензия, глухость сердечных тонов, менингеальные симптомы (ригидность затылочных мышц, симптомы Кернига, Брудзинского), рассеянная неврологическая симптоматика (снижение сухожильных рефлексов, горизонтальный нистагм, хоботковый рефлекс и пр.). При наличии очаговых симптомов и признаков раздражения мозговых оболочек показано проведение люмбальной пункции с макроскопической оценкой прозрачности, цвета ликвора, скорости его вытекания.
- Лабораторные исследования. Примерно в 30% случаев в анализе крови обнаруживается лейкопения, реже лимфопения, тромбоцитопения. Биохимические показатели обычно соответствуют норме, возможно незначительное повышение активности АСТ, АЛТ, креатинина, мочевины. При исследовании ликвора спинномозговая жидкость прозрачная, бесцветная, отмечается выраженный лимфоцитарный плеоцитоз, незначительное увеличение содержания белка. Уровень глюкозы, хлоридов остается в пределах нормы. В анализе мочи специфические изменения отсутствуют, при длительной лихорадке возможно нахождение следовых количеств белка.
- Выявление инфекционных агентов. Выделение вируса из крови методом ПЦР возможно уже на 4-9 сутки от начала болезни. В спинномозговой жидкости антитела к антигенам возбудителя определяют с помощью ИФА. Метод ПЦР для поиска вируса в ликворе применяется реже из-за низкой чувствительности, высокой специфичности. Существует возможность ПЦР-определения возбудителя в моче. ИФА для серологической диагностики значим только при контроле парных сывороток на 1-8 и 14-21 день заболевания и одномоментном исследовании на антитела к другим флавивирусам (во избежание перекрестных реакций). Для установления штамма вируса применяется секвенирование генома, при исследовании секционного материала назначаются иммуногистохимические анализы.
- Лучевые методы, ЭКГ, ЭЭГ. Для дифференциальной диагностики выполняется рентгенография легких, компьютерная, магнитно-резонансная томография головного мозга с контрастированием, при необходимости – ПЭТ-КТ. На ЭКГ могут выявляться признаки гипоксии миокарда, снижения атриовентрикулярной проводимости. При проведении ЭЭГ в 50-80% случаев отмечается снижение активности пораженных участков мозга. УЗИ брюшной полости позволяет определить увеличение размеров селезенки, печени; обязательным является осмотр лимфоузлов, щитовидной железы, забрюшинного пространства и малого таза.
Дифференциальная диагностика
Дифференциальную диагностику осуществляют с обширным кругом болезней:
- общими инфекциями: листериозом, ОРВИ, гриппом, туберкулезом, лептоспирозом, орнитозом, герпетической инфекцией, энтеровирусной инфекцией;
- другими геморрагическими лихорадками (желтая, Ласса, Эбола, чикунгунья, Марбурга, Рифт-Валли, крымская, ГЛПС),
- сепсисом;
- поражением головного мозга: клещевым энцефалитом, церебральным токсоплазмозом, ВИЧ-энцефалитом, менингококковой инфекцией,острым лимфоцитарным хориоменингитом, японским энцефалитом;
- сифилисом;
- прионными болезнями.
Возможными причинами подобного симптомокомплекса могут служить онкологические заболевания крови, дебют диффузных болезней соединительной ткани, тиреотоксикоз, травмы головы, геморрагические инсульты, инфаркты головного мозга, злокачественные новообразования ЦНС.
Лечение лихорадки Западного Нила
Всем пациентам с подозрением на данное заболевание показана госпитализация. При прогрессировании неврологической симптоматики лечение проводится в реанимационном отделении либо в палате интенсивной терапии. Необходим строгий постельный режим до устойчивого исчезновения лихорадки в течение 3-4 дней, купирования острых неврологических симптомов и появления возможности самостоятельного передвижения в пределах палаты. Диета не разработана, рекомендовано употреблять легкие питательные блюда, принимать достаточное количество жидкости. При угрозе отека мозга водный режим ограничивается и тщательно контролируется.
Специфического метода лечения лихорадки не существует. В некоторых исследованиях хорошо зарекомендовало себя применение препаратов альфа-интерферона, вируснейтрализующих моноклональных антител. Рибавирин для терапии инфекции не рекомендован, поскольку при вспышке в Израиле было установлено, что смертность пациентов с поражением ЦНС в группе лиц, получавших рибавирин, оказалась выше, чем среди остальных. Назначается симптоматическая терапия. Используются жаропонижающие (парацетамол, целекоксиб), вазопротекторы (рутозид), седативные (барбитураты, диазепам), мочегонные (фуросемид) препараты, осуществляется инфузионная дезинтоксикация (глюкозо-солевые, сукцинатсодержащие растворы).
Прогноз и профилактика
Своевременное обращение и лечение снижает риски осложнений и способствует полному выздоровлению в течение 10 дней. При наличии неврологических поражений срок реконвалесценции увеличивается до 30 и более дней. Летальность при нейроинвазивной лихорадке Западного Нила достигает 20%, обычно связана с параличом дыхательной мускулатуры. Описаны длительные (свыше 1 года) депрессивные эпизоды у 33% пациентов, перенесших заболевание. Период сохранения астеновегетативных проявлений в среднем составляет 36 недель, неврологических симптомов – более 8 месяцев.
Специфическая профилактика для людей не разработана, существует лишь эффективный препарат для вакцинации лошадей. Одной из причин отсутствия человеческой вакцины является высокая изменчивость вируса; в настоящее время проходят клинические испытания живые аттенуированные и рекомбинантные субстанции, а также ДНК-вакцина. К методам неспецифической профилактики болезни относятся своевременное выявление и изоляция больных, ветеринарный контроль над популяциями диких птиц и домашних животных, борьба с комарами (дезинсекция, противомоскитные сетки, спецодежда, репелленты).
1. Лихорадка Западного Нила (клиника, эпидемиология, диагностика, патоморфология и лечение): Автореферат диссертации/ Петров В.А. - 2004.
2. Клинико-эпидемиологические аспекты и вопросы лечения лихорадки Западного Нила/ Е.А. Иоанниди, В.Г. Божко, В.П. Смелянский, Е.Т. Божко. - Лекарственный вестник. - 2015 - Т.9, №3(59).
3. Диагностика и лечение лихорадки Западного Нила: метод. рекомендации для студентов медицинских ВУЗов / Н.И. Мамедова, Ю.М. Амбалов. – 2013.
4. Геморрагические лихорадки у туристов и мигрантов (медицина путешествий). Ч.4/ под ред. Ю.В. Лобзина. - 2015.
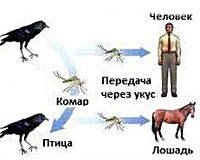
Вирус Западного Нила (ВЗН) может приводить к развитию неврологической болезни и смерти людей. ВЗН обычно встречается в Африке, Европе, на Ближнем Востоке, в Северной Америке и Западной Азии. В природе ВЗН поддерживается благодаря циклу, включающему передачу вируса между птицами и комарами. Приобретать инфекцию могут люди, лошади и другие млекопитающие.
Вирус Западного Нила (ВЗН) из рода flavivirus принадлежит антигенному комплексу японского энцефалита семейства Flaviviridae.
Вспышки болезни
Вирус Западного Нила был впервые изолирован у женщины в районе Западного Нила в Уганде в 1937 году. В 1953 г. он был выявлен у птиц (ворон и голубеобразных) в районе дельты Нила. До 1997 г. ВЗН не рассматривался в качестве патогенного для птиц. В то время в Израиле к смерти разных видов птиц, у которых были признаки энцефалита и паралича, приводил более вирулентный штамм. Инфекции людей, обусловленные ВЗН, регистрируются во многих странах мира на протяжении более чем 50 лет.
В 1999 г. ВЗН, циркулирующий в Тунисе и Израиле, был ввезен в Нью-Йорк, где привел к крупной и драматической вспышке болезни, которая в последующие годы распространилась на континентальной территории Соединенных Штатов Америки (США). Вспышка ВЗН в США (1999-2010 гг.) показала, что ввоз и закрепление трансмиссивных патогенных микроорганизмов за пределами их нынешней среды обитания представляют серьезную опасность для мира.
Самые крупные вспышки болезни происходили в Израиле, Греции, Румынии, России и США. Через места вспышек пролегают крупные миграционные пути птиц. Первоначально ВЗН был распространен в Африке, некоторых частях Европы, на Ближнем Востоке, в Западной Азии и Австралии. После его интродукции в 1999 г. в США вирус распространился и в настоящее время широко укоренился на территории от Канады до Венесуэлы.
Передача инфекции
Инфицирование человека чаще всего происходит в результате укусов инфицированных комаров. Комары инфицируются во время питания кровью инфицированных птиц - в их крови вирус циркулирует в течение нескольких дней. В конечном итоге вирус попадает в слюнные железы комара. Во время его последующего питания кровью (во время укусов комаров) вирус может попадать в организм людей и животных, где он может размножаться и приводить к болезни.
Вирус может также передаваться при контакте с другими инфицированными животными, их кровью или другими тканями.
Признаки и симптомы
Инфекция ВЗН либо протекает бессимптомно (примерно у 80% инфицированных людей), либо может приводить к развитию лихорадки Западного Нила или тяжелой болезни Западного Нила.
Примерно у 20% инфицированных ВЗН людей развивается лихорадка Западного Нила. Ее симптомы включают лихорадочное состояние, головную боль, усталость и боли в теле, тошноту, рвоту, иногда кожную сыпь (на туловище) и распухшие лимфатические узлы.
Симптомы тяжелой болезни (называемой также нейроинвазивной болезнью), такой как энцефалит или менингит Западного Нила или полиомиелит Западного Нила, включают головную боль, высокую температуру, ригидность шеи, помрачение сознания, дезориентацию, кому, тремор, судороги, мышечную слабость и паралич. По оценкам, наиболее тяжелая форма болезни развивается примерно у одного из 150 человек, инфицированных вирусом Западного Нила. Тяжелая болезнь может развиться у человека любого возраста, однако люди старше 50 лет и некоторые люди с ослабленным иммунитетом (например, пациенты, перенесшие трансплантацию) подвергаются самому высокому риску развития тяжелой болезни в результате инфицирования ВЗН.
Инкубационный период обычно составляет от 3 до 14 дней.
Диагностирование
Вирус Западного Нила можно диагностировать с помощью целого ряда различных тестов:
- Сероконверсия антител IgG (или значительный рост титров антител) в двух образцах, взятых с интервалом в одну неделю, путем проведения иммуноферментного анализа (ИФА).
- Иммуноферментный анализ (ИФА) с использованием иммобилизованных антител IgG.
- Анализ нейтрализации.
- Выявление вирусов методом полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР).
- Изолирование вирусов путем культивирования клеток.
JgG могут быть выявлены почти во всех образцах спинномозговой жидкости (СМЖ) и сыворотки, взятых у инфицированных ВЗН пациентов во время появления у них клинических признаков. Антитела IgG могут оставаться в сыворотке более одного года.
Лечение и вакцина
Для пациентов с нейроинвазивной болезнью Западного Нила проводится поддерживающее лечение, при котором часто требуются госпитализация, внутривенные вливания, вспомогательная искусственная вентиляция легких и профилактика вторичных инфекций. Вакцины для людей не существует.
Переносчики и животные-хозяева
Вирус ЗН поддерживается в природе благодаря циклу передачи "комар-птица-комар". Основными переносчиками ВЗН, в основном, считаются комары рода Culex, в частности, Cx. Pipiens. ВЗН поддерживается в популяциях комаров через вертикальную передачу (от взрослых особей яйцам).
Птицы являются резервуарными хозяевами ВЗН. В Европе, Африке, на Ближнем Востоке и в Азии редко наблюдается смертность птиц, связанная с инфекцией ВЗН. И, наоборот, в Америке вирус является высокопатогенным для птиц. Вирус был выявлен в мертвых и умирающих птицах более 250 видов, но особенно чувствительными являются птицы из семейства ворон (Corvidae). Птицы могут приобретать инфекцию различными путями, отличными от укусов комаров. Разные виды птиц обладают разным потенциалом для поддержания цикла передачи.
Лошади, как и люди, являются "конечными" хозяевами. Это означает, что, приобретая инфекцию, они не распространяют ее. Инфекции с клиническими проявлениями у лошадей также бывают редко и, как правило, протекают в легкой форме, но могут приводить к развитию неврологической болезни, включая смертельный энцефаломиелит.
Профилактика
Предотвращение передачи инфекции среди лошадей
В связи с тем, что случаям заболевания людей предшествуют вспышки ВЗН среди животных, необходимо создать систему активного эпиднадзора среди животных для выявления новых случаев инфекции среди птиц и лошадей. Это имеет решающее значение для обеспечения раннего предупреждения ветеринарных служб и органов общественного здравоохранения. В Америке в целях содействия сообществу важное значение имеет уведомление местных органов о мертвых птицах.
Разработаны вакцины для лошадей. Лечение является поддерживающим и проводится в соответствии со стандартными ветеринарными практическими методиками для животных, инфицированных вирусными возбудителями болезней.
Уменьшение риска инфицирования людей
При отсутствии вакцины единственным путем уменьшения числа инфекций среди людей является повышение осведомленности в отношении факторов риска и просвещение людей в отношении мер, которые они могут принимать для уменьшения воздействия вируса.
- Уменьшение риска передачи инфекции комарами. Усилия по предотвращению передачи инфекции, в первую очередь, должны быть направлены на личную защиту и защиту на уровне сообществ от укусов комаров с помощью использования противомоскитных сеток и индивидуальных репеллентов, ношения одежды светлого цвета (рубашек с длинными рукавами и брюк) и воздержания от пребывания на открытом воздухе в пиковое время укусов комаров. Кроме того, необходимо проводить программы по стимулированию сообществ к уничтожению мест размножения комаров в жилых районах.
- Уменьшение риска передачи инфекции от животного человеку. При обращении с больными животными или их тканями и при проведении процедур забоя и выбраковки необходимо надевать перчатки и другую защитную одежду.
- Уменьшение риска передачи инфекции при переливании крови и трансплантации органов. Во время вспышки болезни в пораженных районах после оценки местной/районной эпидемиологической ситуации необходимо предусматривать ограничения донаций крови и органов, а также лабораторное тестирование.
Борьба с переносчиками
Эффективная профилактика инфекций людей ВЗН зависит от разработки всесторонних, комплексных программ по эпиднадзору и борьбе с комарами в районах, где встречается вирус. Необходимы исследования для определения местных видов комаров, причастных к передаче ВЗН, включая те виды, которые могут служить "мостом" между птицами и людьми. Особое внимание необходимо уделять комплексным контрольным мерам, включающим уменьшение источника инфекции (при участии сообществ), управление водными ресурсами, химические вещества и методы биологического контроля.
Профилактика инфекции в медицинских учреждениях
Работники здравоохранения, осуществляющие уход за пациентами с предполагаемой или подтвержденной инфекцией ВЗН или обращающиеся с взятыми у них образцами, должны принимать стандартные меры предосторожности в области инфекционного контроля. Работу с образцами, взятыми у людей и животных с предполагаемой инфекцией ВЗН, должен проводить специально подготовленный персонал в надлежащим образом оборудованных лабораториях.
Ответные меры ВОЗ
Европейское региональное бюро ВОЗ и региональное бюро ВОЗ для стран Америки вместе со страновыми бюро и международными партнерами оказывают интенсивную поддержку в проведении эпиднадзора за ВЗН и принятии ответных мер на вспышки болезни, соответственно в Европе и Северной Америке, Латинской Америке и странах Карибского бассейна.
Что такое лихорадка Западного Нила? Каковы проблемы ее диагностики и дифференциальной диагностики?
Что такое лихорадка Западного Нила?
Каковы проблемы ее диагностики и дифференциальной диагностики?
Вирус лихорадки Западного Нила (ЛЗН) впервые выделен в 1937 году в Уганде при массовом обследовании на носительство вируса желтой лихорадки у больной с лихорадочным заболеванием, сопровождавшимся сонливостью. Через три месяца в крови у нее были обнаружены антитела против выделенного вируса.
Вирус ЛЗН (ВЛЗН) относится к роду Flavivirus семейства Flaviviridae (ранее входившему в семейство Togaviridae), содержит однонитевую несегментированную РНК, его репликация происходит в цитоплазме пораженных клеток. ВЛЗН принадлежит к антигенному комплексу японского энцефалита, включающего также возбудителей энцефалита Сент-Луис, желтой лихорадки, денге и др. (более 15 нозоформ).
Заболевания, вызываемые вирусами этого комплекса, характеризуются лихорадкой, геморрагическим синдромом, поражением ЦНС, гепатитом, которые встречаются в различных сочетаниях 2
Вследствие несовершенства механизма передачи наследственной информации ВЛЗН, как и многие другие однонитевые РНК-вирусы, обладает значительной изменчивостью генетической структуры и широким антигенным спектром. Это, по-нашему мнению, может приводить к изменению потенциала вирулентности и характера клинических проявлений болезни. Филогенетические исследования штаммов ВЛЗН, изолированных в 1937-2000 годах в различных регионах мира, показали их широкую вариабельность [16, 17].
Резервуаром вируса являются птицы водно-околоводного комплексов, чем и объясняется широкое распространение вируса в природе. Основными переносчиками ВЛЗН являются орнитофильные комары рода Culex, а также Aedes и др. Вирус адаптируется к местным видам аргасовых и иксодовых клещей, участвующих в сохранении вирусной популяции в межэпизоотический период. В циркуляцию вируса могут включаться дикие и домашние животные, например лошади, у которых болезнь протекает тяжело, с картиной энцефаломиелита [9].
Восприимчивость человека к ВЛЗН высока, хотя, по-видимому, преобладает бессимптомное инфицирование или легкие лихорадочные формы болезни. Так, в Бухаресте в 1996 году число бессимптомных или слабо выраженных случаев было в 140-320 раз больше, чем клинически выраженных [14]. В пользу этого говорит и высокая частота обнаружения антител у населения в высокоэндемичных районах. Однако данных о протективных свойствах антител нет. В этой связи интерес представляет возрастная структура больных. В высокоэндемичных регионах среди больных преобладают дети младшего возраста, в слабоэндемичных регионах болеют, причем тяжело, лица старших возрастных групп. Так, во время наблюдавшейся нами вспышки в Волгограде среди лиц с подтвержденным диагнозом пациенты старше 50 лет составили 51%, дети —16%, 78% умерших были старше 60 лет. Аналогичная ситуация наблюдалась и в Бухаресте в 1996 году, когда заболеваемость среди лиц до 50 лет составила 6 на 100 тыс. населения, а старше 70 лет — 40 на 100 тыс., летальность, соответственно, 0 и 15% [12, 14]. Аналогичный феномен наблюдается и при японском энцефалите и энцефалите Сент-Луис.
Возможно, что в данном случае мы сталкиваемся с феноменом антителозависимого иммунологического усиления, описанным при денге. При первичном заражении вирусом денге развивается доброкачественное заболевание. При повторном заражении другим серотипом вируса возникает тяжелейший синдром шока денге. Суть феномена состоит в фиксации комплекса вирус — антитело на поверхности мембраны клеток, что способствует увеличению числа инфицированных клеток, в частности моноцитов и макрофагов, и развитию генерализованных реакций. При ЛЗН в слабоэндемичных районах возможно повторное инфицирование лиц старших возрастов другим сероваром вируса или модифицированным вирусом. Однако эта гипотеза требует подтверждения.
Другие аспекты патогенеза ЛЗН также изучены мало. Анализ наших собственных наблюдений, патоморфологических и вирусологических данных позволяет предположить, что ВЛЗН распространяется гематогенно, в том числе внутри инфицированных лейкоцитов [1], поражая эндотелий сосудов, ганглиозные клетки коры головного мозга, кардиомиоциты. Ответная реакция проявляется формированием периваскулярных лимфоидных инфильтратов. Поражение нейроцитов сопровождается их дистрофией и некрозом. Повреждение сосудов способствует развитию отека-набухания мозга, возникновению локальных и генерализованных проявлений тромбогеморрагического синдрома.
Наблюдавшаяся в 1999 году в Волгограде вспышка ЛЗН существенно отличалась, так же как и другие регистрировавшиеся в последнее время вспышки, от описанных в предшествующие годы. Она по своим масштабам уступала лишь вспышке заболеваний в ЮАР в 1974 году.
Вспышка возникла в июле — сентябре в Волгограде, городе Волжском и близлежащих областях, когда в стационары поступило 739 больных с однотипной картиной (лихорадка, головная боль, боли в мышцах, суставах, резкая слабость, симптомы поражения ЦНС). Следует подчеркнуть, что в 1997 и 1998 годах в Волгограде в летние месяцы наблюдался беспрецедентный для России рост заболеваемости нейроинфекциями. Так, в 1997 году за июль — август заболело серозными и гнойными менингитами и менингоэнцефалитами 135 человек, преимущественно дети от 3 до 9 лет. Течение нейроинфекций было доброкачественным. В 1988 году только за месяц, с 10 августа по 9 сентября, заболело 149 человек, причем преобладали взрослые, в том числе 42% старше 50 лет, 9 больных (6%) умерли. Таким образом, есть основания полагать, что случаи заболевания ЛЗН имели место уже в 1997 году.
Хотя в целом по характеру интоксикационного синдрома течение болезни соответствовало имеющимся в литературе описаниями ЛЗН, имелись и существенные различия: продолжительность лихорадочного периода в среднем составляла более 8 суток, в отдельных случаях до 4 недель. Явления склерита и конъюнктивита отмечены только у 13% больных, сыпь — в единичных случаях, катаральные явления, полиаденопатия, гепатолиенальный синдром не наблюдались. Жидкий стул отмечен у 5% больных.
У всех пациентов доминировали симптомы поражения ЦНС: интенсивная головная боль диффузного характера, сопровождающаяся тошнотой, а у половины больных рвотой центрального характера. Нередко отмечалось головокружение, заторможенность, адинамия, корешковые боли, гиперстезия кожи; у 25% больных — повышение AД, более чем у половины (50%) — менингеальный синдром.
При исследовании цереброспинальной жидкости у 347 больных патологических изменений не выявлено, менингеальный и общемозговой синдромы были кратковременными, температура тела нормализовалась в течение 2-8 суток, то есть наблюдалась лихорадочная (гриппоподобная) форма болезни.
У 308 больных в течение 2-3 суток симптомы поражения ЦНС нарастали. Помимо менингеального синдрома выявлялась общемозговая симптоматика, мышечный тремор, анизорефлексия, нистагм, пирамидные знаки. ЦСЖ при люмбальной пункции вытекала под повышенным давлением, была прозрачной или опалесцирующей. При микроскопии выявлялся плеоцитоз в пределах от 15 до 2000 в 1 мкл, в среднем 200-300 клеток в 1 мкл. Плеоцитоз был лимфоцитарным, с примесью нейтрофилов. В первые трое суток у части больных плеоцитоз был смешанным или нейтрофильным (до 80% нейтрофилов). Количество белка повышалось в пределах 0,45-1,65 г/л. Содержание глюкозы находилось у верхних границ нормы. Течение болезни было относительно тяжелым, но доброкачественным. Температура нормализовалась в пределах 7-12 суток, ЦСЖ — в течение 2-3 недель, однако длительно сохранялась мышечная слабость, утомляемость. Эта форма болезни трактовалась нами как менингеальная.
У 84 больных была менингоэнцефалитическая форма болезни, которая характеризовалась тяжелым, злокачественным течением. Интоксикация и гипертермия были выражены с первых дней. Симптомы поражения ЦНС нарастали. С третьего-четвертого дня болезни на фоне менингеального синдрома начинала превалировать энцефалитическая симптоматика: спутанность сознания, возбуждение, стопор, а в отдельных случаях кома; часто отмечались судороги, мышечный тремор, парезы нижних конечностей, реже — черепных нервов, нистагм, нарушение стволовых функций. 40 больных умерли при явлениях отека мозга и расстройства дыхания. По сравнению с предыдущей группой наблюдалась меньшая выраженность менингеального синдрома, плеоцитоз ЦСЖ находился в пределах 10-300 клеток в 1 мкл, содержание белка повышалось до 0,6-3,0 г/л.
Летальность составила 5,4% общего числа больных, а в группе больных менингоэнцефалитом — 48%. При лихорадочной и менигеальной формах болезни летальных исходов не было.
Эти данные позволяют заключить, что современную ЛЗН следует отнести к группе тяжелых (опасных) вирусных болезней.
Диагноз ЛЗН может быть подтвержден выделением культуры вируса из крови в культуре клеток МК-2 или путем внутримозгового заражения мышей. Возбудитель может быть обнаружен прямым методом флюоресцирующих антител. Эффективны и широко применяются серологические реакции (РТГА, РСК, РН), в последние годы используется метод ИФА. О наличии ВЛЗН свидетельствует нарастание титра антител в четыре раза (на два разведения) при исследовании парных сывороток, взятых с интервалом 7-10 дней, или обнаружение антител класса IgM, поскольку в эндемичных районах антитела класса IgG могут обнаруживаться у значительной части населения. К недостаткам серологических реакций можно отнести значительный процент отрицательных результатов и затруднения при дифференцировке с другими флавирусными инфекциями комплекса японского энцефалита, так как возбудители имеют общие антигены и возможны перекрестные положительные реакции.
Наиболее эффективным и практически доступным методом ранней диагностики (с первого дня болезни) является полимеразная цепная реакция (ПЦР), позволяющая обнаружить специфические фрагменты генома вируса в крови и цереброспинальной жидкости, а также в трупном материале [12, 14-17]. Амплификация при помощи ПЦР генома ВЛЗН из культуры вируса или непосредственно из клинических образцов тканей больного может быть дополнена его детальным филогенетическим анализом.
Так, проведенное нами изучение генетической структуры ВЛЗН, выделенного в Волгограде, показало наличие в его геноме отличий от классического вируса и близость к вирусу, выделенному в Нью-Йорке [12, 16, 17]. Возможно, что особенности клинической картины болезни, наблюдавшиеся нами во время вспышки в Волгограде, связаны с изменением антигенных свойств вируса и резким возрастанием потенциала его вирулентности.
Изменения вирулентности вируса и, соответственно, распространение болезни в человеческой популяции известны и в отношении других флавирусов. Так, в 1945-1949 годы на территории Омской области и в прилегающих регионах отмечалась интенсивная вспышка флавирусной Омской геморрагической лихорадки. Заболеваемость достигла 4 тыс. на 100 тыс. населения, затем она снизилась до единичных случаев, хотя циркуляция вируса в этом регионе продолжается [1].
Дифференциальный диагноз при ЛЗН проводится в зависимости от клинической формы с широким кругом заболеваний. Важно учитывать эпидемиологические особенности ЛЗН: сезонность, ограниченную периодом активности комара — переносчика инфекции в данной местности, единичные случаи болезни в очаге, отсутствие контагиозности, связь заболевания с употреблением каких-либо пищевых продуктов или пользованием определенным источником водоснабжения. Гриппоподобную форму болезни приходится дифференцировать с лептоспирозом, гриппом, при наличии катаральных явлений — с другими ОРВИ; при диспептических расстройствах — с энтеровирусной инфекцией; в случаях, протекающих с лимфаденопатией и гепатолиенальным синдромом, — с аденовирусной инфекцией и инфекционным мононуклеозом.
Менингеальную форму болезни необходимо дифференцировать прежде всего с энтеровирусными менингитами, лимфоцитарным хориоменингитом и другими серозными вирусными менингитами.
Тяжелые случаи менингоэнцефалитов дифференцируются с герпетическим энцефалитом, туберкулезным менингитом. Преобладание в первые дни болезни в ЦСЖ нейтрофилов, тяжелая картина болезни, по нашим наблюдениям, нередко приводят к ошибочной диагностике бактериальных гнойных менингитов. Следует иметь в виду, что при гнойных менингитах и менингоэнцефалитах менингеальный синдром развивается на 1-2-й дни болезни, общемозговой синдром и очаговая симптоматика — на 2-4-й дни болезни, плеоцитоз ЦСЖ превышает 1000 в 1 мкл, преобладают сегментоядерные нейтрофилы, содержание глюкозы снижено, в крови — воспалительная реакция. При вирусных менингитах и менингоэнцефалитах ЦСЖ прозрачная, плеоцитоз в ранние сроки, когда возможно преобладание нейтрофилов, не превышает 200 клеток, обычно обнаруживаются молодые формы нейтрофилов, содержание глюкозы у верхних границ нормы или повышено. В крови тенденция к лейкопении и лимфоцитозу.
Этиотропная терапия и иммунотерапия при ЛЗН не разработаны. Госпитализация проводится по клиническим показаниям (гипертермия, выраженный нейротоксикоз, менингеальный синдром, общемозговая и очаговая неврологическая симптоматика). В остальных случаях больные лечатся на дому симптоматическими средствами. В связи с сосудистыми расстройствами следует избегать назначения ацетилсалициловой кислоты.
При менингеальной форме болезни больные нуждаются в умеренной дегидратационной терапии с использованием солюретиков, дезинтоксикации путем инфузии полиионных растворов, поляризующей смеси, применении анальгетиков.
Наиболее сложную задачу представляет лечение больных тяжелой менингоэнцефалитической формой болезни. Важное значение наряду с дегидратацией имеет поддержание нормоволемии, так как избыточная дегидратация приводит к снижению ОЦК, уменьшению мозгового кровотока, усилению гипоксии мозга, являющейся ключевым механизмом развития его отека-набухания. Именно об этом, по нашим наблюдениям, чаще всего забывают практические врачи. С самого начала лечения необходимо проведение оксигенотерапии путем ингаляции кислородно-воздушной смеси. При нарастании признаков отека мозга (развитие комы, судорожного синдрома, появление тахипноэ с резким снижением pCO2 и развитием гипоксемии) необходимо переводить больных на ИВЛ, не дожидаясь возникновения глубоких степеней дыхательных расстройств. С целью снижения проницаемости гематоэнцефалического барьера необходимо назначение дексаметазона в дозе 0,25±0,5 мг/кг в сутки. Показано также применение антиоксидантов, антигипоксантов, ноотропов, противосудорожных средств, коррекция нарушений КЩС и электролитного баланса.
Профилактика ЛЗН направлена на борьбу с комарами, в частности обработку мест их выплода (водоемы, подвалы жилых домов), использование средств защиты от комаров (затягивание окон сеткой, обработка жилых помещений и кожи репелентами). Эффективность этих мер была доказана во время вспышки ЛЗН в Нью-Йорке в 1999 году.
Литература
Лихорадка Западного Нила: история и эпидемиология
По данным Д. К. Львова, на территории бывшего СССР вирус циркулирует от Белоруссии до Приморского края, в частности в Закавказье, бассейне Каспийского моря, Средней Азии. Регистрировались и единичные заболевания среди людей [1, 9].
С 1996 года ситуация изменилась. В этом году в Бухаресте и прилегающих районах, то есть за пределами тропического и субтропического пояса, возникла крупная вспышка ЛЗН. Заболело не менее 400 человек, летальность составила около 4-6%, было инфицировано около 4% населения города [13, 14]. Летом 1999 года в Нью-Йорке произошла вспышка ЛЗН. Только менингоэнцефалитом заболело 58 человек, 7 из них умерли [15, 16]. Первоначально диагноз трактовался как энцефалит Сент-Луис, поскольку ранее на Американском континенте ЛЗН не регистрировалась. В этом же году в Волгоградской, Астраханской и Краснодарской областях также возникли крупные вспышки ЛЗН [9-12, 17]. Все эти вспышки, в отличие от описанных ранее, характеризовались высокой частотой поражения ЦНС и высокой летальностью. До настоящего времени в районах, вовлеченных в эти вспышки, наблюдаются случаи заболевания людей и инфицирования птиц ЛЗН (Румыния, 1997-1998 [18]), а также выявляются перезимовывающие комары-вирусоносители (Нью-Йорк, 2000, D. Morse, personal communication), то есть циркуляция вируса продолжается.
Таким образом, за последние годы резко расширился ареал ЛЗН, которая приобрела черты тяжелой нейроинфекции. Учитывая широкую циркуляцию вируса на территории России и стран ближнего зарубежья, следует признать, что для российского здравоохранения ЛЗН представляет новую актуальную проблему.
Читайте также:

