Материал для микробиологического исследования туберкулеза
Обновлено: 18.04.2024
Выявление – составная часть борьбы с туберкулезом. Для выявления и диагностики туберкулеза применяются различные методы (туберкулинодиагностика, рентгено-флюорографические, бактериологические), но наиболее информативным, быстрым и экономичным является бактериоскопия мокроты по Цилю – Нельсену у лиц с симптомами, подозрительными на туберкулез (кашель с выделением мокроты более 3 нед, кровохарканье, боли в грудной клетке, потеря массы тела) и рентгенография грудной клетки.
To detect tuberculosis is part of its control programme. For identification and diagnosis of the disease, different (tuberculin diagnostic, X-ray, fluorographic, and bacteriological) methods are used, but the most informative, rapid, and cost-effective ones are Ziehl-Neelsen’s sputum bacterioscopy in individuals with signs of suspected tuberculosis (over 3-week productive cough, hemoptysis, chest pain, weight loss) and chest X-ray.
В.В. Пунга — доктор мед. наук, руководитель отдела Центрального НИИ туберкулеза РАМН, Москва
V.V. Punga — MD, Head of Department, Central Research Institute of Tuberculosis, Russian Academy of Medical Sciences, Moscow
В ыявление – составная часть борьбы с туберкулезом, направленная на идентификацию случаев туберкулеза в обществе. Выявление больных туберкулезом осуществляется медицинским персоналом учреждений общей лечебной сети при обследовании пациентов, обратившихся за медицинской помощью, а также при плановых профилактических обследованиях определенных групп населения.
Основными методами выявления туберкулеза остаются:
– туберкулинодиагностика;
– рентгенофлюорографические обследования;
– бактериологическая диагностика.
Все эти методы, каждый в отдельности или в комбинации, применяются у разных групп населения: туберкулинодиагностика – у детей и подростков; профилактические флюорографические обследования – у лиц старше 15 лет; бактериологические, рентгенологические обследования, туберкулинодиагностика – у лиц с повышенным риском заболевания туберкулезом, находящихся на диспансерном учете, обращающихся в поликлиники и поступающих в стационар на лечение с симптомами заболевания, подозрительными на туберкулез. Туберкулез поражает различные органы и системы, поэтому для диагностики внелегочного туберкулеза применяются специальные методы обследования в зависимости от локализации заболевания.
Одним из приоритетных направлений в системе противотуберкулезных мероприятий в сложившихся социально-экономических условиях является выявление туберкулеза в учреждениях общей лечебно-профилактической сети среди лиц, обратившихся за медицинской помощью. У всех лиц с симптомами, подозрительными на туберкулез органов дыхания (кашель с мокротой более 2 – 3 нед, боли в грудной клетке, потеря массы тела, субфебрильная температура, потливость, кровохарканье), необходимо исследовать мокроту на микобактерии туберкулеза (МБТ) методом микроскопии мазка по Цилю – Нельсену и провести рентгенографию (флюорографию) грудной клетки. Как показали исследования, проводимые в ряде территорий Российской Федерации (Ивановская, Томская области, республика Марий Эл), этот подход позволяет выявить более половины впервые заболевших туберкулезом органов дыхания с бактериовыделением, наиболее опасных в эпидемиологическом отношении, сократить сроки диагностики туберкулеза и время от первого обращения больного в медицинское учреждение до начала противотуберкулезного лечения. Исследования мокроты методом микроскопии мазка по Цилю – Нельсену необходимо осуществлять во всех клинико-диагностических лабораториях общей лечебной сети. Больных, у которых выявлены МБТ, следует направлять в противотуберкулезные диспансеры для дообследования, подтверждения диагноза туберкулеза, лечения и постановки на учет.
Бактериоскопический метод прост, экономичен и позволяет при положительном результате исследования мазка мокроты установить диагноз туберкулеза органов дыхания. Бактериоскопическому обследованию подлежат обратившиеся в медицинское учреждение лица:
– с явными симптомами заболевания;
– с наличием продолжительного (более 3 нед) кашля с выделением мокроты, кровохарканьем и болями в грудной клетке;
– контактировавшие с бациллярными больными туберкулезом;
– имеющие рентгенологические изменения в легких, подозрительные на туберкулез.
Выявление больных туберкулезом легких бактериоскопическим методом должно осуществляться во всех клинико-диагностических лабораториях лечебно-профилактических учреждений общей сети: взрослых и детских поликлиниках, республиканских, краевых, областных, городских и центральных районных больницах, клиниках научно-исследовательских институтов, участковых больницах и сельских врачебных амбулаториях, психиатрических больницах, медико-санитарных частях пенитенциарных учреждений и др. Как минимум 3 мазка мокроты необходимо исследовать в лаборатории методом микроскопии по Цилю – Нельсену на кислотоустойчивые бактерии. Первую и вторую пробы мокроты берут в присутствии медицинского работника в день обращения пациента (с промежутком 1,5 – 2 ч), затем ему выделяют посуду для сбора утренней мокроты перед вторым посещением врача. Для получения положительного результата важно правильно организовать сбор мокроты, который следует проводить в отсутствии посторонних людей в отдельной, хорошо проветриваемой комнате. Пациенту необходимо объяснить, как следует откашливать мокроту из более глубоких отделов легких. В поликлинике или больнице все медицинские сестры должны быть обучены методике сбора мокроты. Больной должен откашливать мокроту в присутствии медицинской сестры. Следует попросить больного сделать несколько глубоких вдохов и покашлять в емкость, после чего проверить наличие в емкости мокроты. Если больной не может откашлять мокроту или она отсутствует, материал для исследования можно получить с помощью раздражающих ингаляций, промывания бронхов и желудка.
В первый же день необходимо сделать рентгенографию грудной клетки. В отдельных случаях (например, когда больной живет далеко от лечебного учреждения или ему трудно добираться до него, или его состояние неудовлетворительное) пациента можно госпитализировать на 2 – 3 дня для обследования. В некоторых отдаленных населенных пунктах более целесообразно обучить фельдшеров или других медицинских работников правильному сбору мокроты, консервации и быстрой доставке ее в ближайшую клинико-диагностическую лабораторию; можно также обучить персонал приготовлению мазков мокроты, высушиванию, фиксации с последующей доставкой в ближайшую лабораторию для окрашивания и исследования. Необходимо исследовать не менее 100 микроскопических полей зрения. Если кислотоустойчивые бактерии не обнаружены в 100 полях зрения, необходимо исследовать дополнительно еще 100 полей.
У взрослых диагноз туберкулеза легких подтверждается обнаружением МБТ в мокроте. У детей до 10 лет в связи с трудностью получения мокроты исследуют промывные воды желудка или мазок из гортани. Процедуру проводят рано утром натощак, полученное содержимое собирают в стерильную посуду и направляют в лабораторию для бактериоскопического и культурального исследования.
Чтобы предупредить заражение туберкулезом при сборе мокроты, медицинский работник обязан быть в шапочке, маске, клеенчатом фартуке и резиновых перчатках. Меры предосторожности также должны применяться при хранении и доставке мокроты в лабораторию на исследование. Для хранения и перевозки используют специальные контейнеры или металлические биксы. Если первые мазки оказались положительными, а больной не пришел к врачу повторно, его следует срочно разыскать и вызвать для дообследования, установления диагноза и направления на лечение.
Кроме микроскопии мазка мокроты, окрашенного по Цилю – Нельсену, в лабораториях, оснащенных люминесцентными микроскопами, возможно исследование материала методом люминесцентной микроскопии. Необходимо обязательно проводить посев мокроты на питательные среды у всех больных, так как у части больных МБТ выявляются только культуральным методом. Посев мокроты или другого материала на выделение возбудителя туберкулеза осуществляют в специализированных лабораториях противотуберкулезных учреждений.
Посев мокроты или другого материала (крови, промывных вод желудка, бронхоальвеолярных смывов, плевральной жидкости) повышает число положительных результатов, которые становятся известными через 4 – 8 нед. В настоящее время существуют методы, которые позволяют сократить длительность выявления МБТ: применение сред для бифазного посева, системы БАКТЕК-460, сокращающие в среднем наполовину сроки роста МБТ. Использование системы БАКТЕК-460 технически просто и позволяет идентифицировать МБТ, определить их лекарственную чувствительность в течение недели.
Кроме прямых методов диагностики туберкулеза (бактериоскопия, культуральный метод), используют и непрямые, основанные на серодиагностике и определении в исследуемом материале нуклеиновых кислот МБТ (полимеразно-цепная реакция – ПЦР). Данные, касающиеся чувствительности и специфичности ПЦР, не позволяют еще в настоящее время использовать этот метод в широкой практике. Микроскопическое исследование патологического материала остается пока наиболее быстрым, чувствительным и дешевым методом, позволяющим установить диагноз туберкулеза.
Активный метод выявления туберкулеза, основанный на массовом рентгенофлюорографическом обследовании населения, для большинства территорий в настоящее время крайне затруднен вследствие его высокой стоимости, изношенности аппаратуры и недостаточной результативности. Проведенный в Ивановской области анализ соотношения стоимости – эффективности выявления случая туберкулеза показал, что на выявление больного по обращаемости затрачивается $ 1590, а при профилактическом осмотре – $ 4000. Сплошные профилактические флюорографические обследования всего населения в возрасте 15 лет и старше, проводимые в прежние годы, в настоящее время также могут быть осуществлены по эпидемиологическим показаниям и при достаточных ресурсах. Профилактические флюорографические обследования для активного выявления туберкулеза в настоящее время следует использовать среди отдельных групп населения, где наиболее часто выявляется туберкулез. Рентгенофлюорографический метод в основном позволяет выявить все случаи “абациллярного” туберкулеза легких (в настоящее время регистрируется 45 – 50% случаев).
Туберкулинодиагностика является основным методом раннего выявления инфицирования туберкулезом детей и подростков. Туберкулинодиагностика как специфический диагностический тест применяется при массовых обследованиях населения на туберкулез, а также в клинической практике для диагностики туберкулеза. Для этих целей используется единая внутрикожная туберкулиновая проба Манту с 2 туберкулиновыми единицами (ТЕ) очищенного туберкулина PPD-L. Ежегодная постановка пробы Манту с 2 ТЕ позволяет своевременно выявить лиц с гиперергическими и усиливающимися реакциями на туберкулин, у которых высок риск заболевания, возможны начальные и локальные формы туберкулеза. Проба Манту считается положительной при размере папулы более 5 мм.
Массовую туберкулинодиагностику среди детей и подростков, посещающих детские ясли, сады, школы, колледжи, проводят специальными бригадами (2 медсестры и врач), сформированными при детских поликлиниках. Детям раннего и дошкольного возраста, не посещающим детские учреждения, пробу Манту ставят в детской поликлинике, а в сельской местности ее производят медицинские работники районных сельских больниц и фельдшерско-акушерских пунктов. При правильной организации мероприятий по раннему выявлению туберкулеза ежегодно туберкулинодиагностикой должно охватываться 90 – 95% детского и подросткового населения административной территории.
Проба Манту с 2 ТЕ безвредна как для здоровых детей и подростков, так и для лиц с различными соматическими заболеваниями. Противопоказаниями для постановки туберкулиновой пробы являются кожные заболевания, аллергические состояния, эпилепсия, острые инфекционные заболевания и хронические заболевания в период обострения. В условиях массовой внутрикожной вакцинации (ревакцинации БЦЖ) проба Манту 2 ТЕ выявляет как послевакцинную, так и инфекционную аллергию. Систематическое проведение детям и подросткам внутрикожных туберкулиновых проб позволяет установить первичное инфицирование и осуществлять поиск очага туберкулезной инфекции среди взрослых.
Таким образом, в настоящее время для выявления больных туберкулезом применяются различные методы. Наиболее информативными, простыми, достоверными и экономичными являются бактериоскопическое исследование мокроты у лиц с симптомами, подозрительными на туберкулез (кашель с выделением мокроты более 3 нед, боли в грудной клетке, кровохарканье, потеря массы тела), рентгенография грудной клетки и туберкулинодиагностика у детей и подростков.
1. Джон Крофтон, Норман Хорн, Фред Миллер. // Клиника туберкулеза. – М., 1996.
2. Диагностика туберкулеза легких бактериоскопическим методом. Метод указания МСБТЛЗ. – Париж, Франция, 1995.
Диагностика туберкулеза. Принципы микробиологической диагностики туберкулеза. Выделение возбудителя туберкулеза.
Для диагностики туберкулёза применяют бактериоскопические, бактериологические, биологические, серологические и аллергологические методы, входящие в обязательный диагностический минимум. Материалом для исследований служат мокрота, отделяемое свищей, моча, СМЖ, испражнения.
Микроскопия возбудителя туберкулеза в патологическом материале. В мазках, окрашенных по Цилю-Нильсену, обнаруживают кислотоустойчивые палочки возбудителя туберкулеза.
Нередко материал содержит мало бактерий туберкулеза и для повышения вероятности их обнаружения используют методы обогащения: центрифугирование и флотацию. В первом случае исследуемый материал обрабатывают смесью растворов NaCl и NaOH, центрифугируют и микроскопируют осадок. Второй метод включает обработку материала смесью NaOH, дистиллированной воды и ксилола (или бензола). Образец энергично встряхивают; образующаяся пена всплывает и захватывает микобактерии. Пену отсасывают и готовят мазки.
Наиболее результативна люминесцентная микросколия возбудителя туберкулеза. Материал обрабатывают аурамин-родамином и бактерии окрашиваются в бело-жёлтый цвет. Для выявления L-форм применяют AT, меченные флюорохромами.
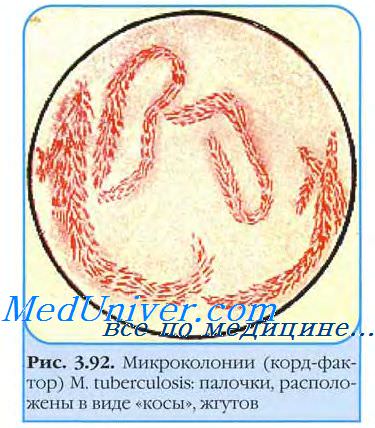
Выделение возбудителя туберкулеза
Достоинство метода — возможность получения чистой культуры туберкулеза, позволяющая её идентифицировать, оценить вирулентные свойства и определить чувствительность к ЛС. Материал засевают, тщательно втирая, на твёрдые питательные среды.
Для повышения эффективности выделения возбудителя туберкулеза и уничтожения контаминирующей микрофлоры применяют методы обогащения или обрабатывают материал 6-12% серной кислотой. Основной недостаток бактериологического метода — длительность получения результата (от 2 до 12 нед). В связи с этим разработаны ускоренные микрометоды выделения возбудителя туберкулеза.
Один из распространённых методов выделения возбудителя туберкулеза, метод Прайса, заключается в следующем. Материал помещают на предметное стекло, обрабатывают серной кислотой, отмывают физиологическим раствором и вносят в питательную среду, дополненную цитратной лизированной кровью.
Стекло вынимают через 3-4 сут и окрашивают но Цилю-Нильсену. При микроскопии обнаруживают микроколонии микобактерии возбудителя туберкулеза. Вирулентные бактерии образуют змеевидные (рис. 22-2), а невирулентные — аморфные микроколонии. Культуры L-форм выделяют посевом в столбик полужидкой среды и инкубируют при 37 °С 1-2 мес.
Рост проявляется в виде облачка помутнения с мелкими вкраплениями. Вирулентность выделенной культуры возбудителя туберкулеза определяют заражением лабораторных животных и по наличию корд-фактора. Последний легко идентифицируют по способности микобактерии связывать нейтральный красный и нильский голубой и удерживать их после добавления щелочи. Вирулентные штаммы возбудителя туберкулеза удерживают красители, авирулентные — нет.
Бактериологический метод диагностики туберкулеза. Влияние химиотерапии на диагностику туберкулеза.
Наилучшие результаты получают при одновременном использовании двух различных плотных сред. При этом не следует ограничиваться однократным или даже повторным исследованием, а необходимо последовательно, через известные интервалы производить посевы мокроты или промывных вод бронхов. Целесообразность такой диагностической тактики подтверждается повседневным опытом и, в частности, наблюдениями, проведенными в Институте туберкулеза в Будапеште. При троекратном исследовании методом посева мокроты у значительной группы больных туберкулезом легких микобактерии были обнаружены у 70,3% из них, после 5 анализов — у 80,7%, а после 10 — у 97,9%.
При бактериологическом способе исследования удается не только выявить и подсчитать количество выросших колоний микобактерии туберкулеза, но и изучить их различные свойства, дифференцировать от кислотоупорных сапрофитов и атипичных штаммов, определить типовую принадлежность, ферментативную активность, лекарственную чувствительность и др.
Успехи различных способов культивирования микобактерии, естественно, ограничили сферу применения биологического метода исследования, т. е. заражения животных исследуемым материалом. Но они ни в какой мере пе исключают его. Путем заражения высокочувствительных к туберкулезу лабораторных животных, главным образом морских свинок, можно обнаружить микобактерий, даже если они содержатся в исследуемом материале в небольшом количестве. Это обстоятельство приобретает, конечно, весьма важное диагностическое значение. Тем же способом удается лучше дифференцировать вирулентные и атипичные штаммы от сапрофитов, определить тип микробов, к которым одни виды животных чувствительны, а другие устойчивы, а также установить патогенность и вирулентность микобактерий туберкулеза.
Следует подчеркнуть, что при специфической химиотерапии затрудняется обнаружение микобактерий в различных выделениях, жидкостях и тканях организма больного. Это явление связано с тем, что под влиянием антибактериальных препаратов, особенно при длительной терапии, понижается жизнеспособность микобактерий и изменяются их морфологические свойства и химический состав, что отражается на тинкториальной способности, так как может вести к снижению или утрате присущей микобактериям кислотоустойчивости. Мертвые микобактерий по Цилю—Нельсену окрашиваются так же, как и живые. Для их дифференциации применяют специальные методы окраски. Так, живые микобактерий, в которых содержится нативная дезоксирибонуклеиновая кислота, окрашиваются метиловым зеленым. Погибшие микробы лучше окрашиваются пиронином в розовый цвет, а сафранином — в красный. При докраске карболовым фуксином живые микобактерий окрашиваются в зеленый цвет, а погибшие — в красный.
Распознавание таких биологически и морфологически измененных форм возбудителя туберкулеза, особенно в условиях повседневной практики, естественно, встречает затруднения. Этим отчасти можно объяснить, что у некоторых больных даже деструктивным туберкулезом легких не находят микобактерий туберкулеза в мокроте уже вскоре после начатой химиотерапии. Нет сомнения, что только у части из них произошло стойкое и полное морфологическое и биологическое оздоровление стенок туберкулезных каверн. У остальных имеет место мнимая абациллярность, что подтверждается возможностью обострения процесса при динамическом наблюдении, а также обнаружением микобактерий в полости или стенках каверны при специальном исследовании. В этом можно убедиться, если произвести пункцию, казалось бы, излеченной каверны и исследовать ее содержимое после промывания физиологическим раствором. Пользуясь таким методом, Neef (1966) из 49 больных с остаточными, большей частью небольшими (до 0,5 см в диаметре), посттуберкулезными полостями в легких у 11 больных, т. е. почти в 1/4 случаев, обнаружил микобактерий, которые не удавалось найти в мокроте или в промывных водах бронхов всеми доступными способами.
Таким образом, в условиях современной химиотерапии возникает необходимость дальнейшего усовершенствования методов обнаружения микобактерий туберкулеза. В то же время обязательным условием является одновременное динамическое комплексное применение различных лабораторных способов исследования патологического материала: бактериоскопии, посева, по возможности заражения лабораторных животных. Необходимо, кроме того, использование ряда специальных методов для выявления не только классических, но и других вариантов возбудителя.
Так, применяя новые питательные среды, а также пенициллин и дигидрострептомицин, можно выделить из мокроты, спинномозговой жидкости, мочи и тканей больных туберкулезом L-формы микобактерий в виде мелких зерен и шаровидных тел.
При дифференциации типичных и атипичных микобактерий используют комплекс многих методов исследования: определяют кислотно- и спиртоустойчивость микобактерий; изучают особенности их роста при различной температуре, на отдельных питательных средах, при наличии и отсутствии солнечного света; исследуют морфологию культур и способность образовывать пигмент; устанавливают степень чувствительности к туберкулостатическим препаратам. Существенное диагностическое значение имеют некоторые биохимические тесты: амидазный и ниациновый, определение каталазной, дегидрогеназной, пероксидазной, уреазной и липазной активности и реакция восстановления нитратов. О вирулентности тех или иных штаммов микробов судят по результатам определения корд-фактора и цитохимическим тестам. Их патогенность устанавливают при заражении морских свинок, белых мышей, кроликов, кур. Эти исследования дополняются изучением антигенных структур, а также аллергическими пробами с туберкулином и сенситинами, серологическими реакциями у больных.
Определенную роль в клинике туберкулеза органов дыхания играет вторичная — смешанная — инфекция, что связано прежде всего с тем что при нем нередко отмечаются хронический бронхит и пневмония, пневмосклероз, бронхоэктазы. Эти изменения могут сопутствовать туберкулезу или становятся его осложнением, особенно при длительном течении. В том и другом случае, отмечают Н. В. Татарский и А. Я. Цигельник (1968), создаются условия для проявления активности вторичной флоры и развития ряда клинических симптомов: повышения температуры, увеличения количества мокроты, нарастания катаральных явлений в легких, амилоидоза и т. д. При бактериологическом исследовании при этом обнаруживают различного вида стрептококки и стафилококки, грамположительные и грамотрицательные кокки, кишечную палочку и т. д. Все они имеют различную степень чувствительности к отдельным антибиотикам. При этом обязательным является выделение чистых культур и определение их патогенности.
При дифференциальной диагностике туберкулеза и глубоких микозов— аспергиллеза, гистоплазмоза, актиномикоза, кокцидиомикоза, нокаридиоза, кандидомикоза и т. д. — важно не только тщательно исследовать нативные и окрашенные препараты мокроты на присутствие дрожжеподобных грибов рода Candida, Coccidoides immitis, Histoplasma capsulatum, Aspergillus fumigatus и т. д., но и производить посевы на специальные питательные среды, главным образом на среду Сабуро с агаром или без него. Положительные результаты приобретают большее диагностическое значение, если одновременно у больных выявляются кожные реакции на кокцидиоидин, гистоплазмин, аспергиллин, бластомицин и др., а также серологические реакции с соответствующими антигенами (реакция преципитации, связывания комплемента).
Лабораторная диагностика туберкулеза. Выявление бактерий туберкулеза.
В распознавании и дифференциальной диагностике туберкулеза, а также в определении эффективности проводимого лечения важную роль играют лабораторные методы исследования. Среди них большое значение имеют прежде всего способы обнаружения микобактерии туберкулеза в различных выделениях, воспалительных экссудатах, жидкостях и тканях организма больного.
При туберкулезе легких микобактерии находят прежде всего в мокроте. Частота, массивность и постоянство бацилловыделения зависят от формы процесса. Оно часто имеет место при инфильтративном и особенно деструктивном туберкулезе легких. Реже или периодически выделяют микобактерии больные очаговыми, диссеминированными и цирротическими формами туберкулеза без явного распада легочной ткани. Существенное значение имеет при этом состояние бронхов. При их специфическом поражении, но сохраненной дренажной функции микобактерии выявляются с мокротой сравнительно чаще и с большим постоянством, чем при нормальном состоянии бронхов или при их стенозе, вызывающем блокаду каверны.
Микобактерии туберкулеза находят в большом количестве в обильно выделяющейся мокроте, а в скудном отделяемом, наоборот, они встречаются реже и в виде единичных экземпляров. У больных, не выделяющих мокроту, лучшие результаты дает применение раздражающих аэрозольных ингаля пий 10—15% раствора поваренной соли в 1% растворе питьевой соды Н. М. Рудой и соавт. (1971) применяют с этой целью смесь, состоящую из 5 мл 10% раствора хлорида натрия, 1 мл химопсина, растворенного в физиологическом растворе, и 20 капель солутана.
Второе место по эффективности выявления бацилловыделения у больных, не выделяющих мокроту, занимает исследование промывных вод трахеи и бронхов, которое предложил Я. С. Зобин (1939). В настоящее время для анестезии гортани у взрослых применяют 0,25% раствор дикаина, разведенный в 10% растворе новокаина. Этот раствор наливают во время фонации на голосовые связки в количестве 0,5—1 мл. У больных с повышенным глоточным рефлексом этим раствором смазывают заднюю стенку глотки. Затем в трахею шприцем с напаянной канюлей вводят 10—20 мл физиологического раствора комнатной температуры.
При этом в результате раздражения слизистой оболочки бронхов возникает кашель, при котором из глубоких дыхательных путей вместе с введенной жидкостью выделяются слизь и мокрота. Это отделяемое исследуют на присутствие микобактерии туберкулеза или другой микробной флоры.
Исследование промывных вод бронхов редко сопровождается серьезными осложнениями. Только при сильном, длительном и приступообразном кашле иногда появляется кровохарканье, может аспирироваться инфекционный материал в здоровые участки легочной ткани, нарастает сердечная недостаточность. Такие явления отмечаются главным образом у больных с сопутствующей бронхиальной астмой, пороком сердца, гипертонией. В подобных случаях, очевидно, не следует прибегать к данному методу исследования. При отсутствии таких противопоказаний, особенно у больных с ограниченными формами процесса, у которых чаще всего и возникает необходимость в исследовании промывных вод бронхов, обычно не наблюдается каких-либо осложнений, и поэтому его можно производить не только в клинических, но и в амбулаторных условиях.
Менее эффективно производимое натощак исследование промывных вод желудка, в которых может содержаться бациллярная мокрота или бронхиальная слизь, чаще заглатываемая детьми, а иногда и взрослыми (Аrmand-Dellille, 1927). Кроме того, микобактерии могут проникать в желудок через его слизистую оболочку при гематогенном распространении инфекции в организме, а также при забрасывании бациоллосодержащей желчи (М. Д. Розанова, 1950). Пользоваться этим методом рекомендуется в тех случаях, когда не удается получить мокроту при раздражающих ингаляциях, при противопоказаниях к применению промывания бронхов или при невозможности их проведения по другим причинам.
Наименее информативно определение бацилловыделения с помощью исследований мазков слизи из гортани, а также промывания только верхних отделов дыхательных путей.
У части больных можно выделить микобактерии из крови. По наблюдениям 49 авторов, обобщенным в 1954 г. Dalencour, бациллемия отмечалась в среднем у 5,3% больных различными формами туберкулеза. П. И. Беневоленский (1945) установил ее у 3,7% больных туберкулезом легких (исключая страдающих гематогенным процессом). Чаще обнаруживают микобактерии в крови при туберкулезе кожи, обширных гематогенных диссеминациях в легких, при менингите. Однако, по сводным данным Kallos (1937). основанным на изучении гемокультур, выделенных от 14 502 больных, туберкулезная бациллемия имела место всего лишь у 1,13% из них.
Частота выявления микобактерии зависит не только от формы заболевания, метода получения материала, но и от способа его исследования (бактериоскопия, посев, заражение животных). Микобактерии туберкулеза обнаруживают при прямой бактериоскопии мазков мокроты, окрашенных по Цилю—Нельсену, при микроскопии с использованием метода обогащения — флотации и люминесцентного способа исследования. Методы обогащения повышают частоту обнаружения микобактерии туберкулеза в мокроте, промывных водах желудка и бронхов, в экссудате, спинномозговой жидкости, в каловых массах на 10—20% по сравнению с результатами прямой бактериоскопии.
Среди бактериоскопических методов выявления бацилловыделения наиболее чувствительным является люминесцентная микроскопия, повышающая возможность обнаружения в мокроте микобактерии на 15—20% по сравнению с обычной бактериоскопией, а при исследовании мазков из флотационных колец — на 8—10%. При этом облегчается изучение некоторых биологических свойств возбудителя — старения культур, аутолиза клеток и др.
Некоторые авторы утверждают, что при флюоресцентной (люминесцентной) микроскопии микобактерии туберкулеза можно выявить даже чаще, чем при посевах мокроты и других материалов на различные питательные среды. Kolbel (1955) обнаружил их при простой бактериоскопии у 39,7% больных, при бактериологическом методе — у 52,1%, а при люминесцентной микроскопии — у 73,6%. На преимущество последнего метода указывают Т. Н. Ященко и И. С. Мечева (1973), Н. С. Страхов и соавт. (1973).
Для суждения об эффективности проводимой антибактериальной терапии придают прогностическое значение уменьшению (или сохранению) в динамике массивности бацилловыделения. Поэтому целесообразно не только констатировать бацилловыделение, но и оценивать его количественный показатель. При этом при бактериоскопии бацилловыделение оценивается как обильное, если находят микобактерии в каждом поле зрения, умеренное — при наличии «единичных микробов в 40—50 полях зрения и скудное — при нахождении их единичных экземпляров в препарате.
Для цитирования: Черноусова Л.Н. Современные тенденции и возможности микробиологической диагностики туберкулеза. РМЖ. 2002;16:697.
ЦНИИ туберкулеза РАМН, Москва
В настоящее время лабораторная диагностика занимает ведущее место в выявлении многих инфекционных заболеваний. Подтверждение диагноза туберкулеза основывается на результатах микробиологических анализов при выделении из биологического материала возбудителя – микобактерий туберкулеза. Современная микробиологическая диагностика туберкулеза состоит из нескольких основных групп анализов, направленных на выявление возбудителя, определение лекарственной чувствительности и типирование микобактерий.
Обнаружение возбудителя
Обнаружение возбудителя начинается с наиболее простых и быстрых бактериоскопических методов с использованием светового микроскопа с окраской по Циль–Нильсену и люминесцентного с окраской флюорохромами. Преимущество бактериоскопии – в быстроте получения результата. Однако возможности ее ограничены из–за низкой чувствительности. Этот метод является наиболее экономичным и рекомендован ВОЗ в качестве основного для выявления заразных больных (табл. 1).
При антибактериальной терапии обнаружение микобактерий туберкулеза имеет прогностическое значение. Поэтому бактериовыделение оценивается количественно. Золотым стандартом выявления микобактерий признаны культуральные исследования. Для посева патологического материала используют яичные среды: Левенштейна–Йенсена, среду Финна II, Мордовского и др. Количество микобактерий (или колоний в пробирке при культуральном методе исследования) в процессе химиотерапии является ориентировочным показателем ее эффективности или косвенным свидетельством развития устойчивости микобактерий к противотуберкулезным препаратам.
Для повышения процента выделения микобактерий посевы патологического материала проводят на несколько сред, в том числе и на жидкие в автоматизированных системах учета роста типа BACTEC, что позволяет удовлетворить все культуральные потребности возбудителя. Посевы инкубируют до двух с половиной месяцев. При отсутствии роста к этому времени посев считается отрицательным. Наиболее чувствительным способом обнаружения микобактерий туберкулеза считается метод биологической пробы – заражение диагностическим материалом высокочувствительных к туберкулезу морских свинок.
Развитие молекулярной биологии позволило значительно повысить эффективность обнаружения микобактерий. Базовым методом молекулярно–генетических исследований является полимеразная цепная реакция (ПЦР), направленная на выявление ДНК микобактерий в диагностическом материале. ПЦР дает экспоненциальное увеличение специфического участка ДНК возбудителя: 20 циклов ПЦР приводят к увеличению исходной ДНК в 1 миллион раз, что позволяет визуализировать результаты методом электрофореза в агарозном геле.
Роль молекулярной диагностики в клинической практике повышается, поскольку увеличивается число больных со скудным бактериовыделением. Однако при постановке диагноза результаты ПЦР являются дополнительными и должны сопоставляться с данными клинического обследования, рентгенографии, микроскопии мазка, посева и даже ответа на специфическое лечение.
Интереснейшая область исследования, которая открывается благодаря ПЦР–диагностике, – изучение латентной инфекции M. tuberculosis. По современной концепции туберкулезной инфекции, из 100 человек, контактирующих с M. tuberculosis, 90 могут быть инфицированы, но только у 10 развивается активная болезнь. У остальных 90% инфекция будет оставаться латентной из–за противотуберкулезного иммунитета. Положительные ответы ПЦР при отрицательных результатах посевов патологического материала отмечаются у 55% лиц, подвергавшихся бытовым контактам с M. tuberculosis, и у 80% лиц, у которых туберкулез протекал без рентгенографических проявлений. Проведение ПЦР–исследований у пациентов из групп риска выявляло больных с отрицательными результатами микроскопии и посевов, но с субклинической инфекцией M. tuberculosis [11]. Подобные результаты были получены и в наших исследованиях [6].
Определение лекарственной устойчивости микобактерий
Для определения лекарственной устойчивости микобактерий используется несколько групп методов (табл. 2). По приказу № 558 МЗ РФ от 1978 г. в бактериологических лабораториях России используется метод абсолютных концентраций. В лаборатории ЦНИИТ РАМН внедрен ускоренный метод по тестированию нитратредуктазной активности микобактерий с помощью реактива Грисса.
В крупных противотуберкулезных центрах используются методы определения лекарственной устойчивости в жидких средах с автоматизированной радиометрической и флюоресцентной системой учета роста микобактерий типа ВАСТЕК, позволяющие сокращать срок анализа до 14 дней.
В последнее время разрабатываются новые методы оценки лекарственной устойчивости на уровне генотипа [10]. Работа по изучению молекулярных механизмов резистентности показала наличие у микобактерий генов, связанных с устойчивостью к различным препаратам: к изониазиду – гены katG, inhA, kasA, к рифампицину – rpoB, к стрептомицину – rpsL и 16SрРНК, к этамбутолу – emb1, к фторхинолонам – gyrA и т.д. [7].
Широкомасштабные исследования по изучению спектра мутаций в геноме устойчивых микобактерий показали, что наиболее распространенными были мутации в 531, 526 и 516 кодонах rpoB гена, устойчивость к изониазиду характеризовалась мутациями в 315 кодоне katG гена. В целом спектр мутаций не отличался от выявленных исследователями в разных регионах мира [2].
Доступность данных по молекулярной основе лекарственной устойчивости к противотуберкулезным препаратам дала возможность разработки новых, основанных на ПЦР, методов, представленных в табл. 2. Наши работы, проведенные совместно с Институтом физико–химической медицины МЗ РФ и Институтом молекулярной биологии РАН, продемонстрировали перспективность использования молекулярно–генетических методов для быстрого определения лекарственной устойчивости [1, 3, 4].
Наибольшие надежды по совершенствованию методов для определения лекарственной устойчивости микобактерий связаны с развитием микрочиповой технологии, позволяющей определять устойчивость одновременно к нескольким противотуберкулезным препаратам микобактерий непосредственно из диагностического материала в течение 2 дней [9].
Типирование микобактерий
Комплекс методов имеется и для типирования микобактерий, когда используются традиционные культуральные и биохимические методы, биологические, а также молекулярно–генетические (табл. 3). На основе молекулярно–генетического типирования микобактерий интенсивно развивается область молекулярно–эпидемиологических исследований, в которой по генотипу микобактерии выявляются очаги и прослеживаются пути распространения туберкулезной инфекции [5, 8].
2. Генерозов Э.В. и др. Молекулярная характеристика полирезистентных клинических штаммов Mycobacterium tuberculosis из России. // Молекулярная генетика, микробиология и вирусология, 2000; 1: 11–7.
3. Генерозов Э.В.и др. Детекция и характеристика мутаций в rроВ гене резистентных к рифампицину клинических штаммов Mycobacterium tuberculosis. // Проблемы туберкулеза, 1999; 2: 39–42.
4. В.М. Михайлович и др. Использование методов гибридизации и ПЦР на специализированном ТБ–микрочипе для обнаружения рифампицин–резистентных штаммов Mycobacterium tuberculosis // БЭБ и М, 2001, 1: 112–7.
5. Черноусова Л.Н.и др. Молекулярная эпидемиология туберкулеза в тюрьмах. // Актуальные проблемы пенитенциарной медицины. Мат–лы международной научно–практич. конференции, Минск, 2001: 48–50.
6. Черноусова Л.Н., Ларионова Е.Е., Севастьянова Э.В., Голышевская В.И. Роль ПЦР–анализа в комплексных бактериологических анализах во фтизиатрии. // Проблемы туберкулеза, 2001; 3: 58–60.
Читайте также:

