Материнская смертность от сепсиса
Обновлено: 24.04.2024
Кафедра акушерства и гинекологии Центра повышения квалификации и последипломной подготовки специалистов Омской государственной медицинской академии
Синдром системного воспалительного ответа в акушерской клинике: решенные вопросы и нерешенные проблемы
Кафедра акушерства и гинекологии Центра повышения квалификации и последипломной подготовки специалистов Омской государственной медицинской академии
Статья посвящена чрезвычайно важной и трудноразрешимой в акушерстве проблеме — синдрому системного воспалительного ответа, играющему значимую роль при большинстве осложнений беременности и родов. С позиций положений доказательной мировой медицины и рекомендаций ВОЗ, рассмотрены патогенетические аспекты синдрома, этапы возникновения, стадии процесса при основных акушерских осложнениях. Обращено внимание на решенные вопросы клинической и лабораторной диагностики системной воспалительной реакции с исходом в синдром дисфункции эндотелия. Представлены лечебная тактика и перспективы коррекции системного воспалительного ответа, а также дискуссионные проблемы синдрома.
Кафедра акушерства и гинекологии Центра повышения квалификации и последипломной подготовки специалистов Омской государственной медицинской академии
В настоящее время в структуре причин материнской смертности в мире инфекционные факторы находятся на третьем месте и обусловливают до 15% всех материнских потерь. В России доля материнской смертности, причиной которой является акушерский сепсис, составляет 3,5%, однако с учетом наблюдений, связанных с абортами, эта цифра достигает 10%. За последние 5 лет в России летальность от сепсиса увеличилась на 25%.
Известно, что в основе понимания сепсиса и септического шока (СШ) лежит синдром системного воспалительного ответа (ССВО). Термин был введен в клиническую практику в 1991 г. R. Bone для целей унификации и систематизации этапов инфекционного процесса.
ССВО (Sirs — systemic inflammatory response syndrome) — неспецифическая реакция организма на инфекционные и неинфекционные агенты; скрининговая категория, характеризующаяся несколькими критериями (достаточно двух): гипертермией (гипотермией), тахикардией, тахипноэ, лейкоцитозом (лейкопенией).
К настоящему времени известны этапы развития ССВО, возможной бактериальной транслокации, полиорганной недостаточности (ПОН). Изучено влияние синдрома на гемостаз, развитие тромбофилических состояний. В то же время проявления ССВО применительно к различным осложнениям в акушерской клинике изучены недостаточно. В лечебной тактике также пока не получили отражения в достаточной мере и патофизиологические изменения, происходящие в процессе прогрессирования ССВО [1—3].
Известно, что основу патогенеза ССВО составляет генерализованная продукция провоспалительных цитокинов (преимущественно фактор некроза опухоли — TNF-α, IL-16, IL-6, IL-8, IL-10). При этом ведущая роль в синдроме дисфункции эпителия (СДЭ) принадлежит TNF-α и IL-6 [4, 5]. В основе нарушения баланса про- и противовоспалительных цитокинов, запускаемого рядом триггерных факторов, весьма значимая роль, вероятно, принадлежит генетической детерминированности. При небольшой агрессивности инициирующего агента (физиологическая беременность) активность цитокинов уравновешивается их антагонистами, и процесс останавливается на этой фазе. При преобладании активности цитокинов ситуация прогрессирует, в кровотоке возрастает содержание острофазовых белков и цитокинов, неуклонно повышается уровень TNF и эндотоксина [6—8]. Особая роль в патогенезе сепсиса принадлежит TLR (толл-подобным рецепторам), способным распознавать практически все основные типы патогенных агентов.
Беременность, несомненно, является состоянием умеренно выраженного (компенсированного) воспалительного ответа и окислительного стресса, что подтверждается обнаружением маркеров воспаления и свободных радикалов в системной циркуляции, повышением уровня активности супероксиддисмутазы и продуктов перекисного окисления липидов [9, 10]. У здоровых беременных выявляется активация комплемента, являющаяся частью нормальной острофазовой реакции на беременность; наблюдаются гранулоцитоз, моноцитоз, изменение активности лейкоцитов, повышение уровня циркуляции эндотелиоцитов, провоспалительных цитокинов.
Процессы воспаления выполняют интегральную роль в динамике беременности, при созревании шейки матки, разрыве плодных оболочек и регуляции маточных сокращений. Ближе к родам в амниотической жидкости нарастает количество провоспалительных цитокинов, простагландинов. Увеличивается синтез TNF-α в амнионе, хорионе, децидуальной оболочке, наиболее выраженный при хориоамнионите и преждевременных родах, особенно ассоциированных с бактериальным вагинозом. В шейке матки происходит привлечение субпопуляций лейкоцитов, макрофагов, нейтрофилов. Лейкоцитоз в пределах миометрия и синтез цитокинов играют важную роль в регуляции родовой деятельности и ее прогрессировании. Миометрий также участвует в создании локального провоспалительного статуса в родах. Полагают, что изменение функции противовоспалительных цитокинов во время родов (понижение их активности) вырабатывалось эволюционно при нормальной активации воспалительного процесса, необходимого для физиологического родового акта.
Фундаментальные исследования установили, что системное воспаление играет ключевую роль в развитии значительно большего количества процессов, чем считалось ранее. ССВО участвует в ситуациях привычной потери беременности (ППБ), преждевременного излития околоплодных вод (ПИОВ), эмболии амниотической жидкостью (ЭАЖ), развитии преэклампсии (ПЭ), HELLP-синдрома, острого гнойного гестационного пиелонефрита, ДВС-синдрома, антифосфолипидного синдрома, метаболического синдрома, синдрома недостаточности плаценты [11—13].
Многолетние исследования на нашей кафедре [14—16], посвященные изучению септических осложнений абортов и острого пиелонефрита у беременных, проводились с помощью оценочных шкал APACHE II, SAPS и SOFA [17—19]. Отмечено, что у больных после аборта с ССВО-3, уменьшение показателя APACHE II с 8,6 до 6,5 балла на 3-и сутки послеоперационного периода свидетельствовало о возможном выздоровлении практически на 100%. У больных с ССВО-4 снижение этого показателя с 12,2 до 8,4 балла соответствовало благоприятному прогнозу заболевания. Полагаем, что для более тяжелого септического шока благоприятным прогностическим признаком следует считать снижение данных показателей до 8,1±0,3 балла (тяжелый сепсис) и 10,1±0,5 балла (септический шок) к 7-м суткам послеоперационного периода. Полученные данные свидетельствуют о прогностической значимости системы APACHE II при ССВО и сепсисе у больных с септическими осложнениями абортов.
На кафедре совместно с урологами [15] проводилось также обследование беременных с острым серозным гестационным пиелонефритом (ОСГП), острым гнойным недеструктивным и деструктивным гестационными пиелонефритами (ОГНГП и ОГДГП) — соответственно 500, 615 и 60 пациенток.
В 1-й группе преобладали больные с ССВО-1; признаки генерализации инфекции отсутствовали. Во 2-й группе основную массу составляли беременные с ССВО-2, реже — с ССВО-3, констатируя проявление начальных признаков генерализации инфекции. В 3-й группе больные с ССВО-3 составили 43,7%, с ССВО-4 — 46,9%, с тяжелым сепсисом — 10,2%, септическим шоком — 3,2%, т. е. присутствовали явные признаки генерализации инфекционного процесса. При относительно нетяжелых формах ОСГП быстрое начало терапии позволяло блокировать развитие ССВО. В этой группе только 2% пациенток имели признаки ССВО-2.
При ОГНГП исходно однозначные показатели, характеризующие состояние организма в процессе лечения, приобретали достаточно выраженные достоверные различия (по шкалам SAPS и SOFA). Через 3 сут после начала терапии у 9,5% пациенток с ОГНГП появлялись признаки ССВО-3; в процессе лечения у больных этой группы более длительно сохранялись признаки ССВО и высокие показатели интоксикации. При этом острый гнойный деструктивный пиелонефрит осложнялся развитием ССВО-3 (начальная фаза ceпcиca), ССВО-4 (сепсиса), тяжелого сепсиса (ССВО-4+ПОН) и септического шока. Регистрировался переход ССВО-3 в ССВО-4 (соответственно — 8,6 и 2,2%), ССВО-4 — в тяжелый сепсис и септический шок (соответственно 12,3 и 3,3%).
Итак, тактика лечения септических осложнении ОГП с позиций оценки ССВО зaключается в постоянном отборе пациенток на всех этапах лечения. На первом этапе выявляются больные с риском генерализации инфекционного процесса, на последующих этапах определяется вероятность возникновения осложнений. По динамике индексов тяжести SAPS и SOFA можно прогнозировать течение и исход воспалительного процесса, определять время прекращения интенсивной терапии, а коррекция и своевременное решение вопроса об адекватной терапии ОГП и его осложненных форм с позиции теории ССВО являются реальным резервом снижения частоты рецидивов заболевания и тяжелых осложнений.
Как известно, патогенез преэклампсии включает три основные составляющие [20, 21]: ишемию плаценты, тотальную дисфункцию эндотелия как результат формирования ССВО; плацентарные факторы, обеспечивающие взаимосвязь между локальной гипоксией плаценты и развитием СВО. Это связующее звено, т. е. так называемый фактор X, пока остается загадкой. По мере усугубления тяжести процесса возрастает концентрация цитокинов (в 5—7 раз) и эндотоксина; за 10—12 нед до клинических проявлений преэклампсии повышается экспрессия эндотелиальных молекул адгезии ICAM-1, свидетельствуя о непосредственном их участии в регуляции воспалительного ответа.
В практике акушерства известно также, что рост концентрации TNF-α и интерферона ассоциируется с преждевременными родами, а снижение провоспалительных цитокинов (IL-4, IL-10) — со спонтанными выкидышами в I триместре беременности. Присоединение при тяжелой преэклампсии HELLP-синдрома, ДВС-синдрома свидетельствует о крайней степени активации процессов системного воспаления и повреждении органов [19—22].
В 1997 г. R. Gomez и соавт. [23] была доказана взаимосвязь повышения концентрации IL-6 с такими процессами у новорожденных, как респираторный дистресс-синдром, неонатальный сепсис, пневмония, внутричерепные кровоизлияния, перивентрикулярная лейкомаляция, дерматиты, церебральные параличи, бронхолегочная дисплазия, анте- и интранатальная гибель доношенного плода [24].
Исходя из сложности развития ССВО и синдрома полиорганной недостаточности при акушерских осложнениях и иных тяжелых патологических процессах, понятно, что терапевтические воздействия на какой-либо отдельный компонент патогенеза не в состоянии прервать каскад патологии. В настоящее время представляются перспективными следующие аспекты терапии ССВО:
1. Антиэндотоксиновая терапия: гипериммунная плазма, иммуноглобулины, эдобакомаб — Ig к липиду А, BPI — протеин. В этом плане имеется ряд ограничений. Во-первых, причиной ССВО может быть повреждение тканей любой этиологии, а не только грамотрицательными микроорганизами. Во-вторых, эти препараты оказывают эффект лишь в начальной стадии заболевания. В дальнейшем при активации провоспалительного каскада включаются многочисленные патологические процессы, приводящие уже к необратимым органным нарушениям.
2. Ингибиторы цитокинового каскада: антитела к IL-8; пентоксифиллин; фосфодиэстераза; плазменные рецепторы цитокинов; антагонисты TNF-α. Пентоксифиллин, подавляя TNF-α, тормозит активацию лейкоцитов, уменьшает их способность к продукции свободных радикалов кислорода, препятствуя повреждению легочной ткани. При эндотоксиновом шоке он увеличивает выживаемость пациентов.
3. Регуляторы свертывающей системы крови: дротрекогин-альфа; тифакогин; ингибиторы PAF; антагонист брадикинина — делтибант; протеины С и S; антитромбин III. Известно, что управление по контролю за качеством пищевых продуктов и лекарственных препаратов США одобрило дротрекогин-альфа для лечения больных с тяжелым сепсисом, как и применение антагониста брадикинина — делтибанта.
4. Ингибиторы активности лейкоцитов: дифенилен йодониумхлорида (DPI); староспорин. Применение этих препаратов, блокирующих процессы активации нейтрофилов, возможно в качестве метода терапии ССВО, снижая продукцию NO в легочной ткани и уменьшая спазм сосудов легких.
5. Антиоксиданты: витамин Е, N-ацетилцистеин. Хороший результат получен при проведении клинических испытаний эффективности N-ацетилцистеина; применение витамина Е уменьшает интенсивность ПОЛ, снижая летальность при сепсисе.
6. Антагонисты TNF-α (антицитокиновая терапия): этанелсепт, анакинра, инфлиексимаб.
7. Антитела к СD-20: ритуксимаб.
В настоящее время, несмотря на достаточно разносторонние и глубокие исследования проблемы ССВО, многие вопросы Sirs, в акушерстве в том числе, остаются нерешенными. Очевидно, что абсолютизировать результаты определения содержания в крови любого из биомаркеров нельзя. Их необходимо соизмерять с конкретной клинической ситуацией и спецификой течения болезни. Уровень любой эндогенной субстанции определяется реактивностью макроорганизма, характером возбудителя, локализацией очага инфекции, а также временем от начала заболевания до забора материала и т. д.
Низкая специфичность критериев СВР послужила причиной разработки подходов к дифференциальной диагностике синдрома инфекционного и неинфекционного генеза. Используемая с этой целью стандартная микробиологическая диагностика требует времени (не менее 48 ч), а в большинстве случаев и более длительного срока. Кроме того, на ее результаты могут влиять предшествующая антибактериальная терапия, трудности или дефекты забора биологического материала.
Нередко у пациентов, нуждающихся в длительном пребывании в отделении реанимации и интенсивной терапии и использовании инвазивных методов органосистемной поддержки, возникают проблемы, связанные с клинической интерпретацией выделенного микроорганизма — разделением процессов инфекции и колонизации [22].
Дополнением к диагностической концепции сепсиса, предложенной И.В. Давыдовским [26], может служить концепция PIRO (ПИРО), которая характеризует предрасположенность к инфекции (Р), описывает особенности локализации и этиологии первичного инфекционного очага (I), системную реакцию организма ® и наличие органной дисфункции (О). Подобный подход дает интегральную оценку конкретной клинической ситуации, объединяя исходные особенности пациента, микроорганизма и результат их взаимодействия.
Важнейшей проблемой является согласованность сроков диагностики, методов оценки клинических проявлений процесса. Как мы должны учитывать клиническую картину Sirs? По максимальному отклонению от каждого из отдельных показателей в течение суток заболевания или иметь в виду одновременно все четыре классических критерия? Не совсем ясно, когда должен выноситься первичный диагноз больному — при поступлении в стационар, после операции или в иные сроки? Достаточно остро стоит вопрос о регистрации больных с сепсисом. Если в клинике выносится этот диагноз, то как он должен учитываться, каковы должны быть мероприятия, каковой должна быть реакция эпидемиолога?
Остается не ясным вопрос о том, каким образом правильно описать распространенность инфекции — как диссеминацию (бактериемию) или как генерализацию? Если как бактериемию — не совсем верно, ибо она — событие весьма частое, наблюдается транзиторно при большинстве инфекций и манипуляций. Следовательно, это генерализация инфекционного процесса, поскольку любое интенсивное воздействие на организм с генерализацией макрофагов способно обусловить картину септического шока (СШ). Поэтому такой подход на уровне ВОЗ привел, по-видимому, к исключению СШ из понятия сепсиса как генерализованной инфекции. Вопрос унификации классификации в этом случае не просто академичен, а напротив, имеет исключительное значение для практики реанимационно-анестезиологических отделений. При С.Ш. определяющее значение приобретает терапия собственно шока как такового, когда порою антибиотики могут лишь ухудшить состояние пациента ввиду еще большего высвобождения дополнительного количества эндотоксинов.
Вопрос о септицемии также сложен. Эта форма инфекции без гнойных метастазов с гемолизом, васкулитами, интерстициальным воспалением в отдельных органах, т. е. с проявлениями гиперчувствительности замедленного типа (чаще при грамотрицательной флоре). Гнойные метастазы при этом могут отсутствовать по причине их малой величины либо они не успевают образоваться, а организм еще не способен к лейкоцитарной реакции. Следовательно, определению генерализованной инфекции отвечает лишь септикопиемия.
Важнейшей проблемой организационного плана остается несогласованность критериев диагностики ССВО с патологоанатомическими службами, которые порою, не учитывая современных представлений о клинических симптомах, выносят в диагноз только септицемию.
Остро стоит вопрос и о квалификации врачей хирургического профиля в этом плане. Известно, что более 20 лет в США существует общество специалистов по хирургической инфекции, более 15 лет — Европейское общество по данному профилю. В то же время в отечественном здравоохранении в системе первичной подготовки врачей этому уделяется внимание в основном лишь в циклах хирургии. Тематические усовершенствования в системе непрерывного медицинского образования по акушерству и гинекологии не всегда целенаправлены на хирургическую (в том числе послеродовая) инфекцию; крайне редки, к сожалению, и не всегда пользуются популярностью эти циклы среди администрации стационаров, а недостаток знаний в этой области — основная причина многих клинических неудач.
Итак, дискуссионными вопросами данной проблемы остаются: дефиниции; уточнение механизмов патогенеза эндо- и экзотоксического видов шока; прогрессирование синдрома дисфункции эпителия в отсутствие (или недостаточной выраженности) гнойно-воспалительной реакции; патогенетические аспекты коррекции дисфункции эндотелия при ССВО; организационные моменты.
Расширение границ понимания данной патологии, углубление знаний о механизме процесса открывают перспективы усовершенствования методов диагностики и терапии многих тяжелых осложнений в акушерской клинике; дальнейшее изучение роли системного воспаления позволит проводить прегравидарную подготовку и коррекцию возможных тяжелых осложнений гестационного периода на ранних этапах.

Представлены результаты анализа материнской смертности от сепсиса за период 1996-2004 г. по Санкт- Петербургу. Показатель материнской смертности от сепсиса составил за эти годы 12,4 на 100 000 живорожденных детей. Установлено, что в большинстве случаев заболевание развивается на неблагоприятном соматическом фоне, высокой отягощенности гинекологической патологией и осложненным акушерским анамнезом. Отмечено начало заболевания еще во время беременности в виде преморбидного состояния или синдрома системной воспалительной реакции у большинства больных. Учет этих моментов в сочетании со своевременным диагнозом и своевременной медицинской помощью - единственный путь в решении задачи снижения материнской смертности от сепсиса.
Ключевые слова
Полный текст
В структуру материнской смертности (МС) Санкт-Петербурга последних лет вносят наиболее существенный вклад экстрагенитальные заболевания и сепсис.
Среди прямых причин МС в 1991-2004 гг. сепсис составил 12,4, тогда как гестоз - 4,3, а кровотечения совместно с разрывом матки - 3,9 на 100 000 живорожденных детей.
Отечественные сепсологи [2, 4] основное внимание обращают на стадии восходящего инфекционно-воспалительного процесса, выделяя фазы септицемии, пиемии (сепсис с метастазами) и септикопиемии (смешанная форма).
- Синдром системной воспалительной реакции
- Сепсис
- Тяжелый сепсис
- Септический шок
Синдром системной воспалительной реакции - это состояние, характеризующееся двумя или более из следующих признаков:
- гипер- или гипотермия;
- увеличение частоты сердечных сокращений;
- напряжение функции внешнего дыхания;
- изменения числа лейкоцитов или состава нейтрофильных гранулоцитов.
Следующая стадия - стадия сепсиса отличается от синдрома системной воспалительной реакции только подтверждением наличия инфекционного процесса.
Тяжелый сепсис обозначает состояние неадекватной перфузии, признаки которой связаны с развитием полиорганной недостаточности. Это состояние мало чем отличается от заключительной стадии септического шока.
Следует отметить определенную теоретизированность такой классификации с мало оправданным выделением некоторых стадий. Как известно, сепсис отличает бурное течение с быстрым развитием септического шока, что особенно характерно для случаев из акушерской практики. Очевидное объяснение этому - массивная инвазия бактерий и их токсических продуктов в сосудистую сеть из беременной матки, особенно при ее сокращении. Такие патофизиологические особенности развития септицемии фактически отсутствуют при любой другой локализации первичного очага инфекции.
Представляется очень спорной оценка сепсиса только как послеродового заболевания: настоящий анализ материнской смертности свидетельствует, что в подавляющем большинстве случаев инфекционный процесс развивался уже во время беременности. Поэтому акцент на послеродовом периоде может способствовать несвоевременному началу лечения.
В силу стертости, атипичности течения просматривается не только синдром системной воспалительной реакции, но и развитие сепсиса, который у беременных часто скрывается за диагнозами: ОРВИ, обострение тонзиллита, острый бронхит, пневмония и др.
Из 15 случаев сепсиса с летальным исходом в 1996-2004 гг., связанных с беременностью и послеродовым периодом (без учета 10 погибших при аборте), семь умерли от сепсиса, осложнившего беременность и протекавшего фактически только во время беременности. У восьми сепсис расценен как послеродовое заболевание, хотя клинические признаки развивающегося инфекционно-воспалительного процесса во время беременности имелись у семи из них, в том числе лихорадка за несколько дней до родоразрешения у двух женщин. Характерно, что послеродовой сепсис всегда протекал в форме септицемии, отличался катастрофически быстрым переходом в стадию бактериальнотоксического шока и синдрома ДВС, а затяжное течение заболевания с образованием гнойных очагов наблюдалось только в случаях септического процесса во время беременности.
Эти данные позволяют считать, что в целях своевременного диагноза и быстрой помощи пациенткам целесообразен пересмотр взглядов на сепсис как на заболевание только послеродового периода.
Кроме того, у беременных женщин необходимо учитывать:
- факторы риска развития септической инфекции;
- преморбидное состояние или состояние предболезни, которое определяется по появлению начальных клинико-лабораторных признаков развивающегося воспаления;
- клинические стадии процесса и варианты его течения: септикопиемия, септицемия, перитонит, бактериально-токсический шок.
Факторы риска достаточно четко свидетельствуют о нездоровье организма к моменту зачатия и развития беременности. В некоторой степени они могут смешиваться с симптомами преморбидного состояния.
Анализ факторов риска выявил одну характерную, но неожиданную особенность: сопутствующая соматическая, гинекологическая заболеваемость, осложненный акушерский анамнез были по ряду параметров достоверно хуже в случаях послеродового сепсиса по сравнению со случаями сепсиса во время беременности. Так, у каждой больной с преимущественной клиникой сепсиса после родов в среднем отмечено более двух сопутствующих соматических заболеваний и особенно часто - сопутствующие инфекционно-воспалительные процессы или их наличие в анамнезе. То же касается гинекологических заболеваний, особенно инфекций, передающихся преимущественно половым путем (ИППП) (табл.1).
Факторы риска развития гнойно-септической инфекции у беременных женщин
Сепсис при беременности
Сепсис после родов
Всего соматических заболеваний
Имели гинекологические заболевания
В том числе ИППП
Воспалительные заболевания придатков матки
Отягощенный акушерский анамнез
ИППП как фактор риска послеродовых заболеваний все же недостаточно учитываются в акушерской практике. Между тем рядом отечественных авторов четко показано, что эти инфекции, состояния дисбиоза, способствуя нарушению местной иммунно-резистентности, облегчают внутриматочную колонизацию аэробными и анаэробными микроорганизмами [1, 5, 6].
Значимый индикатор возможных проблем беременности - отягощенный акушерский анамнез. Он встретился у 6 из 7 имевших в прошлом беременности в группе послеродового сепсиса. Обращает на себя внимание тяжесть имевшихся осложнений: помимо самопроизвольных абортов, преждевременных родов, гестоза, кровотечений, антенатальных потерь, отмечены ПОНРП, в двух случаях операция кесарева сечения с осложненным послеоперационным течением, расхождением швов, бактериальнохламидийный плацентит и др.
Все указанные факторы риска можно отнести к индикаторам неблагополучия и неготовности женского организма к наступлению беременности.
Значение учета факторов риска или факторов прогноза возрастает, если в процессе беременности развивается преморбидное состояние.
Выявлено несколько клинических признаков преморбидного состояния:
- Угроза прерывания беременности, которая иногда сочетается с многоводием, иногда - с преждевременным излитием околоплодных вод. О значении данного признака свидетельствует тот факт, что в связи с угрозой невынашивания на протяжении беременности были госпитализированы, в том числе неоднократно, шесть из 15 женщин, причем в пяти случаях - из группы развития сепсиса после родов. Это же осложнение, иногда в сочетании с многоводием, преждевременным излитием вод, оказалось причиной госпитализации пяти пациенток непосредственно перед родоразрешением. Как известно, при развитии воспаления мигрирующие в его очаг нейтрофильные гранулоциты способствуют разрушению коллагена и тем самым - преждевременному созреванию шейки матки, разрушению структур оболочек. Другой механизм - выделение колонизированными бактериями фосфолипазы А2, влияющей на освобождение арахидоновой кислоты с запуском простагландинового цикла в маточно-плодовых структурах и последствиями в виде излития околоплодных вод и прерывания беременности.
- Прогрессирующая, иногда выраженная железодефицитная анемия (Нb80-100г/л), мало поддающаяся лечению железосодержащими препаратами.
- Тенденция к артериальной гипотензии (АД 94/52-103/55 мм рт. ст.).
- Тенденция к увеличению числа лейкоцитов (в среднем - 10-11 × 109/л с колебаниями в одних и тех же случаях от 10 до 15 × 109/л).
- Тенденция к увеличению незрелых форм нейтрофильных гранулоцитов - палочкоядерных клеток, появлению метамиелоцитов (юных) и других форм, что в отдельных случаях наблюдалось на протяжении всей беременности. Как известно, величину левого сдвига оценивают по отношению числа сегментоядерных к числу незрелых форм нейтрофилов. В норме это отношение равно 15-17, при развитии преморбидного состояния у беременных оно оказалось в два раза меньше, т.е. 7-8. Если учесть бактерицидные свойства нейтрофилов с выделением токсичных для микроорганизмов компонентов, то такая тенденция является четким сигналом начала развития инфекционно-воспалительного процесса.
- Активизация системы гемостаза со снижением числа тромбоцитов (150-170 × 109/л) и увеличением концентрации фибриногена (4,5-5,5 г/л). Воспаление и повреждение тканей индуцирует биосинтез фибриногена в печени, который является маркером воспалительного процесса.
- Клинико-лабораторные признаки нарушения функции почек: снижение относительной плотности мочи, протеинурия, лейкоцитурия, повышение концентрации креатинина (более 100 мкмоль/л).
- Признаки нарушения углеводного обмена: усиленная жажда, жалобы на зуд в области гениталий, кандидоз, наличие крупного плода, ожирение.
- Гипопротеинемия и гипоальбуминемия как следствие повышенной проницаемости периферического сосудистого русла.
В большинстве случаев указанным симптомам не придавали должного значения и, следовательно, не проводили дополнительного обследования как в женских консультациях, так и в отделениях патологии беременности. По поводу осложнений в разные сроки беременности получили дородовое стационарное лечение 8 из 15 погибших женщин. Общее число госпитализаций у них составило 16 (от 1 до 3), не считая последнего, заключительного поступления в стационар. На заключительном этапе в отделения патологии беременности были госпитализированы 8 женщин, остальные поступили в связи с началом родов. Общее число дней, проведенных в стационарах до момента родов или смерти еще до начала родов, составило у погибших более 300, что позволяет делать определенные выводы о качестве оказываемой в них врачебной помощи, включая обследование, диагностику, подходы к лечению осложнений беременности и экстрагенитальных заболеваний.
Выше отмечено, что вариант септикопиемии встретился у 5 из 7 женщин с сепсисом во время беременности и ни в одном случае послеродового заболевания. Фактически у всех больных септикопиемией источником сепсиса оказались экстра- генитальные очаги: легкие (абсцедирующая пневмония), кожа (фурункулы, раневые поверхности), сосуды (ангиогенный сепсис у героиновых наркоманок). Отмечены следующие особенности течения септикопиемии:
- Несмотря на полимикробный характер возбудителей сепсиса - это группа энтеробактерий (Escherichiacoli,Klebsiellapneumonia, Proteus vulgaris и другие грамотрицательные бактерии, кроме них - Staphylococcus aurens, Staphylococcus epidermididis, Streptoccpocus faecalis, Streptoccpocus viridans, неспорообразующие анаэробы и др.), можно заметить четкую связь септикопиемии со стафилококковой флорой и особенно - Staphylococcus aurens. Известно, что золотистый стафилококк - наиболее частый возбудитель кожных инфекций, в случаях бактериемии способствует развитию абсцедирующих пневмоний, менингита, эндокардита. Развитие эндокардита было характерно и для инфицирования эпидермальным стафилококком. С одним из двух видов золотистого стафилококка - коагулазопозитивным связано образование тромбов. Такой вариант течения сепсиса отмечен и у беременных женщин: наличие септических тромбов, инфарктов и абсцессов в легких, ТЭ ветвей и разветвлений легочной артерии, наличие множественных септических тромбоэм- болов в миокарде, эндокарде, с развитием полипозно-язвенного эндокардита, диффузно-очагового гнойного миокардита, фибринозно-гнойного перикардита, наличие множественных абсцессов в печени, почках, селезенке, мозге с развитием гнойного менингоэнцефалита, тромбоэмолических инфарктов с массивными вторичными кровоизлияниями в разных отделах мозга.
- Ни в одном случае септикопиемии не отмечено развития бактериально-токсического шока или клинической стадии синдрома ДВС. Концентрация фибриногена, ФА, тромботест у больных септикопиемией отражали состояние гиперкоагуляции, что также подтверждает влияние коагулазопозитивного золотистого стафилококка (табл. 2).
- Выше отмечено, что в случаях сепсиса во время беременности, то есть септикопиемии, был благополучнее акушерский анамнез, реже - сопутствующая соматическая патология. Течение септикопиемии отличали длительность (в среднем 7-8 недель), интермиттирующий характер с периодами некоторого улучшения, повторными ознобами, лихорадкой, образованием новых гнойных метастазов и всегда - тяжелое повреждение плодово-плацентарного комплекса, о чем свидетельствуют 4 мертворождения и состояние гипотрофии у двух живых новорожденных.
Таблица 2. Показатели коагулограммы у больных септицемией и септикопиемией
Сепсис новорожденных – генерализованная гнойно-септическая инфекция, характеризующаяся наличием первичного очага и циркуляцией инфекции в крови. Сепсис новорожденных проявляется признаками инфекционного токсикоза (температурной реакцией, вялостью, диспепсией, землистой окраской кожных покровов) и образованием гнойных метастатических очагов в различных органах (мозговых оболочках, легких, костях, печени и пр.). Диагноз сепсиса у новорожденных устанавливается на основании клинических критериев и выделения возбудителя при бактериологическом посеве крови. Лечение сепсиса новорожденных включает системную антибиотикотерапию, санацию первичного и метастатических гнойных очагов, посиндромную терапию.
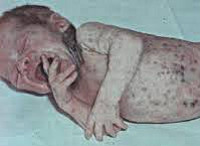
Общие сведения
Сепсис новорожденных – общий инфекционный процесс, обусловленный попаданием условно-патогенной и гноеродной микрофлоры из локальных очагов в кровяное русло и сопровождающийся тяжелыми системными проявлениями. По данным зарубежной педиатрии, частота сепсиса новорожденных составляет 0,1-0,8%; среди недоношенных и детей с перинатальной патологией, находящихся в ОРИТ, - 14%. Неонатальная смертность, обусловленная сепсисом новорожденных, высока и стабильна – около 30-40%. Развитию сепсиса способствуют недостаточная сформированность барьерных механизмов и иммунитета у новорожденных, пограничные состояния периода новорожденности, патологическое протекание перинатального периода, сложность ранней диагностики септических состояний.

Причины
В настоящее время доминирующее место (около 50%) среди возбудителей сепсиса новорожденных принадлежит грамположительной флоре (главным образом, стафилококкам, гемолитическому стрептококку группы А). Чуть реже (до 40% случаев) выявляется грамотрицательная микрофлора (кишечная палочка, синегнойная палочка, клебсиелла и др.); в 10% этиологическими агентами выступает смешанная флора (часто ассоциация стафилококка с грибами Candida).
Со стороны матери факторами, способствующими бактериальной контаминации новорожденного, выступают бактериальный вагиноз, кольпиты, эндометрит. Большое значение имеет степень и характер иммуносупрессии у новорожденного, которые могут быть связаны с неполноценным питанием или приемом лекарств беременной, наследственным иммунодефицитом или ВИЧ-инфекцией. В отдельных случаях причиной вспышек сепсиса новорожденных становится несоблюдение санитарного режима в родильных или детских отделениях.
Классификация
По времени развития выделяют внутриутробный и постнатальный (ранний неонатальный и поздний неонатальный) сепсис новорожденных. Внутриутробный сепсис предполагает антенатальное или интранатальное инфицирование плода; при этом первичный гнойно-септический очаг располагается вне организма ребенка (чаще всего в его роли выступает плацентит, хорионит, хориоамнионит и т. д.). В случае постнатального сепсиса первичный гнойно-воспалительный очаг всегда располагается в организме самого новорожденного.
Ранний неонатальный сепсис новорожденных развивается в первые 4-ро суток жизни ребенка. Клинические течение заболевания обычно молниеносное, с быстрым развитием полиорганнной недостаточности, летальным исходом в 5-20% случаев. Поздний неонатальный сепсис новорожденных манифестирует на 5-й день и позднее. Характеризуется медленно прогрессирующим течением, возникновением вторичных септических очагов, 5-10%-ной летальностью.
Течение сепсиса новорожденных может быть молниеносным (3-7 дней), острым (до 4-8 недель), подострым (до 1,5-3 месяцев), затяжным (более 3 месяцев). С учетом локализации первичного септического очага и входных ворот различают: пупочный, кожный, легочный, ринофарингеальный, отогенный, риноконъюнктивальный, кишечный, урогенный, катетеризационный и др. виды сепсиса новорожденных. Сепсис новорожденных может протекать в форме септицемии или септикопиемии.
Симптомы сепсиса новорожденных
Септицемия или сепсис новорожденных без метастазов обычно развивается на фоне предшествующего мокнущего пупка, конъюнктивита, гнойничковой сыпи, опрелостей, стоматита. Предвестниками сепсиса новорожденных могут выступать вялость или беспокойство, снижение аппетита, обильные частые срыгивания, плохая прибавка в весе. В период разгара развивается температурная реакция (гипер- или гипотермия), отечный синдром или эксикоз, гипотрофия. Характерным признаком сепсиса новорожденных является грязновато-серый (землистый) оттенок кожных покровов, желтушность, мраморность кожи, сыпь.
Вследствие токсического поражения различных органов возникают гепатоспленомегалия, пневмопатия (тахипноэ, цианоз), кардиопатия (тахикардия или брадикардия, артериальная гипотензия), диспепсия, мочевой синдром (олигурия, анурия, ОПН), геморрагический синдром, надпочечниковая недостаточность. Чаще всего септицемия осложняется присоединением пневмонии, которая выступает как самостоятельное интеркуррентное заболевание.
Септикопиемия или сепсис новорожденных с гнойными метастазами характеризуется возникновением на фоне интоксикации вторичных очагов отсева в мозговых оболочках, легких, костях, печени, других органах. Чаще всего септикопиемия протекает с развитием гнойного менингита, абсцедирующей пневмонии, остеомиелита; реже – с формированием абсцесса печени, гнойного артрита, панофтальмита, медиастинита, флегмоны желудка или кишечника. В восстановительном периоде происходит санация пиемических очагов, стихание токсикоза, постепенное восстановление нарушенных функций.
Молниеносная форма сепсиса новорожденных протекает с развитием септического шока: стремительным ухудшением состояния ребенка, снижением температуры тела, брадикардией, кровоточивостью, отеком легких, острой почечной недостаточностью. Летальный исход при молниеносном течении сепсиса новорожденных наступает в течение 3-5 суток.
Диагностика сепсиса новорожденных
Диагноз сепсиса новорожденного может быть заподозрен неонатологом или педиатром на основании лихорадки свыше 3 дней или прогрессирующей гипотермии; гиперлейкоцитоза, сменяющегося лейкопенией; повышением содержания в крови маркеров инфекционного процесса (СРБ, интерлейкина-8, прокальцитонина).
Факт бактериемии при сепсисе новорожденных подтверждается путем посева крови на стерильность. Важное значение имеет выявление первичного гнойного очага и метастатических очагов, микробиологического исследование отделяемого из них (бактериологическое исследование мазка с конъюнктивы, мочи на микрофлору, соскоба/отделяемого с кожи на микрофлору, мазка из глотки, кала на дисбактериоз и т. п.).
Дифференциальная диагностика сепсиса новорожденных осуществляется с локализованными гнойно-воспалительными заболеваниями (пневмонией, медиастинитом, перитонитом, менингитом, энтероколитом), генерализованными вирусными инфекциями (цитомегалией, герпесом, энтеровирусной инфекцией) и микозами (кандидозом, аспергиллезом) и др. Для этого используются дополнительные лабораторные методы – ПЦР, ИФА, микроскопия.
Лечение сепсиса новорожденных
Терапия при сепсисе новорожденных проводится одновременно в нескольких направлениях и включает санацию септического и пиемических очагов, подавление циркуляции возбудителя в крови, коррекцию нарушенных функций.
Основу этиологического лечения сепсиса новорожденных составляет антибиотикотерапия: эмпирическая комбинированная до уточнения характера микрофлоры) и целенаправленная после получения антибиотикограммы. Противомикробные препараты вводятся внутривенно, в максимальных возрастных дозировках в течение 10-15 суток с последующей сменой. Чаще всего в клинической практике для лечения сепсиса новорожденных в различных сочетаниях используются цефалоспорины, аминогликозиды, аминопенициллины, карбапенемы и др.
С целью местного лечения гнойных очагов производится вскрытие фурункулов и абсцессов, перевязки с антибактериальными и ферментными препаратами; назначается УВЧ, СВЧ, электрофорез.
Патогенетическая терапия сепсиса новорожденных включает иммунокоррекцию (плазмаферез, гемосорбцию, введение иммуноглобулинов), проведение дезинтоксикационной терапии (внутривенной инфузии глюкозо-солевых растворов и свежезамороженной плазмы), адекватную кислородотерапию и т. д. При сепсисе новорожденных обязательно проводится мониторинг состояния жизненно-важных функций: АД, ЧСС, ЭКГ, КОС и газового состава крови, биохимических показателей (сахара крови, креатинина, электролитов), гематокрита.
В остром периоде сепсиса целесообразно пребывание новорожденных в кувезе, кормление материнским молоком, тщательный уход. В восстановительном периоде к лечению подключается гимнастика, массаж, лечебные ванны.
Прогноз и профилактика сепсиса новорожденных
Прогноз сепсиса новорожденных серьезный: летальность составляет от 30-40% до 60% среди глубоко недоношенных детей. У выздоровевших детей в отделенном периоде могут отмечаться частые ОРВИ, пиелонефрит, анемия, перинатальная энцефалопатия.
Профилактика сепсиса новорожденных включает выявление и санацию инфекций мочеполовой сферы у беременной, соблюдение противоэпидемических мероприятий медперсоналом родильных домов и отделений новорожденных, тщательный гигиенических уход за новорожденным, естественное вскармливание. Вопрос о сроках вакцинации новорожденных с сепсисом против туберкулеза и против гепатита В , проводимой в первые дни жизни, решается в индивидуальном порядке.
Приведены результаты анализа данных Росстата за 2010 г. и 2014 г. о мертворождаемости и ранней неонатальной смерти вследствие врожденного сепсиса. Cнижение нижней границы времени регистрации мертворождений с 28 недель (2014 г.) до 22 недель (2010 г.) практически не отразилось на частоте врожденного сепсиса. В 2014 г. врожденный сепсис являлся первоначальной причиной смерти в 0,12 % наблюдений мертворождения и в 4,06 % случаев смерти новорожденных в первые 6 дней жизни. Частота летальных исходов от врожденного сепсиса и факторов, способствующих его развитию, варьирует в различных федеральных округах Российской Федерации. Определенную роль в развитии врожденного сепсиса играют инфекционные заболевания матери, а также воспалительные поражения плаценты.

1. Антонова Л.К., Иванов А.А., Кольцова С.Ю., Близнецова Е.А. Дети, родившиеся с экстремально низкой массой тела: клинико-патоморфологические особенности // Тверской медицинский журнал. – 2014. – № 6. – С. 1–8.
2. Арестова И.М., Киселева Н.И., Жукова Н.П., Дейкало Н.С. Диагностика, лечение и профилактика некоторых инфекций, специфичных для перинатального периода. Особенности подготовки к беременности // Охрана материнства и детства. – 2015. – № 1. – С. 41–51.
3. Васильев В.В., Мурина Е.А., Осипова З.А. и др. Врожденные инфекции: пути совершенствования диагностики, лечения и профилактики // Педиатр. – 2010. – № 2. – С. 26–30.
4. Малюжинская Н.В., Петрова И.В., Полякова О.В., Клиточенко Г.В. Особенности заболеваемости недоношенных детей в Волгограде и Волгоградской области // Актуальные проблемы гуманитарных и естественных наук. – 2014. – № 10. – С. 404–406.
6. Мишнев О.Д., Кравченко Э.В., Трусов О.А., Щеголев А.И. Показатели работы патологоанатомической службы взрослой сети лечебно-профилактических учреждения Министерства здравоохранения и социального развития Российской Федерации в 2000-2004 гг. (предварительные данные). – М., 2006. – 100 с.
7. Савельев В.С., Гельфанд Б.Р., Мишнев О.Д., Щеголев А.И. Хирургический сепсис: клинико-патологоанатомические аспекты // Арх. патол. – 2007. – № 4. – С. 59–63.
9. Самсыгина Г.А., Шабалов Н.П., Дегтярёва М.В. Сепсис // Неонатология: национальное руководство / Под ред. Н.Н. Володина. – М.: ГЭОТАР-Медиа, 2009. – С. 673–687.
12. Щеголев А.И., Павлов К.А., Дубова Е.А., Фролова О.Г. Мертворождаемость в субъектах Российской Федерации в 2010 году // Арх. патол. – 2013. – № 2. – C. 20–24.
13. Щеголев А.И., Туманова У.Н., Фролова О.Г. Региональные особенности мертворождаемости в Российской Федерации // Актуальные вопросы судебно-медицинской экспертизы и экспертной практики в региональных бюро судебно-медицинской экспертизы на современном этапе. – Рязань: 2013. – С. 163–169.
14. Di Renzo G.C., Roura L.C., Facchinetti F. et al. Guidelines for the management of spontaneous preterm labor: identification of spontaneous preterm labor, diagnosis of preterm premature rupture of membranes, and preventive tools for preterm birth // J. Matern. Fetal Neonatal Med. – 2011. – Vol. 24, № 5. – P. 659–667.
15. Hyde T.B., Hilger T.M., Reingold A. et al. Trends in incidence and antimicrobial resistance of early-onset sepsis: population-based surveillance in San Francisco and Atlanta // Pediatrics. – 2002. – Vol. 110. – P. 690–695.
16. Leal Y.A., Avarez-Nemegyei J., Velazquez J.R. et al. Risk factors and prognosis for neonatal sepsis in southeastern Mexico: analysis of a four-year historic cohort follow-up // BMC Pregnancy and Childbirth. – 2012. – Vol. 12. – P. 48.
17. Naher H.S., Khamael A.B. Neonatal Sepsis: The bacterial causes and the risk factors // Intern. Res. J. Med. Sci. – 2013. – Vol. 1, № 6. – P. 19–22.
18. Pammi M., Flores A., Leeflang M., Versalovic j. Molecular assays in the diagnosis of neonatal sepsis: A systematic review and meta-analysis // Pediatrics. – 2011. – Vol. 128. – P. e973-e985.
19. Scuchat A., Zywicki S.S., Dinsmoor M.J. et al. Risk factors and opportunities for prevention of early-onset neonatal sepsis: a multicenter case-control study // Pediatrics. – 2000. – Vol. 105. – P. 21–26.
20. Tallur S.S., Kasturi A.V., Nadgir S.D. et al. Clinico-bacteriological study of neonatal septicemia in Hubli // Indian J. Pediatr. – 2000. – Vol. 67. – P. 169–174.
Сепсис, представляющий собой полиэтиологическое инфекционное генерализованное заболевание, развивается из местных очагов инфекции и расценивается, как правило, в качестве осложнения таких заболеваний [7, 10]. В этой связи он не учитывается в отчетах Росстата, что не позволяет оценить истинные показатели заболеваемости и смертности в стране и регионах [6].
Вместе с тем, в клинике выделяют ранний и поздний неонатальный сепсис [8, 9, 18]. Ранний (врождённый) неонатальный сепсис развивается при внутриутробном (антенатальном) и интранатальном инфицировании, когда клинические симптомы появляются в первые 3 суток жизни. Для позднего неонатального сепсиса характерно постнатальное инфицирование, при этом клиническая манифестация происходит позднее 4-го дня жизни.
Цель работы: сравнительный анализ перинатальной смертности от сепсиса в федеральных округах Российской Федерации в 2010 и 2014 годах.
Материалы и методы исследования
В основу работы положен анализ статистических форм А-05 Росстата за 2010 г. и 2014 г., относящихся к мертворождению и ранней неонатальной смертности, без учета Крымского федерального округа. Данные формы А-05 Росстата представляют собой перекрестные таблицы, в которых по горизонтали представлена патология плода или новорожденного (первоначальная причина смерти), а по вертикали – заболевания или состояния матери, осложнения со стороны плаценты, пуповины и оболочек, патология беременности и родов, обусловившие (способствовавшие) наступлению смерти новорожденного плода или новорожденного. Значимость различий оценивали при помощи критерия Хи-квадрат Пирсона, в том числе с поправкой Йейтса, и точного критерия Фишера в зависимости от количественных характеристик.
Результаты исследования и их обсуждение
Согласно данным статистических форм А-05 Росстата за 2014 г., в целом по Российской Федерации в перинатальном периоде умерло 16989, включая 11593 мертворожденных и 5396 умерших в первые 168 часов жизни. Соответственно этому значения показателя перинатальной смертности в Российской Федерации в 2014 г составили 8,83 ‰, показателя мертворождаемости – 6,02 ‰ и показателя ранней неонатальной смертности – 2,82 ‰.
Для сравнения в 2010 г. родилось живыми 1788948 детей, в перинатальном периоде погибло 13248, в том числе было 8300 мертворожденных и 4948 умерших в первые 168 часов. В результате показатели перинатальной смертности, мертворождаемости и ранней неонатальной смертности составляли 7,37 ‰, 4,62 ‰ и 2,75 ‰ соответственно [12, 13]. Более высокие значения показателей в 2014 г закономерно обусловлены внедрением новых критериев рождения (с 22 недель гестации).
Согласно данным Росстата по Российской Федерации за 2014 г., врожденный сепсис фигурировал в качестве основного заболевания только в 14 (0,12 %) наблюдениях среди всех случаев мертворождения (табл. 1). Для сравнения, в 2010 г, когда статистическому учету подлежали мертворожденные на сроке беременности 28 недель и более, врожденный сепсис был расценен как основное заболевание в 12 наблюдениях, что составило 0,16 % от общего количества мертворожденных. То есть истинный врожденный сепсис крайне редко является причиной гибели плода. Примечательно, что в Южном и Северо-Кавказском федеральных округах такие наблюдения вообще отсутствовали в 2014 г (табл. 1). При этом снижение нижней границы времени регистрации мертворождений с 28 недель до 22 недель практически не отразилось на частоте врожденного сепсиса у мертворожденных.
Количество мертворожденных и умерших новорожденных от врожденного сепсиса в федеральных округах РФ в 2010 г. и 2014 г. (общее количество и процент от общего количества)
Читайте также:

