Медицинская паразитология как выглядит токсоплазмоз
Обновлено: 19.04.2024
Обследовано 537 беременных, обратившихся в Городской центр по токсоплазмозу в период с 2010 по 2013 гг и 145 новорожденных. Показано, что токсоплазмоз играет важную роль в акушерско-гинекологической патологии. Обнаружение у женщин токсоплазменных антител
Токсоплазмоз — широко распространенная зоонозная паразитарная инфекция, характеризующаяся полиморфизмом клинических проявлений и значительной вариабельностью течения процесса: от здорового, бессимптомного носительства до тяжелых, летальных форм болезни. Токсоплазмоз несет потенциальную угрозу для плода при заражении им во время беременности. Одним из наиболее распространенных методов профилактики врожденного токсоплазмоза является проведение скринингового серологического обследования беременных на токсоплазмоз и назначение антимикробной терапии и/или прерывание беременности при его выявлении.
Для лабораторной диагностики токсоплазмоза беременных чаще всего применяют серологические методы: реакцию непрямой иммунофлюоресценции (РНИФ), иммуноферментный анализ (ИФА Toxo IgG, IgM). Диагноз подтверждается достоверно нарастающей динамикой показателей этих тестов, их высоким уровнем либо наличием антител класса IgM и изучением их динамики.
Трудности профилактики токсоплазмоза до настоящего времени обусловливаются, прежде всего, отсутствием официально утвержденной национальной программы исследований в данной области, проводимых на современном уровне.
Целью настоящей работы было раннее выявление токсоплазмоза у беременных и новорожденных и обоснование целесообразности использования антимикробной терапии для профилактики врожденной инфекции.
Пациенты и методы проведения исследования
Под нашим наблюдением находилось 537 беременных, впервые обратившихся в Городской центр по токсоплазмозу (ГЦТ) в период с 2010 по 2013 г., в возрасте от 18 до 40 лет (средний возраст составил 27,6 ± 1,34 года), и 145 новорожденных.
Основанием для наблюдения являлся факт обнаружения в сыворотке крови пациентов антител классов IgМ и/или IgG к Toxoplasma gondii и высокие уровни антител в РНИФ.
Основную группу составили 48 беременных с инаппарантным токсоплазмозом и 34 их новорожденных, контрольную группу — 489 беременных, инфицированных токсоплазмами, и 107 их новорожденных.
Для решения поставленных задач проводились клинические наблюдения, комплекс лабораторных и функциональных методов диагностики в динамике у беременных женщин, состоящих под наблюдением у гинеколога женской консультации. У всех беременных тщательно изучался эпидемиологический анамнез. При этом наибольшее внимание уделялось наличию акушерской, гинекологической и соматической патологии, выявлению признаков острого манифестного токсоплазмоза во время беременности и в предшествующие 6 месяцев (субфебрилитет, признаки интоксикации, полилимфаденит, диарейный синдром, артралгии, миалгии и т. д.).
Всем беременным в женских консультациях не менее двух раз проводились ультразвуковое исследование плода (на сроке гестации 9–10 и 28–30 недель) и органов брюшной полости, электрокардиографическое исследование (ЭКГ), общий анализ крови, биохимический анализ крови, коагулограмма, общий анализ мочи. Диагноз токсоплазмоза устанавливался клинически и подтверждался лабораторными тестами: РНИФ и ИФА IgG, IgM. Все исследования проводились в ГЦТ при первичном обследовании, в динамике и по окончании лечения (если оно проводилось).
Помимо исследования крови матери, нами проводилось определение специфических антител IgG и IgM в пуповинной крови новорожденных. Кровь забиралась из сосудов пуповины сразу вслед за ее пережатием и пересечением после родов.
Результаты исследования и их обсуждение
При обработке данных эпидемиологического анамнеза выявлено, что среди факторов риска инфицирования токсоплазмами женщин важную роль играют контакты с домашними животными, в частности с кошками (84,5% случаев контакта), контакт с почвой (работа на загородных дачных участках (56,4% случаев)), употребление термически слабообработанных мясных продуктов (47,6% случаев), а также производственная занятость (23,7% случаев).
У основной группы пациентов инаппарантный токсоплазмоз протекал без клинических проявлений.
Анализ изучения данных гинекологического анамнеза выявил высокую частоту встречаемости хронических воспалительных заболеваний и специфических урогенитальных инфекций, играющих важную роль в этиопатогенезе внутриутробного инфицирования у женщин основной группы по сравнению с контрольной. Частота встречаемости нарушений менструальной функции и бесплодия была значительно выше у беременных, инфицированных токсоплазмами.
Наличие токсоплазменной инфекции оказывает существенное влияние на течение беременности и родов, являясь причиной большинства присоединяющихся впоследствии осложнений и одной из основных причин невынашивания беременности. Отягощенный акушерский анамнез (самопроизвольные выкидыши, замершая беременность, частота медицинских абортов и др.) имел место у 2/3 из числа женщин, инфицированных токсоплазмами. Данные за врожденные пороки развития и раннюю неонатальную смерть отмечены только в группе женщин, инфицированных токсоплазмами.
Анализ результатов ИФА IgG и IgM позволил выделить основную группу беременных с инаппарантным токсоплазмозом и контрольную — беременных, инфицированных токсоплазмами в зависимости от уровня антител: низкими (52–132 ME), средними (135–280 ME) и высокими (280–1000 ME). Высокие уровни токсоплазменных антител IgM регистрировались у женщин с инаппарантной формой токсоплазмоза, а при инфицировании токсоплазмами — не регистрировались.
Уровни антител в реакции непрямой иммунофлюоресценции (РНИФ) определялись в соотношении 1:40, 1:80, 1:160 — у контрольной группы и в соотношении 1:320, 1:640, 1:1280, 1:2560 — у основной группы беременных.
Всем пациентам основной группы назначалась антимикробная терапия со II триместра беременности по схеме: спирамицин 3 млн МЕ в сутки и фолиевая кислота по 1 таблетке 3 раза в день. Длительность лечения определялась индивидуально, в зависимости от снижения уровней токсоплазменных антител и не превышала трех курсов.
Спирамицин — макролидный антибиотик природного происхождения, является эффективным и наиболее безопасным средством лечения токсоплазмоза. Он единственный из антибактериальных препаратов, который может назначаться в ранние сроки беременности без временных ограничений, начиная с первого триместра.
Результаты серологических показателей до лечения и после, а также перед родами представлены в табл. 1 и 2.
При проведении исследования пуповинной крови методом ИФА и РНИФ новорожденных от матерей с инаппарантной формой токсоплазмоза основной группы, получивших курс антимикробной терапии, и новорожденных от матерей, инфицированных токсоплазмами, контрольной группы были выявлены специфические токсоплазменные антитела IgG у 34 детей основной и 107 новорожденных контрольной группы. Токсоплазменные антитела IgΜ не обнаруживались ни у одного ребенка. При этом уровень антител новорожденных соответствовал уровню антител у матери, что связано с передачей антител трансплацентарно.
Полученные результаты динамического наблюдения детей, родившихся от матерей с инаппарантным токсоплазмозом и матерей, инфицированных токсоплазмами, не выявили отставание в физическом, моторном и нейропсихическом развитии.
Контрольное серологическое исследование детей, проведенное в возрасте от 12 месяцев до года, не выявило как специфических антител класса IgM, так и нарастания титров токсоплазменных антител класса IgG, как у детей основной, так и контрольной групп.
На основании наших исследований можно утверждать, что инаппарантный токсоплазмоз должен рассматриваться как фактор высокого риска развития осложнений течения беременности и родов, что в последующем может отражаться на состоянии здоровья ребенка.
Анализируя представленные данные, подтверждается необходимость проведения комплексных лабораторных исследований на токсоплазмоз среди беременных женщин, включающих в себя комплекс серологических методик; представитель природных макролидов спирамицин рассматривается в настоящее время как антибиотик первоочередного выбора в первом триместре беременности при лечении инаппарантного токсоплазмоза матери и профилактике врожденной инфекции плода.
Выводы
- Для определения риска развития врожденного токсоплазмоза при первичном обследовании беременных на ранних сроках, наиболее информативными являются данные эпидемиологического анамнеза (возможность заражения во время беременности) и результаты серологического скрининга РНИФ и ИФА IgM и IgG к Toxoplasma gondii в сыворотке крови.
- Динамика показателей РНИФ и уровней антител IgG и IgM в ИФА служат маркером эффективности проведенной терапии.
- Своевременное выявление токсоплазмоза на ранних сроках беременности и назначение комбинированной этиотропной терапии предотвращает развитие врожденного токсоплазмоза.
- В результате катамнестического наблюдения (продолжительностью до года) за детьми, родившимися от матерей с инаппарантным токсоплазмозом, включенных в исследование, не было выявлено клинико-лабораторных и инструментальных признаков врожденного токсоплазмоза, что свидетельствует о эффективности проводимой медикаментозной профилактики этого заболевания.
Литература
- Лысенко А. Я., Владимова М. Г., Кондрашин А. В., Майори Дж. Клиническая паразитология. Под ред. Лысенко А. Я. Женева, ВОС; 2002.
- Guerina N., Hsu H., Meissner C., Maguire J., Lynfield R., Stechenberg B. et al. Neonatal serologic screening and early treatment for congenital Toxoplasma gondii infection // N Engl J Med. 2004; 330 (26): 1858–1863.
- Беляева Н. М., Зембатова С. Х., Иванова Л. П., Дзуцева Ф. К., Никитина Г. Ю., Борисенко Ю. В. Особенности диагностики и лечения токсоплазмоза у беременных // Лечащий Врач. 2011. № 11. 24–26.
- Peyron F., Wallon M., Liou C., Garner P. Treatments for toxoplasmosis in pregnancy (Cochrane Review). In The Cochrane Library 2003; Oxford: Update Software.
- Лобзин Ю. В., Васильев В. В., Тимченко В. Н., Васильева И. С. Токсоплазмоз беременных: достижения и нерешенные вопросы // Российский медицинский журнал. М., 2001; 37–39.
- О выявлении и профилактике токсоплазмоза в г. Москве: Методические рекомендации. М., 2013.
- Беляева Н. М., Зембатова С. Х., Дзуцева Ф. К. Проблема токсоплазмоза у беременных и новорожденных. Материалы IV Всероссийского Конгресса по инфекционным болезням. М., 2012; 51–52.
Н. М. Беляева*, доктор медицинских наук, профессор
С. Х. Зембатова* , 1
Л. П. Иванова*
Ф. К. Дзуцева**
Ю. В. Борисенко**, кандидат биологических наук
* ГБОУ ВПО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва
** ГЦТ ДЗМ, Москва
Abstract. 537 pregnant women applied to City Toxoplasmosis Center during the period of 2010–2013 and 145 newborns were been checked. As it is shown in the article toxoplasmosis has important role in obstetric-gynecologic pathology. Finding toxoplasmosis antibodies IgM in women’s organisms as well as high levels of indirect immunofluorescence reaction marker of inapparent toxoplasmosis should be considered as indication of necessity of preventing and medical measures.
Что такое токсоплазмоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, паразитолога со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Токсоплазмоз — это острое и хроническое паразитарное заболевание человека в виде манифестных форм или носительства, вызываемое простейшими внутриклеточными паразитами — токсоплазмами, которые попадая в организм человека могут при условиях иммунодефицита поражать нервную ткань, среды глаза, сердечно-сосудистую и ретикулоэндотелиальную системы, вызывая поражение организма той или иной степени тяжести. Болезнь относится к группе TORCH-комплекса, т. е. вызывает врождённую патологию.
Этиология
Таксономия:
Вид — Toxoplasma gondii
Токсоплазмы обитают в мире в трёх формах:
- трофозоиты (тахизоиты);
- цисты (брадизоиты);
- ооцисты.
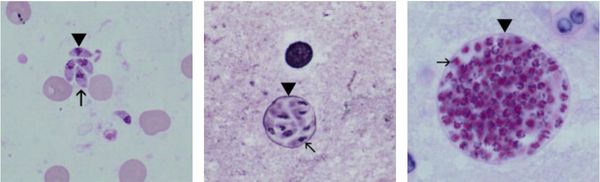
Трофозоиты достигают 4-7 мкм в длину и 2-4 мкм в ширину. Их тело по форме напоминает полумесяц с заострённым передним и закруглённым задним концами, состоит из пелликулы (покровной ткани) и различных органелл. Такие паразиты обитают во всех клетках млекопитающих кроме эритроцитов, размножаются путём деления. Могут создавать движение, активно проникая в клетки хозяина через клеточную мембрану или посредством фагоцитоза (захвата и переваривания клетки). Обнаруживаются в тканях в острой стадии инфекции. Их скопление внутри одной клетки называют псевдоцистой. Трофозоиты неустойчивы вне клетки и во внешней среде, быстро погибают при высушивании, прогревании и применении дезинфицирующих средств. Хорошо окрашиваются по Романовскому. Чувствительны к различным химиопрепаратам (сульфаниламидам, некоторым макролидам и другим).
Цисты размерами до 100 мкм отличаются плотной оболочкой, через которую не могут проникнуть антитела или лекарственные препараты. Внутри оболочки сосредоточено 3000-5000 паразитов, со временем они увеличиваются. Цисты формируются в организме хозяина (в основном в скелетных мышцах, миокарде и ЦНС) и живут там десятки лет. Чрезвычайно устойчивы к воздействиям внешних факторов. При адекватной иммунной системе могут пожизненно находиться в состоянии функционального покоя и не приносить никакого вреда организму человека.
Ооцисты играют основную роль в передаче инфекции. Они представляют собой овальные образования 10-12 мкм в диаметре. Их развитие и формирование длится 3-24 дня и проходит в слизистой оболочке тонкой кишки кошек. Затем в течение 7-20 дней паразиты выделяются с испражнениями, после этого срока новые фекалии кошки уже не заразны. За сутки с испражнениях животного выделяется до 10 миллионов ооцист. Спустя 2-3 дня при температуре 24 °C происходит споруляция ооцист — образование спор. При благоприятных условиях микроорганизмы сохраняются во внешней среде до года и дольше.
Существует множество штаммов токсоплазм, одни из которых отличаются высокой вирулентностью, а другие относительно маловирулентны. [1] [2] [7] [9]
Эпидемиология
Учитывая большое количество латентных форм, заболевание не поддаётся общему исчислению — им может быть заражено не менее 1,5 миллиардов человек. Только ежегодно регистрируется около 200 тысяч случаев внутриутробного инфицирования.
Распространение возбудителя повсеместное — токсоплазма обнаружена на всех материках. После заражения паразиты способны пожизненно сохранятся в организме большинства животных и птиц. Количество случаев приобретённого токсоплазмоза в разных странах колеблется: от 85 % во Франции и Мадагаскаре до 15 % в США и Англии.
- Фекально-оральный:
- водный и пищевой путь — при недостаточной термической обработке, чаще при употреблении сырого мяса и фарша;
- контактно-бытовой путь — при несоблюдении санитарных норм в повседневной жизни, например, при общении с кошками.
- Вертикальный путь (от матери к плоду) — преимущественно при первичном заражении матери во время беременности, часто у ВИЧ-инфицированных в стадии СПИДа.
- Артифициальный путь — при пересадке органов, в которых расположены цисты, пациенту с плохим иммунитету.
- Аэрогенный путь — при попадании инфицированной ооцистами пыли в рот человека.
- Контактный путь — при повреждении целостности кожных покровов. Встречается крайне редко, в основном у работников лабораторий и скотобоен, отмечен лишь в некоторых источниках, явного практического значения не имеет.
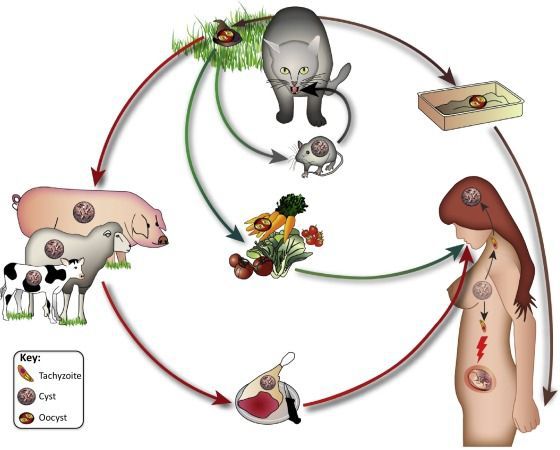
От человека к человеку заболевание не предаётся (кроме случаев каннибализма). Нельзя заразиться посредством укуса насекомых и при половом контакте.
Инфицирование токсоплазмой вызывает устойчивый пожизненный иммунитет к повторному заражению, однако известны случаи рецидива первичной инфекции при заражении другим высоковирулентным штаммом (у беременных, заразившихся при употреблении сырого мяса с другого континента). [1] [3] [5] [8] [9]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы токсоплазмоза
Инкубационный период при манифестных формах (явных проявлениях болезни) длится от двух недель до двух месяцев.
Специфичных симптомов, характерных именно для токсоплазмоза, не существует.
В большинстве случаев приобретённого токсоплазмоза заболевание протекает бессимптомно или со стёртой клиникой, напоминающей нетяжёлое ОРЗ: кратковременная лихорадка, слабость, недомогание, повышение температуры до 38,0 °C, увеличение периферических лимфоузлов, небольшое увеличение печени и селезёнки.
Доказано, что токсоплазма может оказывать влияние на психику человека. Это выражается в учащении рискованных действий, снижении концентрации внимания, повышенной нервозности, у лиц с тяжёлым острым или длительным хроническим активным течением повышен риск развития шизофрении.
Иногда заболевание проявляется изолированной глазной формой — длительно текущие увеиты, иридоциклиты и хориоретиниты. Как правило, эти нарушения являются поздними проявлениями нераспознанного ранее врождённого процесса.
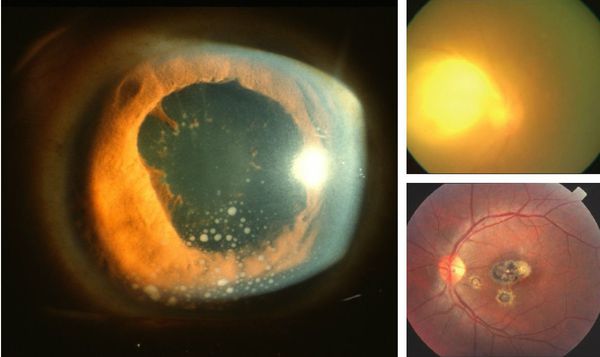
У людей с выраженным иммунодефицитом (ВИЧ, пересадка органов с последующей цитостатической терапией) возможно развитие генерализованного процесса с поражением нескольких органов (головного мозга, сердца, печени, почек, лёгких), нередко очень тяжёлого течения, проявляющегося в виде синдрома полиорганной недостаточности.
Токсоплазмоз у беременных может протекать в различных клинических вариантах и представляет опасность не столько для самой беременной (исключая тяжело протекающие патологии у беременных со СПИДом), сколько для плода.
При первичном заражении беременной токсоплазмозом имеет значение срок гестации:
- При инфицировании в первом триместре передача возбудителя плоду происходит лишь в 4 % случаев (к 13 неделе — в 6 %), но заканчивается, как правило, гибелью плода и выкидышем на ранних сроках. Если первичная инфекция у матери в первом триместре доказано, но выкидыш до 13 недели беременности не произошёл, то крайне высока вероятность, что внутриутробной передачи не было и ребёнок будет здоров.
- При инфицировании во втором триместре (особенно на 24-26 неделях) риск внутриутробной передачи резко возрастает и достигает 30-40 %, причём сопровождается развитием тяжёлых проявлений заболевания — одновременное увеличение селезёнки и печени, воспаление сосудистой оболочки и сетчатки глаза, поражения ЦНС в виде гидроцефалии, кальцификация, сыпь, миокардит, пневмония и другие.
- При заражении матери в третьем триместре передача инфекции ребёнку происходит с частотой до 90 %, однако проявления заболевания являются латентными или субклиническими и могут появиться спустя годы после рождения (отставание в развитии, нарушения зрения). [1][2][4][9]
Патогенез токсоплазмоза
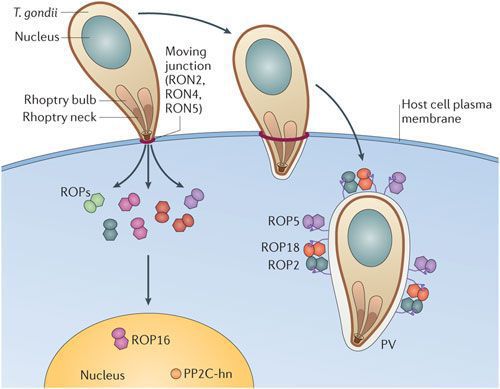
По мере развития и размножения токсоплазм поражённые клетки разрушаются, происходит заражение новых здоровых клеток, и при попадании возбудителя в кровоток паразиты разносятся по всему организму. Образуются некрозы с формированием фиброзной ткани и кальцификацией (отложение солей кальция в организме).
Под воздействием иммунитета безоболочечные трофозоиты превращаются в брадизоиты (оболочечные скопления токсоплазм), т.е. в тканевые цисты, которые сохраняются десятками лет в неактивном состоянии и при значительном снижении иммунитета способны к обратной трансформации с развитием обострения.
При первичной инфекции у беременных возбудитель проникает в ткани плода и вызывает воспалительный процесс, причём в разные периоды развития наблюдается различный характер воспаления: у эмбриона происходит лишь альтерация (дистрофия и некроз ткани без фиброза), в раннем фетальном периоде дополняется повышенным образованием соединительной ткани (фиброзом), а в позднем фетальном периоде присоединяется сосудистый компонент. Отсюда вытекают различные по характеру и тяжести поражения плода, которые зависят от сроков инфицирования матери. [1] [2]
Классификация и стадии развития токсоплазмоза
По течению процесса токсоплазмоз бывает:
- острым — до одного месяца;
- подострым - 1-3 месяц;
- хроническим — более трёх месяцев.
По клиническим признакам выделяют пять форм заболевания:
- Врождённый острый токсоплазмоз:
- манифестная форма (с указанием ведущих проявлений);
- субклиническая форма (с указанием способа верификации диагноза).
- Врождённый хронический токсоплазмоз:
- обострение / ремиссия;
- с резидуальными (остаточными) явлениями / без резидуальных явлений.
- Врождённый латентный токсоплазмоз.
- Приобретённый острый токсоплазмоз.
- Приобретённый хронический токсоплазмоз.
По степени тяжести заболевание бывает:
- лёгким;
- среднетяжёлым;
- тяжёлым (врождённая инфекция, токсоплазмоз при СПИДе).
По наличию осложнений выделяют:
- осложнённый токсоплазмоз;
- неосложнённый токсоплазмоз.
В Международной классификации болезней 10 пересмотра выделены шесть типов заболевания:
- B58.0 Токсоплазмозная окулопатия;
- B58.1 Токсоплазмозный гепатит (K77.0*);
- B58.2 Токсоплазмозный менингоэнцефалит (G05.2*);
- B58.3 Легочный токсоплазмоз (J17.3*);
- B58.8 Токсоплазмоз с поражением других органов;
- B58.9 Токсоплазмоз неуточнённый. [1][2][3]
Осложнения токсоплазмоза
При врождённой форме может возникнуть гидроцефалия, микроцефалия, задержка психомоторного развития и слепота. Эти осложнения сопровождаются увеличением или уменьшением размеров черепа, различными неврологическими расстройствами — косоглазием, судорогами, трудностью с сидением и держанием головы, рвотой и другими.
При глазной форме заболевания развивается слепота, снижение остроты зрения и воспалительные явления всех сред глаза. Причём возможно как рождение с грубыми дефектами зрения, так и появление воспалительных явлений и нарушения зрения спустя много лет после рождения.
Токсоплазмоз у иммунокомпрометированных людей осложняется шизофренией, токсоплазменный энцефалитом и полиорганной недостаточностью — тяжёлой патологией различных органов при выраженном иммунодефиците. При этом свойственна картина тяжёлого энцефалита. Прогноз, как правило, неблагоприятный. [1] [5] [8] [9]
Диагностика токсоплазмоза
Лабораторная диагностика:
- Клинический анализ крови: снижение уровня тромбоцитов, увеличение количества лимфоцитов и эозинофилов.
- Биохимический анализ крови: возможно повышение уровня трансаминаз и билирубина.
- Иммуноферментный анализ (ИФА):
- Выявление специфических антител класса M — острая инфекция или её реактивация. Имеет ряд недостатков — низкая специфичность, длительная циркуляция в организме, иногда до года после острого процесса. В сложных случаях уточнение следует производить при помощи метода "двойной сэндвич" или "иммунозахват" IgM ELISA.
- Выявление специфических антител класса G (клеток памяти) — носительство, инфицированность — появляются в среднем со второй недели заболевания и достигают пика на 1-2 месяце, сохраняются пожизненно, за исключением СПИД-ассоциированных заболеваний.
- Авидность IgG — уточнение давности заболевания. Недостатком является отсутствие стандартизации результатов, что зачастую приводит к различным ошибкам интерпретации. Наибольшее значение имеет высокая авидность, остальные результаты низкой и слабой авидности могут быть ошибочными и не должны трактоваться как недавно перенесённое заболевание при отсутствии других подтверждающих этот факт тестов.
- ПЦР-диагностика: выявление ДНК токсоплазмы в крови, других жидкостях и тканях человеческого организма. Особенно информативна в диагностике генерализованного, глазного и врождённого токсоплазмоза, в т. ч. в антенатальном периоде путём проведения амнио (не ранее 16 недель) и кордоцентеза (с 18 недели беременности).
- УЗИ-диагностика: внутриутробное выявление гидро- и микроцефалии, кальцификатов, гепатоспленомегалии и выраженной задержки развития. [1][2][4][5][6]
Дифференциальная диагностика
Токсоплазмоз — это инфекция с необычайно разнообразными проявлениями, поэтому ввиду неспецифичности проявлений основное место в дифференциальной диагностике отводиться лабораторному обследованию, а именно специфическим серологическим тестам.
Необходимо исключить следующие заболевания:
-
(ВЭБ-инфекцию) — боли в горле, преимущественное увеличение затылочных и заднешейных лимфоузлов, характерные изменения гемограммы (появление большого количества атипичных мононуклеаров и отсутствие столь выраженных изменений при врождённом течении), положительные IgM и ПЦР крови; — лимфоцитарный характер гемограммы, частое поражение слюнных желёз, положительные IgM, ПЦР крови;
- туберкулёз — длительное постепенное начало, лёгкий субфебрилитет (до 38,0 °C), ночная потливость, нездоровый румянец на щеках, кашель, специфические изменения в лёгких, положительные пробы на туберкулёз, выявление бациллы Коха в мокроте;
- лимфопролиферативные заболевания (лимфома Ходжкина, неходжкинские лимфомы) — специфические изменения при биопсии поражённой ткани (лимфоузлов);
- ВИЧ-инфекция — наличие факта возможного заражения, увеличение всех групп лимфоузлов, положительная серология;
- саркоидоз — специфические изменения в лёгких, положительные результаты гистологического исследования. [1][2][5]
Лечение токсоплазмоза
Большинство случаев приобретённого токсоплазмоза протекают в лёгкой или бессимптомной форме, они не регистрируются и, по-видимому, не нуждаются в каком-либо лечении.
Необходимость проведения специфической этиотропной терапии возникает лишь у некоторых групп пациентов:
- беременные с доказанным первичным инфицированием (в ряде случаев при реактивации хронической инфекции);
- дети с врождённой формой токсоплазмоза (при наличии явных клинических и лабораторных проявлений заболевания, субклинических и инаппарантных формах) — сроки и объём терапии зависят от конкретных данных;
- иммунокомпрометированные люди, у которых токсоплазмоз (острый или в фазе реактивации хронического процесса) протекает с выраженными клинико-лабораторными проявлениями. Основное направление воздействия в этом случае должно быть на устранение причины иммунодефицита, повышение уровня СД4 клеток.
Проведение лечения может осуществляться как в стационаре, так и амбулаторно в зависимости от выраженности процесса, реакции пациента на вводимые препараты, необходимости тех или иных вариантов патогенетического и симптоматического обеспечения. [1] [4] [7]
Прогноз. Профилактика
При приобретённом токсоплазмозе у иммунокомпетентных лиц прогноз благоприятный, у иммунокомпрометированных лиц (СПИД) прогноз серьёзен, нередки летальные исходы.
При врождённом токсоплазмозе исход заболевания зависит от сроков инфицирования плода:
- при инфицировании в первом триместре, как правило, происходит выкидыш;
- в более поздние сроки последствия варьируются от тяжёлых до резидуальных форм.
Основным методом профилактики приобретённого и врождённого токсоплазмоза является соблюдение санитарно-гигиенических правил, особенно беременными, не имеющими антител класса G к токсоплазмам:
- ограничение контакта с кошками;
- запрет на употребление сырого мяса, фарша и морепродуктов;
- тщательная промывка зелени, фруктов и овощей;
- мытьё рук перед едой;
- работа на приусадебном участке только в перчатках.
Для беременных особенно важен скрининг антител к токсоплазме, позволяющий выявить активно протекающее заболевание или риск его возникновения, а также вовремя провести медикаментозную профилактику острого токсоплазмоза беременной и снизить риск врождённой инфекции на 60 %. При отсутствии антител класса G в первом триместре необходимо отслеживать антитела IgM и IgG не только в тертьем, но и во втором триместре беременности.
В очаге токсоплазмоза противоэпидемические мероприятия не проводятся, вакцина на разработана. [2] [3]
Что такое лямблиоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, инфекциониста со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Лямблиоз — это острое и хроническое паразитарное заболевание человека в виде манифестных форм или носительства, вызываемое кишечными лямблиями, которые колонизируют слизистую оболочку преимущественно тонкого кишечника, нарушают процессы пристеночного пищеварения и способствуют развитию и усугублению поражения желудочно-кишечного тракта и других заболеваний.
Этиология
Возбудитель — лямблия. Данный род паразитов включает в себя шесть типов, но заболевание человека вызывает только один тип — кишечная лямблия (Giardia duodenalis, Giardia lamblia, Giardia intestinalis). Это жгутиковое микроскопическое простейшее, впервые описанное чешским медиком-анатомом Д.Ф. Лямблем в 1859 году. Оно имеет до восьми генетических подтипов, но для человека патогенны только А и В (также имеют подтипы).
Вид — Giardia lamblia
Возбудитель лямблиоза (кишечная лямблия) существует в виде двух жизненных форм:
- вегетативная (трофозоиты) — стадия активного размножения внутри организма;
- цистная — образуется при неблагоприятных условиях среды.
Трофозоиты — это анаэробные, грушевидные микроорганизмы размерами 9-18 мкм. Они обитают в верхних отделах тонкого кишечника. Подвижны (имеют характерное движение в виде вращения вокруг продольной оси — боковое движение), тело спереди расширено и закруглено, сзади сужено и заострено. Имеют в составе два ядра (между ними пролегают опорные нити — аксостили) и парные органоиды — четыре жгутика и два медиальных тела.
Трофозоиты не имеют цитостома — органа заглатывания пищи и пищеварительной вакуоли, поэтому они всасывают пищу, переваренную хозяином (в основном, углеводы), всей поверхностью тела. Это называется осмотическим питанием.
Как выглядят лямблии:
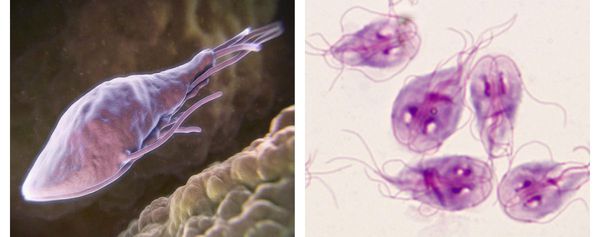
В передней их трети тела расположен присасывательный диск в виде специального углубления. С его помощью лямблии прикрепляются к ворсинкам слизистой оболочки тонкого кишечника. Цитоплазматическая мембрана задней поверхности имеет по краям булавовидные выросты, что также создаёт дополнительную прикрепляющую составляющую.
Размножаются путём продольного деления. Слабо устойчивы в условиях окружающей среды при покидании организма хозяина: при комнатной температуре даже в отсутствии агрессивных факторов быстро погибают.
Цистная форма неподвижна. Паразиты имеют овальную форму, лишены свободных жгутиков (сложно свёрнутые), их размеры достигают 10-14 мкм, окружены толстой, несколько отделённой от тела оболочкой (данная особенность имеет значение при распознавании вида).
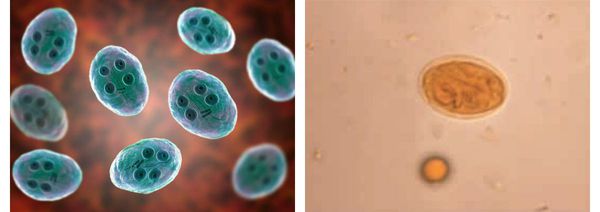
Зрелые цисты внутри имеют четыре ядра, незрелые — два ядра. Образуются в нижних отделах кишечника в процессе выхода из организма с фекалиями. Очень устойчивы во внешней среде: могут сохраняться месяцами в воде при температуре 4-20°C, при хорошей влажности способны сохраняться на контаминированных (обсеменённых) продуктах питания до недели. При кипячении цисты погибают мгновенно, а при высушивании и низкой влажности гибель наступает в течении суток. Устойчивы к бытовому хлорированию воды, действию щелочей и кислот, ультрафиолетовому излучению. Низкие температуры переносит относительно хорошо, но при этом снижая свою жизнеспособность. [1] [3] [6] [9]
Эпидемиология
Распространение заболевания повсеместное, преимущественно в странах с влажным тёплым климатом. Только официально выявляемые случаи в России приближаются к 150 тысячам в год.
Сезонность выражена неярко, некоторый всплеск заболеваемости отмечается в тёплое время года. Возрастной состав больных склоняется в сторону детей.
Источник заражения — люди (больные различными формами лямблиоза и паразитоносители), причём наибольшая заразность наблюдается в подостром периоде заболевания, когда в 1 г фекалий может содержаться до нескольких десятков миллионов цист. Лямблии животных (нечеловеческие типы паразитов) не имеют доказательной базы в плане распространения и заражения человека.
Факторами передачи паразитов выступает загрязнённая цистами термически не обработанная питьевая вода, пища, грязные руки (возможна прямая передача от человека к человеку). Определённую роль в передаче лямблий играют насекомые (тараканы, мухи) и животные (собаки, кошки) — они являются механическими переносчиками (паразиты располагаются на их теле, шерсти, лапках, транзитом в кишечнике).
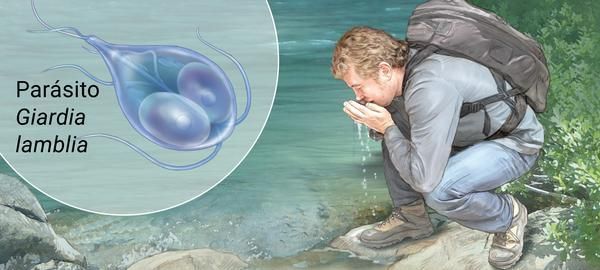
Механизм передачи — фекально-оральный (водный, пищевой и контактно-бытовой пути). Наиболее часто передача осуществляется:
- через водопроводную воду;
- при употреблении плохо промытых зелени и овощей (или промытых под водопроводной водой без последующей термической обработки);
- при нарушении правил санитарной гигиены, особенно в детских коллективах.
Доза заражения — от 10 до 100 цист (в зависимости от индивидуальных свойств иммунной реактивности кишечника). Возможны случаи невосприимчивости к паразитам: цисты лямблий, встречая агрессивно настроенную среду кишечника, проходят транзитом и выделяются в окружающую среду в неизменённом виде.
Иммунитет после лямблиоза нестойкий и ненапряжёный, возможно повторное заражение. Повышенный риск заболевания имеют лица с патологией иммунитета кишечника и дефицитом IgA. [2] [3] [5] [8] [10]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы лямблиоза
Инкубационный период длится от нескольких дней до месяца и более. Чаще всего при заболевании не наблюдается вообще никаких клинических проявлений, особенно у взрослых.
К основным возможным симптомам лямблиоза относятся:
- Симптомы интоксикации и вегетативных изменений — повышенная утомляемость, плаксивость, раздражительность, нарушение ритма сна, головокружения, аритмии, субфебриллитет и другие.
- Симптомы поражения ЖКТ — дискомфорт и боли различной интенсивности и характера в различных отделах живота, тошнота, снижение аппетита, появление чувства горечи во рту, нарушения стула (запоры и поносы), налёт на языке и неприятный запах изо рта, снижение массы тела и другое.
- Симптомы поражения кожи — аллергические высыпания различного характера и локализации, атопический дерматит, бледность и шероховатость кожи, повышенная сухость покровов, хейлит (воспалительные изменения кожи губ и их слизистой), заеды (трещинки в уголках рта), нетипичное/неконтролируемое течение хронических патологий кожи.
- Усиление развития и обострения заболеваний, прямо не связанных с лямблиозом — бронхиальная астма, псевдоаллергические явления, гастриты, язвы желудка и двенадцатиперстной кишки, холецистит, неспецифический язвенный колит, артриты и другое.
- Симптомы мальабсорбции (потери питательных веществ) — авитаминозы, отставание в физическом и умственном развитии, дистрофия (эти проявления более характерны для детей).
Лямблиоз у детей
Как правило, у детей первыми симптомами лямблиоза становится появление субфебрильной или фебрильной температуры (37,1–38,0°C или 38,0–39,0°C), болей в животе, тошноты, иногда рвоты, метеоризма, жидкого стула. Живот при этом болезнен, вздут, урчит по ходу кишечника. Грудные дети становятся беспокойными, кричат, нарушается сон, симптомы лямблиоза усиливаются во время и после кормления, возможно появление аллергодерматозов и опрелостей. В динамике при отсутствии лечения это может приводить к нарушению роста и психоэмоционального развития, частым простудным или аллергическим заболеваниям, развитию хронических проблем органов ЖКТ.
У детей более позднего возраста и взрослых яркие симптомы лямблиоза наблюдаются редко — на первый план выходит постепенное развитие диспепсических явлений со стороны ЖКТ умеренного характера:
- метеоризм;
- дискомфорт и боли в животе преимущественно в околопупочной области и правом подреберье;
- нарушения стула в различных сочетаниях;
- появление налёта на языке;
- иногда горечь во рту и кожные проявления (усиление выраженности угревой сыпи, хронических полиэтиологических заболеваний, например, псориаза и дерматитов);
- возможны вегетативные расстройства, головные боли, головокружения, неустойчивость артериального давления, повышения температуры тела, чувствительность лимфоузлов.
Лямблиоз у беременных
Лямблиоз у беременных не имеет каких-либо специфичных отличий от лямблиоза у остальных людей, но может приводить к повышению риска развития у беременной В-12 дефицитной анемии и снижению веса плода (гипотрофии). [1] [3] [5] [7] [10]
Патогенез лямблиоза
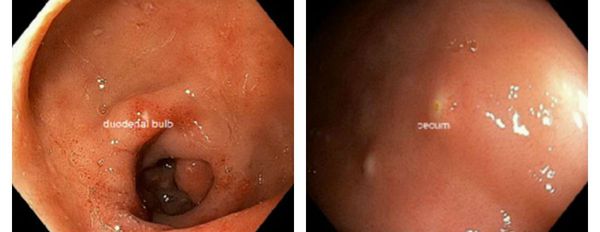
Характерен так называемый "симптом манной крупы" — белёсые полусферические выбухания слизистой оболочки двенадцатиперстной кишки, представляющие собой зоны очагового отёка со скоплением увеличенного количества лейкоцитов.
Посредством механического раздражения и выделения паразитами продуктов жизнедеятельности (токсическое влияние) происходит стимуляция образования слизи, повышение регенераторной функции кишечника, нарушение выработки факторов нейрогуморальной регуляции пищеварения (холецистоцикин и других) и двигательной активности гепатогастродуоденальной области. Это ведёт к дезорганизации висцеро-висцеральных связей области двенадцатиперстной кишки, поджелудочной железы и желчевыводящей системы, а также к нарушению функционирования органов ЖКТ, нарушению микробиоценоза кишечника, активизации анаэробной флоры, расстройствам расщепления и всасывания белков, жиров, углеводов, витаминов и микроэлементов.
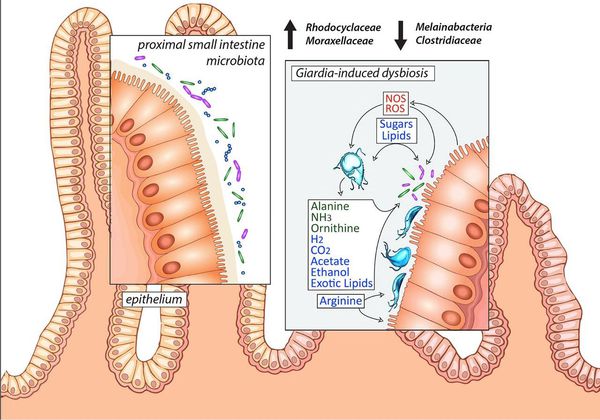
Возникает воспаление слизистой кишечника по типу реакций гиперчувствительности замедленного типа, происходит воздействие на иммунорегуляторные белки (мимикрия), снижение выработки иммуноглобулинов (в частности IgA) из-за нарушения всасывания белков и снижение фагоцитарной активности. Всё это в совокупности со всасываемыми продуктами жизнедеятельности лямблий становится причиной истощения иммунной системы (как кишечника, так и общего иммунитета), развития хронического поражения кишечника, провоцирует длительное обострение имеющихся хронических заболеваний и усугубление ряда аллергозависимых дерматозов. [1] [4] [7] [8]
Классификация и стадии развития лямблиоза
По клинической форме лямблиоз бывает:
- бессимптомным (носительство);
- кишечным — преимущественно симптомы кишечной формы, но можгут быть и гастритические проявления (дискомфорт в животе, неустойчивый стул, тошнота);
- билиарно-панкреатическим (рефлекторный) — дискомфорт в эпигастрии и правом подреберье, привкус горечи во рту, повышенная частота развития плохо контролируемых гастродуоденитов и панкреатитов;
- астено-невротическим — слабость, вялость, повышенная утомляемость, раздражительность, эмоциональная неустойчивость;
- токсико-аллергическим — периодические высыпания на теле, обострение хронических кожных заболеваний и бронхиальной астмы, эозинофилия;
- смешанным.
Течение лямблиоза бывает трёх типов:
- острым — до одного месяца;
- подострым — 1-3 месяца;
- хроническим — более трёх месяцев.
По наличию осложнений лямблиоз бывает:
Выделяют три степени заболевания:
Осложнения лямблиоза
Возможны специфические и неспецифические осложнения лямблиоза.
К специфическим относятся:
-
— зудящие обширные высыпания на теле;
- отёк Квинке — выраженный отёк подкожной клетчатки, иногда сопровождающийся зудоим и чувством удушья;
- офтальмопатия — нарушения восприятия органом зрения;
- артрит — дискомфорт и боли в суставах;
- гипокалиемическая миопатия — слабость определённых групп мышц.
К неспецифическим осложнениям относятся:
- наслоение интеркуррентных заболеваний (вторичная флора);
- белково энергетическая недостаточность (гипо- и авитаминоз, снижение веса, анемия и другие). [1][2][8][10]
Диагностика лямблиоза
Лабораторная диагностика лямблиоза включает в себя:
- Клинический анализ крови — в остром периоде наблюдается эозинофилия, базофилия и повышение СОЭ; в последующие периоды — умеренная эозинофилия или нормальное значение эозинофилов, иногда незначительная базофилия.
- Биохимический анализ крови — иногда отмечается повышение уровня общего билирубина и амилазы.
- Копроовоскопическое исследование кала — "золотой стандарт" диагностики. Оно позволяет выявить цисты (наиболее часто) и вегетативные формы лямблий (в редких случаях). В виду прерывистого цистообразования показано неоднократное исследование с некоторым интервалом (семь дней). Существует широко распространённое заблуждение о том, что кал нужно сдавать "тёплым" (свежим). На самом деле, в этом нет никакой необходимости. Так как данное исследование предполагает обнаружение цист лямблий, которые очень устойчивы во внешней среде, период от дефекации до исследования никоим образом не влияет на информативность результата анализа.
- Иммунохроматографический метод и ПЦР-диагностика кала (выявление антигенов и нуклеиновых кислот паразита) — имеет хорошую информативность и вполне может применяться в комплексе с другими методами исследований.
- ИФА-диагностика — малоинформативное исследование, так как локализация лямблий в просвете кишечника не создаёт условий для полноценного иммунного ответа, который наблюдается в основном у детей при остром заболевании, что создаёт значительное число ошибочных результатов как гипо-, так и гирпедиагностики.
- Дуоденальное зондирование (выявление вегетативных форм лямблий в двенадцатиперстной кишке) — может применяться в сложных диагностических случаях и при подозрении на коинвазирование (например, описторхами при описторхозе).
- УЗИ органов брюшной полости и ФГДС — позволяют выявить признаки нарушения моторики гепатобилиарной области. [2][3][5][6][9]
Дифференциальная диагностика предполагает исключение следующих заболеваний:
- паразитарные заболевания другой этиологии (как кишечной, так и внекишечной локализации);
- хронический гастродуоденит (симптомосходная симптоматика);
- кишечные инфекции (сальмонеллёз, дизентерия, ротавирус и другие);
- дисбиоз кишечника (сборное понятие, характеризующееся неустойчивостью стула, дискомфортом в животе различного характера, снижением веса и другими симптомами). [1][5][9]
Лечение лямблиоза
Лечение острой формы лямблиоза, которая возникает в основном у детей, должно осуществляться в стационаре и включать в первую очередь дезинтоксикационную и дегидратационную терапию, а также щадящее питание.
Медикаментозная терапия
При подтверждении диагноза проводится этиотропное лечение одним из противолямблиозных препаратов (нитрогруппа) в сочетании с желчегонными средствами, и лекарствами, улучшающими микрофлору кишечника.
При длительном хроническом течении в виду персистирующей колонизации лямблиями слизистой оболочки тонкого кишечника и местным иммунодефицитом курс лечения должен быть комплексным, включающим:
- диета (потреблять меньше углеводов);
- средства этиотропного воздействия (химиопрепарат);
- приём желчегонных препаратов;
- иммунотерапию (усиление фагоцитоза и восполнение дефицита IgA);
- устранение дисбиоза кишечника (пробиотики).
К сожалению, в последнее время всё чаще встречаются штаммы лямблий, устойчивых к различным видам противопаразитарной терапии, поэтому средняя вероятность успешной эрадикационного лечения не превышает 85%.
Гигиена при лечении лямблиоза
Лямблиоз редко передаётся между членами семьи, если соблюдать простейшие гигиенические правила: мыть руки после посещения уборной, перед едой и после контакта с животными.
Лечение народными средствами
Эффективность и безопасность методов народной медицины научно не доказана. Без адекватного лечения лямблиоз может привести к различным осложнениям: крапивнице, отёку Квинке, нарушениям зрения, артриту и слабости мышц.
Лечение лямблиоза у детей
Новорождённых от лямблиоза, как правило, не лечат, так как нет подходящих препаратов. В основном рекомендуется улучшать микрофлору и работу кишечника.
Детей старшего возраста лечат так же, как и взрослых, но подбирают необходимую дозировку и форму препарата.
Лечение лямблиоза у беременных
Беременным лечение, как правило, противопоказано (потенциальный вред препаратов превышает пользу от лечения), в основном предпочтение отдаётся улучшению флоры и работы кишечника.
Контроль излеченности
После курса лечения проводится паразитологический контроль методом копроовоскопии или ПЦР не ранее двух недель после завершения курса лечения длительностью в три месяца со сдачей анализа раз в месяц. [1] [3] [4] [5]
Прогноз. Профилактика
При назначении адекватного лечения прогноз благоприятен, осложнения редки.
Специфической профилактики не разработано. Основной упор следует делать на меры соблюдения санитарных норм:
Токсоплазмоз — широко распространенная зоонозная паразитарная инфекция, характеризующаяся полиморфизмом клинических проявлений и значительной вариабельностью течения процесса: от здорового, бессимптомного носительства до тяжелых, летальных форм болезни.
.jpg)
Токсоплазмоз — широко распространенная зоонозная паразитарная инфекция, характеризующаяся полиморфизмом клинических проявлений и значительной вариабельностью течения процесса: от здорового, бессимптомного носительства до тяжелых, летальных форм болезни.
Этиология. Возбудитель токсоплазмоза Toxoplasma gondii относится к царству Protozoa, классу Coccidia, отряду Eucoccidiorida, типу Apicomplexa. T. gondii — условно патогенный внутриклеточный паразит, поражающий в организме промежуточных хозяев, в том числе человека, любые ядерные клетки гистеофагоцитарной системы.
Эпидемиология. Пораженность или инфицированность токсоплазмами населения Российской Федерации в среднем составляет около 20,0%. Показатели пораженности выше в регионах с теплым климатом; среди лиц ряда профессиональных групп: рабочие мясокомбинатов и звероводческих ферм, животноводы, ветеринарные работники и др. Инфицированность женщин, как правило, в 2–3 раза выше, чем у мужчин.
Заболеваемость токсоплазмозом во много раз ниже показателей инфицированности, однако трудности диагностики, несмотря на обязательную регистрацию, не позволяют судить об истинном уровне инфекции.
Восприимчивость к токсоплазмозу — практически поголовная. Распространение инфекции — повсеместное в виде носительства и спорадических заболеваний. Основной источник инфекции — дикие и домашние кошки.
Основной фактор передачи токсоплазм — сырое или недостаточно термически обработанное мясо, мясные продукты с находящимися в нем цистами токсоплазм. К дополнительным факторам передачи инфекции относятся плохо вымытая зелень, овощи, фрукты (с земли), грязные руки с находящимися на них ооцистами возбудителя.
Основные пути передачи:
- пищевой — связанный с употреблением в пищу термически плохо обработанного мяса, содержащего цисты паразита;
- контактный — ассоциированный с больными кошками, выделяющими токсоплазмы с фекалиями;
- трансплацентарный — при котором становится возможным проникновение токсоплазм в плод, с последующим развитием врожденного токсоплазмоза у новорожденного;
- парентеральный — при котором не исключается передача инфекции реципиенту при переливании крови, пересадке органов и тканей.
Беременная с токсоплазмозом не представляет эпидемиологической опасности ни для окружающих, ни для медицинского персонала, что делает возможным лечение этих пациентов как в амбулаторных условиях, так и в любом соматическом стационаре.
Патогенез. Вышедшие из цист или ооцист возбудители внедряются в эпителиальные клетки тонкого кишечника, где они размножаются, образую первичный аффект и проникая затем в региональные лимфатические узлы, а из них с током лимфы — в кровь. Диссеминация возбудителя приводит к поражению самых различных органов и тканей.
При беременности, в условиях сниженного иммунитета, наряду с первичным заражением токсоплазмами, опасным является и реактивация паразита (при инфицировании до беременности), что в значительной степени определяет течение и исход беременности.
При выходе токсоплазм из цист происходит диссеминация возбудителей. Их концентрация в тканях ассоциирована со способностью токсоплазм проникать трансплацентарно, что приводит к развитию внутриутробной патологии на любом сроке беременности.
Заражение плода наблюдается у беременных как с первичным инфицированием токсоплазмами, так и реактивацией возбудителя во время беременности у серопозитивных женщин. Поражение плода может возникать на любом сроке гестации, но особую опасность представляет его инфицирование в первом и втором триместрах. При заражении в третьем триместре беременности преобладают бессимптомные формы течения заболевания, а поздние клинические признаки проявляются через месяцы и годы.
Заражение на ранних сроках эмбриогенеза заканчивается спонтанным выкидышем, мертворождением, вызывает тяжелые нарушения развития — анэнцефалию, анофтальмию, гидроцефалию, гепатоспленомегалию и др. (табл.).
Формирование иммунитета приводит к исчезновению возбудителя из крови, прекращается его размножение в клетках. Образуются истинные тканевые цисты, которые могут длительно, десятилетиями, в интактном состоянии сохраняться в организме (носительство токсоплазм).
Клиника. Приобретенный токсоплазмоз по характеру течения делится на острый и хронический. Кроме того, в зависимости от длительности болезни и выраженности клинических симптомов возможно подострое, а также инаппарантное (субклиническое) течение инфекции, которое характеризуется определенной динамикой либо высоким уровнем специфических антител в крови, при отсутствии клинических проявлений болезни. Таким образом, наиболее удобной для практического здравоохранения, с нашей точки зрения, является следующая классификация приобретенного токсоплазмоза: острый, подострый, хронический, инаппарантный и носительство.
Клинические проявления токсоплазмоза у беременных не имеют каких-либо существенных отличий от уже известной клинической картины заболевания.
Лабораторная диагностика. Для лабораторной диагностики токсоплазмоза чаще всего применяют серологические методы: реакцию непрямой иммунофлюоресценции (РНИФ) и иммуноферментный анализ (ИФА). Диагноз подтверждается достоверно нарастающей динамикой показателей этих тестов, их высоким уровнем либо наличием антител класса IgM. Существенное значение в диагностике токсоплазмоза, особенно в дифференциации острого и хронического процессов, имеет определение классов иммуноглобулинов, в частности антител класса IgM. Надежно диагностировать токсоплазменную инфекцию можно лишь при сравнении результатов серологических реакций в динамике. Антитела всех классов существенно повышаются к концу второй — началу третьей недели от момента инфицирования и достигают диагностического уровня. Диагноз токсоплазмоза при наличии соответствующей клиники может быть поставлен при положительной серологической конверсии, когда второй анализ сыворотки становится положительным.
Диагностика токсоплазмоза у беременных женщин включает в себя весь комплекс необходимых клинических, параклинических и специальных (иммунобиологических) исследований, которые применяются для диагностики токсоплазмоза вообще.
Обязательным условием обследования беременной на токсоплазмоз должна быть консультация врача-инфекциониста для подтверждения либо исключения текущего инфекционного манифестного или бессимптомного (инаппарантного) токсоплазменного процесса.
Учитывая исключительную важность результатов иммунологического обследования в диагностике токсоплазмоза у беременных, необходимо правильно интерпретировать полученные данные.
Вариант 3: клинические проявления инфекции отсутствуют; серологические реакции положительные в низких, средних, иногда высоких титрах (РНИФ 1:640, ИФА IgG ≥ 200 Ед/мл; ИФА IgM — положительно). При исследовании парных сывороток (через 3–4 недели) регистрируется достоверное нарастание уровня специфических антител класса IgM.
Заключение: инаппарантный токсоплазмоз — реальная угроза инфицирования плода.
Вариант 4: имеются клинические проявления токсоплазмоза; серологические реакции положительные в низких и средних (иногда высоких) титрах: РНИФ 1:1280, ИФА IgG ≥ 200 Eд/мл; ИФА IgM — положительно, при исследовании парных сывороток в динамике регистрируется достоверное нарастание уровня специфических антител; выявляются специфические антитела класса IgM-класса. Заключение: острый токсоплазмоз.
Рекомендации: экстренная превентивная этиотропная терапия (не ранее чем со II триместра беременности); в I триместр — рассмотреть вопрос о прерывании беременности; проводят кордо- и амниоцентез на 22–23 неделях беременности; новорожденный обследуется на токсоплазмоз, и при подтверждении диагноза проводится этиотропная терапия (диспансерное наблюдение 5 лет).
Вариант 5: имеются клинические проявления инфекции; серологические реакции положительные в высоких или средних показателях; при исследовании парных сывороток в динамике регистрируется снижение уровня специфических антител (РНИФ ≤ 1:1280, ИФА IgG — 200 Eд/мл; ИФА IgM — положительно). Заключение: подострый токсоплазмоз. Рекомендации: этиотропная терапия (не ранее чем со II триместра); в I триместр — ставится вопрос о прерывании беременности; новорожденный обследуется на токсоплазмоз и при подтверждении диагноза проводится этиотропная терапия (диспансерное наблюдение 5 лет).
Вариант 6: имеются клинические проявления токсоплазмоза; серологические реакции положительны в низких или средних показателях (РНИФ 1:640, ИФА IgG — 200 Eд/мл; ИФА IgM — отрицательно); при исследовании парных сывороток (через 3–4 недели) динамики уровня антител нет; антитела класса IgM отсутствуют. Заключение: хронический приобретенный токсоплазмоз. Рекомендации: этиотропная терапия не проводится; при необходимости специфическая терапия вне беременности; прерывание беременности не показано.
Лечение. Показанием к назначению этиотропной терапии у беременных женщин являются острый, подострый и инаппарантный токсоплазмоз. Лечение хронического токсоплазмоза следует проводить строго по клиническим показаниям либо до, либо после беременности. При отсутствии жалоб и клинических показаний не нуждаются в лечении женщины, переболевшие токсоплазмозом до беременности. Эти женщины расцениваются как практически здоровые лица, не требующие специального медицинского наблюдения. Лечение беременных женщин следует проводить не ранее 12–16 недель беременности (со II триместра беременности).
Назначаются препараты группы пириметамина (Фансидар, Ровамицин).
Фансидар содержит сульфадоксин 500 мг и пириметамин 25 мг. Этиотропная терапия состоит из 2–3 циклов. Назначается 1 таблетка 1 раз в 3 дня № 8 таблеток на цикл. Учитывая возможность угнетения кроветворения под действием этиотропных препаратов, рекомендуется назначение фолиевой кислоты (в средних терапевтических дозах), а также проведение общих анализов крови и мочи. При непереносимости препаратов группы пириметаминов назначают Ровамицин, 1 таблетка которого содержит спиромицина 3 млн МЕ. Назначают по 3 млн МЕ 3 раза в день с семидневным перерывом. Хорошая переносимость Ровамицина больными, отсутствие лекарственного взаимодействия, высокая эффективность позволяют назначать его для лечения токсоплазмоза у беременных. При непереносимости пириметаминов возможна замена на антибиотики, например, эритромицин.
Противопоказаниями для назначения Фансидара и его аналогов, а также сульфаниламидных препаратов и антибиотиков являются: нарушения эритропоэза с анемией, заболевания почек с нарушением их функций, заболевания печени, декомпенсация сердечной деятельности.
В зависимости от сроков беременности целесообразно проведение не менее двух полных курсов этиотропной терапии с перерывами между ними 1–1,5 месяца.
Как показала практика, у пациенток с инаппарантным течением острого токсоплазмоза хороший эффект дает комплексное применение Фансидара с иммуномодуляторами (Галовит, Полиоксидоний). Уже после первого цикла лечения наблюдается значительное снижение IgM.
Профилактика врожденного токсоплазмоза. Профилактика врожденного токсоплазмоза должна строиться с учетом того факта, что только первичное заражение женщины во время беременности может привести к инфицированию плода. Оптимально профилактика врожденного токсоплазмоза должна включать в себя обследование женщин детородного возраста на токсоплазмоз до или, в крайнем случае, во время беременности. Неиммунные беременные женщины должны быть обязательно взяты на диспансерное наблюдение и обследоваться на токсоплазмоз 1 раз в триместр.
Литература
- О выявлении и профилактике токсоплазмоза в Москве. Методические рекомендации (№ 25). М., 2007.
- Лысенко А. Я. Клиническая паразитология. Женева, 2002.
- Hill D., Dubey J. P. Toxoplasma gondii: transmission, diagnosis and prevention // Clin. Microbiol. Infect. 2002. № 10.
- Desmonts G., Couvreur J. Toxoplasmosis in pregnancy and its transmission to the fetus // Bull. N. Y. Acad. Med. 1974. № 2.
Ф. К. Дзуцева*
Г. Ю. Никитина**
Ю. В. Борисенко*
Л. П. Иванова***, кандидат медицинских наук, доцент
С. Х. Зембатова***
*Городской центр по токсоплазмозу, **ГКБ им. С. П. Боткина, ***РМАПО, Москва
Читайте также:

