Метод пцр для диагностики трихомониаза
Обновлено: 19.04.2024
Статья посвящена диагностике и терапии урогенитального трихомониаза. Выделены основные преимущества и недостатки каждого метода. Отмечена необходимость проведения расширенного диагностического маршрута и лабораторного обследования на всех этапах инфекцион
Одно из первых мест в структуре инфекций, передающихся половым путем, во всех странах мира занимает урогенитальный трихомониаз (УГТ). По данным ВОЗ ежегодно в мире регистрируется более 333 млн новых случаев инфекций, передающихся половым путем, из них на мочеполовой трихомониаз приходится более 170 млн случаев [1, 2]. В Российской Федерации заболеваемость УГТ в последние годы составляет около 200 случаев на 100 тыс. населения [3, 4]. Среди женщин, обратившихся к врачу по поводу выделений из влагалища, УГТ диагностируют по данным различных авторов в 18–50%, а иногда и 80% случаев, у мужчин с негонококковыми уретритами трихомонадные поражения составляют до 20–34,8% [2, 5–7].
Возбудителем урогенитального трихомониаза является простейший одноклеточный микроорганизм — Trichomonas vaginalis, которая в процессе эволюции приспособилась паразитировать в органах мочеполовой системы человека [8].
Характерными клиническими характеристиками для УГТ являются: полиморфизм, многоочаговость поражения, нередко хроническое течение с рецидивами, возможность транзиторного и асимптомного носительства. Малосимптомные, хронические, вялотекущие формы заболевания, а также трихомонадоносительство, которое составляет 10–35% среди женщин и 2–41% среди мужчин, имеют большое значение в эпидемиологическом плане, способствуя распространению возбудителя среди половых партнеров [7]. Вследствие возможного развития осложнений воспалительного характера УГТ представляет серьезную угрозу репродуктивному здоровью человека [9]. Трихомониаз рассматривается фактором риска заражения ИППП, в том числе ВИЧ-инфицирования. Ряд исследователей отмечают, что инфицирование T. vaginalis, особенно длительно существующая, персистирующая трихомонадная инфекция, может быть фактором риска развития рака шейки матки [10].
Диагностика УГТ основывается на выявлении клинических признаков заболевания и обнаружении T. vaginalis в исследуемом материале.
Таким образом, поскольку симптомы трихомониаза, как и большинства других ИППП, непатогномоничны и не являются надежными критериями, в обязательном порядке с целью диагностики трихомонадной инфекции необходимо применение лабораторных методов исследования.
В России основными методами, используемыми для выявления трихомонад в биологическом материале, долгое время оставались только микроскопия нативного, окрашенного препаратов и культуральное исследование.
Микроскопия нативного препарата — это определение трихомонад в нативном препарате (метод исследования неокрашенного свежего препарата впервые предложен Донне в 1836 г.), который готовят путем смешивания исследуемого материала с каплей теплого изотонического раствора хлорида натрия (лучше раствора Рингера–Локка), затем накрывают покровным стеклом и микроскопируют при увеличении объектива 40 и окуляра 7 или 10. Для исследования берется отделяемое уретры, цервикального канала, влагалища, центрифугат мочи, эякулят, секрет предстательной железы и др. При изучении нативного препарата особое внимание обращается на размеры и форму трихомонад, характер их движения, внутреннее содержимое клеток. Необходимо найти овальное или грушевидное тело, чуть больше лейкоцита (размеры в среднем от 13 до 17 мкм), имеющее жгутики и совершающее характерные толчкообразные поступательные движения. Иногда можно заметить движение свободных жгутиков. Цитоплазма трихомонад обычно зернистая, чаще вакуолизирована. Ядра плохо различимы или чаще вообще не обнаруживаются. Более четко видеть движения и структуру трихомонад позволяет фазово-контрастная микроскопия (с окраской нативного препарата 0,01% раствором сафранина). Однако оценка жизнеспособных, но неподвижных, атипичных форм (без жгутиков, ундулирующей мембраны, атипично делящихся (почкующихся) клеток) методом микроскопии нативного препарата крайне проблематична. В целом чувствительность этого метода варьирует в широких пределах и зависит, прежде всего, от формы заболевания, локализации трихомонад, а также от квалификации персонала, проводящего исследование. Необходимо помнить, что при отсутствии типичных форм трихомонад диагноз трихомониаза может считаться лишь предположительным и должен подтверждаться другими методами.
Микроскопия окрашенных препаратов несколько повышает процент выявления трихомонад по сравнению с нативными препаратами, так как при этом учитываются все, а не только подвижные особи. Кроме того, окрашенные препараты можно использовать для оценки воспалительного процесса (на наличие воспалительного процесса косвенно указывают скопление лейкоцитов на клетках плоского эпителия или вокруг них, большое количество слизи в мазках и др.), выявления гонореи, мицелия грибов, микрофлоры: кокков, палочек и т. д. Методика включает в себя поиск известной формы трихомонады с правильно очерченным, эксцентрично расположенным ядром на фоне нежно-ячеистой структуры цитоплазмы. Для выявления жгутиков и ундулирующей мембраны препарат следует изучать методами окраски по Романовскому–Гимзе, Лейшману.
Однако в течение последних десятилетий у больных УГТ все чаще стали определяться атипичные, амастиготные (метаболически малоактивные особи паразита, лишенные органоидов движения — блефаропласта, жгутиков и ундулирующей мембраны) формы влагалищных трихомонад, что значительно усложнило диагностику инфекции, так как морфология и подвижность — основные критерии выявления простейших.
Необходимо отметить, что эффективность микроскопического метода исследования в целом недостаточная. Относительно других методов лабораторной диагностики, являясь определенно экономически наиболее целесообразным, он имеет низкую чувствительность — от 50% до 64,9% (для культурального — 73–89,2%; для метода полимеразной цепной реакции (ПЦР) — 93–98,7%) [8, 11, 12]. Интерпретация результата субъективная и во многом зависит от опыта специалиста, качества мазка и соблюдения условий забора материала. Ошибки при проведении микроскопических исследований, прежде всего, обусловлены:
- потерей влагалищными трихомонадами характерной подвижности после того, как они извлечены из среды человеческого организма;
- принятием эпителиальных клеток, макрофагов и других клеточных элементов за трихомонады;
- существованием различных форм трихомонад (округлые, безжгутиковые (амастиготные) формы, со сниженной метаболической активностью — разночтения при оценке результатов);
- низкотитражными препаратами (концентрация трихомонад ниже 10 5 КОЕ/мл с помощью микроскопии уже не определяется [8]) или препаратами, содержащими огромное количество клеток эпителия, лейкоцитов и различного деструктивного материала из очага поражения;
- нередкой потерей типичных морфологических признаков во время фиксации и окрашивания, что создает трудности для этиологической идентификации.
Отмечается снижение чувствительности микроскопического метода при бессимптомных формах заболевания, а также при исследовании недостаточного количества полей зрения [8].
Вместе с этим следует особо подчеркнуть нередкость и ложноположительных результатов микроскопического исследования, которые обусловлены чаще всего принятием за трихомонады эпителиальных клеток или других клеточных элементов. Однако необходимо помнить, что диагноз урогенитального трихомониаза, как и других заболеваний, обусловленных ИППП, ведет за собой целый ряд не только медицинских, но и этических проблем, и ценой диагностической ошибки могут стать недоверие и ухудшение взаимоотношений в супружеской паре, развод, суицидальные последствия и т. п. Поэтому необходимо быть крайне требовательными к верификации диагноза и при малейших сомнениях подтверждать более чувствительными методами исследования.
Несмотря на все недостатки микроскопического метода, он, благодаря относительно низкой стоимости и быстроте исполнения, остается в нашей стране преобладающим в диагностике урогенитального трихомониаза [8].
Культуральные исследования хоть и повышают эффективность диагностики урогенитального трихомониаза в сравнении с микроскопическими методами, однако существенно уступают методам амплификации нуклеиновых кислот. Вместе с тем существенным недостатком культуральной диагностики трихомониаза является и ее длительность: регламентированная процедура предусматривает культивирование до 17 дней с изучением культуры для идентификации простейших на 3–5 день, при отрицательных результатах на 7–9, 11–17 дни после посева.
Следует отметить, что существующие другие методы лабораторных исследований, в том числе прямую иммунофлюоресценцию (ПИФ) и иммуноферментный анализ (ИФА) для обнаружения антител T. vaginalis, на сегодняшний день не рекомендуется использовать для диагностики трихомонадной инфекции в связи с тем, что существующие наборы не обладают достаточной чувствительностью, позволяющей осуществлять качественную диагностику трихомониаза [8, 17].
К сожалению, ни один из имеющихся на сегодняшний день диагностических тестов не является в 100% случаев совершенным. Главной задачей современной диагностики любой ИППП и, в частности, урогенитального трихомониаза, с целью раннего и достоверного диагноза, является индивидуальный подход к конкретному пациенту с определением роли и места каждого метода и их комплексного применения при выявлении возбудителя.
При выборе диагностического метода необходимо учитывать также половые и возрастные особенности. У мужчин трихомонады обнаружить значительно труднее, чем у женщин, что связано, прежде всего, с тем, что T. vaginalis в отделяемом уретры часто находятся в малоподвижной форме, имеются в небольшом количестве. Поэтому для более достоверных данных обследования у мужчин нельзя ограничиваться анализом только уретрального отделяемого, надо исследовать также осадок свежевыпущенной мочи, секрет предстательной железы, сперму; необходимо проведение множественных лабораторных исследований с использованием различных методов и их комбинаций. У девочек (до наступления менархе) диагноз урогенитального трихомониаза устанавливается на основании микроскопического и/или культурального исследования, подтвержденного молекулярно-биологическим методом.
Необходимо отметить, что лабораторные обследования, как наиболее объективные, с помощью которых устанавливается достоверный диагноз и назначается адекватная терапия, надо проводить на всех этапах инфекционного процесса (первичное обследование, оценка динамики течения воспалительного процесса, определения эффективности лечения).
Особое внимание необходимо уделить также важному этапу обследования — топической диагностике, которая осуществляется с помощью не только тщательного осмотра, но и с применением инструментальных методов (кольпоскопии, трансвагинального ультразвукового исследования (УЗИ) у женщин, трансректального УЗИ у мужчин).
Показанием к проведению лечения является обнаружение T. vaginalis при микроскопическом и/или культуральном исследованиях и/или исследовании молекулярно-биологическими методами у пациента либо у его полового партнера. Одновременное лечение половых партнеров является обязательным.
Целями лечения являются эрадикация T. vaginalis, клиническое выздоровление, предотвращение развития осложнений и предупреждение инфицирования других лиц.
Во избежание развития тяжелых побочных реакций (дисульфирамоподобная реакция) пациентов следует предупреждать о необходимости избегать приема алкоголя и содержащих его продуктов как в ходе терапии метронидазолом и тинидазолом, так и в течение 24 часов после его окончания. При непереносимости перорального метронидазола его интравагинальное назначение также противопоказано.
При лечении трихомониаза рекомендуется применять метронидазол, орнидазол или тинидазол 500 мг внутрь 2 раза в сутки в течение 5 дней.
При лечении осложненного, рецидивирующего трихомониаза и трихомониаза других локализаций метронидазол применяют 500 мг внутрь 3 раза в сутки в течение 7 дней или 2,0 г внутрь 1 раз в сутки в течение 5 дней; орнидазол 500 мг внутрь 2 раза в сутки в течение 10 дней; тинидазол 2,0 г внутрь 1 раз в сутки в течение 3 дней.
При лечении осложненных форм урогенитального трихомониаза возможно одновременное применение местнодействующих протистоцидных препаратов, таких как вагинальная таблетка метронидазола 500 мг 1 раз в сутки в течение 6 дней, гель метронидазола 0,75% 5 г интравагинально 1 раз в сутки в течение 5 дней.
Лечение беременных осуществляется на любом сроке для предотвращения преждевременного разрыва плодных оболочек, преждевременных родов и низкой массы плода: метронидазол 2,0 г однократно.
При лечении детей используют метронидазол 10 мг/кг массы тела внутрь 3 раза в сутки в течение 5 дней или орнидазол 25 мг/кг массы тела 1 раз в сутки в течение 5 дней.
Требования к результатам лечения включают эрадикацию T. vaginalis, клиническое выздоровление. Установление излеченности трихомонадной инфекции на основании микроскопического, культурального метода исследования и методов амплификации РНК (NASBA) проводится через 14 дней после окончания лечения, на основании методов амплификации ДНК (ПЦР, ПЦР в реальном времени) — не ранее чем через месяц после окончания лечения. При отрицательных результатах обследования пациенты дальнейшему наблюдению не подлежат. При отсутствии эффекта от лечения исключают реинфекцию, назначают иные препараты или курсовые методики лечения [18].
В заключение хотелось бы еще раз отметить, что в связи с отсутствием четко специфических симптоматических проявлений клиническая дифференцировка урогенитального трихомониаза достаточно затруднительна и неточна без лабораторной диагностики, результативность которой, особенно для бессимптомных, хронических форм заболевания, будет во многом зависеть от выбранного метода. Полноценное обследование больных с расширением спектра диагностических и параклинических технологий позволит повысить качество диагностической помощи, что в последующем, несомненно, поможет в выборе оптимального объема, содержания и этапности лечебных технологий.
Литература
Е. И. Юнусова 1 , кандидат медицинских наук
Л. А. Юсупова, доктор медицинских наук, профессор
З. Ш. Гараева, кандидат медицинских наук
Г. И. Мавлютова, кандидат медицинских наук

Урогенитальный трихомониаз является наиболее распространенным заболеванием мочеполового тракта и занимает первое места среди заболеваний, передаваемых половым путем. Трихомониаз ассоциируется с вагинитом, цервицитом, уретритом и воспалительными заболеваниями органов малого таза. Он оказывает влияние на исход беременности и считается кофактором передачи ВИЧ. Распространенность варьирует в пределах 5-74 % для женщин и 5-29% для мужчин. Трихомонада мочеполовая передается при половом контакте. Возможность инфицирования женщин трихомониазом при купании в реках, в бане в настоящее время полностью отвергается. В зависимости от длительности реакции заболевания и интенсивности различают свежую, острую, торпидную, хроническую формы трихомониаза и трихомонадоносительство. Также различают урогенитальный трихомониаз не осложненный и трихомониаз с осложнениями. Осложнения при трихомонадных уретритах у мужчин встречается часто и представлены в виде простатита, везикулита и эпидидимита, которые по клинической картине таковых гонорейной этиологии протекают более бурно. При длительном течении возможно образование множественных стриктур уретры. Для успешной диагностике трихомониаза следует придерживаться следующих принципов: сочетанное использование различных способов диагностики; неоднократные исследования изучаемого материала; забор материала из разных органов (уретра, мочевой пузырь, вульва, вагина, протоки больших вестибулярных желез), правильная техника забора и транспортировка материала. Для лабораторной диагностики трихомониаза принимаются следующие методы: микроскопия нативного препарата, микроскопия окрашенного препарата, люминисцентная микроскопия, культуральные, иммунологические методы, метод ПЦР. С помощью применения комплексной диагностики трихомониаза оценивается форма и тактика лечения. Нами были проведены обследования группы пациентов (мужского и женского пола), с хроническим трихомониазом 48 человек и острым трихомониазом 16 человек. Были проведены следующие методы диагностики: микроскопия мазка, иммуноферментный анализ (ИФА), бактериологический посев на Trichomonas vaginalis и ДНК - диагностика (ПЦР). В 1 группе с хроническим трихомониазом был обнаружен возбудитель при микроскопии мазка у 25 человек, что составило 52 %, у 27 человек - при бактериологическом посеве (56%); у 33 человек - методом ИФА (68,7%) и у 38 человек - с помощью ПЦР диагностики. В группе с острой формой трихомониаза: микроскопия - 12 человек (75%); метод ИФА - 1 человек (6%), бактериологический посев - 7 человек (43%), метод ПЦР - 14 человек (87,5%). Все пациенты получали соответствующее патогенетическое лечение. После лечения проводился контроль излеченности через 15 дней, повторный контроль проводился через 30 дней. Всем больным предлагалось отказаться от половых контактов на время лечения и полного снятия диагноза. Контроль после окончания лечения проводился тремя методами диагностики: с помощью микроскопии, бактериологическим методом и методом ПЦР. При контроле излеченности через 30 дней после лечения с хроническим трихомониазом при микроскопии были обнаружены положительные результаты у 8 человек (16,6%), при бактериологическом посеве - 12 человек (25 %), с помощью ПЦР - диагностики - 23 человека (47%). Данные контрольных результатов через 30 дней после лечения трихомониаза с острым течением: казались положительными при использовании метода микроскопии 3 человека (18,7%), при бактериологическом посеве - 3 человека (18,7%), при использовании ПЦР- диагностики -5 человек (31,2%). Таким образом, полученные данные подтвердили наиболее высокую эффективность применения ПЦР анализа в качестве диагностики, особенно при хронической форме трихомониаза и контроля качества лечения.
Резюме. Лабораторная диагностика трихомониаза - обязательная составляющая при постановке диагноза урогенитальный трихомоноз. Обзор освещает диагностические методы, направленные на выявление простейшего, антигенов T.vaginalis, специфических антител и ДНК возбудителя. Отражены существующие проблемы в интерпретации результатов и сведения об эффективности применения того или иного метода в алгоритме обследования пациентов.
Ключевые слова: лабораторная диагностика, урогенитальный трихомониаз.
The laboratory diagnostic of genitourinary trichomoniasis (literature review)
Abstract. The laboratory diagnostics of trichomoniasis is strongly recommended for the diagnosis confirmation. Current review summarizes diagnostic methods directed to identification by morphology of protozoa, by antigenic properties of T.vaginalis, by specific antibodies and by the pathogen DNA detection. Overview reflects the existing problems in the interpretation of results and information about the efficacy of each method in the patient's examination algorithm.
Key words: laboratory diagnostics, urogenital trichomoniasis.
Трихомониаз в структуре ИППП
Одно из центральных мест в структуре заболеваемости инфекциями, передающимися половым путем, занимает трихомоноз. Он широко распространен в странах Африки, Южной и Юго-Восточной Азии, а также в странах с большим притоком эмигрантов. В последние годы продолжается положительная тенденция к снижению уровня заболеваемости трихомонозом, однако отмечается рост скрытых и малосимптомных форм инфекции, затрудняющих своевременную диагностику трихомониаза и лечение [7,11].
Особенно распространен трихомоноз среди женщин [33], однако вопрос о значении T.vaginalis в патологии беременности остается открытым из-за противоречивости информации по этому вопросу [23,26]. Клиническая картина урогенитального трихомоноза характеризуется отсутствием специфических признаков и примерно у 50 % инфицированных трихомонозом имеет место бессимптомный характер течения заболевания, т.е. возможно трихомонадоносительство [49]. Недовыявление трихомонад - причина неконтролируемого их распространения среди сексуально активного населения. В результате это приводит к развитию хронических орхоэпидидимитов и простатитов у мужчин, а также хронических аднекситов у женщин, что в итоге может служить причиной бесплодия, невынашивания беременности, патологии новорожденных [25,29].
Трихомоноз имеет важное медицинское, социальное и экономическое значение не только из-за высокой распространенности инфекции, но и из-за доказанной роли T.vaginalis как кофактора ВИЧ-инфекции и рака шейки матки [33].
Сравнительный анализ лабораторных методов диагностики трихомониаза
Диагностика урогенитального трихомониаза основывается на обнаружении в исследуемом материале T.vaginalis. Диагноз не может быть поставлен исключительно на основании клинической картины, поскольку патогномоничные симптомы встречаются только у 2 % пациенток. Ещё в 1980 году были представлены результаты, свидетельствующие о том, что если диагноз трихомоноза устанавливать только на основании клинической картины, то 88 % инфицированных T.vaginalis женщин будет дан ложноотрицательный результат, а у 29 % неинфицированных диагноз был бы поставлен ошибочно [27]. В связи с тем, что клинические симптомы зачастую не отражают реальной картины заболевания, в обязательном порядке необходимо применение лабораторных методов диагностики трихомониаза, причем актуальна задача своевременного проведения исследования.
До настоящего времени в соответствии с протоколом ведения больных урогенитальным трихомониазом [14] основными методами обнаружения трихомонад являются микроскопический и культуральный, т.е. прямая идентификация возбудителя в мазке либо при культивировании на питательной среде. Но сложилась парадоксальная ситуация: при высоком уровне заболеваемости трихомонозом в России отсутствует производственный выпуск стандартных, разрешенных к применению препаратов и питательных сред для диагностики трихомониаза. В практике используют зарубежные среды, что влияет на стоимость исследования, или приготовленные по прописям в лабораториях, что влияет на воспроизводимость и достоверность получаемых результатов.
Диагностика трихомониаза существенно осложнилась в последние годы в связи с распространенностью нетипичных округлых форм T.vaginalis, обнаруживаемых при световой микроскопии витальных препаратов [3].
Роль микроскопического метода при постановке диагноза
Исторически микроскопия - это первый метод в лабораторной диагностике трихомоноза. Его использование экономически целесообразно в силу простоты и возможности одновременного просмотра мазка и на другие возбудители. Микроскопия может производиться в нативном препарате или в препарате, окрашенном по различным методикам. Нативный препарат необходимо исследовать в течение 10 минут после забора материала, поскольку утрачивается подвижность возбудителя, клетка округляется и получение однозначного результата затрудняется [30]. В положительных случаях микроскопии нативного препарата трихомонады обнаруживаются в виде грушевидной, овальной или округлой формы по величине несколько превосходящей лейкоциты [5]. Для подвижных форм характерны толчкообразные движения за счет жгутиков и ундулирующей мембраны, которые особенно хорошо видны при исследовании в микроскопе с темнопольным конденсором. Необходимо отличать подвижность T.vaginalis от подвижных жгутиковых представителей семейства Bodonidae. Подвижные бактерии, прикрепленные к лейкоцитам и создающие ложное впечатление движения, также вероятно ошибочно идентифицировать как крупную трихомонаду.
Микроскопия окрашенных препаратов несколько повышает процент выявления трихомонад по сравнению с нативными препаратами в силу того, что учитываются не только типичные жгутиковые, но и амастиготные формы. Кроме того окрашенные препараты можно использовать для косвенной оценки воспалительного процесса - скопление лейкоцитов на клетках плоского эпителия или вокруг них. Еще один косвенный признак урогенитального трихомоноза - наличие большого количества слизи в исследуемом материале [6]. Правда, с увеличением количества лейкоцитов в отделяемом из уретры у мужчин больных урогенитальным трихомонозом, вероятность получения ложноположительных результатов культуральным и микроскопическим методами увеличивается [12].
В препаратах, окрашенных метиленовым синим, трихомонады наблюдаются в виде округлой или овальной формы, расположенные в слизи между клеточными элементами. Четко просматривается оболочка паразитов, эксцентрично расположенное ядро, интенсивно окрашенное в синий цвет, протоплазма - светло-синяя, вакуоли - бесцветные. При таком способе окраски трихомонады имеют характерный вид и хорошо распознаются [8]. Для более детального просмотра клетки и выявления хорошо идентифицируемых жгутиков следует использовать дифференциальные методы окраски по Романовскому-Гимзе, Лейшману.
В целом микроскопия нативного препарата считается высокоспецифичным тестом (99,8 %), но имеет низкую чувствительность - от 38 % до 82 %. [1,10 ,17,48]. Во многом это связано с высокой долей субъективизма при визуальной оценке результатов.
Питательные среды для культурального исследования
В связи с низкой чувствительностью микроскопического метода и в соответствии с протоколом ведения больных урогенитльным трихомониазом [14] идентификацию T.vaginalis следует проводить культуральным методом, считающимся, по мнению большинства исследователей, "золотым стандартом".
Первое in vitro культивирование T.vaginalis было проведено в 1915 г [36]. С тех пор разработаны разные варианты жидких и полужидких питательных сред для диагностики трихомониаза: среда Джонсона-Трасселя (СPLM), Даймонд среда, модифицированная Даймонд среда с добавлением тиогликолята натрия, среда Купферберг STS, среда Купферберг Difco, среда InPouch TV, среда TYM.
Известна попытка создания бессывороточной питательной среды для культивирования трихомонад [35]. Была предложена синтетическая питательная среда, в которой лошадиная сыворотка была заменена на бычий сывороточный альбумин и холестерин, совместно либо с глицериновыми жирными кислотами, либо со смесью жирных кислот. Однако на такой модифицированной среде скорость роста и урожай T.vaginalis были низкими.
В 70-80-х годах прошлого века в отделе микробиологии ЦНИИКВИ была разработана модифицированная среда Джонсона-Трасселя - среда СКДС [5]. В состав этой среды входят: смесь гидролизата казеина и гидролизина или аминопептида, отходы фармацевтической промышленности при изготовлении лизоцима, ферментативный гидролизат биомассы микроорганизмов, а также экстракт кормовых дрожжей. Коммерчески среда СКДС не выпускается.
В настоящее время отечественные производители выпускают следующие готовые питательные среды: питательная среда для выявления влагалищных трихомонад (ООО "Диагност-Мед", г. Омск), основа питательной среды для культивирования трихомонад (НПО "Микроген", г. Махачкала) и питательная среда СВТ для визуальной диагностики трихомониаза (НИИЭМ имени Пастера, г. Санкт-Петербург).
Исследования, посвященные сравнению питательных сред, немногочисленны. Так, в США в 1989 г. были проведены сравнительные испытания питательных сред, используемых для культивирования T.vaginalis. В качестве посевного материала они использовали клинические образцы вагинальных секретов от больных трихомонозом [43]. Частота обнаружения на разных питательных средах была следующей: Даймонд среда (93,9 %), модифицированная Даймонд среда с добавлением тиогликолята натрия (92,3 %), среда Купферберг STS (38,5 %) и среда Купферберг Difco (49,2 %). Были отмечены высокие ростовые свойства питательной среды Даймонд и положительный эффект добавления. Авторы, однако, указывают на низкую селективность исследованных питательных сред в отношении дрожжеподобных грибов (в 32 % случаев наблюдался рост дрожжеподобных грибов).
В Англии в 1997 г было проведено сравнительное исследование чувствительности питательных сред InPouch TV, Diamond и Джонсона-Трасселя [21]. В 4 мл каждой из трех сред добавляли по 30 мкл инокулюма. Результат оценивали на первые, вторые и четвертые сутки. Было показано, что наибольшей чувствительностью обладает питательная среда InPouch TV (87 %) по сравнению с Diamond (60 %) и Джонсона-Трасселя (57 %).
Культуральная диагностика трихомониаза напрямую зависит от выпускаемых питательных сред. В оптимальном алгоритме лабораторной диагностики обязательной ступенью должно быть культуральное исследование, причем с использованием качественных стандартизированных питательных сред [9]. Этот вывод подтверждается исследованиями, проведенными в 1990 г в ЦНИКВИ [2], которые показали, что подавляющее число больных трихомонозом (72,8 %), как среди женщин, так и среди мужчин, были выявлены при использовании культурального метода.
Методы, основанные на выявлении антигенов
Использование иммунохимических методов обнаружения антигенов возбудителя, таких как иммуноферментный анализ (ИФА) и реакция иммунофлуоресценции (РИФ), особенно актуально в случаях невозможности проведения культурального исследования или при расхождении результатов культурального и микроскопического методов.
Было показано, что чувствительность РИФ ниже, чем культурального исследования, но выше микроскопии нативного препарата [44]. Однако эта во многом субъективная методика к тому же требует отдельной обработки каждого мазка и люминесцентного микроскопа. Одновременная обработка всех проб в планшете и автоматическая детекция цветовых продуктов ферментативной реакции исправили некоторые основные недостатки РИФ.
В работах 80-х годов ИФА давал соизмеримый с культуральным методом процент положительных результатов. Однако авторы указывали, что из-за очевидной гетерогенности изолятов T.vaginalis при описываемых ими условиях ни один из них не имеет моноклональных антител, способных связываться с антигенами в клинических образцах [31,47]. Использование в качестве антигена отдельных иммуногенных белков для получения моноклональных антител несколько изменило сложившееся представление, и была продемонстрирована возможность обнаружения почти 90 % из протестированных клинических изолятов с положительным ответом.
Кроме того, явное преимущество этого метода перед методом "золотого стандарта" - это отсутствие строгих температурных требований. Авторы отмечают, что, возможно, важным звеном в получении достоверного результата служит процедура получения клинического материала, и важно использовать для образца буферный раствор, вследствие того, что помещение организма в фосфатно-солевой буферный раствор позволяет ему освобождать антигенную детерминанту, необходимую для связывания с антителом. Из этого следует, что ранее приписываемая гетерогенность T.vaginalis может быть обусловлена недоступностью антигенных детерминант для антитела, а не отсутствием антигена на поверхности трихомонады [34].
Стоит подчеркнуть, что в России отсутствуют коммерческие разрешенные к применению ИФА и РИФ тест-системы для диагностики трихомониаза.
Диагностическая ценность серологического метода
Изучением иммунологии трихомоноза занимаются уже долгое время [3]. В литературе мало информации о природе иммунного ответа при трихомонозе, неизвестно влияние макро и микроорганизмов на наличие или отсутствие симптомов. Однако понятно, что природа этого механизма неоднозначна и многообразна [20].
Большая часть противотрихомонадных антител принадлежит к IgG-классу [37]. Тем не менее, в сыворотках больных женщин выявляют повышенное содержание специфических IgM, и IgA антител, а при остром трихомонозе в вагинальных смывах отмечается увеличение IgA [28]. Для определения противотрихомонадных антител у пациентов в разные годы пытались использовать реакцию связывания комплимента (РСК) [18], внутрикожную пробу [8], реакцию пассивной гемагглютинации (РПГА) [32, 37, 38], реакцию непрямой иммунофлуоресценции (РНИФ) [13].
В 1981 году для серодиагностики трихомоноза впервые был использован метод иммуноферментного анализа (ИФА). При использовании в качестве "подложки" цельноклеточного антигена чувствительность составила всего 80,4 % [45]. Позднее были предприняты попытки использовать в качестве антигена цистеиновые протеиназы T.vaginalis, поскольку предполагается, что они вовлечены в патогенез. Специфичность в этом случае составила 100 %, однако чувствительность не превысила 90 % [20, 46].
В России подобных работ не проводилось, и, по мнению наших исследователей, чувствительность метода составляет чуть более 30 %, и его использование может быть рекомендовано только в качестве вспомогательного теста [16]. Низкая эффективность серологических методов в диагностике трихомониаза связана также с тем, что антитрихомонадные антитела могут циркулировать в сыворотке крови в течение длительного времени после лечения, а значит, практически невозможно дифференцировать текущую и пролеченную формы заболевания [19].
Методы, основанные на выявлении нуклеиновых кислот. Методы генодиагностики на основе определения специфических нуклеотидных последовательностей (мишеней) ДНК возбудителя появились сравнительно недавно. Уже в 1992 Riley D. E. впервые сообщил об использовании ПЦР в диагностике трихомоноза [41]. В работе было показано, что этот метод при использовании электрофоретического способа регистрации результатов помогает выявлять от 10 до 100 трихомонад в исследуемом материале.
Чувствительность и специфичность ПЦР во многом обусловлена правильным выбором мишеней для амплификации [42]. В наибольшей степени исследованные локусы в геномах простейших - это гены рибосомальных РНК, отличающиеся мультикопийностью (254 копии 18S рРНК/на клетку T.vaginalis) [22]. Наряду с геном 18S pРНК исследован ген бета-тубулина T.vaginalis. Использование праймеров из этого гена обеспечивало чувствительность равную 98 % в сравнении с культуральным методом системы InPouch [39]. Вместе с тем, оценивая эффективность праймеров, следует учитывать генетически обусловленную внутривидовую вариабельность Т.vaginalis. Сравнение пяти наборов диагностических праймеров показало, что чувствительность ПЦР, в первую очередь, зависит от выбора праймеров и, в меньшей степени, от способа регистрации результата: иммуноферментный метод детекции продуктов ПЦР показал лучший результат, чем электрофорез в геле [24].
Согласно современным представлениям, применение метода ПЦР оправдано при диагностике латентного течения трихомоноза, для выявления Т.vaginalis при микст-инфекции урогенитального тракта, при скрининговых исследованиях (в комплексе с микроскопическим методом), а также для контроля качества микроскопического исследования. В целом, эффективность диагностики существенно повышается при использовании ПЦР в сочетании с культуральным и/или микроскопическими методами исследования.
Заключение
Из-за отсутствия четкой клинической картины при хронических и стертых формах трихомоноза только лабораторные методы выявляют этиологический агент и устанавливают диагноз заболевания. В лабораторной диагностике острого трихомоноза при наличии в исследуемом материале типичных форм паразитов микробиологические методы дают однозначно интерпретируемые результаты, тогда как хронический трихомоноз, обусловленный неподвижными округлыми трихомонадами, представляет определенные трудности и требует использования комплекса лабораторных методов. Отметим, что, при очевидных преимуществах ПЦР, основным референс методом остается культуральное исследование.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Трихомониаз: причины появления, симптомы, диагностика и способы лечения.
Определение
Урогенитальный (мочеполовой) трихомониаз – инфекционное заболевание, вызываемое простейшим паразитом влагалищной трихомонадой (Trichomonas vaginalis). Во внешней среде возбудитель неустойчив, он погибает при температуре +40°С, под воздействием ультрафиолета, дезинфектантов, при высушивании, а также смещении вагинального рН. Заболевание передается половым путем и вызывает поражение урогенитального тракта человека.

Причины появления трихомониаза
У взрослых заражение трихомониазом происходит при незащищенном половом контакте с больным урогенитальным трихомониазом.
Заражение детей возможно интранатальным путем (во время родов). В исключительных случаях девочки младшего возраста могут заражаться при нарушении правил личной гигиены (например, через влажное полотенце, которым незадолго до этого пользовался больной трихомониазом).
Классификация трихомониаза
Классификация урогенитального трихомониаза основана на локализации воспалительного процесса.
1. Трихомониаз нижнего отдела урогенитального тракта у женщин:
- вульвит - воспаление малых половых губ и преддверия влагалища;
- вагинит, или кольпит – воспаление влагалища;
- цервицит – воспаление шейки матки;
- уретрит – воспаление мочеиспускательного канала (уретры);
- цистит – воспаление мочевого пузыря.
- вестибулит – воспаление вестибулярных желез в преддверии влагалища;
- парауретрит, или скинеит – воспаление парауретральных желез;
- сальпингит – воспаление фаллопиевых (маточных) труб.
- уретрит - воспаление мочеиспускательного канала (уретры);
- баланит и баланопостит – воспаление кожи головки полового члена и воспаление кожи головки полового члена в сочетании с воспалением крайней плоти соответственно;
- цистит - воспаление мочевого пузыря.
- эпидидимит – воспаление придатков яичка;
- простатит – воспаление предстательной железы;
- везикулит, или сперматоцистит – воспаление семенных пузырьков;
- парауретрит - воспаление парауретральных желез.
Жалобы пациентов с трихомониазом неспецифичны – аналогичные симптомы могут отмечаться и при других ИППП. Возможно острое и хроническое течение заболевания, часто, особенно у мужчин, болезнь протекает бессимптомно.
Трихомониаз нижних отделов мочеполового тракта.
20-40% больных не предъявляют никаких жалоб.
При наличии клинических проявлений женщин беспокоят выделения из половых путей серо-желтого цвета, нередко – пенистых, с неприятным запахом. Возможны зуд, жжение, болезненность во время половых контактов (диспареуния) и/или при мочеиспускании (дизурия), дискомфорт и/или боль в нижней части живота.
Мужчин могут беспокоить серо-желтые, жидкие выделения из уретры, зуд, жжение в области уретры, боль в промежности, отдающая в прямую кишку, возможны диспареуния и дизурия. Реже болезнь проявляется эрозивно-язвенными высыпаниями на коже головки полового члена. Иногда в сперме присутствует кровь.
Трихомониаз органов малого таза и других мочеполовых органов.
При вестибулите женщин беспокоят незначительные выделения из половых путей серо-желтого цвета, нередко – пенистые, с неприятным запахом, болезненность и отечность в области вульвы. При формировании абсцесса (гнойного воспаления с образованием полости) присоединяются симптомы общей интоксикации, появляются интенсивные боли пульсирующего характера.
При сальпингите женщины отмечают боль в нижней части живота, нередко схваткообразного характера, пенистые выделения из половых путей серо-желтого цвета, с неприятным запахом. При хроническом течении заболевания субъективные проявления менее выражены.
При эпидидимите мужчин беспокоят серо-желтые, жидкие выделения из мочеиспускательного канала, дизурия, диспареуния, болезненность в области придатка яичка и паховой области, боль в нижней части живота, в области мошонки, в промежности, отдающая в прямую кишку, поясницу и крестец.
При простатите пациенты жалуются на боль в промежности и в нижней части живота с иррадиацией в область прямой кишки, дизурию.
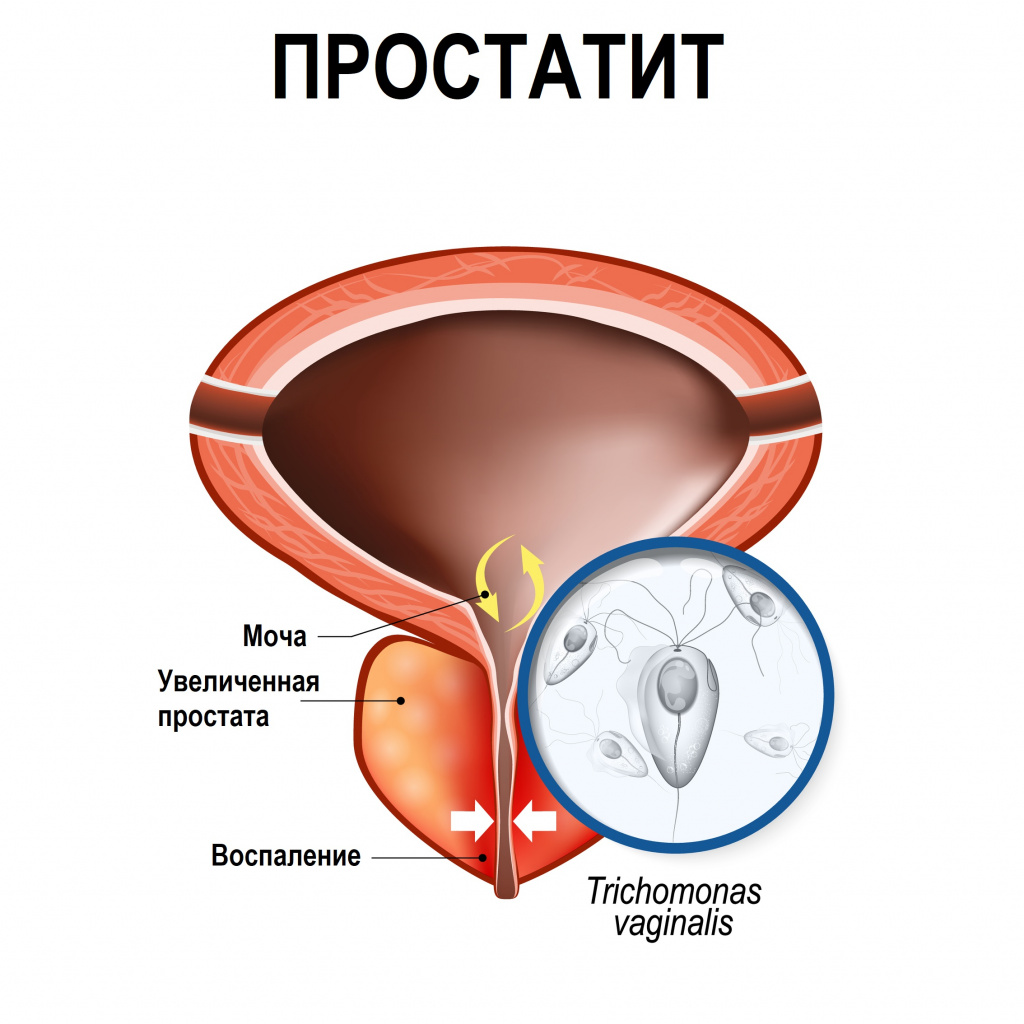
При везикулите отмечается боль в области крестца, промежности, заднего прохода, усиливающаяся при мочеиспускании и дефекации, учащенное мочеиспускание, ночные эрекции, возможна примесь крови в сперме.
Диагностика трихомониаза
Заподозрить воспалительное заболевание мочеполового тракта врач может на основании жалоб и данных осмотра пациента. Подтвердить диагноз и главное - установить возбудителя, чтобы назначить адекватное лечение, можно только по результатам лабораторной диагностики.
Поскольку трихомониаз может быть причиной бесплодия и осложнений беременности, исключение этого заболевания требуется половым партнерам при планировании беременности и при обследовании женщин во время беременности, а также в случае гибели плода и бесплодия в анамнезе.
Обследование показано перед предстоящими операциями на половых органах и органах малого таза, а также половым партнерам больных ИППП и лицам, перенесшим сексуальное насилие.
- Основными методами лабораторного подтверждения трихомониаза являются микроскопическое исследование мазка, микробиологический посев и ПЦР-тестирование.
- Trichomonas vaginalis обнаруживается в гинекологических и урологических мазках на микрофлору - микроскопическое (бактериоскопическое) исследование мазка, окрашенного по Граму.
Трихомониаз - заболевание мочеполового тракта, вызванное инфицированием Trichomonas vaginalis, являющейся строгим облигатным паразитом человека. Это одно из самых частых заболеваний, передающихся половым путем. У мужчин поражается, уретра, предстательная железа и семенные пузырьки, у женщин – влагалище, шейка матки и уретра.
- определяемый фрагмент - специфический участок ДНК Trichomonas vaginalis;
- специфичность определения - 100%;
- чувствительность определения - 100 копий ДНК Trichomonas vaginalis в образце.
Обследование женщин целесообразно проводить в первую половину менструального цикла, не ранее 5 –ого дня. Допустимо обследование во второй половине цикла, не позднее, чем за 5 дней до предполагаемого начала менструации. При наличии выраженных симптомов воспаления, взятие материала проводится в день обращения. Накануне и в день обследования пациентке не рекомендуется выполнять спринцевание влагалища. Не рекомендуется взятие биоматериала на фоне проведения антибактериальной терапии ( общей / местной) и во время menses, ранее 24- 48 часов после полового контакта, интравагинального УЗИ и кольпоскопии. Рекомендуется брать материал не ранее, чем через 14 дней после применения антибактериальных препаратов и местных антисептиков, и не ранее, чем через 1 месяц после применения антибиотиков перорально. Если для исследования берут соскоб из уретры, сбор материала проводят до или не ранее 2 - 3 часов после мочеиспускания.
- Установление этиологии хронического инфекционного процесса урогенитального тракта.
- Воспаление мочеполовой системы.
- Цистит, пиелонефрит, эндометрит.
- Беременность.
- Простатит, везикулит.
- Бесплодие.
- Зуд в области наружных половых органов.
- Обильные выделения из влагалища у женщин или скудные белесоватые или серые пенистые выделения из мочеиспускательного канала у мужчин.
- Прожилки крови в сперме.
- Дифференциальная диагностика урогенитальных инфекций.
- Профилактические скрининговые исследования.
Интерпретация результатов исследований содержит информацию для лечащего врача и не является диагнозом. Информацию из этого раздела нельзя использовать для самодиагностики и самолечения. Точный диагноз ставит врач, используя как результаты данного обследования, так и нужную информацию из других источников: анамнеза, результатов других обследований и т.д.
Обращаем внимание, что сроки выполнения ПЦР-исследований могут быть увеличены при проведении подтверждающих тестов.
Читайте также:

