Методические рекомендации по видовой идентификации стафилококков
Обновлено: 18.04.2024
Микробиологические методы идентификации микробов
рода Staphylococcus
Целью идентификации является установление рода и вида выделенной чистой культуры. Род стафилококка относится к семейству Micrococcaceae, в которое входят также роды Micrococcus и Planococcus. Общими чертами представителей этого семейства являются: морфология, положительная окраска по Граму; наличие фермента – каталазы.
Род Staphylococcus состоит из нескольких видов, наиболее важными из которых являются S.аureus, S.epidermidis и S.saprophyticus. Представители последних двух видов являются коагулазоотрицательными и долгое время считались непатогенными. В настоящее время доказано, что эпидермальный стафилококк может вызвать такие заболевания, как эндокардит, сепсис, конъюнктивит, инфекция ран и мочевыводящих путей, послеродовые инфекции, а сапрофитический – острый уретрит, цистит и др. На первом этапе устанавливается принадлежность выделенной культуры к семейству Micrococcaceae и роду Staphylococcus. На принадлежность культуры к семейству микрококков указывает положительная проба на каталазу, так как другие кокки (в частности стрептококки), каталазу не образуют. Для установления принадлежности культуры к роду Staphylococcus основными методами являются культуральный и биохимический.
Культуральный метод . Основным отличием стафилококков от микрококков является окраска колоний на плотной среде. Для стафилококков характерна золотистая или белая окраска колоний. У микрококков колонии окрашены в желтый или розовый цвет.
Биохимический метод . Он основан на том, что стафилококки являются факультативными анаэробами, микрококки – облигатными аэробами. В связи с этим стафилококки способны расти и ферментировать глюкозу в анаэробных условиях, а микрококки лишены этой возможности. Для определения этого признака культуру засевают петлёй в столбик полужидкой среды, содержащей 1% глюкозы и индикатор на кислые продукты. Сверху среду заливают стерильным вазелиновым маслом и ставят в термостат при 37 0 С на 5 суток. Рост культуры и изменение цвета среды указывает на принадлежность её к роду Staphylococcus.
Если культура имеет золотистый (палевый), пигмент, коагулирует плазму и обладает хотя бы одним из двух других ферментов (лецитиназа, ДНК–аза) – её относят к виду золотистого стафилококка. При отсутствии полного набора указанных признаков (основным является наличие плазмокоагулазы) проводят идентификацию видов эпидермального и сапрофитического стафилококков по трем основным признакам, отличающим эти два вида (см. таблицу).
Вид стафилококка | Устойчивость к новобиоцину | Фосфатаза | Ферментация маннита |
эпидермальный | - | + | - |
сапрофитический | + | - | + |
Устойчивость к новобиоцину определяют путём посева культуры на среду, содержащую 2 мкг/мл новобиоцина. Ферментацию маннита проводят в аэробных условиях путём посева культуры бляшкой на поверхность среды в чашке Петри, содержащей 1% маннита и индикатор на кислые продукты. Появление окрашенных колоний (в цвет индикатора) указывает на способность культуры ферментировать маннит. Таким образом, для эпидермального стафилококка характерны:
- чувствительность к новобиоцину;
- наличие фосфатазы и неспособность окислять маннит.
Для сапрофитического стафилококка характерны противоположные свойства.
Выделенные культуры S.aureus обычно подвергают фаготипированию с международным набором фагов (22 фага). Определение фаготипа стафилококка помогает установить источник инфекции и принадлежность выделенной культуры к госпитальным штаммам.
Контрольные вопросы
Опишите по дням ход исследования и результаты при выделении золотистого стафилококка из гноя. Опишите по дням ход исследования и результаты при подозрении на сепсис: сколько крови взять, в какую питательную среду посеять, какое количество питательной среды взять, в каких условиях производится взятие крови и её посев. Дальнейший ход исследования описать отдельно при обнаружении стафилококка и стрептококка. Какие материалы исследуют при подозрении на стафилококковое пищевое отравление, что обнаруживают в исследуемых материалах, на каких животных ставится проба? Идентификация чистой культуры стафилококка: по каким признакам определяют родовую и видовую принадлежность. Методы определения факторов патогенности стафилококка: пламокоагулазы, лецитовителлазы, ДНК-азы. Фаготипирование стафилококков: с какой целью проводится, каким набором фагов, методика фаготипирования. Схема микробиологического исследования при пищевой интоксикации стафилококкового происхождения. Опишите по дням ход исследования и результаты при выделении стрептококка из гноя. Краткая характеристика основных видов из группы грамотрицательных микроорганизмов. Синегнойная палочка: название по–латыни, морфология, культивирование, пигментообразование, основные факторы вирулентности; группы больных, у которых чаще всего наблюдается синегнойная инфекция. Протей: название по-латыни, морфология и физиология, особенности культуральных свойств. Кишечные палочки: наиболее частые формы инфекции (места локализации воспалительных процессов). Характеристика возбудителей анаэробной газовой инфекции (основных трёх видов): название видов по-латыни, морфология (споры, жгутики, капсула). Окраска по Граму, способ биологического окисления, среды для культивирования, характер колоний в толще агара, изменения на среде Вильсон-Блера, изменения на молоке; свойства токсина, действие в организме, серологические типы токсина. Факторы инвазивности. Характеристика неспорообразующих (неклостридиальных) анаэробов. Классификация: семейства, роды, основные виды (названия по-латыни). Основные свойства: морфология, отношение к окраске по Граму, условия культивирования. Ассоциация микроорганизмов (смешанная инфекция) при гнойных и раневых инфекциях: наиболее частые сочетания, особенности микробиологической диагностики при ассоциациях возбудителей.
Задания для выполнения в процессе самоподготовки
Написать по-латыни названия видов неспорообразующих анаэробов, грамотрицательных микроорганизмов – возбудителей раневых и гнойных инфекций и названия возбудителей анаэробной газовой инфекции.
Работа студента на практическом занятии
1. Продолжение исследования гноя (2-й день). Изучите и опишите колонии стафилококка на чашках с кровяным агаром. С помощью миллиметровой бумажки определите диаметр зон задержки роста вокруг дисков с антибиотиками и сделайте вывод о чувствительности микрофлоры гноя к антибиотикам. Проведите идентификацию выделенной чистой культуры стафилококка:
а) учтите результаты посева на анаэробное сбраживании глюкозы;
б) поставьте реакцию плазмокоагуляции: в пробирку с 0,5 мл кроличьей цитратной плазмы в разведении 1:4 (опыт) и в другую пробирку с 0,5 мл раствора хлорида натрия (контроль) внесите по 1 петле исследуемой культуры стафилококка. Пробирки поставьте в термостат. В конце занятия проверьте результат и сделайте вывод, данные запишите в журнал;
в) учтите результаты посева на лецитовителлазу;
г) учтите результаты посева на ДНК-азу;
д) учтите результаты фаготипирования.
4. Разберите схему исследования при стафилококковой интоксикации.
5. Изучите профилактические и лечебные препараты, применяемые при стафилококковых и стрептококковых инфекциях. Посмотрите препараты, прочитайте этикетки, охарактеризуйте каждый препарат по схеме: что собой представляет (вакцина, анатоксин, сыворотка, иммуноглобулин и др.), что содержит (антиген, антитело), как приготовлен, для чего применяется. Если препарат лечебно-профилактический – какое оказывает действие на организм. Дозируется ли препарат и в каких единицах? Если диагностический – что выявляют с помощью этого препарата?
6. Исследование отделяемого раны на возбудителей анаэробной газовой инфекции. Ознакомьтесь с сопроводительной запиской и внесите данные в журнал. Приготовьте мазок из отделяемого раны, окрасьте по Граму, промикроскопируйте. Произведите посев на среду Китта–Тароцци, на среду Вильсон–Блера и на молоко. Проделанную работу и результаты запишите в журнал.
1.1 . В настоящих методических указаниях представлена информация о роли метициллинрезистентных штаммов золотистого стафилококка в возникновении внутрибольничных инфекций, их микробиологических и эпидемиологических особенностях, изложены традиционные и молекулярно-генетические методы идентификации и типирования.
1.2 . Методические рекомендации разработаны в помощь специалистам органов и учреждений, осуществляющих государственный санитарно-эпидемиологический надзор, и лечебно-профилактических учреждений, осуществляющих организацию и проведение профилактических и противоэпидемических мероприятий по борьбе с внутрибольничными инфекциями.
2.2 . Положение о государственной санитарно-эпидемиологической службе Российской Федерации, утвержденное постановлением Правительства Российской Федерации № 554 от 24 июля 2000 г.
В последнее десятилетие проблема внутрибольничных инфекций (ВБИ) приобрела исключительно большое значение для всех стран мира. Это обусловлено, прежде всего, значительным ростом числа госпитальных штаммов микроорганизмов, обладающих устойчивостью к широкому кругу антимикробных препаратов. Несмотря на значительный недоучет, в Российской Федерации ежегодно регистрируется около 30 тыс. случаев внутрибольничных инфекций, при этом минимальный экономический ущерб составляет более 5 млрд. рублей ежегодно. Среди возбудителей ВБИ одно из первых мест, по-прежнему, принадлежит микроорганизмам рода Staphylococcus , наиболее патогенным представителем которого является S . aureus . Эпидемиологическая ситуация осложняется в связи с широким распространением в стационарах, а также появлением и во внебольничной среде, клинических изолятов S.aureus, устойчивых к оксациллину (ORSA или MRSA). MRSA способны вызывать разнообразные клинические формы внутрибольничных инфекций, включая наиболее тяжелые, такие как: бактериемия, пневмония, синдром септического шока, септический артрит, остеомиелит и другие, которые требуют длительного и дорогостоящего лечения. Появление осложнений, вызванных MRSA, приводит к увеличению сроков госпитализации, показателей летальности, значительным экономическим потерям. Показано, что рост частоты ВБИ, наблюдаемый в стационарах различных стран мира, обусловлен распространением эпидемических штаммов MRSA, многие из которых способны вырабатывать пирогенные токсины - суперантигены, подавляющие иммунный ответ на S . aureus.
С конца 90-х годов прошлого века в стационарах России отмечается рост частоты выделения MRSA, которая в ряде больниц достигла 30 - 70 %. Это делает неэффективным использование многих антимикробных препаратов и существенно ухудшает качество оказания медицинской помощи населению. В этих условиях совершенствование методов эпидемиологического и микробиологического мониторингов, направленных на выявление эпидемически значимых штаммов, приобретает все более актуальное значение.
4.1. Таксономия и биологические особенности
4.2. Клиническое значение
В настоящее время MRSA являются ведущими возбудителями внутрибольничных инфекций в стационарах многих странах мира. Частота их выделения в стационарах США, Японии, многих стран Западной Европы достигает 40 - 70 %. Исключение составляют, по-видимому, только ряд скандинавских стран, где исторически были приняты жесткие противоэпидемические меры по контролю за распространением таких штаммов. В стационарах Российской Федерации частота выделения MRSA колеблется от 0 до 89 %. Наибольшая частота выделения отмечается в реанимационных, ожоговых, травматологических и хирургических отделениях стационаров, расположенных в крупных городах. Одной из основных причин этой закономерности является концентрация в таких стационарах пациентов с нарушениями целостности кожных покровов и поврежденными иммунологическими барьерами. Наиболее частым местом локализации инфекции являются послеоперационные и ожоговые раны и дыхательные пути. Первичные и вторичные бактериемии наблюдаются примерно у 20 % инфицированных больных. В случае инфицирования ожоговых больных частота бактериемии нередко возрастает до 50 %. Факторами, способствующими развитию бактериемии, является присутствие центрального венозного катетера, анемия, гипотермия и назальное носительство. Развитие бактериемии значительно увеличивает вероятность летального исхода. Особенно высокая смертность, обусловленная бактериемией, наблюдается среди пациентов, находящихся в ожоговых и отделениях интенсивной терапии, где она может достигать 50 % по сравнению с 15 % в контрольной группе. Риск развития летального исхода возрастает почти в три раза среди пациентов, у которых бактериемия обусловлена MRSA по сравнению с пациентами, инфицированными метициллинчувствительными штаммами S . aureus. Развитие госпитальной бактериемии приводит к значительному увеличению стоимости госпитализации. В современных условиях лечение таких пациентов требует, как правило, внутривенного введения ванкомицина, тейкопланина или линезолида, однако клиническая эффективность этих препаратов нередко оказывается значительно ниже, чем у антибиотиков, используемых для лечения пациентов с осложнениями, вызванными метициллинчувствительными S.aureus. По данным Центра по контролю за заболеваниями (США) средняя продолжительность пребывания пациента в больнице в случае хирургического вмешательства составляет 6,1 дня, тогда как при возникновении осложнений, вызванных MRSA она увеличивается до 29,1 дней, при этом средние расходы возрастают с 29455$ до 92363$ в пересчете на каждый случай. Заболевания, вызванные MRSA, могут начинаться на фоне терапии антибиотиками, в том числе аминогликозидами и цефалоспоринами. В этой связи необходимо отметить, что неадекватное назначение антибиотиков в случае тяжелых ВБИ драматически ухудшает прогноз заболевания. Летальность при осложнениях, вызванных MRSA, значительно колеблется и зависит как от возраста пациента, сопутствующего заболевания (артериальная гипертензия, диабет и др.), так и от присоединения дополнительной микрофлоры. Наиболее распространенными вторичными проявлениями инфекции, обусловленной MRSA, являются эндокардиты, гематогенный остеомиелит, септический артрит. Одним из наиболее грозных осложнений, вызываемых MRSA, является синдром токсического шока (СТШ). Клинические проявления СТШ включают следующий симптомокомплекс: гипертермия, сыпь, рвота, диарея, гипотензия, генерализованный отек, острый респираторный дистресс синдром, полиорганная недостаточность, диссеминированная интраваскулярная коагуляция. СТШ может развиться как осложнение после родов, хирургических вмешательств, при суперинфицировании S . aureus трахеальных повреждений, вызванных вирусом гриппа. Недавно описанные стафилококковая скарлатина и синдром упорной десквамации эпителия рассматривают как варианты СТШ.
4.3. Факторы патогенности и вирулентность
Вопрос о вирулентности MRSA остается дискутабельным. Они практически не вызывают заболевания у здоровых лиц из числа медицинского персонала. Вместе с тем, в многочисленных исследованиях показано, что прогноз при тяжелых формах внутрибольничных инфекций, таких как пневмония и бактериемия, значительно хуже среди пациентов, инфицированных MRSA, по сравнению с пациентами, инфицированными метициллинчувствительными S.aureus.
4.4. Генетический контроль устойчивости к метициллину и особенности фенотипической экспрессии
Мишенью действия b -лактамных антибиотиков (как пенициллинов, так и цефалоспоринов) являются транс- и карбоксипептидазы - ферменты, участвующие в биосинтезе основного компонента клеточной стенки микроорганизмов - пептидогликана. Благодаря своей способности связываться с пенициллином и другими b -лактамами данные ферменты получили название пенициллинсвязывающих белков (ПСБ). У Staphylococcus aureus имеются 4 ПСБ, отличающиеся как по молекулярной массе, так и по функциональной активности. Устойчивость метициллинрезистентных штаммов золотистого стафилококка (MRSA) к b -лактамным антибиотикам обусловлена продукцией дополнительного пенициллинсвязывающего протеина - ПСБ-2 ¢ , отсутствующего у чувствительных микроорганизмов. При подавлении В -лактамным антибиотиком активности основных пенициллинсвязывающих белков ПСБ-2 ¢ , в силу своего более низкого сродства к препаратам данной группы, продолжает функционировать и сохраняет микробной клетке жизнеспособность. Синтез ПСБ-2 ¢ кодируется геном mec A , расположенным на хромосоме S.aureus, в специфической области, обнаруживаемой только у метициллинрезистетных штаммов стафилококка - тес ДНК. Ме c ДНК представляет новый класс мобильных генетических элементов, который получил название стафилококковая хромосомная кассета тес (Staphylococcal chromosomal cassette тес = SCCmec ). Выявлено существование 4 типов SCCmec , различающихся как размерами (от 21 до 66 т.п.н.), так и набором генов, составляющих данные кассеты. Разделение на типы основано на различиях в генах, образующих собственно комлекс тес, и в наборе генов, кодирующих рекомбиназы сс rА и сс r В, входящих в различных сочетаниях в стафилококковую хромосомную кассету (рис. 1 ). Комлекс тес может включать: тесА - структурный ген, детерминирующий синтез ПСБ-2 ¢ ; mec I - регуляторный ген, влияющий на транскрипцию тесА; mecR1 - ген, передающий внутрь клетки сигнал о наличии в среде b -лактамного антибиотика; а также инсерционные последовательности IS 431 и IS 1272. В настоящее время известны 4 варианта комплекса тес (рис. 2 ).
Кроме того, различия между типами кассет тес обусловлены присутствием ряда дополнительных генов, расположенных в генетических областях J1а, J 1 b.
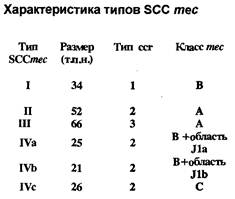
Рис. 1. Типы SCCmec.
Генетическая структура комплексов тес различных классов
• Класс A, IS431 - mecA-mecR1-mec1
• Класс В , IS431 - mecA- D mec R1-IS1272
• Класс С , IS431 - mecA- D mec R1-IS431
• Класс D, IS431 - mec A- D mec R 1
Рис. 2. тесА - структурный ген, детерминирующий синтез ПСБ-2 ¢ ;
mecI - регуляторный ген, влияющий на транскрипцию тесА;
mecR1 - ген, передающий внутрь клетки сигнал о наличии в среде b -лактамного антибиотика; IS431 и IS1272 - инсерционные последовательности
Уникальность метициллинрезистентности заключается также и в существовании феномена гетерорезистентности, суть которого состоит в том, что в условиях инкубации при 37 °С не все клетки популяции проявляют устойчивость к оксациллину. Генетический контроль феномена гетерорезистентности до настоящего времени полностью не выяснен. Известно только, что на экспрессию устойчивости могут влиять регуляторные гены b -лактамазы, а также ряд дополнительных генов, так называемые fem (factors essential for methicillin resistance) или aux, локализованные в различных частях хромосомы S.aureus, вне SCCmec . Сложность регуляции проявляется в фенотипических различиях. Выделяют 4 стабильных фенотипа (класса) резистентности. Первые три класса являются гетерогенными. Это означает, что в популяциях стафилококков, относящихся к этим классам, присутствуют субпопуляции микробных клеток с разным уровнем резистентности. При этом клоны стафилококков, получаемые из изолированных колоний (образовавшихся при рассеве первичной культуры) по популяционному составу полностью совпадают с исходной культурой.
Класс 1. Рост 99,99 % клеток подавляется оксациллином в концентрации 1,5 - 2 мкг/мл, рост 0,01 % микробов подавляется только при 25,0 мкг/мл.
Класс 2. Рост 99,9 % клеток подавляется при концентрации оксациллина 6,0 - 12,0 мкг/мл, тогда как рост 0,1 % микробов подавляется при концентрации > 25,0 мкг/мл.
Класс 3. Рост 99,0 - 99,9 % клеток подавляется при концентрации 50,0 - 200,0 мкг/мл и только рост 0,1 - 1 % микробной популяции подавляется при концентрации оксациллина 400,0 мкг/мл.
Класс 4. Представители этого класса характеризуются гомогенным уровнем устойчивости, который превышает 400,0 мкг/мл для всей популяции.
В связи с наличием гетерогенности по устойчивости к оксациллину могут возникать трудности при идентификации MRSA традиционными микробиологическими методами.
4.5. Особенности эпидемиологии MRSA
Будучи однажды занесенными в стационар, MRSА могут выживать там в течение длительного времени. Это определяет стратегию противоэпидемических мероприятий: очень важно не допустить занос и распространение в стационаре эпидемических штаммов.
Следует отметить, что периодически происходит смена эпидемического штамма, доминирующего на отдельных территориях. Так, по данным стафилококковой референс-лаборатории в Colindale ( London), в 1996 г. штаммы EMRSA-15 и EMRSA-16 были ответственны за более чем 1500 инцидентов, охвативших трех и более пациентов, в 309 больницах Англии, тогда как остальные эпидемические штаммы были ответственны только за 361 инцидент в 93 больницах. Распространение этих эпидемических штаммов привело к росту смертности от MRSA в 15, а частоты бактериемии в 24 раза за период с 1993 по 2002 г.г. согласно данным национального департамента статистики Великобритании.
Продолжает нарастать спектр антибиоткорезистентности эпидемических штаммов MRSA. Они гораздо быстрее, чем метициллинчувствительные, приобретают устойчивость к препаратам из группы фторхинолонов. Характерной чертой многих эпидемических штаммов MRSA является устойчивость практически ко всем известным классам антимикробных препаратов, за исключением гликопептидов и оксазолидинонов. В последние годы участились случаи выделения изолятов MRSA, обладающих умеренной чувствительностью к ванкомицину и даже ванкомицинрезистентных. Распространение таких штаммов в стационарах России может иметь драматические последствия.
С проблемой госпитальных штаммов MRSA тесно переплетается и проблема MRSA вне госпитального происхождения. Эти штаммы пока не обладают множественной резистентностью к антибиотикам, генетически отличаются от госпитальных штаммов, их происхождение остается неизвестным. Предполагается, что они сформировались из спорадических госпитальных штаммов. Внегоспитальные штаммы MRSA способны вызывать некротизирующую форму пневмонии, характеризующуюся крайне тяжелым течением и требующей госпитализации пациента, в связи с чем возникает угроза заноса и распространения таких штаммов в стационарах.
Диагностика и санация стафилококковых бактерионосителей
Главный государственный санитарный врач Российской Федерации - Первый заместитель Министра здравоохранения Российской Федерации Г.Г.Онищенко 6 апреля 2001 г.
В методических рекомендациях представлена принципиально новая схема лабораторной диагностики стафилококковых бактерионосителей: цитоскопический метод выявления бактерионосителей стафилококков; питательная среда, позволяющая выделять стафилококки с персистентными свойствами; способ дифференциации стафилококковой микрофлоры, основанный на определении у штаммов, выделенных от бактерионосителей, факторов персистенции; предложены новые средства санации: масляный раствор витамина А, микроклимат спелеошахты, препарат электролизного водного раствора гипохлорита натрия.
Методические рекомендации предназначены для бактериологов, эпидемиологов, инфекционистов и врачей других специальностей.
Рекомендации разработаны сотрудниками Оренбургской государственной медицинской академии и Оренбургского института клеточного и внутриклеточного симбиоза УрО РАН (член-корреспондент РАН и РАМН, профессор О.В.Бухарин; профессор Б.Я.Усвяцов, доктор биологических наук О.Л.Карташова, кандидат биологических наук С.Б.Киргизова, кандидат медицинских наук Л.И.Паршута).
Введение
Настоящие методические рекомендации посвящены проблеме профилактики стафилококкового бактерионосительства.
В этиологической структуре внутрибольничных инфекций, возникающих в акушерских и хирургических стационарах, большая роль принадлежит стафилококкам. Основным источником гнойной стафилококковой инфекции являются бактерионосители.
Работами сотрудников Оренбургской медицинской академии и Института клеточного и внутриклеточного симбиоза УрО РАН (1989-1997) установлено, что факторы персистенции стафилококков (антилизоцимная, антиинтерфероновая, антикомплементарная активности), направленные на инактивацию защитных механизмов хозяина, обеспечивают длительное переживание бактерий и создают основу резидентного бактерионосительства.
В представленных методических рекомендациях предлагаются новые подходы к профилактике стафилококковых инфекций, включающие: цитоскопический метод выявления бактерионосителей; питательную среду, позволяющую избирательно выделять стафилококки с персистентными свойствами; способ дифференциации резидентной и транзиторной стафилококковой микрофлоры, основанный на определении факторов персистенции у штаммов, выделенных от бактерионосителей.
Учитывая то обстоятельство, что подавление персистирующих свойств возбудителя затрудняет его паразитирование и тем самым повышает эффективность лекарственных воздействий, разработаны эффективные способы санации через снижение персистентных характеристик стафилококка.
Апробация предлагаемых методик в лечебно-профилактических учреждениях города показала их преимущество по сравнению с классическими методами профилактики.
Приоритетность способов диагностики и санации стафилококковых бактерионосителей подтверждена 2 авторскими свидетельствами и 4 патентами РФ на изобретения.
Диагностика стафилококковых бактерионосителей
Предлагаемый метод диагностики стафилококкового бактерионосительства отличается от существующих принципиально новой схемой исследования, включающей в себя: цитоскопический метод выявления бактерионосителей стафилококков; посев на питательную среду, позволяющую избирательно выделять стафилококки с персистентными свойствами (патент РФ N 2088668 "Питательная среда для выделения стафилококков с персистентными характеристиками"); способ дифференциации резидентной и транзиторной стафилококковой микрофлоры, основанный на определении факторов персистенции у штаммов, выделенных от бактерионосителей.
Цитоскопический метод
1. Реактивы, приборы, стекло
1.1. Среда-199 - официнальная среда для сохранения культуры клеток, производится в Свердловском НИИ вирусных инфекций.
1.2. Пробирки, ГОСТ 10515*, диаметр 15 мм, высота 145-150 мм
* На территории Российской Федерации документ не действует. Действует ГОСТ 25336-82, здесь и далее по тексту. - Примечание изготовителя базы данных.
1.4. Пастеровские пипетки
1.5. Предметное стекло
1.7. Ватный тампон, укрепленный на проволоке
2. Метод заключается в следующем:
2.1. Исследуемый материал (клетки эпителия слизистой оболочки переднего отдела носа) забирают с помощью стерильных ватных тампонов, смоченных в физиологическом растворе.
2.2. Тампон погружают в стерильную пробирку с 1,0 мл среды-199, встряхивают в течение 15 минут, тампон отжимают о стенки пробирки и удаляют.
2.3. Содержимое пробирки инкубируют в течение 1-2 часов при 37 °С в термостате (для сохранения жизнеспособности эпителиальных клеток и размножения в них стафилококков).
2.4. Верхний слой жидкости удаляют при помощи пастеровской пипетки, из осадка делают мазок на чистое, хорошо обезжиренное стекло (стекла обезжиривают при помощи смеси Никифорова).
2.5. После подсыхания мазок фиксируют метанолом в течение 5 минут и окрашивают одним из принятых методов (синькой Мансона, по Романовскому-Гимзе и др.).
2.6. При микроскопии мазков просматривают не менее 30 эпителиальных клеток (учитывают клетки с хорошо видимым ядром). В том случае, если обнаруживают 5 и более клеток, содержащих микроколонии стафилококков (группа из 4 и более кокков), то делают заключение о резидентном бактерионосительстве.
2.7. Для уточнения видовой характеристики стафилококков проводят бактериологическое исследование.
Бактериологический метод
А. Выделение чистой культуры стафилококка с персистентными свойствами путем посева на элективную питательную среду с фузидином
1. Реактивы, приборы, стекло
* На территории Российской Федерации документ не действует. Действует ГОСТ 25336-82, здесь и далее по тексту. - Примечание изготовителя базы данных.
1.2. Натрий хлористый, ГОСТ 4233-77 (Михайловский завод химреактивов)
1.3. Куриное яйцо
1.4. Фузидин-натрий-натриевая соль фузидиевой кислоты (Пензенский комбинат медицинских препаратов "Биосинтез")
1.5. Питательный агар для культивирования микроорганизмов, сухой, код ОКП 93 8511 0197 ФС 42-188 ВС-88 (НПО "Питательные среды", Махачкала)
1.6. Физиологический раствор (9 г NaCl на 1 л воды)
1.7. Ватный тампон, укрепленный на проволоке
2. Элективная питательная среда (приготовление и посев)
2.1. Приготовление элективной среды: к 850 мл расплавленного мясо-пептонного агара добавляют 85 мл NaCl, затем среду стерилизуют, остужают до 50 градусов и добавляют 150 г желточной взвеси (желток асептически извлекают из яйца, взбалтывают с 200 мл изотонического раствора хлорида натрия). Перед заливкой чашек Петри во флаконы вносят 0,0002 г/л антибиотика фузидина. Все тщательно перемешивают, готовую среду разливают в стерильные чашки, подсушивают в термостате при 37 °С в течение 10 минут.
2.2. На поверхность среды засевают исследуемый материал (клетки эпителия слизистой оболочки носа), который забирают с помощью стерильных ватных тампонов, смоченных в физиологическом растворе, и учитывают результаты через 24 часа инкубации в термостате при 37 °С.
2.3. Рост колоний на данной среде позволяет отнести бактерионосителя к резидентному типу, т.к. имеет место преимущественный рост стафилококка с персистентными свойствами.
Б. Идентификация чистой культуры; определение резидентной стафилококковой микрофлоры
При дифференциации резидентной стафилококковой микрофлоры от транзиторной, кроме учета микробной обсемененности, рекомендуется определять у выделенных штаммов чувствительность к фузидину, а также персистентные свойства (антилизоцимная, антиинтерфероновая, антикомплементарная активности), как наиболее информативные биологические характеристики (А.с. СССР N 1449587 "Способ выявления возбудителя при гнойно-воспалительных процессах"; патент РФ N 2010860 "Способ определения антикомплементарной активности микроорганизмов").
1. Реактивы, приборы, стекло
1.2. Питательный агар для культивирования микроорганизмов, сухой, код ОКП 93 8511 0197 ФС 42-188 ВС-88 (НПО "Питательные среды", Махачкала)
1.3. Физиологический раствор (9 г NaCl г на 1 л воды)
1.4. Официнальные диски с фузидином (Минмедпром РФ объединение "Мосмедпрепарат" им. А.Я.Карпова)
1.5. Яичный лизоцим, регистрационный номер 76/506/6 (Фармацевтическое акционерное общество "Ферейн", Москва)
1.6. Культура Micrococcus luteus (N 211001 по каталогу ГИСК им. Л.А.Тарасевича)
1.7. Препарат человеческого лейкоцитарного интерферона (ПО "Иммунопрепарат", Уфа)
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Идентификация микроорганизмов и определение чувствительности их к антибиотикам с применением автоматизированной системы для биохимического анализа
Дата введения: с момента утверждения
1. РАЗРАБОТАНЫ ФГУЗ "Федеральный центр гигиены и эпидемиологии" Роспотребнадзора (А.И.Верещагин, М.В.Зароченцев, И.В.Новокшонова, М.А.Ярославцева); ФГУН ГНЦ ПМБ Роспотребнадзора (М.В.Храмов, В.М.Храмов); ФГУЗ "Центр гигиены и эпидемиологии в г.Москве" (Н.Я.Салова, Ф.М.Абасова) при участии ООО "СИ-ЛАБ", Москва (А.М.Веселовский, М.Б.Беглов).
2. РЕКОМЕНДОВАНЫ К УТВЕРЖДЕНИЮ Комиссией по государственному санитарно-эпидемиологическому нормированию при Федеральной службе по надзору в сфере защиты прав потребителей и благополучия человека (протокол от 02.06.2011 N 1).
3. УТВЕРЖДЕНЫ И ВВЕДЕНЫ В ДЕЙСТВИЕ Главным государственным санитарным врачом Российской Федерации, Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека Г.Г.Онищенко 30.06.2011.
4. ВВЕДЕНЫ ВПЕРВЫЕ.
1. Область применения
1.1. Настоящие методические указания устанавливают методы идентификации патогенных биологических агентов, обнаруженных в продовольственном сырье и пищевых продуктах, парфюмерно-косметической и другой продукции, объектах окружающей среды, клиническом (биологическом) материале, и устанавливают методы определения чувствительности выделенных микроорганизмов к антимикробным препаратам.
1.2. Методические указания предназначены для органов и учреждений Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, осуществляющих контроль качества и безопасности продовольственного сырья и пищевых продуктов, парфюмерно-косметической и другой продукции, объектов окружающей среды, а также могут быть использованы для проведения производственного контроля другими испытательными лабораториями, аккредитованными в установленном порядке.
2. Нормативные ссылки
4. СП 1.3.1285-03 "Безопасность работы с микроорганизмами I-II групп патогенности (опасности)".
5. СП 1.3.2322-08 "Безопасность работы с микроорганизмами III-IV групп патогенности (опасности) и возбудителями паразитарных болезней".
7. СанПиН 1.2.681-97 "Производство и контроль парфюмерно-косметической продукции для обеспечения ее безопасности и качества".
8. СанПиН 2.1.3.2630-10 "Санитарно-эпидемиологические требования к организациям, осуществляющим медицинскую деятельность".
9. МУК 4.2.1890-04 "Определение чувствительности микроорганизмов к антибактериальным препаратам".
3. Общие положения
3.1. Автоматизированная система для биохимического анализа (далее - система) может быть использована при биохимической идентификации видовой принадлежности штаммов микроорганизмов, выделенных из различного материала в соответствии с действующими методическими документами и определении чувствительности микроорганизмов к противомикробным препаратам. Биохимическая идентификация микроорганизмов с применением системы может осуществляться альтернативно биохимической идентификации, проводимой общепринятыми методами in vitro.
3.2. Работы по идентификации микроорганизмов и определению чувствительности их к противомикробным препаратам с применением системы следует осуществлять в соответствии с требованиями действующих нормативно-методических документов, регламентирующих безопасность работы с патогенными биологическими агентами.
4. Сущность метода
4.1. Идентификация микроорганизмов с применением системы основана на регистрации и анализе результатов изменения биохимических субстратов под действием микроорганизмов (биохимическая идентификация) в сопоставлении с базой данных, включающей информацию о биохимических профилях микроорганизмов.
4.2. Принцип определения чувствительности микроорганизмов к антимикробным препаратам с применением системы основан на определении ингибиции роста микроорганизмов антимикробными препаратами различных концентраций с установлением их минимальных ингибирующих концентраций (МИК), либо на выявлении множественной лекарственной устойчивости микроорганизмов.
4.3. Система позволяет осуществлять идентификацию аэробных и факультативно-анаэробных бактерий различных групп и семейств, дрожжевых, дрожжеподобных и других микроскопических грибов (прилож.1).
Определение чувствительности микроорганизмов к антибиотикам и антимикотическим препаратам осуществляется с применением системы и различных типов планшет (прилож.2).
4.4. Система включает фотометр, который позволяет считывать результаты, полученные при проведении идентификации микроорганизмов и определении их чувствительности к антибиотикам на адаптированных к ней тест-планшетах. Результаты обрабатываются и интерпретируются автоматически. Информация о результатах идентификации микроорганизмов (с указанием рода, вида, биотипа, альтернативного близкородственного вида, статистических данных) отражается на экране компьютера в течение нескольких секунд. Возможно сохранение данных на диске и вывод их на печать.
4.5. Наименования микроорганизмов, идентифицируемых системой, приводятся в соответствии с 9-м изданием международного "Определителя бактерий Берджи".
5. Отбор, подготовка проб (культур) и внесение бактериальной суспензии
5.1. При работе с применением системы используются суточные бактериальные культуры, выращенные на питательной среде в соответствии с инструкцией по применению тест-планшетов и стрипов. Если исследуемый материал находился в лиофилизированном состоянии в ампулах, то необходимо восстановить культуру на питательной среде, рекомендуемой в инструкциях по применению тест-планшетов или стрипов, после чего еще раз пересеять культуру на аналогичную питательную среду.
5.2. Для внесения исследуемого материала в тест-планшеты необходимо приготовить бактериальную суспензию определенной мутности (в зависимости от типа теста) по стандартам мутности подобных Mc-Farland или ФГБУ "НЦЭСМП" или с аналогичными характеристиками.
5.4. Все работы, в т.ч. пересевы, приготовление бактериальной суспензии и внесение ее в лунки планшета, осуществляют асептично с соблюдением требований биологической безопасности и техники лабораторных работ.
6. Аппаратура, материалы и реактивы
Система, подобная МикроТакс, SY-LAB Gerate, GmbH (или Система с аналогичными характеристиками), включющая:
2) инкубатор МТ-5 (внутренняя камера которого выполнена из нержавеющей стали) с жидкокристаллическим дисплеем. Диапазон температур: от 20 до 70 °С. Отклонение от температуры при 37 °С: ±0,5 °С, время нагрева до 37 °С - 37 мин, время охлаждения с 37 до 30 °С - 79 мин;
4) управляющий блок на базе персонального компьютера с программным обеспечением и принтером.
Тест-планшеты, подобные МикроТакс или с аналогичными характеристиками - стандартные, 96-луночные, с внесенными компонентами:
- МикроТакс-IDS (4 теста/планшет) - для быстрой (экспресс) в течение 5-6 ч идентификации 113 наиболее клинически значимых штаммов энтеробактерий, стафилококков, стрептококков, энтерококков;
- МикроТакс-RPO (2 теста/планшет) - для идентификации 167 видов бактерий родов: стафилококки, стрептококки, энтерококки, коринебактерии, листерии;
- МикроТакс-Candida (4 теста/планшет) - для идентификации 32 видов клинически значимых грибов/дрожжей за 24 ч;
- МикроТакс-STREP 2 (4 теста/планшет) - для идентификации клинически значимых стрептококков и энтерококков за 20-24 ч;
- МикроТакс-AM КН2 (1, 2 или 4 теста/планшет) - для определения чувствительности дрожжей и криптококков к антимикотическим агентам (6 антимикотических агентов в различных концентрациях) за 22-24 ч;
- МикроТакс-AM MIC (1, 2 или 4 теста/планшет) - для определения чувствительности дрожжей и криптококков к антимикотическим агентам (9 антимикотических агентов в различных концентрациях) за 22-24 ч;
- МикроТакс-SВ/быстрый тест (1, 2 или 4 теста/планшет) - для определения бактериальной чувствительности к антибиотикам за 6 ч;
Стрипы, подобные перечисленным, или с аналогичными характеристиками:
- MIC-стрип ESBLII (1 контроль) - фенотипический подтверждающий тест для детекции ESBL (-лактамазы), которая продуцируется энтеробактериями;
- MIC-стрип MRSA (1 контроль) - фенотипический подтверждающий тест для детекции метициллин-резистентных стафилококков;
- MIC-стрип PEN (1 контроль) - фенотипический подтверждающий тест для детекции резистентности к пенициллину у пенициллиноустойчивых изолятов стрептококков и пневмококков;
- MIC-стрип VAN (1 контроль) - фенотипический подтверждающий тест для детекции ванкомицин-резистентных грамположительных бактерий.
Реактивы и питательные среды:
- типа NF-Susmed, реактив для МикроТакс-NF или с аналогичными характеристиками;
- типа Candida-Susmed, реактив для МикроТакс-RC или с аналогичными характеристиками;
Читайте также:

