Методика взятия материала для бактериологического исследования при подозрении на дифтерию
Обновлено: 11.05.2024
Выявление дифтерийной палочки. Принципы микробиологической диагностики дифтерии. Диагностика дифтерии. Культивирование дифтерии. Определение токсигенности дифтерийной палочки.
С целью раннего выявления дифтерии и определения носителей дифтерийной палочки необходимы выделение и идентификация возбудителя, а также определение его способности к токсинообразованию. Материалом для исследования служат дифтеритические плёнки, слизь из носоглотки или отделяемое из подозрительных поражений кожных покровов.
Забор материала на дифтерию проводят двумя стерильными тампонами: один используют для посева, с другого делают мазки и окрашивают их по Граму и Найссеру. Взятый материал следует доставлять в лабораторию не позднее чем через 3 ч.
Бактериоскопия дифтерийной палочки
Окраска по Граму не является специфичной, так как дифтерийные палочки сравнительно плохо воспринимают красители, но позволяет косвенно идентифицировать непатогенные коринебактерии, располагающиеся в виде палисада (параллельно) или в виде китайских иероглифов. Окраска по Найссеру позволяет выявить характерные зёрна Бабеша-Эрнста и отличить дифтерийную палочку от ложнодифтерийной палочки С. pseudodiphtheriticum (С. hofmannii), часто обитающей в носоглотке.

Культивирование дифтерийной палочки
Бактерии дифтерии выделяют посевом на элективные среды с теллуритом (например, Клауберга II или Маклёода), ложнодифтерийная палочка (палочка Хофманна) теллур не восстанавливает (см. рис. 8 на вклейке). Для выделения чистой культуры дифтерии часть подозрительной колонии засевают на скошенный агар (или среду Ру), вторую часть — на твёрдую питательную среду для определения токсигенности и (не обжигая петли) проводят определение цистиназной активности (проба Пизу). При положительном результате наблюдают образование коричневого облачка вокруг линии укола. Чистую культуру идентифицируют на средах Хйсса, пользуясь укороченным пёстрым рядом (глюкоза, мальтоза, сахароза, мочевина), что позволяет отличить С. diphtheriae от непатоген пых коринебактерии (рис. 14-3).
Определение токсигенности дифтерийной палочки
Определение токсигенности дифтерийной палочки in vivo. Проводят подкожным или внутрикожным заражением 0,5-1,0 мл бактериальной культуры морских свинок массой 250 г. За 24 ч до заражения одно животное иммунизируют дифтерийным антитоксином. При положительном результате неиммунизированные животные погибают в течение 3-5 сут.
Фаготипирование дифтерийной палочки
Для дифференциальной диагностики возбудителей используют набор из 9 кори нефагов. С его помощью можно типировать большинство токсигенных и нетоксигенных штаммов биовара gravis.
Показания: подозрение на дифтерию, ангину; контактным с больным дифтерией; обследование декретированных групп.
Противопоказания: нет.
Оснащение:
2. Стерильные прямые ватные тампоны в комплекте с пробирками или в отдельной упаковке
3. Шпатель стерильный в крафт-пакете
4. Штатив для пробирок
4. Термоконтейнер для транспортировки
4. Стерильные перчатки, маска
5. Лоток для использованного материала.
6. Емкость с дез.раствором
Подготовка пациента:
1.Установить доброжелательное отношение с пациентом.
2. Проинформировать пациента о предстоящей манипуляции и ходе ее выполнения, получить информированное согласие.
3. Помочь пациенту занять нужное положение, лицом к источнику света.
Техника выполнения:
I. Забор мазка из носа:
1. Повести гигиеническую обработку рук, надеть перчатки.
3. Первым пальцем левой руки слегка приподнять кончик носа пациента, правой - осторожно, стараясь не касаться наружной поверхности носа, легким вращательным движением ввести тампон в нижний носовой ход с одной, а затем с другой стороны.
4. Извлечь тампон из полости носа и осторожно опустить в пробирку, не касаясь стенок пробирки.
5. Поставить пробирку в штатив.
II. Забор мазка из зева:
1. Попросить пациента запрокинуть голову, широко открыть рот.
3. Осторожно провести тампоном сначала по правой дужке, правой миндалине, далее - по левой миндалине и левой дужке, при наличии фибринозных налетов, материал собирают на границе здоровой и пораженной ткани.
4. Извлечь тампон из полости рта, не касаясь слизистой оболочки рта и языка,
и осторожно опустить его в стерильную пробирку, не касаясь стенок пробирки.
5. Поставить пробирку с тампоном в штатив.
6. Штатив с пробирками поместить в термоконтейнер для транспортировки.
7. Обработать перчатки и использованный материал в соответствии с требованиями санэпидрежима.
8. Провести гигиеническую обработку рук.
9. Доставить материал в бактериологическую лабораторию.
Возможные осложнения: травма слизистой оболочки.
Примечание: забор материала производить натощак, или через 2 часа после еды, питья, полоскания ротовой полости; материал отправляется в лабораторию не позднее 2-х часов после забора; в инфекционных отделениях, возможно выполнение посева сразу на питательную среду на чашку Петри, сразу отправив посев в термостат.
В документированной процедуре изложены правила сбора и транспортирования биологических материалов в лабораторию клинической микробиологии (бактериологии) ГОБУЗ “Мурманская областная клиническая больница им. П. А. Баяндина” в целях повышения качества результатов лабораторных исследований и организации противоэпидемических и профилактических мероприятий, а также профилактики внутрибольничных инфекций у медицинского персонала и пациентов.
Документированная процедура предназначены для использования в МОКБ, а также может использоваться организациями, направляющими заказ на услугу по лабораторной диагностике.
Общие положения
Предложенная техника сбора и транспортирования биологических материалов в ЛКМ МОКБ позволит снизить уровень преаналитической ошибки и повысить качество работы лаборатории по объективизации результатов.
Документированная процедура определяет правила предохранения медицинского персонала и пациентов от инфицирования при сборе и доставке в лаборатории проб биоматериалов, которые могут быть обсеменены бактериями, грибами, вирусами, паразитами.
Общие требования к сбору проб биоматериала для микробиологического исследования
Материал для исследования собирают в достаточном количестве.
Материал должен соответствовать характеру инфекционного процесса.
При сборе материала необходимо использовать только стерильные инструменты и посуду, соблюдая правила асептики для исключения контаминации (загрязнения) биопробы нормальной микрофлорой, т.к. ее наличие приводит к ошибочной трактовке результатов.
При сборе биоматериала медперсонал обязан использовать средства индивидуальной защиты (далее - СИЗ) (перчатки, маска, шапочка, очки и др.).
Необходимо осуществлять сбор биоматериала только в рекомендуемые транспортные среды и контейнеры.
Материал для исследования, по возможности, собирают до начала антибактериальной терапии. При отсутствии такой возможности собирают, непосредственно, перед повторным введением (приемом) препаратов.
В бланке направления на исследование в обязательном порядке указывают наименование принимаемых антибактериальных препаратов.
Не допускается загрязнение наружную поверхность посуды при сборе и доставке проб.
Не допускается загрязнение сопроводительных документов (направлений).
При сборе биоматериала в пробирки, необходимо использовать штативы.
После взятия биоматериала, необходимо сделать запись о процедуре в бланке направления: дату, время взятия, другую информацию.
Правила маркировки проб биоматериала для микробиологического исследования
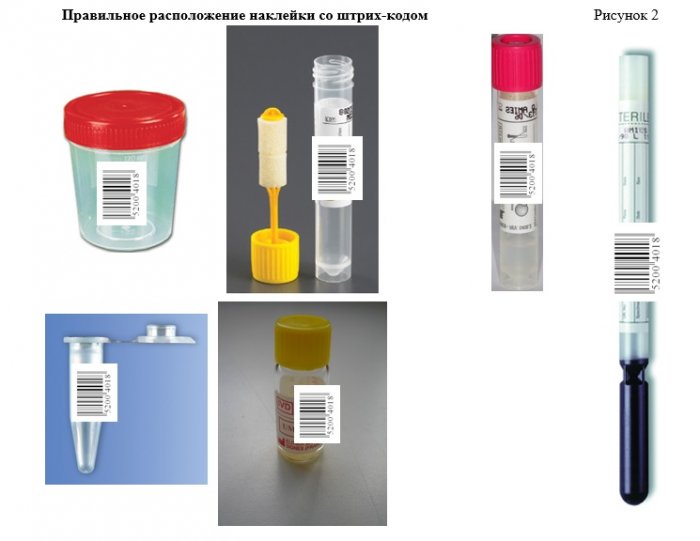
Все биопробы, поступающие в лабораторию должны пройти процедуру штрих-кодирования.
Наклейки, с нанесенными штрих-кодами, получают в централизованной многофункциональной лаборатории (далее ЦМЛ) МОКБ.
Цель штрих-кодирования - идентификация пациента (на пробирке (контейнере, флаконе) и на бланке должен быть одинаковый номер штрих-кода).
Штрих-код наклеивают на пробирку (контейнер, флакон) строго вертикально цифровой надписью сверху вниз, на имеющуюся наклейку. Необходимо оставить прозрачную зону для контроля состояния биопробы. Штрих-коды, наклеенные неровно, не будут считываться сканерами приборов.
Штрих-код должен быть наклеен ровно и плотно, строго вертикально (длинной стороной вдоль пробирки, контейнера) (рисунок 2).
При маркировке контейнера штрих-код наклеивается непосредственно на сам контейнер, на крышку маркировка не наносится.
Рекомендуется двойная маркировка - помимо штрих-кодирования, на емкость для сбора наносится краткая запись (номер, фамилия, уточнение локализации биоматериала и др.).
Выбор лент со штрих-кодами определяется количеством пробирок, контейнеров для исследований одного пациента, с учетом штрих-кодирования бланка направления (не менее 2-х штрих кодов на ленте: 1-й-на пробирку, 2-й на бланк).
Весь биоматериал маркируется двойными штрих-кодами.
Исключение для исследования:
Необходимо использовать тройной штрих-код:
1 – направление-бланк на исследование
2 – аэробный флакон
3 – анаэробный флакон

Общие требования к условиям хранения проб биоматериала до доставки в лабораторию
Соблюдайте условия хранения биопроб до доставки в лабораторию (таблица 1).
Рекомендуется организовать в отделениях медицинской организации место хранения биопроб до их отправки в лабораторию (таблица 2).
Регулярно проводите дез.обработку места хранения биопроб, контейнеров.
Сопроводительные документы (бланки направлений на исследования) помещают в пластиковый пакет (файл) для исключения контакта с биоматериалом.
Общие условия хранения биопроб до доставки в лабораторию
Вид изделия, используемого для сбора и доставки биопробы
Температурный режим, и др.
Доставка в лабораторию
Биопробы в пробирке с транспортными средами
при комнатной температуре (18—20°С), в тёмном месте
в течение 48 часов
Стерильный контейнер с нативным биоматериалом
при комнатной температуре (18—20°С), в тёмном месте
в течение 2 часов
при температуре 2-8 0 С
в течение 24 часов
при температуре 37 0 С
в течение 2 часов*
Флаконы с кровью на стерильность
при комнатной температуре (18—20°С), в тёмном месте
в течение 2 часов
в течение 24 часов**
* Доставка ликвора для бактериологического исследования.
** Отсроченная загрузка флаконов в анализатор увеличивает время выполнения анализа.
Рекомендации по организации места хранения биопроб до доставки в лабораторию
Температурный режим хранения, и др.
Место хранения биопроб
при комнатной температуре
(18—20°С), в тёмном месте
В закрытом контейнере для доставки
при температуре 2-8 0 С
В термоконтейнере с хладоэлементами
при температуре 37 0 С
В контейнере с термоэлементами, нагретыми до необходимой температуры (грелка, обернуть одноразовой пеленкой, ветошью)
Общие требования к доставке проб биоматериала для микробиологического исследования
Доставка проб биоматериала осуществляется в рабочие дни и время ЛКМ (бактериологии), согласно режиму доставки в ЛКМ.
Исключение составляет круглосуточный прием от отделений МОКБ следующих биоматериалов:
Пробы ликвора - для проведения реакции латекс-агглютинации и бактериологического посева.
Пробы крови - для посева на стерильность.
Собранный материал доставляют в лабораторию в рекомендуемые сроки (таблица 1).
Доставка биоматериала осуществляется курьером.
Не допускается доставка биоматериала пациентами.
Не допускается доставка биоматериала в руках, карманах, хозяйственных сумках и других предметах личного пользования.
Дно контейнеров должно быть покрыто сухим адсорбирующим материалом (марлевая салфетка, ткань, вата и пр.).
Доставляемые емкости с биоматериалами должны быть закрыты пробками, крышками, исключающими выливание содержимого во время транспортирования.
Доставка жидкого биоматериала осуществляется строго в вертикальном положении, в штативах.
Сопроводительные документы (бланки направлений на исследования) помещают в непромокаемый пакет (файл, папка) для исключения контакта с биоматериалом.
Разбор доставленного биоматериала должен проводиться с соблюдением мер предосторожности. Емкости с биоматериалами должны помещаться на поднос или лоток. Персонал должен использовать средства индивидуальной защиты (резиновые перчатки, маску).
Общие условия хранения биопроб до доставки в лабораторию
Вид изделия, используемого для сбора и доставки биопробы
Температурный режим, и др.
Доставка в лабораторию
Биопробы в пробирке с транспортными средами
при комнатной температуре (18—20°С), в тёмном месте
в течение 48 часов
Стерильный контейнер с нативным биоматериалом
при комнатной температуре (18—20°С), в тёмном месте
в течение 2 часов
при температуре 2-8 0 С
в течение 24 часов
при температуре 37 0 С
в течение 2 часов*
Флаконы с кровью на стерильность
при комнатной температуре (18—20°С), в тёмном месте
в течение 2 часов
в течение 24 часов**
* Доставка ликвора для бактериологического исследования.
** Отсроченная загрузка флаконов в анализатор увеличивает время выполнения анализа.
Правила по сбору, доставке и хранению различных проб биоматериала для микробиологического исследования
Пробы при инфекционно-воспалительных процессах дыхательных путей
Пробы при инфекционно-воспалительных процессах мочеполовой системы
Общие требования к сбору, хранению и доставке проб биоматериала для ПЦР-диагностики
Правила по сбору, доставке и хранению различных проб биоматериала для ПЦР-диагностики
Лабораторные исследования при инфекционных заболеваниях. Методы
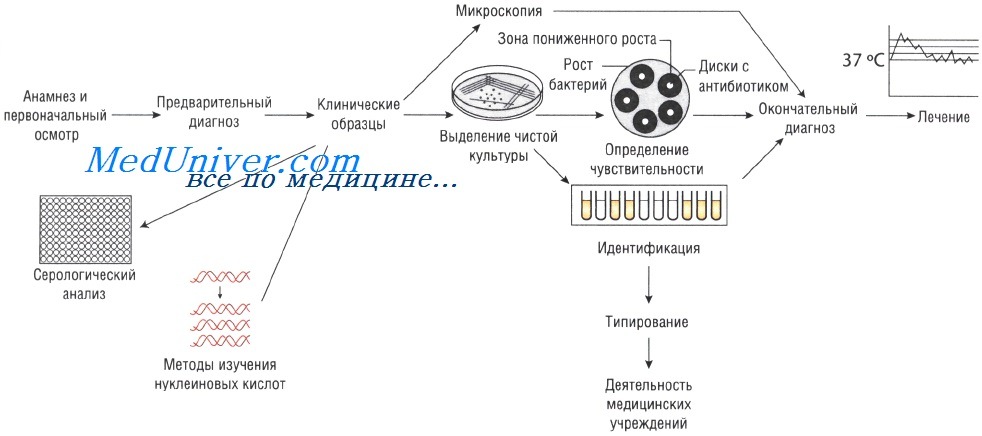
Отбор проб для анализа при инфекционных заболеваниях. Для микробиологического исследования может быть отобрана любая ткань или физиологическая жидкость организма.
Выделение чистой культуры способствует увеличению количества бактерий и их точной идентификации. Для этого используют питательные среды. Если в образце присутствует нормальная микрофлора, то применяют избирательные (селективные) среды, позволяющие создать условия, неблагоприятные для роста непатогенных микроорганизмов и способствующие росту патогенной микрофлоры.
Для получения точных результатов следует выбрать оптимальный метод отбора проб и подойти к этому процессу с должной аккуратностью. При несоблюдении правил асептики контаминация проб крови микроорганизмами извне может привести к назначению неправильного лечения.
Большинство бактерий не способны существовать вне организма хозяина: облигатные анаэробы погибают под действием кислорода воздуха, а некоторые возбудители очень чувствительны к высыханию (Neisseria gonorrhoeae). Именно поэтому анализируемые образцы сразу после отбора должны быть помещены на подходящие среды или посеяны на среды для транспортировки.
Лабораторные методы исследования при инфекционных заболеваниях
Образцы могут быть проанализированы невооружённым глазом (например, для определения взрослых гельминтов в фекалиях или крови в мокроте). Микроскопия — быстрый и недорогой метод исследования, но требует высокого технического мастерства, характеризуется низкой чувствительностью: для точного определения необходимо присутствие большого количества возбудителей.
Кроме того, очень часто условно-патогенные микроорганизмы принимают за патогенные, что связано с недостаточной специфичностью метода.
Для определения возбудителя могут быть использованы различные красители (например, аурамин или окрашивание по Цилю—Нильсену для идентификации микобактерий). Уротропиновый серебряный окрашивает хитин клеточной стенки грибов и Pneumocystis jiroveci. Краситель Гимза применяют для окрашивания возбудителей малярии, лейшманий и других паразитов.
В основе иммунофлюоресцентного метода лежит применение специфических антител, помеченных флюоресцентными маркёрами. Микроскопию осуществляют в ультрафиолетовом свете, при этом возбудитель и связанные с ним антитела светятся ярко-зелёным цветом.
Лабораторные исследования при инфекционных заболеваниях
Выделение чистой культуры возбудителя при инфекционных заболеваниях
Иногда, даже при выраженных клинических симптомах, возбудитель может присутствовать в очаге инфекции в количестве, недостаточном для микроскопического определения. В этом случае выделение чистой культуры позволяет увеличить численность микроорганизмов в исследуемом субстрате.
Существует два способа выращивания микроорганизмов: на жидких (увеличивается количество возбудителей) и твёрдых (исследуют отдельные колонии, в том числе и на чувствительность к антибиотикам) питательных средах. Большинство возбудителей инфекций человека достаточно требовательны к условиям культивирования. Именно поэтому питательные среды для их выращивания должны содержать белки, сахарозу и нуклеиновые кислоты (присутствующие в крови и сыворотке).
Кроме того, необходимо поддерживать соответствующий газовый состав: для культивирования анаэробов необходимо отсутствие кислорода, в то время как для облигатных аэробов (Bordetella pertussis) — наоборот. Оптимальная температура выращивания большинства патогенных микроорганизмов составляет 37 °С; культивирование некоторых фибов осуществляют при 30 С.
Идентификация возбудителя инфекционного заболевания
Симптомы заболеваний зависят от вида возбудителей, вызвавших их. Именно поэтому идентификация микроорганизма позволяет предположить клиническую картину вызываемого им заболевания (например, симптомы инфекции, вызванной Vibrio cholerae, отличны от таковых при заражении Shigella sonnei). Большое значение имеет выделение Neisseria meningitidis именно из спинномозговой жидкости. Идентификация микроорганизмов основана на:
• изучении морфологических свойств их колоний в агаре;
• различной окраске по Граму;
• способности возбудителей к образованию спор;
• изучении биохимических свойств (каталазный или коагулазный тесты).
Точное определение штамма обычно зависит от результатов биохимического анализа (например, уреазный тест) или обнаружения продуктов жизнедеятельности бактерий (индол). Возбудителей, которые не могут быть выращены на питательных средах, идентифицируют при помощи молекулярно-генетического метода ДНК и секвенирования (например, Trophyrema whippelii).

Определение чувствительности возбудителя инфекционного заболевания к антибиотикам
Если для эрадикации микроорганизмов достаточно стандартной дозы антимикробного препарата, то их считают чувствительными, если необходимо увеличение дозы лекарственного средства — относительно устойчивыми. Абсолютно устойчивыми (резистентными) называют возбудителей, в отношении которых антибиотикотерапия неэффективна. Существует широкий спектр различных методов определения чувствительности к антимикробным препаратам.
Методы Британской ассоциации антимикробной химиотерапии (British Society of Antimicrobial Chemotherapy — BSAQ и Института клинических лабораторных стандартов (Clinical Laboratory Standards Institute — С LSI) основаны на определении диаметра зоны слабого роста микроорганизмов на твёрдой питательной среде при применении антимикробного препарата.
Минимальную подавляющую концентрацию антибиотика измеряют с помощью Е-теста, растворения препарата в питательном бульоне или нанесения его на плотный агар. В последнем случае на засеянный исследуемыми микроорганизмами агар наносят бумажные диски, пропитанные различными антибиотиками (метод бумажных дисков).
Уровень чувствительности зависит от диаметра зоны пониженного роста бактерий. Однако тестирование in vitro предоставляет лишь приблизительные данные, так как в клинической практике многое зависит от состояния больного.

Серологический анализ при инфекционном заболевании
Различные виды инфекций можно идентифицировать с помощью определения иммунного ответа, возникающего при внедрении возбудителя. Для этого существует большое количество различных методов: реакция агглютинации (РА), реакция связывания комплемента (РСК), реакция нейтрализации (РН) и иммуноферментный анализ (ИФА). Диагноз устанавливают на основании:
• определения уровня антител (IgM) в ответ на попадание в организм чужеродного белка (антигена);
• определения антигена.
Молекулярный анализ при инфекционном заболевании
Южный блоттинг и метод гибридизации нуклеиновых кислот. Методы основаны на связывании меченой ДНК с анализируемым образцом, при условии, что он имеет определённую последовательность аминокислот. Связанный комплекс определяют по активности метки. Это достаточно быстрый и надёжный способ, который, тем не менее, уступает по чувствительности молекулярно-генетическим методам.

Метод молекулярно-генетический (NAAT)
Для диагностики инфекционных заболеваний используют несколько молекулярно-генетических методов. Механизм выделения патогенной ДНК или РНК в количестве, достаточном для постановки диагноза, для каждого метода индивидуален. Так, при молекулярно-генетическом методе ДНК возбудителя разделяют на отдельные цепи, затем синтезируют праймеры для связывания с целевыми последовательностями. Образование новой ДНК катализирует полимераза.
Основное преимущество — достижение результата даже при наличии всего лишь одной копии ДНК. Благодаря автоматизированным системам и большому выбору специальных наборов эти методы стали доступны большинству диагностических лабораторий. Новые аппараты способны выдавать результат в режиме реального времени. Генетические методы позволяют идентифицировать микроорганизмы, выращивание которых отличается сложностью или сопряжено с риском для человека (например, Mycobacterium tuberculosis и Chlamydia trachomatis).
Кроме того, их можно использовать для определения генов, кодирующих устойчивость к действию антибиотиков (например, мутационный ген rpoВ, обеспечивающий устойчивость М. tuberculosis к рифампицину). Это позволяет заранее выбрать альтернативный путь лечения инфекционных заболеваний.
Иногда необходимо проводить типирование микроорганизмов в случае их распространения в больницах или в окружающей (внебольничной) среде.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Дифтерия относится к инфекционным болезням, развитие которых обусловлено заражением организма бактериями. Для патологии характерно появление пленочного налета на поверхности пораженных органов, например, в ротоглотке, носовых ходах, глазах или ушной раковины. Для постановки диагноза при подозрении на инфекционное заболевание врач направляет пациента на мазок на дифтерию из носа и зева.
Содержание статьи

Заподозрить активацию палочки Леффлера (инициатора развития дифтерии) можно на основании некоторых симптомов:
- острое начало;
- фебрильная гипертермия, когда температура превышает 38 градусов;
- цефалгия (головные боли);
- недомогание;
- учащенное сердцебиение;
- лимфаденит, при котором близко расположенные с воспалительном очагу лимфоузлы увеличиваются в диаметре, при прощупывании становятся болезненными, уплотненными.
Через 3 суток от начала болезни температура снижается до субфебрильных показателей, а фибринозные пленки уплотняются, приобретают перламутровый окрас.
Не пытайтесь самостоятельно удалить пленки с миндалин, носа. Это приводит к обнажению раневой поверхности и появлению кровоточивости.
Акцентируем внимание, что существует токсическая форма болезни. Для нее характерна гектическая лихорадка, выраженная слабость. Признаком прогрессирования дыхательной, кардиальной недостаточности является появление акроцианоза (посинение ушей, носа, носогубной зоны, пальцев), а также снижение артериального давление и нарастание тахикардии.
При этом пациента могут беспокоить галлюцинации, как проявление интоксикации, гипоксического поражения структур головного мозга. Также наблюдается возбуждение, тошнота, гнусавость голоса, затрудненное дыхание, одышка и отечность шеи.
Дифтерийный токсин приводит к развитию крупа, когда поражается трахея и бронхиальное дерево. Симптоматически патология проявляется лающим кашлем, который постепенно становится беззвучным и развивается асфиксия.
В связи с высокой токсичностью возбудителя в детском возрасте проводится вакцинация с последующей ревакцинацией. Несвоевременное лечение болезни приводит к развитию:
- инфекционно-токсического шока;
- асфиксии;
- почечной дисфункции (нефроз, ренальная недостаточность);
- поражению нервов;
- миокардита;
- полиорганной недостаточности (при токсической и гипертоксической формах).
Показания для анализа
В ряде случаев мазок на дифтерию и другую патогенную флору проводится при подозрении на развитие заболевания. Однако с профилактической целью исследование показано:
- при трудоустройстве в лечебные, детские учреждения, в пищевую сферу;
- перед посещением учебных учреждений;
- беременным для определения риска возможных осложнений;
- после контакта с больным человеком;
- для подбора лекарственной терапии.
Таким образом, профилактическое исследование дает возможность предупредить развитие эпидемий, связанных с распространение инфекционных возбудителей.
Особенности диагностики
Различают несколько штаммов палочки Леффлера. Они отличаются по культуральным, структурным и ферментативным свойствам. Для подтверждения диагноза врач бактериальный анализ на дифтерию. Исследуя материал, специалист обнаруживает бациллу Леффлера, что в сочетании с клинической картиной является достоверным фактором болезни.
Для обнаружения инфекционного агента может потребоваться до полусуток, при условии, если пациент не принимал лекарственные препараты.

Когда мазок из зева берется на фоне антибактериальной терапии, рост бактерий значительно замедляется, а результаты диагностики не считаются достоверными. В таком случае целесообразно использовать серологические методы исследований.
Чаще всего для этого назначается РПГА, которая проводится в течение первых 3 суток и спустя неделю постановки диагноза. Диагностический метод дает возможность выявить антитела к токсину дифтерийной бактерии. Положительный результат отмечается при увеличении антител в 4 и более раз. Таким образом, можно найти людей с низким уровнем иммунной защиты против дифтерийного токсина.
При отсутствии антител на дифтерийный токсин проводится вакцинация с помощью АКДС.
Подготовка к сдаче мазков
Когда требуется мазок на дифтерию, как сдавать анализ разберем несколько позже. Сейчас остановимся на подготовительном этапе. Он включает:
- прекращение приема антибактериальных средств за 10 дней до диагностики;
- использование растворов для полоскания ротовой полости, ротоглотки с антисептическими компонентами запрещается за 5 суток до исследования;
- анализ сдается натощак;
- в день диагностики не рекомендуется чистить зубы.
Забор материала

Необходимый материал для диагностики берется из зева и носа. Вначале пациент наклоняет назад голову, максимально широко открывает ротовую полость. Специалист фиксирует язык металлическим или деревянным пластырем, принимая его ко дну полости рта.
Стерильным тампоном на удлиненной петле специалист проводит по слизистой оболочке ротоглотки. В процессе введения и выведения из ротовой полости тампона он не должен соприкасаться с другими поверхностями. Материал на тампоне опускается в пробирку, благодаря которой он транспортируется в лабораторию без повреждений и гибели микробов.
Набранный материал следует посеять в первые 2 часа. В процессе забора материала человек может испытывать неприятные ощущения или позыв на рвоту (особенно те пациенты, у которых повышен рвотный рефлекс).
Далее врач приступает к взятию мазка из носового хода. Для этого пациент также наклоняет голову назад, очищается носовой ход от слизи, а кожные покровы обрабатываются спиртом.
Стерильный тампон на удлиненной петле необходимо вводить поочередно в носовые ходы, плотно соприкасаясь с поверхностью слизистой оболочки. После этого тампон опускается в стерильную пробирку, и отправляют ее в лабораторию.
Микроскопическое исследование
Взятый из ротоглотки материал подвергается микроскопии. Для этого врач наносит его на предметное стекло, окрашивает специальными красителями и изучает клеточный состав.
Морфологические признаки дифтерийной палочки настолько различны, что микроскопия используется, как предварительное исследование перед посевом. Оно дает возможность проанализировать состав флоры. Окраска может проводится по Граму, Леффлеру (наиболее информативный, часто используемый) и Нейссера.
В мазках дифтерийные палочки расположены, как римская цифра 5.
Посев материала

Для обеспечения оптимальных условий для роста и размножения бактерий необходимо подобрать специальную питательную среду. Посев на дифтерию осуществляется в стерильном боксе на свернутую сыворотку Ру, теллуритовые дифсреды, сывороточно-/кровяно-теллуритовый агар или среду Клауберга.
Материал помещают в среду, затем рассеивают по поверхности. Для этого применяется чашка Петри. Инкубация посевов осуществляется в условиях термостата. Ежедневно контролируется рост и характер вырастающих колоний. С целью выделения чистой культуры пересеиваются колонии на селективные питательные среды.
Благодаря бакпосеву и дополнительной диагностике удается подтвердить диагноз инфекционного заболевания и своевременно принять меры по лечению больного человека и предупреждению распространения инфекции среди его окружения.
Читайте также:

