Методы микробиологических исследований при бактериальных инфекциях
Обновлено: 19.04.2024
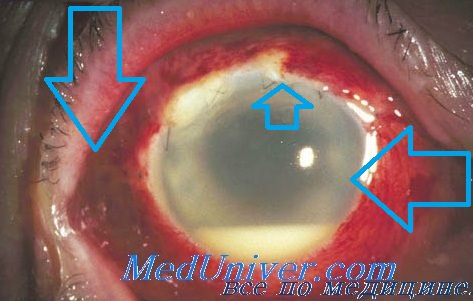
Микробиологические методы исследования в офтальмологии
Для определения видовой и типовой принадлежности возбудителей внутриглазных бактериальных инфекций, а также чувствительности микроорганизмов к антибиотикам проводят микробиологические исследования.
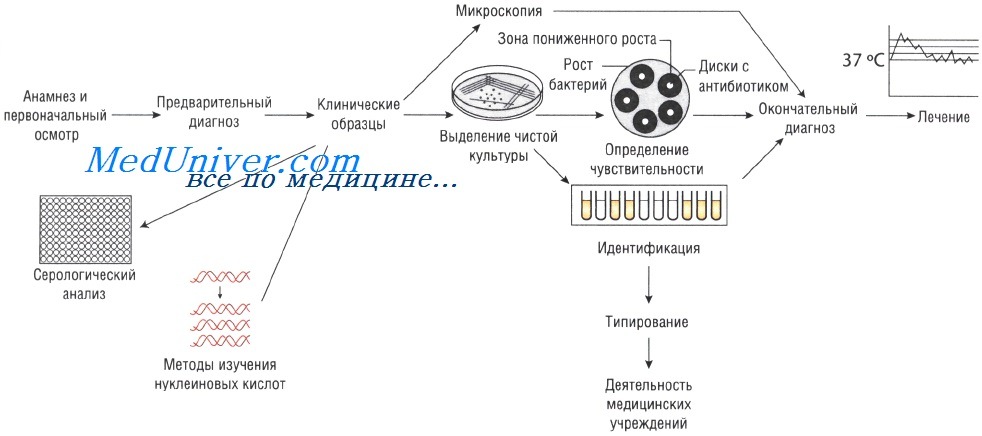
Как известно, надежным методом точного определения видовой и типовой принадлежности возбудителей бактериальных инфекций является бактериологическое исследование, которое включает в себя бактериоскопическое исследование материала от больного, выделение искомого возбудителя в чистой культуре, идентификацию выделенной культуры (изучение морфологии, культуральных, биохимических и антигенных свойств).
При бактериальных инфекциях прежде всего проводят бактериоскопическое исследование материала. Для ориентировочной простой окраски используется, например, метиленовый синий, а затем выполняется дифференциальная окраска по Граму.
При выделении чистой культуры применяют оптимальные среды с установленным рН. В некоторых случаях изменение рН обусловливается ростом бактерий. В таких случаях добавляются буферные смеси, например фосфатный буфер. Важным моментом является создание нужной концентрации кислорода и углекислоты, так как некоторые виды бактерий могут размножаться при пониженной концентрации кислорода (полуаэробные условия), другие — при полном отсутствии кислорода (анаэробные условия). Для некоторых кокков (стафилококки, гонококки) необходимо повышенное содержание углекислоты. Оптимальной температурой для большинства патогенных бактерий является 37 °С.
Для выделения чистой культуры (если материал не сильно загрязнен посторонней флорой) первичный посев делают на простые питательные среды, например мясопептонный агар. При обильной сопутствующей микрофлоре с целью выделения искомого микроба применяют различные диагностические питательные среды: селективные, способствующие росту отдельных групп бактерий и тормозящие рост других; среды обогащения (для накопления бактерий одной группы); дифференциально-диагностические и др.
Идентификацию выделенной культуры бактерий начинают с изучения культуральных свойств — характера роста микробов на плотных и жидких питательных средах. Большинство патогенных бактериальных видов дает пышный рост через 24-36 ч, некоторые виды могут размножаться быстрее (через 10-16 ч). Выделение чистой культуры и изучение морфологии дают возможность определить видовую принадлежность бактерий только ориентировочно.
Для более точной характеристики возбудителя инфекции необходимо определение его биохимической активности, в частности — ферментных свойств. Диагностическое значение имеют четыре группы ферментов:
1) сахаролитические, расщепляющие углеводы;
2) протеолитические, расщепляющие белки;
3) стеатолитические, расщепляющие жиры;
4) окислительно-восстановительные.
В микробиологической лаборатории Московского научно-исследовательского института глазных болезней им. Гельмгольца при выполнении подобных исследований используют следующую методику. В качестве простой питательной среды при выделении чистой культуры применяют мясоиептониый бульон с добавлением 0,2% глюкозы. Пробирки с первичными посевами выдерживают в термостате при температуре 37 °С в течение 3 сут. Посевы ежедневно просматривают и в случае обнаружения в них роста бактерий проводят бактериоскопическое исследование при окраске метиленовым синим и по Граму. Дальнейшее исследование проводят соответственно микрофлоре.
Если при бактериоскопии обнаруживается стафилококк, то с целью определения его гемолитической активности производят высев материала на кровяной агар, лицитовителазной активности — на желточно-солевый агар. Для определения плазмокоагулирующей активности ставятся реакции со стандартной сухой плазмой кролика. По совокупности результатов изучения гемолитической, лицитовителазной, плазмокоагулирующей активности и наличия пигмента дается заключение о патогенности стафилококка. В случае обнаружения при бактериоскопии грамотрицательных бактерий производится пересев материала на свернутую лошадиную сыворотку и простой агар. По характеру роста и наличию пигмента пиоцианина дается заключение о наличие синегнойной палочки.
Если пигмент отсутствует, то по характеру роста на питательной среде определяется кишечная палочка, идентификация которой производится путем пересева материала на среду Эндо.
При определении чувствительности бактерий, выделенных у пациентов с внутриглазной инфекцией, в качестве тест-микроба служит золотистый стафилококк, выделявшийся от больного. Разведение культуры производится соответственно оптическому стандарту мутности, получаемому из Государственного НИИ стандартизации и контроля биологических препаратов им. Л. А. Тарасевича. В качестве питательной среды используют стандартный питательный агар. Для микробов, не растущих на простых питательных средах, к агару добавляют 5% кровь или сыворотку крови. Диски пропитываются различными антибиотиками (всего 18 наименований).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Лабораторные исследования при инфекционных заболеваниях. Методы
Отбор проб для анализа при инфекционных заболеваниях. Для микробиологического исследования может быть отобрана любая ткань или физиологическая жидкость организма.
Выделение чистой культуры способствует увеличению количества бактерий и их точной идентификации. Для этого используют питательные среды. Если в образце присутствует нормальная микрофлора, то применяют избирательные (селективные) среды, позволяющие создать условия, неблагоприятные для роста непатогенных микроорганизмов и способствующие росту патогенной микрофлоры.
Для получения точных результатов следует выбрать оптимальный метод отбора проб и подойти к этому процессу с должной аккуратностью. При несоблюдении правил асептики контаминация проб крови микроорганизмами извне может привести к назначению неправильного лечения.
Большинство бактерий не способны существовать вне организма хозяина: облигатные анаэробы погибают под действием кислорода воздуха, а некоторые возбудители очень чувствительны к высыханию (Neisseria gonorrhoeae). Именно поэтому анализируемые образцы сразу после отбора должны быть помещены на подходящие среды или посеяны на среды для транспортировки.
Лабораторные методы исследования при инфекционных заболеваниях
Образцы могут быть проанализированы невооружённым глазом (например, для определения взрослых гельминтов в фекалиях или крови в мокроте). Микроскопия — быстрый и недорогой метод исследования, но требует высокого технического мастерства, характеризуется низкой чувствительностью: для точного определения необходимо присутствие большого количества возбудителей.
Кроме того, очень часто условно-патогенные микроорганизмы принимают за патогенные, что связано с недостаточной специфичностью метода.
Для определения возбудителя могут быть использованы различные красители (например, аурамин или окрашивание по Цилю—Нильсену для идентификации микобактерий). Уротропиновый серебряный окрашивает хитин клеточной стенки грибов и Pneumocystis jiroveci. Краситель Гимза применяют для окрашивания возбудителей малярии, лейшманий и других паразитов.
В основе иммунофлюоресцентного метода лежит применение специфических антител, помеченных флюоресцентными маркёрами. Микроскопию осуществляют в ультрафиолетовом свете, при этом возбудитель и связанные с ним антитела светятся ярко-зелёным цветом.
Лабораторные исследования при инфекционных заболеваниях
Выделение чистой культуры возбудителя при инфекционных заболеваниях
Иногда, даже при выраженных клинических симптомах, возбудитель может присутствовать в очаге инфекции в количестве, недостаточном для микроскопического определения. В этом случае выделение чистой культуры позволяет увеличить численность микроорганизмов в исследуемом субстрате.
Существует два способа выращивания микроорганизмов: на жидких (увеличивается количество возбудителей) и твёрдых (исследуют отдельные колонии, в том числе и на чувствительность к антибиотикам) питательных средах. Большинство возбудителей инфекций человека достаточно требовательны к условиям культивирования. Именно поэтому питательные среды для их выращивания должны содержать белки, сахарозу и нуклеиновые кислоты (присутствующие в крови и сыворотке).
Кроме того, необходимо поддерживать соответствующий газовый состав: для культивирования анаэробов необходимо отсутствие кислорода, в то время как для облигатных аэробов (Bordetella pertussis) — наоборот. Оптимальная температура выращивания большинства патогенных микроорганизмов составляет 37 °С; культивирование некоторых фибов осуществляют при 30 С.
Идентификация возбудителя инфекционного заболевания
Симптомы заболеваний зависят от вида возбудителей, вызвавших их. Именно поэтому идентификация микроорганизма позволяет предположить клиническую картину вызываемого им заболевания (например, симптомы инфекции, вызванной Vibrio cholerae, отличны от таковых при заражении Shigella sonnei). Большое значение имеет выделение Neisseria meningitidis именно из спинномозговой жидкости. Идентификация микроорганизмов основана на:
• изучении морфологических свойств их колоний в агаре;
• различной окраске по Граму;
• способности возбудителей к образованию спор;
• изучении биохимических свойств (каталазный или коагулазный тесты).
Точное определение штамма обычно зависит от результатов биохимического анализа (например, уреазный тест) или обнаружения продуктов жизнедеятельности бактерий (индол). Возбудителей, которые не могут быть выращены на питательных средах, идентифицируют при помощи молекулярно-генетического метода ДНК и секвенирования (например, Trophyrema whippelii).

Определение чувствительности возбудителя инфекционного заболевания к антибиотикам
Если для эрадикации микроорганизмов достаточно стандартной дозы антимикробного препарата, то их считают чувствительными, если необходимо увеличение дозы лекарственного средства — относительно устойчивыми. Абсолютно устойчивыми (резистентными) называют возбудителей, в отношении которых антибиотикотерапия неэффективна. Существует широкий спектр различных методов определения чувствительности к антимикробным препаратам.
Методы Британской ассоциации антимикробной химиотерапии (British Society of Antimicrobial Chemotherapy — BSAQ и Института клинических лабораторных стандартов (Clinical Laboratory Standards Institute — С LSI) основаны на определении диаметра зоны слабого роста микроорганизмов на твёрдой питательной среде при применении антимикробного препарата.
Минимальную подавляющую концентрацию антибиотика измеряют с помощью Е-теста, растворения препарата в питательном бульоне или нанесения его на плотный агар. В последнем случае на засеянный исследуемыми микроорганизмами агар наносят бумажные диски, пропитанные различными антибиотиками (метод бумажных дисков).
Уровень чувствительности зависит от диаметра зоны пониженного роста бактерий. Однако тестирование in vitro предоставляет лишь приблизительные данные, так как в клинической практике многое зависит от состояния больного.

Серологический анализ при инфекционном заболевании
Различные виды инфекций можно идентифицировать с помощью определения иммунного ответа, возникающего при внедрении возбудителя. Для этого существует большое количество различных методов: реакция агглютинации (РА), реакция связывания комплемента (РСК), реакция нейтрализации (РН) и иммуноферментный анализ (ИФА). Диагноз устанавливают на основании:
• определения уровня антител (IgM) в ответ на попадание в организм чужеродного белка (антигена);
• определения антигена.
Молекулярный анализ при инфекционном заболевании
Южный блоттинг и метод гибридизации нуклеиновых кислот. Методы основаны на связывании меченой ДНК с анализируемым образцом, при условии, что он имеет определённую последовательность аминокислот. Связанный комплекс определяют по активности метки. Это достаточно быстрый и надёжный способ, который, тем не менее, уступает по чувствительности молекулярно-генетическим методам.

Метод молекулярно-генетический (NAAT)
Для диагностики инфекционных заболеваний используют несколько молекулярно-генетических методов. Механизм выделения патогенной ДНК или РНК в количестве, достаточном для постановки диагноза, для каждого метода индивидуален. Так, при молекулярно-генетическом методе ДНК возбудителя разделяют на отдельные цепи, затем синтезируют праймеры для связывания с целевыми последовательностями. Образование новой ДНК катализирует полимераза.
Основное преимущество — достижение результата даже при наличии всего лишь одной копии ДНК. Благодаря автоматизированным системам и большому выбору специальных наборов эти методы стали доступны большинству диагностических лабораторий. Новые аппараты способны выдавать результат в режиме реального времени. Генетические методы позволяют идентифицировать микроорганизмы, выращивание которых отличается сложностью или сопряжено с риском для человека (например, Mycobacterium tuberculosis и Chlamydia trachomatis).
Кроме того, их можно использовать для определения генов, кодирующих устойчивость к действию антибиотиков (например, мутационный ген rpoВ, обеспечивающий устойчивость М. tuberculosis к рифампицину). Это позволяет заранее выбрать альтернативный путь лечения инфекционных заболеваний.
Иногда необходимо проводить типирование микроорганизмов в случае их распространения в больницах или в окружающей (внебольничной) среде.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Диагностика бактериальных инфекций. Бактериологическое и серологическое исследование
Бактериологический метод включает бактериоскопию материала от больного, выделение чистой культуры возбудителя и его идентификацию с определением чувствительности к антибиотикам и химиопрепаратам.
Выбор материала для исследования бактериоскопическим методом зависит от предполагаемой этиологии заболевания, стадии болезни с учетом ее патогенеза, биологических свойств возбудителя и других моментов.
1. При инфекционных болезнях, протекающих с бактериемией (брюшной тиф, генерализованные и септические формы сальмонеллеза); при сепсисе любой этиологии, вызываемом не только гноеродной кокковой микрофлорой, синегнойной палочкой, но и более редкими ее возбудителями (Serratia Salinaria, неферментирующие бактерии, анаэробы, L-формы стрептококка (метод Сукнева) и другие микроорганизмы), прибегая в этих случаях к посевам на специальные питательные среды. Следует подчеркнуть, что успех частоты и спектр выделяемых возбудителей из крови и других биологических секретов больного зависят от эрудиции, пытливости, настойчивости и упорства работников бактериологической лаборатории.
2. Спинномозговая жидкость (гнойные менингиты; туберкулезный менингит при длительном выращивании (более месяца) на специальных для выделения туберкулезных бактерий питательных средах.
3. Мокрота (острые пневмонии и трахеобронхиты, туберкулез, коклюш, чума, редкие формы брюшного тифа (пневмотиф), легионеллез, респираторный микоплазмоз и хламидиозы).
4. Слизь, гной с миндалин (стрептококковые и стафилокковые ангины).
5. Налет и слизь с миндалин, из зева и носа, отделяемое с конъюнктивы, половых органов (дифтерия).
6. Соскоб со слизистой носа (проказа).
7. Отделяемое из носа и ротоглотки (синуиты, озена, риносклерома).
8. Отечная жидкость, кусочки пораженных мышц, некрозированные ткани (анаэробные инфекции); отделяемое ран (ботулизм; в случае необходимости и столбняк).
9. Пунктат из увеличенных лимфоузлов (туберкулез, токсоплазмоз).
10 Содержимое карбункула и пунктат из нагноившихся лимфоузлов (чума, туляремия, септикопиемия, сибирская язва).
Бактериологические исследования при особо опасных инфекциях (чума, туляремия, бруцеллез, холера (при которой исследуются только испражнения(!)) выполняются в специальных режимных лабораториях, исключающих возможность самозаражения ее сотрудников при работе с бактериальными культурами и распространение возбудителей за пределы этих лабораторий.
Серологические исследования. Внедрены в клинику несколько позднее бактериологического метода, предложенного Р. Кохом. В 1896 г. Ф. Видаль обнаружил, что сыворотки крови больных брюшным тифом к концу 1-й недели болезни приобретают способность агглютинировать брюшнотифозную палочку - возбудителя брюшного тифа (положительная реакция Видаля). При полимикробной этиологии инфекционных болезней после открытия Видаля стали также прибегать к определению титров сывороточных агглютининов к выделяемым из патологического материала нескольким видам бактерий (реакция аутовидаля) и контролировать их динамику в зависимости от стадии болезни. Наиболее высокие титры агглютининов к одному из видов выделенных бактерий свидетельствуют в пользу его большей этиологической причастности к развитию болезни.
Уже в начале применения реакции Видаля в клинике было замечено, что самые тяжелые формы, например, брюшного тифа могут протекать при отсутствии в крови агглютининов (отрицательная реакции Видаля), что указывает на относительную диагностическую ценность этого метода как при брюшном тифе, так и при других инфекционных болезней. Позднее он был заменен более чувствительными серологическими методами. Но приоритетное значение открытия Видаля останется навсегда.
В настоящее время для серологической диагностики бактериальных инфекций применяют более чувствительные методы, когда антиген бактерий сорбируют на поверхности эритроцитов (эритроцитарные диагностикумы1). Таким образом, были разработаны принципиально новые серологические реакции: прямой (РПГА) и непрямой гемагглютинации (РИГА). Они широко применяются для серологической диагностики многих бактериальных, вирусных и других инфекций (брюшного тифа, сальмонеллеза, шигеллезов, бруцеллеза, туляремии и др.). Сохраняет свое диагностическое значение реакция преципитации при некоторых заболеваниях (ботулизме и сибирской язве - реакция Асколи для ее диагностики у животных). В серодиагностике особенно широко в настоящее время применяется реакция связывание комплемента (РСК), предложенная в 1901 г. французскими исследователями Борде и Жангу (сифилис, гонорея, бруцеллез, токсоплазмоз, туберкулез, проказа, сап). РСК имеет наибольшее значение для серодиагностики вирусных инфекций (грипп, другие ОРВИ, герпес, энцефалит, эпидемический паротит, орнитоз и др.), а также многочисленных риккетсиозов.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Лабораторные исследования при инфекционных заболеваниях. Методы
Отбор проб для анализа при инфекционных заболеваниях. Для микробиологического исследования может быть отобрана любая ткань или физиологическая жидкость организма.
Выделение чистой культуры способствует увеличению количества бактерий и их точной идентификации. Для этого используют питательные среды. Если в образце присутствует нормальная микрофлора, то применяют избирательные (селективные) среды, позволяющие создать условия, неблагоприятные для роста непатогенных микроорганизмов и способствующие росту патогенной микрофлоры.
Для получения точных результатов следует выбрать оптимальный метод отбора проб и подойти к этому процессу с должной аккуратностью. При несоблюдении правил асептики контаминация проб крови микроорганизмами извне может привести к назначению неправильного лечения.
Большинство бактерий не способны существовать вне организма хозяина: облигатные анаэробы погибают под действием кислорода воздуха, а некоторые возбудители очень чувствительны к высыханию (Neisseria gonorrhoeae). Именно поэтому анализируемые образцы сразу после отбора должны быть помещены на подходящие среды или посеяны на среды для транспортировки.
Лабораторные методы исследования при инфекционных заболеваниях
Образцы могут быть проанализированы невооружённым глазом (например, для определения взрослых гельминтов в фекалиях или крови в мокроте). Микроскопия — быстрый и недорогой метод исследования, но требует высокого технического мастерства, характеризуется низкой чувствительностью: для точного определения необходимо присутствие большого количества возбудителей.
Кроме того, очень часто условно-патогенные микроорганизмы принимают за патогенные, что связано с недостаточной специфичностью метода.
Для определения возбудителя могут быть использованы различные красители (например, аурамин или окрашивание по Цилю—Нильсену для идентификации микобактерий). Уротропиновый серебряный окрашивает хитин клеточной стенки грибов и Pneumocystis jiroveci. Краситель Гимза применяют для окрашивания возбудителей малярии, лейшманий и других паразитов.
В основе иммунофлюоресцентного метода лежит применение специфических антител, помеченных флюоресцентными маркёрами. Микроскопию осуществляют в ультрафиолетовом свете, при этом возбудитель и связанные с ним антитела светятся ярко-зелёным цветом.

Лабораторные исследования при инфекционных заболеваниях
Выделение чистой культуры возбудителя при инфекционных заболеваниях
Иногда, даже при выраженных клинических симптомах, возбудитель может присутствовать в очаге инфекции в количестве, недостаточном для микроскопического определения. В этом случае выделение чистой культуры позволяет увеличить численность микроорганизмов в исследуемом субстрате.
Существует два способа выращивания микроорганизмов: на жидких (увеличивается количество возбудителей) и твёрдых (исследуют отдельные колонии, в том числе и на чувствительность к антибиотикам) питательных средах. Большинство возбудителей инфекций человека достаточно требовательны к условиям культивирования. Именно поэтому питательные среды для их выращивания должны содержать белки, сахарозу и нуклеиновые кислоты (присутствующие в крови и сыворотке).
Кроме того, необходимо поддерживать соответствующий газовый состав: для культивирования анаэробов необходимо отсутствие кислорода, в то время как для облигатных аэробов (Bordetella pertussis) — наоборот. Оптимальная температура выращивания большинства патогенных микроорганизмов составляет 37 °С; культивирование некоторых фибов осуществляют при 30 С.
Идентификация возбудителя инфекционного заболевания
Симптомы заболеваний зависят от вида возбудителей, вызвавших их. Именно поэтому идентификация микроорганизма позволяет предположить клиническую картину вызываемого им заболевания (например, симптомы инфекции, вызванной Vibrio cholerae, отличны от таковых при заражении Shigella sonnei). Большое значение имеет выделение Neisseria meningitidis именно из спинномозговой жидкости. Идентификация микроорганизмов основана на:
• изучении морфологических свойств их колоний в агаре;
• различной окраске по Граму;
• способности возбудителей к образованию спор;
• изучении биохимических свойств (каталазный или коагулазный тесты).
Точное определение штамма обычно зависит от результатов биохимического анализа (например, уреазный тест) или обнаружения продуктов жизнедеятельности бактерий (индол). Возбудителей, которые не могут быть выращены на питательных средах, идентифицируют при помощи молекулярно-генетического метода ДНК и секвенирования (например, Trophyrema whippelii).

Определение чувствительности возбудителя инфекционного заболевания к антибиотикам
Если для эрадикации микроорганизмов достаточно стандартной дозы антимикробного препарата, то их считают чувствительными, если необходимо увеличение дозы лекарственного средства — относительно устойчивыми. Абсолютно устойчивыми (резистентными) называют возбудителей, в отношении которых антибиотикотерапия неэффективна. Существует широкий спектр различных методов определения чувствительности к антимикробным препаратам.
Методы Британской ассоциации антимикробной химиотерапии (British Society of Antimicrobial Chemotherapy — BSAQ и Института клинических лабораторных стандартов (Clinical Laboratory Standards Institute — С LSI) основаны на определении диаметра зоны слабого роста микроорганизмов на твёрдой питательной среде при применении антимикробного препарата.
Минимальную подавляющую концентрацию антибиотика измеряют с помощью Е-теста, растворения препарата в питательном бульоне или нанесения его на плотный агар. В последнем случае на засеянный исследуемыми микроорганизмами агар наносят бумажные диски, пропитанные различными антибиотиками (метод бумажных дисков).
Уровень чувствительности зависит от диаметра зоны пониженного роста бактерий. Однако тестирование in vitro предоставляет лишь приблизительные данные, так как в клинической практике многое зависит от состояния больного.

Серологический анализ при инфекционном заболевании
Различные виды инфекций можно идентифицировать с помощью определения иммунного ответа, возникающего при внедрении возбудителя. Для этого существует большое количество различных методов: реакция агглютинации (РА), реакция связывания комплемента (РСК), реакция нейтрализации (РН) и иммуноферментный анализ (ИФА). Диагноз устанавливают на основании:
• определения уровня антител (IgM) в ответ на попадание в организм чужеродного белка (антигена);
• определения антигена.
Молекулярный анализ при инфекционном заболевании
Южный блоттинг и метод гибридизации нуклеиновых кислот. Методы основаны на связывании меченой ДНК с анализируемым образцом, при условии, что он имеет определённую последовательность аминокислот. Связанный комплекс определяют по активности метки. Это достаточно быстрый и надёжный способ, который, тем не менее, уступает по чувствительности молекулярно-генетическим методам.

Метод молекулярно-генетический (NAAT)
Для диагностики инфекционных заболеваний используют несколько молекулярно-генетических методов. Механизм выделения патогенной ДНК или РНК в количестве, достаточном для постановки диагноза, для каждого метода индивидуален. Так, при молекулярно-генетическом методе ДНК возбудителя разделяют на отдельные цепи, затем синтезируют праймеры для связывания с целевыми последовательностями. Образование новой ДНК катализирует полимераза.
Основное преимущество — достижение результата даже при наличии всего лишь одной копии ДНК. Благодаря автоматизированным системам и большому выбору специальных наборов эти методы стали доступны большинству диагностических лабораторий. Новые аппараты способны выдавать результат в режиме реального времени. Генетические методы позволяют идентифицировать микроорганизмы, выращивание которых отличается сложностью или сопряжено с риском для человека (например, Mycobacterium tuberculosis и Chlamydia trachomatis).
Кроме того, их можно использовать для определения генов, кодирующих устойчивость к действию антибиотиков (например, мутационный ген rpoВ, обеспечивающий устойчивость М. tuberculosis к рифампицину). Это позволяет заранее выбрать альтернативный путь лечения инфекционных заболеваний.
Иногда необходимо проводить типирование микроорганизмов в случае их распространения в больницах или в окружающей (внебольничной) среде.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

