Методы микробиологической диагностики брюшного тифа и паратифов а и
Обновлено: 26.04.2024
Возбудителями брюшного тифа и паратифов (А, В) являются бактерии рода Salmonella, в состав которого входят два вида: Salmonella enterica с 6 подвидами (включая возбудители брюшного тифа, паратифов, сальмонеллезов – всего более 2400 сероваров) и Salmonellabongori(редко встречающиеся сальмонеллы).Возбудитель брюшного тифа обозначается как Salmonellaсеровара Typhi (Salmonella entericaspp. enterica ser. typhi, прежнее название Salmonella typhi), паратифа А — Salmonellaсеровара ParatyphiA, паратифа В — Salmonellaсеровара Paratyphi В.
Методы микробиологической диагностики брюшного тифа и паратифов представлены в схеме 9.
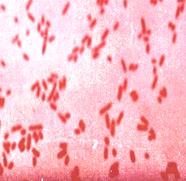
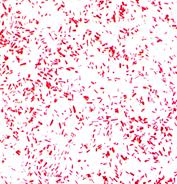
Выбор материала и метода микробиологической диагностики этих заболеваний зависит от стадии патогенеза. На первой неделе заболевания и в течение всего лихорадочного периода возбудитель можно выделить из крови (гемокультура), с конца второй и на третьей неделе — из мочи (уринокультура) и испражнений (копрокультура). Высокий процент высеваемости возбудителя отмечается при исследовании костного мозга (выделение миелокультуры). Удается обнаружить сальмонеллы в скарификате розеол (розеоло-культура), ликворе, содержимом двенадцатиперстной кишки, секционном материале. У реконвалесцентов исследуют испражнения и желчь (выделение биликультуры). Начиная со второй недели заболевания проводят серологическое исследование. Микроскопическое исследование материала от больного не проводится, т.к. все энтеробактерии (как патогенные, так и непатогенные, например, E.coli) по морфологическим свойствам идентичны (рис. 14).
Бактериологическое исследованиеявляется основным лабораторным методом диагностики брюшного тифа и паратифов.
Ранним и надежным методом бактериологической диагностики является выделение возбудителей из крови (гемокультура).Взятую в асептических условиях кровь (15-20 мл) засевают на 10% желчный бульон или среду Рапопорт (10% желчный бульон, 1 % маннита или 2 % глюкозы, 1 % индикатора Андреде; в среду помещен поплавок для улавливания газа) в соотношении крови и среды 1:10 для накопления сальмонелл. Посевы инкубируют при 37 0 С 18 —24 ч. При наличии сальмонелл маннит или глюкоза расщепляется с образованием кислоты и среда приобретает красный цвет; появление в поплавке газа свидетельствует о газообразовании - характерном признаке паратифозных бактерий.
Схема 9.Микробиологическая диагностика брюшного тифа и паратифов.
А б
Рис. 14. а - кишечная палочка(E.coli ув. Х1350), б- возбудитель брюшного тифа(S.typhi, ув. Х630) в мазках из чистой культуры. Окраска по Граму. Грамотрицательные беспорядочно расположенные палочки средних размеров.
Копрокультуру выделяют путем посева фекалий на среду Плоскирева, Эндо, висмут-сульфит агар и среды накопления (селенитовую, магниевую, тетратионатную, Кауфмана, Мюллера) с последующей 18 —24-часовой инкубацией при 37 °С.
На 2-й день на средах Плоскирева, МакКонки или Эндо вырастают бесцветные (лактозоотрицательные) колонии, а на висмут-сульфит-агаре – черные. Колонии сальмонелл паратифа А окрашены взеленый цвет, так как не образуют сероводород. Из типичных колоний готовят мазок, окрашивают по Граму и после микроскопии остаток колонии пересевают на среду Ресселя или Олькеницкого. При отсутствии типичных колоний на те же среды засевают материал со среды обогащения.
ставят ориентировочную, а потом развернутую РА. Ориентировочную РА ставят со смесью О-сывороток, включающей агглютинины к О-антигенам 2, 4, 7, 8, 9, 3-10. При отсутствии РА с этой смесью используют смесь монорецепторных О-сывороток к редким группам сальмонелл (антитела к антигенам 11, 13, 15, 19, 23 и т.д.) При получении положительных результатов культуру испытывают отдельно с каждой из О-сывороток, входящих в состав смеси. После этого культуру агглютинируют с Н-сыворотками 1 фазы (a, b, i, c, d, g, m) а потом 2 фазы (1,2; 1,5), устанавливая антигенную формулу выделенной сальмонеллы в соответствии со схемой Кауфмана-Уайта (таблица 9). Эта схема разработана на основании изучения у сальмонелл О и Н антигенов и применяется с целью антигенной идентификации патогенных сальмонелл.

Таблица 9. Антигенная структура сальмонелл (сокращенная схема Кауфмана-Уайта)
| Группа | Серовар | О-антиген | Н-антиген | |
| Фаза 1 | Фаза 2 | |||
| А | Paratyphi A | 1, 2, 12 | a | - |
| B | Paratyphi B Typhi murium | 1, 4, 5, 12 1, 4, 5, 12 | b i | 1, 2 1, 2 |
| C | Paratyphi C Cholerae suis | 6, 7, Vi 6, 7 | c c | 1, 5 1, 5 |
| D | Typhi Enteritidis | 9, 12, Vi 1, 9, 12. | d g, m | - - |
Мочу, дуоденальное содержимое, соскоб розеол, секционный материал с целью выделения тифо-паратифозных бактерий засевают на плотные среды (Эндо, Мак-Конки и т.п. в чашке Петри), а также в среды накопления. При наличии характерного роста идентификация проводится по вышеописанной схеме.
Таблица 10. Биохимические свойства возбудителей брюшного тифа и паратифов
| Биовар S.enterica | Ферментация | Продукция | ||||||
| Лакто- Зы | Глю- козы | Маль- тозы | Саха- розы | Ман- нита | Н2S | NH3 | индо- ла | |
| Typhi | - | К | К | - | К | + | - | - |
| Paratyphi A | - | КГ | КГ | - | КГ | - | - | - |
| Paratyphi В | - | КГ | КГ | - | КГ | + | + | - |
Обозначения: (+) - наличие свойства, (-) - отсутствие свойства, К – образование кислоты, КГ – образование кислоты и газа.
Аналогично проводится исследование испражнений упереболевших брюшным тифом и паратифом лиц, а также у работников детских учреждений, питания и водоснабжения с целью выявления бактерионосителей.
Серологическое исследование.Для серологической диагностики брюшного тифа и паратифов ставят реакцию Видаля (развернутая РА) с целью определения соответствующих антител в крови больного. Антитела к возбудителям брюшного тифа, паратифов А и В обнаруживаются в сыворотке крови больных с 8— 10-го дня заболевания. Исследуемую сыворотку крови разводят двукратно в 6 параллельных рядах пробирок от 1:100 до 1: 1600 в объеме 1 мл, куда вносят по 2 капли ОН- и О- брюшнотифозного, паратифозного Аи паратифозного В диагностикумов. О-диагностикумы получают кипячением или обработкой спиртом взвеси соответствующих культур, ОН-диагностикумы - обработкой формалином. Для контроля антигена диагностикумы вносятся в той же дозе в 1 мл физиологического раствора, а для контроля сыворотки используют сыворотку в разведении 1:100 без добавления диагностикумов.
О-антитела имеют диагностическое значение, они появляются в крови на второй неделе заболевания и исчезают к его концу, а Н-агглютинины нарастают к концу заболевания. и диагностической ценности не имеют. Н-антитела могут обнаруживаться также у переболевших и вакцинированных. Ряд брюшнотифозных вакцин вызывает также выработку Vi – и О антител. Диагностический титр О-антител в реакции Видаля у неиммунизированных лиц 1 :100, а при отсутствии типичной клинической картины - 1 :200. Однако титр антител у больных может быть ниже диагностического в связи с ранним назначением антибиотиков или наличием у больного вторичного иммунодефицита. Таким образом, отрицательная реакция Видаля не исключает тифопаратифозное заболевание. С другой стороны, повышенные титры О-антител могут быть обусловлены прививками. Поэтому при подозрении на брюшной тиф или паратифы целесообразно исследовать сыворотку крови как можно раньше (до появления антител), а затем в динамике (с интервалом 7-12 дней) для выявления нарастания титра антител более чем в 4 раза. Если сыворотка крови больного агглютинирует одновременно два или три вида диагностикумов, учитывают титр агглютинации: специфическая агглютинация происходит обычно с более высокими, а групповая — с более низкими разведениями сыворотки.
Более чувствительны РНГА с эритроцитарными групповыми (А, В, С, Д, Е)и монорецепторными диагностикумами, а также ИФА, которые ставят с парными сыворотками в динамике заболевания.
Vi-антитела чаще обнаруживаются у бактерионосителей сальмонелл брюшного тифа, т.к. Vi-антиген способствует длительной персистенции возбудителя в организме. При обследовании лиц, подозрительных на носительство брюшнотифозных палочек, применяется РНГА с эритроцитарным Vi-диагностикумом для определения соответствующих антител и их принадлежности к классу IgG.
ЭПИДЕМИОЛОГИЯ, ПРОФИЛАКТИКА И ЛАБОРАТОРНАЯ ДИАГНОСТИКА БРЮШНОГО ТИФА
3аместитель начальника Главного управления НИИ и координации научных исследований В.М.Христюк
22 ноября 1984 г.
Заместитель министра К.И.Акулов
22 ноября 1984 г.
Составители: Н.А.Чернышева, И.Н.Каменская, Н.А.Курносова (Московский НИИЭМ им.Г.Н.Габричевского); В.В.Мефодьев, Г.В.Кондинский, Г.Н.Пекло, В.А.Майер, Б.Н.Гречаная, А.П.Размашкина, А.К.Крестьянинова (Тюменский НИИКИП); Ю.К.Рачковская (Ростовский-на-Дону НИИЭМГ).
В результате осуществления широких мероприятий по обеспечению населения доброкачественной питьевой водой, а также проведения комплекса лечебно-профилактических мероприятий заболеваемость брюшным тифом в РСФСР в последние годы резко снизилась. При этом основные проявления эпидемического процесса брюшного тифа несколько изменились.
Исходя из этого обстоятельства, в настоящих методических рекомендациях излагаются некоторые вопросы, касающиеся эпидемиологических особенностей современного брюшного тифа, профилактики и лабораторной диагностики инфекции. Особое внимание обращается на тактику использования серологического метода для диагностики хронического бактериологического метода для диагностики хронического бактерионосительства. Разделы IV и V даны в дополнение к "Инструкции по выявлению, учету и наблюдению за носителями бактерий брюшного тифа и паратифов" Минздрава СССР от 02.02.81.
I. ЭПИДЕМИОЛОГИЯ
Основные проявления эпидемического процесса при брюшном тифе в последние годы характеризуются низким уровнем заболеваемости и очаговости, резким сокращением количества и массивности вспышек, снижением тяжести клинического течения заболевания. На этом фоне динамика заболеваемости брюшным тифом сохраняет тенденцию дальнейшего снижения. Показатели заболеваемости брюшным тифом городского и сельского населения в большинстве территорий стали почти равнозначными.
В ряде областей, краев и АССР сохраняются эндемичные очаги инфекции - отдельные населенные пункты или микрорайоны городов, в которых вследствие все еще неудовлетворительного состояния водоснабжения из года в год регистрируется повышенный уровень заболеваемости.
На большинстве территорий заболеваемость брюшным тифом носит спорадический характер. Групповые заболевания (вспышки) чаще наблюдаются в закрытых коллективах (домах для престарелых, психиатрических больницах), в организованных группах населения, временно находящихся в неудовлетворительных санитарно-гигиенических бытовых условиях.
Сезонная кривая на фоне снижения заболеваемости брюшным тифом приобрела более сглаженный характер, но максимум заболеваний регистрируется в сентябре, октябре месяцах. В местностях с водным типом эпидемического процесса подъемы, обусловленные употреблением населением инфицированной воды, обычно наблюдаются в холодный период года, что, как известно, связано с замедлением процессов самоочищения воды и лучшей выживаемостью возбудителя во внешней среде при низких температурах.
В числе заболевших брюшным тифом доля детей до 14 лет постепенно уменьшается и в среднем не превышает 25%. Однако на территориях с интенсивно действующим водным фактором передачи инфекции она достигает 35-40%, наиболее высокие показатели заболеваемости отмечаются в группе детей 7-14 лет. Среди детей дошкольного возраста, в основном в группе не посещающих детские дошкольные учреждения, регистрируются отельные случаи заболеваний, связанные с заражением в домашних условиях от хронических бактерионосителей. Среди взрослых основную массу заболевших составляют лица молодого возраста.
Источник инфекции и путь передачи при спорадических заболеваниях брюшным тифом обычно не удается определить. Среди выявленных источников инфекции 25-30% составляют больные, 5-6% реконвалесцентны и 65-70% хронические бактерионосители, чаще всего они оказываются выявленными впервые.
Эпидемиологическая роль больных определяется прежде всего степенью выраженности клинических проявлений болезни. Однако в последние годы на фоне облегчения клинического течения брюшного тифа роль источников инфекции чаще играют больные легкими и стертыми формами болезни. Трудности клинической диагностики таких случаев и связанные с ними недостатки в проведении лечебно-профилактических мероприятий (поздние диагностика, госпитализация) влекут за собой возникновение групповых заболеваний в быту, школах, домах-интернатах.
Водный путь распространения брюшного тифа все еще сохраняет ведущую роль, хотя число водных вспышек и групповых заболеваний резко сократилось. Возникновение их наблюдается при загрязнении питьевой воды во время локальных аварий на водопроводе и канализации, в случаях использования для питья воды технического водопровода и из открытого водоема. Иногда заболевания связаны с загрязнением воды колодцев.
Водные вспышки, возникшие в результате одномоментного заражения воды, характеризуются взрывным началом и относительно быстрым спадом числа заболеваний после устранения причины инфицирования воды. Заболевания протекают в легкой и среднетяжелой форме, иногда с удлиненным инкубационным периодом (в отдельных случаях до 28 дней и более) в результате заражения сравнительно небольшой дозой возбудителя.
В населенных пунктах с водопользованием из открытых водоемов при условии длительного фекального загрязнения водоисточника заболеваемость брюшным тифом может удерживаться на повышенном уровне в течение ряда лет.
Второе место по эпидемической значимости принадлежит бытовому пути распространения брюшного тифа, при котором наряду с единичными могут возникать групповые заболевания, но отсутствуют какие-либо закономерности в распределении заболевших по территории, возрасту и профессиональному признаку. Характерно вовлечение в эпидемический процесс неработающих контингентов, неорганизованных детей, лиц пожилого возраста. В домах для престарелых, психиатрических больницах, школах-интернатах могут наблюдаться отельные бытовые вспышки инфекции, связанные с заражением от невыявленных бактерионосителей или больных легкими формами.
Эпидемиологический диагноз бытового заражения ставят тогда, когда исключено действие водного и пищевого фактора, показана связь с источником инфекции и имеют место неудовлетворительные санитарно-гигиенические условия в очаге.
Пищевой путь и пищевые продукты как факторы передачи инфекции имеют небольшое значение. Инфицирование пищевого продукта обычно происходит на конечном этапе его реализации, сводится к контаминации отдельной партии или порции продукта, что влечет за собой заражение ограниченной группы людей.
Среди продуктов наиболее опасно молоко, которое служит хорошей питательной средой для бактерий, что способствует накоплению возбудителя и быстрому инфицированию всей массы продукта. Величина такой вспышки определяется количеством зараженного продукта, степенью его инфицированности и количеством людей, употреблявших его. Длительность инкубационного периода в этих случаях чаще не превышает 7 дней, заболевания протекают в среднетяжелой и тяжелой клинических формах.
II. ПРОФИЛАКТИЧЕСКИЕ И ПРОТИВОЭПИДЕМИЧЕСКИЕ МЕРОПРИЯТИЯ
В профилактике брюшного тифа основное значение имеют коммунальные и санитарно-гигиенические мероприятия, направленные на улучшение водоснабжения и очистки населенных пунктов.
В условиях существенного улучшения коммунального благоустройства городов и поселков в предупреждении распространения брюшного тифа значительно возрастает роль лечебно-профилактических мероприятий и в первую очередь активного выявления лихорадящих больных среди контактных в очаге, обследования длительно температурящих (более 5 дней) методом гемокультуры. Целесообразна организация повторных обходов (не реже чем 2 раза в неделю).
Лица, подозрительные на заболевание брюшным тифом, подлежат госпитализации в инфекционную больницу, остальные подвергаются клиническому наблюдению на дому или провизорной госпитализации в специальное отделение. Вопрос об оставлении лихорадящего больного на дому решается инфекционистом и эпидемиологом.
За лицами, общавшимися с больным или подозрительным на заболевание, медицинское наблюдение с ежедневной термометрией осуществляют в течение 21 дня с момента изоляции больного. С целью поиска источника в очаге инфекции у лиц, общавшихся с больным дома или по месту работы (учебы и т.п.), проводят бактериологическое исследование испражнений и исследование сыворотки крови на брюшнотифозное бактерионосительство (реакция агглютинации с бактерийным диагностикумом из сальмонелл брюшного тифа ОН и РПГА с эритроцитарными сальмонеллезными диагностикумами Ви и 0-1, 9, 12).
В случае обнаружения положительных реакций в титрах, превышающих уровень нормальных антител в данной местности (обычно этот уровень составляет разведение сыворотки 1:40-1:80 для О- и Н-антител и 1:20-1:40 для Ви-антител), при отсутствии у обследуемого признаков острого заболевания брюшным тифом проводят исследование сыворотки крови в РА и РПГА с применением цистеина. При положительном результате этого обследования - многократное бактериологическое исследование кала и мочи и однократное исследование желчи в соответствии с "Инструкцией по выявлению, учету и наблюдению за носителями бактерий брюшного тифа и паратифов" Минздрава СССР от 02.02.81 (см. приложение N 1).
При групповых заболеваниях и вспышках обследованию на бактерионосительство подвергаются в первую очередь лица, подозреваемые в качестве источника массового заражения - работники водоснабжения, общественного питания, торговли, детских учреждений и др., занимающиеся разными видами обслуживания населения.
В условиях вспышки (при действии фактора массового заражения) обследование на бактерионосительство контактных лиц в каждом отдельном очаге больного брюшным тифом теряет смысл, следует осуществлять только наблюдение за ними с целью раннего выявления повторных случаев заболевания. Лица, подвергшиеся риску одномоментного заражения, с целью более полного выявления среди них больных легкими и стертыми формами инфекции, подлежат бактериологическому (однократно кал) и серологическому (реакция агглютинации с бактерийным диагностикумом и РПГА с эритроцитарными 0-1, 9, 12 и Ви диагностикумами) обследованиям. Последнее проводится двукратно с интервалом в 5-10 дней.
Лица, выделившие возбудителя, а также с серологическими признаками инфекции подлежат госпитализации для установления характера бактериовыделения и подтверждения диагноза болезни.
Мероприятия, направленные на повышение невосприимчивости организма к брюшному тифу - вакцинация населения и фагирование брюшнотифозным бактериофагом, в настоящее время имеют значение при условии избирательного и целенаправленного их применения, главным образом, по эпидемическим показаниям.
На вооружении практики здравоохранения имеется спиртовая брюшнотифозная моновакцина, обогащенная Ви-антигеном, применяемая для иммунизации детей 7-14 лет, и химическая сорбированная брюшнотифозная вакцина - для контингентов взрослых.
В районах с постоянно повышенным уровнем заболеваемости плановой вакцинации подлежат отдельные "эпидемиологически значимые" возрастные и профессиональные группы населения.
В отдельных населенных пунктах (поселок, деревня) или микрорайонах города с ежегодно регистрируемым высоким уровнем заболеваемости при условии неудовлетворительного состояния водоснабжения и невозможности его улучшения в ближайшее время показано расширение прививаемых контингентов, вплоть до проведения поголовной иммунизации.
Выборочная иммунизация контактных лиц проводится в очагах хронических бактерионосителей с неудовлетворительными санитарно-гигиеническими условиями проживания.
Проведение экстренной вакцинопрофилактики показано в условиях острого эпидемического подъема заболеваемости брюшным тифом, наблюдающегося среди ограниченного контингента людей и обусловленного действием невыясненного или водного фактора, устранение которого в кратчайшие сроки невозможно. В этом случае применяется брюшнотифозная вакцина, обогащенная Ви-антигеном. Прививки проводятся в максимально сжатые и ранние от начала вспышки сроки, с соблюдением сроков ревакцинации у ранее привитых.
Брюшнотифозный бактериофаг применяется по эпидпоказаниям - с целью временного обеззараживания источников инфекции (больных, реконвалесцентов, бактерионосителей), профилактически - с целью предупреждения инфицирования контингентов повышенного риска заражения (детей, посещающих организованные коллективы, лиц престарелого возраста, пищевиков и лиц, к ним приравненных).
Бактериофаг назначается в следующих дозах: детям в возрасте от 6 месяцев до 3 лет по 10 мл (или по 1 таблетке) на прием; от 3 до 10 лет - 15 мл; детям старше 10 лет и взрослым - по 25 мл (или по 2 таблетки на прием) в соответствии с "Наставлением по применению брюшнотифозного бактериофага", утвержденным 30.06.81.
В очаге брюшного тифа (в семье или коллективе) для предупреждения последующих заболеваний бактериофаг назначается в два цикла: первый - сразу после выявления больного, второй - после возвращения реконвалесцента из больницы в семью или коллектив. Препарат дают каждые 3-5 дней в течение 15 дней.
С целью санации реконвалесцентам после перенесенного брюшного тифа перед выпиской из стационара бактериофаг дается 3 дня подряд.
На территориях, являющихся эндемичными по брюшному тифу, в период сезонного подъема заболеваемости фагирование целесообразно проводить хроническим бактерионосителям в целях уменьшения их эпидемической опасности (1 раз в неделю).
При неблагоприятной эпидемической ситуации по брюшному тифу в отдельном учреждении (психбольница, интернат для престарелых и др.) или в коллективе людей, находящихся в неудовлетворительных санитарно-гигиенических условиях (строительный отряд и т.д.), для предупреждения возникновения повторных заболеваний показано поголовное фагирование (1 раз в три дня в течение срока, установленного эпидемиологом).
В целях эффективного применения брюшнотифозного бактериофага следует проверять литическую активность каждой партии поступающего препарата в отношении культур брюшного тифа, циркулирующих на данной территории.
III. ЭПИДЕМИОЛОГИЧЕСКИЙ АНАЛИЗ
Эффективность оперативных мероприятий по борьбе с инфекцией, разработанных на основе текущего эпидемиологического анализа заболеваемости брюшным тифом, во многом зависит от качества эпидемиологического обследования очагов, а также полноты санитарного и санитарно-бактериологического контроля за эпидемиологическими значимыми объектами.
При проведении эпидемиологического обследования в очаге брюшного тифа, особенно в условиях групповой заболеваемости (вспышки), большое значение имеет тщательный сбор информации. Очень важно установить точную дату заболевания, место пребывания заболевшего в период предполагаемого заражения (с учетом максимального срока инкубационного периода), характер его деятельности, условия питания, водопотребления, санитарные условия дома и по месту работы и др. При уточнении даты заболевания следует сопоставить данные опроса с динамикой клинических симптомов и результатами лабораторного обследования больного.
С целью поиска источника инфекции проводят работу по выявлению недиагностированных случаев брюшного тифа среди лиц, общавшихся с больным и среди декретированных контингентов. При этом проверяют больничные листы, журналы температурящих, истории болезни, амбулаторные карты. Лиц, подозрительных на переболевание брюшным тифом (такими могут быть длительно лихорадящие с диагнозом пневмония, ОРЗ и др.), подвергают целенаправленному клиническому и лабораторному обследованию.
Результаты анализа динамики заболеваний, их территориального распределения, возрастной и профессиональной структуры заболевших, длительности инкубационного периода болезни и тяжести клинического течения позволяют сделать предположение о действующем факторе распространения брюшного тифа. Данные санитарного и санитарно-бактериологического обследования различных объектов помогают придти к окончательному выводу по этому вопросу. Большое значение имеет совпадение фаготипов и биотипов культур, выделенных от разных источников и объектов. Однако отрицательные результаты бактериологических исследований на патогенную кишечную микрофлору не являются основанием для исключения роли того или иного фактора в распространении инфекции.
Правильность выводов, полученных на основании данных эпидемиологического анализа, проверяется и подтверждается эффективностью целенаправленных противоэпидемических мероприятий.
В ходе ретроспективного анализа заболеваемости проводят изучение особенностей эпидемического процесса за определенный отрезок времени (5-10 и более лет). При анализе территориального распределения заболеваемости выделяют конкретные населенные пункты с повышенным ее уровнем, проводят районирование территории по условиям заражения населения брюшным тифом. При этом необходимо охарактеризовать состояние водообеспечения (удельный вес населения, пользующегося разными видами водоснабжения, количество воды на душу населения, удельный вес анализов воды, не соответствующих требованиям ГОСТа); состояние санитарной очистки (показатели канализования жилого фонда, охвата домовладений плановой очисткой, обеспеченности ассенизационным транспортом); состояние общественного питания (охват населения общественным питанием, смывы на пищевых объектах с высевом кишечной палочки др.); качество продукции молокозавода (удельный вес анализов, не удовлетворяющих санитарным требованиям, и др.).
Для районов с разными условиями заражения разрабатывают дифференцированные комплексные планы мероприятий по профилактике брюшного тифа.
IV. ВЫЯВЛЕНИЯ, УЧЕТ И НАБЛЮДЕНИЕ ЗА НОСИТЕЛЯМИ БАКТЕРИЙ БРЮШНОГО ТИФА
В настоящее время хроническое бактерионосительство считается одним из видов латентной инфекции, своеобразным симбиозом клеток хозяина и микроба, состоянием, когда иммунные механизмы организма не способны элиминировать микроорганизмы, но угнетают активность болезнетворных факторов, предупреждая развитие выраженного клинического проявления инфекционного процесса.
Система мер выявлению и наблюдению за бактерионосителями строится с учетом патогенетических особенностей бактерионосительства. По типу бактериовыделения носителей брюшного тифа общепринято подразделять на следующие группы:
1. Транзиторные носители. Такая форма носительства возникает при попадании бактерий в кишечник человека, невосприимчивого к инфекции, либо при малой заражающей дозе. Бактерии при этом не проникают в кровь, внутренние органы и выделяются из кишечника. Характеризуется однократным, редко двукратным, выделением возбудителя из испражнений в течение небольшого промежутка времени, отсутствием каких-либо симптомов заболевания в момент выделения культуры и серологических сдвигов.
2. Острые носители. Это лица, выделяющие бактерии брюшного тифа в течение первых трех месяцев после перенесения заболевания. Большинство таких носителей (95%) самостоятельно, без дополнительного лечения освобождаются от бактерий в течение указанного срока.
4.2. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Бактериологическая диагностика брюшного тифа и паратифов А, В и С
Дата введения: с момента утверждения
1. РАЗРАБОТАНЫ: ФГУН Санкт-Петербургский НИИЭМ им. Пастера Роспотребнадзора (Л.А.Кафтырева, З.Н.Матвеева, Г.Ф.Трифонова); ГОУВПО "Санкт-Петербургская государственная медицинская академия им. И.И.Мечникова" Федерального агентства по здравоохранению и социальному развитию (А.Г.Бойцов).
2. РЕКОМЕНДОВАНЫ К УТВЕРЖДЕНИЮ Лабораторным Советом Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (протокол от 24.12.07 N 11фц/5327).
3. УТВЕРЖДЕНЫ Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации Г.Г.Онищенко 29 декабря 2007 г. 0100/13745-07-34
4. ВВЕДЕНЫ В ДЕЙСТВИЕ с момента утверждения.
5. ВВЕДЕНЫ ВПЕРВЫЕ.
1. Область применения
1.1. В методических рекомендациях изложены основные принципы и особенности бактериологической диагностики брюшного тифа и паратифов А, В и С; содержатся современные сведения о биологических свойствах возбудителей, резистентности к антибактериальным препаратам, о питательных средах для их выделения и особенностях дифференциации возбудителей брюшного тифа и паратифов от других серологических вариантов сальмонелл.
1.2. Методические рекомендации предназначены для специалистов микробиологических лабораторий, проводящих соответствующие исследования.
2. Список сокращений
АБП - антибактериальный препарат
ВСА - висмут-сульфит агар
ЛПУ - лечебно-профилактическое учреждение
МПК - минимальная подавляющая концентрация
РИФ - реакция иммунофлюоресценции
ЦНС - центральная нервная система
"+" - положительная реакция в первые сутки;
"-" - отрицательная реакция на 4-20 сутки;
"(+)" - замедленная положительная реакция на 2-20 сутки;
d - различные ферментативные реакции.
Возможна дифференциация на ферментативные варианты.
3. Общие положения
3.1. Брюшной тиф и паратифы А, В и С являются антропонозными кишечными инфекциями, вызываемыми микроорганизмами Salmonella Typhi, Salmonella Paratyphi A, Salmonella Paratyphi В и Salmonella Paratyphi С. В настоящее время чаще регистрируется брюшной тиф, реже - паратиф В, редко - паратиф А и крайне редко - паратиф С.
3.2. Заболевания характеризуются язвенным поражением лимфатической системы тонкой кишки, бактериемией, лихорадкой, циклическим клиническим течением с выраженной интоксикацией, розеолезной сыпью на кожных покровах туловища, гепато- и спленомегалией. Более характерен запор, нежели диарея. Изъязвление пейеровых бляшек подвздошной кишки примерно в 1% случаев приводит к кишечному кровотечению и прободению кишечника с самыми неблагоприятными последствиями для больного.
3.3. Диагноз брюшного тифа и паратифов А, В и С ставится на основании клинических признаков болезни с учетом эпидемиологического анамнеза и данных комплексного лабораторного обследования, которое включает классические бактериологический и серологический методы. Бактериологическая диагностика имеет приоритетное значение, т.к. в этом случае удается получить наиболее полную информацию о биологических свойствах возбудителя, включая его чувствительность к антибактериальным препаратам.
3.4. Применение антимикробных препаратов для этиотропной терапии брюшного тифа и паратифов позволило, с одной стороны, снизить летальность с 10-20% до уровня менее 1%, а с другой стороны - осложнило лабораторную диагностику, т.к. нередко забор материала для лабораторного исследования осуществляется уже после начала антибиотикотерапии. Этот факт заставляет более тщательно подходить к вопросу выбора материала для исследования, взятия исследуемого материала, техники исследования.
3.5. Современной особенностью эпидемиологии брюшного тифа является резкое увеличение частоты завоза (заноса) инфекции с эндемичных по этому заболеванию территорий, стран ближнего и дальнего зарубежья, а также заражение жителей России при выезде в эти страны и в процессе миграции внутри страны. Другой особенностью является наличие обширного контингента высокого эпидемиологического риска в виде лиц без определенного места жительства, среди которых регистрируется высокая заболеваемость брюшным тифом.
3.6. Данные методические рекомендации составлены с целью унификации методов бактериологической диагностики брюшного тифа и паратифов А, В и С, а также правильной интерпретации результатов лабораторного исследования с учетом современных особенностей клиники, лечения и эпидемиологической обстановки на конкретных территориях.
4. Показания к проведению бактериологической диагностики
Показанием к проведению бактериологического исследования биологического материала на наличие возбудителей брюшного тифа и паратифов А, В и С является необходимость обследования:
4.1) больных с подозрением на тифопаратифозное заболевание, а также с лихорадкой неясной этиологии, продолжающейся 5 и более дней;
4.2) лиц, общавшихся с больными брюшным тифом и паратифами А, В, С;
4.3) работников отдельных профессий, производств и организаций при поступлении на работу и по эпидемиологическим показаниям;
4.4) лиц перед поступлением в стационары и специализированные санатории по клиническим и эпидемиологическим показаниям;
4.5) лиц при оформлении на стационарное лечение в больницы (отделения) психоневрологического (психосоматического) профиля, дома престарелых, интернаты для лиц с хроническими психическими заболеваниями и поражениями ЦНС, в другие типы закрытых учреждений с круглосуточным пребыванием;
4.6) больных брюшным тифом и паратифами после исчезновения клинических симптомов перенесенного заболевания перед выпиской из стационара;
4.7) лиц, переболевших брюшным тифом и паратифами, во время диспансерного наблюдения;
4.8) хронических бактерионосителей, выявленных среди работников отдельных профессий, производств и организаций, при повторном поступлении на работу на указанные предприятия и объекты;
4.9) секционного материала при подозрении на заболевание брюшным тифом и паратифами.
5. Материально-техническое обеспечение метода
5.1. Стандартное испытательное и вспомогательное оборудование, средства измерения для микробиологических лабораторий.
5.2. Питательные среды, диагностические сыворотки и химические реагенты для культивирования, выделения, идентификации и определения чувствительности к антибактериальным препаратам возбудителей брюшного тифа и паратифов А, В и С.
5.3. Для лабораторной диагностики тифо-паратифозных заболеваний и выявления бактерионосителей должны использоваться питательные среды и реагенты, разрешенные к применению на территории Российской Федерации в установленном порядке.
6. Лабораторная диагностика брюшного тифа и паратифов
6.1. Принцип бактериологического метода основан на обнаружении живых микроорганизмов в различных биологических субстратах (кровь, моча, кал, желчь, костный мозг, розеолы) в зависимости от стадии заболевания. Для этого производят посев определенного количества биологического материала на специальные питательные среды с последующей инкубацией в термостате и идентификацией выросших колоний микроорганизмов, характерных для S. Typhi, S. Paratyphi A, S. Paratyphi В и S. Paratyphi С, по культурально-ферментативным свойствам и антигенной характеристике.
6.2. Только бактериологическое исследование может обеспечить точную постановку этиологического диагноза и контроль освобождения организма от возбудителя. В отношении дифференциальной диагностики брюшного тифа и паратифов единственным методом является лабораторное исследование биологического материала с выделением возбудителя и идентификация его до уровня серологического варианта, т.к. клиническое течение инфекционного процесса не всегда позволяет различить эти нозологические формы.
7. Бактериологическое исследование
7.1. Выделение возбудителей брюшного тифа и паратифов А, В и С проводят по одной и той же схеме бактериологического исследования биоматериалов.
7.2. Порядок сбора материала для лабораторных исследований на тифо-паратифозные заболевания определен СП 3.1.1.2137-06.
7.3. Техника сбора и транспортирования биоматериалов в микробиологические лаборатории описана в МУ 4.2.2039-05.
7.4. Материалом для бактериологического исследования с целью диагностики брюшного тифа и паратифов являются:
желчь (дуоденальное содержимое).
Возбудители могут быть также выделены из:
Материалом для бактериологического исследования с целью выявления бактерионосителей, согласно СП 3.1.1.2137-06, являются:
желчь (дуоденальное содержимое).
7.5. Исследование секционного материала проводится с целью уточнения диагноза.
7.6. Сбор биологического материала для лабораторных исследований осуществляется до начала этиотропного лечения: медицинским работником, заподозрившим тифо-паратифозную инфекцию; при групповой и вспышечной заболеваемости - специалистами учреждений Роспотребнадзора и персоналом лечебно-профилактических учреждений. От госпитализируемых больных материал для бактериологического исследования забирается в приемном отделении стационара.
7.7. От лиц, общавшихся с больными или носителями (контактными), сбор материала проводится медицинскими работниками ЛПУ и других организаций и учреждений по месту выявления больных.
7.8. Биоматериал для лабораторного исследования сопровождают специальным направлением. Доставка материала самими обследуемыми не допускается. При невозможности своевременной доставки материала используют консерванты и транспортные среды (табл.1).
8. Бактериологическое исследование крови
Показанием к исследованию крови является подозрение на тифо-паратифозные заболевания или лихорадочное состояние невыясненного происхождения (лихорадка неясного генеза), наблюдающееся в течение 5 и более дней (СП 3.1.1.2137-06).
Соотношение кровь - питательная среда должно быть 1:10-1:60. Количество независимо отбираемых проб крови и время их взятия определяется лечащим врачом согласно МУ 4.2.2039-05 при лихорадке неясного генеза или согласно МУ 04-723/3 МЗ СССР (1984) при подозрении на тифо-паратифозные заболевания. У больных, получающих антибактериальные препараты, пробы необходимо собирать непосредственно перед введением (приемом) следующей дозы препарата.
При наличии лихорадки оптимальным является взятие крови на фоне повышения температуры тела (но не на пике температуры!). Посев на питательные среды проводят непосредственно у постели больного.
При подозрении на тифо-паратифозные заболевания для посева крови можно использовать среду Рапопорт, 20%-й желчный бульон, мясопептонный бульон с добавлением 1%-й глюкозы (во флаконах по 100 мл). Ранее использовали посев крови в стерильную дистиллированную (водопроводную) воду. Однако предпочтительнее использовать специальные среды для посева крови.
Количество засеваемой крови в разгар лихорадки может составлять 10 мл, в более поздние сроки - до 20 мл (у детей - до 5 мл).
При лихорадке неясного генеза продолжительностью более 5 дней, как правило, должны исследоваться несколько проб крови. Взятие крови из вены проводят согласно МУ 4.2.2039-05. Это необходимо для дифференциации истинной бактериемии от случайной контаминации крови при венопункции (вероятность загрязнения пробы вследствие случайного прокола сальной или потовой железы составляет 3%). Для посева крови в этом случае используют две среды: 1) среду для аэробов и факультативных анаэробов и 2) среду для облигатных анаэробов (например, "двойная" среда + тиогликолевая среда согласно приказу МЗ СССР от 12.04.85 N 535) или универсальную среду для аэробов и анаэробов.
Предпочтительно использовать промышленно произведенные среды, разрешенные к применению в России.
Посевы инкубируют при 37 °С в течение 10 суток с ежедневным просмотром. При этом флаконы с "двойной" средой наклоняют, омывая плотную часть среды.
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: исходя из особенностей патогенеза брюшного тифа, на 1-й неделе заболевания, в период бактериемии, возбудителей выделяют из крови (получение гемокультуры), со 2-й недели заболевания — из испражнений (получение копрокультуры), мочи или желчи.
Бактериологическое исследование(схема 13.2.1).
Получение гемокультуры. В 1-й день из локтевой вены больного берут 5—10 мл крови и засевают в колбу с 50—100 мл селективной среды Раппопорт, содержащей желчный бульон (для подавления роста других бактерий), глюкозу, индикатор Андреде и поплавок для обнаружения газа. Указанные соотношения крови и среды необходимы для подавления бактерицидного действия белков крови. Посевы инкубируют при 37 "С в течение 18—20 ч. На 2-й день при росте сальмонелл наблюдается помутнение и изменение цвета среды. При росте паратифозных бактерий (биовары paratyphi А, Си schottmuelleri) наряду с указанными изменениями появляются пузырьки газа в поплавке. Для ускорения ответа из среды Раппопорт делают мазки и препараты "висячая" капля. При наличии чистой культуры грамотрицательных подвижных палочек и изменении цвета среды (или наличии газа) дают первый предварительный ответ. Затем культуру из среды Раппопорт пересевают в пробирку со средой Ресселя, полагая при этом, что из крови выделена чистая культура и можно сразу приступить к ее идентификации. Одновременно со среды Раппопорт делают посевы на среду Эндо для получения изолированных колоний с целью проверки чистоты выделенной культуры.
На 3-й день отмечают ферментацию глюкозы на среде Ресселя и ставят ориентировочную реакцию агглютинации на стекле. На основании полученных данных дают второй предварительный ответ. Для дальнейшего исследования отбирают несколько бесцветных колоний со среды Эндо и пересевают их в среду Ресселя или скошенный питательный агар (для контроля полученных результатов). Чистую культуру пересевают на среды "пестрого" ряда и серотипируют в реакции агглютинации на стекле со смесью групповых сывороток, а затем с

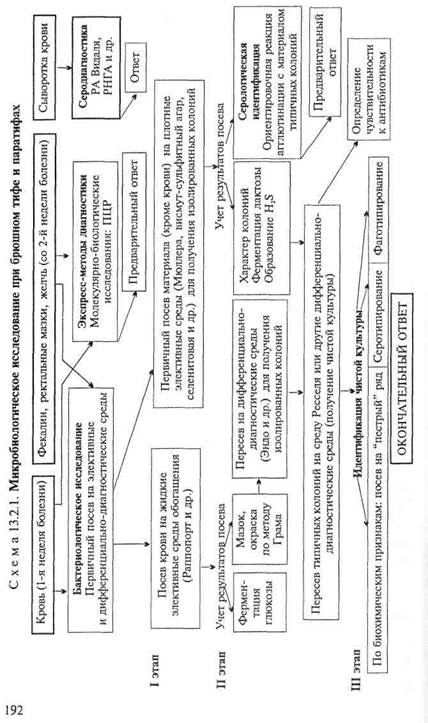 |
адсорбированными монорецепторными О- и Н-сальмонеллез-ными сыворотками. Окончательный диагноз устанавливают на основании биохимических (табл. 13.2.1) и антигенных свойств.
Таблица 13.2.1. Биохимические свойства сальмонелл — возбудителей брюшного тифа и паратифов
| Биовар S.enterica | Ферментация | Образование | |||||
| лактозы | глюкозы | мальтозы | сахарозы | ман-нита | H2S | NH3 | индола |
Typhi - К К - К + -
Paratyphi А - КГ КГ - КГ - -
Schottmuelleri — КГ КГ - КГ + +
Условные обозначения: К — образование кислоты; КГ — образование кислоты и газа; (+) — обнаружение признака; (—) — отсутствие признака.
Биохимические признаки (развернутый "пестрый" ряд) позволяют дифференцировать сальмонеллы от схожих сними энтеробактерий: Citrobacter, Hafnia (табл. 13.2.2).
Таблица 13.2.2. Дифференциация сальмонелл и других энтеробакте рий по биохимическим признакам
| Род | Лизин- декар- бокси- лаза | Ферментация углеводов | р- Галак-този-даза | ||
| дуль-цита | сорбита | ксилозы | рам-нозы | салицина | 4% лактозы |
Salmonella ± К(-) К К К - - -
Citrobacter - К(-) К К К К(±) К(±) К
Hafnia + - - К К К(+) - К
Условные обозначения: (+) — положительная реакция; (—) — отрицательная реакция; ± — вариабельная реакция; К — образование кислоты; К(—) — образование кислоты (редко); К(±) — образование кислоты (вариабельно).
Выделенную чистую культуру бактерий используют для определения чувствительности к антимикробным препаратам.
Фаготипирование. С помощью набора стандартных Vi-фагов определяют до 78 фаготипов S.enterica биовара typhi. При этом необходимым условием является наличие в культуре FZ-антигена. Культуры S.enterica биовара paratyphi В (schottmuelleri) дифференцируются на11 фаготипов и подтипов.
Получение копрокультуры. Испражнения засевают на одну из дифференциально-диагностических сред (Эндо или Левина) или элективные среды обогащения (Мюллера, селени-
товая или висмут-сульфит агар). Для посева петлю фекалий вносят в пробирку с изотоническим раствором хлорида натрия и готовят суспензию. После оседания крупных комочков суспензию петлей наносят на поверхность агаровой среды — на одну половину чашки. Материал тщательно растирают шпателем по одной, а затем по другой половине чашки для получения изолированных колоний. Посевы инкубируют при 37 °С в течение 18—20 ч. На 2-й день изучают характер колоний, выросших на чашках (рис. 13.2.1; на вклейке), пересевают 2—3 бесцветные колонии (со среды Эндо или Левина) или колонии черного цвета (висмут-сульфит агар) на среду Ресселя и в пробирки со скошенным питательным агаром. При отсутствии подозрительных колоний на чашках делают высевы из среды Мюллера или селенитовой среды на чашки со средой Эндо для получения изолированных колоний. Для ускорения ответа ставят ориентировочную реакцию агглютинации на стекле с материалом, взятым из бесцветной колонии. Далее поступают так же, как и при идентификации гемокультуры.

Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования.Молеку-лярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР. В случае обнаружения соответствующих молекул можно поставить предварительный диагноз.
Серодиагностика. Влабораторной практике широко применяют развернутую реакцию агглютинации Видаля, основанную на обнаружении в сыворотке крови людей антител — агглютининов, которые появляются в конце 1-й — начале 2-й недели заболевания. Реакцию ставят одновременно с четырьмя антигенами: О- и Н-брюшнотифозными, А- и В-паратифозными диагностикумами. Брюшнотифозные монодиагностикумы применяют для установления стадии болезни, так как содержание О- и Н-антител в разные ее периоды неодинаково. О-антитела появляются на 1-й неделе, накапливаются в разгар заболевания и исчезают к моменту выздоровления. Н-антитела появляются в разгар заболевания, накапливаются к концу заболевания и сохраняются у переболевших в течение длительного времени. У людей, вакцинированных против брюшного тифа и парати-фов, также наблюдается положительная реакция Видаля, причем в довольно высоком титре, поэтому "инфекционный Ви-даль" удается отличить от "прививочного" только по нарастанию титра агглютининов у больных в процессе заболевания. Реакцию Видаля ставят в четырех рядах пробирок по 7 пробирок в каждом ряду, из которых 5 опытных и 2 контрольные. Для контроля каждого диагностикума в пробирки вносят по 1 мл изотонического раствора хлорида натрия, в который добавляют 2 капли диагностикума. В контрольной пробирке с
1 мл сыворотки (без диагностикума) не должно быть хлопьев. При спонтанной агглютинации реакция не учитывается. Диагностический титр реакции Видаля равен 1:200. Для серологического исследования реконвалесцентов и выявления бактерионосителей широко используют реакцию непрямой И-гемаг-глютинации, с помощью которой в сыворотке крови людей определяют присутствие антител к К/-антигену. В качестве антигена используют эритроцитарный Р?-диагностикум, представляющий собой взвесь эритроцитов человека 1(0) группы, обработанных формалином и сенсибилизированных Fz'-антиге-ном S.enterica биовара typhi. Готовят разведения испытуемой сыворотки от 1:10 до 1:1280. При положительной реакции эритроциты покрывают дно пробирки в виде диска с зазубренными краями, а надосадочная жидкость остается прозрачной. При отрицательной реакции, так же как и в контроле, эритроциты осаждаются на дно пробирки и имеют виддиска с ровными краями ("пуговки"). Диагностическое значение имеет титр пассивной Й-гемагглютинации, начиная с 1:40 и выше. Всех лиц, сыворотка крови у которых дает положительный результат в РНГА с эритроцитарным F/f-диагностикумом, рассматривают как подозрительных на носительство S.enterica биовара typhi и подвергают многократному бактериологическому обследованию.
• Микробиологическая диагностика сальмонеллезов
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: испражнения, при генерализованной форме — кровь.
МЕТОДЫ ДИАГНОСТИКИ: микробиологическая диагностика сальмонеллезов принципиально не отличается от диагностики брюшного тифа и паратифов. Серодиагностика не применяется по причине большого числа сероваров возбудителей.
• Микробиологическая диагностика кишечного иерсиниоза
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: испражнения, при генерализованной форме — кровь, моча, спинномозговая жидкость.
МЕТОДЫДИАГНОСТИКИ:
Бактериологическое исследование.Посев материала на дифференциально-диагностические (среда Эндо, Мак-Конки, СБТС-агар с желчью и бромтимоловым синим) и селективные (CIN-arap с антибиотиками цефсулодином и новобиоцином) плотные среды или жидкие среды обогащения (буферно-казе-иново-дрожжевой бульон, 1 %, пептонная вода с рН 7,6—7,8). Посевы инкубируют при 25 "С в течение 24—48 ч. Идентификация чистой культуры осуществляется на основании морфологии, подвижности, тинкториальных свойств (грамотрица-

тельные палочки с закругленными концами и характерным биполярным окрашиванием, неспорообразующие, перитрихи), культуральных, биохимических признаков.
Экспресс-методы диагностики: иммунохимические, биохимические и молекулярно-биологические исследования.Молеку-лярно-биологические исследования. Исследуемый материал, полученный из очага инфекции, используют для обнаружения ДНК возбудителя с помощью ПЦР.В случае обнаружения соответствующих молекул можно поставить предварительный диагноз.
Серодиагностика.Диагностическое значение имеет обнаружение антител к поверхностным антигенам возбудителей наиболее распространенных серотипов (03, 04, 05, 06, 08, 09) в РА. Положительной считается РА в титре не менее 1:160. Разработаны также ИФА-тесты.
• Микробиологическая диагностика кишечного дисбактериоза
МАТЕРИАЛ ДЛЯ ИССЛЕДОВАНИЯ: фекалии. МЕТОДЫ ДИАГНОСТИКИ:
Бактериоскопическое исследование.Имеет ориентировочное значение. При резко выраженном дисбактериозе в мазках преобладают микроорганизмы определенных видов (например, дрожжеподобные грибы, стафилококки и др.) на фоне существенного уменьшения грамотрицательной микрофлоры.
Бактериологическое исследование.Проводится количественное исследование состава микрофлоры кишечника. Для этого из исследуемого материала готовят разведения Ю -2 , 10 -4 , Ю -6 и т.д. Первичные посевы по 0,1 мл каждого разведения производят параллельно на несколько питательных сред (Эндо, кровяной агар, ЖСА, агар Сабуро и др.) и инкубируют при 37 °С. Подсчитывают число выросших колоний и определяют число КОЕ в 1 г материала. Проводят отсев 2—3 колоний каждого вида для выделения и идентификации чистых культур микроорганизмов.
Дляобнаружения анаэробных Bifidobacterium spp. делают мерные посевы материала в разведениях 10" 7 и выше в пробирки с 13—15 мл модифицированной среды Блаурокка, в состав которой входит печеночный бульон, пептон — 1 %, лактоза — 1 %, хлорид натрия — 0,5 %, цистин — 0,01 %, агар-агар — 0,75%, твин-80 — 0,1 %. При росте Bifidobacterium spp. через 24—48 ч происходит помутнение всей среды с образованием тяжей или отдельных колоний. Готовят мазки и окрашивают по методу Грама. Выделение чистых культур Bifidobacterium spp. является весьма трудоемким и практически необязательным. При необходимости идентификацию представителей рода осуществляют по биохимическим свойствам.
Для оценки результатов бактериологического исследования
сопоставляют полученные данные с количественным содержанием микроорганизмов в норме. Ориентировочные критерии нормальной микрофлоры толстой кишки представлены в табл. 13.2.3.
Таблица 13.2.3. Критерии нормы кишечной флоры
Патогенные микробы сем. Enterobacteriaceae О
Общее количество E.coli, млн/г 300—400
E.coli со слабовыраженными ферментативными
свойствами, % До 10
E.coli с гемолитическими свойствами, % Нет
Энтеробактерии (лактозоотрицательные и лактозополо
жительные): Hafnia, Aerobacter, Citrobacter, Klebsiella,
Serratia, % До 5
Кокковые формы, % До 25
Гемолитический стафилококк по отношению ко
всем кокковым формам, % Нет
Bifidobacterium spp. (рост при посеве разведения) 10 и выше
Бактерии рода Proteus Нет
Грибы рода Candida Нет
При кишечном дисбактериозе происходит значительное снижение облигатной анаэробной микрофлоры, и в первую очередь Bifidobacterium spp., а также увеличение аэробных видов, в частности E.coli, содержание которых может превышать 10 11 микробных клеток в 1 г испражнений. Увеличивается частота обнаружения штаммов E.coli со слабой ферментацией лактозы и имеющих гемолитические свойства (до 30—40 %), гемолитических и негемолитических стафилококков, бактерий рода Proteus, грибов рода Candida (до 15—16 %). У лиц с дис-бактериозами более часто обнаруживают лактозоотрицательные и лактозоположительные энтеробактерии, относящиеся к родам Hafnia, Aerobacter, Citrobacter. Для микроорганизмов, в норме отсутствующих в испражнениях или имеющихся в небольшом количестве, показателем дисбактериоза будет содержание их 10 5 —10 6 и выше КОЕ в 1 г материала (Proteus spp., Klebsiella pneumoniae, Pseudomonas aeruginosa, Staphylococcus aureus, Candida spp.). Для окончательного заключения о кишечном дисбактериозе важное значение имеет повторное его выявление в динамике обследования больного.
• Диагностические, профилактические и лечебные препараты
Читайте также:

