Методы регистрации эндогенной интоксикации
Обновлено: 24.04.2024
2.КЛАССИФИКАЦИЯ ЭНДОГЕННОЙ ИНТОКСИКАЦИИ
2.1. ПРИЧИНЫ И МЕХАНИЗМЫ ЭНДОГЕННОЙ ИНТОКСИКАЦИИ
Эндогенная И может быть вызвана токсическими продуктами, образующимися в организме при различных заболеваниях (аллергических болезнях, ожоговой болезни) и экстремальных состояниях. К эндогенной И. относится отравление продуктами жизнедеятельности бактерий, находящихся в организме. В ряде случаев И. становится ведущим патогенетическим фактором, определяющим развитие клинической картины (уремия, токсикоинфекции, тиреотоксикоз, токсическая дифтерия, токсическая диспепсия и др).
В механизмах как эндогенной, так и экзогенной И. имеется много общего, т. к. в том и другом случае повреждающим фактором является токсический агент. Кроме того, И, вызванная экзогенным фактором, может реализоваться эндогенным путем; например, отравление антихолинэстеразными ядами типа физостигмина или фосфакола в основном сводится к аутоинтоксикации ацетилхолином, который накапливается в синаптических образованиях вследствие прекращения его ферментативного гидролиза.
К числу веществ, накапливающихся в организме при различных заболеваниях и вызывающих эндогенную И., относятся химические соединения различной природы: продукты превращения аминокислот (фенол, крезол, индол, скатол, путресцин, кадаверин), жиров (γ-оксимасляная кислота, ацетоуксусная кислота и ацетон). Имеют значение также активные белки, аденилнуклеотиды, гистамин, серотонин, кинины и другие физиологически активные вещества, выделяющиеся в значительных количествах при повреждении клеток и тканей. При инфекционных заболеваниях происходит накопление бактериальных токсинов и других продуктов жизнедеятельности микробов, а также продуктов распада тканей.
Основной причиной И в условиях трансплантации является реакция трансплантат против хозяина. При возникновении И в различных экстремальных состояниях, например, при ожоговой болезни, травме, патогенетическое значение имеет подавление детоксицирующей способности ретикулоэндотелиальной системы, в связи с чем в организме происходит накопление эндотоксина Е. coli. вызывающего расстройства микроциркуляции. Имеет место также стимулирование неферментативного перекисного окисления липидов клеточных мембран, в результате чего в организме накапливаются токсичные продукты, что вызывает изменение проницаемости этих мембран. При лучевом поражении, кроме того, происходит накопление липидных и хиноноподобных токсинов, повреждающее действие которых на клетки приводит к накоплению в организме гистамина и других физиологически активных продуктов белкового распада. Снижение содержания в тканях естественного ингибитора цепных окислительных реакций токоферола имеет значение для развития И при авитаминозе Е и новообразованиях.
2.2. ИСТОЧНИКИ ЭНДОТОКСИНЕМИИ
- продукты нормального обмена веществ в высоких концентрациях (лактат, пируват, мочевая кислота, мочевина, креатинин, билирубина глюкуронид и др.);
- вещества, избыточно образующиеся при извращенном метаболизме (кетоны, альдегиды, спирты, карбоновые кислоты, аммиак и др.);
- продукты распада клеток и тканей из очагов тканевой деструкции и/или из ЖКТ при нарушении барьерных функций мембран (липазы, лизосомальные ферменты, катионные белки, миоглобин, индол, скатол, фенол и др.);
-компоненты и эффекторы регуляторных систем организма в патологических концентрациях: активированные ферменты (лизосомальные, протеолитические, продукты активации калликреинкининового каскада, системы свертывания крови и фибринолиза);
- медиаторы воспаления, биогенные амины, цитокины, простагландины, лейкотриены, белки острой фазы и другие биологически активные вещества;
- активные соединения, образующиеся при перекисном окислении липидов;
- микробные токсины (экзо- и эндотоксины) и другие факторы патогенности микроорганизмов (патогенных, условно-патогенных, непатогенных);
- иммуночужеродные продукты клеточного распада, антигены и иммунные комплексы-агрессоры.
2.3. ПУТИ ЭЛИМИНАЦИИ ЭНДОГЕННЫХ ТОКСИНОВ
- газообразные вещества – выделяются через легкие;
- гидрофильные низко- и среднемолекулярные вещества – удаляются почками, через кожу, ЖКТ в виде растворов;
- гидрофобные низко- и среднемолекулярные вещества – транспортируются белками и/или клетками крови в печень и легкие, где и биотрансформируются при участии монооксигеназной системы или
претерпевают изменения в реакциях связывания с последующим удалением через почки, кожу, ЖКТ;
- гидрофобные низко- и среднемолекулярные вещества – связываются с белками плазмы крови, приобретают свойства гаптенов и поглощаются клетками иммунной системы;
- высокомолекулярные соединения – транспортируются по лимфатическим сосудам, элиминируются моноцитарно-макрофагальной системой (до 80% макрофагов организма находится в печени).
2.4. СТАДИИ ЭНДОГЕННОЙ ИНТОКСИКАЦИИ
Острый эндотоксикоз протекает как каскадный процесс. Развитие и прогрессирование его связано с несоответствием между образованием (поступлением и т.д.) токсических субстанций, в том числе образующихся в результате последующей токсической аутоагрессии, и способностью органов, входящих в функциональную систему детоксикации (легкие, печень, почки, ЖКТ, кожа, система иммунологического надзора), их трансформировать, нейтрализовать и элиминировать. Существенное значение могут иметь нарушения соотношений между веществами антагонистами в гуморальных регуляторных системах (ферменты-антиферменты, оксиданты-антиоксиданты, цитокины-антицитокины и т.д.).
Исходя из взаимоотношений эндогенной интоксикации и возможностей функциональной системы детоксикации (ФСД) можно выделить 4 стадии развития эндотоксикоза: компенсации, напряжения, субкомпенсации и декомпенсации.
3. ПАТОГЕНЕЗ ЭНДОГЕННОЙ ИНТОКСИКАЦИИ
Механизм И в основном заключается в повреждающем действии эндогенного или экзогенного токсического агента на те или иные клеточные структуры и нарушении метаболических процессов в организме. При некоторых видах И повреждение клеток может иметь характер некроза (напр., при воздействии четыреххлористого углерода на печень), однако, в большинстве случаев происходят обратимые изменения на различных уровнях организма от субклеточного до системного, которые приводят к сдвигам гомеостаза в связи с нарушением метаболизма. Так, в основе мембранотоксического действия афлатоксинов, некоторых бактериальных токсинов, сапонинов лежит нарушение структуры фосфолипидов и образование промежуточных продуктов гидролиза. В механизмах И имеет значение не только непосредственное действие токсических веществ на определенные функции, но и нейрогуморальные и рефлекторные влияния, а также вовлечение в патологический процесс серотонина, кининов и других физиологически активных веществ, выделяющихся в значительных количествах при повреждении клеток и тканей.
В механизмах И имеют значение не только непосредственное действие токсических веществ на определенные функции, но и нейрогуморальные и рефлекторные влияния, а также вовлечение в патологический процесс различных органов и систем. При хронических И некоторыми химическими соединениями, алкилирующими фосфатные группы нуклеиновых кислот (нитрозоэтилмочевина, этилметан-сульфонат и др.), может проявиться их мутагенное действие; при И некоторыми циклическими углеводородами (3,4-бензпирен и др.) – канцерогенное действие.
Развитию И противостоят детоксицирующие системы организма, обеспечивающие химическое превращение токсичных веществ в менее токсичные или растворимые вещества, поддающиеся выведению из организма (окисление, гидролиз, метилирование, восстановление и образование парных соединений и другие процессы). Эти процессы происходят с участием ферментных систем организма, обеспечивающих обезвреживание и метаболические превращения ядовитых веществ. Яды, поступающие в кровь, через воротную вену попадают в печень, являющуюся мощным детоксицирующим барьером, и частично в ней нейтрализуются. И развивается при поступлении в организм токсичных веществ в количестве, превышающем возможности детоксицирующих систем или при их неполноценности.
4. КЛИНИКА ЭНДОГЕНОЙ ИНТОКСИКАЦИИ
5. КЛИНИЧЕСКОЕ ОБСЛЕДОВАНИЕ ПАЦИЕНТОВ С СИНДРОМОМ ЭНДОГЕННОЙ ИНТОКСИКАЦИИ. УРОВНИ ДИАГНОСТИКИ
Диагностика ЭИ разработана главным образом на биохимическом уровне.
В том случае, если состояние не является критическим, для его диагностики целесообразно использовать тот же принцип, что и заложенный в основу распознавания дистресса, т.к., по-видимому, эндогенная интоксикация во многом пересекается с реакцией общего адаптационного синдрома. Мы предлагаем оценивать такие признаки дистресса, главным образом субъективные, которые составляют основу ряда вопросников для диагностики дистресса (табл. 1).
Синдром эндогенной интоксикации. Клиника синдрома эндогенной интоксикации.
В настоящее время одной из наиболее сложных проблем интенсивной терапии является синдром эндогенной интоксикации (СЭИ), сопровождающий значительное количество патологических состояний (шок, перитонит, панкреатит и др.), которые по мере своего развития могут приводить к летальному исходу.
Прогрессирование эндотоксикоза обусловлено накоплением в крови различных по происхождению, химической структуре и биологическому воздействию веществ, именуемых эндотоксинами. Эндотоксины способствуют развитию острой почечно-печеночной недостаточности, сердечно-сосудистой недостаточности, острого респираторного дистресс-синдрома, приводя в конечном итоге к появлению крайне тяжелого состояния - синдрома мультиорганной дисфункции.
Эндогенная интоксикация - клинический синдром, возникающий при различных по этиологии патологических состояниях, обусловленных накоплением в тканях и биологических жидкостях организма продуктов нарушенного обмена веществ, метаболитов, деструктивных клеточных и тканевых структур, разрушенных белковых молекул, pi сопровождающийся функциональными и морфологическими поражениями органов и систем организма.
Выделяют три основных звена, которые определяют тяжесть состояния больных и выраженность клинической симптоматики: токсемия, нарушение микроциркуляции, угнетение функций собственных детоксицирующих и защитных систем организма.
Основным звеном патогенеза синдрома эндогенной интоксикации является токсемия. К сожалению, четкая дифференциация токсических веществ эндогенного происхождения практически невозможна. Однако в каждом конкретном случае можно выделить "первичные" и "вторичные" эндотоксины. Так, при ожогах, синдроме длительного раздавливания, облитерирующих сосудистых заболеваниях "первичными" являются продукты белковой деградации, "вторичными" - продукты естественного метаболизма, накопление которых в организме является следствием угнетения функций естественной детоксикации и экскреции.
Эндотоксемия, нарушая тонус периферических сосудов, реологию крови, кинетические и механические свойства форменных элементов крови, приводит к тканевой гипоксии, которая является одним из важных звеньев патогенеза СЭИ, течение которого усугубляется снижением функции органов естественной детоксикации и экскреции. Токсины блокируют места связывания молекул альбумина, что ведет к снижению эффективности проводимого медикаментозного лечения, поскольку этот белок является транспортным агентом для многих фармакологических препаратов.
Клиника синдрома эндогенной интоксикации.
Сопоставление экспериментальных и клинических исследований позволило выявить следующие стадии развития синдрома эндогенной интоксикации.
I стадия синдрома эндогенной интоксикации. Реактивно-токсическая возникает в ответ на формирование первичного деструктивного очага или травматического повреждения. Лабораторными признаками этой стадии являются повышение в крови уровней молекул средней массы (МСМ), продуктов перекисного окисления липидов (ДК и МДА), возрастание ЛИИ.
II стадия синдрома эндогенной интоксикации - стадия выраженной токсемии развивается после прорыва гастогематического барьера, когда в циркулирующую кровь попадают эндотоксины, образовавшиеся в первичном очаге интоксикации, с последующим распространением и накоплением в организме. В зависимости от состояния организма, его резистентности и исходного уровня детоксицирующих и иммунных систем выделяют компенсированную и декомпенсированную стадии выраженной токсемии.
III стадия синдрома эндогенной интоксикации - мультиорганной дисфункции (СМОД) наблюдается при дальнейшем прогрессировашш патологического процесса как следствие тяжелого повреждения эндотоксинами различных органов и систем с развитием их функциональной декомпенсацш!. Клинически эта стадия Проявляется нарушением сознания, гипоксией, выраженной сердечной Недостаточностью, олигурией, паралитической непроходимостью кишечника. В крови определяется высокая концентрация креатинина, мочевины, билирубина.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Маркеры эндогенной интоксикации. Диагностика эндогеннной интоксикации.
1. Лейкоцитоз (увеличение количества лейкоцитов в венозной крови (более 10-10 /л). При оценке степени выраженности интоксикации лейкоцитоз следует учитывать наряду с другими признаками, свидетельствующими о длительности заболевания, распространенности патоло-ТОческого процесса и его динамики.
2. Лейкоцитарный индекс интоксикации (Кальф-Калиф Я. Я., 1941). Нормальные значения ЛИИ колеблются от 0,3 до 1,5.

3. Ядерный индекс интоксикации (Даштаянц Г. А., 1978). При ЯИИ, равном 0,05-0,08, состояние больного оценивается как удовлетворительное, 0,3-1,0 - средней степени тяжести, более 1,0 -тяжелое.
У больных в стадии токсемии ЛИИ и ЯИИ может снижаться, что свидетельствует о декомпенсации систем кроветворения и детоксикации. В этих случаях значительная часть токсичных продуктов белковой природы и эндотоксинов фиксируется на микросгустках и агрегатах и, выключаясь из общего кровотока, снижает токсичность крови.
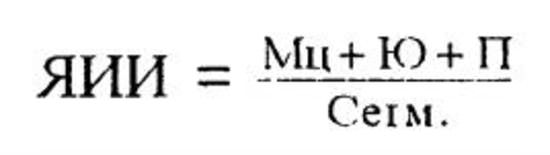
4. Индекс интоксикации (Гринев М. В., 1989). При ИИ, равном 35, прогноз заболевания неблагоприятный, при ИИ выше 45 в 100% случаев - летальный исход.
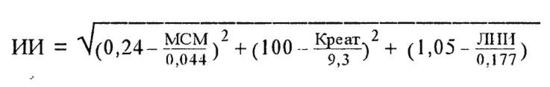
5. Концентрация общего белка в плазме крови.
- снижение уровня общего белка в плазме крови до 45 г/л указывает на тяжелую эндогенную интоксикацию и неблагоприятный исход болезни;
- уменьшение концентрации общего белка за счет альбуминовой фракции отражает использование альбумина как важнейшего фактора плазменной детоксикации, связывания и удаления токсинов;
- увеличение альфа-2-глобулинов в два раза огражает активность процесса с нарушением дезаминирования;
- увеличение гамма-глобулинов указывает на рост продукции грубодисперсных белков;
- снижение альбумино-глобулинового коэффициента (отношение количества альбуминов к количеству глобугашов) обусловливает при выраженной интоксикации переход альбуминов в ткани вследствие нарушенной проницаемости стенок сосудов, снижение интенсивности синтеза альбуминов в почечной ткани, ускорение их распада и превращения в другие белки, частично в глобулины, а также усиление синтеза альфа-2- и гамма-глобулинов. В норме атъбумино-глобулиновый коэффициент колеблется от 1,5 до 2,3.
6. Билирубин. Уровень билирубина более 30 ммоль/л вызывает выраженньш мембранотоксический эффект. Встраиваясь в мембраны и проникая в клетку, билирубин повреждает липиды митохондрий, вызывая их необратимое набухание, ингибирует утилизацию глюкозы, нарушает активность ферментов, ионную клеточную проницаемость. При эндогенной интоксикации билирубин плохо связывается с белками вследствие как гипоальбуминемии, так и вытеснения его из комплекса с альбумином лекарственными препаратами (гормонами, салуретиками).
7. Мочевина и креатинин. Увеличение уровня мочевины более 16 ммоль/л и креатинина более 0,2 ммоль/л указывает на наличие эндогенной интоксикации и сопровождается нарушением нейрогумо-рального контроля ЦНС.
8. Токсическая энзимопатия.
- увеличение уровней АЛТ, ACT, ЛДГ (изоферменты 1, 2, 5) указывает на нарушение проницаемости клеточных мембран;
- гипергликемия, увеличение концентрации лактата и пирувата отражает энергетическую несостоятельность клетки;
- увеличение концентрации молочной кислоты без повышения концентрации пировиноградной кислоты свидетельствует о повреждении ферментативных клеточных процессов;
- увеличение ДНКазы, РНКазы, кислой фосфатазы, катапрессина Д отражает степень деструкции клеток, лизиса внутриклеточных белков, а также энергодефицит клетки.
9. Молочная кислота. Увеличение концентрации молочной кислоты отражает уровень энергодефицита и гипоксии. Концентрация молочной кислоты более 4 ммоль/л расценивается как прогностически неблагоприятный признак.
10. Молекулы средней массы (МСМ) - являются олигопептидами с массой от 500 до 5000 Д, по своей природе относящимися к белковым токсинам с высоким содержанием дикарбоновых и низким - ароматических кислот.
МСМ обладают прямым мембранотоксическим действием и инициируют появление пептидов, близких по структуре к биорегуляторам. Среди них выделяют гепатоцеребральные, уремические, ишеми-ческие, ожоговые МСМ. На 80% МСМ состоят из белков и их метаболитов, в том числе продуктов гидролиза фибриногена и глобулинов, катаболизма глюкокортикоидов. В состав средних молекул входят биологически активные вещества (паратгормон, нейротоксин X, ингибиторы фагоцитоза, гемопоэза, хрупкости мембран эритроцитов, утилизации глюкозы и др.). Этим и определяется токсичность МСМ: нарушение эритропоэза, снижение розеткообразования, ингибирование дыхания митохондрий, нарушение синтеза ДНК в гепатопитах и лимфоцитах. Нейротоксические эффекты МСМ связаны с образованием ложных медиаторов: МСМ, взаимодействуя с инсулином, инактивируют гормон, ингибируя фосфорилирование, нарушают энергетический обмен в клетке.
Увеличение уровня МСМ - один из самых чувствительных признаков эндогенной интоксикации.
11. Коэффициент нейтрофилы/лимфоциты (отношение клеток неспецифической и специфической защиты). В норме коэффициент равен 2,0.
Увеличение коэффициента до 4,0 и более свидетельствует о нарастании тяжелой интоксикации.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

Эндогенная интоксикация представляет собой патологический процесс, сопровождающийся образованием и накоплением в организме веществ, обладающих токсическими свойствами. Это универсальное явление, характерное для всех патологических состояний, сопровождающихся деструкцией тканей, нарушением обмена веществ, снижением функционального состояния физиологических систем дезинтоксикации. Удалось выявить стабильные в норме биохимические показатели, характеризующие метаболический статус по низко- и среднемолекулярным веществам белкового и небелкового происхождения. Субстраты, остающиеся в супернатанте после осаждения высокомолекулярных белков представлены веществами промежуточного, нормального или патологического обмена веществ небелковой природы. В организме существуют системы выведения токсических веществ. В первую очередь к ним относятся почки, которые удаляют из организма практически все растворимые чужеродные продукты, попавшие в кровоток, конечные промежуточные метаболиты, которые в повышенных концентрациях могут оказывать токсическое действие.
В организме существуют системы выведения токсических веществ. В первую очередь, к ним относятся почки, которые удаляют из организма практически все растворимые чужеродные продукты, попавшие в кровоток, конечные и промежуточные метаболиты, в том числе и те, которые в повышенных концентрациях могут оказывать токсическое влияние - мочевина, креатинин, мочевая кислота, аммиак в виде аммонийных солей и др. Поэтому нарушение их функционального состояния зачастую приводит к развитию тяжелой интоксикации. Вещества не только удаляются почками, но и претерпевают биологическую трансформацию на уровне канальцев. Уровень веществ низкой и средней молекулярной массы и олигопептидов является общепринятым маркером эндогенной интоксикации, вероятно, позволяет оценивать тяжесть и прогноз заболевания и является критерием эффективности проводимого лечения.
Суть метода заключается в одновременном определении веществ низкой и средней молекулярной массы в нескольких средах организма: плазме, эритроцитах и моче по методу М.Я.Малаховой (1987 г.). Расчет конечного результата производят путем интегрального измерения площади фигуры, образованной полученными значениями экстинций для каждого типа определения веществ низкой и средней молекулярной массы плазмы, эритроцитов и мочи путем умножения суммы полученных значений экстинций на шаг длины волны:
ВН и СММ пл.= (Е238+Е242+Е246+. +Е306)х4 (усл.ед.) .
ВН и СММ эр.= (Е238+Е242+Е246+. +Е306)х4 (усл.ед.) .
ВН и СММ м.= (Е238+Е242+Е246+. +Е306)х4 (усл.ед.)
Изучение закономерностей развития эндогенной интоксикации при гриппе выявило, что концентрация веществ низкой и средней молекулярной массы была достоверно повышена по отношению к здоровым в периоде разгара заболевания во всех исследуемых жидкостях организма. Уровень веществ низкой и средней молекулярной массы был выше показателей у здоровых людей в плазме в среднем в 1,8 , в эритроцитах в 1,5, а в моче в 1,7 раз. В периоде угасания клинических симптомов эти показатели снижались, но оставались достоверно повышенными по сравнению со здоровыми. В периоде ранней реконвалесценции уровень веществ низкой и средней молекулярной массы в эритроцитах приближался к норме, тогда как в плазме крове и моче оставался достоверно выше, что свидетельствовало о незавершенности патологического процесса в этом периоде. В периоде поздней реконвалесценции происходила нормализация изучаемого показателя в плазме и моче.
Читайте также:

