Микобактериальная инфекция при спиде
Обновлено: 24.04.2024
Инфицирование атипичными микобактериаями. Инфекции атипичных микобактерий.
По данным исследований, проведенных в Москве, Киеве, Ленинграде, Львове, Фрунзе и других городах, атипичные микобактерий составляют в среднем 1,67% среди 17 495 выделенных культур. Неодинакова и частота различных видов атипичных микобактерий. По данным Н. М. Макаревич (1973), среди общего числа ското-хромогенные штаммы высеваются в 55,8% случаев, нефотохромогенные— в 25%, быстро растущие — в 10,8%, фотохромогенные — в 8,3%.
Сравнительно чаще выделяют атипичные микобактерий из пораженных периферических лимфатических узлов у детей. По данным Schroder (1969), они составили 12% среди всех видов микобактерий туберкулеза, обнаруженных при этой форме процесса в 1958—1966 гг. в ФРГ.
Следует, однако, подчеркнуть, что патогенными считаются лишь те атипичные кислотоустойчивые микобактерий, которые повторно высеиваются из мокроты одного и того же больного или из резецированного легкого и другого органа, образуют многочисленные колонии в культурах и вызывают патологические изменения в организме у некоторых лабораторных животных, например у белых мышей.
Уверенность в заражении такими микобактериями возрастает, если больные реагируют на гомологичные сенситины, полученные из того или иного вида типичных микобактерий, более интенсивными внутрикожными реакциями, чем на стандартный туберкулин. Известным подтверждением этиологической роли атипичных микобактерий в генезе болезни служит также обнаружение методом двойной диффузии в агаре специфических антител в сыворотке крови больных (Jenkins, 1959).
Атипичные микобактерии могут проникнуть в организм различными путями: с воздухом, пылью, водой, с плохо обработанными продуктами от животных, при контакте с зараженными домашними животными и птицами. Возможность передачи инфекции от человека человеку не установлена.
Н. М. Макаревич (1973) выделила атипичные микобактерий из мокроты 102 больных, 84 из которых поступили в клинику с диагнозом: туберкулез легких. Однако этиологическая роль этих видов микробов в развитии болезни была подтверждена лишь в 25 случаях; в остальных — они были сопутствующими микобактериями и не влияли на клинику и течение специфического легочного процесса.
Обращает на себя внимание, что большинство больных микобактериозами — мужчины преимущественно среднего и пожилого возраста. Часть из них заняты в профессиях, связанных с уходом за животными и с вдыханием угольной или металлической пыли. У них не отмечается контакта с бацилловыделителями. Заболевание протекает хронически на протяжении многих лет с выраженной наклонностью к фиброзу, развитию эмфиземы и возникновению кровохарканья. Образующиеся каверны в легких часто тонкостенные и не сопровождаются бронхогенпым обсеменением. При всех указанных формах болезни туберкулостатические препараты I ряда оказываются неэффективными из-за устойчивости к ним атипичных штаммов микобактерий. В последнее время установлено известное терапевтическое действие в этих случаях циклосерина, канамицина, этамбутола и рифампицина, к которым атипичные микобактерий оказываются чувствительными.
Совместно с Н. М. Макаревич и Б. Я. Бакаповой мы имели возможность наблюдать больного М., 65 лет, страдавшего микобактериозом, вызванным М. fortuitum.
Микобактериоз — болезнь будущего, утверждают некоторые авторы. Трудно сказать, оправдается ли это предположение. Тем не менее повсеместно накапливающиеся клинико-лабораторные наблюдения побуждают к дальнейшим углубленным исследованиям в этой области и уточнению взаимосвязи туберкулеза и микобактериоза.
Обобщая приведенные данные, следует, таким образом, прийти к выводу, что форма и характер течения туберкулеза в какой-то степени определяются теми или иными биологическими свойствами микобактерий.
Известную роль в клинических проявлениях болезни играют пути заражения. При крайне редко встречающемся внутриутробном инфицировании поражаются главным образом печень, селезенка, брюшина, мезен-териальные лимфатические узлы и в меньшей степени — легкие. Подобное явление отмечается и при заражении большой дозой микобактерий алиментарным путем. На это указывают, например, результаты клинического и секционного исследования детей в Любеке, которым при вакцинации ошибочно была введена культура вирулентных микобактерий человеческого типа. Первичный комплекс среди умерших у 85% находился в брюшной полости и у 15% — в легких. У 104 человек из 174 оставшихся в живых и длительно наблюдавшихся крупные обызвествленные очаги обнаруживались в забрюшинных лимфатических узлах, у 59 — в шейных и лишь у 11 — в легких и во внутригрудных лимфатических узлах.
В Баварии, где еще в 1952 г. был широко распространен туберкулез среди рогатого скота, а население часто пользовалось сырым молоком и непастеризованными молочными продуктами, при обследовании большой группы клинически здоровых школьников у 43% из них были обнаружены обызвествленные забрюшинные и брыжеечные лимфатические узлы. В этих случаях, очевидно, имело место энтеральное заражение микобактериями бычьего типа.
- Вернуться в оглавление раздела "Пульмонология."
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.

1. Корнилова З.Х., Луконина И.В., Алексеева Л.П. Туберкулез в сочетании с ВИЧ-инфекцией // Туб. 2010. №3. С.3-9.
2. Оттен Т.Ф. Микобактериоз у больных с ВИЧ-инфекцией / В кн.: Беляков Н.А., Рахманова А.Г.(ред.). Вирус иммунодефицита человека-медицина. Гл.10.2. СПб.: Балтийский медицинский образовательный центр, 2011. С.199-224.
4. Adjemian J., Prevots D. R., Gallagher J. et al. Lack of adherence to evidence based treatment guidelines for nontuberculous mycobacterial lung disease. Ann. Am. Thorac. Soc. 2014. V. 11, № 1. Р. 9-16.
5. Andréjak C., Nielsen R., Thomsen V. et al. Chronic respiratory disease, inhaled corticosteroids and risk of non-tuberculous mycobacteriosis. Thorax. 2013. V. 68, № 3. Р. 256-262.
6. Brode S.K., Daley C.L., Marras T.K. The epidemiologic relationship between tuberculosis and non-tuberculous mycobacterial disease: a systematic review. Int. J. Tuberc. lung Dis. 2014. V. 18, № 11. Р. 1370-1377.
7. Daley C. L., Griffith D. E. Pulmonary non-tuberculous mycobacterial infections. Int. J. Tuberc. Lung. Dis. 2010. V. 14, № 6. Р. 665-671.
8. Griffith D. E., Aksamit T., Brown-Elliott B. A. et al. An official ATS/ IDSA statement: Diagnosis, treatment, and prevention of nontuberculous mycobacterial diseases. Am. J. Respir. Crit. Care Med. 2007. V. 175, № 4. Р. 367-416.
К клиническим и рентгенологическим критериям для постановки диагноза микобактериоза согласно рекомендациям относятся: имеющиеся респираторные симптомы; обнаружение при рентгенографическом исследовании в легких очаговых или полостных изменений или наличие при компьютерной томографии множественных бронхоэктазов с мелкими очагами, при этом должна быть проведена дифференциальная диагностика в целях исключения других заболеваний, имеющих сходную рентгенологическую картину.
К микробиологическим критериям микобактериоза относятся:
– наличие в двух и более независимо взятых образцах мокроты нетуберкулезных микобактерий;
– не менее одного положительного результата культурального исследования материала, полученного при проведении бронхоскопии (бронхоальвеолярный лаваж [БАЛ] или промывные воды бронхов);
– морфологические изменения в тканях и органах (наличие гранулематозного воспаления или обнаружение кислотоустойчивых бактерий) и наличие роста культуры НТМБ этой ткани или не менее из одного образца БАЛ / промывных вод бронхов или мокроты,
или все вышеперечисленные критерии. В настоящее время этот вопрос является дискуссионным и широко обсуждается.
Цель исследования – изучить особенности клинических проявлений и диагностики микобактериозов у лиц, живущих с ВИЧ-инфекцией.
Результаты исследования и их обсуждение
Клиническое наблюдение 1
Пациентка Ш. (35 лет). Туберкулезом раньше не болела. Наблюдалась в Центре по борьбе со СПИД в течение 10 лет (4В стадия), получала антиретровирусную терапию. В июле 2018 г. перенесла пневмоцистную пневмонию, лечилась в стационаре, выписана с улучшением. В начале ноября состояние вновь ухудшилось, госпитализирована в стационар Центра по борьбе со СПИД. При обследовании на рентгенограмме легких выявлена патология, в мокроте обнаружены кислотоустойчивые микобактерии (КУМ), в связи с чем переведена в противотуберкулезный диспансер (ПТД) для исключения туберкулеза.
При поступлении в ПТД 22.11.2018 жалобы на кашель со слизистой мокротой до 50 мл в сутки, одышку при незначительной физической нагрузке, слабость, повышение температуры тела до 37оС, похудение на 4 кг за последний месяц. Общее состояние средней тяжести, пониженного питания, кожные покровы бледные. Дыхание жесткое с бронхиальным оттенком, гудящие хрипы в нижних отделах легких. ЧДД 24 в минуту. АД 90/55 мм рт. ст. Печень выступает на 7 см из-под подреберья.
Общий анализ крови: гемоглобин – 75 г/л; эритроциты – 2,9х1012/л; цветной показатель – 0,75; лейкоциты – 15,4х109/л; эозинофилы – 1; палочкоядерные – 16; сегментоядерные – 74; лимфоциты – 3; моноциты – 6; СОЭ – 57 мм/ч.
Общий анализ мочи: удельный вес – 1024; белок – 0,3; эритроциты – 1–2; лейкоциты – 5–6; цилиндры – 3–4.
Количество СD4+ лимфоцитов – 42 клетки/мкл.
В мокроте методом люминесцентной микроскопии выявлены кислотоустойчивые микобактерии КУМ (+) от 21.11.2018, 23.11.2018, 27.11.2018.
В мокроте методом ПЦР РВ от 26.11.2010 ДНК МБТ не выявлены; ПЦР Дженэксперт от 23.11.2018 ДНК МБТ не выявлены.
В мокроте посевом (BACTEC) от 23.11.2018, 26.11.2018 НТМБ(+). Иммунохроматографический тест на микобактерии туберкулеза TBAgMRT64 Rapid – отрицательный. Реакция на Диаскинтест отрицательная.
УЗИ органов брюшной полости: УЗ-признаки гепатоспленомегалии, диффузных изменений печени и поджелудочной железы.
Фибробронхоскопия: слева бронхи без особенностей. В просвете среднедолевого бронха (СДБ) справа густая слизисто-гнойная мокрота. По задней стенке СДБ с переходом на латеральную изъязвление, дно которого покрыто густыми массами белого цвета. Вокруг слизистая отечна, гиперемирована. Множество бугорков. За счет этих изменений БС4 сужено почти наполовину. Выше слизистая незначительно отечна. Шпора СДБ острая.
Гистологическое исследование биопсийного материала: в биоптате мелкие кусочки некротического детрита и фрагменты неспецифической грануляционной ткани с диффузной лимфоцитарной и нейтрофильной инфильтрацией, обилие мелких кровеносных сосудов.
При окраске по Цилю–Нильсену КУМ не определяются.
Заключение: морфологическая картина неспецифического воспаления.
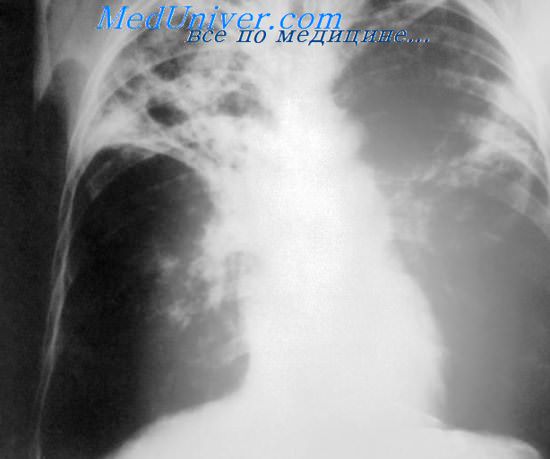
На обзорной рентгенограмме органов грудной клетки в прямой и правой боковой проекции определяются массивное неоднородное инфильтративное затенение в средней доле правого легкого с четкой границей по междолевой борозде, неоднородное инфильтративное затенение в проекции 9-го сегмента левого легкого. Корни расширены. Тень средостения смещена влево (рис. 1, 2).
Рис. 1. Обзорная рентгенограмма органов грудной клетки в прямой проекции больной Ш.

Рис. 2. Обзорная рентгенограмма органов грудной клетки в правой боковой проекции больной Ш.
Мультиспиральная компьютерная томография органов грудной полости: в верхних и средних долях правого легкого массивная инфильтрация, участки консолидации в S8 нижней доли. Множественные полиморфные очаги по всем полям, больше справа. Часть из них с деструкцией. Лимфатические узлы гиперплазированы до 12–14 мм. Сердце обычных размеров, в перикарде жидкость, толщина слоя 12 мм. Дегенеративные изменения позвоночника. Костно-деструктивных изменений не выявлено.
Таким образом, у больной были типичные клинические проявления микобактериоза: кашель, одышка, лихорадка, потеря веса, анемия. Имелись рентгенологические изменения в легких в виде фокусов и очагов и поражение внутригрудных лимфатических узлов. Диагноз верифицирован бактериологическим методом исследования мокроты (рост НТМБ в двух анализах мокроты методом ВАСТЕК).
Клиническое наблюдение 2
Пациентка М., 32 года. Из анамнеза известно, что туберкулезом раньше не болела, наблюдается в Центре по борьбе со СПИД с 2008 г. (4В стадия), получает автиретровирусную терапию (АРВТ). В августе 2018 г. перенесла менингоэнцефалит. Состояние ухудшилось в октябре 2018 г., когда стали беспокоить кашель, общая слабость, плохой аппетит. Была госпитализирована в стационар. В легких при рентгенологическом исследовании выявлена патология. Больной была назначена антибактериальная терапия. При исследовании мокроты получили КУМ(+) методом люминесцентной микроскопии. Для исключения туберкулеза пациентка направлена в противотуберкулезный диспансер.
При поступлении в противотуберкулезный диспансер: состояние относительно удовлетворительное. Кожные покровы чистые, бледные. В легких дыхание аускультативно жесткое, хрипы не выслушиваются. ЧДД – 18 в минуту. Тоны сердца ритмичные ЧСС – 78 ударов в минуту, АД 100/65 мм рт. ст. Язык влажный, с белым налетом. Живот мягкий, безболезненный.
Общий анализ крови от 28.11.2018: гемоглобин – 130 г/л; эритроциты – 3,8х10/л; цветной показатель – 1,0; лейкоциты – 8,5х109/л; эозинофилы – 2%; палочкоядерные – 3%; сегментоядерные – 76%; лимфоциты – 8%; моноциты – 11%; СОЭ – 33 мм/ч.
Общий анализ мочи от 28.11.2018: уд. вес – 1020; белок – 0,19 г/л; лейкоциты – 1–3 в поле зрения.
Количество СD4+ лимфоцитов 101 клетка/мкл от 27.11.2018.
В мокроте КУМ (+) от 28.11.2018, 05.12.2018, 06.12.2018, 14.12.2018, 18.12.2018 методом люминесцентной микроскопии.
В мокроте методом ПЦР-РВ от 04.12.2018, 20.12.2018 ДНК МБТ не выявлены.
ПЦР Дженэксперт от 03.12.2018 ДНК МБТ не выявлены.
В мокроте посевом (BACTEC) от 05.12.2018, 06.12.2018 НТМБ(+). Иммунохроматографический тест на МБТ TBAgMRT64 Rapid – отрицательный.
Реакция на Диаскинтест – отрицательная.
Фибробронхоскопия № 1: слева устье нижнедолевого бронха сужено до почти щелевидного за счет бугристой опухоли с густым налетом некроза белого цвета.
Биопсия № 1: в собственном слое слизистой обилие мелких кровеносных сосудов и диффузная воспалительная инфильтрация лимфоидного и нейтрофильного характера, на фоне которого определяются мелкие нечеткие эпителиоидно-клеточные гранулемы. При окраске по Цилю–Нильсену КУМ не определяются.
Фибробронхоскопия № 2: устье верхнедолевого бронха справа полностью стенозировано бугристой опухолью с густым налетом фибрина белого цвета.
Биопсия № 2: в биоптате – мелкие фрагменты слизистой, местами покрытые многослойным плоским эпителием, местами – слоем некротического детрита. В слизистой – диффузная нейтрофильная и лимфоцитарная инфильтрация, на фоне которой местами определяются нечеткие мелкие эпителиоидно-клеточные гранулемы. В центре некоторых гранулем – скопление ядерного детрита. При окраске по Цилю–Нильсену КУМ не обнаружены.
МСКТ ОГК: в верхней доле S1, S2 справа и нижней доле S6 и базальной пирамиде левого легкого определяются очаговые изменения, деструкция четко не видна. Гиперплазированы бронхопульмональные лимфатические узлы. Средостение структурно не смещено.
В представленном случае клинические проявления микобактериоза (кашель, общая слабость, потеря веса) были мало выраженными. Это можно объяснить количеством СД4+ лимфоцитов (101 кл/мкл). Диагноз микобактериоза поставлен своевременно благодаря бактериоскопическому исследованию мокроты больной, консультации фтизиатра и комплексу обследований в противотуберкулезном диспансере.
1. В настоящее время наблюдается рост заболеваемости микобактериозами у лиц, живущих с ВИЧ-инфекцией. Для своевременного выявления микобактериозов у врачей различных специальностей должна быть настороженность.
2. Диагноз микобактериоза следует устанавливать на основании комплексного клинико-рентгенологического и микробиологического обследования. Главными критериями при постановке данного диагноза должны быть выделение культуры НТМБ и гистологическая верификация.
Частое осложнение СПИДа — диссеминированная инфекция, вызванная Mycobacterium avium-intracellulare (Mycobacterium avium complex). Показано, что эта инфекция значительно снижает продолжительность жизни больных СПИДом, а ее лечение приводит к улучшению состояния и повышает выживаемость. Риск инфекции, вызванной Mycobacterium avium-intracellulare, особенно высок при значительном снижении числа лимфоцитов CD4. Это инфекционное осложнение возникает в течение года примерно у 8% больных, число лимфоцитов CD4 у которых ниже 100 мкл –1 . Если число лимфоцитов CD4 более 100 мкл –1 , диссеминированная инфекция, вызванная этим возбудителем, возникает гораздо реже.
Mycobacterium avium-intracellulare — условно-патогенные микроорганизмы, которые обычно обнаруживаются в почве и воде. Наиболее частый источник заражения — загрязненная вода.
Как правило, диссеминированная диссеминированная инфекция, вызванная Mycobacterium avium-intracellulare (Mycobacterium avium complex) не имеет специфической клинической симптоматики. Большинство пациентов предъявляют жалобы на высокую лихорадку (более 40 °С), выраженную потерю массы тела (более 10% массы тела), диарею, боли в животе. При наличии подобной симптоматики у больного с ВИЧинфекцией с количеством CD4-лимфоцитов менее 100 клеток/мкл необходимо исключить микобактериоз. Возможно развитие очаговых поражений в виде лимфаденитов различной локализации (шейные, паховые, брюшные лимфатические узлы), остеомиелита (позвонков), артритов, поражений кожи. При ультразвуковом исследовании часто регистрируют увеличение размеров печени и селезенки.
Подтвердить диагноз микобактериоза можно на основании выделения Mycobacterium avium-intracellulare при посеве крови, пунктата костного мозга, биопсийного материала. Обнаружение микобактерий в кале, мокроте или бронхоальвеолярном лаваже при отсутствии клинической симптоматики может свидетельствовать только о колонизации слизистых. Терапию в таких случаях назначать нецелесообразно.
Пациентам показано назначение комплексной терапии, включающей макролиды (кларитромицин по 500 мг 2 раза в сутки или азитромицин по 600 мг 1 раз в сутки) в сочетании с этамбутолом (1200 мг/сут) и рифабутином (300 мг/сут). Продолжительность терапии, как правило, составляет не менее 6 мес.
При одновременном использовании АРВТ лечение микобактериоза можно прекратить после повышения количества CD4-лимфоцитов (более 100 клеток/мкл). Доза кларитромицина обычно не превышает 500 мг 2 раза в сутки. Вместо кларитромицина можно назначать азитромицин, который меньше влияет на систему цитохрома P-450. В качестве резервных препаратов применяют: амикацин (15 мг/кг в сутки внутривенно), фторхинолоны (левофлоксацин по 500 мг внутрь 1 раз в сутки, ципрофлоксацин по 500-750 мг внутрь 2 раза в сутки).
Существуют лекарственные взаимодействия кларитромицина и ряда АРВП: AUC (площадь под кривой) кларитромицина повышается при одновременном приеме с индинавиром (на 50%), ритонавиром (на 75%), ампренавиром (на 18%), лопинавиром/ритонавиром (на 77%), атазанавиром (на 94%), невирапином (на 26%) и саквинавиром (на 177%). При совместном приеме атазанавира и кларитромицина последний следует использовать в половинной дозе или назначить другой препарат, поскольку повышение концентрации кларитромицина увеличивает риск удлинения интервала Q-T на кардиограмме.
Одновременный прием кларитромицина и указанных выше АРВП не требует коррекции дозы кларитромицина, за исключением сочетания кларитромицина с лопинавиром/ритонавиром или ритонавиром у больных с почечной недостаточностью. Одновременный прием эфавиренза снижает концентрацию кларитромицина на 39%, поэтому целесообразно заменить его азитромицином.
Больным с ВИЧ-инфекцией при количестве CD4-лимфоцитов менее 50 клеток/мкл можно назначить профилактику микобактериозов макролидами (азитромицин по 1200 мг 1 раз в неделю) или рифабутином (ежедневно по 150 мг). При увеличении числа CD4-лимфоцитов более 100 клеток/мкл можно прекратить первичную профилактику (через 3 мес) и поддерживающую терапию (через 6 мес).
Развитие МАС-инфекции как проявление синдрома восстановления иммунитета
Клиническая симптоматика микобактериоза обычно развивается в течение первых 3 мес после начала АРВТ (в раде случаев синдром восстановления иммунитета наблюдают через 6-8 мес) у больных с исходно низким количеством CD4-лимфоцитов (менее 50 клеток/мкл) и хорошим вирусологическим и иммунологическим ответом на лечение (РНК ВИЧ 100 клеток/мкл). Как правило, клинические проявления МАС-инфекции включают лихорадку, увеличение лимфатических узлов шеи, средостения, брыжейки. Возможно развитие перикардита, остеомиелита, кожных абсцессов, бурситов, поражения ЦНС.
Терапевтическая тактика включает: продолжение АРВТ по прежней схеме, терапию МАС-инфекции, применение нестероидных противовоспалительных средств и в ряде случаев стероидов (преднизолон - по 20-40 мг/сут в течение 4-8 нед).
ВИЧ-инфекция и СПИД [Электронный ресурс] : национальное руководство / под ред. акад. РАМН В.В. Покровского. - М. : ГЭОТАР-Медиа, 2013.
а) Терминология:
1. Аббревиатуры:
• Нетуберкулезные микобактерии (НТМ)
• Нетуберкулезная микобактериальная инфекция (НТМБ)
• Mycobacterium avium complex (MAC)
2. Синонимы:
• Микобактерии, отличные от туберкулеза (MOOT)
• Синдром Леди Уиндермир:
о Изначально описан для нодулярной бронхоэктатической НТМБ
3. Определение:
• Поражение легких, обусловленное НТМ:
о Наименования: экзогенные микобактерии, атипичные микобактерии, MOOT
о Не передаются от человека человеку, изоляция больных не требуется
о Источник инфекции: водопроводная вода и зараженная земля
о Вялотекущее и медленно прогрессирующее заболевание
б) Визуализация:
2. Рентгенография легких при нетуберкулезной микобактериальной инфекции:
• Фиброзно-кавернозная форма:
о Тонкостенная каверна(ы) в верхних долях
о Утолщение апикальной плевры
• Бронхоэктатическая форма:
о Неоднородные затемнения и ретикулярные изменения в средней доле правого легкого/язычковых сегментах левого легкого
о Уменьшение объема/бронхоэктазы средней доли правого легкого/язычковых сегментов левого легкого
• Солитарный очаг/объемное образование (может имитировать рак легкого)
• При иммунодефиците:
о Консолидация, узлы, объемные образования
о Лимфаденопатия средостения/корней легких
4. Сцинтиграфия легких при нетуберкулезной микобактериальной инфекции:
• ПЭТ/КТ:
о Очаги НТМБ обычно накапливают контраст
о Солитарный очаг/объемное образование может имитировать рак легкого морфологически и по накоплению ФДГ
(Слева) На рентгенограмме органов грудной клетки в прямой проекции у мужчины 37 лет со смешанной бронхоэктатической и кавернозной формой нетуберкулезной микобактериальной инфекции определяются распространенные неоднородные и очаговые затемнения в проекции верхних долей обоих легких.
(Справа) На аксиальной КТ с КУ (слева) и аксиальной MIP (справа) у этого же пациента визуализируется полость в нижней доле правого легкого на фоне распространенного правостороннего целлюлярного бронхиолита с наличием центрилобулярных очагов. Бронхоэктатическая и кавернозная форма нетуберкулезной микобактериальной инфекции могут сочетаться. (Слева) На фотографии резецированного легкого у пациента с нетуберкулезной микобактериальной инфекцией в периферических отделах визуализируется полость неправильной формы со стенками светло-коричневого цвета.
(Справа) На микрофотографии с малым увеличением (окраска гематоксилин-эозином) образца тканей, полученного у пациента с нетуберкулезной микобактериальной инфекцией, визуализируются множественные гранулемы с признаками некроза и кавитации, приле жащие к крупному бронху, на фоне гранулематозной бронхопневмонии. (Слева) На рентгенограмме органов грудной клетки в прямой проекции у мужчины 53 лет с эмфиземой и кавитирующей нетуберкулезной микобактериальной инфекцией определяются неоднородные мультифокальные затемнения в правом легком наряду с участком кавитации в верхушечных отделах справа.
(Справа) На аксиальной КТ с КУ у этого же пациента определяются признаки центрилобулярной эмфиземы в верхних долях обоих легких наряду с полостью с толстыми стенками в верхней доле справа. Кавитация обычно возникает на фоне предшествующего поражения легких, эмфиземы, интерстициального заболевания, муковисцидоза и т.д.
в) Дифференциальная диагностика легких нетуберкулезной микобактериальной инфекции:
2. Диффузный аспирационный бронхиолит:
• Может быть неотличим от бронхоэктатической формы НТМБ
• Факторы риска аспирации: ахалазия, обструкция пищевода, бандажирование желудка, гастроэзофагеальный рефлюкс, неврологические нарушения (деменция), и т.д.
4. Рак легкого:
• Может быть морфологически неотличим от НТМБ, проявляясь на КТ и/или ПЭТ/КТ как солитарный очаг или объемное образование
д) Клинические особенности:
2. Демография:
• Эпидемиология:
о Заболеваемость в мире медленно нарастает:
- > по сравнению с ТБ в США и Канаде
- В США с 1994 года по 2006 год наблюдается повышение заболеваемости:
Женщины: 4,5-4,7/100 тысяч человек, мужчины: 3,5-4,9/100 тысяч человек
- В Канаде заболеваемость растет с 1995 по 2003 год; общая заболеваемость: 3,2-4,6/100 тысяч человек
4. Течение и прогноз:
• Прогрессирование на рентгенограммах и КТ у 50% пациентов с легочными инфекциями (MAC) при лечении или без такового
• У пациентов с участками консолидации или кавитацей при первичной КТ заболевание вероятнее прогрессирует и требует лечения
• Антибиотикотерапия применяется при увеличении объема поражения на контрольной КТ
• Прогноз:
о Вариабельный ответ на антибиотикотерапию
о MAC: заболевание, вызванное М. intracellulare, у пациентов с низкой массой тела протекает тяжелее, чаще возникает фиброзно-кавернозная форма, чаще появляются респираторные симптомы, выше уровень положительных анализов мазка мокроты, больше объем поражения на КТ, прогноз хуже по сравнению с М. avium
5. Лечение нетуберкулезной микобактериальной инфекции легких:
• MAC:
о Фиброзно-кавернозная форма: кларитромицин или азитромицин, этамбутол, рифампин, и/или стрептомицин или амикацин
о Бронхоэктатическая форма: кларитромицин или азитроми-цин в сочетании с этамбутолом и рифампином
• Mycobacterium abscessus: плохо поддаются лечению
е) Диагностическая памятка. Следует учесть:
• НТМБ у пожилой женщины с бронхоэктазами в средней доле правого легкого и язычковых сегментах левого легкого и целлюлярным бронхиолитом на диагностических изображениях
ж) Список использованной литературы:
1. Henkle Е et al: Nontuberculous mycobacteria infections in immunosuppressed hosts. Clin Chest Med. 36(1):91-9, 2015
2. Lee G et al: Serial CT findings of nodular bronchiectatic Mycobacterium avium complex pulmonary disease with antibiotic treatment. AJR Am J Roentgenol. 201 (4):764-72, 2013
3. Griffith DE et al: An official ATS/IDSA statement: diagnosis, treatment, and prevention of nontuberculous mycobacterial diseases. Am J Respir Crit Care Med. 2007 Feb 15; 175(4):367-416. Review. Erratum in: Am J Respir Crit Care Med. 175(7):744-5, 2007
4. Martinez S et al: The many faces of pulmonary nontuberculous mycobacterial infection. AJR Am J Roentgenol. 189(1 ):177-86, 2007
Инфекции вызванные микобактериями (Mycobacterium tuberculosis, leprae, avium и т.д.): диагностика, лечение, профилактика
Насыщенная липидами клеточная стенка микобактерии обусловливает их кислотоустойчивость. Существует более пятидесяти видов микобактерии, большинство из которых присутствует в окружающей среде и не представляет опасности для человека.
Эпидемиология и патогенез туберкулеза (Mycobacterium tuberculosis)
Основной путь передачи туберкулёза — воздушно-капельный. Лёгкие являются первым органом, поражаемом при туберкулёзе. В месте проникновения возбудителя формируется воспалительный очаг (первичный комплекс), из которого инфекция может распространиться по всему организму (милиарное распространение). Заболевание может неожиданно разрешиться либо перейти в локализованный процесс (например, менингит).
Устойчивость к туберкулёзу обеспечивает Т-клеточное звено иммунитета. При его нарушении болезнь может рецидивировать (предполагаемый риск составляет 10%). Яркую клиническую картину заболевания чаще обнаруживают у пациентов со сниженным иммунитетом (например, у больных с ВИЧ-инфекцией).
Mycobacterium tuberculosis фагоцитируются макрофагами, но не инактивируются фаголизосомами, а размножаются в цитоплазме клеток. Выраженный иммунный ответ приводит к локальному разрушению тканей (образование полостей в лёгких — каверн) и возникновению симптомов, обусловленных цитокин-индуцированной системной воспалительной реакцией (лихорадка, потеря массы тела).
В качестве факторов вирулентности выступает большое количество антигенов, в том числе липоарабиноманнан (стимулятор цитокинов) и супероксиддисмутаза (обеспечивает выживаемость внутри макрофагов).
Клинические признаки туберкулеза
Возбудитель может поражать любой орган: он имитирует как воспалительные заболевания, так и злокачественные новообразования. Симптомы туберкулёза лёгких — хронический кашель, кровохаркание, лихорадка, потеря массы тела, рецидивирующая бактериальная пневмония. При отсутствии лечения болезнь переходит в хроническую форму, характеризующуюся постепенным ухудшением состояния.
При туберкулёзном менингите отмечают повышение температуры, помутнение сознания, при поражении почек — лихорадку, потерю массы тела, а также признаки локальной инфекции, осложнённой фиброзом мочеточников и гидронефрозом. Прогрессирование туберкулёза костей, обычно поражающего пояснично-крестцовый отдел позвоночника, характеризуется признаками вертебрального коллапса и сдавления нервов.
Кроме того, гной из очага инфекции может проникать под оболочку поясничной мышцы, в результате чего возникает паховый абсцесс. Поражение крупных суставов приводит к артриту и разрушению суставной ткани. При абдоминальной инфекции наблюдают брыжеечную лимфаденопатию, хронический перитонит, а также лихорадку, потерю массы тела, асцит, признаки нарушения всасывания в кишечнике. Диссеминированная (милиарная) инфекция может протекать без симптомов поражения лёгких.
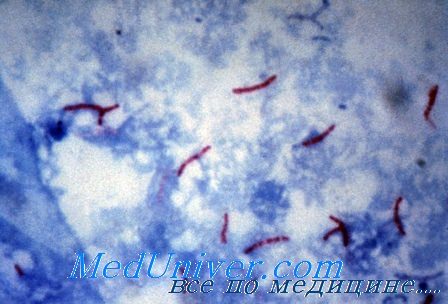
Микобактерии туберкулеза
Лабораторная диагностика туберкулеза (Mycobacterium tuberculosis)
• Культивирование на средах, обогащенных липидами (яичные среды), или с добавлением малахитового зелёного (среда Левенштейна—Йенсена) для подавления роста других бактерий. Препарат окрашивают по методу Циля—Нильсена.
• Определение чувствительности штаммов на скошенной питательной среде Левенштейна—Йенсена.
• Молекулярно-генетические методы (помогает уточнить наличие гена ргоВ, идентифицировать туберкулёзный антигенный комплекс и определить устойчивость к рифампицину).
• Типирование Mycobacterium tuberculosis с помощью анализа полиморфизма длины рестрикционных фрагментов.
• Измерение уровня цитокинов периферической крови, продуцируемых моноцитами (для диагностики остроты процесса).
Лечение и профилактика туберкулеза
Для лечения туберкулёза лёгких применяют этамбутол в комплексе с пиразинамидом (в первые 2 мес) и рифампицин и изониазид (на протяжении 6 мес). При поражении других органов используют такую же схему лечения, основанную на способности лекарственного препарата проникать в различные ткани (например, в спинномозговую жидкость). В последнее время всё чаще выделяют мультирезистентные штаммы возбудителя туберкулёза.
Вероятность их обнаружения зависит от числа случаев неполного излечения, уровня жизни и др. В этом случае для лечения используют препараты второй линии: аминогликозиды, фторхинолоны, этионамид или циклосерин (после обязательного определения чувствительности возбудителя к антибиотикам).
Вакцинация аттенуированными (ослабленными) штаммами (вакцина для профилактики туберкулёза, синоним — вакцина Кальметт—Герена, БЦЖ) позволяет избежать милиарного распространения инфекции, но клинические исследования в некоторых странах не подтвердили её эффективности. Пациентам с высоким риском развития туберкулёза назначают профилактическое лечение рифампицином и изониазидом, а лицам с ВИЧ-инфекцией рекомендован приём рифабутина или кларитромицина в течение длительного времени.
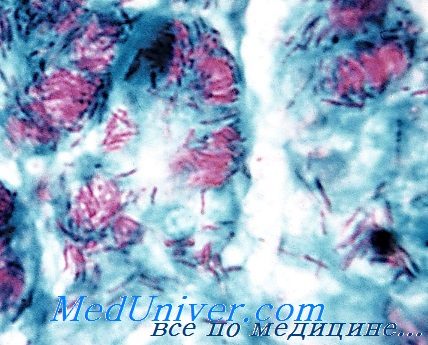
Микобактерии лепры
Инфекция вызванная Mycobacterium leprae - Лепра
Возбудителя лепры (проказы) до настоящего времени не удалось культивировать на искусственных питательных средах.
Mycobacterium leprae вызывает поражение периферических нервов, сопровождаемое нарушением болевой чувствительности. Разрушение и деформация суставов и фаланг пальцев делают пациентов физически недееспособными. Итог заболевания индивидуален и зависит от иммунного ответа. В настоящее время выделяют три типа иммунного ответа при лепре:
• туберкулоидный (превалирует Thl-ответ);
• лепроматозный (преобладает Тh2-ответ);
• пограничный.
При туберкулоидном типе инфекции у пациентов развивается стойкий клеточный иммунитет, возникает большое количество гранулём, трофические поражения нервов. В тканях обнаруживают небольшое количество бактерий. Для лепроматозного типа характерен слабый клеточный иммунитет, отсутствие гранулём и генерализованная инфекция (леонтиаз, депигментация и нарушение чувствительности).
Диагноз основан на результатах микроскопического исследования препаратов поражённой кожи (окраска по Цилю-Нильсену) и биоптатов кожных покровов гистологического исследования. Для лечения применяют рифампицин, дапсон и клофазимин, эффективные на ранних стадиях заболевания, но неспособные препятствовать повреждению нервов и деформации конечностей, при возникновении которых необходимо хирургическое вмешательство.
Микобактерии не вызывающие туберкулез
Различные виды микобактерий могут вызывать локализованные или диссеминированные заболевания у лиц со сниженным иммунитетом. Некоторые из них могут инфицировать имплантируемые ткани.
Mycobacterium avium. В состав комплекса входят Mycobacterium avium, M. intracellular и М. scrofulaceum. Некоторые из них поражают птиц, других животных, являясь санрофитами окружающей среды. Их считают наиболее распространённой причиной микобактериального лимфаденита у детей, остеомиелита у пациентов со сниженным иммунитетом и пневмонии у лиц пожилого возраста. При прогрессирующей ВИЧ-инфекции эти микроорганизмы способны вызывать диссеминированные инфекции и бактериемию.
Возбудители из авиум-внутриклеточного комплекса устойчивы к действию большинства противотуберкулёзных препаратов, поэтому для лечения инфекций, вызванных ими, применяют методы комплексной терапии с использованием рифабутина, кларитромицина и этамбутола. При развитии лимфаденита иногда требуется хирургическое вмешательство.
Mycobacterium kansasi, M. Malmoense, M. Xenopi. Вызывают вялотекущую инфекцию лёгких, похожую на туберкулёз, у пациентов с хроническими заболеваниями лёгких (бронхоэктазией, силикозом, хронической обструктивной болезнью лёгких). Начальную терапию осуществляют с помощью стандартных препаратов после определения чувствительности микроорганизмов к антибиотикам.
Mycobacterium marinum, М. ulcerans. Mycobacterium marinum вызывают хронические гранулематозные инфекции кожи. Возбудитель обитает в реках, запущенных бассейнах и неухоженных садках для рыбы. Заболеванию свойственно возникновение множественных гнойничковых очагов, покрытых твёрдой коркой. Инфекции, вызванные М. ulcerans, распространены в сельскохозяйственных зонах Африки и Австралии. Бактерии обычно поражают нижние конечности, при этом обнаруживают папулёзные очаги, сопровождаемые изъязвлением и глубоким повреждением тканей (включая костную).
Видео диагностика и лечение микобактериоза. Д.м.н., профессор В.Н. Зимина
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

