Микобактериозы органов дыхания презентация
Обновлено: 22.04.2024
3. Туберкулез
4. Туберкулез - таксономия
Подотдел 4: Бактерии с высоким % содержания G+C
Порядок Actinomycetales
Подпорядок Corynebacterineae
Семейство Mycobacteriaceae
Род Mycobacterium
Группа медленно растущих микобактерий
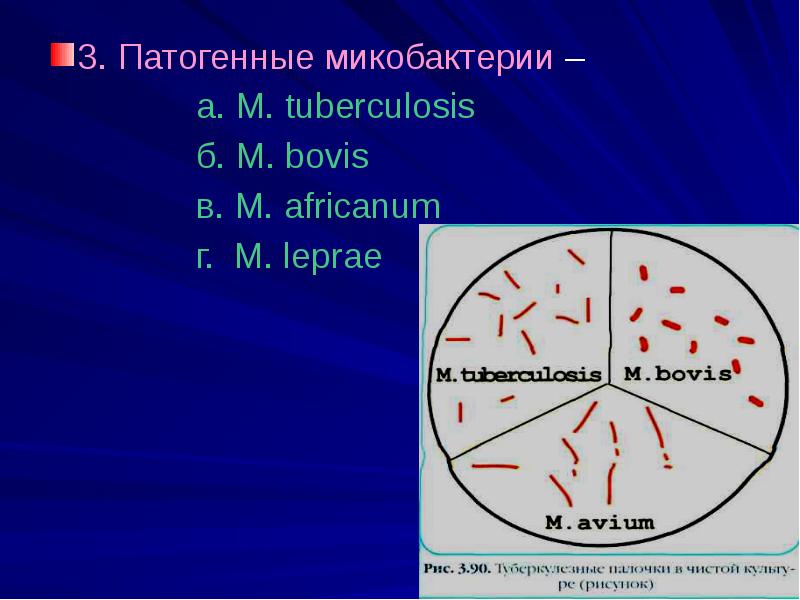
1.M.tuberculesis – основной возбудитель туберкулеза
человека
2.M.bovis – возбудитель туберкулеза КРС, возбудитель
туберкулеза человека
3.M.africanum - возбудитель туберкулеза человека
3.M.leprae – возбудитель лепры
4.M.avium complex (около 20 видов) – возбудители
микобактериозов.
Микобактерии - грам+ прямые или изогнутые бактерии,
способные образовывать нитевидные и мицелиальные
структуры, кокки, L-формы ( выраженный полиморфизм)
По Цилю-Нильсену окрашены в красный цвет.
Аэробный тип метаболизма.
5. M.tuberculesis – основной возбудитель туберкулеза.
6. Микобактерии
7. Туберкулез – строение МБТ
Прокариоты, нет высокоорганизованных органелл.
Форма –слегка изогнутая или прямая палочка.
Неподвижны,не образуют капсул и спор.
Клеточная стенка по своему химическому составу
отличается от Г+, но содержит и обычные
компоненты.
Липидов 40% ( жирные к-ты, воска, сульфолипиды,
миколовые кислоты. –
Комплекспептидогликан-арабиногалактатмиколовая кислота – прочный каркас.
Высокое
содержание
липидов
обеспечивает
устойчивость к кислотам, спиртам, щелочам,
дезинфицирующим средствам, высушиванию и
солнечным лучам, патогенность.
8. Клеточная стенка микобактерий 2-миколовые кислоты3- арабиногалактан 4-пептидогликан,5-ЦПМ,
9. Туберкулез - таксономия
10. Туберкулез – факторы патогенности
Не продуцируют токсины.
Компоненты клеточной стенки.
Полисахариды -15% сухой массы вещества
Липидные фракции клеточной стенки
1.Корд-факторосновной
фактор
патогенности,
токсический гликолипид, эфир трегалозы и миколовой
кислоты ( обусловливает кислотоустойчивость)
Фактор адгезии, колонизации, антифагоцитарный фактор,
препятствует
слиянию
фагосомы
с
лизосомой,
токсическое воздействие на митохондрии.
Располагается
на
поверхности,
способствует
гидрофобности.
Располагается в виде жгутов.
11. Корд-фактор
12. Корд-фактор
13. Туберкулез – факторы патогенности
Воск –Д- пептидогликолипид, содержит
миколовые килоты,антифагоцитарный фактор.
Нарушает проникновение нутритивных
факторов.
Тормозят миграцию лимфоцитов
Сульфолипиды – располагаются в наружном
слое, способствуют выживанию внутри
макрофагов, угнетают выделение
лизосомальных ферментов
Ацетонрастворимые липиды –усиливают
иммуносупрессивные свойства микобактерий,
При участии туберкулина модифицируют
мембраны клеток организма, цитотоксические
клетки разрушают их, принимая за
инфицированные.
14. Туберкулез – факторы патогенности
Белковые компоненты микобактерий.
Туберкулин
–
высвобождается
при
распаде
микобактерий.
Не токсичен для здоровых людей.
Основной антиген, против него направлен иммунный
ответ.
Токсичен для инфицированных и больных, у которых
развилось состояние ГЗТ.
Имеет сходство с антигенами главного комплекса
гистосовместимости, чем больше сходство тем более
восприимчив человек к туберкулезу ( генетическая
предрасположенность к туберкулезной инфекции.
Встраивается
в
липосомы
ацетонрастворимых
липидов,модификация клеточных мембран.
15. Туберкулез – устойчивость во внешней среде
Липиды
придают
гидрофобность
и
устойчивость во внешней среде.
Из
всех
неспорообразующих
наиболее
устойчивы микобактерии.
Устойчивы к высушиванию
При
отсутствии
солнечного
света
жизнеспособность месяцы, при рассеянном
свете 1,5 месяца.
В речной воде 7 месяцев
Устойчивы к дез.растворам.
Под воздействие УФО – 3 минуты.
При кипячении 5 минут
Пастеризация – 30 минут
16. Эпидемиология
17. Предрасположенность
Не всегда развитие хронических форм туберкулеза
связано со снижением функций иммунной системы.
Генетическая предрасположенность к туберкулезу,
связана с особенностями функционирования системы
внутриклеточного клиренса фагоцитов,
с дефектами системы гуморальных факторов
резистентности слизистых оболочек,
с определенными белками, экспрессируемыми генами
главного комплекса гистосовместимости (HLA I и II
классов) Вероятно, определенную роль играют также
половые
гормоны,
так
как
туберкулезом
и
аспергиллезом чаще болеют мужчины (69-75%)
18. Предрасположенность
Одним
из
факторов
генетической
предрасположенности
к
туберкулезу
является
дефект системы поверхностно-активных молекул
(сурфактантов), к которой относят маннозосвязывающий белок (МСБ), белки-сурфактанты A и Д,
коллектины и пентраксины.
Сурфактанты поддерживают стабильность альвеол
и функционирование легких,
обладают прямым
антимикробным действием,
ингибируют рост
бактерий за счет увеличения их проницаемости и
доступности для связи с коллектинами, которые
впоследствии облегчают фагоцитоз бактерий
19. Предрасположенность
Мутации в трех разных генах, связанных с
продукцией и функционированием сурфактантов,
приводят к дефициту этих белков и связаны с
рядом острых и хронических болезней легких
Пентраксины
–
это
суперсемейство
консервативных белков, имеющих циклическую
мультимерную структуру.
Было
показано,
что
животные
с
инактивированным геном, кодирующим длинный
пентраксин Ptx3, являются чувствительными к
инфекции
20. Роль клеток врожденной системы иммунитета в защите от внутриклеточных патогенов
Макрофаги и полиморфноядерные нейтрофилы
(ПМН) могут распознавать, связывать и
интернализовать клетки M. Tuberculosis.
Основным лигандом TLR на поверхности M.
tuberculosis является арабиноманан, который
распознается
TLR2.
Распознавание
консервативных структур патогенов клетками
врожденного
иммунитета
зачастую
осуществляется не непосредственно TLR, а
через образование комплексов с белкамипосредниками ( сурфактантами легких SP-A и
SP-D)
21. Распознавание микобактерий макрофагами и участие в противоинфекционном иммунитете
22. Роль клеток врожденной системы иммунитета в защите от внутриклеточных патогенов
M. Tuberculosis персистируют внутри
эндосом макрофагов.
Формирование
фагосомы
запускает
процесс
созревания
фаголизосомы,
который контролируют Ca2+ и регуляторы
движения
органелл
вокруг
малых
GTP(guanosine
triphosphatases)связывающих
белков
Rabs
и
эффекторных молекул активируемого
каскада, таких как липидные киназы,
молекулы, связанные с органеллами, и
аппарат слияния мембран.
23. Роль клеток врожденной системы иммунитета в защите от внутриклеточных патогенов
Способность Мф убивать внутриклеточные патогены (
M. Tuberculosis) зависит от генетической устойчивости
связана с геном bcg. Ген кодирует макрофагальный
белок, связанный с естественной устойчивостью
макрофагов (Natural resistance-associated macrophage
protein 1, Nramp1) к внутриклеточным патогенам.
Nramp1
является
насосом,
выкачивающим
двухвалентные катионы, такие как Fe2+ и Ni2+, из
эндосом в цитозоль за счет обмена на протоны. Nramp 1
экспрессирован
в
клетках
макрофагальномоноцитарной линии.
Его основная роль связана с устойчивостью фагоцитов
именно к внутрифагосомальным патогенам
25. Эпидемиология
Возможен контактный через поврежденные
кожные покровы и слизистые
При уходе забольными животными.
Заражение хирургов и пат.анатомов.
Трансплацентарный не реализуется,
вследствие тромбоза кровеносных сосудов
плаценты. Возможно при заглатывании
амниотической жидкости.
70% взрослого населения инфицировано, у
10% развивается первичный туберкулез.
Инкубационный период 3-8 недель до 1 года.
26. Патогенез
В развитии заболевания выделяют
Первичный туберкулез, диссеминированный и вторичный
Микобактерии проникают в дыхательный тракт до альвеол,
где фагоцитируются альвеолярными макрофагами,
незавершенный фагоцитоз(за счет корд-фактора)..
В месте массированной гибели зараженных фагоцитов
наблюдается формирование гранулем и казеозного
некротического материала. Формирование гранулем
является способом, выработанным иммунной системой
для ограничения дальнейшей диссеминации патогена.
Туберкулезный специфический воспалительный очаг
(бугорок) формируется на фоне ГЗТ –первичный аффект
27. Патогенез
Воспаление распространяется на лимфатические
пути и региональный лифатический узел –
первичный комплекс:
Грануломатозный
воспалительный
очаг+лимфангоит+лимфаденит.
Гранулема содержит
В центре – творожистый некроз, окружен
эпителиоидными
клетками
и
клетками
Пирогова-Лангханса (гигантские многоядерные
клетки,
трансформированные
макрофаги,
участвуют в ограничении зоны воспаления).
Периферия лимфоидные клетки и нейтрофилы.
28. Гранулема
29. Гигантские клетки
30. Гранулема
31. Патогенез
При заживлении очага творожистые массы
кальцинируются, вокруг образуется капсула
из соединительной ткани, внутри
жизнеспособные бактерии(L –формы).
Заживший очаг – Гона, формируется в
легочной ткани и грудных лимфоузлах.
При снижении резистентности – формы
трансформируются в высоковирулентные
формы, активация процесса, развитие
вторичного туберкулеза (эндогенная
инфекция).
Возможна экзогенная – суперинфекция.
32. Очаг Гона
Первичный
туберкулез
возникает
у
ранее
неинфицированных,
характеризуется
токсикоаллергическими
осложнениями,
некротическими
изменениями в тканях.
Характерна гематогенная диссеминация.
Вторичный – в иммунном организме у ранее
инфицированных людей, процесс локализуется чаще
в одном органе.
Не характерна гематогенная диссеминация.
Противотуберкулезный
иммунитет
нестерильный
инфекционный, длительная персистенция L форм.
Проявляется через 6-8 недель после попадания
микобактерий в макроорганизм.
Основная роль принадлежит клеточным факторам.
34. Туберкулез Первичная инфекция
35. Миллиарный туберкулез
36. Туберкулез - каверна
37. туберкулез
В основе клеточного иммунитета (ГЗТ)
лежит
лежит
эффективное
взаимодействие
макрофагов
и
лимфоцитов Особое значение имеет
контакт макрофагов с Т-хелперами(CD4+)
и Т-супрессорами (CD8+). Макрофаги,
поглотившие
МБТ,
экспрессируют
антигены
микобактерий
(в
виде
пептидов) и выделяют в межклеточное
пространство интерлейкин -1 (ИЛ-1),
который
активирует
Т-лимфоциты
(CD4+).
38. Туберкулез
39. формирование гранулемы
40. Иммунитет
Т-хелперы
(CD4+)
взаимодействуют
с
макрофагами.
Сенсибилизированные Т-лимфоциты (CD4+ и
CD8+)
выделяют
хемотаксины,
гаммаинтерферон,ИЛ-2,
активируют
миграцию
макрофагов в сторону расположения МБТ,
повышают
ферментативную
и
общую
бактерицидную активность макрофагов
Но выработка B-лимфоцитами опсонизирующих
антител, которые обволакивают микобактерии и
способствуют
их
склеиванию,
усиливает
фагоцитоз.
41. Иммунитет
Активированные макрофаги вырабатывают
активные формы кислорода и перекись
водорода( кислородный взрыв), образуется
оксид азота – NO.
Разрушительное
действие
МБТ
на
фаголизосомы
ослабевает,
и
бактерии
разрушаются лизосомальными ферментами.
Выделяемые
макрофагами
медиаторы
активируют
также
B-лимфоциты,
ответственные за синтез иммуноглобулинов,
однако их накопление в крови на устойчивость
организма к МБТ не влияет.
Выраженный клеточный ответ формируется
через 8 недель.
43. Профилактика
БЦЖ — Бацилла Кальмета—Герена (Bacillus
Calmette—Guérin) —вакцина против,
туберкулеза, приготовленная из штамма
Mycobacterium bovis.
В 1928 г. вакцина была принята Лигой Наций.
С 2006 года некоторые страны прекратили
массовую вакцинацию
В США вакцинируют только мигрантов.
В РФ 3-7 день ,7лет,14 лет.
44. лечение
рифабутин или рифампицин
стрептомицин или канамицин
изониазид или фтивазид
пиразинамид либо этионамид
45. Диагностика –прямая микроскопия
46. Мезентериальные лифоузлы
47. Микроскопия люминесцентная основана на способности липидов микобактерий поглощать люминесцентные красители и светиться в люминесцентно
Микроскопия
люминесцентная
основана на способности липидов микобактерий
поглощать
люминесцентные
красители
и
светиться в люминесцентном микроскопе
49. Диагностика туберкулеза
50. Диагностика –кожно-аллергическая проба Манту
52. Микобактериозы-сходные с туберкулезом заболевания, вызванные условно-патогенными микобактериями.
Микобактериозы-сходные с туберкулезом
заболевания, вызванные условнопатогенными микобактериями.
1.Медленнорастущие
фотохромогенные(M.marinum) – пигмент на свету
–бассейновая
гранулема,
инфекция
распространяется вдоль лимфатических сосудов,
у больных с иммунодефицитами-изъязвления.
53. Микобактериозы
2.Медленнорастущие скотохромогенные – в
темноте желтые пигменты (М.scrofulaceum)Основная причина лимфаденитов у детей.
Могут поражать кости и мягкие ткани.
3.-медленно
растущие
нехромогенные
микобактерии (М. avium complex).
Описаны поражения кожных покровов,
мышечной ткани, костного скелета.
4.Быстрорастущие
как
ското,
так
и
фотохромогенные микобактерии( M.fortuitum).
What is NTM?
Нетуберкулёзный микобактериоз –
инфекционное заболевание.
Нетуберкулёзная микобактерия подобна
микобактерии туберкулёза.
NTM распространяется через
окружающую среду, но не от человека к
человеку.
Лечению поддаётся редко ~ 50%.
Причины развития
микобактериоза
Новые методы диагностики;
Иммунодефицит;
Иммуносупрессивные состояния;
заболеваемости ВИЧ-инфекцией.
Поражение при
микобактериозах
НТМ могут вызывать:
Болезни легких, из-за
чего клиника часто
напоминает
туберкулез;
Лимфаденит;
Заболевания кожи;
Диссеминированные
заболевания.
Верификация диагноза проводится только при выделении и идентификации
возбудителя.
Предполагаемый
микобактериоз легких –
сильно поражены
инфильтратом макрофагов
(стрелки).
Предполагаемый
микобактериоз
двенадцатиперстной
кишки - многочисленные
внутриклеточные, тонкие,
палочковидные,
кислотоустойчивые
бактерии в цитоплазме
макрофагов (стрелки).
Цветная просвечивающая электронная
микрофотография (ПЭМ) инфекции
Mycobacterium avium complex (MAC)
(легкое человека).
Роль в ВИЧ-инфекции
Говоря о
нетуберкулезном
микобактериозе у
больных
ВИЧ‐инфекцией при
иммунодефиците,
обычно подразумевают
заболевание,
вызванное
Mycobacterium
avium‐intracellulare
(МАС).
Развивается в период относительной компенсации Т‐клеточного
иммунитета или у длительно получающих АРВТ.
Роль в муковисцидозе
Причина – дефект гена, отвечающего за транспорт ионов Na и Cl
через клеточную мембрану
Роль в муковисцидозе
Характеризуется поражением
органов внешней секреции,
нарушением функций ДС и ЖКТ.
Роль в муковисцидозе
• В США 7-13%
пациентов;
• В Израиле 23%
в 2008 году;
• Напротив, в
Европе
намного ниже
2-7%.
1. кафедра микробиологии и вирусологии РНИМУ им.Н.И.Пирогова
2. Tuberculosis
• Это хроническая бактериальная инфекция
с образованием гранулем в пораженных
тканях и
выраженной реакцией клеточного
иммунитета
с участием цитотоксических Т-лимфоцитов
(гиперчувствительность замедленного действия, ГЗТ)
• Название происходит от лат. tuberculum —
бугорок
3. Туберкулез
4. Исторический очерк
5. Исторический очерк
6. Исторический очерк
Известно, что жизнь многих известных
людей того времени трагически
закончилась в связи с туберкулезом композитор Фредерик Шопен, писатель и
путешественник Р.Л.Стивенсон, создатель
одной из теорий иммунитета Пауль Эрлих
Однако и в наши дни туберкулез – это
значительная проблема здравоохранения
7. Эпидемиология
ежегодно заболевают 9 млн., у 3
млн. -туберкулез с летальным исходом
• В РФ – смертность составляет 18/ 100 000 жителей ,
летальный исход ежегодно - 25 000 человек
По данным ВОЗ -
Основной источник инфекции – больной
туберкулезом. Животные – играют
второстепенную роль (природный резервуар
M.bovis ). Основной путь заражения - аэрогенный
(слизистая полости рта, миндалины,бронхи)
Возможен контактный путь заражения – через
поврежденную кожу и слизистые оболочки
(хирурги, анатомы)
Довольно редко – заражение пищевым путем
(термически необработанные молочные
продукты), заболевание чаще поражает детей
8. Этиология
• Отдел Firmicutes
• Сем. Mycobacteriaceae
• Род
Mycobacterium
Патогенные для человека возбудители
туберкулеза
– Мусоbacterium tuberculosis,
M. bovis, M.africanum, M.leprae
Условно-патогенные(атипичные) микобактерии
M. kansasii
M. intracellulare
M. scrofuloceum
9. Микобактерии – возбудители туберкулеза легких
• Неподвижные, тонкие прямые или
несколько изогнутые палочки
• Клеточная стенка представлена большим
количеством липидов (40%)
Высокое содержание липидов
обеспечивает устойчивость к кислотам,
спиртам, щелочам, дезинфицирующим
средствам
• Это факультативные внутриклеточные
паразиты
10. Основные биологические свойства кислотоустойчивость и медленный рост
11. Структура микобактерий
12. Структура микобактерий
• Клеточная стенка: миколиновые кислоты,
ковалентно связанные с арабино галактаном, выявлены также белки-порины
Основная группа липидов - на поверхности
клетки:
• Липоарабиноманнан,LAM, липоманнан,LM
• Сульфатид, SL
• Димиколат трегалозы (корд-фактор) – отмечено, что
палочки растут в виде извитых шнуров
13. Строение клеточной стенки M.tuberculosis миколовая к-та(2),арабиногалактан (3), пептидогликан (4), цитоплазматическая мембрана
14. Факторы патогенности
• Липидные фракции клеточной стенки
• Корд-фактор (димиколат трегалозы) –
фактор адгезии и колонизации, антифагоцитарный фактор
• Воск Д – пептидогликолипид, содержит
миколовые кислоты, антифагоцитарный
фактор
• Сульфолипиды (способствуют выживанию внутри
клеток)
• Белковый фактор –Туберкулин – антиген,
против которого направлен иммунный ответ
(высвобождается при распаде микобактерий)
15. Роль корд-фактора и миколиновых кислот в патогенезе туберкулеза
• Подавляют слияние фаго- и лизосомы,
• Усиливают секрецию макрофагами
провоспалительных цитокинов (IL-1, TNFα),
• Служат адъювантами, усиливая и ускоряя
процессы активации и дифференцировки
клонов цитотоксическихТ-клеток
16. Диагностические методы прямая микроскопия
17. Диагностические методы
• Используют метод
флотации,
готовят мазки и
окрашивают их по
методу ЦиляНильсена
• На голубом фоне
мокроты видны
рубиново-красные
кислотоустойчивые
микобактерии
18. Люминисцентная микроскопия
• Основана на свойствах липидов микобактерий
поглощать люминисцентные красители и создавать
свечение в люминисцентном микроскопе
• Мазки окрашивают
(ауромин+родамин)
• Туберкулезные
микобактерии дают
желто-зеленое
свечение,
нетуберкулезные
– зеленое
19. Метод микрокультивирования (метод Прайса)
• Готовят мазки и помещают стекла в цитратную
кровь (жидкая питательная среда)
• Через 3-5 дней проводят анализ окрашенных
мазков
• Вирулентные палочки туберкулеза обнаруживают
по присутствию корд-фактора в виде изогнутых
жгутов,
• невирулентные микобактерии - по рыхлым
скоплениям бактериальных клеток
20. Микобактерии туберкулеза корд-фактор
21. M.tuberculosis (культивирование на среде Левенштейна-Йенсена)
22. Колонии M.tuberculosis
23. Идентификация возбудителя
24. Микобактерии туберкулеза Электронограмма
25. Метаболизм микобактерий
• Скорость роста микобактерий: способны
делиться каждые 18ч (E.coli -20 мин).
• Полагают – замедленный рост связан с
биосинтезом нуклеиновых кислот
• При изучении метаболизма определили 2
пути проницаемости для препаратов
26. Микобактерии пути проницаемость препаратов
I. Большой диаметр водного поринового
канала – путь для таких препаратов как
прониазид, пиразинамид, циклосерин,
ПАСК
2. Диффузия липофильных веществ
гидрофильные тетрациклины,
фторхинолоны
–
27. Образование гранулем
28. В составе гранулемы – ядро и периферия
• Ядро – макрофаги, многоядерные
гигантские клетки (от слияния
активированных макрофагов),
эпителиальные клетки
• Периферия – скопление Т-лимфоцитов
• Композиция гранулемы включает также
нейтрофилы, дендритные клетки,
компоненты внеклеточного матрикса,
такие как коллаген
30. Патогенез
• Центр гранулемы подвергается казеозному
некрозу. В процесс вовлекаются молекулы
адгезии, хемокины и цитокины (медиаторы
иммунного ответа).
Цитотоксические Т-лимфоциты (ЦТЛ CD8+)
способны осуществлять киллинг инфицированных
макрофагов, которые становятся мишенями для
ЦТЛ, если не отвечают на активацию и не способны
к деструкции бактерий, а также
ЦТЛ секретируют IFN обеспечивая путь для
дополнительной активации макрофагов и развития
защитного иммунитета
31. Распознавание микобактерий через TLR-2 рецепторы макрофагов
32. Туберкулиновые пробы
• Белок туберкулин, впервые выделенный после
культивирования в глицериновой питательной
среде,
был способен вызывать характерные реакции
через 24-48ч после внутрикожного введения
инфицированным пациентам
• В качестве Международного стандарта выбран PPD –
очищенный препарат, который широко применяется
в настоящее время.
33. Реакция гиперчувствительности замедленного типа (ГЗТ)
• При ГЗТ предварительно сенсибилизированные
антигенами Т-клетки, концентрируются в месте
введения туберкулина. Отрицательная проба
указывает на отсутствие предшествующей
инфекции
• В основе реакции ГЗТ лежат клональная экспансия
цитотоксических лимфоцитов (ЦТЛ) и высокая
активность цитокинов
• При нарушении процесса иммунорегуляции
реакция ГЗТ утрачивает функцию защиты и
участвует в повреждении ткани
34. Внутрикожная проба с туберкулином (PPD)
35. проба Манту
• Это кожно-аллергическая проба
• Положительная проба: папула d= 5мм и
более
• Отрицательная проба: уколочная реакция
(0-1мм) - указание на отсутствие
предшествующей инфекции
36. Первичный туберкулез
37. Первичный туберкулез
• Если инфекция проявляется только в
кожной пробе, то профилактикаизониазидом (чтобы предотвратить
резистентность – рифампицин,
офлоксацин, этинамид), при ограниченной
инфекции – конверсия туберкулиновой
пробы к 6-й нед.
• При прогрессировании или реактивации
инфекции возможны лихорадка, кашель
(кровь в мокроте), поражение бронхов,
одышка, гипоксия. Изониазид, этамбутол
рифампицин, пиразинамид, амикацин
39. Первичная инфекция M.tuberculosis
40. Патогенез
• Первичный туберкулез
характеризуется формированием
воспалительного очага на фоне развития
ГЗТ
• При кальцинировании области поражения
остается очаг Гона (формируется в ткани
легких и регионарных лимфатических
узлах
• Вторичный туберкулез
• может развиться спустя годы у лиц зрелого и
пожилого возраста
41. Вторичный туберкулез
• Симптомы вторичного туберкулеза могут
развиваться как после первичного
заболевания, так и при реинфекции
экзогенными микобактериями
• В большинстве случаев процесс
локализуется в верхушке легких (высокий
уровень оксигенации способствует
усилению роста аэробных палочек)
42. Механизмы патогенеза
• Казеозный некроз и фиброз
рассматривают как результат действия
цитокинов
• Микобактерии поглощаются
альвеолярными макрофагами, которые
активируются и продуцируют IL-I, IL-8. TNF
• Некроз ткани может быть связан с
выходом TNFα в кровь
43. Туберкулез легких
44. Профилактика
Вакцина - БЦЖ — Бацилла Кальметта—
Герена (Bacille Calmette—Guérin, BCG) —
приготовлена из Mycobacterium bovis
непатогенного штамма
С 2006 года некоторые страны прекратили
массовую вакцинацию
В России вакцинируют на 3-7 день жизни
ребенка, в 7 и 14 лет.
45. Лечение
• M.marinum – хромотохромогенные
медленнорастущие микобактерии (пигмент
появляется на свету), с образованием
гранулемы. Инфекция распространяется
вдоль лимфатических
сосудов, заражение
(бассейн) приводит к
изъязвлениям при
иммунодефицитных
состояниях
47. Микобактериозы
M. scrofulaceum
микобактерии
(в
пигменты)
- медленнорастущие
темноте
желтые
Основная причина лимфаденитов
поражаться кости и мягкие ткани.
у
детей.
Могут
M. avium complex - медленнорастущие
нехромогенные микобактерии
Описаны поражения кожных покровов, мышечной
ткани, костного скелета.
M.fortuitum-быстрорастущие микобактерии
48. Микобактериозы
49. Лепра
Mycobacterium leprae – это патогенные
микобактерии, возбудители лепры
(проказа, болезнь Hansen)
Заболевание имеет две формы –
туберкулоидную и лепроматозную
Туберкулоидная форма заболевания
может рассматриваться как
самокупирующийся процесс
• Лепроматозная форма известна как
злокачественная форма






































Микобактерии – это грамположительные кислото-, спирто- и щелочеустойчивые бактерии, относятся к семейству Micobacteriaceae, роду Micobacterium Характерно: Высокое содержание липидов и восков (до 60%) Каротиноидные пигменты Каталазаположительные Резистентны к действию лизоцима Медленный рост
Среди микобактерий по биологическим свойствам и патогенности для человека выделяют 3 группы: 1. Микобактерии сапрофиты – обитают в почве, воде и на слизистых оболочках человека и животных
2. Условно-патогенные микобактерии– вызывают микобактериозы Классификация нетуберкулезных микобактерий по Runyon Группа I. Фотохромогенные - М. Kansasii, М. Intermedium, М. Asiaticum, И. Simae, М. marinum Группа II.Скотохромогенные - М. Szulgai, М. Scrofulaceum, М. Xenopi, М. lentiflavum, М. interjectum Группа III.Нехромогенные (непигментированные) медленно растущие - М. avium-intracellulare, M. malmoense, М. shimoidei М. Genavense, M. celatum Группа IV. Быстрорастущие. -М. Fortuitum, М. chelonae
Micobacterium bovis имеют большинство признаков, аналогичных M. tuberculosis. Micobacterium bovis имеют большинство признаков, аналогичных M. tuberculosis. Отличительными признаками являются: по морфологии – палочки более короткие и толстые. культуральные св-ва: микробы еще медленнее растут на питательных средах. На жидких средах образуют тонкую, влажную пленку на поверхности. На плотных средах на 21-60 день образуют мягкие, ша-ровидные, влажные, прозрачные серовато-белого цвета колонии в S-форме. Глицерин не стимулирует их рост. Ускорение роста наблюдается при снижении концентрации кислорода и наличии пирувата в среде. Являются факультативными анаэробами.
Обладают иной биохимической активностью: дают отрицательные пробы на ниацин, никатинамидазу, восстановление нитратов в нитриты. Обладают иной биохимической активностью: дают отрицательные пробы на ниацин, никатинамидазу, восстановление нитратов в нитриты. Патогенны для морских свинок и кроликов. У кроликов при внутривенном заражении через 1-2 мес. развивается генерализованная инфекция, заканчивающаяся их гибелью. Устойчивы к действию многих противотуберкулезных препаратов. У человека чаще вызывают внелегочные формы туберкулеза – поражаются костно-суставная, мочеполовая системы, лимфатические узлы. Нередко “бычий туберкулез” протекает скрытно, тяжело, лечение его затруднено.
4. Свободные сульфатиды (сульфолипиды) – это трегалоза, эстерифицированная сульфатной группой и четырьмя миколовыми кислотами. 4. Свободные сульфатиды (сульфолипиды) – это трегалоза, эстерифицированная сульфатной группой и четырьмя миколовыми кислотами. 5. Микозиды – это гликолипиды, образующие своеобразную микрокапсулу. Они похожи на ЛПС Гр “-” бактерий, токсичны и вызывают образование гранулем. 6. Липоарабиноманнан, начинается от ЦПМ, пронизывает клеточную стенку и выходит на ее поверхность (рецептор). В состав входят разветвленные полимеры арабинозы и маннозы, связанные с производными пальмитиновой и туберкулостеариновой кислот.
Считают, что “туберкулез – это болезнь макрофагов”. M. tuberculosis, проникая в организм человека, прежде всего поражают макрофаги. Липиды и липидосодержащие структуры M. tuberculosis оказывают прямое действие на макрофаги, способствуют развитию тубер-кулезного очага – гранулемы.
1. Микозиды и липоарабиноманнан – определяют прикрепление микроорганизма к клеточным рецепторам макрофагов и инициируют “неагрессивный фагоцитоз” M. tuberculosis без активации “дыхательного взрыва”, т. е. без образования активных форм кислорода и азота. 1. Микозиды и липоарабиноманнан – определяют прикрепление микроорганизма к клеточным рецепторам макрофагов и инициируют “неагрессивный фагоцитоз” M. tuberculosis без активации “дыхательного взрыва”, т. е. без образования активных форм кислорода и азота. 2. Сульфатиды и “корд - фактор” токсичны и поражают мембраны митохондрий , препятствуют дыхательному взрыву, ингибируют фагосомно-лизосомное слияние, разрушают мембраны фаголизосом. За счет них микроорганизмы находятся в цитоплазме, а не в фаголизосоме, что дает возможность размножаться в цитоплазме. Сульфатиды также за счет отрицательного заряда нейтрализуют катионные белки макрофагов.
3. Воск Д вместе с “корд - фактором” обладают токсичностью, активируют макрофаги с выделением из них провоспалительных цитокинов (в частности, ФНО вызывает кахексию = истощение за счет активации липаз), тормозят миграцию в очаг полиморфноядерных фагоцитов. Участвуют в образовании туберкулезных гранулем. 3. Воск Д вместе с “корд - фактором” обладают токсичностью, активируют макрофаги с выделением из них провоспалительных цитокинов (в частности, ФНО вызывает кахексию = истощение за счет активации липаз), тормозят миграцию в очаг полиморфноядерных фагоцитов. Участвуют в образовании туберкулезных гранулем. 4. Фтионовые кислоты (фосфатидная фракция липидов) вызывают формирование гранулем за счет усиления миграции к очагу макрофагов. Фтионовые кислоты + Воск Д+ туберкулопротеины вызывают сенсибилизацию организма, развивается ГЗТ.
5. Миколовые кислоты отвечают за : - токсичность - вирулентность (вместе с “корд - фактором”) - развитие ГЗТ (в комплексе с белком - туберкулопротеином) - кислотоустойчивость M. tuberculosis, спирто-, щелочеустойчивость. 6. Туберкулостеариновые кислоты обусловливают процессы казеозного (творожистого) некроза в очаге.
7. M. tuberculosis синтезируют аммоний, который защелачивает среду в макрофагах, в результате блокируется активность лизосомальных ферментов. 7. M. tuberculosis синтезируют аммоний, который защелачивает среду в макрофагах, в результате блокируется активность лизосомальных ферментов. 8. Каталаза и пероксидаза инактивируют активные формы кислорода в макрофагах, что способствует сохранению и размножению микробов в этих клетках. Данные ферменты обусловливают чувствительность микробов к препаратам группы гидрозидов изоникотиновой кислоты –изониазиду.
Исход заболевания определяется активностью Т-хелперов, которые активируют фагоцитарную активность макрофагов и активность Т-киллеров. Исход заболевания определяется активностью Т-хелперов, которые активируют фагоцитарную активность макрофагов и активность Т-киллеров. При массивном хроническом инфицировании, способствующем интенсивному размножению микобактерий и гибели фагоцитирующих клеток, происходит активация клеток с супрессорной активностью, что ведет к развитию вторичного иммунодефицита и иммунологической толерантности.
Если терапевтическое воздействие на два первых вида популяции не вызывает особых затруднений и лечебный стерилизующий эффект достигается быстро и легко, то для подавления медленно размножающейся персистирующей внутриклеточной популяции необходимо длительное воздействие препаратов, обладающих способностью хорошо проникать внутриклеточно и оказывать бактерицидное действие. Если терапевтическое воздействие на два первых вида популяции не вызывает особых затруднений и лечебный стерилизующий эффект достигается быстро и легко, то для подавления медленно размножающейся персистирующей внутриклеточной популяции необходимо длительное воздействие препаратов, обладающих способностью хорошо проникать внутриклеточно и оказывать бактерицидное действие.
Микроорганизмы - возбудители антропозоонозных инфекций Антропозоонозы – это инфекционные заболевания человека, при которых источником возбудителя являются животные (больные или носители)
Выделяют две группы заболеваний: 1. Передаваемые от домашних животных и др. синантропных животных: - бактериальные инфекции - сальмонеллез, бруцеллез, туберкулез, столбняк, сибирская язва, лептоспирозы - вирусные – ящур - грибковые – аспергиллез, трихофития, микроспория - протозойные – балантидиаз, токсоплазмоз 2. Передаваемые от диких животных - природно-очаговые: - бактериальные – листериоз, чума, туляремия, лептоспироз, спирохетозы, риккетсиозы - вирусные – геморрагические лихорадки, вирусные энцефалиты. - протозойные – лейшманиоз.
Отношение к температуре: хорошо переносят низкие температуры, погибают при высоких Являются внутриклеточными паразитами – размножаются внутри клеток лимфоидно-макрофагальной системы, вызывают бактериемию и септицемию.
Факторы патогенности А) эндотоксин Б) поверхностные структуры, обеспечивающие инвазивность и агрессивность В) внутриклеточный паразитизм Г) ГЗТ при бруцеллезе и туляремии
Палочки спорообразующие грамположительные Сибиреязвенные бациллы Семейство Bacillaceae род Bacillus Bacillus anthracis
Биохимические свойства Обладает сахаролитической активностью - разлагает до кислоты глюкозу, сахарозу, фруктозу, мальтозу и декстрин - гидролизует крахмал - образуют ацетилметилкарбинол - образует лецитиназу Протеолитическая активность: - разжижает желатину на 2-5 сут. - свертывает молоко за 3 -5 сут., затем пептонизирует сгусток и разжижается, при расщеплении белков образуется Н2S и аммиак, накапливается бурый пигмент.
Антигенная структура Капсульные АГ представлены полипептидами, соединенными с молекулами D-глутаминовой кислоты. По капсульным АГ выделяют единственный серовар, антитела к капсульным АГ не обладают протективным действием. Соматический АГ представлен полисахаридами клеточной стенки (состоит из Д-галактозы и N-ацетилглюкозамина), антитела к нему не обладают протективным действием, длительно сохраняется во внешней среде. Сибиреязвенный экзотоксин имеет сложную структуру и включает в себя протективный АГ - липопротеин термолабильный, относится к токсинам класса С).
Факторы патогенности I. Факторы адгезивности: 1- капсульный полипептид обеспечивает адгезию на чувствительных клетках – энтероцитах кишечника или эпителиоцитах дыхательного тракта, обладает выраженной антифагоцитарной активностью. 2- протективный АГ- обеспечивает взаимодействие с мембранами клеток организма человека и животных. II. Факторы инвазивности: поверхностные структуры + лецитиназа + протеазы = проникновение вглубь кожи и слизистых. III. Факторы агрессивности: капсула – защищает микробные клетки от поглощения и разрушения фагоцитами – нейтрофилами и макрофагами. D-глутаминовые кислоты – внутриклеточный паразитизм.
IV. Токсинообразование. IV. Токсинообразование. Экзотоксин, имеет сложную структуру, его образование кодируется плазмидой, комплексом из 3-х генов. Токсин состоит из 3-х компонентов: протективный антиген – на него в организме вырабатываются защитные АТ. летальный фактор – обладает цитотоксическим действием и вызывает отек легких, является ферментом металлопротеазой, нарушает синтез белка, как следствие наблюдается гибель клетки. отечный фактор - проявляет эффект аденилатциклазы, повышает концентрацию цАМФ в клетках макроорганизма, в результате повышается проницаемость клеток и сосудов, развивается отек (особенно отек легких).
Механизмы и пути заражения контактный – при уходе за больными животными, при разделки мяса, переработки шкур, шерсти – попадают в организм вегетативные формы или споры. аэрогенный – при вдыхании спор микробов: - при уходе за животными, переработке шкур - при пересыпки порошков и т.д.. алиментарный – при употреблении мяса больных животных (вегетативные формы) редко трансмиссивный путь – через кровососущих насекомых – слепней, мух-жигалок.
Клинические формы Выделяют: кожную форму легочную форму - развивается при ингаляции спор микроорганизмов. желудочно-кишечную септическую форму
Диагностика Бактериоскопический Из исследуемого материала готовят 4 мазка. Фиксированные мазки окрашивают: 1- по методу Грама – грамположительные палочки. 2- по Романовскому – Гимзе или по Ожешко (споры). 3-по методу Бурри-Гинса или по Ребигеру (раствор Ребигера – 15-20 г генцианвиалета растворяют в 100 мл 40% формалина, раствор одновременно фиксирует и окрашивает препарат в течение 15-20 сек.) – бациллы окрашиваются в фиолетовый цвет, а капсулы в красно-фиолетовый цвет. 4- сибиреязвенной люминисцирующей сывороткой (РИФ), при этом сибиреязвенные бациллы выглядят как палочки с ободком, светящиеся зеленоватым светом.
Бактериологический метод Бактериологический метод Серологический метод Биологическая проба Аллергический метод Молекулярно-генетический метод
Вы можете изучить и скачать доклад-презентацию на тему Микобактерии. Возбудители туберкулеза. Презентация на заданную тему содержит 43 слайдов. Для просмотра воспользуйтесь проигрывателем, если материал оказался полезным для Вас - поделитесь им с друзьями с помощью социальных кнопок и добавьте наш сайт презентаций в закладки!






































Исторические сведения В XVII веке Франциск Сильвий впервые связал маленькие плотные узелки, обнаруженные в различных тканях при вскрытии трупа, с признаками чахотки. В 1819 г. французский врач Рене Лаэннек предложил метод аускультации лёгких, что имело большое значение в разработке методов диагностики туберкулёза. В 1868 году немецкий патолог Теодор Лангханс обнаружил в туберкулёзном бугорке гигантские клетки. В 1882 г. в Германии Роберт Кох после 17 лет работы в лаборатории открыл возбудителя туберкулёза, которого назвали бациллой Коха. Он обнаружил возбудителя при микроскопическом исследовании мокроты больного туберкулёзом после окраски препарата везувином и метиленовым синим. Впоследствии он выделил чистую культуру возбудителя и вызвал ею туберкулёз у подопытных животных. В настоящее время фтизиатры пользуются термином МБТ (микобактерия туберкулёза). В 1882—1884 годах Франц Циль и Фридрих Нельсен (Германия) предложили эффективный метод окраски кислотоустойчивых микобактерий туберкулёза.
В 1919 г. микробиолог Альбер Кальметт и ветеринарный врач Камиль Герен (оба — Франция) создали вакцинный штамм микобактерии туберкулёза для противотуберкулёзной вакцинации людей. Штамм был назван «бациллы Кальметта — Герена (BCG – Bacilles Calmette — Guerin). Впервые вакцина БЦЖ была введена новорождённому ребёнку в 1921 г. В 1925 г. Кальметт передал профессору Л. А. Тарасевичу штамм вакцины БЦЖ, которая была названа БЦЖ-1. Через три года экспериментального и клинического изучения было установлено, что вакцина безвредна. Смертность от туберкулёза среди вакцинированных детей в окружении бактерионосителей была меньше, чем среди невакцинированных. В 1928 году было рекомендовано вакцинировать БЦЖ новорождённых из очагов туберкулёзной инфекции С 1935 г. вакцинацию стали проводить в широких масштабах не только в городах, но и в сельской местности. В середине 1950-х вакцинация новорождённых стала обязательной. До 1962 г. проводили в основном пероральную вакцинацию новорождённых, с 1962 для вакцинации и ревакцинации стали применять более эффективный внутрикожный метод введения вакцины. В 1985 г. для вакцинации новорождённых с отягощённым постнатальным периодом была предложена вакцина БЦЖ-М, которая позволяет уменьшить антигенную нагрузку вакцинируемых.
В 1943 г. Зельман Ваксман совместно с Альбертом Шацем получил стрептомицин — первый противомикробный препарат, который оказывал бактериостатическое действие на микобактерии туберкулёза. С 1954 г. во фтизиатрии начали применять парааминосалициловую кислоту (ПАСК), тибон, препараты изоникотиновой кислоты (изониазид, фтивазид, салюзид, метазид). В начале 1970-х г. началось применение рифампицина и этамбутола. К концу XX века спектр препаратов, применяемых во фтизиатрии, значительно расширился. По современной классификации Всемирной организации здравоохранения, изониазид, рифампицин, пиразинамид, этамбутол и стрептомицин относятся к т.н. препаратам первого ряда. Все остальные препараты, применяемые для лечения туберкулёза, именуются препаратами второго, третьего ряда и т.д. (в зависимости от отношения препаратов к тому или иному поколению антибиотиков).
Микобактерии Микобактерии - палочковидные бактерии порядка Асtinomycetales, семейства Мycobacteriaceae, рода Мycobacterium; широко распространены в почве, воде и среди людей. Род Мycobacterium включает свыше 100 видов. Они вызывают туберкулез, лепру, микобактериоз. Типовой вид М. tuberculosis. Микобактерии - палочковидные бактерии (0,2-0,7 х 1,0-10 мкм), иногда ветвящиеся, нитевидные и мицелиоподобные с гомогенной или зернистой цитоплазмой. Грамположительны (окрашиваются плохо), неподвижны, имеют микрокапсулу. Аэробы. Содержат в клеточной стенке большое количество липидов, миколовых кислот, арабиногалактан, липоарабиноманнан и пептидогликан. Плохо воспринимают анилиновые красители, окрашиваются по Цилю—Нильсену и флюорохромами (аурамин). Устойчивы к кислотам, спирту, щелочам. Виды делятся на медленно растущие (появление видимого роста после 7 дней) и быстро растущие (появление видимого роста до 7 дней). Некоторые виды (М. leprae) не культивируются. Микобактерии родственны родам Nocardia, Rhodococcus, Corynebacterium, представители которых имеют миколовые кислоты.
Рост микобактерий на среде Левенштейна-Йенсена (состоит из яичной основы, малахитового зеленого и добавок): А) рост гранулированных, бородавчатых, сухих колоний M. tubercuiosis; Б, В) рост фотохромогенных, от гладких до неровных колоний M. kansassii, M. gordonae.
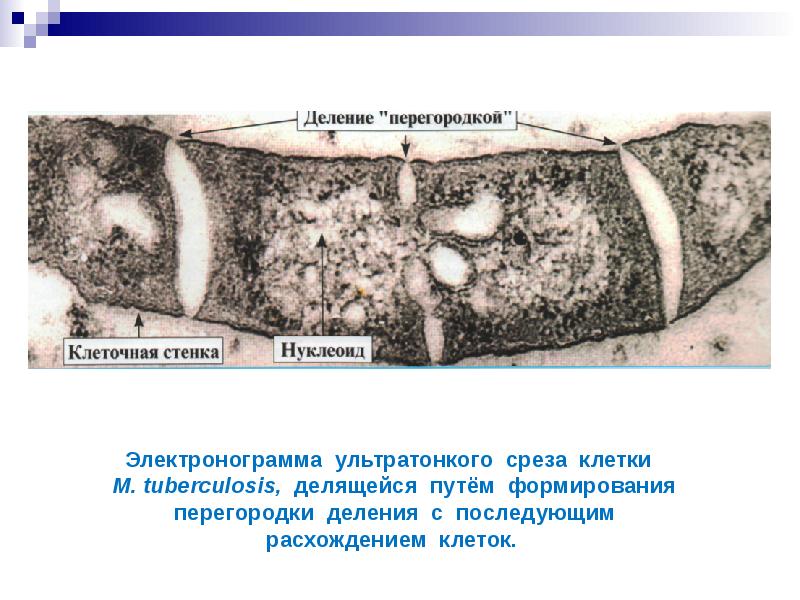
Электронограмма ультратонкого среза клетки M. tuberculosis, делящейся путём формирования перегородки деления c последующим расхождением клеток.
Формы сохранения жизнеспособности в макроорганизме МБТ, поглощённые макрофагами в процессе фагоцитоза, сохраняют свою жизнеспособность длительное время и могут вызывать заболевание после нескольких лет бессимптомного существования. МБТ могут образовывать L-формы, имеющие сниженный уровень метаболизма и ослабленную вирулентность. L-формы могут длительное время персистировать (сохраняться) в организме и индуцировать (вызывать) противотуберкулёзный иммунитет. МБТ могут существовать в виде очень мелких фильтрующихся форм, которые выделяются у больных, длительно принимавших противотуберкулёзные препараты.
Приобретённый клеточный иммунитет эффективное взаимодействие макрофагов и лимфоцитов. Особое значение имеет контакт макрофагов с Т-хелперами (CD4+) и Т-супрессорами (CD8+). Макрофаги, поглотившие МБТ, экспрессируют на своей поверхности антигены микобактерий (в виде пептидов) и выделяют в межклеточное пространство интерлейкин-1 (ИЛ-1), который активирует Т-лимфоциты (CD4+). В свою очередь Т-хелперы (CD4+) взаимодействуют с макрофагами и воспринимают информацию о генетической структуре возбудителя. Сенсибилизированные Т-лимфоциты (CD4+ и CD8+) выделяют хемотаксины, гамма-интерферон и интерлейкин-2 (ИЛ-2), которые активируют миграцию макрофагов в сторону расположения МБТ, повышают ферментативную и общую бактерицидную активность макрофагов. Активированные макрофаги интенсивно вырабатывают активные формы кислорода и перекись водорода. Это так называемый кислородный взрыв; он воздействует на фагоцитируемый возбудитель туберкулёза. При одновременном воздействии L-аргинина и фактора некроза опухолей-альфа образуется оксид азота NO, который также обладает антимикробным эффектом. В результате всех этих процессов разрушительное действие МБТ на фаголизосомы ослабевает, и бактерии разрушаются лизосомальными ферментами. При адекватном иммунном ответе каждое последующее поколение макрофагов становится всё более иммунокомпетентным. Выделяемые макрофагами медиаторы активируют также B-лимфоциты, ответственные за синтез иммуноглобулинов, однако их накопление в крови на устойчивость организма к МБТ не влияет. Но выработка B-лимфоцитами опсонирующих антител, которые обволакивают микобактерии и способствуют их склеиванию, является полезной для дальнейшего фагоцитоза. Повышение ферментативной активности макрофагов и выделение ими различных медиаторов может вести к появлению клеток повышенной чувствительности замедленного типа (ПЧЗТ) к антигенам МБТ. Макрофаги трансформируются в эпителиоидные гигантские клетки Лангханса, которые участвуют в ограничении зоны воспаления. Образуется экссудативно-продуктивная и продуктивная туберкулёзная гранулёма, образование которой свидетельствует о хорошем иммунном ответе на инфекцию и о способности организма локализовать микобактериальную агрессию. На высоте гранулематозной реакции в гранулеме находятся Т-лимфоциты (преобладают), B-лимфоциты, макрофаги (осуществляют фагоцитоз, выполняют аффекторную и эффекторную функции); макрофаги постепенно трансформируются в эпителиоидные клетки (осуществляют пиноцитоз, синтезируют гидролитические ферменты). Реакция ПЧЗТ появляется через 2—3 недели после инфицирования, а достаточно выраженный клеточный иммунитет формируется через 8 недель. После этого размножение микобактерий замедляется, общее их число уменьшается, специфическая воспалительная реакция затихает. Но полной ликвидации возбудителя из очага воспаления не происходит. Сохранившиеся МБТ локализуются внутриклеточно (L-формы) и предотвращают формирование фаголизосомы, поэтому недоступны для лизосомальных ферментов. Такой противотуберкулёзный иммунитет называется нестерильным. Оставшиеся в организме МБТ поддерживают популяцию сенсибилизированных Т-лимфоцитов и обеспечивают достаточный уровень иммунологической активности
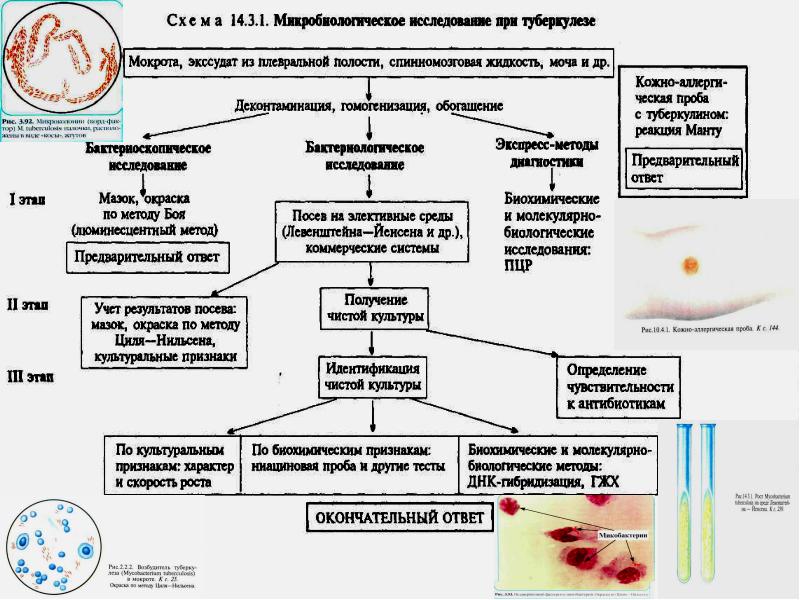
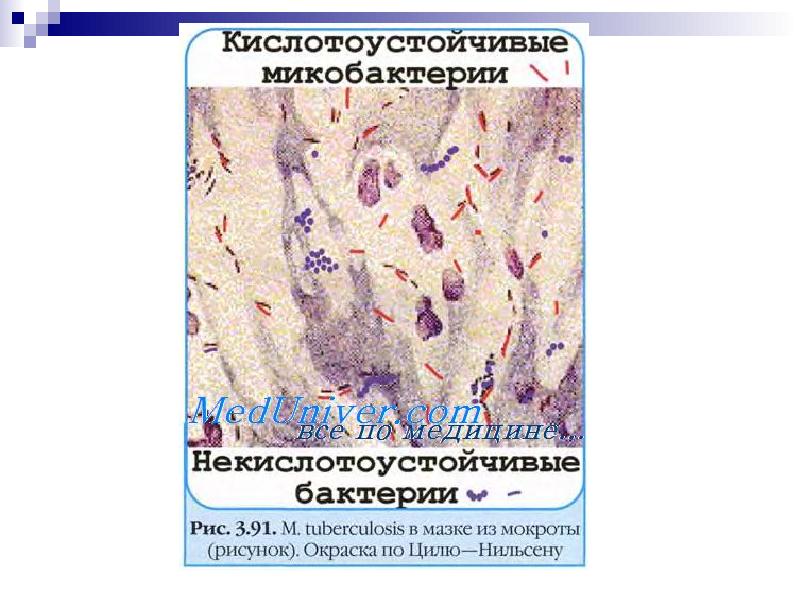
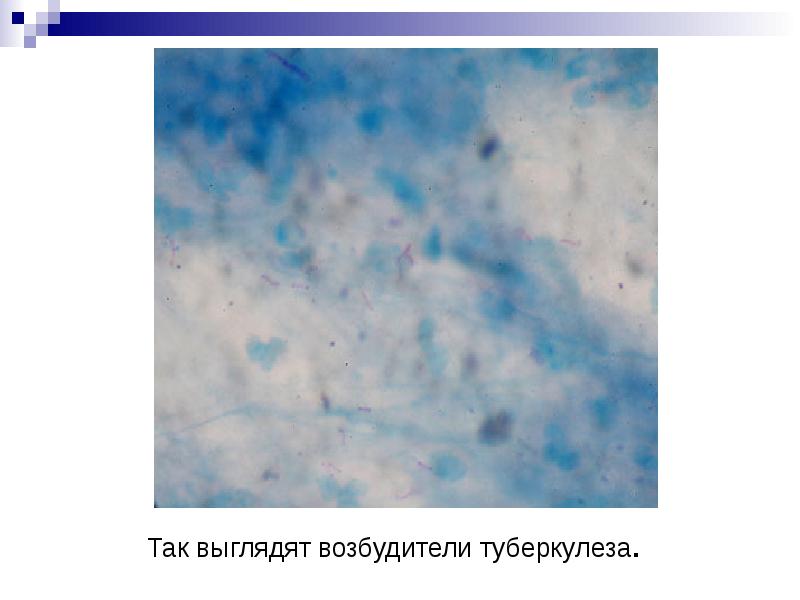
Микробиологическая диагностика Бактериоскопический метод: микроскопия мазков (окраска по Цилю—Нильсену) из патологического материала, в том числе из мокроты, обогащенной гомогенизацией или флотацией. Бактериологический метод: посев на среду Левенштейна—Йенсена, Финн 2 и др., микрокультивирование по Прайсу (рост микроколоний при помещении мазка в жидкую питательную среду. Биологическая проба: заражение морских свинок и кроликов. Серологический метод: РНГА, ИФА; определяют антитела против комплекса антигенов клеточной стенки, липоарабиноманнана, гликолипидов, фибронектинсвязывающего антигена. Кожно-аллергические пробы: внутрикожное введение туберкулина (проба Манту). Молекулярно-генетический метод: ПЦР; метод генной дактилоскопии возбудителя — Саузерн-блот-гибридизация с использованием инсерционного элемента (IS) в качестве зонда.
Проба Манту: на 2-3 день после внутрикожного введения туберкулина появляется папула (в результате инфильтрации кожи Т-лимфоцитами, сенсибилизированными к микобактериям). Размер паппулы измеряют прозрачной линейкой. Положительная реакция развивается через 6-10 нед после проникновения возбудителя.
Диаскин-тест Диаскинтест® – инновационный внутрикожный диагностический тест, в основе которого лежит - комбинация из двух рекомбинантных белков (ESAT6/CFP10), которые отсутствуют у M.bovis BCG и большинства непатогенных микобактерий, за счет чего тест обладает высокой чувствительностью и специфичностью. Тест позволяет четко дифференцировать иммунные реакции, обусловленные инфекцией M.tuberculosis, поствакцинальный иммунитет (БЦЖ) и неспецифические реакции, возникающие при инфицировании непатогенными микобактериями. Диаскинтест®: • имеет высокий профиль безопасности; • высоко специфичен – не вызывает положительных реакций у здоровых и вакцинированных БЦЖ лиц, в отличие от туберкулина, часто вызывающего положительную реакцию в этих случаях; • высоко чувствителен – все больные активным туберкулезом и лица с высоким риском развития туберкулеза дают положительную реакцию на препарат; • позволяет судить об активности процесса и контролировать эффективность терапии туберкулеза; у лиц (в том числе детей), излеченных от туберкулеза – реакции отрицательные.
Лечение Трёхкомпонентная схема лечения стрептомицин изониазид пара-аминосалициловая кислота (ПАСК). Четырёхкомпонентная схема лечения рифабутин или рифампицин стрептомицин или канамицин изониазид или фтивазид пиразинамид либо этионамид На сегодняшний день система лечения т. н. препаратами первого ряда (включая изониазид, рифампицин, стрептомицин, пиразинамид и этамбутол) является общепринятой в 120 странах мира, включая развитые страны. Пятикомпонентная схема лечения К упомянутой выше четырёхкомпонентной схеме добавляется производное фторхинолона, например, ципрофлоксацин. Включение препаратов второго, третьего и выше поколения является основным при лечении лекарственноустойчивых форм туберкулёза. Режим лечения препаратами второго и выше поколения подразумевает как минимум 20 месяцев ежедневного приёма препаратов. Данный режим гораздо дороже, чем лечение препаратами первого ряда. Существенно ограничивающим моментом также является наличие огромного количества различного рода побочных эффектов от применения препаратов второго и выше поколения. Если, несмотря на 4—5-компонентный режим химиотерапии, микобактерии всё же развивают устойчивость к одному или нескольким применяемым химиопрепаратам, то применяют химиопрепараты второй линии: циклосерин, капреомицин и другие, относящиеся ко второму(резервному) ряду вследствие своей токсичности для человеческого организма.
Читайте также:

