Микоплазменная хламидийная легионеллезная пневмония
Обновлено: 13.05.2024
Микоплазменная пневмония
Воспаление легких, вызываемое M.pneumoniae, наиболее часто диагностируется у детей и лиц молодого возраста, достигая среди указанных контингентов 20–30% от числа всех этиологически верифицированных внебольничных пневмоний. Напротив, в старших возрастных группах микоплазменная пневмония диагностируется, как исключение (1–3%). Наряду со спорадическими случаями наблюдаются и групповые (эпидемические) вспышки заболевания – в основном в организованных коллективах (школьники, военнослужащие).
Микоплазменная пневмония, как правило, сопровождается ознобом, мышечными и головными болями, симптомами инфекции верхних дыхательных путей. Напротив, кровохарканье и боли в груди весьма нетипичны.
При стетоакустическом обследовании удается получить зачастую весьма скудную информацию: локально выслушиваются мелкопузырчатые хрипы или незвучная инспираторная крепитация при отсутствии укорочения (притупления) перкуторного звука. Нередко определяются шейная лимфаденопатия, полиморфные кожные сыпи, гепатоспленомегалия.
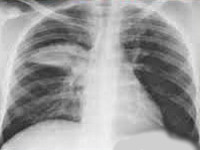
При рентгенографии органов грудной клетки обнаруживается неоднородная инфильтрация легочной ткани, локализующаяся преимущественно в нижних долях легких, причем в 10–40% случаев процесс имеет двусторонний характер. Массивная очагово–сливная инфильтрация, полостные образования, плевральный выпот для микоплазменной пневмонии не характерны. Нередко даже в случаях своевременно назначенной адекватной антибактериальной терапии пневмоническая инфильтрация разрешается спустя многие недели, существенно отставая от клинического выздоровления.
Известно, что M.pneumoniae инициирует выраженную поликлональную пролиферацию лимфоцитов. Именно этим обстоятельством можно объяснить многообразие внелегочных иммунологически опосредованных проявлений заболевания – кожных, суставных, гематологических, гастроинтестинальных, неврологических и др. В свое время особое внимание в диагностике микоплазменной инфекции уделялось феномену высокого титра холодовых гемагглютининов с субклиническим гемолизом (положительная проба Кумбса, ретикулоцитоз). Однако, как было установлено в последующем, данная лабораторная находка не является специфичной для микоплазмоза и с разной частотой обнаруживается при цитомегаловирусной инфекции, легионеллезе, эпидемическом паротите и особенно при инфекционном мононуклеозе.
Выделение культуры Mycoplasma pneumoniae – чрезвычайно трудоемкий и длительный процесс (микроорганизм растет крайне медленно, требует 7–14 сут., часто и гораздо более длительных сроков инкубации, а также специальных сред, содержащих все предшественники, необходимые для синтеза макромолекул, способных обеспечить микоплазмы источниками энергии) – см. табл. 2.
Определение антигена микоплазмы может быть достигнуто несколькими методами. Использование поликлональной антисыворотки характеризуется очень малой специфичностью, поскольку значительное число индивидов являются здоровыми носителями инфекции. Обнаружение антигена в мокроте с использованием реакции иммуноферментного анализа (ИФА) демонстрирует вариабельную чувствительность (40–81%) и специфичность (64–100%), если при этом в качестве референс–метода рассматривается выделение культуры возбудителя. Имеющиеся в арсенале современных лабораторий коммерческие ДНК–РНК–пробы, дающие возможность идентифицировать M.pneumoniae в мазках из зева, характеризуются высокой специфичностью, но низкой чувствительностью. В настоящее время все большее внимание привлекает технология полимеразной цепной реакции (ПЦР), однако для дифференциации активной и персистирующей инфекции необходимо проведение серологических тестов.
Тест холодовой агглютинации ввиду его низкой чувствительности и специфичности в настоящее время в клинической практике не используется. Реакция связывания комплемента демонстрирует вариабельную чувствительность (50–90%) и субоптимальную специфичность. Наиболее приемлемым стандартом серологической диагностики микоплазменной инфекции сегодня является ИФА с обнаружением специфических IgG и IgM. ИФА демонстрирует высокую чувствительность и специфичность – 92% и 95% соответственно. Время сероконверсии, т.е. четырехкратного возрастания титра антимикоплазменных антител при последовательном исследовании проб крови, взятых в остром периоде заболевания и в периоде реконвалесценции, обычно составляет 3–8 недель.
Хламидийная пневмония
Каждый из трех известных в настоящее время видов хламидий способен вызывать воспаление легких: Chlamydia trachomatis – отдельные случаи пневмонии у новорожденных; Chlаmydophila psittaci – поражение легких при пситтакозе (орнитозе); Chlamydophila pneumoniae – весьма распространенный возбудитель пневмонии и острого бронхита у взрослых и детей. Собственно C.pneumoniae, как уже говорилось выше, и рассматривается как один из актуальных возбудителей атипичной пневмонии. Этиологический вклад Chlamydia pneumoniae в развитие внебольничной пневмонии, преимущественно у лиц молодого возраста, составляет 3–10%.
Клиническая картина респираторного хламидиоза, ввиду его недостаточной изученности, представляется менее определенной, нежели, например, микоплазменной инфекции. Установлено весьма распространенное бессимптомное или малосимптомное течение С.pneumoniae–инфекции. Так, при обследовании военнослужащих–новобранцев было подтверждено, что только у 10% из числа лиц с серологически верифицированной активной хламидийной инфекцией обнаруживались клинико–рентгенологические признаки пневмонии. Наверное, именно этот факт и объясняет значительную частоту бессимптомных серопозитивных лиц (25–86%), причем с возрастом частота циркуляции антихламидийных антител в популяции возрастает. Бессимптомное назофарингеальное носительство C.pneumoniae определяется примерно у 5–7% обследуемых здоровых детей, что предполагает возможность передачи инфекции от человека к человеку с респираторными секретами.
Клиническая картина хламидийной пневмонии часто оказывается схожей с таковой при микоплазменной пневмонии. Лихорадка и малопродуктивный приступообразный кашель встречаются в 50–80% случаев. Выраженная гиперемия зева и боли при глотании, часто сопровождаемые осиплостью голоса, наблюдаются более чем у трети больных, нередко являясь дебютными и/или наиболее демонстративными признаками заболевания.
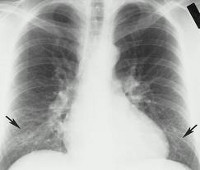
При рентгенографии органов грудной клетки чаще визуализируется мелкоочаговая (размером 2–3 см), нередко многофокусная инфильтрация. Лобарная инфильтрация, образование полостей в легких и плевральный выпот нетипичны для хламидийной пневмонии. Количество лейкоцитов и лейкоцитарная формула в периферической крови обычно нормальные.
Хламидийная пневмония характеризуется, как правило, нетяжелым, но нередко затяжным течением.
Первоначально для выделения культуры C. pneumoniae использовались 6–7–дневные куриные эмбрионы (возбудитель наиболее интенсивно размножается в эктодермальных клетках оболочки желточного мешка). Впрочем, затем выяснилось, что этот метод демонстрирует низкую чувствительность. В конечном счете выбор был сделан в пользу перевиваемой линии клеток человека (Hеlа, La 229), до того использовавшейся для выделения респираторного синцитиального вируса (табл. 3).
Обычно вначале проводят определение IgG, предваряя этим тестом определение IgM. Таким образом, исключается ложноположительное определение IgM в случаях наличия ревматоидного фактора, особенно у пожилых пациентов. Свидетельствами активной хламидийной инфекции являются четырехкратное нарастание титров IgG или IgA в парных сыворотках крови, взятых с 2–4–недельным интервалом в остром периоде заболевания и в периоде реконвалесценции, или однократно определяемый высокий титр антихламидийных антител (например, IgG>=1:512).
В настоящее время активно обсуждается перспектива клинического применения ПЦР в диагностике хламидийной инфекции. Однако относительная сложность в проведении и высокая цена сдерживают масштабное распространение этой диагностической технологии. Впрочем, ПЦР позволяет осуществить быструю диагностику, что может в части случаев оказаться полезным в плане выбора соответствующей антимикробной химиотерапии.
Легионеллезная пневмония
Физическая симптоматика легионеллезной пневмонии, как правило, убедительна: локальная крепитация, признаки консолидации легочной ткани (бронхиальное дыхание, укорочение перкуторного звука). Рентгенологические данные неспецифичны – визуализируется очаговая пневмоническая инфильтрация, локализующаяся обычно в пределах одной доли легких. Нередко одновременно обнаруживается и ограниченный плевральный выпот и, напротив, нечасто, обычно на поздних стадиях болезни, формируются полостные образования в легких. Процесс нормализации рентгеновской картины занимает обычно длительное время, иногда несколько месяцев.
Данные лабораторных исследований, хотя и несут неспецифическую информацию, но, указывая на полисистемность поражения, могут быть использованы, как определенный диагностический критерий. Так, в анализах мочи определяется гематурия и протеинурия; в крови часто выявляются повышенная активность щелочной фосфатазы, креатинфосфокиназы, аминотрансфераз, гипербилирубинемия. В клинической гемограмме обнаруживаются лейкоцитоз с нейтрофилезом и абсолютная лимфопения, значительное увеличение СОЭ.
L.pneumophila – чрезвычайно трудный для культивирования микроорганизм (табл. 4). Метод выделения культуры возбудителя демонстрирует широкий диапазон чувствительности – от 11 до 80% (в сравнении с детекцией антигена).
Тест прямой иммунофлюоресценции наиболее популярен в клинической практике. Он очень быстр в выполнении, но его чувствительность вариабельна и относительно невысока (18–75%). Чувствительность прямой иммунофлюоресценции возрастает до 80%, если этот метод подкрепляется культуральным или если респираторные секреты (трахеальный аспират или жидкость бронхоальвеолярного лаважа) предварительно обработаны. Специфичность теста может достигать 94%. Спустя 4–6 дней после начала адекватной антибактериальной терапии определение антигена становится невозможным.
Антиген L.pneumophila может быть также обнаружен в моче радиоиммунологически, с использованием ИФА или в реакции латексной агглютинации. Однако следует иметь в виду, что легионеллезный антиген может персистировать в течение многих месяцев после выздоровления, а ИФА пригоден только для идентификации L.pneumophila, 1–й серогруппы.
Наиболее популярная сегодня диагностика легионеллеза предполагает идентификацию специфических антител – непрямая иммунофлюоресценция, ИФА и микроагглютинация. В типичных случаях сероконверсия (четырехкратное нарастание титра специфических антител) наблюдается через 4–8 недель, однако у лиц старших возрастных групп этот временной интервал может достигать 14 недель. Следует также учитывать тот факт, что 20–30% пациентов, переносящих острую легионеллезную инфекцию, не демонстрируют нарастания титра антител. ИФА характеризуется высокой специфичностью (95%) и приемлемой чувствительностью (85%) при определении специфических IgG и IgM. Описываются отдельные наблюдения перекрестных реакций с Pseudomonas aeruginosa, Chlamydia/Chlamydophila spp., Mycoplasma pneumoniae и Campylobacter spp.
Лечение атипичной пневмонии
Рис. 1. Алгоритм эмпирической антибактериальной терапии нетяжелой внебольничной пневмонии (по A.Ortqvist, 2002 [4], с изменениями)
При нетяжелом течении атипичной пневмонии (вероятнее всего, микоплазменной или хламидийной этиологии) макролиды следует назначать внутрь в среднетерапевтических дозах – эритромицин по 250–500 мг каждые 6 часов; кларитромицин по 250 мг каждые 12 часов; азитромицин по 500 мг 1 раз в день в течение 3–х дней или по 250 мг 2 раза в день в 1–й день и по 250 мг 1 раз в день со 2–го по 5–й дни.
В последние годы была показана и высокая клиническая эффективность новых фторхинолонов в лечении легионеллезной пневмонии (левофлоксацин, 500 мг один раз в сутки в течение 10–14 дней) [8].
Продолжительность антибактериальной терапии атипичной пневмонии составляет не менее 2–3–х недель; минимизация сроков лечения несет в себе реальный риск рецидива инфекции. При этом следует еще раз напомнить, что зачастую клиническое выздоровление при микоплазменной, хламидийной или легионеллезной инфекциях нижних дыхательных путей существенно опережает более позднее рентгенологическое, которое порой затягивается на многие недели или даже месяцы.
1. Niederman M.S., Mandell L.A., Anzueto A. et al. Guidelines for the management of adults with community–acquired pneumonia. Diagnosis, assessment of severity, antimicrobial therapy, and prevention. Am J Respir Crit Care Med 2001; 163: 1730–1754.
2. British Thoracic Society Guidelines for the management of community–acquired pneumonia in adults. Thorax 2001; 56 Suppl. 4: 1–64.
3. M.J.Fang, M.Fine, J.Orloff et al. New and emerging etiologies for community–acquired pneumonia with implications for therapy: a prospective multicenter study of 359 cases. Medicine 1990; 69:307–316.
4. Ortqvist A. Treatment of community–acquired lower respiratory tract infections in adults. Eur Respir J 2002; 20: Suppl. 36, 40s–53s.
5. И.С.Тартаковский. Современные подходы к диагностике атипичных пневмоний. Клиническая микробиология и антимикробная химиотерапия 2000; 1: 60–68.
6. Reese R.E., Betts R.F., Gumustop B. Handbook of antibiotics. 3rd ed. Philadelphia:Lippincott Williams & Wilkins; 2000
7. File T.M., Tan J.S. Plouffe J. F. The role of atypical pathogens: Myciplasma pneumoniae, Chlamydia pneumoniae, and Legionella pneumophila in respiratory infections. Infect Dis Clin North Am 1998; 12: 569–592.
8. Chidiac C. Legionella pneumophila effectively managed by levofloxacin. Abstracts of 7th International Symposium of New Quinolones. Edinburgh, UK, 2001; 57.
Микоплазменная пневмония – атипичная легочная инфекция, возбудителем которой является Мycoplasma pneumoniae. Заболевание сопровождается катаральными и респираторными проявлениями (заложенностью носа, першением в горле, приступами навязчивого малопродуктивного кашля), интоксикационным синдромом (субфебрилитетом, слабостью, головной болью, миалгией), явлениями диспепсии (дискомфортом в ЖКТ). Микоплазменная этиология пневмонии подтверждается данными рентгенографии и КТ легких, серологического и ПЦР исследований. При микоплазменной пневмонии показаны макролиды, фторхинолоны, бронходилататоры, отхаркивающие средства, иммуномодуляторы, физиолечение, массаж.
МКБ-10
Общие сведения
Микоплазменная пневмония – заболевание из группы атипичных пневмоний, вызываемое патогенным агентом – микоплазмой (М. pneumoniae). В практике пульмонологии частота микоплазменных пневмоний варьирует, составляя от 5 до 50% случаев внебольничных воспалений легких или около трети пневмоний небактериального генеза. Заболевание регистрируется в виде спорадических случаев и эпидемических вспышек. Характерны сезонные колебания заболеваемости с пиком в осенне-зимний период. Микоплазменная пневмония наблюдается преимущественно у детей, подростков и молодых пациентов до 35 лет, намного реже – в среднем и зрелом возрасте. Легочная инфекция чаще встречается в организованных коллективах с тесными контактами (в дошкольных, школьных и студенческих группах, у военнослужащих и др.), возможны семейные случаи инфекции.
Причины
Микоплазменную пневмонию вызывают высоковирулентные штаммы анаэробных микроорганизмов рода Мycoplasma – M. pneumoniae. Возбудитель представлен мелкими (по размеру сравнимыми с вирусными частицами), не имеющими клеточной стенки (аналогично L-формам бактерий), прокариотическими организмами. Микоплазмы легко адсорбируются на поверхностных рецепторах клеток-мишеней (эпителиоцитов трахеи и бронхов, альвеолоцитов, эритроцитов и др.) и паразитируют на мембране или внутри клетки-хозяина. Интеграция микоплазмы в клеточную мембрану или ее проникновение внутрь клетки превращает последнюю в иммунологически инородную, что провоцирует развитие аутоиммунных реакций. Именно аутоантителообразование служит причиной нереспираторных проявлений микоплазменной инфекции.
Микоплазмы способны длительно персистировать в эпителиальных клетках и лимфоглоточном кольце; легко передаются воздушно-капельным путем от больных и бессимптомных носителей со слизью из носоглотки и респираторного тракта. Микоплазмы малоустойчивы во внешних условиях: чувствительны к перепаду pH, нагреванию и высушиванию, ультразвуку и УФО, не растут на недостаточно влажных питательных средах.
Кроме микоплазменной пневмонии, микроорганизмы также могут стать причиной острого воспаления верхних дыхательных путей (фарингита), бронхиальной астмы, обострений хронического обструктивного бронхита и развития нераспираторной патологии (перикардита, отита, энцефалита, менингита, гемолитической анемии) у практически здоровых людей.
Отсутствие клеточной оболочки обеспечивает микоплазмам резистентность к β-лактамным антибиотикам – пенициллинам, цефалоспоринам. При микоплазменной инфекции отмечается развитие локального воспаления с выраженной иммуноморфологической реакцией, местным антителогенезом (всех классов иммуноглобулинов - IgM, IgA, IgG), активацией клеточного иммунитета. Симптомы микоплазменной пневмонии обусловлены преимущественно агрессивной ответной воспалительной реакцией макроорганизма (постинфекционной гиперсенситивностью, опосредованной Т-лимфоцитами).
Симптомы микоплазменной пневмонии
Инкубационный период при микоплазменной пневмонии может длиться 1-4 недели (обычно 12-14 дней). Начало заболевания, как правило, постепенное, но может быть подострым или острым. Выделяют респираторные, нереспираторные и генерализованные проявления микоплазменной пневмонии.
В начальном периоде возникает поражение верхних дыхательных путей, которое протекает в виде катарального назофарингита, ларингита, реже острого трахеобронхита. Отмечается заложенность носа, сухость в носоглотке, першение в горле, осиплость голоса. Ухудшается общее состояние, постепенно нарастает температура до субфебрильных значений, появляется слабость, потливость. В острых случаях симптомы интоксикации возникают в первые сутки заболевания, при постепенном развитии - только на 7-12 день.
Характерен продолжительный (не менее 10-15 дней) малопродуктивный пароксизмальный кашель. Во время приступа кашель очень сильный, изнурительный с выделением незначительного количества вязкой слизистой мокроты. Кашель может приобретать хронический характер, сохраняясь на протяжении 4-6 недель из-за обструкции дыхательных путей и гиперреактивности бронхов. Спектр проявлений микоплазменной пневмонии может включать признаки острой интерстициальной пневмонии.
Из внелегочной симптоматики для микоплазменной пневмонии наиболее характерны высыпания на коже и барабанных перепонках (по типу острого мирингита), миалгия, дискомфорт в ЖКТ, нарушение сна, умеренная головная боль, парестезии. Присоединение нереспираторных проявлений утяжеляет течение микоплазменной пневмонии.
Может возникать умеренный фибринозный или экссудативный плеврит, иногда - плевритическая боль. При наличии сопутствующей хронической обструкции микоплазменная пневмония способствует обострению обструктивного синдрома. Для детей младше 3-летнего возраста характерно малосимптомное течение.
В неосложненных случаях симптомы микоплазменной пневмонии в течение 7-10 дней постепенно исчезают, заболевание разрешается самостоятельно. Имеется риск перехода в смешанную (микоплазменно-бактериальную) форму пневмонии вследствие присоединения вторичной инфекции (обычно, пневмококка). Осложнениями микоплазменной пневмонии выступают синдром Стивенса-Джонсона, синдром Гийена-Барре, миелит, энцефалит, менингит.
Диагностика
При постановке диагноза микоплазменной пневмонии учитываются данные клинической картины, рентгенографии и КТ легких, серологического и ПЦР-исследований. Установление этиологии на первой неделе заболевания затруднено из-за первоначальной невыраженности физикальных проявлений. Рано отмечается гиперемия задней стенки глотки, гипертрофия миндалин, постепенно может появиться очаговое ослабленное везикулярное дыхание, крепитация, редкие средне- и мелкопузырчатые хрипы, укорочение перкуторного звука. Для микоплазменной пневмонии типично присутствие внелегочной симптоматики.
На рентгенограмме легких заметно двустороннее усиление легочного рисунка с типичными для пневмонии неоднородными, нечеткими очаговыми инфильтратами в нижних сегментах, в 50% случаев – интерстициальные изменения, перибронхиальная и периваскулярная инфильтрация. Обширная лобарная инфильтрация отмечается редко.
Лабораторные сдвиги – лейкоцитоз и подъем СОЭ в периферической крови при микоплазменной пневмонии менее выражены, чем у больных бактериальным воспалением легких. Микробиологическое исследование с выделением культуры M.pneumoniae из мокроты, ткани легких и плевральной жидкости практически не используется, так как требует продолжительных сроков инкубации и высокоселективных сред. При обычной микроскопии мокроты микоплазмы не выявляются.
Для этиологической верификации микоплазменной пневмонии и установления активной и персистирующей форм инфекции проводится комплекс анализов, включающих серотипирование (ИФА, РСК, РНИФ) и молекулярно-биологическое исследование (ПЦР). Показательно 4-кратное повышение титров IgA и IgG в парных сыворотках (в острую стадию и в период реконвалесценции). Для микоплазменной пневмонии свойственно заметное угнетение Т-клеточного и фагоцитарного звеньев иммунитета, гуморальные сдвиги (повышение количества В-лимфоцитов, уровней IgM и ЦИК).
ЭКГ-изменения могут возникать у больных при появлении миокардита и перикардита. Необходимо дифференцировать микоплазменную пневмонию от ОРВИ, бактериальной пневмонии, орнитоза, легионеллеза, туберкулеза легких.
Лечение микоплазменной пневмонии
При острой микоплазменной пневмонии с выраженным респираторным синдромом лечение проводится в стационарных условиях. На время лихорадки рекомендован постельный режим с обеспечением хорошей аэрации палаты; диета, употребление слегка подкисленной воды, клюквенного морса, компотов и соков, настоя плодов шиповника.
В качестве основной эрадикационной терапии при микоплазменной пневмонии назначаются макролиды (азитромицин), фторхинолоны (офлоксацин, ципрофлоксацин) и тетрациклины. Предпочтительность макролидов обусловлена безопасностью для новорожденных, детей и беременных. Целесообразно проведение ступенчатой антибиотикотерапии – сначала (2-3 дня) внутривенное введение, затем - пероральный прием того же препарата или другого макролида.
Для профилактики рецидива микоплазменной пневмонии курс антибиотиков должен длиться не менее 14 дней (обычно 2–3 недели). Также показаны бронходилататоры, отхаркивающие препараты, анальгетики и антипиретики, иммуномодуляторы. В период реконвалесценции используется немедикаментозная терапия: ЛФК, дыхательная гимнастика, физиопроцедуры, массаж, водолечение, аэротерапия, санаторно-курортное лечение в условиях сухого и теплого климата.
Диспансерное наблюдение у пульмонолога в течение 6 месяцев показано часто болеющим пациентам с хроническими заболеваниями бронхолегочной системы. Прогноз микоплазменной пневмонии обычно благоприятный, летальность может достигать 1,4%.
1. Особенности внебольничной пневмонии, вызванной Mycoplasma pneumoniae: обзор литературы и результаты собственных исследований/ Рачина С.А, Бобылев А.А., Козлов Р.С., Шаль Е.П., Яцышина C.Б., Шелякина О.Г.// Клиническая микробиология и антимикробная химиотерапия. – 2013 – Т.13, №1.
2. Клинико-иммунологическая характеристика микоплазменной пневмонии: Автореферат диссертации/ Меньщикова И.В. – 2007.
3. Пневмония с атипичной (микоплазменной и хламидийной) инфекцией. Особенности клиники, течения, исходы: Диссертация/ Полякова И.Г. – 2006.
Хламидийная пневмония – это инфекционно-воспалительный процесс в легких, вызванный облигатными внутриклеточными бактериями рода Chlamydia и Chlamydophila. Для хламидийной пневмонии характерны респираторные проявления (ринит, трахеобронхит), малопродуктивный кашель, субфебрильная и фебрильная температура, внелегочные симптомы (артралгия, миалгия). При постановке диагноза учитываются аускультативные и рентгенологические данные, однако решающая роль принадлежит лабораторной диагностике (ИФА, МИФ, ПЦР и др.). Для терапии хламидийной пневмонии применяются антимикробные средства (макролиды, тетрациклины, фторхинолоны), иммуномодуляторы, физиопроцедуры.
МКБ-10
Общие сведения
Хламидийная пневмония – этиологическая разновидность атипичной пневмонии, возникающая при инфицировании дыхательных путей различными видами хламидий - Ch. рneumoniae, Ch. psittaci и Ch. trachomatis. Считается, что ежегодно среди внебольничных пневмоний от 5 до 15% случаев вызываются хламидиями; во время эпидемических вспышек этот показатель может составлять 25%. Чаще всего заболевают взрослые, случаи хламидийной пневмонии у новорожденных связаны с заражением от матерей, больных урогенитальным хламидиозом.
Бессимптомное носительство хламидий в носоглотке определяется более чем у половины взрослых и 5-7% детей, поэтому вероятность передачи инфекции с респираторными секретами очень высока. Описаны внутрисемейные вспышки хламидийной пневмонии, а также случаи массовой заболеваемости в изолированных коллективах.

Причины
Характеристика возбудителя
Из всего многообразия представителей семейства Chlamydiaceae в этиологическом отношении практический интерес для пульмонологии представляют три типа хламидий: Chlamydophila pneumoniae, Сhlamydia trachomatis и Chlamydophila psittaci.
- Ch. pneumoniae служит самым частым возбудителем респираторных хламидиозов (в том числе хламидийного фарингита, синусита, бронхита, пневмонии) у пациентов всех возрастов.
- С Сh. trachomatis связана заболеваемость трахомой, мочеполовым хламидиозом, венерической лимфогранулемой, а также хламидийной пневмонией среди новорожденных и грудничков до 6 месяцев. Также с этим типом хламидий ассоциированы пневмонии у иммунокомпрометированных лиц и сотрудников лабораторий.
- Ch. psittaci рассматривается как возбудитель орнитоза (пситтакоза), часто протекающего в форме тяжелой интерстициальной пневмонии.
Механизм передачи
Пути заражения каждой разновидностью хламидий отличаются, однако все типы могут распространяться гематогенным путем. Передача Ch. pneumoniae от человека к человеку осуществляется преимущественно воздушно-капельным и контактно-бытовым путями. Инфицирование штаммом Ch. psittaci происходит воздушно-пылевым или фекально-оральным путем при вдыхании пыли или употреблении пищи, содержащей биологические секреты птиц-переносчиков инфекции (попугаев, канареек, кур, уток, голубей, воробьев и др.).
Инфицирование новорожденных Ch. trachomatis происходит в процессе родов от матерей с урогенитальной хламидийной инфекцией. При интранатальном заражении у 15-25% младенцев возникает хламидийный назофарингит и конъюнктивит, которые часто осложняются пневмонией.
Патогенез
Все хламидии являются облигатными грамотрицательными микроорганизмами, паразитирующими внутри клеток хозяина. В макроорганизме хламидии могут существовать в инфекционной форме (элементарные тельца) и вегетативной форме (ретикулярные тельца). Элементарные тельца проникают внутрь клетки путем стимуляции эндоцитоза, где преобразуются в ретикулярные тельца. Последние обладают высокой метаболической активностью и способностью к внутриклеточному бинарному делению.
Цикл размножения длится около 48 часов, после чего ретикулярные тельца вновь превращаются в элементарные, происходит разрыв мембраны клетки хозяина с выходом элементарных телец новой генерации во внеклеточную среду. Далее цикл инфицирования новых клеток повторяется.
Симптомы хламидийной пневмонии
Пневмония, вызванная Chlamydophila pneumoniae
Хламидийной пневмонией, вызванной Ch. pneumoniae, чаще болеют дети и молодые люди в возрасте от 5 до 35 лет. Среди причин внебольничной пневмонии в этой возрастной группе хламидии уступают только Mycoplasma pneumoniae.
Начало болезни острое или постепенное. В первом случае симптомы интоксикации и поражения дыхательных путей достигают максимальной выраженности уже на 3-и сутки. При подостром течении хламидийная пневмония манифестирует с респираторного синдрома (ринита, назофарингита, ларингита), познабливания, субфебрилитета, в связи с чем в первую неделю болезни у пациентов ошибочно диагностируется ОРЗ. Главным образом, больных беспокоит заложенность носа, нарушением носового дыхания, умеренные слизистые выделения из носа, осиплость голоса.
Пневмония, вызванная Сhlamydia trachomatis
Начало часто постепенное; у детей хламидийной пневмонии нередко предшествует конъюнктивит, острый средний отит или бронхит этой же этиологии. Ранним признаком становится сухой кашель, который, усиливаясь, приобретает приступообразный характер. На фоне кашлевых приступов у ребенка возникает тахипноэ, цианоз и рвота, однако репризы отсутствуют. Постепенно отмечается усугубление одышки, увеличение ЧД до 50-70 в минуту, дыхание становится кряхтящим. Вместе с тем, общее состояние обычно остается удовлетворительным, симптомы интоксикации и дыхательная недостаточность выражены слабо.
Аускультативная и рентгенологическая картина двусторонней хламидийной пневмонии разворачивается к исходу первой – в начале второй недели. В разгар заболевания могут появиться симптомы энтероколита, гепатоспленомегалия. Выздоровление часто затягивается на многие недели и месяцы. При тяжелых формах хламидийной пневмонии может возникать пневмоторакс, плеврит, абсцедирование. Из внелегочных осложнений встречаются миокардиты, эндокардиты, менингоэнцефалиты. Дети, перенесшие хламидийную пневмонию, вызванную Ch. trachomatis, в дальнейшем чаще страдают бронхиальной астмой и другими хроническими обструктивными заболеваниями легких.
Пневмония, вызванная Chlamydophila psittaci (Орнитоз)
Варианты клинического течения орнитоза различны – от бессимптомного до тяжелого. Самым ярким симптомом выступает высокая (до 39,5-40°С и выше) температура тела, сопровождающаяся ознобами и сильнейшей интоксикацией (резкой слабостью, головной болью, артралгиями, миалгиями). В отсутствие других симптомов данное состояние нередко расценивается как лихорадка неясного генеза.
В дальнейшем более чем в половине случаев возникает малопродуктивный кашель, боль в груди, увеличение печени и селезенки. Характерными признаками, указывающими на хламидийную этиологию пневмонии, служат признаки нейротоксикоза, пятнистая сыпь на коже, носовые кровотечения. Часто возникают расстройства пищеварения: тошнота, рвота, абдоминальные боли, поносы или запоры.
Клинико-рентгенологические изменения могут сохраняться в течение 4-6 недель. Типичными осложнениями орнитоза выступают гепатит, ДВС-синдром, венозные тромбозы, гемолитическая анемия, полиневропатии, миокардит.
Диагностика
Затруднения при установлении этиологического диагноза связаны с тем, что в отличие от бактериальных пневмоний, при хламидийной пневмонии отсутствуют отчетливые физикальные и рентгенологические признаки, а также характерные изменения в периферической крови. В этих условиях терапевтам и пульмонологам приходится ориентироваться, главным образом, на указания анамнеза, особенности клинической картины и подтверждать свои подозрения лабораторными методами (ИФА, ПЦР и др.).
- Физикальный осмотр. Аускультативные данные вариабельны: дыхание может быть жестким, бронхиальным или ослабленным везикулярным; хрипы в разгар заболевания чаще влажные или крепитирующие. Перкуторный звук обычно притуплен.
- Рентгенография. При рентгенографии легких выявляется очаговая, сегментарная или долевая инфильтрация либо интерстициальные изменения.
- Лабораторная диагностика. Наиболее специфичным и чувствительным является культуральный метод выделение возбудителя, однако из-за длительности и трудоемкости диагностики на практике обычно ограничиваются серотипированием. Стандартом на сегодняшний день служат ИФА и МИФ (реакция микроиммунофлюоресценции). При проведении ИФА на активность хламидийной инфекции указывает повышение титра специфических IgМ, IgG и IgА более 1:16, 1:512 и 1:256 соответственно; МИФ - повышение титра IgG/IgА в парных сыворотках крови в 4 и более раз. ПЦР-анализ позволяет быстро и безошибочно идентифицирвоать ДНК возбудителя, однако не позволяет отличить персистирующую инфекцию от активной.
Дифференциальную диагностику хламидийной пневмонии следует проводить с гриппом, коклюшем; вирусной, микоплазменной, легионеллезной, грибковой пневмонией и другими атипичными легочными инфекциями.
Лечение хламидийной пневмонии
Сложность эффективного лечения хламидийной пневмонии сопряжена с тем, что хламидии присутствуют в организме одновременно как во внеклеточных, так и внутриклеточных формах, поэтому необходимо воздействовать на оба этих звена. Кроме этого, активизация инфекции, как правило, происходит на фоне угнетения иммунитета, что также требует коррекции иммунного ответа.
Средствами эрадикационной терапии при хламидийной пневмонии признаны антимикробные препараты из групп макролидов, фторхинолонов и тетрациклинов. Наиболее предпочтительны среди них макролиды, т. к. могут применяться для терапии новорожденных, детей и беременных. Из препаратов этой группы наибольшей активностью в отношении хламидий обладают кларитромицин, джозамицин, эритромицин, спирамицин.
Также успешно справляются с хламидийной инфекцией фторхинолоны (ципрофлоксацин, офлоксацин, левофлоксацин) и тетрациклины (доксициклин, моноциклин), однако прием последних исключается при беременности и печеночной недостаточности. Длительность курса противомикробного лечения хламидийной пневмонии составляет не менее 2–3 недель.
С целью коррекции иммунологических расстройств, а также предупреждения рецидива инфекции, помимо антимикробных средств, назначаются иммуномодуляторы, витамины, пробиотики. В период реконвалесценции большое внимание уделяется физиотерапии, дыхательной гимнастике.
Прогноз
У пациентов молодого возраста с отсутствием сопутствующей патологии хламидийная пневмония обычно оканчивается выздоровлением. Среди пожилых летальные исходы возникают в 6-10% случаев. Наблюдения специалистов указывают на возможную этиологическую роль Ch. pneumoniae в развитии атеросклероза, саркоидоза легких, ишемического инсульта, болезни Альцгеймера, поэтому перенесенная хламидийная пневмония может иметь далеко идущие последствия. Однозначно доказано отрицательное влияние респираторного хламидиоза на течение бронхиальной астмы и частоту ее обострений.
Атипичная пневмония – это инфекционно-воспалительные поражения легких, вызываемые нехарактерными (атипичными) возбудителями – хламидиями, микоплазмами, легионеллами, вирусами. Атипичные пневмонии протекают с явлениями общего недомогания, высокой лихорадкой, ознобами, потливостью, мышечной и головной болью, кашлем, одышкой. В тяжелых случаях может развиться легочно-сердечная недостаточность и наступить гибель пациента. Диагностика атипичной пневмонии требует учета данных эпиданамнеза, идентификации возбудителя (методами ИФА, РИФ, ПЦР, культурального посева и др.), проведения рентгенографии легких. С учетом этиологии лечение атипичной пневмонии проводится противомикробными (макролидами, фторхинолонами, тертрациклинами) и противовирусными химиопрепаратами. Основная трудность терапии заключается в том, что против некоторых вирусных возбудителей атипичной пневмонии до настоящего времени не найдено действенных препаратов.
МКБ-10
Общие сведения

Причины
На сегодняшний день к так называемым атипичным микроорганизмам - возбудителям атипичной пневмонии относится многочисленная группа инфекционных агентов. Атипичные пневмонии могут вызываться микоплазменной (Mycoplasma pneumoniae) и хламидийной (Chlamydophila pneumoniae) инфекцией, легионеллой (Legionella spp.), коксиеллой (Coxiella burnetti), вирусами (респираторными вирусами парагриппа 1, 2 и 3; гриппа А и В; вирусом EpsteinBarr, респираторным синцитиальным вирусом), возбудителями лептоспироза (Leptospira spp.), туляремии (Francisella tularensis), хантавирусами, коронавирусом ТОРС (SARS-CoV) и др. Несмотря на значительные различия эпидемиологической и микробиологической характеристики возбудителей, а также патоморфологической картины инфекционного процесса, данные микроорганизмы объединены устойчивостью к антибиотикам пенициллинового ряда и другим β-лактамам, а также общими подходами к лабораторной верификации.
Заражение атипичной пневмонией происходит обычно при тесном контакте в коллективах; путь передачи - воздушно-капельный. Восприимчивость к SARS высокая вне зависимости от возраста: среди болеющих атипичной пневмонией преобладают люди моложе 40 лет, обладающие крепким здоровьем. Инкубационный период при атипичной пневмонии длится от 3-х до 10 дней. В зависимости от возбудителя выделяют следующие основные формы атипичной пневмонии: микоплазменную пневмонию, лихорадку Q, легионеллезную пневмонию, хламидийную пневмонию, тяжелый острый респираторный синдром и др.
Атипичная микоплазменная пневмония
Симптомы
Атипичная микоплазменная пневмония составляет около 10-20% случаев от всех воспалений легких у детей и подростков и 2-3% случаев – у взрослых. В детских коллективах возможны очаговые эпидемические вспышки микоплазменной пневмонии. Клинически респираторный микоплазмоз может протекать в виде назофарингита, трахеита, бронхита, атипичной пневмонии.
Течение микоплазменной пневмонии, как правило, легкое или среднетяжелое. После инкубационного периода (3-11 дней) наступает непродолжительный продромальный период (1-2 суток), в течение которого беспокоит сухость слизистых верхних дыхательных путей, першение в горле, сухой кашель, головная боль и незначительное недомогание. Клиника собственно атипичной микоплазменной пневмонии характеризуется субфебрильной температурой, не поднимающейся выше 38°С; приступообразным непродуктивным кашлем, который беспокоит около 2-3 недель. В 20-30% случаев микоплазменное воспаление легких является двусторонним.
В тяжелых случаях атипичная микоплазменная пневмония протекает с высокой лихорадкой, выраженной интоксикацией, артралгией, миалгией, носовыми кровотечениями, полиморфной сыпью на коже, шейным лимфаденитом, альбуминурией и микрогематурией, гепатоспленомегалией, дистрофическими изменениями миокарда. Однако обычно, по сравнению с бактериальным воспалением, микоплазменная пневмония имеет более вялое и стертое течение. Осложнениями микоплазменной пневмонии могут являться деформирующий бронхит, бронхиолит, бронхоэктазы, пневмосклероз.
Диагностика
Лечение
Своевременная и адекватная этиотропная терапия способствует быстрому регрессу клинических проявлений атипичной микоплазменной пневмонии. Между тем, рентгенологические изменения могут сохраняться длительно, до 4-6 недель. В терапии атипичной пневмонии, вызываемой микоплазмой, используются макролиды (азитромицин, эритромицин), линкозамины (клиндамицин) основным курсом не менее 7 дней и дополнительным - 2 дня после стихания симптомов. Одновременно проводится симптоматическая (жаропонижающая, муколитическая, бронхолитическая) терапия, при бронхиолите назначаются глюкокортикостероиды.
Атипичная хламидийная пневмония
Симптомы
Микроорганизмы из рода Chlamydophila (С.trachomatis, С.pneumoniae) обладают тропностью к эпителиальным клеткам мочеполовой системы, конъюнктивы, бронхов, легких, вызывая у человека урогенитальный хламидиоз, хламидийный конъюнктивит, острый бронхит, пневмохламидиоз. На долю хламидийных пневмоний приходится не менее 10% случаев всех воспалений легких. Заболеваемости атипичной хламидийной пневмонией наиболее часто подвержены дети и подростки, а также люди пожилого и старческого возраста. Chlamydophila pneumoniae иногда длительно существует в организме, не вызывая инфекционных проявлений.
Диагностика
Физикальные изменения при атипичной хламидийной пневмонии сохраняются 7-10 дней, а рентгенологические – до 12-30 суток. Стетоакустическое обследование выявляет в легких сухие и влажные хрипы. Рентгенологические изменения характеризуются мелкоочаговой и/или интерстициальной инфильтрацией чаще с двух сторон. Присутствие в организме хламидии определяется с помощью культурального, микроскопического, ИФА, ПЦР исследования биологических сред. Наибольшее диагностическое значение при атипичной хламидийной пневмонии имеет определение IgA, IgG, IgM к антигенам белков внешней мембраны.
Лечение
Препаратами этиотропного действия при атипичной хламидийной пневмонии служат тетрациклины и макролиды. Курс терапии должен продолжаться не менее 10-14 дней, поскольку короткие циклы могут способствовать хронизации и рецидивированию пневмохламидиоза. В некоторых случаях прибегают к назначению фторхинолонов (спарфлоксацина, офлоксацина и др.), доксициклина.
Атипичная легионеллезная пневмония
Симптомы
Атипичная легионеллезная пневмония встречается преимущественно среди лиц среднего и пожилого возраста. К ее возникновению предрасполагает курение, иммуносупрессия, хроническая почечная недостаточность. Инфекция чаще развивается в летние месяцы и регистрируется в виде спорадических случаев или массовых вспышек. Данная форма атипичной пневмонии протекает по типу долевой пневмонии, с вовлечением в патологический процесс терминальных бронхиол и альвеол, массивной экссудацией и выраженным отеком интерстициальной ткани в зоне поражения.
Атипичная легионеллезная пневмония имеет тяжелое клиническое течение. Симптоматика характеризуется подъемом температуры в течение 24-48 ч до 40°С и выше, сильнейшими ознобами и головной болью. Одновременно присоединяется кашель: вначале сухой, затем – с отделением слизистой или слизисто-гнойной мокроты. В 20% случаев отмечается кровохарканье. Общая картина отягощается одышкой, мышечными и плевральными болями, тошнотой, рвотой, диареей, тахикардией, абдоминальными болями. Наиболее грозными осложнениями атипичной легионеллезной пневмонии служат дыхательная недостаточность и вторичная почечная недостаточность, приводящие к гибели больных.
Диагностика
При диагностике атипичной легионеллезной пневмонии учитываются эпидемиологические данные, тяжелое клиническое течение пневмонии, результаты инструментальных и лабораторных исследований. При аускультации в легких выслушиваются влажные хрипы. С помощью рентгенографии (КТ, МРТ легких) определяются округлые инфильтраты, занимающие не менее одной доли легкого и имеющие тенденцию к слиянию. У трети пациентов выявляется плеврит с небольшим количеством плеврального выпота.
Как правило, посев крови и мокроты на наличие легионелл дает отрицательный результат. Диагноз атипичной легионеллезной пневмонии удается подтвердить путем посева на специальные среды трахеального аспирата, лаважной жидкости, плеврального выпота. С целью получения необходимого биологического материала проводится трахеальная аспирация, бронхоскопия с забором мокроты, бронхоальвеолярный лаваж, плевральная пункция. Также используется РИФ, ИФА диагностика.
Лечение
Прогрессирующее ухудшение состояния при атипичной пневмонии, вызываемой легионеллой, часто диктует необходимость перевода пациента на ИВЛ. Клиническое улучшение, как правило, появляется на 4-5 сутки после начала интенсивного применения антибиотиков (эритромицина, рифампицина, доксициклина, ципрофлоксацина). Лихорадка при атипичной легионеллезной пневмонии в среднем продолжается около 2-х недель; разрешение инфильтратов в легочной ткани занимает до 1 мес. В некоторых случаях после атипичной пневмонии остаются участки ограниченного пневмосклероза в легких. Реконвалесценция протекает медленно, длительно сохраняется слабость и утомляемость.
Атипичная пневмония (тяжелый острый респираторный синдром)
Симптомы
Атипичная пневмония – малоизвестная форма острой респираторной инфекции, поражающей нижние дыхательные пути. Известно, что возбудителями атипичной пневмонии является ТОРС (SARS)-коронавирус, входящий в семейство Сoronaviridae. В настоящее время продолжается эпидемиологическое, лабораторное и клиническое изучение ТОРС-коронавируса. Большинство заболевших атипичной пневмонией в 2002-2003 г.г. составили лица 25-70 лет; отмечены единичные случаи заболеваемости детей до 15 лет. Основной механизм передачи коронавируса - воздушно-капельный, однако выявление возбудителя в моче и фекалиях не исключает возможности фекально-орального заражения.
Инкубационный период при атипичной пневмонии составляет 2-7, в отдельных случаях - 10 дней. Вначале симптомы атипичной пневмонии малоспецифичные: заболевание манифестирует с высокой лихорадки (выше 38°С), которая сопровождается ознобами, потливостью, головными болями, миалгией. В ряде случаев на высоте лихорадочного состояния отмечается рвота и диарея.
На 3-7 сутки атипичной пневмонии развивается сухой кашель, одышка, прогрессирующая гипоксемия. Нарастающая гипоксия сопровождается цианозом носогубного треугольника, тахикардией, глухостью сердечных тонов, гипотонией. В последующие 6-7 суток у части пациентов наблюдается улучшение самочувствие и стихание симптоматики; в других случаях - развивается респираторный дистресс-синдром, требующий перехода к ИВЛ. В последней группе пациентов отмечается высокая летальность от токсико-инфекционного шока, острой дыхательной и сердечной недостаточности, сопутствующих осложнений.
Диагностика
Отсутствие достоверных диагностических тест-систем тяжелого острого респираторного синдрома и сложность дифференциальной диагностики заболевания в начальном периоде, диктует необходимость предполагать атипичную пневмонию у пациентов, посещавших в течение 10 дней эпидемически неблагополучные районы, а также лиц, страдающих лихорадочным состоянием с симптомами респираторного поражения.
Аускультативно при атипичной пневмонии определяется ослабление дыхания, крепитация, влажные мелкопузырчатые хрипы. При перкуссии выявляется притупление легочного звука. Рентгенологически в разгар атипичной пневмонии обнаруживаются двусторонние внутритканевые инфильтраты на периферии легочных полей. В лабораторных тестах крови выявляется лимфопения, тромбоцитопения, повышение уровня печеночных ферментов, изменение газового состава крови (снижение насыщения крови О2). Для идентификации возбудителя атипичной пневмонии используются ИФА, РИФ, молекулярные тесты.
Лечение
Поскольку атипичная пневмония является новым и малоизученным заболеванием, эффективной этиологической терапии пока не разработано. Согласно рекомендациям ВОЗ, при атипичной пневмонии необходимо включение в схему лечения нескольких противомикробных препаратов (фторхинолонов, ß-лактамов, цефалоспоринов, тетрациклинов). Данные меры позволяют предупредить наслоение бактериальной инфекции.
Прогноз и профилактикаи
Прогноз атипичной пневмонии зависит от формы заболевания: при микоплазменной и хламидийной пневмонии он, как правило, благоприятный для жизни; при легионеллезной и особенно ТОРС-инфекции – очень серьезный. С целью профилактики заражения и распространения атипичной пневмонии ВОЗ рекомендует воздерживаться от посещения эпидемически неблагоприятных регионов; установить строгий эпидконтроль лиц, прибывающих из данных районов; проводить дезинфекцию транспортных средств; использовать индивидуальные маски однократного применения при необходимости контакта с пациентами, подозрительными в отношении инфекции. В настоящее время работа по созданию эффективной вакцины и специфических тестов ранней диагностики атипичных пневмоний продолжается.
2. Современные подходы к диагностике атипичных пневмоний/ Тартаковский И.С.// Клиническая микробиология и антимикробная химиотерапия – 2000 - Том 2, № 1.
3. Атипичная пневмония - значимая проблема детского возраста/ Горбич О. А.// Медицинский журнал. - 2016. - № 3.
Атипичная пневмония при выявленном возбудителе встречается в 7–20% внебольничной пневмонии. C учетом пациентов без четкой клинической симптоматики и при отсутствии идентификации возбудителя этот процент может быть выше.
Серологические исследования у амбулаторных больных с клиникой респираторной инфекции выявляют достоверное повышение титра антител к:
- Mycoplasma pneumoniae, как единственному возбудителю – в 22,8% случаев
- Chlamydia pneumoniae – в 10,7%
- Legionella – в 0,7%
- M. pneumoniae + C. pneumoniae – в 3,4%.
Этиологический агент не был верифицирован в 48,3% случаев, в остальных случаях выявлены типичные возбудители. Подобные результаты получены и среди госпитализированных пациентов: из 1300 случаев M. pneumoniae выявлялась в 5%, а в группе пожилых больных – в 9%.
Микоплазменная инфекция
Всего существует 120 видов микоплазм, входящих в класс Mollicutes, но только 13 видов микоплазм, 2 вида ахолеплазм и 1 вид уреаплазм были выделены от человека. В развитии патологии человека участвуют 3 вида:
- Mycoplasma pneumoniae
- Mycoplasma hominis
- Ureaplasma urealyticum.
Микоплазменная инфекция проявляется следующими клиническими формами:
Как при естественном, так и при экспериментальном заражении после инкубационного периода в 3–11 дней заболевают 40–90% пациентов. Невосприимчивые к микоплазме пациенты выделяют возбудитель и могут служить источником инфекции в течение нескольких недель. У них закономерно формируется рост титра антител без клинических симптомов заболевания. Пневмония и бронхит наиболее характерны для инфекции M. pneumoniae.
Микоплазмы растут в аэробных и анаэробных условиях на средах с добавлением сыворотки. Внутриклеточный паразитизм обеспечивается специализированными органеллами, обеспечивающими взаимодействие с клетками-мишенями хозяина. Существуя в виде филаментных форм, они продуцируют белки, тропные к мембранам эпителиальных клеток респираторного тракта. После контакта с эпителиальной клеткой М. pneumoniae производит пероксид водорода и суперокcид, повреждающие клетки реснитчатого эпителия. Но есть механизмы в патогенезе, не связанные с непосредственным действием инфекционного агента, а опосредованные патоиммунологическими реакциями на внедрение микоплазменных антигенов. Антитела к гликолипидному антигену могут действовать, как аутоантитела в перекрестных реакциях с эритроцитами и клетками головного мозга.
Эпидемиология
Заражение происходит воздушно–капельным путем, источником является инфицированный человек. Инкубационный период до 3–х недель. Обычная сезонность – осенне–зимний период, но сохраняется возможность заражения в течение всего года.
Наиболее высока заболеваемость в организованных коллективах и семьях. Формирующийся иммунитет непродолжителен.
Клинические симптомы
Часто микоплазменная инфекция протекает бессимптомно и выявляется только при обнаружении сероконверсии. При развитии поражения дыхательных путей жалобы пациента часто не соответствуют скудным объективным данным. Начало постепенное, с головных болей, недомогания, лихорадки, не достигающих высокой степени выраженности.
Симптомы поражения дыхательных путей
- Кашель от сухого, надрывного до продуктивного со светлой мокротой. Кашель – самый частый симптом при поражении респираторного тракта. У больных с микоплазменной инфекцией кашель присутствует всегда, но среди кашляющих всего 3–10% больных пневмонией.
- Одышка – довольно редкий симптом, если она возникает, то выражена слабо.
- Лихорадка – характерный симптом микоплазменной инфекции – не достигает высокой степени выраженности. В основном нет соответствия между лихорадкой и рентгенологической картиной и анализами крови.
- Симптомы фарингита у 6–59%.
- Ринорея у 2–35%.
- Боли в ухе (мирингит) у 5%.
- Бессимптомный синусит.
- При физикальном обследовании выявляются невыраженные хрипы (сухие или влажные мелкопузырчатые), перкуторно чаще всего изменений не обнаруживают.
Внелегочные проявления микоплазменной инфекции
- Гемолиз, сопровождающийся повышенными титрами холодовых агглютининов
- Катаральный панкреатит
- Катаральный менингит, менингоэнцефалит, нейропатия, церебральная атаксия
- Макуло–папулезные поражения кожи (описывается связь с синдромом Стивенса–Джонсона)
- Миокардит (не часто)
- Гломерулонефрит (не часто)
- Миалгии, артралгии (без картины истинного артрита).
- Рентгенологическое обследование чаще всего выявляет усиление легочного рисунка, характерное для перибронхиальнной инфильтрации, но могут быть очаговые инфильтраты, дисковидные ателектазы, увеличение лимфоузлов корня легкого, плеврит.
- Лабораторные данные: гемолитическая анемия с повышением титров холодовых агглютининов и ретикулоцитозом. Лейкоцитоз не отмечается. Тромбоцитоз возможен, как ответ на анемию.
- Спинномозговая жидкость: лимфоцитоз с повышенным уровнем белка.
- Иммунологическая диагностика: определение титров противомикоплазменных антител (IgM, IgG). Положительный результат: исходное повышение титров антител >=1:32 или 4–х кратное увеличение в динамике. Появление антител отмечается к 7–9 дню, а максимум – к 3–4 неделе заболевания. Определение антигенов (максимально достоверные результаты в течение одной недели от начала болезни).
- Полимеразная цепная реакция основана на определении специфической ДНК микоплазмы пневмонии. Чувствительность метода – 93%, специфичность – 98%.
Так как в большинстве клинических ситуаций на момент начала лечения возбудитель неизвестен, то при подозрении на атипичные пневмонии эмпирически назначают макролиды, тетрациклины и фторхинолоны.
Эффективен эритромицин в дозе 1 г каждые 6 часов. Азитромицин имеет преимущества перед эритромицином и кларитромицином. Может применяться доксициклин в суточной дозе 100 мг, в том числе и как второй антибиотик при атипичных пневмониях. Возможно назначение фторхинолонов (спарфлоксацин 400 мг в первые сутки, затем по 200 мг в сутки, ципрофлоксацин).
Кортикостероиды и противовоспалительные препараты назначаются при гемолизе, поражении центральной нервной системы. Возможно проведение плазмафереза при этих осложнениях, но убедительных доказательств его эффективности пока не получено.
Хламидийная инфекция
Хламидии – внутриклеточные возбудители, чаще всего поражающие глаза, органы мочеполовой системы и органы дыхания. Хламидии отличаются от других прокариотов размером генома (600 миллионов дальтонов) и в этом отношении могут быть сравнимы только с микоплазмами. Они не содержат пептидогликаны в клеточной стенке. Цикл роста микроорганизма сложный, двухфазный, состоящий из 2 различных форм: элементарной и ретикулярной. Ретикулярная – это форма, в которой бактерии размножаются, располагается внутриклеточно. После внутриклеточного деления ретикулярных форм образующиеся промежуточные формы, покидая клетки, превращаются в элементарные формы, которые вновь проникают в клетки хозяина и продолжают цикл своего развития. Вне клеток хозяина хламидии существуют в виде элементарных форм.
Разновидности хламидий
- C. trachomatis, вызывающая трахому, венерический лимфогранулематоз и урогенитальную патологию,
- C. pneumoniae, вызывающая патологию респираторного тракта,
- C. psittaci, вызывающая пситтакоз.
Воспалительные реакции связаны с действием самого инфекционного агента и различных иммунопатологических механизмов. Одним из интригующих моментов патогенеза хламидийной инфекции является предполагаемая связь с атеросклерозом и ишемической болезнью сердца.
C. рneumoniae – наиболее частый возбудитель из хламидий, выявляемых при патологии человека. Инфекция C. pneumoniae – широко распространенная инфекция, поражающая взрослых и детей (до 100 случаев на 100 тыс. населения). Наряду с микоплазменной и легионелллезной инфекцией относится к атипичным пневмониям. Чаще поражает пациентов в пожилом возрасте (в отличие от микоплазмы пневмонии, которая встречается у людей до 30–35 лет). Наиболее часто инфекция C. pneumoniae встречается у людей в возрасте 65–79 лет.
Клинические проявления
Инфекция C. pneumoniae часто протекает бессимптомно или малосимптомно, но возможны варианты тяжелого течения атипичной пневмонии.
Симптомы поражения респираторной системы
- Кашель сухой или со светлой мокротой
- Интоксикация различной степени выраженности
- Боли в грудной клетке
- Умеренно выраженные сухие или влажные хрипы.
Внелегочные проявления
- Менингоэнцефалит
- Guillain–Barrе синдром
- Реактивный артрит
- Миокардит
Диагноз основывается на эпидемиологических, клинических данных и доказывается лабораторными методами.
Объективные методы обследования
- Рентгенологическое обследование: усиление легочного рисунка или локальная субсегментарная инфильтрация.
- Лабораторные данные: нормальный анализ крови.
- Определение антител (реакции связывания комплемента и микроиммунофлюоресценция).
- Определение антигена (иммунофлюоресценция и иммуноферментный метод).
- Полимеразная цепная реакция.
Иммунофлюоресценция и полимеразная цепная реакция могут быть использованны для диагностики с чувствительностью 76% и специфичностью 99%.
Несмотря на диагностические возможности, в большинстве случаев проводится эмпирическая терапия. Тактика лечения не связана с воздействием на отдельный микроорганизм, и предусматривает весь спектр атипичных возбудителей. Поэтому макролиды (эритромицин 4 г в сутки, азитромицин 500 мг в сутки и кларитромицин) являются препаратами выбора. При необходимости добавляют доксициклин 100 мг в сутки, возможно применение фторхинолонов, особенно при подозрении на легионеллезную инфекцию (спарфлоксацин и др.).
Легионеллезная инфекция
Легионелла была идентифицирована в 1976 г. во время вспышки заболевания пневмонией среди участников съезда американских легионеров.
Было установлено, что клинически легионеллез может проявляться в виде 2–х основных форм:
- болезнь легионеров – пневмония, вызванная легионеллой;
- Понтиакская лихорадка (протекает без локальных симптомов с головной болью, повышением температуры, недомоганием и проходит без лечения). Смертность при внебольничной легионеллезной пневмонии достигает 16–30% при отсутствии лечения или при назначении неэффективных антибиотиков, а при госпитальной – до 50%.
Клинические симптомы пневмонии, не имеющие особенностей, в сочетании с гастроинтестинальными симптомами составляют клиническую картину болезни легионеров. Инкубационный период составляет 2–10 дней. Заболевание начинается с интоксикационного синдрома, затем присоединяются локальные симптомы: кашель со скудной мокротой (иногда окрашенной кровью, реже выраженное кровохарканье), боли в грудной клетке.
Клинические симптомы пневмонии, не имеющие особенностей, в сочетании с гастроинтестинальными симптомами составляют клиническую картину болезни легионеров. Инкубационный период составляет 2–10 дней. Заболевание начинается с интоксикационного синдрома, затем присоединяются локальные симптомы: кашель со скудной мокротой (иногда окрашенной кровью, реже выраженное кровохарканье), боли в грудной клетке.
Частота отдельных симптомов при легионеллезной пневмонии:
Клиническая картина тяжелой пневмонии при соответствующем эпиданамнезе и высокой лихорадке может свидетельствовавть о легионеллезной инфекции, а при присоединении желудочно–кишечных симптомов достоверность такого диагноза увеличивается.
Внелегочные проявления
Редко встречаются, но возможны: эндокардит, миокардит, перикардит, синусит, парапроктит, панкреатит, перитонит, пиелонефрит (особенно у больных с иммунодефицитом).
Признаки, характерные для болезни легионеров
- Присутствие желудочно–кишечных симптомов, особенно диареи.
- Окраска мокроты по Граму: нейтрофилез и грамотрицательные палочки.
- Гипонатриемия.
- Отсутствие эффекта от бета–лактамов и аминогликозидов.
Объективные методы обследования
- При рентгенологическом исследовании выявляют инфильтративные тени со склонностью к слиянию, усиление легочного рисунка, симптомы экссудативного плеврита. Рентгенологические изменения видны к 3–му дню, а при обратном развитии несколько отстают от клиники и нормализуются не ранее, чем через месяц.
- Клинический анализ крови: лейкоцитоз со сдвигом формулы влево, повышение СОЭ, относительная лимфопения, тромбоцитопения.
- Клинический анализ мочи: гематурия, протеинурия.
- Гипонатриемия, гипофосфатемия.
- Посев на селективные среды (чувствительность до 80%).
- Определение антигена в моче иммуноферментным анализом (чувствительность 70%, специфичность до 100%)
- Иммунофлюоресценция для определения антигена в мокроте (чувствительность 50–70%)
- Определение антител в крови – увеличение титров 4–х кратное ко 2–й неделе болезни или исходно в 2 раза, или при одновременном повышении титров иммуноглобулинов М и G (чувствительность 72%)
- Полимеразная цепная реакция – теоретически перспективное исследование, но пока без практического применения.
При выборе антибиотика были выявлены несоответствия результатов чувствительности легионеллы in vivo и in vitro, что связано с особенностями роста легионеллы на средах и внутриклеточным расположением в организме. Наиболее эффективными являются антибиотики, создающие высокую внутриклеточную концентрацию: макролиды, фторхинолоны, тетрациклины, рифампицин. Современные макролиды (азитромицин, кларитромицин) являются антибиотиками выбора для лечения легионеллезной инфекции, благодарая следующим свойствам:
- высокая внутриклеточная концентрация
- преимущественная концентрация в ткани легкого, фагоцитах и альвеолярных макрофагах
- однократный или двукратный прием в сутки
- низкая токсичность по отношению к желудочно–кишечному тракту.
Высокую активность против легионеллы показали новые хинолоны (спарфлоксацин и др.). Спарфлоксацин – дифторхинолон, который благодаря своей химической структуре приобрел высокую активность против грамположительных возбудителей по сравнению с монофторхинолонами (ципрофлоксацин и др.), сохранив активность в отношении грамотрицательной флоры. Спарфлоксацин назначают 400 мг per os в первые сутки, затем по 200 мг в сутки. Препарат в отличие от других фторхинолонов не влияет на фармакокинетику теофиллина, что позволяет назначать его больным бронхиальной астмой и хроническим обструктивным бронхитом, длительно получающим препараты теофиллина.
Также могут быть использованы тетрациклин, доксициклин, триметоприм/сульфаметоксазол. При необходимости монотерапия макролидами может быть усилена рифампицином. Длительность лечения составляет 10–14 дней, в случае азитромицина – 7–10 дней и до 21 дня у пациентов с иммунодефицитом.
Частота пневмонии, вызванной атипичными возбудителями (микоплазмами, хламидиями и легионеллами), составляет 20% и более среди всех внебольничных пневмоний. Поэтому для проведения эмпирической терапии внебольничной пневмонии при неизвестном возбудителе рекомендуется использовать комбинацию бета–лактамных антибиотиков и макролидов или монотерапию новыми фторхинолонами (спарфлоксацин и др.). Эти препараты обладают широким спектром противомикробной активности, включающим кокковую флору, грамотрицательные и атипичные возбудители.
Читайте также:

