Микотические аневризмы при инфекционном эндокардите это
Обновлено: 25.04.2024
Возникновение аускультативной картины клапанного порока - недостаточности пораженного клапана или изменение характера шума у больного с ранее имевшимся пороком сердца.
По мере присоединения иммунопатологических реакций у части больных появляются признаки миокардита, который проявляется болями в груди, сердцебиением, перебоями в работе сердца. Объективное исследование выявляет изменение границ сердца, глухость тонов, появляется картина сердечной недостаточности.
У части больных ИЭ развивается инфаркт миокарда, причиной которого является коронарит или эмболия коронарных артерий. Клинические признаки соответствуют картине острого инфаркта миокарда.
Абсцесс створок, фиброзного клапанного кольца и абсцесс миокарда часто являются находками при ЭХОКГ - исследовании или во время аутопсии. Только при деструкции створок и фиброзного кольца возникает картина выраженной клапанной регургитации, нередко с проявлениями также и острой сердечной недостаточности.
Отрыв хорд отрыв папиллярных мышц - в клинической картине преобладают признаки клапанной регургитации и выраженные симптомы острой сердечной недостаточности, появляющиеся сразу после отрыва указанных внутрисердечных структур.
Признаки перикардита. Перикардит у больных ИЭ может быть фибринозным, выпотным; реже выпот может носить гнойный характер
Внесердечные проявления иэ
Поражение почек при инфекционном эндокардите.
Проявления почечной патологии практически однотипны: протеинурия, гематурия, нефритический синдром, реже нефротический синдром и артериальная гипертензия. Наиболее часто
Почечная недостаточность при ИЭ обычно возникает вследствие иммунокомплексного диффузного ГН, реже относится к проявлениям нарушенной гемодинамики или токсичности, связанной с антибиотикотерапией (интерстициальный нефрит или повреждение, индуцированное аминогликозидами). Частота развития почечной недостаточности при ИЭ оценивается довольно противоречиво - от 5% до 50% в разных группах больных. По данным S.Mouli и соавт., почечная недостаточность занимает второе по частоте место среди осложнений ИЭ после сердечной недостаточности. В большинстве исследований, анализирующих исходы ИЭ, почечная недостаточность рассматривается, как один из предикторов неблагоприятного исхода и внутрибольничной летальности. Наиболее высокая летальность от почечной недостаточности отмечается у больных с септическим синдромом или после сердечно-сосудистой хирургии.
Клинически ГН при ИЭ диагностируется реже, чем на секции.
Вторичный амилоидоз почек - редкое осложнение современного ИЭ - следует подозревать у больных с длительно текущим ИЭ с выраженной протеинурией, ухудшением функции почек, особенно в случаях увеличения размеров почек, для диагностики рекомендуется бипсия почек.
У больных ИЭ также могут наблюдаться лекарственные нефропатии, вызванные антибиотикотерапией, особенно аминогликозидами. Антибактериальная терапия при ИЭ с поражением почек предполагает исключение нефро-токсических антибиотиков, а при почечной недостаточности - уменьшение доз и кратности их введения.
При ИЭ довольно часто наблюдаются эмболии почечных сосудов с развитием инфарктов почек, микотических аневризм почечных артерий, абсцессов почек. Тромбоэмболии артерий почек возникают у 5—17% больных. Внезапные односторонние боли в пояснице и животе, макрогематурия, болезненность при поколачивании по пояснице становятся нередко причиной ошибочного диагноза почечной колики или пиелонефрита при наличии лихорадки. Ультразвуковое исследование и компьютерная томография почек выявляют инфаркты почек. Поражение почек в настоящее время не является главной причиной смертности больных ИЭ, но имеет неблагоприятное прогностическое значение. Причиной уменьшения частоты поражения почек следует считать раннее антибактериальное лечение и сокращение вследствие этого длительности заболевания.
Поражения кожи при инфекционном эндокардите.
Поражения глаза при инфекционном эндокардите.
Типично включают точечные конъюнктивальные кровоизлияния (пятна Лукина), которые наблюдаются у 24-76,8% больных ИЭ, обычно в первую неделю госпитализация, пятна Рота - ретинальные кровоизлияния, выявляющиеся при фундоскопии у 2,5—5,5% больных.
Костно-мышечные проявления при инфекционном эндокардите.
Симптомы поражения костно-мышечной системы, наблюдающиеся по разным данным у 15-62,8% больных, типичны для ИЭ. Артралгии и реже встречающиеся моно- олигоартриты (преимущественно голеностопных и коленных суставов), единичные случаи сакроилеита, являются преимущественно иммунными проявлениями заболевания. Артралгии быстро проходят на фоне адекватной антибактериальной терапии ИЭ и не требуют, как правило, дополнительного лечения.
Тромбогеморрагические осложнения инфекционного эндокардита
Тромбоэмболии (ТЭ), как и кровоизлияния, прежде всего в центральную нервную систему, оказывают значительное влияние на прогноз заболевания.
На частоту тромбоэмболических осложнений оказывают влияние три группы факторов:
локализация инфекционного очага на клапанах сердца,
размеры и подвижность вегетации.
Чаще всего ТЭ наблюдаются при стафилококковом ИЭ (44,7-55%).
Поражение нервной системы при ИЭ.
Неврологические осложнения при ПИЭ встречаются у 18 - 45% больных. Среди всех тромботйческих/тромбоэмболических проявлений на долю поражения центральной нервной системы приходится до 52-72%. Если анализировать структуру неврологических осложнений, опираясь на результаты многочисленных исследований, основную их часть составляют ишемические повреждения (до 90%), меньшую - кровоизлияния различного характера (до 10-20%). Неврологические осложнения могут быть первым проявлением ИЭ в 10-15% случаев.
Поражение селезенки.
Частота развития инфарктов селезенки колеблется от 12,7 до 46%, а ее абсцессов - до 6%. Редко инфаркт селезенки, как и ее разрыв, может быть первым клиническим проявлением ИЭ. Эмболии в артерии конечностей возникают в 8,9-16,3% случаев, эмболический инфаркт миокарда диагностируют у 3-6,9%) больных. В последние годы отмечается возрастание.
Частота развития инфарктов селезенки колеблется от 12,7 до 46%, а ее абсцессов - до 6%. Редко инфаркт селезенки, как и ее разрыв, может быть первым клиническим проявлением ПИЭ. эмболический инфаркт миокарда диагностируют у 3-6,9% больных. В последние годы отмечается возрастание частоты легочно-плевральные осложнений не только при правосторонней локализации ИЭ, но и при левосторонней.
Микотическая аневризма редкое осложнение ИЭ, развивающееся в результате прямой инвазии стенки артерии микроорганизмами с инфицированных эмболов, эмболической окклюзии vasa vasoru mили отложения иммунных комплексов в сосудистой стенке с развитием локального иммунного воспаления и ослабления артериальной стенки. Различают внутричерепную и экстракраниальную локализацию микотических аневризм. Чаще микотическая аневризма развивается в артериях головного мозга, преимущественно в дистальных ветвях средней мозговой артерии. Экстракраниальные микотические аневризмы выявляют в 2-5% случаев ИЭ, чаще в артериях конечностей.
Возможности диагностики микотической аневризмы определяются ее локализацией и размерами: внечерепное расположение облегчает обнаружение при пальпации, ультразвуковом и ангиографическом исследованиях. Нередко первым проявлением аневризмы бывает кровотечение из-за разрыва. При лечении антибиотиками примерно в трети случаев микотические аневризмы исчезают. В последние годы стало возможным превентивное хирургическое лечение церебральных и экстрацеребральных микотических аневризм, ведущее к снижению летальности.
Периферические абсцессы.
Чаще возникают у больных ИЭ с положительной гемокультурой. Острый стафилококковый ИЭ часто осложняется метастатической инфекцией - центральной нервной системы, сердца, легких, почек, суставов и другой локализации.
Проявления собственно инфекции и системного воспаления в клинике современного ИЭ сохраняют диагностическое значение независимо от формы болезни. Повышение температуры до фебрильных цифр, ознобы наряду с кардиальными проявлениями ИЭ относятся к наиболее чувствительным признакам заболевания. Часто наблюдаются спленомегалия (21-77,5%) и нормохромная анемия (70—87,5%). При значительной лихорадке и выраженных инфекционно-токсических проявлениях заметна потеря массы тела больных, что в сочетании с анемией, повышением СОЭ нередко направляет на ложный путь поиска онкологической патологии (хотя у пожилых больных мы неоднократно наблюдали сочетание ИЭ с онкологическими и лимфопролиферативными заболеваниями).
В качестве справочной информации ниже приведена частота встречаемости основных клинических симптомов ИЭ (Е. Braunwald,Heartdisease, 5-thEd. 1997):
Классификация аневризм артерий головного мозга по размерам:
- ≤6 mm — маленькая
- 7 to 12 mm — средняя
- 13 to 24 mm — большая
- ≥25 mm — гигантская
Если аневризма располагается дистальнее первой бифуркации артерий виллизиева круга, следует подозревать микотическую аневризму. Необходимо помнить также о возможности бактериального эндокардита, сопровождающегося эмболиями и исследовать культуры крови. Если такие аневризмы локализуются в артериальной сети более дистально (полушария мозжечка, кортикальная поверхность), они редко являются источниками значительных количеств свернувшейся крови в базальных цистернах.
Выраженного церебрального вазоспазма при разрывах микотических аневризм почти никогда не наблюдается. Однако микотические аневризмы подвержены повторному разрыву. Хотя антибиотикотерапия может снизить угрозу повторного кровоизлияния, окончательным методом лечения является хирургическая облитерация. Ее следует проводить несмотря на то, что пациент получает антибиотики по поводу предполагаемого или действительного бактериального эндокардита.
На выполненной ангиографии артерий головного мозга в боковой проекции показана микотическая аневризма в теменно-затылочной области.
Причиной появления микотических аневризм сосудов головного мозга является переносная инфекция (бактериальный эндокардит). Бактериальный эмбол с током крови заносится в артериальное русло головного мозга и вызовет закупорку одной из ветвей его артерий. В стенке артерии начинается инфекционный процесс, приводящий в дальнейшем к формированию микотической аневризмы. Вильям Ослер (William Osler) первым ввёл понятие и описал микотическую аневризму в 1885 году на лекции по аневризме аорты у пациента с бактериальным эндокардитом. Это название в дальнейшем стало применятся ко всем аневризмам, возникающим после бактериальной инфекции в стенке сосуда, включая аневризмы артерий головного мозга.
При бактериальном эндокардите септический эмбол вызывает воспаление и разрушение стенке артерии головного мозга. Пока нет точных данных о механизме возникновения микотической аневризмы в артерии мозга. По одной теории аневризма формируется в следствии разрушения инфекцией внутреннего (эндотелия) и мышечного слоя артерии непосредственно из просвета сосуда, по другой — из сосудов питающих стенку артерии (vasa vasorum).
Микотические аневризмы артерий мозга выявляются в 2-10% случаев заболевания бактериальным эндокардитом и насчитывают 2,5-6,2 % от всего количества случаев встречаемых аневризм мозга. Три четверти от всех микотических аневризм артерий мозга поражают среднюю мозговую артерию, оставшаяся четверть — остальные артерии. Микотические аневризмы как правило формируются в вышележащих (дистальных) ветвях сосудов мозга, в отличие от мешковидной аневризмы, которая чаще всего встречается в нижележащих (проксимальных) ветвях артерий возле Виллизиева круга.
Микотическая аневризма артерии мозга формируется в течении 1 месяца с момента бактериальной эмболии её просвета. Стрептококк и стафилококк — это бактерии, которые чаще всего вызывают бактериальный эндокардит, и несущие ответственность за возникновение микотических аневризм сосудов мозга.
Кровоизлияния в полости черепа, как внутримозговые так и субарахноидальные, встречаются у 2,7-7% пациентов с бактериальным эндокардитом и обычно вызваны разрывом микотической аневризмы. Для больных с неразорвавшейся микотической аневризмой уровень смертности составляет 30%. После разрыва микотической аневризмы смертность достигает 80%.
Диагностика микотической аневризмы артерий мозга
Так как высок риск смертности пациентов при разрыве таких аневризм, рекомендована повторная ангиография артерий мозга в динамике каждые 2 недели в процессе антибактериальной терапии до момента разрешения аневризмы или принятия решения об оперативном вмешательстве.

На МРТ головного мозга показана микотическая аневризма в правой теменно-затылочной области головного мозга на фоне гидроцефалии (расширены боковые желудочки).
Однажды идентифицированную микотическую аневризму на селективной ангиографии в последующем можно отслеживать при магниторезонансной (МРТ) или спирально компьютерной томографии (СКТ) сосудов головного мозга. Данные методы томографии являются альтернативой и используются для безопасного мониторинга и определения размеров аневризмы у пациента в процессе лечения антибиотиками.
Лечение микотической аневризмы артерий мозга
Вопрос лечения больных с микотической аневризмой остаётся спорным. Некоторые врачи утверждают, что необходима нейрохирургическая операция. Другие рекомендуют наблюдение за пациентом с выполнений серии ангиограмм на фоне антибактериальной терапии и откладывают оперативное выключение аневризмы, если она не исчезает или увеличивается, не смотря на применяемые антибиотики.
Пациентов с неразорвавшиеся микотические аневризмы артерий мозга часто можно успешно лечить при помощи антибактериальной терапии. При разорвавшиеся аневризме лечение будет хирургическим. Традиционно нейрохирургическое лечение при микотической аневризме состоит в её выключении из кровотока и последующем удалении. Внутрисосудистая техника включает в себя введение в просвет аневризмы специального клея или отделяемой спирали.
Внутрисосудистая операция выключения кровотока в неразорвавшейся микотической аневризме с помощью отсоединяемой спирали.
Клиппирование микотической аневризмы с использованием аппаратов для нейронавигации — это метод, который требует меньших манипуляций на мозге за счёт прямого доступа к аневризме через костное отверстие малого размера (малоинвазивная краниотомия) и минимальное воздействие на кору головного мозга (малоинвазивная кортикотомия) у пациента.
Наблюдений успешного лечения микотических аневризм антибиотиками пока мало. У пациентов может произойти спонтанная закупорка просвета аневризмы намного позже проводимой ему антибактериальное терапии. Так же нет данных, по которым можно чётко определить каким пациентам грозит риск разрыва микотической аневризмы, требующий хирургического лечения.
Ни одно заболевание сердца не может сравниться с инфекционным эндокардитом по частоте, разнообразию и тяжести неврологических осложнений. Не случайно, что более ста лет назад Ослер описал инфекционный эндокардит как триаду, состоящую из лихорадки, сердечного шума и гемиплегии [1]. Инфекционный эндокардит является чрезвычайно тяжелым заболеванием с летальностью, достигающей при консервативном лечении 80% (общая летальность составляет [2, 3]. В настоящее время инфекционный эндокардит вышел на четвертое место по уровню смертности среди инфекционных синдромов после уросепсиса, пневмонии и перитонита и занял нишу социально обусловленных заболеваний [4]. Несмотря на успехи в диагностике и лечении инфекционного эндокардита частота неврологических осложнений заболевания остается в последние три десятилетия на уровне (по нашим данным — около 25%) [5, 6, 7, 8, 9, 10, 11]. Присоединение неврологических осложнений значительно увеличивает летальность. При мозговой эмболии на фоне инфекционного эндокардита она колеблется между 20% и 80% (по нашим данным — около 60%), а в доантибиотическую эру она составляла 100% [5, 11, 12, 13, 14]. Основными этиопатогенетическими факторами при инфекционном эндокардите являются: травма эндокарда, бактериемия и ослабление резистентности организма. Спектр наиболее частых возбудителей и предрасполагающих кардиальных повреждений к настоящему времени претерпел некоторые изменения. Ревматическое заболевание сердца было одним из наиболее распространенных заболеваний сердца, предрасполагающих к эндокардиту (вторичный инфекционный эндокардит), но сейчас чаще развивается первичный инфекционный эндокардит, то есть поражение условно неизмененных клапанов сердца. Вместе с изменениями предрасполагающих условий изменились и возбудители эндокардита. Наиболее частыми остаются стрептококки и стафилококки, однако, частота стрептококковой этиологии снижается, а стафилококковой — растет, кроме того, в последние годы продолжает расти доля энтерококка, а также грамотрицательной флоры, микоплазм, вирусов, грибов, риккетсий, вероятно, вследствие иммуносупрессии, изменения клапанного субстрата и использования антимикробных средств. Неврологические осложнения у больных инфекционным эндокардитом чаще развиваются при поражении золотистым стафилококком [3, 11, 12, 15, 16]. Характерный патологический признак инфекционного эндокардита — это наличие вегетаций на створках клапанов. Вегетации состоят из аморфного фибрина и тромбоцитов вместе с возбудителями и лейкоцитами, являясь, таким образом, инфицированными белыми фибрин-тромбоцитарными тромбами. Возбудители, как правило, локализуются глубоко внутри вегетации и, таким образом, надежно защищены от антибактериальных факторов крови. Для обнаружения вегетаций используют эхокардиографию. Трансэзофагеальная эхокардиография значительно превосходит трансторакальное исследование — чувствительность достигает специфичность — [3]. У обследованных нами пациентов вегетации имели существенные различия: по размеру — от очень мелких до массивных (24 мм); по форме — шаровидные, булавовидные, лентовидные, дольчатые; по характеру прикрепления к клапану — на узком основании, на широком основании; по подвижности — флотирующие, фиксированные; по структуре — рыхлые, организованные. Очень важной является последняя характеристика, поскольку она отражает активность инфекционного процесса в сердце и эмбологенный потенциал вегетаций. Шестидесятиминутный транскраниальный допплеровский мониторинг кровотока по средней мозговой артерии позволяет детектировать микроэмболические сигналы (МЭС) у больных инфекционным эндокардитом. В нашем исследовании все пациенты с МЭС имели свежий инфекционный эндокардит (давность не более 2 месяцев) и рыхлые вегетации по данным эхокардиографии. При давности эндокардита более 2 месяцев МЭС не обнаруживались. Появление МЭС связано с пассажем мелких фрагментов рыхлых клапанный вегетаций, а также агрегатов тромбоцитов, образующихся в турбулентном потоке вблизи пораженного клапана. Неврологические осложнения наиболее часто возникают до начала антибактериальной терапии и в первую неделю ее проведения. В подавляющем большинстве случаев церебральная эмболия развивается в течение первого месяца от момента появления симптомов эндокардита. В этот период вегетации являются рыхлыми и могут легко фрагментироваться, вызывая эмболизацию. Затем в процессе адекватной антибактериальной терапии происходит уплотнение вегетаций. По данным эхокардиографии, выполненной в динамике, вегетации становятся плотными и прочными, они организуются, покрываются эндотелием и уже реже вызывают эмболии. Неврологические осложнения инфекционного эндокардита связаны с количеством, размером, локализацией и инфицированностью эмболов. Пациенты с инфекционным эндокардитом могут переносить инфаркт головного мозга, интрацеребральную и субарахноидальную геморрагию, микотическую аневризму, энцефалопатию, внутримозговой абсцесс, менингит и менингоэнцефалит. Ишемический инсульт является наиболее частой неврологической манифестацией инфекционного эндокардита (по данным литературы — у пациентов с инфекционным эндокардитом, по нашим данным — у 20%). Методы нейровизуализации демонстрируют в большинстве случаев множественные ишемические очаги, из которых примерно половина — корковые, локализующиеся в бассейнах концевых ветвей мозговых артерий, а другая половина представляет собой лакунарные очаги, располагающиеся в глубине полушарий мозга на границе серого и белого вещества. При небольших размерах очагов течение инсульта является достаточно доброкачественным. МРТ является более информативным методом исследования, чем КТ, в выявлении очагового поражения головного мозга у больных инфекционным эндокардитом. Наиболее часто поражается бассейн левой средней мозговой артерии. Церебральная геморрагия имеет место приблизительно у пациентов с инфекционным эндокардитом (по нашим данным — у 5%), чаще при поражении Staphylococcus aureus, и происходит вследствие трех отдельных патофизиологических механизмов. Церебральная септическая эмболия с последующим эрозивным артериитом является причиной и ранней геморрагии, и образования микотических аневризм с их последующим разрывом. Геморрагическая трансформация ишемического инфаркта дополняет данную триаду. Экспериментальные исследования церебральной септической эмболии документируют появление септического артериита в течение 1 дня после эмболии. Считается, что сосудистая деструкция возникает вследствие проникновения микроорганизмов из просвета сосуда в пространства Вирхова-Робена через vasa vasorum окклюзированного сосудистого сегмента. Микроорганизмы затем проникают в адвентицию сосуда, разрушая более медиальные слои до тех пор, пока не достигнут внутренней эластической пластинки. Микотические аневризмы по данным литературы имеют место у 5%-12% пациентов с эндокардитом (по нашим данным — около 1%). Примерно половина микотических аневризм разрывается с развитием интрацеребральной геморрагии или субарахноидального кровоизлияния. Иногда разрыв аневризм происходит спустя месяцы после излечения эндокардита. Летальность при разрыве достигает 80%. У 30% больных при антибиотикотерапии аневризмы подвергаются обратному развитию, а также менее вероятен разрыв аневризмы. Острая энцефалопатия — второе по частоте неврологическое осложнение эндокардита (по данным литературы и нашим данным ее переносят около 20% пациентов с инфекционным эндокардитом). Патофизиологическими механизмами являются мультифокальная септическая микроэмболия с последующим образованием микроинфарктов и микроабсцессов, изменения интракраниальных артерий (периваскулярная пролиферация), мозговая дисциркуляция и интоксикация. Аутопсические исследования пациентов с неврологическими осложнениями эндокардита показывают множественные микроинфаркты у 23%, микроабсцессы — у 26%. Большие абсцессы головного мозга редки. Они имеют место менее чем в 1% случаев при эндокардите. Менингит и менингоэнцефалит развиваются примерно у 4% пациентов с инфекционным эндокардитом, являются, как правило, дебютом заболевания, и поражение клапанов сердца выявляется уже после постановки неврологического диагноза. Таким образом, неврологические осложнения при инфекционном эндокардите представляют собой довольно пеструю картину. Инфекционный эндокардит до сегодняшнего дня остается одним из наиболее трудно диагностируемых заболеваний, несмотря на хорошо известные клинические и лабораторные признаки. Особенно затруднена постановка правильного диагноза в случае дебюта заболевания неврологическими осложнениями. По нашим данным примерно у 10% больных инфекционный эндокардит дебютировал развитием неврологических осложнений в виде ишемического, геморрагического инсультов или субарахноидального кровоизлияния. В этом случае имеются некоторые отличительные особенности течения неврологической патологии, которые позволяют заподозрить инфекционный эндокардит в качестве причинного фактора.
- Начало развития неврологической симптоматики является острым, с захватом нескольких бассейнов кровоснабжения головного мозга. Очаговые симптомы поражения нервной системы часто не достигают выраженной степени. Более часто, чем при инсультах иного генеза, встречается общемозговая симптоматика (головная боль, оглушение и др.).
- При нейровизуализации выявляются множественные инфаркты мозга.
- Часто наблюдается повышение температуры тела еще до развития симптомов поражения нервной системы.
- При лабораторных исследованиях выявляется: снижение уровня гемоглобина, снижение количества эритроцитов, лейкоцитоз, увеличение СОЭ.
- При УЗИ часто обнаруживается увеличение селезенки.
- При эхокардиографии выявляются клапанные вегетации.
СПИСОК ЛИТЕРАТУРЫ
- Osler W. Gulstonian lectures on malignant endocarditis // Lancet.- 1885.- Vol. 1.- P.
- Шевченко Ю.Л. Хирургическое лечение инфекционного эндокардита.- СПб.: Наука, 1995.- 230 с.
- Mylonakis E., Calderwood S.B. Infective endocarditis in adults // N. Engl. J. Med.- 2001.- Vol. 345.- P.
- Bayer A.S., Bolger A.F., Taubert K.A., et al. Diagnosis and management of infective endocarditis and its complications // Circulation.- 1998.- Vol. 98.- P.
- Arauz-Gongora A.A., Souta-Meirino C.A., Cotter-Lemus L.E., et al. The neurological complications of infectious endocarditis // Arch. Inst. Cardiol. Mex.- 1998.- Vol. 68.- P.
- Jones H.R., Siekert R.G., Ceraci J.E. Neurologic manifestations of bacterial endocarditis // Ann. Int. Med.- 1969.- Vol. 71.- P.
- Millaire A., Leroy O., Gaday V., et al. Incidence and prognosis of embolic events and metastatic infections in infective endocarditis // Europ. Heart J.- 1997.- Vol. 18.- P.
- Pruitt A.A., Rubin R.H., Karchmer A.W., Duncan G.W. Neurologic complications of bacterial endocarditis // Medicine.- 1978.- Vol. 57.- P.
- Salgado A.V., Furlan A.J., Keys T.F., et al. Neurologic complications of endocarditis: A experience // Neurology.- 1989.- Vol. 39.- P.
- Кузнецов А.Н. Кардиогенная и артерио-артериальная церебральная эмболия: Этиология, патогенез, клиника, диагностика, лечение и профилактика: Автореф. дис. : д-ра мед. наук.- СПб., 2001.- 32 с.
- Климов И.А. Автореф. Дис.
- Heiro M., Nikoskelainen J., Engblom E., et al. Neurologic manifestations of infective endocarditis: A experience in a teaching hospital in Finland // Arch. Intern. Med.- 2000.- Vol. 160.- P.
- Herrschaft H. Herzkrankheiten als Ursache zerebraler Symptome und Syndrome // Fortschr. Neurol. Psychiatr.- 1990.- Jg.58.- S.
- Rabinovich S., Evans J., Smith J.M., January L.E. A long term view of bacterial endocarditis: 337 cases // Ann. Int. Med.- 1965.- Vol. 63.- P. 185.
- Hanna J.P., Furlan A.J. Cardiac disease and embolic sources // Brain ischemia: Basic concepts and clinical relevance / Ed. by Caplan L.R.- London, etc.: Springer-Verlag, 1995.- P.
-
— круглосуточно. — понедельник-пятница, с 08:00 до 21:00; суббота, с 09:00 до 18:00; воскресенье, с 09:00 до 18:00.
В летний период: понедельник-пятница, с 08:00 до 21:00; суббота, с 09:00 до 18:00; воскресенье, с 09:00 до 15:00.

Аневризма аорты - патологическое расширение самого крупного сосуда в организме человека, которое сопровождается истончением его стенки с вероятностью разрыва и смертельного кровотечения. В аневризматическом мешке образуются тромботические массы, которые могут смываться током крови и вызывать закупорки артерий нижних конечностей или внутренних органов, что чревато развитием острой артериальной недостаточности и гангрены. Осложнения аневризмы аорты являются причиной 6% всех смертей в развитых странах мира. Однако существует эффективное и безопасное лечение, которое снижает риск таких осложнений в десятки раз.
Причины развития аневризмы аорты
Точные причины патологического расширения аорты до сих пор не установлены. Общепринятой является точка зрения, считающая врожденную слабость соединительной ткани основным фактором развития заболевания. В пользу этой теории говорит множественность аневризм в различных отделах артериальной системы. К другим факторам риска относятся:
- Атеросклероз - поражение стенки аорты липидными бляшками ослабляет стенку сосуда.
- Высокое артериальное давление, многократно увеличивающее нагрузку на стенку аорты. В результате артериальной гипертензии развивается аневризма восходящей аорты, корня, грудной и других отделов.
- Сахарный диабет повреждает кровеносные сосуды, приводя к ускоренному развитию атеросклероза, отека стенки сосуда и риска развития аневризмы.
- Аневризма аорты иногда развивается при кистозном медионекрозе - врожденной дегенерации соединительной ткани стенки артерий. Это происходит при редком наследственном заболевании - синдроме Марфана. Иногда подобный патологический процесс возникает при беременности.
- Микотическая аневризма аорты - инфекционный процесс в стенке сосудов. Данная патология может развиться при попадании бактерий на фоне специфических заболеваний (сифилис) или неспецифического сепсиса.
- Воспалительные аневризмы - заболевания соединительной ткани (васкулиты, ревматизм, псориаз) могут вызвать ослабление сосудистой стенки и развитие патологического расширения.
- Травматические аневризмы аорты развиваются вследствие ушиба грудной клетки или живота, чаще при автоавариях или падениях с высоты. Может произойти повреждение участка аорты с неполным разрывом стенки, ослабленная стенка может растянуться и привести к образованию аневризмы.
Строение аорты и особенности локализации аневризмы
Аорту принято делить на несколько отделов, в каждом из которых может развиться аневризма:
- Восходящая аорта - корень от левого желудочка сердца до первой крупной ветви (брахиоцефального ствола). От восходящей аорты отходят венечные артерии сердца (коронарные). Аневризма восходящего отдела аорты приводит к растяжению аортального кольца и развитию тяжелой аортальной недостаточности, поэтому лечение аневризм восходящего отдела аорты от сердца полностью лежит в компетенции кардиохирургов. Аневризма грудной аорты дает осложнения на сердце, что делает это заболевание таким опасным для жизни. Аневризма грудной аорты вызывает симптомы и является причиной клапанной недостаточности сердца, а при диаметре около 50 мм имеет большую склонность к разрыву и смертельному кровотечению. Операции при аневризме восходящего отдела аорты проводятся кардиохирургами в условиях гипотермии и искусственного кровообращения.
- Дуга аорты - это отдел, от которого отходят артерии, кровоснабжающие голову и руки (сонные и подключичные артерии). Симптомы аневризмы дуги аорты помимо разрыва могут проявляться признаками нарушений мозгового кровообращения, связанных с тромбозом полости аневризмы и эмболами, попавшими в сонные артерии. Коррекцию аневризмы дуги аорты оптимально проводить гибридным методом - установкой эндопротеза (стент-графта в полость аневризмы) с предварительным включением сонных и подключичных артерий в кровоток в обход патологического участка.
- Нисходящая грудная аорта - от левой подключичной артерии до диафрагмы (мышцы, разделяющей грудную и брюшную полость). Аневризмы нисходящего отдела аорты также несут риск разрыва и для лечения предпочтительно использовать эндоваскулярный метод (эндопротезирование).
- Супраренальная (надпочечная) брюшная аорта является продолжением нисходящей - от диафрагмы до почечных артерий. В этой части аорты отходят важные артерии к желудку, печени, тонкой кишке и селезенке. Опасность представляет разрыв и тромбоз артерий внутренних органов. Открытое вмешательство на такой аневризме с включением всех ветвей представляет известные трудности. Сложные эндоваскулярные операции с использованием стент-графта с дополнительными ветвями менее опасны, хотя и имеют довольно высокую стоимость расходного материала.
- Инфраренальная (подпочечная) брюшная аорта - от почечных артерий до разделения аорты на артерии ног (подвздошные). От этого отдела отходит артерия к толстой кишке (нижняя брыжеечная). Это наиболее частый вид аортальной аневризмы, дающий много осложнений, однако операцию в этом отделе выполнить технически проще, чем при других локализациях. Возможно проведение как эндоваскулярной операции (эндопротезирование), так и открытой (резекция аневризмы с протезированием).
Течение аневризмы аорты
Неосложненная аневризма аорты медленно, но неуклонно растет в размерах и начинает сдавливать окружающие ткани, вызывая болевые ощущения. При развитии тромбоза аневризматического мешка и переносе фрагментов тромбов по кровотоку могут появиться признаки недостаточности кровообращения конечностей (трофические язвы, некрозы пальцев) или внутренних органов (почечная недостаточность, нарушение спинального кровообращения). Чем больше диаметр аневризмы, тем выше риск ее разрыва. При наличии симптомов аневризмы брюшного отдела аорты и размера свыше 5 см в диаметре риск разрыва повышается до 20% в год, то есть через 5 лет погибают все пациенты. Аневризма аорты через выпячивание стенки может давить на окружающие ткани подобно опухоли, вызывая разрушение поясничных позвонков и даже грудины.
Осложнения аневризмы аорты
Диаметр аорты в области аневризмы значительно увеличен, поэтому кровоток в зоне этого мешка замедлен. В патологической емкости могут образоваться тромбы, которые уменьшают функционирующий просвет аорты и тем самым нормализируют скорость кровотока. Однако тромботические массы являются рыхлой и нестабильной структурой. При некоторых условиях отдельные кусочки этих тромбов могут отрываться и переноситься с током крови в ниже- или вышележащие отделы сосудистого русла, приводя к закупорке артерии и развитию острой недостаточности кровообращения (гангрене, инсульту).
В ряде случаев просвет аневризмы может тромбироваться полностью, в этом случае развивается картина острой недостаточности кровообращения в частях тела, расположенных ниже по течению аорты. Если этот процесс происходит в брюшной аорте, то это может быть инфаркт кишечника (гибель кишки) или гибель обеих ног.
Расширение просвета аорты развивается за счет уменьшения толщины стенки. Стенка аневризмы представляет собой растянутую тонкую соединительно-тканную мембрану. Повышение артериального давления, незначительные травмы и другие неустановленные факторы могут привести к внезапному разрыву аневризматического мешка и профузному кровотечению. Любая аневризма имеет риск смертельного разрыва, но риск зависит от размеров мешка - при диаметре более 5 см риск разрыва составляет около 10% в год. Клиническая картина носит характер шока: резкая слабость, снижение артериального давления, бледность кожи, тяжелое состояние, часто требуется сердечно - легочная реанимация. При разрывах послеоперационная летальность составляет не менее 50%. Без экстренной операции умирают все больные.
Прогноз заболевания
Без хирургического вмешательства расширение постоянно прогрессирует, чем и опасно течение аневризмы аорты. При аневризмах диаметром меньше 4 сантиметров риск разрыва невысокий. Если она выявляется у больных пожилого возраста (старше 70 лет), то вмешательство сосудистого хирурга не требуется, достаточно динамического наблюдения. При диаметре более 5 см риск разрыва очень серьезный, поэтому показания к хирургическому лечению должны быть более активными. Тромбоэмболии в большинстве случаев не зависят от размера аневризматического мешка, поэтому при их появлении необходимо всегда ставить вопрос о хирургическом лечении.
Современное лечение аневризмы
Осложнения аневризмы требуют неотложной операции. Своевременное хирургическое вмешательство может сохранить жизнь. Такое вмешательство должно проводиться в стационаре, имеющем все необходимое как для эндоваскулярного, так и открытого хирургического лечения аневризмы. Хотя разрыв аневризмы может быть прооперирован, в этих случаях удается спасти только около 50% пациентов. Даже если пациент переживет операцию, у него нередко начнут развиваться осложнения со стороны почек, некроз кишечника или ишемия ног. Любые другие осложнения, связанные с аневризмами, такие как эмболия, боль в животе, кишечная непроходимость требуют срочной операции по ее устранению.Плановое лечение имеет определенные показания, которые зависят от локализации аневризмы, возраста пациента, сопутствующих заболеваний сердца и легких. Если диаметр аневризмы превышает 50 мм риск разрыва становится неприемлемым. Боль в животе, эмболия в конечности, нарушения функции кишечника при аневризме являются показанием к хирургической операции. Если аневризма увеличивается в размерах более, чем на 10% в год, это тоже является фактором риска разрыва и заставляет принять решение о хирургическом лечении. Риск разрыва аневризмы брюшной аорты диаметром 7 см и более составляет почти 20% в год. Для устранения аневризмы аорты не существует легкого метода. Эта патология представляет серьезные сложности для хирургов.
В 1885 г. W.Osler ввел термин "мико-тическая" применительно к аортальной аневризме, развившейся как следствие бактериального эндокардита.
Микотические (вторично-инфекционные) аневризмы образуются как следствие длительно существующего инфекционного процесса. Наиболее часто микотические аневризмы являются осложнением септического бактериального эндокардита. Наши данные свидетельствуют, что примерно у 75 % больных источником осложнения служит аортальный клапан, у 12,5 % больных — митральный клапан и у 12,5 % больных — аортальный и митральный клапаны. В целом микотические аневризмы могут явиться следствием инфекции костей, легких; описано образование микотичес-ких аневризм после коронарной ангиопластики, после катетеризации бедренной артерии. Локализация ми-котических аневризм может быть самой разнообразной: сонные, плечевые, подвздошные, бедренные артерии и артерии подколенно-тибиаль-ной области. Наиболее излюбленная локализация — артерии нижних конечностей (до 75 %), на все остальные сосудистые регионы приходится лишь 25 %.
Этиология, классификация, течение. Наличие микотических аневризм всегда ассоциировано с понятием сепсис. Сепсис может быть как первопричиной, так и вторичным проявлением инфекционной эмболии.
При классифицировании микотических аневризм принято выделять первичный регион и цель поражения септическим эмболом: бифуркация артерии, vasa vasorum, атеросклероти-
ческая бляшка; вторичное инфицирование атеросклеротической аневризмы. Локально — непосредственное инфекционное поражение артериальной стенки в месте проникновения инфекционного агента; инфекционные ложные аневризмы (травматические или как следствие хирургического вмешательства), т.е. первичные и вторичные. Сифилитические и туберкулезные аневризмы характерны для аорты и в настоящий момент большого клинического значения не имеют. Следует выделить несколько механизмов инфицирования сосудистой стенки:
▲ эмболизация сосуда септичес ким эмболом, "пришедшим" из серд ца, при наличии у больного септичес кого бактериального эндокардита. Таким путем развивается примерно 80 % микотических аневризм;
▲ вторичное инфицирование ате-росклеротических аневризм при бактериемии в местах развившихся гематом;
инфицирование сосудистой стенки из периартериальных лимфатических коллекторов и сплетений;
инфицирование сосудистой стенки как следствие перенесенной травмы или операции (последний путь инфицирования можно рассматривать как ятрогенный).
Таким образом, механизм образования аневризм заключается в эмболии инфекционного агента в дистальное сосудистое русло с последующей фрагментацией стенки и изменением ее прочности. Большую роль в развитии аневризм придают фактору разрушения внутренней эластической мембраны. Дальнейшее развитие аневризмы может быть аналогичным развитию атеросклеротических или ложных аневризм.
Бактериология. При бактериологическом исследовании микотических аневризм выявляется широкий спектр микроорганизмов: пневмококки, стрептококки, стафилококки, энтеро-бактерии, клебсиелла, протей, эшери-хии, клостридии, бактероиды и т.д.
Среди всех микотических аневризм различной локализации у 83 % больных с аневризмами, вызванными грамотрицательной флорой, появляется разрыв. При микотических аневризмах, вызванных грамположи-тельной флорой, он наблюдается значительно реже и не превышает 10 %.
По нашим данным, наиболее часто причиной микотических аневризм являются стафилококковая флора (65,5 %) и сальмонеллы (34,5 %).
Хирургическая тактика при наличии микотической аневризмы и сопутствующего порока сердца имеет особенности, связанные с тем, что изолированная резекция аневризмы нецелесообразна, а коррекция первым этапом порока сердца без резекции аневризмы имеет в своей основе два порочных момента:
остается источник инфицирования, что особенно опасно при наличии искусственных клапанов сердца;
ограничения движения в конечности, болевой синдром не позволяют проводить активизацию больных после операций на сердце, что является принципиально важным для начала ранней реабилитации больных. Поэтому наиболее целесообразно проведение одномоментной операции — коррекции клапанного порока сердца и резекции периферической микотической аневризмы.
Приводим клиническое наблюдение больного с микотической аневризмой и одномоментным протезированием клапанов сердца.
Больной К., 34 лет, поступил в плановом порядке с жалобами на повышение температуры, общую слабость, головокружение, одышку, возникавшую при подъеме на 1-й этаж. Боли в правой нижней конечности в покое распирающего характера появились внезапно на фоне относительного благополучия. Считает себя больным в течение 1 года. Заболевание началось остро, с повышения температуры; больной с диагнозом "острое респираторное заболевание" лечился сначала амбулаторно, затем стационарно. При поступлении в клинику состояние больного тяжелое. Кожные покровы бледные.
Тоны сердца ясные, ритмичные. На аорте II тон отсутствует. Систолодиастоли-ческий шум на аорте с проведением в левую подмышечную область. Слабый систолический шум на основании сердца. АД 120/10 мм рт.ст. Пульс 90 в 1 мин. Печень увеличена на 5 см. Эхокардиографи-ческое заключение: недостаточность аортального и митрального клапанов. Фракция выброса 70 %.
Правая нижняя конечность прохладная, отечная, движения в коленном и голеностопном суставах ограничены, вынужденное согнутое положение в коленном суставе. В подколенной области определяется пульсирующее образование, над которым выслушивается систолический шум. Чувствительность сохранена. При ультразвуковой допплерогра-фии лодыжечно-плечевой индекс 0,43. При дуплексном сканировании выявлена трехкамерная аневризма подколенной артерии (рис. 7.37). Аневризматические мешки располагались в проекции трех
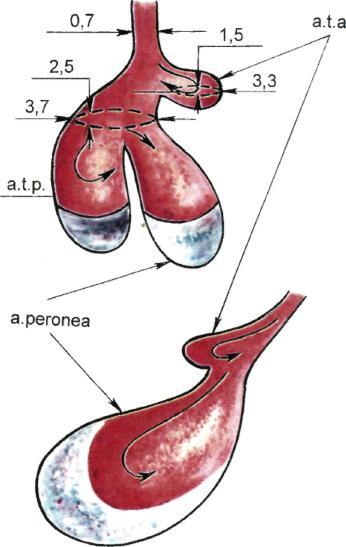
Рис. 7.37. Данные УЗИ при микотической аневризме подколенной артерии.
а. реrоnеа — малоберцовая артерия; a.t.a. — передняя большеберцовая артерия; a.t.p. — задняя большеберцовая артерия.
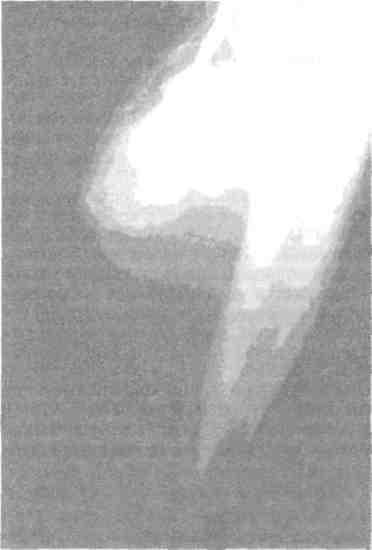
Рис. 7.38. Ангиограмма. Микотическая аневризма подколенной артерии.
основных артерий голени. При ангиографии выявлена разорвавшаяся аневризма подколенной артерии (рис. 7.38).
Диагноз: активный бактериальный эндокардит аортального и митрального клапанов; вторичная инфекционная аневризма правой подколенной артерии.
Боль и вынужденное положение конечности мы объяснили как следствие разорвавшейся аневризмы. Учитывая необходимость последующей реконструктивной операции, мы приняли решение о проведении одномоментной реконструкции клапанного порока сердца и резекции вторичной инфекционной аневризмы с восстановлением кровотока в подколенной области. Больному в плановом порядке выполнена операция протезирования аортального и митрального клапанов с резекцией аневризмы подколенной артерии.
Первый этап операции. После раздельной канюляции полых вен и восходящей аорты начато искусственное кровообращение, достигнута гипотермия 27 °С. Пережата и продольно вскрыта аорта; кардиоплегия в коронарные артерии
(впоследствии каждые 20 мин). Вскрыто левое предсердие. При ревизии аортального клапана выявлено, что левая коронарная створка разрушена, имеется также краевое разрушение правой коронарной створки с кальцинированными веге-тациями, пролабирующими в полость левого желудочка. Клапан иссечен. При ревизии митрального клапана обнаружен отрыв основной хорды передней створки, на желудочковой поверхности последней — кальцинированные вегетации. Иссечен митральный клапан. Отдельными П-образными швами (N-14) в митральную позицию подшит протез ЭМИКС-31, левое предсердие ушито. В аортальную позицию отдельными П-образными швами (N-16) подшит протез ЭМИКС-25, ушита аорта. После профилактики воздушной эмболии восстановлен сердечный ритм. Дренированы полость перикарда и переднее средостение. Гемостаз. Послойное ушивание ран.
Общее время искусственного кровообращения составило 132 мин, пережатия аорты — 94 мин.
Второй этап операции. Второй этап начат после окончания первого. В нижней трети бедра рассечены кожа и подкожная жировая клетчатка, выделена подколенная артерия. Рассечены кожа и подкожная жировая клетчатка от подколенной области до средней трети голени в проекции задней большеберцовой артерии. Выше суставной щели пережата подколенная артерия, после чего вскрыты фасция и большая полость, заполненная свежими тромботическими массами. Аневризматическое изменение подколенной артерии начинается на 3 см дистальнее щели коленного сустава, устья артерий голени и начальные сегменты задней и передней большебер-цовых артерий отсутствуют на протяжении 6—8 см. Измененные стенки артерии определяются только по задней стенке аневризмы и представлены белесыми истонченными и изъеденными отдельными тяжами.
Собственно полость аневризмы представляет собой трехкамерное образование, распространяющееся в проекции хода трех основных сосудов голени (12— 12—18 см). Отмечается активное кровотечение из многочисленных коллатеральных перетоков и зияющих (неспадающих-ся) основных магистралей в ретроградном направлении. Из просвета аневризмати-ческого мешка прошиты и перевязаны все кровоточащие магистрали и их ветви.
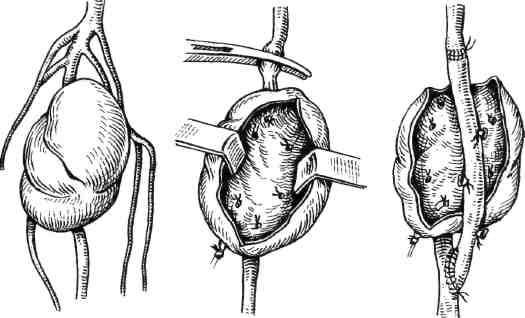
Рис. 7.39. Резекция аневризмы подколенной артерии с аутове-нозным протезированием.
В средней трети голени выделена задняя болынеберцовая артерия, стенки артерии мягкие, ретроградный кровоток слабый.
После забора и обработки аутовенозно-го трансплантата из большой подкожной вены наложены проксимальный анастомоз с подколенной артерией конец в конец и дистальный анастомоз конец в бок с задней болыиеберцовой артерией под операционным микроскопом нитью пролей 8/0 непрерывным обвивным швом. После снятия зажимов определяется отчетливая пульсация на задней болыиеберцовой артерии дистальнее анастомоза (рис. 7.39). После тщательного гемостаза рана ушита послойно с оставлением активных дренажей. Общая кровопотеря за время операции — резекции аневризмы подколенной артерии составила 2,3 л, из которых 2 л были возвращены больному аппаратом реинфузии ("Cell Saver", Италия).
Послеоперационный период протекал относительно гладко. ЛПИ увеличился до 1,2 с восстановлением магистрального кровотока. Швы сняты на 12-е сутки. В послеоперационном периоде больной прошел курс консервативного лечения, включавший инфузионную терапию ан-гиопротекторами и лечебную физкультуру. На момент выписки ограничений функции оперированной конечности не было.
Таким образом, своевременная диагностика и адекватная хирургическая тактика позволяют эффективно лечить группу заболеваний, объединенных общим названием "аневризмы периферических артерий".
Абалмасов К.Г., Морозов К.М., Тутов Е.Г. и др. Опыт одномоментной коррекции клапанных пороков сердца и хирургии мико-тических аневризм периферических артерий//Анналы хирургии. — 1996. — № 3. — С. 12-27.
Петровский Б.В. Прогресс современной ангиохирургии/Хирургия. — 1991. — № 1. — С. 9-16.
Покровский А.В., Земское Н.Н., Шор НА. Повреждения магистральных сосудов конечностей. — Киев, 1983. — С. 231—234.
Спиридонов А.А., Омиров Ш.Р. Хирургия аневризм брюшной аорты//Грудн. и сер-деч.-сосуд, хир. — 1992. — № 9—10. — С. 33-36.
Чазов Е.И. Болезни сердца и сосудов: Руководство для врачей. — М.: Медицина, 1993. - С. 443.
Coley B.D., Roberts А.С., Fellmeth B.D. et al. Postangiographic femoral arteria pseudoaneu-rysms //J. Radiol. (California, San Diego). — 1995. - Vol. 194, N 2. - P. 307-311.
Kotval P.S., Shah P.M., Babu S.C. et al. Popliteal vein compression due to popliteal artery aneurysm: effects of aneurysm size//J. Ultrasound. Med. — 1995. — Nov. — Vol. 14, N 11. - P. 805-811.
Lascaratos J. Surgery on Aneurysms in Byzantine Times (324—1453 a.d.)//Europ. J. Vase. Endovasc Sure. — 1998. — February. — Vol. 15.
Mooney M.J., Tollefson D.F., Andersen С A. et al. Duplex-guided compression of iatrogenic femoral pseudoaneurysms//J. Amer. Coll. Surg. (KY, USA). - 1995. - Aug. - Vol. 181, N 2. - P. 155-159.
Nahrstedt U., Ruckert K. Isolated, true aneurysm of the tibiofibular trunk-a rarity among peripheral aneurysms. Das isolierte, echte Aneurys-ma des Truncus tibiofibular — eine Raritat unter den peripheren Aneurysmen//Vasa. — 1995. — Vol. 324, N 4. - P. 373-376.
Nguyen H.H., Chleboun J. O. False popliteal aneurysm after femoral embolectomy//Aust. N-Z. J. Surg. - 1995. - May. - Vol. 65, N 5. - P. 362-364.
Rieck В., Kupsch E., Wittig K. et al. Traumatic aneurysms of the hand. Description of 5 cases: Traumatische Aneurysmata der Hand. Bes-chreibung von funf Fallen (Hannover, Ger-many)//1995. - Dec. - Vol. 27, N 3. — P. 132-136.
Saito К., Baskaya M.K., Shibuya M. et al. False traumatic aneurysm of the dorsal wall of the su-praclinoid internal carotid artery — case re-port//Neurol. Med. Chir. - Tokyo. - 1995. -Dec. - Vol. 35, N 12. - P. 886-891.
YusufS.W., Baker D.M., Hind R.E. et al. En-doluminal transfemoral abdominal aortic aneurysm repair with aorto-uni-iliac graft and fem-orofemoral bypass//Brit. J. Surg. (Nottingham, UK). - 1995. - Jul. - Vol. 82, N 7. - P. 916.
Zell S. С Mycotic false aneurysm of the superficial femoral artery. Delayed complication of Salmonella gastroenteritis in a patient with the acqujred immunodeficiency syndrome//West. J. Med. (Reno, USA). - 1995. - Jul. - Vol. 163, N 1. - P. 72-74.
Читайте также:

