Микробиологическая диагностика инфекционных заболеваний красноженов
Обновлено: 19.04.2024
ИФА. В настоящее время уже появились коммерческие наборы для выявления Аг некоторых возбудителей, позволяющие их идентифицировать в течение 5-10 мин. Для выявления Аг на твёрдой фазе сорбируют известные AT и добавляют сыворотку, содержащую Аг; после инкубирования несвязанный Аг декантируют, систему промывают и вносят меченые AT, специфичные к сорбированным AT. Повторяют процедуру инкубирования и отмывания, вносят хромогенный субстрат, положительный результат фиксируют при изменении окраски системы.
Гибридизация ДНК — высокоспецифичный метод, позволяющий идентифицировать геном вируса после его гибридизации комплементарными молекулами ДНК. В качестве маркёра применяют ферменты и изотопы. Метод определяет способность вирусной ДНК гибридизиро-ваться с меченой комплементарной ДНК; специфичность метода прямо пропорциональна длине комплементарной цепочки. Перспективен метод гибридизации нуклеиновых кислот in situ. Для постановки реакции меченую ДНК наносят на биоптаты тканей (в том числе на фиксированные формалином или заключённые в парафиновые блоки) и регистрируют взаимодействие с комплементарной ДНК. Метод используют для выявления вирусов простого герпеса, папилломы человека, Эпстайна-Барр и др.
ПЦР. Метод значительно увеличивает чувствительность метода гибридизации, повышая содержание вирусной ДНК в материале, полученном от больного, а также ускоряет время получения результата.
Методы диагностики микозов ( грибковых заболеваний )
Микроскопия — один из основных методов выявления возбудителей микозов. Позволяет проводить экспресс-диагностику микозов и получать результат в течение 1—2 ч, тогда как для выделении культуры возбудителя необходимы недели. Для экспресс-диагностики препараты часто необходимо окрашивать специальными красителями, так как простая окраска гематоксилином и эозином часто не позволяет выявить клетки грибов.
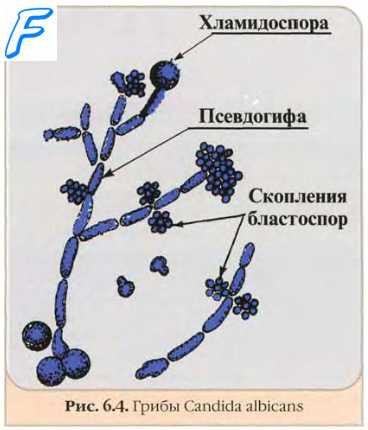
Неокрашенные препараты грибов
Микроскопия методом висячей или раздавленной капли. Метод позволяет выявить структуры грибов в клинических образцах без предварительного окрашивания.
Обработка 10% едким калием (КОН). Метод используют в первую очередь для визуализации структур возбудителей в фрагментах кожи и её придатках (ногти, волосы), отделяемом очагов поражения и влагалища. В указанных образцах содержится большое количество клеток, в которых КОН разрушает кератин, оставляя неизменёнными клетки грибов.
Окрашенные препараты грибов. Окраска мазка грибов.
• Окраска мазка грибов по Граму. В мазках из клинического материала грибы представлены грамположительными клетками. Клетки Cryptococcus neoformans плохо воспринимают красители, что можно использовать как дифференциально-диагностический признак при микроскопии окрашенных мазков СМЖ.
• Окраска мазка грибов нигрозином или тушью по Бурри мазков СМЖ позволяет выявить капсулированные клетки Cryptococcus neoformans. Для идентификации этого микроорганизма можно использовать муцикармин или конго красный.
• Окраска мазка грибов по Романовскому-Гимзе или Райту мазков крови и костного мозга позволяет выявить дрожжевую форму Histoplasma capsulatum в цитоплазме фагоцитов.
• Окраска мазка грибов метенаминовым серебряным по Гомори. Метод включает предварительную обработку гистологических препаратов хромовой кислотой с последующим нанесением красителя (клетки грибов тёмно-серые или чёрные).
• Окраска мазка грибов по Гридли. Метод включает предварительную обработку препаратов хроматом лейко-фуксина с последующим нанесением фуксинового альдегида и метанилового жёлтого (клетки грибов розово-пурпурные на жёлтом фоне).
• Окрашивание перйодной кислотой и реактивом Шиффа (по Мак-Манусу). 1,2-Гликольные группировки полисахаридов клеточных стенок грибов сначала окисляются перйодной кислотой до альдегидов, реагирующих с сульфитом лейкофуксина реактива Шйффа; клетки окрашиваются в насыщенно розовый или красный цвет.
Иммунофлюоресцентная микроскопия грибов
Наибольшее распространение нашла РИФ. Применяют AT, меченные флюоресцеинами; для выявления грибковых Аг реагент наносят на гистологический препарат, инкубируют и проводят люминесцентную микроскопию.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
В настоящее время ПЦР является одним из высокочувствительных методов диагностики инфекционных заболеваний, который позволяет выявлять единичные бактериальные клетки. Показано, что диагностическая и экономическая эффективность выявления возбудителей повышается за счет одновременной ПЦР-детекции наиболее значимых патогенов в смеси информативных субстратов. Целью настоящей работы явилось сравнение эффективности ПЦР с различными методиками выделения ДНК Mycoplasma genitalium, Mycoplasma hominis, Ureaplasma urealyticum у больных c урогенитальными инфекциями. Показано, что в случае выделения ДНК с использованием сорбента, по сравнению с фенольно-хлороформным преципитирующим методом экстракции, наблюдался максимальный продукт амплификации, что свидетельствует о наиболее полном экстрагировании ДНК из бактерий. Данный метод ПЦР был наиболее эффективен при диагностике урогенитальных инфекций микоплазменной этиологии.

1. Бухарин О.В. Проблемы персистенции патогенов в инфектологии // Журнал микробиологии, эпидемиологии и иммунобиологии. – 2006. – № 4. – С. 4-8.
2. Дмитриев А.Г. Лабораторная диагностика бактериальных урогенитальных инфекций. – М. : Медицинская книга, 2003. – 336 с.
3. Карамова А.Э. Значение микоплазм в развитии воспалительных заболеваний урогенитального тракта, генетические аспекты резистентности к антибиотикам, тактика ведения больных : автореф. … канд. мед. наук. – М., 2003. – 19 с.
4. Красноженов Е.П. Микробиологическая диагностика инфекционных заболеваний. – Ростов н/Д : Феникс, 2006. – 252 с.
5. Лашин С.А. и др. Корреляции оперонной структуры с длиной генома у 14 видов микоплазм // Вестник ВОГиС. – 2009. – Т. 13. – № 1. – С. 84-89.
7. Прилепская В.Н., Кисина В.И., Соколовский Е.В. К вопросу о роли микоплазм в урогенитальной патологии // Гинекология. – 2007. – № 1.
8. Савичева А.М. Лабораторная диагностика и терапия репродуктивно значимых инфекций // Лечащий врач. – 2008. – № 3.
9. Brotman R.M., Erbelding E.J., Jamshidi R.M. et al. Findings associated with recurrence of bacterial vaginosis among adolescents attending sexually transmitted diseases clinics // J. Pediatr Adolesc Gynecol. – 2007. – Aug; 20 (4):225-31.
10. Valysheva I.V. New Method for the Determination of Anti-lactoferrin Activity of Microorganisms / Valysheva I.V., Valyshev F.V., Kartashova O.L., Chainikova I.N., Bukharin O.V. // Журнал микробиологии, эпидемиологии и иммунобиологии. – 2003. – № 4. – С. 64-67.
11. Ferris M.J., Masztal A., Martin D.H. Use of speciesdirected 16S rRNA gene PCR primers for detection of Atopobium vaginae in patients with bacterial vaginosis // J. Clin. Microbiol. – 2004; 42:5892-4.
Микрофлора влагалища является важнейшим индикатором состояния здоровья, а ее количественный и качественный состав отражает состояние половой системы. Регуляция видового и количественного состава микрофлоры вагинального биотопа в значительной мере зависит от иммунной, эндокринной систем организма и особенностей процессов обмена веществ.
Дестабилизация вагинальной экосистемы может быть вызвана рядом факторов, обусловленных урбанизацией населения, неблагоприятным воздействием окружающей среды, а также образом жизни: раннее начало и беспорядочные половые связи, бесконтрольное применение лекарственных препаратов, особенно антибиотиков и контрацептивов.
С использованием молекулярно-генетических приемов подтверждено, что доминантная микробиота влагалища взрослой женщины преимущественно представлена лактобактериями, бифидобактериями, но может различаться по количественному и качественному составу у отдельных индивидуумов и групп населения в зависимости от возраста, национальной принадлежности, условий проживания, состояния здоровья (Шендеров, 2005).
Одним из ведущих методов современной лабораторной диагностики инфекций репродуктивного тракта является полимеразная цепная реакция (ПЦР). Полимеразная цепная реакция, основанная на выявлении уникальных фрагментов геномов инфекционных агентов, соответствует данным требованиям, существенно расширяет возможности диагностики, позволяет обнаруживать некультивируемые и труднокультивируемые формы микроорганизмов (Говорун B.М., 2000; Шагинян И.А., 2000; Ребриков Д.В., 2009; Mullis K.B., 1994; Newton C.R., 1997; Farrell D.J., 2001).
Целью настоящей работы явилось выявление клинических изолятов семейства Mycoplasmataceae, возбудителей воспалительных инфекций репродуктивного тракта, с использованием ПЦР-диагностики классическим методом выделения ДНК с использованием сорбента и фенольно-хлороформным преципитирующим методом экстракции ДНК.
Проведение амплификации состояло из трех этапов: денатурации ДНК при 94 ºС, отжига праймеров на денатурированной ДНК и элонгации (синтеза новой цепи с помощью фермента Taq-ДНК-полимеразы, наибольшая активность которого проявляется при 72 ºС).
В работе применяли: классический метод выделения ДНК с использованием сорбента (первый метод) и фенольно-хлороформный преципитирующий метод экстракции ДНК (второй метод).
Праймеры для идентификации M genitalium CCACTCGAGCCAAGGCCAAGGCCCTC-20,2 и CTACGGGGAAAGCGGGGGA-20, для M. hominis P-120 CTCCCGGAACCGGCTCACC и P-56 TGGGCGGACCCCTCATGCCAG, U.urealyticum Ur5-GCGCAGGCGGGTTTGAAGTTTGGT-3.
Ur2-5GCCCTATCCCGAACTGAGTAAC-3 были выбраны на основании нуклеотидной последовательности в GenBank L08642 и использованы для амплификации фрагмента генов G37 и G317 микоплазм длиной 215 и 713 н.п. соответственно. Для подбора праймеров были использованы программы Gene Runner Version 3.05 и Primer Blast (ресурсы GeneBank).
На этапе детекции продукты амплификации ПЦР (20 мкл) анализировали электрофоретически, для чего были использованы готовые агарозные гели, содержащие 2,3% агарозы и бромистого этидия. Электрофоретический буфер также входил в состав коммерческого набора.
Анализ электрофореграмм проводили с помощью видеосистемы Gel Imager и программного обеспечения Gel Analyzer, что позволило документировать и обрабатывать видеоизображение фореграмм в УФ-излучении при длине волны 254 нм.
Результаты. Исследование 268 клинических образцов ДНК выявило наличие в них M. hominis, M. genitalium и U. urealyticum. в 92 (34,3%) случаях (рис. 1).

Рис. 1. Показатели инфицированности пациенток микоплазмами, выявленными культуральным методом и ПЦР.
Результаты ПЦР-анализа микоплазм показали, что использование видоспецифических праймеров позволяет дифференцировать виды M. hominis, M. genitalium и U. urealyticum. В ряде случаев ДНК из клинических образцов реагировала с праймерами на два или три указанных вида возбудителей одновременно, что указывает на их возможную ассоциацию. В виде моноинфекций микоплазмы выявлены у 62 пациенток (23,1%), в виде ассоциаций – у 93 человек (34,7%). Наиболее частыми ассоциантами являлись M. hominis и U. urealyticum (62%), а также M. hominis и M. genitalium (36%). У 2% больных женщин были обнаружены ассоциации, включающие М. hominis, M. genitalium и U. urealyticum.
Анализ выявляемости возбудителей при воспалительных заболеваниях урогенитального тракта показал, что М. hominis культуральным методом была выявлена у 95 больных (35,8%). Из них микоплазмы обнаружили у 41 больной уретритом (43,2%), у 22 (23,1%) – эндоцервицитом, у 12 (12,6%) – аднекситом и у 20 (21,1%) – кольпитом (табл. 1).
Таблица 1 – Показатели выявления микоплазм у пациенток с воспалительными заболеваниями урогенитального тракта культуральным методом и ПЦР
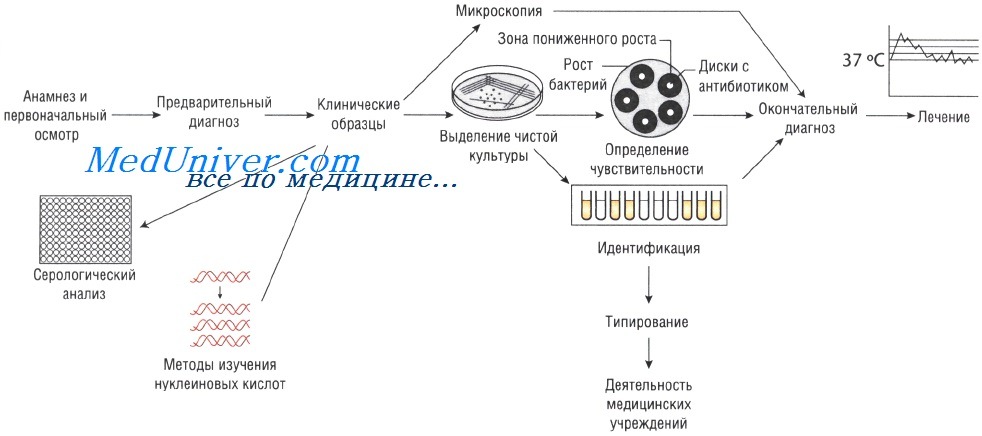
Лабораторные исследования при инфекционных заболеваниях. Методы
Отбор проб для анализа при инфекционных заболеваниях. Для микробиологического исследования может быть отобрана любая ткань или физиологическая жидкость организма.
Выделение чистой культуры способствует увеличению количества бактерий и их точной идентификации. Для этого используют питательные среды. Если в образце присутствует нормальная микрофлора, то применяют избирательные (селективные) среды, позволяющие создать условия, неблагоприятные для роста непатогенных микроорганизмов и способствующие росту патогенной микрофлоры.
Для получения точных результатов следует выбрать оптимальный метод отбора проб и подойти к этому процессу с должной аккуратностью. При несоблюдении правил асептики контаминация проб крови микроорганизмами извне может привести к назначению неправильного лечения.
Большинство бактерий не способны существовать вне организма хозяина: облигатные анаэробы погибают под действием кислорода воздуха, а некоторые возбудители очень чувствительны к высыханию (Neisseria gonorrhoeae). Именно поэтому анализируемые образцы сразу после отбора должны быть помещены на подходящие среды или посеяны на среды для транспортировки.
Лабораторные методы исследования при инфекционных заболеваниях
Образцы могут быть проанализированы невооружённым глазом (например, для определения взрослых гельминтов в фекалиях или крови в мокроте). Микроскопия — быстрый и недорогой метод исследования, но требует высокого технического мастерства, характеризуется низкой чувствительностью: для точного определения необходимо присутствие большого количества возбудителей.
Кроме того, очень часто условно-патогенные микроорганизмы принимают за патогенные, что связано с недостаточной специфичностью метода.
Для определения возбудителя могут быть использованы различные красители (например, аурамин или окрашивание по Цилю—Нильсену для идентификации микобактерий). Уротропиновый серебряный окрашивает хитин клеточной стенки грибов и Pneumocystis jiroveci. Краситель Гимза применяют для окрашивания возбудителей малярии, лейшманий и других паразитов.
В основе иммунофлюоресцентного метода лежит применение специфических антител, помеченных флюоресцентными маркёрами. Микроскопию осуществляют в ультрафиолетовом свете, при этом возбудитель и связанные с ним антитела светятся ярко-зелёным цветом.
Лабораторные исследования при инфекционных заболеваниях
Выделение чистой культуры возбудителя при инфекционных заболеваниях
Иногда, даже при выраженных клинических симптомах, возбудитель может присутствовать в очаге инфекции в количестве, недостаточном для микроскопического определения. В этом случае выделение чистой культуры позволяет увеличить численность микроорганизмов в исследуемом субстрате.
Существует два способа выращивания микроорганизмов: на жидких (увеличивается количество возбудителей) и твёрдых (исследуют отдельные колонии, в том числе и на чувствительность к антибиотикам) питательных средах. Большинство возбудителей инфекций человека достаточно требовательны к условиям культивирования. Именно поэтому питательные среды для их выращивания должны содержать белки, сахарозу и нуклеиновые кислоты (присутствующие в крови и сыворотке).
Кроме того, необходимо поддерживать соответствующий газовый состав: для культивирования анаэробов необходимо отсутствие кислорода, в то время как для облигатных аэробов (Bordetella pertussis) — наоборот. Оптимальная температура выращивания большинства патогенных микроорганизмов составляет 37 °С; культивирование некоторых фибов осуществляют при 30 С.
Идентификация возбудителя инфекционного заболевания
Симптомы заболеваний зависят от вида возбудителей, вызвавших их. Именно поэтому идентификация микроорганизма позволяет предположить клиническую картину вызываемого им заболевания (например, симптомы инфекции, вызванной Vibrio cholerae, отличны от таковых при заражении Shigella sonnei). Большое значение имеет выделение Neisseria meningitidis именно из спинномозговой жидкости. Идентификация микроорганизмов основана на:
• изучении морфологических свойств их колоний в агаре;
• различной окраске по Граму;
• способности возбудителей к образованию спор;
• изучении биохимических свойств (каталазный или коагулазный тесты).
Точное определение штамма обычно зависит от результатов биохимического анализа (например, уреазный тест) или обнаружения продуктов жизнедеятельности бактерий (индол). Возбудителей, которые не могут быть выращены на питательных средах, идентифицируют при помощи молекулярно-генетического метода ДНК и секвенирования (например, Trophyrema whippelii).

Определение чувствительности возбудителя инфекционного заболевания к антибиотикам
Если для эрадикации микроорганизмов достаточно стандартной дозы антимикробного препарата, то их считают чувствительными, если необходимо увеличение дозы лекарственного средства — относительно устойчивыми. Абсолютно устойчивыми (резистентными) называют возбудителей, в отношении которых антибиотикотерапия неэффективна. Существует широкий спектр различных методов определения чувствительности к антимикробным препаратам.
Методы Британской ассоциации антимикробной химиотерапии (British Society of Antimicrobial Chemotherapy — BSAQ и Института клинических лабораторных стандартов (Clinical Laboratory Standards Institute — С LSI) основаны на определении диаметра зоны слабого роста микроорганизмов на твёрдой питательной среде при применении антимикробного препарата.
Минимальную подавляющую концентрацию антибиотика измеряют с помощью Е-теста, растворения препарата в питательном бульоне или нанесения его на плотный агар. В последнем случае на засеянный исследуемыми микроорганизмами агар наносят бумажные диски, пропитанные различными антибиотиками (метод бумажных дисков).
Уровень чувствительности зависит от диаметра зоны пониженного роста бактерий. Однако тестирование in vitro предоставляет лишь приблизительные данные, так как в клинической практике многое зависит от состояния больного.

Серологический анализ при инфекционном заболевании
Различные виды инфекций можно идентифицировать с помощью определения иммунного ответа, возникающего при внедрении возбудителя. Для этого существует большое количество различных методов: реакция агглютинации (РА), реакция связывания комплемента (РСК), реакция нейтрализации (РН) и иммуноферментный анализ (ИФА). Диагноз устанавливают на основании:
• определения уровня антител (IgM) в ответ на попадание в организм чужеродного белка (антигена);
• определения антигена.
Молекулярный анализ при инфекционном заболевании
Южный блоттинг и метод гибридизации нуклеиновых кислот. Методы основаны на связывании меченой ДНК с анализируемым образцом, при условии, что он имеет определённую последовательность аминокислот. Связанный комплекс определяют по активности метки. Это достаточно быстрый и надёжный способ, который, тем не менее, уступает по чувствительности молекулярно-генетическим методам.

Метод молекулярно-генетический (NAAT)
Для диагностики инфекционных заболеваний используют несколько молекулярно-генетических методов. Механизм выделения патогенной ДНК или РНК в количестве, достаточном для постановки диагноза, для каждого метода индивидуален. Так, при молекулярно-генетическом методе ДНК возбудителя разделяют на отдельные цепи, затем синтезируют праймеры для связывания с целевыми последовательностями. Образование новой ДНК катализирует полимераза.
Основное преимущество — достижение результата даже при наличии всего лишь одной копии ДНК. Благодаря автоматизированным системам и большому выбору специальных наборов эти методы стали доступны большинству диагностических лабораторий. Новые аппараты способны выдавать результат в режиме реального времени. Генетические методы позволяют идентифицировать микроорганизмы, выращивание которых отличается сложностью или сопряжено с риском для человека (например, Mycobacterium tuberculosis и Chlamydia trachomatis).
Кроме того, их можно использовать для определения генов, кодирующих устойчивость к действию антибиотиков (например, мутационный ген rpoВ, обеспечивающий устойчивость М. tuberculosis к рифампицину). Это позволяет заранее выбрать альтернативный путь лечения инфекционных заболеваний.
Иногда необходимо проводить типирование микроорганизмов в случае их распространения в больницах или в окружающей (внебольничной) среде.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Лабораторные методы при диагностике вирусных инфекций включают:
• выделение и идентификацию возбудителя;
• обнаружение и определение титров противовирусных AT;
• обнаружение Аг вирусов в образцах исследуемого материала;
• микроскопическое исследование препаратов исследуемого материала.
Забор материала для выявления вирусов
При заборе материала для исследований необходимо выполнять следующие условия:
• образцы следует отбирать как можно раньше либо с учётом ритма циркуляции возбудителя;
• материал следует отбирать в объёме, достаточном для всего комплекса исследований;
• образцы следует доставлять в лабораторию незамедлительно (!), при относительно кратковременной транспортировке (не более 5 сут) образцы сохраняют на льду, при более длительной — при температуре -50 С.
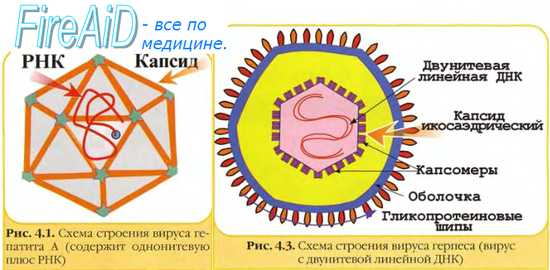
Выделение и культивирование вирусов
Выделение и идентификация возбудителя — золотой стандарт в диагностике вирусных инфекций.
Культуры клеток для выявления вирусов
Вирусы размножаются только в живых клетках, и выделение возбудителя в заражённой культуре клеток — один из основных методов диагностики вирусных инфекций. Поскольку большинство патогенных вирусов отличает тканевая и типовая специфичность, то почти к каждому вирусу можно подобрать соответствующие клеточные или тканевые чультуры, а также создать стандартные условия культивирования (наличие клеток одного типа). Размножение вируса обеспечивают чувствительные (пермиссивные) клетки. Поэтому при выделении неизвестного возбудителя проводят одномоментное заражение 3~4 культур клеток, предполагая, что одна из них может оказаться пермиссивной. Культуры клеток получают диспергированием соответствующих органов и тканей, но чаще используют эмбриональные ткани (человека и животных) либо трансформированные опухолевые клетки. При помещении на соответствующую плоскую поверхность клеточные культуры обычно растут в виде монослоя. Первично-трипсинизированные культуры. Суспензии клеток получают гомогенизированием соответствующих тканей, предварительно обработанных трипсином. Культуры часто представлены клетками смешанного типа и не подлежат повторному культивированию. Жизнеспособность таких культур составляет 2-3 нед.
Полуперевиваемые линии клеток представлены диплоидными клетками человека и животных. Культуры ограниченно пригодны к повторному диспергированию и росту (как правило, не более 20-30 пересевов), сохраняя при этом жизнеспособность и не подвергаясь спонтанной трансформации.
Перевиваемые линии клеток (гетероплоидные культуры) представлены клетками, подвергнутыми длительному культивированию и спонтанным трансформациям. Культуры способны к многократному диспергированию и перевиванию. Работа с ними менее трудоёмка по сравнению с приготовлениями первичных культур; перевиваемые клетки относительно одинаковы по своей морфологии и стабильны по свойствам.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

