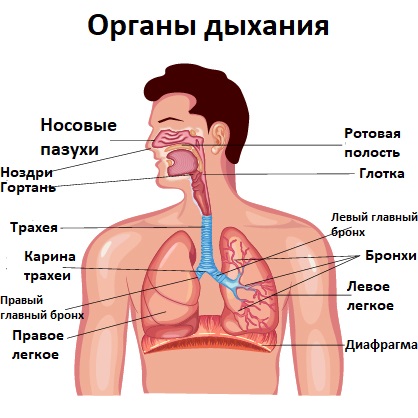
Микробиологические методы диагностики инфекций верхних дыхательных путей
Обновлено: 19.04.2024
Инфекции дыхательных путей (острые респираторные заболевания, ОРЗ) могут вызвать бактерии, вирусы и грибы. Среди бактериальных возбудителей чаще встречаются Mycoplasma pneumoniae, Chlamydophila pneumoniae, Streptococcus pneumoniae, Haemophilus influenzae, Staphylococcus aureus, представители семейства Enterobacteriaceae, Legionella pneumophila, возбудители коклюша и дифтерии. Среди вирусных возбудителей ОРЗ наибольшее значение имеют представители четырех семейств РНК-содержащих вирусов (ортомиксовирусы, парамиксовирусы, коронавирусы и пикорнавирусы) и двух семейств ДНК-содержащих вирусов (аденовирусы, парвовирусы). Дети дошкольного возраста подвержены ОРЗ, в среднем, 4–8 раз в год, школьники – 2–6 раз в год, взрослые – 2–3 раза в год. В контингентах часто болеющих детей эпизоды ОРЗ регистрируются от 10 до 12 раз в год. ОРЗ могут протекать в легкой, в средне-тяжелой и в тяжелой (круп, бронхиты, бронхиолиты, пневмонии) формах.
Общими показаниями для лабораторного обследования с целью проведения этиологической диагностики ОРЗ является наличие у пациента остро возникшего заболевания с локальными симптомами поражения дыхательных путей при наличии общеинтоксикационного синдрома.
Инфекционные болезни дыхательных путей необходимо дифференцировать от других заболеваний/состояний неинфекционной природы (аллергия, тромбоэмболия легочной артерии, эндокардит трикуспидального клапана, облитерирующий бронхиолит, системные васкулиты, инфаркт легкого, легочная эозинофилия и пр.) на основании результатов клинико-рентгенологического и лабораторного обследований. Следует принимать во внимание, что пневмонии могут развиваться вследствие инфицирования возбудителями особо-опасных и природно-очаговых инфекций (орнитоз, Ку-лихорадка, легочная форма сибирской язвы, туляремия и др.), в связи с чем, необходимо тщательно собирать и анализировать эпидемиологический анамнез. У лиц со сниженной активностью иммунной системы, ОРЗ могут вызывать также энтеровирусы, вирусы герпеса, цитомегаловирус, кандиды, аспергиллы, криптококки, пневмоцисты. Следует проводить дифференциальную диагностику коклюшной инфекции от острых бронхитов, вызванных другими возбудителями. Дифференциальная диагностика гриппа и других ОРЗ возможна только с помощью лабораторных методов исследования.
Лабораторные исследования, применяемые с целью этиологической диагностики инфекций верхних и нижних дыхательных путей, включают прямые (обнаружение возбудителя, его генома и АГ) и косвенные (обнаружение АТ) методы диагностики.
Микроскопия (бактериоскопия) окрашенного по Граму мазка мокроты и СМЖ позволяет определить лишь доминирующий морфотип потенциального бактериального патогена. Ценность метода и решаемые задачи различаются в зависимости от того, из какого локуса организма отобран клинический материал. Целью исследования материала из стерильных локусов – кровь, СМЖ, плевральная жидкость и т. д., является определение доминирующего морфотипа потенциального бактериального патогена и отношения к окраске по Граму. Кроме того, выявляется характер воспалительной реакции (лейкоцитоз или лимфоцитоз). Целью исследования материала из нестерильных локусов – мокрота, БАЛ, отделяемое из уха или придаточных пазух, – служит определение его пригодности для бактериологического посева и определение характера воспаления. Критерием пригодности мокроты служит наличие менее 10 эпителиальных клеток и более 25 нейтрофильных лейкоцитов в поле зрения. Бактериоскопия мазков из носо- и ротоглотки не информативна, поэтому не проводится.
Культуральный метод применяется для выделения и идентификации чистой культуры патогена. В клинической практике метод используют для выявления бак териальных возбудителей ОРЗ (Streptococcus pneumoniae, Haemophilus influenzae и др.) за исключением Mycoplasma pneumoniae и Chlamydophila pneumoniae. Бактериологический посев клинического материала проводится с целью дальнейшей культуральной и биохимической идентификации возбудителя, определения антибиотикочувствительности. Показанием для исследования крови служит пневмония, септические состояния, менингит. Метод позволяет обнаруживать возбудитель не более чем у 10–20% госпитализированных больных внебольничной пневмонией.
Среди вирусных возбудителей ОРЗ культивирование возможно для вирусов гриппа А и В, респираторно-синцитиального вируса, вирусов парагриппа 1–3 типов, метапневмовируса человека и аденовирусов, однако как рутинная процедура данный метод используется только для вирусов гриппа. Исследование характеризуется достаточно большой продолжительностью, но незаменимо при необходимости детального изучения патогенности, чувствительности к антимикробным препаратам, антигенных и других свойств изолятов микроорганизмов. Аналитические характеристики культуральных исследований во многом зависят от качества используемых сред, а также иммунологических и биохимических идентификационных тестов.
Для обнаружения АГ пневмококка, гемофильной палочки и ряда других бактериальных патогенов в стерильных видах клинического материала (кровь, СМЖ) применяют латекс-агглютинацию; для исследования материала из нестерильных локусов (мокрота, БАЛ и др.) метод не предназначен. Чувствительность и специфичность наборов реагентов разных производителей составляет 99–100% и 85–98%, соответственно.
Обнаружение фрагментов генома возбудителей инфекционных болезней дыхательных путей в большинстве случаев наиболее эффективно и востребовано для ранней диагностики и скрининга с целью последующего получения чистой культуры возбудителя. Для рутинных исследований применяются тесты на основе ПЦР, которые позволяют обнаружить РНК/ДНК патогенов непосредственно в образцах биологического материала. Максимальный уровень специфичности и чувствительности имеют наборы реагентов с использованием гибридизационно-флуоресцентной детекции продуктов амплификации. Для диагностики заболеваний, вызванных условно- патогенными бактериями, в связи с их возможным носительством в верхних дыхательных путях, целесообразно применять только количественные тесты на основе ПЦР в сочетании с исследованием материала из нижних дыхательных путей.
Обнаружение специфических АТ в сыворотках больных ОРЗ методами ИФА, РТГА, РСК предназначено для ретроспективного подтверждения диагноза при инфицировании Mycoplasma pneumoniae, Chlamydophila pneumoniae, Legionella pneumophila, Coxiella burnetii и вирусных инфекций. Ограничением такого способа диагностики является необходимость подтверждения появления специфических АТ (сероконверсии) 4-кратным нарастанием титра специфических АТ в образцах сыворотки крови, полученных последовательно в острый период заболевания и в период реконвалесценции (спустя 10 дней – 1 месяц). Достоверность результата увеличивается в случае проведения исследования в обеих сыворотках одновременно. Определение АТ IgM считается более ценным с клинической точки зрения, поскольку они появляются в ранние сроки инфицирования и могут служить маркером недавно перенесенной инфекции.
Микрофлору верхних дыхательных путей изучают при заболеваниях носа и зева, а также у больных пневмонией, не отделяющих мокроту, и при обследовании на бактерионосительство.
Отделяемое из носа берут стерильным ватным тампоном, который вводят в глубь полости носа. Материал из носоглотки берут стерильным заднеглоточным тампоном, из зева — увлажненным ватным тампоном. Тампоны помещают в стерильные пробирки и доставляют в лабораторию в максимально короткие сроки. Хранить тампоны с материалом следует в холодильнике не более 2—3 ч. Посев тампоном производят на чашки Петри с 5% кровяным агаром, которые инкубируют 18—24 ч при температуре 37 °С. Просматривают выросшие колонии, выделяют чистые культуры, идентифицируют их, определяют чувствительность к антибиотикам. Из материала, оставшегося на тампоне, делают мазки, которые окрашивают по Граму и Нейссеру.
При оценке результатов исследования следует учитывать видовой и количественный состав нормальной микрофлоры, содержащейся в клиническом образце: обнаружение микробов, не относящихся к нормальной микрофлоре верхних дыхательных путей, или необычно большое количество микробов какого-либо вида указывает на их этиологическую значимость в заболевании.
20.14. Диагностика менингитов
Микробиологическое исследование ликво-ра необходимо в случаях, подозрительных на менингит, а также при коматозных состояниях и неврологических симптомах неясного генеза.
Гнойный менингит — гнойное воспаление мозговых оболочек. Встречаются первичный менингит, вызванный менингококками, и вторичный, возбудителями которого являются все прочие УПМ. Возбудители заносятся в субарахноидальное пространство при воспалительных процессах в других органах гематогенным, лимфогенным, контактным путями, а также при травмах.
Ликвор в норме стерилен, поэтому положительный результат микробиологического исследования — это всегда расшифровка этиологического диагноза, своевременность постановки которого может в ряде случаев предотвратить смертельный исход заболевания.
Этиология менингитов очень разнообразна. Наиболее часто из ликвора выделяют следующие микробы:
при гнойных менингитах — Neisseria meningitidis, Streptococcus pneumoniae, Staphylococcus aureus, Streptococcus трупп А, В, D; Haemophilus influenzae, E. coli, Klebsiella, Proteus, Pseudomonas, Achromobacter, Listeria monocytogenes;
при асептических менингитах — Mycobacterium tuberculosis, Leptospira, Cryptococ-cus neoformans, Toxoplasma gondii, вирусы.
Взятие проб ликвора должно проводиться при строжайшем соблюдении правил асептики, исключающих его контаминацию.
Первые капли ликвора (до 1 мл) собирают в пробирку и направляют на цитологическое исследование. Для посева используют следующую порцию жидкости, которую собирают в стерильную пробирку в количестве 2—5 мл. При подозрении на туберкулезную или грибковую этиологию менингита следует брать не менее 10 мл ликвора. Учитывая, что один из ведущих возбудителей менингита — Neisseria meningitidis— чрезвычайно чувствителен к охлаждению, взятые пробы должны быть доставлены в лабораторию как можно скорее, а до этого сохраняться строго при 37 °С.
Во всех случаях, подозрительных на менингит, для микробиологического исследования кроме ликвора берут материал из предполага-
емого первичного очага инфекции: мазки из носоглотки, среднего уха, ран после нейрохирургических и других оперативных вмешательств, кровь.
В лаборатории ликвор центрифугируют при 2500— 3000 об/мин 10 мин. Надосадочную жидкость отсасывают стерильной пипеткой в пробирку и используют для биохимического и серологического исследований. Оставшийся осадок и около 0,5 мл жидкости используют для приготовления мазков и посева. Гнойный ликвор можно использовать для исследования без предварительного центрифугирования. До конца подготовительных операций ликвор хранят при 37 °С. Из осадка делают два тонких мазка на стекле, окрашивая по Граму и метиленовым синим, и немедленно микроскопируют. Нередко, особенно при нелеченых случаях менингита, по типичной морфологии могут быть выявлены такие возбудители как N. meningitidis, S. pneumoniae, H. influenzae. Обнаружение в мазках неспоровых четко грамположительных коротких толстых палочек заставляет заподозрить Listeria monocytogenes в качестве возбудителя менингита. Результаты первичной микроскопии служат основанием для предварительной диагностики, которая немедленно сообщается лечащем врачу и определяет ход дальнейшего исследования.
Посев ликвора производят на следующие питательные среды: сывороточный агар (инкубация в нормальной атмосфере), 5% кровяной агар (инкубация в анаэробных условиях и в атмосфере, обогащенной 10% С02), шоколадный агар, среды для анаэробов.
Проверку роста проводят после ночной инкубации и в дальнейшем ежедневно до появления роста. При отсутствии роста в течение 7 дней выдается отрицательный результат. При появлении роста на какой-либо из сред делают мазки, окрашивают по Граму, проводят посевы на плотные питательные среды для выделения культур и их идентификации.
В большинстве случаев выделение микробов из ликвора свидетельствует об их этиологической роли. В редких случаях выделение УПМ может быть связано с контаминацией ликвора при его взятии. В таких случаях, чтобы избежать диагностической ошибки, следует повторить исследование. В случаях менингита, вызванного УПМ, лечебные мероприятия не оказывают столь быстрого стерилизующего эффекта, как при патогенных возбуди-
телях. Кроме того, должны быть проведены количественные исследования микрофлоры. Отсутствие микрофлоры в первичных мазках ликвора и отсутствие роста (или рост единичных колоний) на плотных питательных средах или наличие роста в жидких питательных средах могут свидетельствовать о нарушении правил асептики при взятии ликвора.
Микробиологическое исследование отделяемого из ротоглотки или носа, которое позволяет диагностировать инфекционные заболевания верхних дыхательных путей (ринит, фарингит, ларингит, тонзиллит), а также оценить эффективность их лечения.
Приём и исследование биоматериала
Когда нужно сдавать анализ Посев отделяемого верхних дыхательных путей на микрофлору (нос, зев)?
Показания к назначению:
- подозрение на инфекцию верхних дыхательных путей,
- оценка эффективности лечения.
Подробное описание исследования
Микрофлора верхних дыхательных путей
Микрофлора верхних дыхательных путей — это совокупность различных видов микроорганизмов, которые населяют нос, рот и глотку.
Как правило, качественный и количественный состав микрофлоры стабилен.
Среди представителей микрофлоры носа и зева выделяют комменсальные (дружественные, непатогенные) и условно-патогенные микроорганизмы.
Комменсальные микроорганизмы:
- нейссерии,
- лактобактерии,
- гемофильная палочка,
- дифтероиды,
- фузобактерии,
- актиномицеты.
Условно-патогенные микроорганизмы:
- грибы рода Candida,
- стафилококки,
- стрептококки,
- энтеробактерии.
Условно-патогенные микроорганизмы — потенциальный источник инфекции верхних дыхательных путей. Если снижается иммунитет, нарушается обмен веществ или баланс гормонов, условно-патогенные микроорганизмы подавляют рост представителей нормальной микрофлоры и приводят к инфекционному заболеванию.
Факторы, провоцирующие рост условно-патогенной микрофлоры:
- бесконтрольный приём антибиотиков,
- воспалительные заболевания верхних дыхательных путей,
- травмы рта и носа (в том числе после хирургического вмешательства),
- хронический стресс.
Инфекции верхних дыхательных путей
Инфекции верхних дыхательных путей (ИВДП) — поражение верхних отделов дыхательной системы чужеродными патогенами (вирусами, бактериями и грибами).
Инфекции верхних дыхательных путей распространены среди людей всех возрастов. Заражение ИВДП возможно в любое время, но пик заболеваемости обычно приходится на осень и зиму.
Инфекции верхних дыхательных путей:
- ринит — воспаление слизистой оболочки носа;
- фарингит — воспаление глотки;
- тонзиллит — воспаление глоточных и нёбных миндалин;
- ларингит — воспаление гортани;
- эпиглоттит — воспаление надгортанника.
Симптомы инфекционных заболеваний верхних дыхательных путей различаются в зависимости от того, какая часть носо- и ротоглотки поражена. Но можно выделить и общие проявления.
Симптомы инфекций верхних дыхательных путей:
- насморк, заложенность носа,
- боль в горле,
- чихание,
- кашель,
- повышение температуры тела,
- общее недомогание,
- боль в мышцах и суставах.
В отсутствие правильного и своевременного лечения возбудители инфекции верхних дыхательных путей могут опуститься в нижние отделы дыхательной системы и окружающие ткани с развитием гнойного воспаления и пневмонии.
Возбудители инфекций верхних дыхательных путей
В большинстве случаев инфекции верхних дыхательных путей вызывают вирусы.
Вирусы — возбудители ИВДП:
- риновирус,
- коронавирус,
- вирус гриппа и парагриппа,
- аденовирус,
- респираторно-синцитиальный вирус,
- вирус Эпштейна — Барр,
- энтеровирус Коксаки В.
Помимо вирусов, инфекционные заболевания верхних дыхательных путей могут вызывать бактерии.
Бактерии — возбудители ИВДП:
- пневмококк,
- β-гемолитический стрептококк группы А,
- дифтерийная палочка,
- микоплазма,
- хламидия,
- золотистый стафилококк,
- моракселла,
- клебсиелла.
Как правило, вирусы и бактерии попадают в дыхательные пути воздушно-капельным или контактно-бытовым путём.
Нередко причиной ИВДП становится инфекция ротовой полости, возникшая из-за кариеса или грибов рода Candida.
Диагностика инфекций верхних дыхательных путей
Чтобы определить возбудителя инфекционного заболевания и назначить лечение, врач направляет пациента на бактериологический анализ отделяемого верхних дыхательных путей — посев на микрофлору.
Посев отделяемого верхних дыхательных путей — культуральный метод исследования, который позволяет выделить из биоматериала пациента микроорганизмы, идентифицировать их и определить точное количество.
Посев отделяемого из зева или носа — стандарт диагностики ИВДП, который позволяет подтвердить или опровергнуть участие вирусов, бактерий и грибов в развитии болезни.
Чтобы правильно выбрать препарат для лечения ИВДП, дополнительно определяют чувствительность возбудителя к антибактериальным препаратам, бактериофагам и антимикотическим средствам.
Если ИВДП была диагностирована ранее, бактериологический посев отделяемого верхних дыхательных путей проводят, чтобы оценить эффективность терапии.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Кашель: причины появления, при каких заболеваниях возникает, диагностика и способы лечения.
Определение
Кашель – это реакция организма на любое раздражение дыхательных путей, мешающее проходимости воздуха. Раздражающими агентами могут быть мокрота, патогенная флора, инородные тела, пыль, опухоли и др.
В ряде случаев кашель может быть сигналом наличия опасных состояний, и тогда надо срочно обратиться к врачу.
Разновидности кашля
Кашель принято подразделять на сухой (непродуктивный) и влажный (продуктивный).
Кроме того, кашель классифицируют еще по некоторым параметрам:
Среди всех видов патологического кашля самым распространенным является затянувшийся сухой кашель при простудных заболеваниях и заболеваниях легких.
Возможные причины кашля
Острый кашель, как правило, обусловлен острыми вирусными инфекциями верхних и нижних дыхательных путей, наблюдается при пневмонии, обострениях бронхиальной астмы, хронической обструктивной болезни легких (ХОБЛ). В первые дни ОРВИ болезнетворные микробы и/или вирусы быстро размножаются в эпителиальных клетках дыхательной системы, поражая их своими токсинами. В ответ на это воздействие раздражаются рецепторы – чувствительные нервные клетки дыхательных путей. Начинается кашель. Поскольку мокрота образуется еще в небольшом количестве, кашель остается сухим. Если до простуды пациент был практически здоров и его иммунитет не был ослаблен, то сухой кашель сохраняется лишь первые 2–3 дня болезни, а затем начинает выделяться мокрота и кашель становится влажным. Таким образом дыхательные пути очищаются от слизи и патогенной флоры.
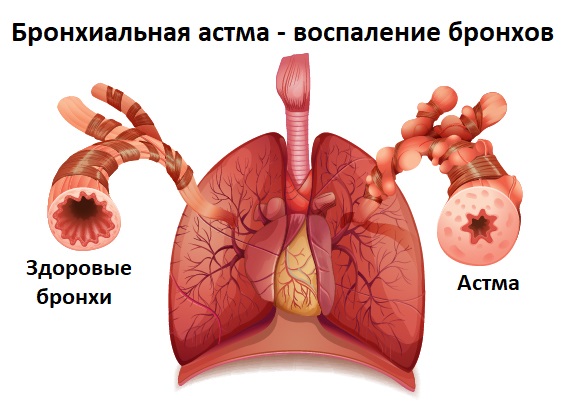
Причиной сухого кашля на выдохе является спазм (значительное сужение) бронхов. Такой спастический кашель может быть признаком бронхиальной астмы и аллергической реакции.
Причиной подострого (постинфекционного) кашля могут стать гиперреактивность бронхов, развитие трахеобронхиальной дискинезии, вследствие перенесенной вирусной, микоплазменной (Mycoplasma pneumoniae) или хламидийной (Chlamydophila pneumoniae) инфекции. Такой кашель часто не поддается стандартной противокашлевой терапии и становится затяжным. Его причиной у взрослых может быть коклюш.
Хронический продуктивный кашель может наблюдаться при ХОБЛ, абсцессе легкого, новообразованиях дыхательных путей и легких. Непродуктивный хронический кашель отмечается при заболеваниях желудочно-кишечного тракта, болезнях сердечно-сосудистой системы, а также может быть связан с приемом некоторых лекарственных препаратов.
Сердечный кашель - результат сердечно-сосудистых заболеваний, таких как артериальная гипертензия, ишемическая болезнь сердца, аритмии, постинфарктный кардиосклероз, пороки клапанов сердца, миокардиты, кардиомиопатии и др. Общим осложнением этих болезней становится хроническая сердечная недостаточность (ХСН), влекущая за собой венозный застой в обоих кругах кровообращения. Недостаточность кровообращения вызывает застой крови в легких и повышение давления в легочных сосудах. Для разгрузки (уменьшения давления) малого круга кровообращения (который снабжает кровью легкие) жидкая часть плазмы пропотевает в стенки альвеол, фактически внутрь легких. Вследствие этого появляется одышка и кашель.
Кашель на нервной почве – это покашливание, не связанное с раздражением кашлевых рецепторов. Нарушение чувствительности слизистой глотки возникает в результате сбоев в работе кашлевого центра, расположенного в мозге. Такой кашель возникает у пациентов с повышенной возбудимостью в ответ на стресс.
Причиной кашля может быть отек гортани, в результате которого сужается ее просвет. Количество воздуха, поступающего в дыхательную систему, сокращается, и ответной реакцией становится сильнейший кашель.
При каких заболеваниях возникает кашель
Острый (кратковременный) непродуктивный кашель (менее 3 недель) может быть симптомом ОРВИ, новой коронавирусной болезни COVID-19, бронхита, заболеваний ЛОР-органов (ринита, тонзиллита, фарингита, синусита, трахеита), когда к кашлю присоединяется насморк, боль или першение в горле, лихорадка, общая слабость, боль в мышцах и суставах. Острый непродуктивный кашель характерен для сердечной астмы, аспирации инородного тела. Он возникает в результате вдыхания раздражающих аэрополлютантов, а также может стать следствием фибробронхоскопии, ларингоскопии.
При обострении бронхиальной астмы приступ кашля выглядит следующим образом: свободный вдох, сменяющийся затрудненным выдохом с сильными кашлевыми толчками. Присутствуют также свистящее дыхание и одышка.
Острый (кратковременный) продуктивный кашель отмечается при пневмонии, остром бронхите, обострении ХОБЛ или хронического бронхита.
Подострый (затяжной) непродуктивный кашель (3—8 недель) возникает после перенесенной инфекции, при коклюше, некоторых заболеваниях ЛОР-органов, плевритах.
Подострый (затяжной) продуктивный кашель отмечается в дебюте хронических заболеваний легких.
Хронический (длительный) непродуктивный кашель (более 8 недель) является симптомом заболеваний желудочно-кишечного тракта (ГЭРБ, грыжа пищеводного отверстия, диафрагмы), интерстициальных заболеваний легких, объемных процессов в средостении, саркоидоза, заболеваний соединительной ткани (синдрома Шегрена, системной склеродермии).
Сердечный кашель сухой, мучительный, усиливается при физических нагрузках, в положении лежа, часто сопровождается посинением кожи губ, лица и других частей тела, болью в сердце и сердцебиением, набуханием шейных вен, одышкой.
Длительным и непродуктивным может быть невротический (психогенный) кашель - он проявляется короткими, достаточно сильными приступами, в промежутках между которыми больного беспокоят подкашливания и першение в горле (эти расстройства наблюдаются только днем, прекращаются ночью, во время приема пищи и разговора).
Хронический (длительный) продуктивный кашель характерен для ХОБЛ, бронхиальной астмы, муковисцидоза, новообразований дыхательных путей и легких, а также для туберкулеза легких.
Диагностика и обследования при кашле
Для постановки диагноза при остром кашле врач ориентируется на жалобы пациента (общее недомогание, повышенная температура тела, першение и/или боль в горле, сухой кашель, боль в груди, усиливающаяся на вдохе, появление гноя в мокроте и т.д.) и в случае необходимости назначает дополнительное обследование, крайне важное при подозрении на пневмонию. Обследование включает рентгенологическое исследование органов грудной клетки либо КТ грудной клетки и средостения, клинический анализ крови и общий анализ мочи, бактериологический посев мокроты.
Исследование, позволяющее получить данные о состоянии органов грудной клетки и средостения.

В динамике обследованы и изучены цитологический состав и микробиологические показатели слизистой оболочки верхних дыхательных путей (ВДП) в ходе лечения пациентов с реккурентными респираторными инфекциями (ПРРИ) и с бронхиальной астмой (БА). Обследовано 165 пациентов, которые были разделены на 3 группы: 48 здоровых (1 группа — контрольная), 54 пациента (группа 2) — ПРРИ, 63 пациента (группа 3) — с БА. Группам 2 и 3 проводили базисную терапию, которую дополняли иммунокорригирующей терапией. У больных с БА выявлены повышенные уровни нейтрофилов и эозинофилов при анализе цитологической картины отделяемого слизистой оболочки носа, у ПРРИ значения этих показателей были увеличены в меньшей степени.
Адекватное лечение привело к снижению частоты жалоб и симптомов заболеваний: двукратное уменьшение обострений бронхиальной астмой и частоты острых респираторных вирусных инфекций у ПРРИ, что сопровождались изменениями цитологических и микробиологический показателей слизистой носоглотки. Исследование динамики цитологических показателей показало значительное снижение частоты обнаружения эозинофилов в отделяемом слизистой оболочки носа обследуемых пациентов обеих групп и существенное снижение высеваемости различной микрофлоры. Сделан вывод о необходимости совершенствования диагностики состояния слизистой оболочки верхних дыхательных путей у ПРРИ и с БА с использованием данных цитологических и микробиологических исследований.
Ключевые слова: бронхиальная астма, пациенты с рекуррентными респираторными инфекциями, микрофлора.
The dynamics examined and studied the cytological composition and microbiological indicators of the mucous membrane of the upper respiratory tract (VDP) in the treatment of patients with recurrent respiratory infections (PRRI) and with bronchial asthma (BA). The study involved 165 patients who were divided into 3 groups: 48 healthy (1 group — control), 54 patients (group 2) — PRRI, 63 patients (group 3) — with BA. Groups 2 and 3 were given basic therapy, which was supplemented with immunocorrective therapy. In patients with asthma, elevated levels of neutrophils and eosinophils were detected when analyzing the cytological picture of the discharge of the nasal mucosa, in RRRI, the values of these parameters were increased to a lesser extent.
Adequate treatment led to a decrease in the frequency of complaints and symptoms of diseases: a twofold decrease in exacerbations of bronchial asthma and the frequency of acute respiratory viral infections in PRRI, which were accompanied by changes in the cytological and microbiological indicators of the nasopharyngeal mucosa. The study of the dynamics of cytological indicators showed a significant decrease in the frequency of eosinophil detection in the discharge of the nasal mucosa of the examined patients of both groups and a significant decrease in the germination rate of various microflora. It was concluded that it is necessary to improve the diagnosis of the condition of the mucous membrane of the upper respiratory tract in PRRI and with BA using data from cytological and microbiological studies.
Key words: bronchial asthma, patients with recurrent respiratory infections, microflora.
Достоверно ясно, что о нарушениях механизмов защиты организма в значительной мере свидетельствует бессимптомное носительство условно-патогенной и патогенной флоры, выступающее в качестве маркера вторичной иммунной недостаточности. Одним из важнейших показателей состояния механизмов локальной защиты верхних дыхательных путей (ВДП) является их колонизационная резистентность, которая зависит от характеристик нормофлоры биотопа и состояния неспецифической резистентности организма [4, 12]. Развивающиеся при этом негативные изменения состояния эубиоза и нарушения иммунного статуса приводят к сдвигам в эндоэкологии макроорганизма, являясь базисом для формирования целого ряда донозологических изменений, которые со временем могут трансформироваться в клинически выраженную патологию, что, как правило, и наблюдается с БА и у контингентов ПРРИ [6]. Однако эти вопросы остаются недостаточно изученными, в доступной литературе практически отсутствуют данные о цитологических и микробиологических характеристиках отделяемого носоглотки у таких детей, не описана динамика показателей состояния слизистой оболочки ВДП в процессе лечения, в том числе с применением иммунотропных лекарственных средств.
Цель работы — изучение динамики клеточного состава и микробиологических показателей слизистой оболочки носоглотки в ходе лечения ПРРИ и с бронхиальной астмой.
Материалы иметоды лечения. На базе терапевтического отделения Кызыл-кийской территориальной больницы проведено обследование 165 пациентов, которые были разделены на 3 группы:
‒ 48 здоровых пациентов (1 группа — контрольная);
‒ 54 пациента (группа 2) — ПРРИ;
‒ 63 пациента (группа 3) — с БА.
Распределение пациентов по возрасту, полу, средней длительности заболевания приведено в табл.1.
Распределение пациентов по возрасту иполу идлительности заболевания
Читайте также:

