Микробиологическое исследование паразиты
Обновлено: 22.04.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Гельминтоз (глистная инвазия): причины появления, симптомы, диагностика и способы лечения.
Определение
Гельминтозы - болезни человека, животных и растений, вызываемые паразитическими червями (гельминтами).
Причины появления гельминтозов
В настоящее время в России встречается более 70 видов из известных 250 гельминтов, паразитирующих в организме человека. Наиболее распространены круглые черви (аскариды, острицы, трихинеллы, власоглав), ленточные черви (свиной, бычий и карликовый цепни, широкий лентец, эхинококки), сосальщики (печеночная и кошачья двуустки).
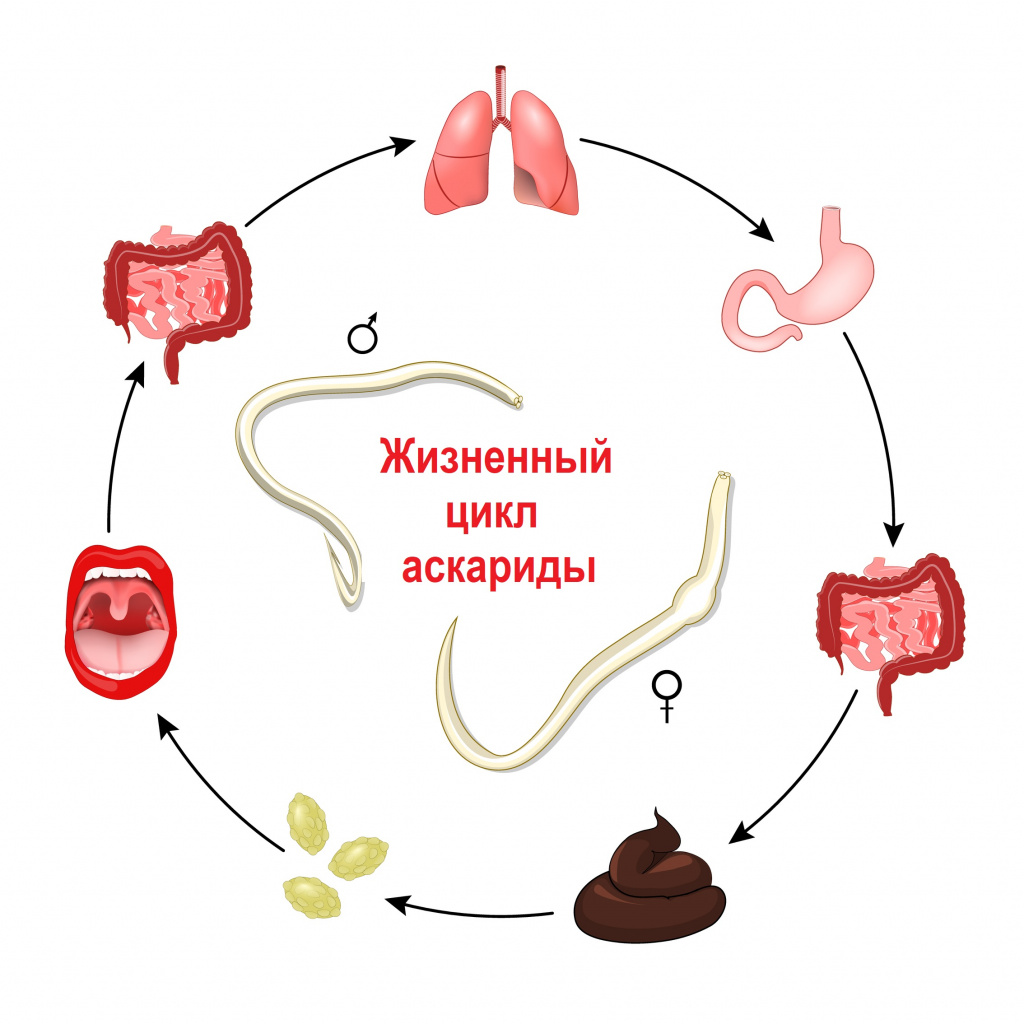
Заражение гельминтами чаще всего происходит после попадания в организм их яиц и/или личинок. В зависимости от механизма заражения и путей передачи гельминтозы подразделяются на: геогельминтозы, биогельминтозы и контактные гельминтозы. Геогельминты развиваются без промежуточных хозяев, биогельминты - с последовательной сменой одного-двух-трех хозяев, контактные гельминты передаются контактным путем.
Свиной цепень, бычий цепень, эхинококк и другие виды червей развиваются с последовательной сменой одного-двух-трех хозяев. Промежуточными хозяевами могут быть рыбы, моллюски, ракообразные, насекомые. Человек заражается этими гельминтами, употребляя в пищу продукты, не прошедшие полноценную термическую обработку:
- мясо говядины, инфицированную финнами (личинками) бычьего цепня;
- свинину, пораженную финнами свиного цепня;
- малосоленую и сырую рыбу с личинками описторхиса или широкого лентеца;
- сырую воду или обработанные этой водой овощи, фрукты.
Контактным путем - то есть при личном контакте здорового человека с зараженным, при пользовании общей посудой, предметами туалета, бельем, при вдыхании пыли в помещении, где находится зараженный человек - передаются энтеробиоз (возбудитель – острица) и гименолепидоз (возбудитель – карликовый цепень). В случае энтеробиоза часто случается самозаражение.
Гельминты определенного вида паразитируют в определенных органах, вызывая различные гельминтозы:
- в толстой кишке - свиной, бычий, карликовый цепни, нематоды (анкилостомы, аскариды, стронгилоиды), острицы, власоглав. Из просвета кишки личинки свиного цепня могут попадать в кровоток и распространяться по организму, оседая в жировой клетчатке, сосудах мышц, камерах глаза, мозге;
- в печени и желчных путях - трематоды (описторхис, клонорхис, фасциола). В печени первично располагаются эхинококковые кисты, а после их разрыва дочерние пузыри можно обнаружить в брыжейке, листках брюшины, селезенке и других органах;
- в органах дыхания - эхинококки, альвеококки, легочные сосальщики, вызывающие парагонимоз;
- в нервной системе - шистосомозы, парагонимоз, эхинококкоз и альвеококкоз;
- в органах зрения - онкоцеркоз, лоаоз, осложненные формы тениоза;
- в органах кровообращения - некатороз, шистосомозы, дифиллоботриоз;
- в лимфатической системе - филяриатозы, трихинеллез;
- в коже и подкожной клетчатке - анкилостомидоз, онкоцеркоз, лоаоз, личиночная стадия шистосомозов;
- в костной системе - эхинококкоз;
- в скелетной мускулатуре - трихинеллез, цистицеркоз мышечной ткани.
Срок жизни гельминтов в организме окончательного хозяина может быть различным, зависит от вида паразита и колеблется от нескольких недель (острицы) до нескольких лет (цепни) и десятилетий (фасциолы).
Классификация заболевания
У человека паразитируют черви двух видов:
- Nemathelminthes – круглые черви, класс Nematoda;
- Plathelminthes – плоские черви, которые включают в себя классы
- Cestoidea – ленточных червей,
- Trematoda – класс сосальщиков.
- биогельминтозы;
- геогельминтозы;
- контактные гельминтозы.
На организм человека гельминты оказывают различное воздействие:
- антигенное воздействие, когда развиваются местные и общие аллергические реакции;
- токсическое действие (продукты жизнедеятельности гельминтов вызывают недомогание, слабость, диспепсические явления);
- травмирующее действие (при фиксации паразитов к стенке кишечника происходит нарушение кровоснабжения с некрозом и последующей атрофией слизистой оболочки; могут нарушаться процессы всасывания; механическое сдавление тканей гельминтами);
- вторичное воспаление в результате проникновение бактерий вслед за мигрирующими личинками гельминтов;
- нарушение обменных процессов;
- в результате поглощения крови некоторыми гельминтами возникает анемия;
- нервно-рефлекторное влияние - раздражение гельминтами нервных окончаний провоцирует бронхоспазм, дисфункцию кишечника и т.д.;
- психогенное действие, проявляющееся невротическими состояниями, нарушением сна;
- иммуносупрессивное действие.
Для гельминтозов характерна стадийность развития. Каждая стадия характеризуется своими клиническими симптомами.
Жалобы пациентов в острой стадии:
- повышение температуры от нескольких дней до двух месяцев (субфебрильная или выше 38ºС, сопровождающаяся ознобом, резкой слабостью и потливостью);
- зудящие рецидивирующие высыпания на коже;
- локальные или генерализованные отеки;
- увеличение регионарных лимфатических узлов;
- боли в мышцах и суставах;
- кашель, приступы удушья, боль в грудной клетке, длительные катаральные явления, бронхит, трахеит, симптомы, симулирующие пневмонию, астматический синдром, кровохарканье;
- боль в животе, тошнота, рвота, расстройства стула.
Для кишечных гельминтозов характерны следующие синдромы:
- диспепсический (дискомфорт в животе, чувство переполнения после еды, раннее насыщение, вздутие живота, тошнота);
- болевой;
- астеноневротический (чувство сильной усталости, повышенная нервная возбудимость и раздражительность).
Кишечные цестодозы (тениаринхоз, дифиллоботриоз, гименолепидоз, тениоз и другие) протекают бессимптомно или с малым количеством симптомов (с явлениями диспепсии, болевым синдромом, анемией).
Трематодозы печени (фасциолез, описторхоз, клонорхоз) вызывают:
- хронический панкреатит;
- гепатит;
- холецистохолангит;
- неврологические нарушения.
Мочеполовой шистомоз проявляется появлением в самом конце мочеиспускания крови, частыми позывами к мочеиспусканию, болью во время мочеиспускания.
Альвеококкоз, цистицеркоз, эхинококкоз могут длительное время протекать бессимптомно. На позднем этапе нагноение или разрыв кист, содержащих паразитов, приводит к анафилактическому шоку, перитониту, плевриту и другим тяжелейшим последствиям.
Для заболеваний, обусловленных паразитированием мигрирующих личинок зоогельминтов, когда человек не является естественным хозяином, различают кожную и висцеральную формы. Кожная форма обусловлена проникновением под кожу человека некоторых гельминтов животных: шистосоматид водоплавающих птиц (трематоды), анкилостоматид собак и кошек, стронгилид (нематоды). При контакте человека с почвой или водой личинки гельминтов проникают в кожу. Возникает чувство жжения, покалывания или зуда в месте внедрения гельминта. Может наблюдаться кратковременная лихорадка, признаки общего недомогания. Через 1-2 недели (реже 5-6 недель) наступает выздоровление.
Висцеральная форма развивается в результате заглатывания яиц гельминтов с водой и пищевыми продуктами. В начале заболевания может быть недомогание, аллергическая экзантема (кожная сыпь). В кишечнике человека из яиц гельминтов выходят личинки, которые проникают через кишечную стенку в кровь, достигают внутренних органов, где растут и достигают 5-10 см в диаметре, сдавливают ткани и нарушают функцию органов. При расположении личинок цепней (цистицерки, ценура) в оболочках и веществе головного мозга наблюдается головная боль, признаки церебральной гипертензии, парезы и параличи, эпилептиформные судороги. Личинки также могут располагаться в спинном мозге, глазном яблоке, серозных оболочках, межмышечной соединительной ткани и др.
Исходом гельминтозов может быть полное выздоровление с ликвидацией гельминтов или развитие необратимых изменений в организме хозяина.
Диагностика гельминтоза
Диагноз гельминтоза устанавливается на основании совокупности жалоб, полученных от пациента сведений о течении болезни, данных лабораторных и инструментальных методов обследования.В острой фазе гельминтозов имеется реакция крови на присутствие гельминта в организме, поэтому рекомендованы следующие исследования:
-
клинический анализ крови: общий анализ, лейкоформула, СОЭ (с микроскопией мазка крови при наличии патологических сдвигов);
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Выявление патогенных простейших основано на идентификации морфологических особенностей возбудителя и в значительной степени зависит от правильного взятия клинического материала и адекватной фиксации. Ошибки при проведении этих мероприятий могут привести к получению ошибочных результатов.
Микроскопия простейших
Поиск патогенных простейших обычно проводят в субстратах, являющихся средой их обитания — испражнениях, крови.
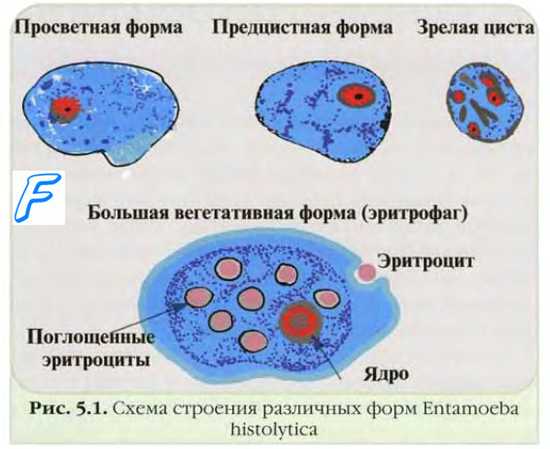
![Методы обнаружения простейших. Микроскопия простейших. Материал для выявления простейших. Выделение простейших]()
Микроскопия простейших в испражнениях
Макроскопическое исследование может выявить примесь крови и слизи (частый диагностический признак амебиаза). Выявление же самих паразитов проводят при светооптической микроскопии влажных нативных препаратов либо в окрашенных мазках. Микроскопия нативных препаратов. Небольшое количество испражнений наносят на предметное стекло, диспергируют в капле физиологического раствора, накладывают покровное стекло и исследуют под микроскопом на наличие трофозоитов (в жидкие испражнения физиологический раствор не вносят). Нативные препараты можно слегка докрашивать раствором Люголя, что облегчает выявление цист. Особенно внимательно необходимо исследовать кровь и слизь; желательно готовить отдельные препараты, не контаминированные (по возможности) фекальными массами. Методы накопления. Для выявления паразитов, присутствующих в незначительных количествах, применяют различные методы накопления. При исследовании кала наиболее часто используют седиментационный метод. Для исследования забирают каплю надосадочной жидкости, наносят на предметное стекло, где смешивают с равным объёмом физиологического раствора, накрывают покровным стеклом и микроскопируют.
Смесь на предметном стекле можно подкрашивать раствором Люголя, раствор разрушает трофозоиты, но позволяет хорошо визуализировать ядра и включения гликогена в цистах. Микроскопия окрашеных мазков позволяет не только выявлять, но и дифференцировать простейших; окраску наиболее часто проводят гематоксилином и эозином по Хайденхайну.
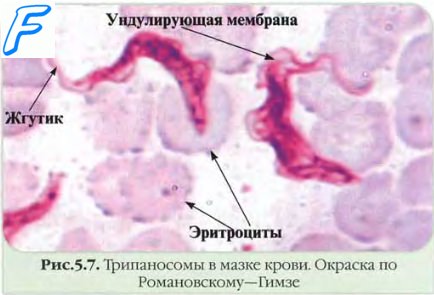
Микроскопия простейших в крови
Капиллярную или венозную кровь помещают в пробирку с антикоагулянтом (например, с этилендиаминтетрауксусной кислотой); исследования необходимо проводить по возможности быстро. Обнаружение простейших проводят микроскопией толстых и тонких мазков. Толстые мазки готовят из больших объёмов крови, нанесённых на предметное стекло; их обычно окрашивают по Романовскому-Гимзе, чего обычно бывает вполне достаточно для выявления паразитов. Тонкие мазки готовят для облегчения морфологической дифференцировки паразитов крови, мазки обычно окрашивают по Романовскому-Гимзе или Райту.
![Методы обнаружения простейших. Микроскопия простейших. Материал для выявления простейших. Выделение простейших]()
Образцы различных тканей
Образцы различных тканей отбирают, учитывая биологию паразита и его типичную локализацию. Образцы кожных покровов окрашивают обычными гистологическими красителями и микроскопируют. Биоптаты лимфатических узлов, селезёнки, печени, аспираты костного мозга и СМЖ забирают при подозрении на трипаносомозы или лейшманиозы. Часть образцов микроскопируют в виде нативных мазкоз, часть окрашивают по Романбвскому-Гимзе или Райту. Также возможно окрашивание образцов различными гистологическими красителями, наиболее употребляемыми для изготовления препаратов из исследуемых тканей.
Выделение простейших
Выделение возбудителей проводят только в специализированных лабораториях, институтах и центрах; проводить эти мероприятия в обычных бактериологических лабораториях недопустимо. На специальных средах и культурах тканей можно выделять и культивировать практически все патогенные простейшие.
Серологические исследования при диагностике простейших
Серологические исследования — наиболее распространённые и доступные диагностические методы. Их часто проводят при подозрении на токсоплазмоз, амебиаз (РИГА, латекс-агглютинация), лейшманиозы (РНГА), трипаносомозы (РНГА, РСК) и т.д.
- Вернуться в оглавление раздела "Микробиология."
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Лабораторная диагностика гельминтозов и протозоозов
Дата введения: с момента утверждения
1. Разработаны Институтом медицинской паразитологии и тропической медицины им.Е.И.Марциновского ГБОУ ВПО Первого Московского государственного медицинского университета (МГМУ) им.И.М.Сеченова (В.П.Сергиев, М.Н.Лебедева, В.Г.Супряга, Ф.П.Коваленко, Е.Н.Морозов, Е.Н.Понировский, Т.В.Продеус, Л.В.Федянина, А.А.Фролова, Е.Н.Жиренкина, К.Ю.Кузнецова, И.В.Кухалева, В.М.Ракова, Н.А.Турбабина, Е.А.Черникова, В.Д.Завойкин, О.П.Зеля, Л.Ф.Морозова, Г.Л.Плющева, Н.Р.Цаава); Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека (Т.М.Гузеева); ФБУЗ "Федеральный центр гигиены и эпидемиологии" Роспотребнадзора (Т.Г.Сыскова); кафедрой факультетской хирургии N 1 Первого МГМУ им.И.М.Сеченова (Г.X.Мусаев); отделом хирургии печени НИЦ Первого МГМУ им.И.М.Сеченова (Г.Г.Ахаладзе); ФБУН "Ростовский НИИ микробиологии и паразитологии" Роспотребнадзора (Т.И.Твердохлебова, Ю.И.Васерин, Е.П.Хроменкова, С.А.Нагорный, Л.Л.Димидова, А.В.Упырев, Л.В.Шишканова, Е.Ю.Криворотова, А.С.Кожухина); Военно-медицинской академией им.С.М.Кирова (С.С.Козлов); НИИ эпидемиологии и микробиологии им.Н.Ф.Гамалеи (Д.Б.Гончаров); Российским научным центром хирургии им.Б.В.Петровского РАМН (Г.А.Шатверян); кафедрой молекулярной биологии МГУ им.М.В.Ломоносова (А.А.Колесников); кафедрой тропических и паразитарных болезней Российской медицинской академии последипломного образования (А.Е.Беляев); Управлением Роспотребнадзора по городу Москве (Т.Н.Иванова); ФБУЗ "Центр гигиены и эпидемиологии в городе Москве" (Н.И.Тимошенко).
2. Рекомендованы к утверждению Комиссией по государственному санитарно-эпидемиологическому нормированию Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (протокол от 29 октября 2013 г. N 3).
3. Утверждены врио руководителя Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главного государственного санитарного врача Российской Федерации А.Ю.Поповой 26 ноября 2013 г.
4. Введены взамен МУК 4.2.735-99 "Паразитологические методы диагностики гельминтозов и протозоозов".
2-е издание, исправленное и дополненное
Область применения
1. Методические указания (далее - МУК) устанавливают порядок применения метода отбора проб и методов лабораторных исследований биологического материала от людей с целью обнаружения возбудителей гельминтозов и протозоозов, определения их видовой принадлежности.
2. Методические указания предназначены для специалистов паразитологических, микробиологических лабораторий санитарно-эпидемиологической службы, медицинских организаций независимо от их организационно-правовых форм, индивидуальных предпринимателей, а также научно-исследовательских институтов, осуществляющих лабораторную диагностику гельминтозов и протозоозов.
3. Методические указания носят рекомендательный характер.
Раздел 1. Лабораторная диагностика кишечных гельминтозов
1.1. Лабораторная диагностика кишечных гельминтов
Гельминты человека относятся преимущественно к двум типам червей: типу плоских червей Plathelminthes и типу круглых червей Nemathelminthes. Тип плоских червей, поражающих человека, включают два класса: ленточные черви - Cestoda и сосальщики - Trematoda. Тип круглых червей включает в себя один класс, имеющий медицинское значение, собственно класс Nematoda.
Большинство гельминтозов можно диагностировать прямыми методами, то есть по обнаружению в биологическом материале (кал, моча, мокрота, дуоденальное содержимое и пр.) гельминтов на разных стадиях развития (взрослых особей, яиц или личинок). Для этого используют макроскопические и микроскопические методы диагностики.
Отбор проб и условия доставки биологического материала в лабораторию для паразитологического исследования
Материалом для лабораторных паразитологических исследований на гельминтозы служит различный биологический материал: кал, кровь, моча, мокрота, лаважная жидкость, дуоденальное содержимое, содержимое кист, биопсионный или постоперационный материал, гистологические препараты внутренних органов и тканей и другой.
Отбор проб кала
Кал после дефекации отбирают из разных участков в количестве не менее 50 г.
Пробу помещают в чистую сухую, стеклянную или пластмассовую посуду с крышками.
Проба кала доставляется в лабораторию и исследуется в день дефекации.
При невозможности исследования пробы кала сразу после дефекации или в день поступления материала в лабораторию, пробу кала хранят при температуре от 0 до 4°С не более суток или собирают в консервант (прилож.8).
Отбор дуоденального содержимого (желчь )
Материал доставляется в лабораторию в чистых химических или центрифужных пробирках сразу после зондирования пациента натощак.
Доставляют все три фракции (порции "А", "В", "С") и исследуют сразу после поступления в лабораторию.
Порцию "А" доставляют для исследования на наличие возбудителей стронгилоидоза, трихостронгилоидозов, анкилостомидозов.
Порции "В" и "С" доставляют для исследования на яйца гельминтов, паразитирующих в протоках печени и желчном пузыре.
Отбор проб мокроты и лаважной жидкости
В лабораторию доставляется мокрота, выделенная при откашливании (не слюна и не слизь с носоглотки), в стерильной посуде с крышками. Проба мокроты исследуется сразу после поступления в лабораторию.
Лаважная жидкость в лабораторию доставляется в стерильной посуде и исследуется в день доставки.
Отбор проб мочи
В лабораторию доставляется моча, собранная между 10 ч утра и 14 ч дня, или все порции суточной мочи; желательно собрать мочу после физической нагрузки (например, 20-30 приседаний).
1.1.1. Методы исследования кала на яйца гельминтов
1.1.1.1. Макроскопические методы
Макроскопические методы служат для обнаружения в кале целых половозрелых гельминтов или их фрагментов невооруженным глазом или с помощью ручной лупы и/или стереомикроскопа.
На поверхности кала после дефекации можно видеть активно ползающих остриц; иногда выделяются с калом аскариды; у пациентов с дифиллоботриозом могут выделяться обрывки стробилы лентеца, а у инвазированных свиным цепнем с калом часто отходят членики гельминта. У инвазированных бычьим цепнем также происходит отхождение члеников, однако значительная доля члеников отходит активно вне дефекации. В живом состоянии такие членики пациенты часто сравнивают с лапшой. Пациент может доставить членики в лабораторию, но если они подсохли, то на лапшу они перестают быть похожи, а выглядят скорее как чешуйки размером с ноготь мизинца. Перед исследованием такой членик следует размочить в физиологическом растворе. Кроме того, за отхождением взрослых гельминтов необходимо следить при оценке результатов лечения.
Необходимые реактивы и оборудование
Предметные стекла большие (610; 812 см)
Лупа, микроскоп и бинокулярный стереоскопический микроскоп типа МБС
Подготовка к исследованию
1) Извлекать пинцетом или препаровальной иглой все подозрительные частицы и крупные образования на отдельное предметное стекло или чашку Петри.
2) Образования, подозрительные на фрагменты гельминтов, рассматривать под микроскопом МБС или под лупой между двумя предметными стеклами.
3) Мелких гельминтов рассматривать в капле глицерина или физиологического раствора под микроскопом при увеличении: окуляр 7 или 10, объектив 8 или 10.
4) Членики ленточных гельминтов поместить на предметное стекло, подсушить, закрыть другим предметным стеклом, слегка сдавить и рассмотреть строение матки.
5) Микроскопия всех визуально обнаруженных в кале паразитов или фрагментов обязательна для уточнения морфологических особенностей и идентификации паразита.
Применение. Метод применяется при идентификации зрелых паразитов или их фрагментов, например для дифференциальной диагностики члеников цестод (бычьего, свиного цепня и широкого, чаечного лентеца).
1.1.1.2. Микроскопические методы
1.1.1.2.1. Метод толстого мазка под целлофаном по Като и Миура
Толстый мазок представляет собой тонкий слой пробы кала на предметном стекле под гигроскопическим целлофаном, пропитанным смесью глицерина, фенола и малахитового зеленого.
Примечание. Гидрофильный целлофан горит в отличие от полиэтиленовой пленки, которая плавится и непригодна для исследования.
Необходимые реактивы и оборудование
Раствор фенола 6%-й (100 мл дистиллированной воды + 6 г фенола)
Раствор малахитового зеленого 3%-й (2,5 г малахитовой зелени + 75 мл дистиллированной воды)
Обезжиренные предметные стекла
Палочки стеклянные или деревянные
Валик или резиновая пробка
Подготовка к исследованию
Приготовление рабочего раствора Като: 100 мл 6%-го раствора фенола + 100 мл глицерина + 1,2 мл 3%-го раствора малахитового зеленого (раствор можно хранить длительное время в склянке из темного стекла с притертой крышкой).
При отсутствии фенола и малахитовой зелени можно использовать раствор глицерина (50 мл глицерина + 50 мл дистиллированной воды).
Подготовка целлофановых полосок. Нарезать полоски из гидрофильного целлофана, чтобы их размер соответствовал размеру предметного стекла.
1) Полоски поместить в рабочий раствор Като не менее, чем на 24 ч до проведения анализа. В 200 мл рабочего раствора можно обрабатывать до 5 тыс. новых целлофановых полосок.
2) На предметное стекло нанести пробу кала размером с горошину. Весь объем пробы кала растереть индивидуальной стеклянной палочкой по стеклу.
3) Мазок кала накрыть целлофановой полоской, обработанной в растворе.
4) Целлофан сверху притереть резиновой пробкой или специальным валиком, ширина которого соответствует или немного больше ширины предметного стекла, до получения тонкого, равномерного, прозрачного слоя.
5) Препарат просветляется при комнатной температуре в течение 20-30 мин.
6) Микроскопировать при увеличении: объектив 8 или 10, окуляр 7 или 10 (для уточнения морфологического строения яиц гельминтов - объектив 40).
1) Позволяет просмотреть в 20-30 раз больше препаратов кала, чем в нативном мазке без применения гигроскопических целлофановых полосок.
2) Выявляет яйца гельминтов желудочно-кишечного тракта при высокой и средней интенсивности инвазии.
1) Рекомендуется при массовых обследованиях населения на кишечные гельминтозы.
2) При обследованиях населения на анкилостомидозы, трихостронгилидозы и гименолепидоз необходимо учитывать, что применение данного метода имеет ограничения во времени, а именно возбудители указанных инвазий разрушаются в течение 1-2 ч.
1.1.1.2.2. Методы седиментации
Метод формалин-эфирной или уксусной седиментации
В основе методов седиментации (осаждения) лежит разность удельного веса используемых химических реактивов и яиц гельминтов: удельный вес яиц высокий, и они концентрируются в осадке.
Лабораторные исследования при инфекционных заболеваниях. Методы
Отбор проб для анализа при инфекционных заболеваниях. Для микробиологического исследования может быть отобрана любая ткань или физиологическая жидкость организма.
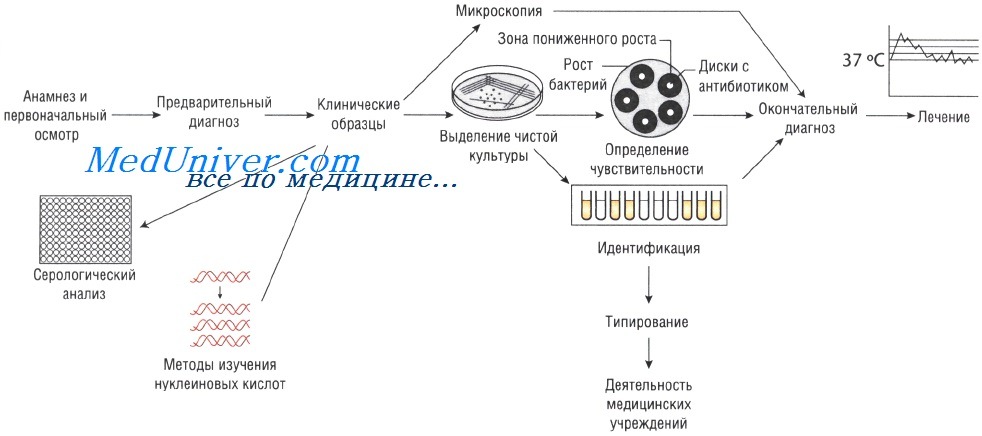
Выделение чистой культуры способствует увеличению количества бактерий и их точной идентификации. Для этого используют питательные среды. Если в образце присутствует нормальная микрофлора, то применяют избирательные (селективные) среды, позволяющие создать условия, неблагоприятные для роста непатогенных микроорганизмов и способствующие росту патогенной микрофлоры.
Для получения точных результатов следует выбрать оптимальный метод отбора проб и подойти к этому процессу с должной аккуратностью. При несоблюдении правил асептики контаминация проб крови микроорганизмами извне может привести к назначению неправильного лечения.
Большинство бактерий не способны существовать вне организма хозяина: облигатные анаэробы погибают под действием кислорода воздуха, а некоторые возбудители очень чувствительны к высыханию (Neisseria gonorrhoeae). Именно поэтому анализируемые образцы сразу после отбора должны быть помещены на подходящие среды или посеяны на среды для транспортировки.
Лабораторные методы исследования при инфекционных заболеваниях
Образцы могут быть проанализированы невооружённым глазом (например, для определения взрослых гельминтов в фекалиях или крови в мокроте). Микроскопия — быстрый и недорогой метод исследования, но требует высокого технического мастерства, характеризуется низкой чувствительностью: для точного определения необходимо присутствие большого количества возбудителей.
Кроме того, очень часто условно-патогенные микроорганизмы принимают за патогенные, что связано с недостаточной специфичностью метода.
Для определения возбудителя могут быть использованы различные красители (например, аурамин или окрашивание по Цилю—Нильсену для идентификации микобактерий). Уротропиновый серебряный окрашивает хитин клеточной стенки грибов и Pneumocystis jiroveci. Краситель Гимза применяют для окрашивания возбудителей малярии, лейшманий и других паразитов.
В основе иммунофлюоресцентного метода лежит применение специфических антител, помеченных флюоресцентными маркёрами. Микроскопию осуществляют в ультрафиолетовом свете, при этом возбудитель и связанные с ним антитела светятся ярко-зелёным цветом.
![Лабораторные исследования при инфекционных заболеваниях]()
Лабораторные исследования при инфекционных заболеваниях
Выделение чистой культуры возбудителя при инфекционных заболеваниях
Иногда, даже при выраженных клинических симптомах, возбудитель может присутствовать в очаге инфекции в количестве, недостаточном для микроскопического определения. В этом случае выделение чистой культуры позволяет увеличить численность микроорганизмов в исследуемом субстрате.
Существует два способа выращивания микроорганизмов: на жидких (увеличивается количество возбудителей) и твёрдых (исследуют отдельные колонии, в том числе и на чувствительность к антибиотикам) питательных средах. Большинство возбудителей инфекций человека достаточно требовательны к условиям культивирования. Именно поэтому питательные среды для их выращивания должны содержать белки, сахарозу и нуклеиновые кислоты (присутствующие в крови и сыворотке).
Кроме того, необходимо поддерживать соответствующий газовый состав: для культивирования анаэробов необходимо отсутствие кислорода, в то время как для облигатных аэробов (Bordetella pertussis) — наоборот. Оптимальная температура выращивания большинства патогенных микроорганизмов составляет 37 °С; культивирование некоторых фибов осуществляют при 30 С.
Идентификация возбудителя инфекционного заболевания
Симптомы заболеваний зависят от вида возбудителей, вызвавших их. Именно поэтому идентификация микроорганизма позволяет предположить клиническую картину вызываемого им заболевания (например, симптомы инфекции, вызванной Vibrio cholerae, отличны от таковых при заражении Shigella sonnei). Большое значение имеет выделение Neisseria meningitidis именно из спинномозговой жидкости. Идентификация микроорганизмов основана на:
• изучении морфологических свойств их колоний в агаре;
• различной окраске по Граму;
• способности возбудителей к образованию спор;
• изучении биохимических свойств (каталазный или коагулазный тесты).Точное определение штамма обычно зависит от результатов биохимического анализа (например, уреазный тест) или обнаружения продуктов жизнедеятельности бактерий (индол). Возбудителей, которые не могут быть выращены на питательных средах, идентифицируют при помощи молекулярно-генетического метода ДНК и секвенирования (например, Trophyrema whippelii).
![типирование при инфекционных заболеваниях]()
Определение чувствительности возбудителя инфекционного заболевания к антибиотикам
Если для эрадикации микроорганизмов достаточно стандартной дозы антимикробного препарата, то их считают чувствительными, если необходимо увеличение дозы лекарственного средства — относительно устойчивыми. Абсолютно устойчивыми (резистентными) называют возбудителей, в отношении которых антибиотикотерапия неэффективна. Существует широкий спектр различных методов определения чувствительности к антимикробным препаратам.
Методы Британской ассоциации антимикробной химиотерапии (British Society of Antimicrobial Chemotherapy — BSAQ и Института клинических лабораторных стандартов (Clinical Laboratory Standards Institute — С LSI) основаны на определении диаметра зоны слабого роста микроорганизмов на твёрдой питательной среде при применении антимикробного препарата.
Минимальную подавляющую концентрацию антибиотика измеряют с помощью Е-теста, растворения препарата в питательном бульоне или нанесения его на плотный агар. В последнем случае на засеянный исследуемыми микроорганизмами агар наносят бумажные диски, пропитанные различными антибиотиками (метод бумажных дисков).
Уровень чувствительности зависит от диаметра зоны пониженного роста бактерий. Однако тестирование in vitro предоставляет лишь приблизительные данные, так как в клинической практике многое зависит от состояния больного.
![Серологические исследования при инфекционных заболеваниях]()
Серологический анализ при инфекционном заболевании
Различные виды инфекций можно идентифицировать с помощью определения иммунного ответа, возникающего при внедрении возбудителя. Для этого существует большое количество различных методов: реакция агглютинации (РА), реакция связывания комплемента (РСК), реакция нейтрализации (РН) и иммуноферментный анализ (ИФА). Диагноз устанавливают на основании:
• определения уровня антител (IgM) в ответ на попадание в организм чужеродного белка (антигена);
• определения антигена.Молекулярный анализ при инфекционном заболевании
Южный блоттинг и метод гибридизации нуклеиновых кислот. Методы основаны на связывании меченой ДНК с анализируемым образцом, при условии, что он имеет определённую последовательность аминокислот. Связанный комплекс определяют по активности метки. Это достаточно быстрый и надёжный способ, который, тем не менее, уступает по чувствительности молекулярно-генетическим методам.
![Молекулярный анализ при инфекционных заболеваниях]()
Метод молекулярно-генетический (NAAT)
Для диагностики инфекционных заболеваний используют несколько молекулярно-генетических методов. Механизм выделения патогенной ДНК или РНК в количестве, достаточном для постановки диагноза, для каждого метода индивидуален. Так, при молекулярно-генетическом методе ДНК возбудителя разделяют на отдельные цепи, затем синтезируют праймеры для связывания с целевыми последовательностями. Образование новой ДНК катализирует полимераза.
Основное преимущество — достижение результата даже при наличии всего лишь одной копии ДНК. Благодаря автоматизированным системам и большому выбору специальных наборов эти методы стали доступны большинству диагностических лабораторий. Новые аппараты способны выдавать результат в режиме реального времени. Генетические методы позволяют идентифицировать микроорганизмы, выращивание которых отличается сложностью или сопряжено с риском для человека (например, Mycobacterium tuberculosis и Chlamydia trachomatis).
Кроме того, их можно использовать для определения генов, кодирующих устойчивость к действию антибиотиков (например, мутационный ген rpoВ, обеспечивающий устойчивость М. tuberculosis к рифампицину). Это позволяет заранее выбрать альтернативный путь лечения инфекционных заболеваний.
Иногда необходимо проводить типирование микроорганизмов в случае их распространения в больницах или в окружающей (внебольничной) среде.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Микробиологические методы исследования в офтальмологии
Для определения видовой и типовой принадлежности возбудителей внутриглазных бактериальных инфекций, а также чувствительности микроорганизмов к антибиотикам проводят микробиологические исследования.
Как известно, надежным методом точного определения видовой и типовой принадлежности возбудителей бактериальных инфекций является бактериологическое исследование, которое включает в себя бактериоскопическое исследование материала от больного, выделение искомого возбудителя в чистой культуре, идентификацию выделенной культуры (изучение морфологии, культуральных, биохимических и антигенных свойств).При бактериальных инфекциях прежде всего проводят бактериоскопическое исследование материала. Для ориентировочной простой окраски используется, например, метиленовый синий, а затем выполняется дифференциальная окраска по Граму.
При выделении чистой культуры применяют оптимальные среды с установленным рН. В некоторых случаях изменение рН обусловливается ростом бактерий. В таких случаях добавляются буферные смеси, например фосфатный буфер. Важным моментом является создание нужной концентрации кислорода и углекислоты, так как некоторые виды бактерий могут размножаться при пониженной концентрации кислорода (полуаэробные условия), другие — при полном отсутствии кислорода (анаэробные условия). Для некоторых кокков (стафилококки, гонококки) необходимо повышенное содержание углекислоты. Оптимальной температурой для большинства патогенных бактерий является 37 °С.
Для выделения чистой культуры (если материал не сильно загрязнен посторонней флорой) первичный посев делают на простые питательные среды, например мясопептонный агар. При обильной сопутствующей микрофлоре с целью выделения искомого микроба применяют различные диагностические питательные среды: селективные, способствующие росту отдельных групп бактерий и тормозящие рост других; среды обогащения (для накопления бактерий одной группы); дифференциально-диагностические и др.
Идентификацию выделенной культуры бактерий начинают с изучения культуральных свойств — характера роста микробов на плотных и жидких питательных средах. Большинство патогенных бактериальных видов дает пышный рост через 24-36 ч, некоторые виды могут размножаться быстрее (через 10-16 ч). Выделение чистой культуры и изучение морфологии дают возможность определить видовую принадлежность бактерий только ориентировочно.
![микробиологические методы исследования в офтальмологии]()
Для более точной характеристики возбудителя инфекции необходимо определение его биохимической активности, в частности — ферментных свойств. Диагностическое значение имеют четыре группы ферментов:
1) сахаролитические, расщепляющие углеводы;
2) протеолитические, расщепляющие белки;
3) стеатолитические, расщепляющие жиры;
4) окислительно-восстановительные.В микробиологической лаборатории Московского научно-исследовательского института глазных болезней им. Гельмгольца при выполнении подобных исследований используют следующую методику. В качестве простой питательной среды при выделении чистой культуры применяют мясоиептониый бульон с добавлением 0,2% глюкозы. Пробирки с первичными посевами выдерживают в термостате при температуре 37 °С в течение 3 сут. Посевы ежедневно просматривают и в случае обнаружения в них роста бактерий проводят бактериоскопическое исследование при окраске метиленовым синим и по Граму. Дальнейшее исследование проводят соответственно микрофлоре.
Если при бактериоскопии обнаруживается стафилококк, то с целью определения его гемолитической активности производят высев материала на кровяной агар, лицитовителазной активности — на желточно-солевый агар. Для определения плазмокоагулирующей активности ставятся реакции со стандартной сухой плазмой кролика. По совокупности результатов изучения гемолитической, лицитовителазной, плазмокоагулирующей активности и наличия пигмента дается заключение о патогенности стафилококка. В случае обнаружения при бактериоскопии грамотрицательных бактерий производится пересев материала на свернутую лошадиную сыворотку и простой агар. По характеру роста и наличию пигмента пиоцианина дается заключение о наличие синегнойной палочки.
Если пигмент отсутствует, то по характеру роста на питательной среде определяется кишечная палочка, идентификация которой производится путем пересева материала на среду Эндо.При определении чувствительности бактерий, выделенных у пациентов с внутриглазной инфекцией, в качестве тест-микроба служит золотистый стафилококк, выделявшийся от больного. Разведение культуры производится соответственно оптическому стандарту мутности, получаемому из Государственного НИИ стандартизации и контроля биологических препаратов им. Л. А. Тарасевича. В качестве питательной среды используют стандартный питательный агар. Для микробов, не растущих на простых питательных средах, к агару добавляют 5% кровь или сыворотку крови. Диски пропитываются различными антибиотиками (всего 18 наименований).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также: