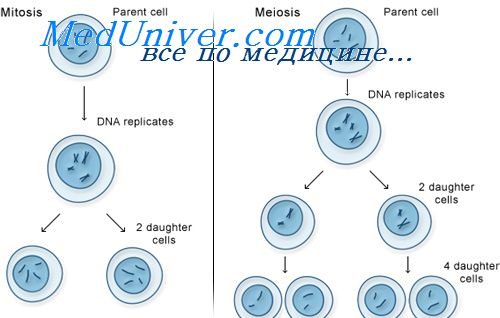
Митозом делятся клетки туберкулезной палочки
Обновлено: 24.04.2024
Особенности деления опухолевых клеток - раковый митоз
До начала деления клетка находится в фазе роста G1. Затем наступает фаза активного синтеза ДНК (S-фаза), в результате которой образуются две генетически идентичные копии хромосомальной ДНК клетки. Эти двойные хромосомы получили название сестринских хроматид. На данном этапе еще до начала митоза хроматиды можно четко наблюдать в световом микроскопе.
Непосредственно перед началом митоза клетка вступает в фазу G2, которая инициируется ферментами — циклин-зависимыми киназами. В самом начале митоза, в прометафазе, каждая из сестринских хроматид связывается с белками в своем центромере, что затем приведет к формированию митотического веретена. Когда все хроматиды свяжутся с белками, происходит образование митотического веретена, или собственно метафаза. В конце этого процесса ядерная мембрана исчезает.
Еще одна группа ферментов — комплекс промоторов анафазы — разлагает белки, препятствующие вхождению клетки в анафазу. В период анафазы эти ферменты расщепляют связи, соединяющие сестринские хроматиды друг с другом, и два набора хромосом расходятся к противоположным полюсам клетки. Клетка делится, и две дочерние клетки вступают либо в фазу продолжительного покоя (фаза G0), либо в фазу роста (фаза G1), когда в клетках вновь начинается репликация ДНК.
На каждой фазе клеточного роста существуют механизмы, которые отслеживают корректность проходимых в клетке процессов и не дают клетке вступить в следующую фазу при обнаружении ошибок. Митоз никогда не начнется, пока не будут выявлены все ошибки в клеточном ДНК. За это ответственны ферменты р53, ATM и СНК2. Формирование митотического веретена происходит под контролем белков BUB1 и MAD. При деактивации этих ферментов расхождение хромосом может произойти с нарушениями.
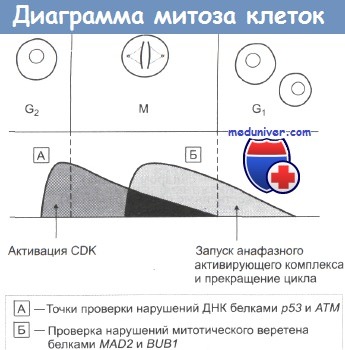
Диаграмма процесса митоза с указанием ключевых точек контроля.
А — точки проверки нарушений ДНК белками р53 и ATM
Б — проверка нарушений митотического веретена белками MAD2 и BUB1
Хромосомная нестабильность является отличительной чертой раковых опухолей, так как их клетки очень часто бывают анеуплоидны. Принимая во внимание сложность митотичес-ких процессов, можно представить себе множество механизмов, которые ответственны за эту нестабильность. В онкологии описано множество мутаций генов, поддерживающих нормальный митотический процесс.
Например, отмечаются мутации в гене р53 при различных локализациях рака. Потеря функциональности у белка р53 приводит к тому, что при делении клеток не выявляются многочисленные нарушения структуры ДНК, что приводит к постепенному дальнейшему нарушению генетической структуры и, в конечном счете, к развитию злокачественных новообразований. Некоторые регуляторные белки являются мишенями для вирусных онкогенов. Так вирус ВТКЛ-1 продуцирует белок TAX.
Последний инактивирует фермент MAD1, что ведет к хромосомной нестабильности. Существует и множество других белков, участвующих в регуляции митоза, мутации в которых приводят к развитию опухоли, как, например, АПК (мутация ведет к аде-номатозному полипоидному колиту).
Нестабильность хромосомной структуры в сочетании с характерными чертами злокачественного фенотипа (подвижность, инвазивность и метастазирование) делает опухолевые клетки более чувствительными к цитостатическим препаратам, чем нормальные клетки. Именно из-за такой высокой чувствительности в лечении рака возможно применять цитостатические агенты в таких дозах, которые оказывают летальное воздействие на опухолевые клетки, но не наносят необратимых повреждений здоровым тканям.
Учебное видео: митоз клетки и его стадии

Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021

Обзор
Деление клетки. Клеточный цикл.
Автор
Редакторы

Спонсор конкурса — дальновидная компания Thermo Fisher Scientific.
В организме человека присутствует примерно 300 типов клеток, и все они делятся на две большие группы: одни могут делиться и размножаться (то есть, они митотически компетентны), а другие — постмитотические — не делятся: это достигшие крайней стадии дифференцировки нейроны, кардиомиоциты, зернистые лейкоциты и другие.
В нашем организме существуют обновляющиеся ткани, в которых есть пул постоянно делящихся клеток, которые заменяют отработанные или погибающие клетки. Такие клетки есть в криптах кишечника, в базальном слое эпителия кожи, в костном мозге (кроветворные клетки). Обновление клеток может происходить довольно интенсивно: так, клетки соединительной ткани в поджелудочной железе заменяются каждые 24 часа, клетки слизистой желудка — каждые три дня, лейкоциты — каждые 10 дней, клетки кожи — каждые шесть недель, примерно 70 г пролиферирующих клеток тонкого кишечника удаляется из организма ежедневно [1].
Стволовые клетки, существующие практически во всех органах и тканях, способны делиться неограниченно. Регенерация тканей происходит за счет пролиферации стволовых клеток, которые могут не только делиться, но и дифференцироваться в клетки той ткани, регенерация которой происходит. Стволовые клетки есть в миокарде, в головном мозге (в гипокампе и в обонятельных луковицах) и в других тканях. Это открывает большие надежды в плане лечения нейродегенеративных заболеваний и инфаркта миокарда [2–4].
Постоянно обновляющиеся ткани способствуют увеличению продолжительности жизни. При делении клеток происходит омоложение тканей: новые клетки приходят на место поврежденных, при этом интенсивнее происходит репарация (устранение повреждений ДНК) и возможна регенерация при повреждении тканей. Не удивительно, что у позвоночных значительно выше продолжительность жизни, чем у беспозвоночных — тех же насекомых, у которых во взрослом состоянии клетки не делятся.
Но в то же время обновляющиеся ткани подвержены гиперпролиферации, что ведет к образованию опухолей, в том числе — злокачественных. Это происходит из-за нарушений регуляции деления клеток и повышенной частоты мутагенеза в активно делящихся клетках. По современным представлениям, чтобы клетка приобрела свойство злокачественности, ей необходимо 4–6 мутаций . Мутации возникают редко, и для того, чтобы клетка стала раковой — это подсчитано для фибробластов человека — должно произойти около 100 делений (такое число делений обычно происходит у человека примерно в возрасте 40 лет) [5].
В целях защиты от самого себя, в организме сформировались специальные клеточные механизмы супрессии опухолей. Один из них — репликативное старение клеток (сенесценция), заключающееся в необратимой остановке деления клетки в стадии G1 клеточного цикла. При старении клетка перестает делиться: она не реагирует на ростовые факторы и становится устойчивой к апоптозу.
Лимит Хейфлика
Феномен старения клеток был впервые открыт в 1961 г. Леонардом Хейфликом с коллегами на культуре фибробластов. Оказалось, что клетки в культуре фибробластов человека при хороших условиях живут ограниченное время и способны удваиваться примерно 50±10 раз, — и это число стали называть лимитом Хейфлика [6], [7]. До открытия Хейфлика господствовала точка зрения, что клетки бессмертны, а старение и смерть — это свойство организма в целом.
Эта концепция считалась неопровержимой во многом благодаря экспериментам Карреля, который поддерживал культуру клеток сердца цыпленка 34 года (ее выбросили лишь после его смерти). Однако, как выяснилось впоследствии, бессмертие культуры Карреля было артефактом, поскольку вместе с эмбриональной сывороткой, которая добавлялась в культуральную среду для роста клеток, туда попадали и сами эмбриональные клетки (и, скорее всего, культура Карреля стала уже далеко не тем, чем была в начале).
По-настоящему бессмертными являются раковые клетки. Так, клетки HeLa, выделенные в 1951 г. из опухоли шейки матки Генриетты Лакс , до сих пор используются цитологами (в частности, c помощью клеток HeLa была разработана вакцина против полиомиелита). Эти клетки даже побывали в космосе.
Еще один важный фактор биологического старения — строение хромосом и их кончиков — теломеров.
Теломерная теория старения
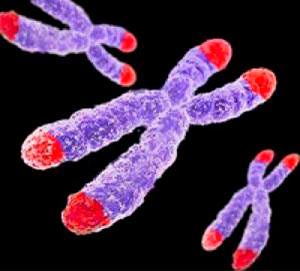
Рисунок 1. Теломеры — концевые участки хромосом. Поскольку хромосом у человека 23 пары (то есть, 46 штук), теломер получается 92.

Рисунок 2. Состав и структура теломер. Многократное деление клетки в случае отсутствия активности теломеразы ведет к укорочению теломер и репликативному старению.

Рисунок 3. Строение теломерного комплекса (шелтерина). Теломеры находятся на концах хромосом и состоят из тандемных повторов TTAGGG, которые заканчиваются 32-членным выступающим одноцепочечным фрагментом. С теломерной ДНК связан шелтерин — комплекс из шести белков: TRF1, TRF2, RAP1, TIN2, TPP1 и POT1.
Любопытно, что у мышей очень длинные теломеры (50–40 т.н.п., по сравнению с 10–15 т.н.п. у человека). У некоторых линий лабораторных мышей длина теломер достигает 150 т.н.п. Более того, у мышей теломераза всегда активна, что не дает теломерам укорачиваться. Однако это, как всем известно, не делает мышей бессмертными. Мало того: у них опухоли развиваются намного чаще, чем у людей, что позволяет предположить, что укорачивание теломер как механизм защиты от опухолей у мышей не работает [15].
При сравнении длины теломер и теломеразной активности у разных млекопитающих оказалось, что виды, для которых характерно репликативное старение клеток, имеют большую продолжительность жизни и большой вес. Это, например, киты, продолжительность жизни которых может достигать 200 лет. Таким организмам репликативное старение просто необходимо, поскольку слишком большое число делений порождает множество мутаций, с которыми необходимо как-то бороться. Предположительно, репликативное старение и есть такой механизм борьбы, который сопровождается к тому же репрессией теломеразы [16].
Старение диференцированных клеток происходит иначе. Стареют и нейроны, и кардиомиоциты, а ведь они не делятся! Например, в них накапливается липофусцин — старческий пигмент, который нарушает функционирование клеток и запускает апоптоз. В клетках печени и селезенки с возрастом накапливается жир.
Связь репликативного старения клеток со старением организма, строго говоря, не доказана, но возрастная патология сопровождается и старением клеток (рис. 4). Злокачественные новообразования пожилого возраста в большинстве своем связаны с обновляемыми тканями. Онкологические заболевания в развитых странах — одна из основных причин заболеваемости и смертности, причем независимым фактором риска раковых заболеваний является просто. возраст. Число смертей от опухолевых заболеваний увеличивается с возрастом по экспоненте, так же как и общая смертность. Это говорит нам, что между старением и канцерогенезом существует фундаментальная связь.
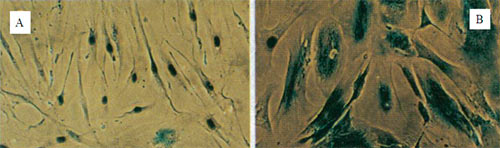
Рисунок 4. Гистохимически окрашенные на наличие β-галактозидазной активности фибробласты человека линии WI-38. A — молодые; B — старые (сенесцентные).
Теломераза — фермент, который был предсказан
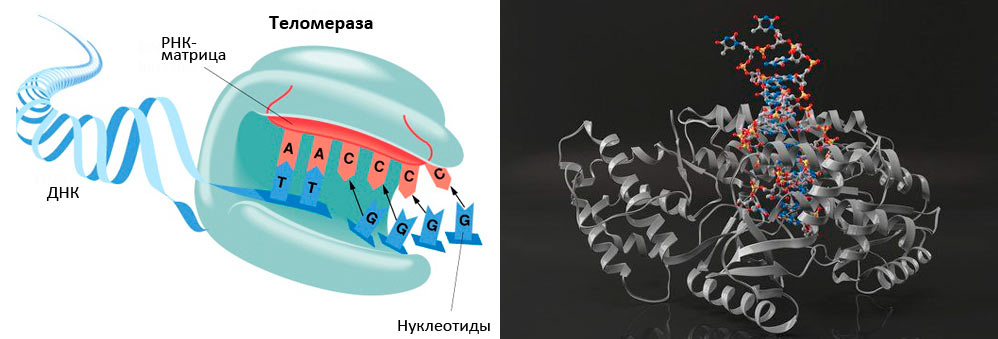
Рисунок 5. Теломераза содержит каталитический компонент (обратную транскриптазу ТERT), теломеразную РНК (hTR или TERC), содержащую две копии теломерного повтора и являющуюся матрицей для синтеза теломеров, и белок дискерин.
По данным Э. Блекберн, теломераза участвует в регуляции активности примерно 70 генов. Теломераза активна в зародышевых и эмбриональных тканях, в стволовых и пролиферирующих клетках. Ее обнаруживают в 90% раковых опухолей, что обеспечивает неудержимое размножение раковых клеток. В настоящее время среди препаратов, которые используют для лечения рака, есть и ингибитор теломеразы. Но в большинстве соматических клеток взрослого организма теломераза не активна.
В состояние сенесценции клетку могут привести многие стимулы — дисфункция теломер, повреждения ДНК, причиной которых могут быть мутагенные воздействия окружающей среды, эндогенные процессы, сильные митогенные сигналы (сверхэкспрессия онкогенов Ras, Raf, Mek, Mos, E2F-1 и др.), нарушения хроматина, стрессы и др. Фактически, клетки перестают делиться — становятся сенесцентными — в ответ на потенциально вызывающие рак события.
Страж генома
О молекулярных механизмах старения клеток

Рисунок 6. Схема клеточного цикла. Клеточный цикл подразделяют на четыре стадии: 1. G1 (предсинтетическая) — период, когда клетка готовится к репликации ДНК. В этой стадии может произойти остановка клеточного цикла в случае обнаружения повреждений ДНК (на время репарации). Если обнаруживаются ошибки в репликации ДНК, и они не могут быть исправлены репарацией, клетка не переходит на стадию S. 2. S (cинтетическая) — когда происходит репликация ДНК. 3. G2 (постсинтетическая) — подготовка клетки к митозу, когда происходит проверка точности репликации ДНК; если обнаружены недореплицированные фрагменты или другие нарушения в синтезе, переход на следующую стадию (митоз) не происходит. 4. М (митоз) — формирование клеточного веретена, сегрегация (расхождение хромосом) и формирование двух дочерних клеток (собственно деление).
Чтобы были понятны молекулярные механизмы перехода клетки в состояние сенесцентности, я напомню вам, как происходит деление клетки.
Процесс размножения клеток называют пролиферацией. Время существования клетки от деления до деления именуют клеточным циклом. Процесс пролиферации регулируется как самой клеткой — аутокринными ростовыми факторами, — так и ее микроокружением — паракринными сигналами.
Активация пролиферации происходит через клеточную мембрану, в которой присутствуют рецепторы, воспринимающие митогенные сигналы — это в основном ростовые факторы и межклеточные контактные сигналы. Ростовые факторы обычно имеют пептидную природу (к настоящему времени их известно около 100). Это, например, фактор роста тромбоцитов, который участвует в тромбообразовании и заживлении ран, эпителиальный фактор роста, различные цитокины — интерлейкины, фактор некроза опухолей, колониестимулирующие факторы и т.д. После активации пролиферации клетка выходит из фазы покоя G0 и начинается клеточный цикл [19] (рис. 6).
Сенесценция клеток и возраст-зависимые заболевания

Рисунок 7. Взаимосвязь между старением клеток и старением организма.
Сенесцентные клетки накапливаются с возрастом и способствуют возрастным заболеваниям. Они снижают пролиферативный потенциал ткани и истощают пул стволовых клеток, что приводит к дегенеративным нарушениям ткани и снижает способность к регенерации и обновлению.
Сенесцентные клетки характеризуются специфической экспрессией генов: они секретируют воспалительные цитокины и металлопротеиназы, разрушающие межклеточный матрикс. Получается, что старые клетки обеспечивают вялотекущее старческое воспаление, а накопление старых фибробластов в коже служит причиной возрастного снижения способности к заживлению ран (рис. 7). Старые клетки также стимулируют пролиферацию и малигнизацию близлежащих предраковых клеток, благодаря секреции эпителиального фактора роста [20].
Сенесцентные клетки накапливаются во многих тканях человека, присутствуют в атеросклеротических бляшках, в язвах кожи, в пораженных артритом суставах, а также в доброкачественных и пренеопластических гиперпролиферативных поражениях простаты и печени. При облучении раковых опухолей некоторые клетки также переходят в состояние сенесценции, тем самым обеспечивая рецидивы заболевания.
Таким образом, клеточное старение демонстрирует эффект отрицательной плейотропии, суть которого состоит в том, что хорошее для молодого организма, может стать плохим для старого. Самый яркий пример — процессы воспаления. Выраженная реакция воспаления способствует быстрому выздоровлению молодого организма при инфекционных заболеваниях. В пожилом же возрасте активные воспалительные процессы приводят к возрастным заболеваниям. Сейчас принято считать, что воспаление играет определяющую роль практически при всех возраст-зависимых заболеваниях, начиная с нейродегенеративных.

Обзор
Автор
Редакторы

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Перед тем, как разглядывать детали сперматогенеза, давайте взглянем на картину в целом [1]. Начнем совсем издалека — со строения генома. В нашем геноме 46 хромосом, из них 2 хромосомы половые (X и Y хромосомы), а остальные 22 пары — аутосомы. Это так называемый диплоидный набор — 2n. Он получается при слиянии яйцеклетки и сперматозоида, которые несут в себе гаплоидные наборы хромосом — n (22 аутосомы, по одной из каждой пары, и одну половую). Именно поэтому в каждом ребенке есть черты отца и матери. Изначально сперматогенез начинается со сперматогоний, исходных половых клеток с диплоидным набором хромосом (2n). Дальнейшие деления сперматогоний приводят к образованию сперматоцитов и именно сперматоциты вступают в мейоз, в результате которого образуются клетки с гаплоидным набором хромосом. Такие клетки называют сперматидами, они имеют круглую форму и внешне сильно отличаются от зрелых сперматозоидов. Поэтому в течение последней части сперматогенеза (ее еще называют спермиогенезом) происходит множество морфологических изменений и образуются зрелые сперматозоиды.
Однако есть еще пара важных вопросов, которые нам важно прояснить, прежде чем приоткрывать занавесу тайн сперматогенеза. В качестве модельного организма мы возьмем мышей, поскольку основные исследования по изучению сперматогенеза проводятся именно на них. И первый важный вопрос: а где же происходит вся эта вакханалия? Для сперматогенеза существует специальный парный орган — тестикулы (семенники). Внутри тестикул млекопитающих можно обнаружить семенные канальцы и межклеточное пространство. В тестикулах также присутствуют кровеносные и лимфатические сосуды, нервные клетки. В межклеточном пространстве обнаружены макрофаги, значительная часть которых находится на поверхности семенных канальцев.
Наиболее распространенным типом клеток, расположенных в межклеточном пространстве, являются клетки Лейдига, они секретируют тестостерон и другие андрогенные соединения. Эта функция важна тем, что способствует развитию вторичных половых признаков и обеспечивает нормальное течение сперматогенеза.
Семенные канальцы имеют U-образную форму, их внутренняя поверхность выстлана семенным эпителием, в котором протекает сперматогенез. Зрелые сперматозоиды попадают в просвет семенных канальцев, далее они направляются в средостение и затем накапливаются в эпидидимисе.
Теперь поговорим немного о том, что же мы хотим получить в конце нашего пути. Зрелый сперматозоид состоит из двух основных частей: это голова и хвост (флагелла) [1]. Отличительной особенностью сперматозоидов грызунов является крюкообразная голова, в то время как у копытных, плотоядных и приматов она округлая. В голове сперматозоида находится ядро, претерпевающее значительные изменения, о которых мы поговорим позже. Еще одним важным элементом, находящимся в голове сперматозоида, является акросома. Это мембранный пузырек с ферментами, который образуется из комплекса Гольджи. Его звездный час наступает при взаимодействии яйцеклетки со сперматозоидом: ферменты высвобождаются, растворяя оболочку яйцеклетки и помогая сперматозоиду проникнуть внутрь.
Для того чтобы добраться до яйцеклетки, у сперматозоида есть хвост (флагелла), который обеспечивает его подвижность [3]. Структурной основой флагеллы является аксонема — сложный комплекс на основе микротрубочек из белка тубулина. Микротрубочки образуют так называемую структуру 9×2+2: 9 дублетов микротрубочек располагаются по кругу, а в центе находятся две одиночные микротрубочки. От одного дублета к другому направлены динеиновые ручки, они обеспечивают скольжение дублетов относительно друг друга. Такое скольжение позволяет хвосту изгибаться в разных направлениях, в итоге его движение происходит по траектории, напоминающей воронку. С центральными микротрубочками дублеты связаны через белковые комплексы, которые называют радиальными спицами.
В хвосте сперматозоида на основе структурных различий выделяют несколько частей.
Самая ближняя к голове часть — соединительная. Именно в ней находится базальная пластинка, через которую происходит связь хвоста с головой.
За ней следует промежуточная часть, где находится митохондриальная спираль, состоящая из 50–75 митохондрий, вокруг которых вытягиваются 9 наружных плотных волокон. Митохондрии поставляют энергию для биения жгутика. Наружные плотные волокна представляют собой белковый комплекс, выполняющий структурную функцию. Промежуточная часть отделена от главной анулусом. Эта кольцевая структура помогает регулировать транспорт белков внутри хвоста.
В главной части уже нет митохондрий, снаружи появляется волокнистая оболочка, которая представляет собой две колонны. Колонны расположены вместо 3 и 8 наружных плотных волокон и соединены серией поперечных ребер. Колонны и ребра играют не только структурную функцию, предполагается, что они служат каркасом, на котором закрепляются ферменты, участвующие в регуляции созревания сперматозоида, подвижности хвоста и различных сигнальных путях.
Самой последней является концевая часть, где располагается аксонема и концы наружных плотных волокон и волокнистой оболочки.
Теперь мы вооружены и готовы начать наше путешествие! Первым делом познакомимся со сперматогониями — неспециализированными диплоидными клетками, с которых начинается сперматогенез.
Вначале было описано всего два типа сперматогоний [4], [5]. У первого, сперматогоний типа A, не обнаружили гетерохроматин в ядре, в то время как у второго, типа B, в ядре присутствовал гетерохроматин. Вскоре после этого был обнаружен тип сперматогоний с промежуточным количеством гетерохроматина — такие клетки были названы промежуточными (In) сперматогониями.
Что это значит для нас? Хроматин может находиться в активном состоянии или неактивном, активный хроматин мы называем эухроматином, а неактивный — гетерохроматином. Поскольку сперматогонии еще не определились со своей будущей профессией, то они себя не ограничивают и хранят генетический материал в активном состоянии. Однако решив стать зрелым сперматозоидом, сперматогония выбирает свой путь и знает, в каком направлении развиваться, поэтому всю ненужную для этого генетическую информацию переводит в неактивное состояние — гетерохроматин. Таким образом, увеличение количества гетерохроматина говорит нам об увеличении специализации клетки.
Сперматогония типа В дает начало прелептотеновым сперматоцитам, которые вступают в мейоз, необходимый для получения гаплоидных клеток [7]. Мейоз состоит из двух последовательных клеточных делений без промежуточной S-фазы. Профаза первого мейоза удлинена и ее разделяют на последовательные стадии: лептотена, зиготена, пахитена и диплотена. Во время лептотены происходит конденсация ДНК, в зиготене гомологичные хромосомы соединяются и компактизируются. На стадии пахитены происходит кроссинговер — обмен участками между гомологичными хромосомами с образованием новых комбинаций генов. Этот процесс повышает наследственную изменчивость, благодаря которой происходит эволюция. В диплотене происходит частичная деконденсация хромосом и экспрессия генов, необходимых для дальнейших процессов. На этом профаза заканчивается. Далее хромосомы расходятся к полюсам клетки и результатом первого деления первичных сперматоцитов с диплоидным набором хромосом (2n) становятся вторичные сперматоциты с гаплоидным набором хромосом (n). При втором делении к полюсам клетки расходятся хроматиды, и после второго деления мейоза образуются круглые сперматиды.
Со стадии круглых сперматид начинается спермиогенез. Клетки больше не делятся, во время спермиогенеза происходит лишь усложнение их структуры, образуется хвост и сперматозоид приобретает знакомый нам вид [3].
Как мы уже знаем, круглые сперматиды образуются после мейотического деления сперматоцитов. Затем во время шага 2–3 аксонема начинает удлиняться и достигает почти полной длины. В это время она окружена жгутиковой мембраной — продолжением клеточной плазматической мембраны. Также во время стадии 2–3 на дистальном конце жгутика начинают формироваться предшественники колонн. Столбцы фиброзной оболочки и ребра впоследствии собираются в дистально-апроксимальном направлении — в том направлении, которое станет основной частью сперматозоидов. Между этапами 6 и 7 базальное тело с прикрепленной аксонемой перемещается к ядру и тянет за собой плазматическую мембрану, после чего плазматическая мембрана окружает промежуточную часть жгутика. На этапе 8 внешние плотные волокна начинают собираться вдоль дублетов микротрубочек аксонемы от промежуточной части к концу хвоста, в конечном итоге растягиваясь по всей длине, но не достигая своего полного диаметра до этапа 16. Также на этапе 8 из комплекса Гольджи образуется акросома. Параллельно с этим образуется манчета [8] — напоминающая юбку структура из микротрубочек и актиновых филаментов, играющая важную роль в транспорте белков из головы в хвост.
На этапе 9 ядро начинает удлиняться и конденсироваться, благодаря этому клетки на дальнейших стадиях называют элонгированными сперматидами. В обычном состоянии ДНК в ядре упакована с помощью белков гистонов, однако для более плотной упаковки гистоны замещаются на протамины [9]. Поскольку протамины несут больше положительных зарядов, отрицательно заряженная ДНК упаковывается еще более плотно, что позволяет уменьшить риск повреждения генетической информации до слияния сперматозоида с яйцеклеткой. Однако при такой плотной упаковке не происходит транскрипция, поэтому все необходимые РНК синтезируются заранее и хранятся в виде рибонуклеопротеиновых комплексов. Также на 9 стадии начинает формироваться анулус и окружает аксонему у ее основания. На шаге 15 анулус мигрирует дистально вдоль аксонемы к будущему месту соединения промежуточной и главной частей. Анулус представляет собой структуру в форме кольца, которая разделяет промежуточную и главную часть хвоста, тем самым участвуя в регуляции транспорта. В начале этапа 15 митохондрии в развивающейся промежуточной части мигрируют к аксонеме и конденсируются вокруг нее и внешних плотных волокон. На этапе 16 избыточная цитоплазма удаляется как остаточное тело. Затем зрелые сперматозоиды попадают в просвет и выходят из тестикул.
Зрелые сперматозоиды попадают в эпидидимис (придаток яичка). Сперматозоиды передвигаются за счет биения ресничек эпителия, при этом созревание сперматозоидов продолжается, они приобретают подвижность [10]. В итоге в эпидидимисе происходит накопление и хранение зрелых сперматозоидов. Около 23×10 6 сперматозоидов находится в эпидидимисе мышей, из которых 73% имеют нормальное строение, а остальные не пережили путешествие так успешно, и у них наблюдаются различные дефекты (отсутствие подвижности, наличие двух голов и т.д.).
В заключение хочется отметить, что различные поколения половых клеток связаны не случайным образом, а образуют клеточные ассоциации фиксированного состава. Так, например, сперматиды на данном этапе спермиогенеза всегда связаны с одними и теми же типами сперматоцитов и сперматогоний [11]. В определенный момент времени в семенном эпителии находится 3–4 типа клеток. В связи с этим у мышей выделяется 12 типов поперечных срезов семенного эпителия.
Словарик
Акросома органоид сперматозоида, в котором находятся ферменты, необходимые для успешного слияния сперматозоида с яйцеклеткой. Аксонема структурная основа хвоста сперматозоида, состоящая из тубулиновых микротрубочек. Анулус кольцевая структура, которая располагается между главной и промежуточной частями хвоста сперматозоидов и способствует регуляции транспорта белков внутри хвоста. Аутосомы хромосомы, которые одинаковы у мужских и женских особей. Волокнистая оболочка комплекс белков, окружающий аксонему в главной части хвоста сперматозоида. Гемато-тестикулярный барьер барьер, образованный плотно сомкнутыми клетками Сертоли и позволяющий избежать аутоиммунной реакции. Гетерохроматин хроматин, находящийся в неактивном состоянии (в этих участках не происходит транскрипция). Гистоны, протамины ядерные белки, участвующие в упаковке ДНК. Клетки Ледига тип клеток в межклеточном пространстве тестикул, секретирующих тестостерон и другие андрогенные соединения. Клетки Сертоли тип клеток, окружающих участвующие в сперматогенезе клетки и обеспечивающих их питательными веществами. Кроссинговер процесс обмена участками между гомологичными хромосомами. Манчета напоминающая юбку структура из микротрубочек и актиновых филаментов и играющая важную роль для транспорта белков из головы в хвост. Наружные плотные волокна комплекс белков, окружающий аксонему в промежуточной части хвоста сперматозоида. Половые хромосомы хромосомы, которые различны у мужских и женских особей. Семенные канальцы U-образные каналы, внутренняя поверхность которых выстлана семенным эпителием, в котором протекает сперматогенез. Сперматиды тип клеток, которые завершают сперматогенез. Претерпевают значительные морфологические преобразования во время спермиогенеза. Сперматогенез процесс созревания мужских половых клеток (сперматозоидов) из стволовых клеток. Сперматогонии неспециализированные диплоидные клетки, с которых начинается сперматогенез. Спермиогенез часть сперматогенеза, во время которой происходит сильное изменение морфологии клетки. Включает в себя стадии круглых и элонгированных сперматид. Сперматоциты тип клеток, которые образуются из сперматогоний и вступают в мейоз, давая начало сперматидам. Тестикулы (семенники) половой орган у мужских особей, в котором происходит сперматогнез. Тестостерон половой гормон, необходимый для сперматогенеза, а также возникновения вторичных половых признаков: увеличения мышечной массы, роста волос на теле по мужскому типу, полового влечения к женщинам, низкого голоса и др. Эпидидимис (придаток яичка) орган мужской половой системы, служащий для накопления сперматозоидов. Эухроматин хроматин, находящийся в активном состоянии (в этих участках происходит транскрипция).
Второе деление мейоза. Амитоз и эндомитоз
Второе деление мейоза протекает как обычный митоз: хроматиды каждой хромосомы гаплоидного набора разъединяются и отходят к противоположным полюсам клетки.
В результате мейоза из одной исходной клетки — сперматогонии у мужчин или оогонии у женщин — возникают четыре гаметы, обладающие одинаковым гаплоидным числом хромосом, но благодаря происшедшему кроссинговеру отличающиеся друг от друга по генному составу. У мужчин четыре гаметы — сперматиды преобразуются в спермин, у женщин в процессе мейоза цитоплазма распределяется между клетками неравномерно, вследствие чего возникает одна крупная клегка — яйцо и три маленькие клетки — полярные тельца, которые дегенерируют.
Амитоз — прямое деление клетки путем перешнуровки ядра, а затем и цитоплазмы. Увеличенное ядро, не изменяя своей структуры, делится на две или много частей, при этом сохраняются ядерная оболочка и ядрышко. В подавляющем большинстве случаев деление ядра не сопровождается делением цитоплазмы, в результате чего образуются двуядерные или многоядерные клетки. В отличие от митотического деления при амитозе не образуется митотического аппарата, и отсутствует спирализация хромосом, и, по-видимому, не происходит правильного распределения генетического материала. Образовавшиеся клетки способны к дальнейшей жизнедеятельности, дифференциации, но не способны к размножению вследствие нарушения хромосомного набора.
По форме амитоз может быть равномерным, когда ядро путем перетяжки делится на два равных; неравномерным, когда образуется одно большое ядро и другое меньшего размера. Иногда ядро делится на ряд мелких ядер одинаковой и разной величины (фрагментация). Амитотически могут делиться фибробласты, гепатоциты, клетки эпидермиса, миоциты, невроциты вегетативной нервной системы и др.
Эндомитоз является специализированной формой митоза, при котором хромосомы проходят нормальный цикл удвоения и спирализации в пределах ядра. Ядерная оболочка на всех стадиях эндомитоза сохраняется, в цитоплазме не возникает митотический аппарат, не происходит деление клетки. В результате эндомитоза образуются крупные полиплоидные ядра с увеличенным в 3 раза и более набором хромосом. Примером полиплоидных клеток могут служить мегакариоциты костного мозга, некоторые клетки паренхимы печени.
Наряду с размножением и ростом происходит специализация клеток для выполнения ими в организме различных функций. Специализация характеризуется появлением в клетках комплекса признаков — биохимических, функциональных и структурных. Процесс становления и формирования признаков, характерных для клеток каждого морфофункционального типа, называют дифференциацией. Она приводит к клеточной неоднородности, что отчетливо обнаруживается при морфологическом исследовании клеток различных тканей и органов.
Дифференциация клеток проявляется в их форме (отростчатые нервные клетки, жгутиковые сперматозоиды), поверхности (всасывающая, или щеточная каемка у кишечных и почечных эпителиоцитов), наличии в цитоплазме органелл специального назначения и цитоплазматических включений. Причем в клетках могут быть неодинаково развиты и органеллы общего значения. Различия ядер проявляются неодинаковой их формой, структурой хроматина, числом ядрышек. Форма ядра часто связана с формой клетки. В сферических, полиэдральных или кубических клетках ядро имеет сферическую форму, в цилиндрических, призматических и веретеновидных — соответственно овоидную, призматическую и веретсновидную, в плоских клетках — плоскую. Форма ядра может быть обусловлена и физиологической активностью клетки. В клетках, обладающих высокой физиологической активностью, ядра часто имеют более сложную форму — бобовидную, сегментированную (лейкоциты).
Морфология туберкулёза человека. Палочка Коха. Тинкториальные свойства туберкулеза. Культуральные свойства возбудителя туберкулеза.
М. tuberculosis (палочка Коха) — тонкая, прямая или слегка изогнутая палочка, размером 1-10*0,2-0,6 мкм, со слегка закруглёнными концами (рис. 22-1). В молодых культурах палочки более длинные, а в старых склонны к ветвлению.
Бактерии туберкулёза способны образовывать L-формы, сохраняющие способность к инфицированию, а также фильтрующиеся формы, патогенетическая роль которых остаётся плохо изученной. Капсул не имеют, но образуют микрокапсулу.
Методом Циля-Нильсена окрашиваются в ярко-красный цвет. Содержат кислотонеустойчивые гранулы (зёрна Муха), располагающиеся в цитоплазме.
Культуральные свойства возбудителя туберкулеза
Туберкулёзные палочки могут расти как в аэробных, так и факультативно анаэробных условиях. Повышенное содержание СО2 (5-10%) способствует более быстрому росту. Оптимальная температура 37-38 °С; рН 7,0-7,2. Нуждаются в присутствии белков, глицерина, факторов роста (биотин, никотиновая кислота, рибофлавин и др.), ионов (Mg2+ K+, Na+ Fe2+) и др.
Для выращивания бактерий туберкулеза наиболее часто применяются глицериновые, картофельные с жёлчью, яичные, полусинтетические и синтетические среды. Наиболее оптимальна среда Лёвенштайна-Йёнсена.
На средах туберкулёзные палочки обычно образуют R-колонии; под влиянием антибактериальных препаратов бактерии могут диссоциировать с образованием мягких и влажных S-колоний.
В жидких средах палочки туберкулеза образуют сухую морщинистую пленку (на 7-10-е сутки), поднимающуюся на края пробирки; среда остаётся прозрачной. В жидких средах выявляют корд-фактор — важный дифференциальный признак вирулентности. Наличие корд-фактора обусловливает сближение бактериальных клеток в микроколониях и их рост в виде серпантинообразных кос.
На плотных средах рост палочек туберкулеза отмечают на 14-40-е сутки в виде сухого морщинистого налёта желто-, вато-кремового цвета. Зрелые колонии напоминают цветную капусту, крошковатые, плохо смачиваются водой и имеют приятный запах. Культуры плохо снимаются со среды, а при прокаливании трещат. Отличительная особенность М. tuberculosis— способность к синтезу значительного количества никотиновой кислоты (ниацина); ниациновый тест — важный метод дифференцировки микобактерий.
Читайте также:

