Могут ли волосы выпадать от токсоплазмоза у
Обновлено: 24.04.2024
Что провоцирует / Причины Токсоплазмозного энцефалита:
Возбудитель - Toxoplasma gondii относится к простейшим. Тип Protozoa. Подтип Sporozoa (обычно образуют споры; реснички, жгутики или псевдоподии отсутствуют). Класс Telosporea (имеется фаза полового размножения). Подкласс Coccidea (трофозоиты располагаются внутриклеточно, имеют "верхушечный комплекс"). Отряд Eucoccideia (жизненный цикл включает чередование бесполого - шизогония и полового размножения - спорогония). Подотряд Eimeriina (половая стадия в эпителии кишки у позвоночных животных; один хозяин или чередование двух хозяев; спорозоиты находятся в "споре"). Вид Toxoplasma gondii. Существует в трех основных формах: трофозоиты (эндозоиты), цисты и ооцисты. Трофозоиты имеют размеры 4-7 мкм в длину и 2-4 мкм в ширину, по форме напоминают полумесяц, хорошо окрашиваются по Романовскому. Они размножаются внутриклеточно во всех клетках млекопитающих за исключением безъядерных (эритроциты) и обнаруживаются в тканях в острой стадии инфекции. Скопление трофозоитов внутри одной клетки называют псевдоцистой. На трофозоиты активно воздействуют различные химиопрепараты (хлоридин, сульфаниламиды, макролиды и др.), они нестойки вне клетки и во внешней среде, быстро погибают при высушивании, прогревании, под влиянием дезинфицирующих средств.
Цисты формируются в организме хозяина, имеют собственную плотную оболочку. Размеры их до 100 мкм, внутри содержится 3000-5000 паразитов и более. Через плотную оболочку цист не проникают ни антитела, ни лекарственные препараты. Они очень устойчивы к различным воздействиям и в организме хозяина сохраняются десятки лет. Большая часть их локализуется в скелетных мышцах, миокарде, центральной нервной системе.
Ооцисты представляют собой образования овальной формы диаметром 10-12 мкм. Они формируются в слизистой оболочке тонкой кишки некоторых представителей семейства кошачьих и выделяются с испражнениями. Сроки появления ооцист в испражнениях кошки зависят от характера инфицирования и составляют от 3 до 24 дней. Экскреции продолжаются от 7 до 20 дней, за сутки с испражнениями может выделяться до 10 млн ооцист. Споруляция в выделенных фекалиях происходит через 2-3 дня (при температуре 24°С); она не реализуется при температуре ниже 4°С и выше 37°С. Ооцисты при благоприятных условиях сохраняются во внешней среде до 1 года и более. Именно они играют основную роль в передаче инфекции.
Культивируются токсоплазмы путем заражения лабораторных животных (белые мыши, морские свинки, кролики, хомяки), в развивающихся куриных эмбрионах, а также в культуре тканей. Имеются различные штаммы токсоплазм, некоторые из них отличаются высокой вирулентностью (штамм RH) и быстро приводят к гибели лабораторных животных, другие - маловирулентные (авирулентные) обычно не вызывают заметных клинических проявлений болезни.
Патогенез (что происходит?) во время Токсоплазмозного энцефалита:
Воротами инфекции чаще служат органы пищеварения, хотя известны случаи внутрилабораторных заражений высоковирулентными штаммами токсоплазм при повреждении кожи (пипеткой или шприцем с культурой токсоплазм). Внедрение возбудителя происходит в нижних отделах тонкой кишки, затем с током лимфы токсоплазмы достигают регионарных (мезентериальных) лимфатических узлов. Здесь развиваются воспалительные изменения с формированием инфекционных гранулем, напоминающих по клеточному составу туберкулезные или бруцеллезные гранулемы. Мезентериальные лимфатические узлы значительно увеличиваются. Затем токсоплазмы попадают в кровь, разносятся по всему организму и фиксируются в различных органах и тканях (печень, селезенка, лимфатические узлы, нервная система, глаза, миокард, скелетные мышцы). В этих органах образуются скопления паразитов в виде цист, которые могут сохраняться в организме десятки лет и даже пожизненно. В местах фиксации возникают воспалительные очаги, а в некоторых органах (нервная система, скелетные мышцы) - очажки некроза, в которых затем откладываются соли кальция и образуются кальцинаты.
В результате жизнедеятельности паразита и выделения антигенов и аллергенов наступает аллергическая перестройка организма (по типу реакций гиперчувствительности замедленного типа) и вырабатываются антитела, которые выявляются в различных иммунных реакциях (РСК, реакция с красителем Сэбина-Фельдмана, РПГА, ИФА и др.). В развитии иммунитета большое значение имеют как клеточные, так и гуморальные факторы. Наличие антител предохраняет от нового заражения даже высоковирулентными штаммами токсоплазм и обусловливает бессимптомное (латентное) течение токсоплазмоза у большинства инфицированных лиц. При ослаблении защитных сил организма и снижении напряженности иммунитета может наступить обострение заболевания (переход латентной формы в манифестную).
Обострение хронического токсоплазмоза, как правило, провоцируется интеркуррентными заболеваниями (грипп, ОРЗ, пневмонии и др.) и может наблюдаться иногда спустя длительное время (до 10-20 лет) после инфицирования. Описаны обострения с развитием тяжелого токсоплазмозного энцефалита после лечения лиц с латентным токсоплазмозом цитостатиками и иммунодепрессантами. В последние годы важное значение приобрела проблема генерализации латентного токсоплазмоза у ВИЧ-инфицированных. В этих случаях токсоплазмоз приобретает острое злокачественное течение с развитием некротического локализованного или диффузного менингоэнцефалита, в процесс вовлекаются глаза и многие органы (сердце, печень, легкие). На фоне развернутой картины СПИДа наслоившееся обострение (генерализация токсоплазмоза) может приводить к гибели больных.
Основная роль в развитии токсоплазмоза у лиц с иммуносупрессией отводится нарушениям продукции цитокинов. Показано, что при развитии токсоплазмоза на фоне ВИЧ-инфекции резко снижается как концентрация сывороточного гамма-интерферона, так и его способность активировать макрофаги. К факторам защиты относят интерлейкин-12, ФНО-, CD-8+, к факторам, способствующим генерализации заболевания - интрелейкины-4, -6, -10.
В патогенезе манифестных форм хронического токсоплазмоза основную роль играет развитие реакций гиперчувствительности замедленного типа к антигенам токсоплазм и продуктам их жизнедеятельности.
Симптомы Токсоплазмозного энцефалита:
Токсоплазмозный энцефалит служит основной причиной заболеваемости и смертности у больных со СПИДом. Заболеваемость токсоплазмозным энцефалитом среди больных этой категории, имеющих антитела к токсоплазмам, колебалась от 6 до 12%. На основании этого полагают, что имелось приблизительно 170 случаев токсоплазмозного энцефалита среди 7000 больных СПИДом, о которых сообщалось в 1984 г., а развитие еще 150 случаев ожидается среди 7000 больных, которые должны заболеть СПИДом по прогнозу на 1985 г.
Частота случаев токсоплазмозного энцефалита у больных со СПИДом и энцефалитом, как сообщалось, колебалась от 25 до 80%. Диагноз токсоплазменного энцефалита следует иметь в виду у лиц с заболеванием центральной нервной системы, не относящихся к группе риска по СПИДу, так как гетеросексуальная передача вируса лейкоза Т-клеток человека (HTLV III) приводит к развитию СПИДа у лиц, не относящихся к типичным группам повышенного риска.
К внешним признакам и симптомам токсоплазменного энцефалита у больных со СПИДом относят озноб, лихорадку, головную боль, припадки, депрессию и неврологические нарушения; эти проявления могут возникать в сочетании с хориоретинитом. У большинства больных со СПИДом и токсоплазмозным энцефалитом в сыворотке отсутствуют специфические антитела, указывающие на наличие острого токсоплазмоза. Демонстрация повышения титра антител к токсоплазмам в спинномозговой жидкости, но не в сыворотке свидетельствует о токсоплазмозном энцефалите у больных со СПИДом.
Диагностика Токсоплазмозного энцефалита:
В спинномозговой жидкости выявляют плеоцитоз, повышение содержания белка и гипогликорахию; в препаратах из центрифугата спинномозговой жидкости могут быть обнаружены тахизоиты. При исследовании спинномозговой жидкости (или тканей мозга) на наличие вирусов методами культивирования необходимо тщательно контролировать клеточные культуры с целью обнаружения токсоплазм, также способных вызывать формирование бляшек или обширные цитопатические эффекты. Клеточные культуры могут быть окрашены красителем Гимзы.
При компьютерной томографии головного мозга наблюдаются признаки диффузного энцефалита и/или одного или нескольких очагов объемного поражения. Внутривенное введение контрастного вещества может выявить кольцевидные, узелковые, мишеневидные поражения в коре или белом веществе, при этом отмечается тенденция к локализации этих поражений глубоко в пределах базальных ганглиев. В начальной фазе инфекционного процесса отклонения от нормы на сканограммах головного мозга выявляются не всегда; иногда первые признаки нарушений впервые могут появиться спустя несколько недель после заражения.
Исследования с задержкой в 1 ч с двойной дозой контрастного вещества помогают выявить поражения, неразличимые на простых сканограммах. При возможности следует произвести биопсию пораженных участков головного мозга, обнаруженных на сканограммах, так как дифференциальная диагностика этих поражений включает энцефалиты, вызываемые грибками родов Candida и Aspergillus, микобактериями и Cryptococcus neoformans, равно как и многоочаговую лейкоэнцефалопатию и лимфому.
При стандартных методах окраски токсоплазмы обнаруживаются только в 50% биоптатов головного мозга от больных с токсоплазмозным энцефалитом. Однако при использовании специфических иммуногистологических методов окрашивания тахизоиты, цисты и/или антигены токсоплазм обнаруживают в биоптатах, полученных от большинства зараженных больных.
Если у больных СПИДом появляются неврологические признаки или симптомы, а на сканограмме головного мозга очаговых изменений не выявляется, однако отмечается положительный тест Сейбина-Фельдмана или высокий уровень IgG в реакции непрямой флюоресценции антител (НФА), целесообразно проведение пробного лечения токсоплазмозного энцефалита. Если при компьютерной томографии на сканограммах выявляются очаговые нарушения, антитела к токсоплазмам, а проведение биопсии затруднено локализацией очагов поражения или клиническим состоянием больного, следует начать предварительное лечение токсоплазмоза.
В подобных случаях положительный эффект от проводимого лечения, наблюдающийся в течение первых 7- 10 дней, подтверждает диагноз токсоплазмозного энцефалита. Если лечение осуществляли с применением кортикостероидов, признаки улучшения, выявленные рентгенографическими методами, не обеспечивают надежного свидетельства в пользу терапевтического эффекта.
Лечение Токсоплазмозного энцефалита:
При установлении диагноза энцефалита больной должен быть госпитализирован в специализированное (инфекционное) или неврологическое отделение. Назначают строгий постельный режим. Больной нуждается в постоянном наблюдении.
На догоспитальном этапе показано применение дегидратационных средств (лазикс, диакарб).
При выраженных менингеальных и энцефалитических симптомах (сильная головная боль, боль в мышцах, токсикоз, рвота, очаговые симптомы) вводят изотонический раствор натрия хлорида, раствор Рингера-Локка. Одновременно подкожно или внутримышечно вводят витамины группы В, аскорбиновую кислоту (не менее 1,5 г в сутки).
Если стандартная схема лечения с применением хлоридина (по 25 мг в сутки), трисульфапиримидина (по 6 - 8 г) или сульфадизина неэффективна, суточную дозу хлоридина следует увеличить до 50 мг. В случае развития у больного неблагоприятной реакции на сульфаниламидный препарат рекомендуется использовать только пириметамин в дозе 50 мг в сутки. Необходимо применять фолиевую кислоту в дозе до 15 мг в сутки, особенно когда отмечается депрессия костного мозга в результате воздействия хлоридина. Однако если депрессия костного мозга у больных со СПИДом обусловлена иммунными механизмами, профилактический прием фолиевой кислоты не устраняет лейкопению.
Профилактика Токсоплазмозного энцефалита:
Меры по профилактике инвазии включают вмешательство в цикл передачи, и их соблюдение особенно важно для больных с иммунодефицитом и серонегативных беременных женщин. Очень важно, чтобы больные из групп риска знали о том, как можно избежать заражения цистами (плохая кулинарная обработка мяса) и спорулированными ооцистами (при контактах с домашними кошками).
Для уничтожения цист мясо следует прогревать до 60°С или замораживать при - 20°С. (Бытовые морозильные камеры не способны создавать и поддерживать такую температуру.) После приготовления пищи из сырого мяса руки следует тщательно мыть; необходимо также мыть фрукты и овощи, которые могут быть загрязнены ооцистами. Обработка продуктов сухим жаром (66°С) или кипящей водой делает ооцисты неинфективными. Следует избегать контактов с экскрементами кошек.
Данных, позволяющих дать четкие рекомендации относительно использования цельной крови, переливания лейкоцитов или трансплантации органов в случае обнаружения у донора антител против токсоплазм нет. Вместе с тем не следует использовать кровь или продукты крови, полученные от лиц с наличием антител против токсоплазм, для переливания больным с иммуносупрессией, а органы для трансплантации серонегативным реципиентам следует брать от лиц с отрицательными серологическим реакциями на токсоплазмоз.
К каким докторам следует обращаться если у Вас Токсоплазмозный энцефалит:
Вас что-то беспокоит? Вы хотите узнать более детальную информацию о Токсоплазмозного энцефалита, ее причинах, симптомах, методах лечения и профилактики, ходе течения болезни и соблюдении диеты после нее? Или же Вам необходим осмотр? Вы можете записаться на прием к доктору .
На сервисе СпросиВрача доступна консультация гинеколога по любой волнующей Вас проблеме. Врачи-эксперты оказывают консультации круглосуточно и бесплатно. Задайте свой вопрос и получите ответ сразу же!

Здравствуйт!Если все скрининги былои в норме, то вм вообще не должно приходить в голову ничего плохого.Это главный показатель благополучия.
Яна, я почитала, что эта инфекция затрагивает органы зрения и слуха, ЦНС. Насколько я знаю, скрининги этого не показывают?


Тогда просто сдайте М и ДЖИ, что касается ДЖИ , можно сдать на авидность, чтобы понять КАК ДАВНО переносили инфекцию

Здравствуйте. Скажите пожалуйста, насколько в близком контакте вы были с котёнком? Вы его обнимали? Прижимали к лицу?

Валерия, нет, насколько я понимаю, что это уже не входит в обязательный перечень анализов. Я веду беременность бесплатно в ЖК.

Вы переносили что-то по типу ОРВИ во время беременности? Чувствовали недомогание?
Сколько раз вы сдавали клинический анализ крови?
Валерия, да, я болела ОРВИ, я знаю, что это могут быть похожие симптомы. Я болела на 4-5 неделе ОРВИ, точнее, у меня всегда любая простуда выражается больным горлом и насморком на несколько дней. Вот такое было

Только один раз? Больше не болели?
Если бы в 4-5 недель был токсоплазмоз, то беременность закончилась бы ранним выкидышем. У вас растет здоровенький малыш
Ещё были эпизоды ОРВИ?
Валерия, большое спасибо :) То есть, скорее всего на раннем сроке был бы выкидыш, а если бы все было бы хорошо, то на скринингах были бы какие-то отклонения? Бесследно это бы не прошло?
Болела коронавирусом в 26 недель, который Омикрон, по сути выглядело как ОРВИ.

Всё верно. Бесследно он бы не прошел. Для своего успокоения можно сдать иммуноглобулины. Но это необязательно
Валерия, то есть такой ситуации, что по всем показателям все супер (общий анализ крови, кстати, вы до этого спросили - сдавала вроде бы раз в каждый триместр), скрининги, кровь, моча - все хорошо, то это точно не было заражения? Т.е. такой ситуации, когда внутри малыш вроде по всем данным чувствует себя хорошо, а сказываться это начнет после рождения? Или слепота - это тоже можно понять по косвенным признакам на скрининге?

Как минимум, в крови бы выявили сдвиг формулы влево, были бы изменения в биохимии и коагулограмме
Нет, слепоту по УЗИ не видно. Но есть много изменений в анализах, которые помогут заподозрить токсоплазмоз
Какие факторы приводят к нарушению роста волос? Обратима ли алопеция, вызванная токсическим действием лекарственных препаратов? Возможно ли лечение медикаментозной алопеции? Воснове нарушения роста волос (их поредения различной степени выра
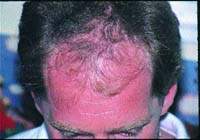 |
Какие факторы приводят к нарушению роста волос?
Обратима ли алопеция, вызванная токсическим действием лекарственных препаратов?
Возможно ли лечение медикаментозной алопеции?
Воснове нарушения роста волос (их поредения различной степени выраженности), а также (реже) развития гипертрихоза лежат многочисленные эндогенные и экзогенные факторы. Среди последних немалую роль играет применение различных медикаментозных средств. При этом выпадение волос может наблюдаться не сразу, а через несколько недель или месяцев после начала приема лекарственного препарата или же начаться (либо стать) более выраженным после его отмены. Обычно при длительном применении того или иного препарата развивается диффузная алопеция, причем в патологический процесс вовлекается почти исключительно волосистая часть головы. Лишь в крайне редких случаях возможно развитие универсального облысения, что, в частности, наблюдается при приеме цитотоксических препаратов, например используемых при наличии у пациента опухолевого процесса.
Однако не во всех случаях выпадение волос определяется длительностью приема какого-либо лекарственного средства. Некоторые препараты, например непрямые антикоагулянты, дают такой эффект только в достаточно высоких дозах, а продолжительность терапии в развитии облысения не имеет существенного значения.
Механизм развития алопеции вследствие проведения какой-либо медикаментозной терапии в настоящее время до конца не ясен. Предполагается [5], что в его основе лежит взаимодействие активных субстанций лекарственных веществ с различными клетками, ответственными за рост волос, а именно фолликулярными кератиноцитами, клетками волосяного матрикса, а также соединительнотканными клетками, окружающими волосяную луковицу и перифолликулярные кровеносные сосуды. Наиболее часто мишенью для токсических эффектов лекарственных веществ становятся кератиноциты волосяных фолликулов. Это, как принято считать, обусловлено тем, что около 90% волосяных фолликулов находятся в фазе анагена, или фазе быстрого роста, а кроме того, интенсивный кровоток в кровеносных сосудах дермы, в частности в зоне волосяного сосочка, способствует повышению биодоступности и в ряде случаев токсичности активных ингредиентов [7, 14].
Помимо этого, кератиноциты волосяных фолликулов обладают выраженной способностью (значительно большей, чем кератиноциты эпидермиса) метаболизировать различные вещества, в первую очередь экзогенной природы [13]. Это обусловлено наличием в волосяных фолликулах различных ферментных систем, в частности цитохрома Р-450, локализованного в наружной мембране митохондрий, мембранах ядра и эндоплазматической сети и осуществляющего окисление неполярных органических соединений путем воздействия молекулярного кислорода. По мнению Boyd et al., 1983 [1], для того, чтобы проявился токсический эффект тех или иных веществ, последние должны взаимодействовать с различными клетками-мишенями после прохождения определенного метаболического пути.
Таким образом, кератиноциты волосяных фолликулов, обладая, с одной стороны, механизмами защиты от повреждающего действия экзогенных веществ и системой их элиминации, с другой стороны, в определенной степени способствуют проявлению токсического эффекта определенных лекарств. Вероятнее всего, что в большинстве случаев имеет место как непосредственное влияние активных субстанций лекарственных средств на митотически активные структуры волосяных фолликулов, замедление скорости кровотока в сосудах дермы и соответственно в волосяном сосочке, так и снижение концентрации в сыворотке крови и тканях липидов и белков и изменение их метаболических путей, а также микроэлементов, необходимых для нормального роста волос, вследствие образования хелатных комплексов, в первую очередь с ионами цинка и меди.
Однако одно и то же химическое соединение (лекарственное вещество) не во всех случаях вызывает развитие алопеции, и степень ее выраженности не всегда одинакова. Возможно, что это связано с особенностями взаимодействия между эндогенными и экзогенными факторами [11, 12].
Диффузная алопеция, обусловленная воздействием лекарственных препаратов, как правило, развивается не внезапно, а в течение нескольких месяцев после определенного латентного периода. В этот период отмечается постепенное уменьшение диаметра волосяной луковицы, замедление скорости роста волос. Развиваются дистрофические изменения волосяного стержня вследствие нарушения биосинтеза протеинов, характерным признаком которого является наличие у отрастающих волос заостренного кончика (по типу писчего пера). При анализе трихограммы у таких пациентов отмечается значительное повышение количества волос, фолликулы которых находятся в фазе телогена (30% и более). Однако провести дифференциальный диагноз между диффузной алопецией, индуцированной лекарственным воздействием на волосяной сосочек, и идиопатическим анагеновым или телогеновым выпадением волос очень трудно, так как данные трихограммы и гистологического исследования неспецифичны. В этих случаях правильной диагностике способствует анамнез. Кроме того, поставить верный диагноз может помочь возобновившееся выпадение волос при повторном назначении лекарственного средства, предположительно являющегося этиологическим фактором.
В большинстве случаев выпадение волос, вызванное применением того или иного лекарственного препарата, обратимо. Как правило, восстановление роста волос отмечается через несколько месяцев после прекращения воздействия этиологического фактора и зависит от степени выраженности изменений в волосяном фолликуле. Несмотря на то что обычно рост волос возобновляется самопроизвольно, по нашему мнению, целесообразно проводить соответствующую терапию, направленную на стимуляцию митотической активности клеток волосяной луковицы, синтез кератина и глобулярных протеинов межфибриллярного матрикса.
Лекарственные средства, прием которых может приводить к развитию облысения, широко используются в клинической практике дерматологов, кардиологов, гинекологов, терапевтов, психиатров и врачей других специальностей. Вообще, алопеция может возникнуть в результате применения любого лекарственного средства. Но было выявлено, что чаще всего усиленное выпадение волос наблюдается на фоне приема следующих групп препаратов [4, 6, 10]: витамин А и его производные; блокаторы бета-адренорецепторов (селективные и неселективные); блокаторы ангиотензин-конвертирующего фермента; антибактериальные препараты; нестероидные противовоспалительные средства; антикоагулянты; производные 6-аминохинолина; тиреостатические препараты; блокаторы гистаминовых Н2-рецепторов; нестероидные антиэстрогенные средства; препараты a-интерферона; производные имидазола; антидепрессанты; противосудорожные препараты; нейролептики; противопаркинсонические препараты; производные гидроксихлорохина; производные триазола; кетоконазол; урикостатические препараты; урикозурические препараты; пероральные контрацептивы; цитостатики; антигельминтные препараты; препараты лития; противогерпетические препараты; допаминомиметики (бромокриптин); депилятории (особенно в случае частого их использования на больных поверхностях); борная кислота.
При этом было отмечено, что из вышеуказанных препаратов значительно чаще диффузная алопеция развивается под влиянием противосудорожных препаратов, антидепрессантов, нейролептиков, витамина А и его синтетических производных, цитостатиков, b-блокаторов.
Так, цитостатические препараты, особенно при назначении их в больших дозах, приводят к практически полному прекращению митотического деления клеток волосяной луковицы.
Антибиотики, противогерпетические и другие средства могут нарушать связь матрикса и волосяного сосочка, что резко уменьшает продолжительность фазы анагена, и, следовательно, волосы значительно быстрее, чем в норме, переходят в фазу катагена, а затем в фазу телогена, что приводит к их интенсивному выпадению. В ряде случаев волосяные фолликулы не вступают в фазы катагена и телогена, а волосы выпадают в фазе анагена [2, 14]. Этот механизм, обусловливающий развитие состояния, называемого анагеновым выпадением волос, точно установлен для антикоагулянтов, препаратов, содержащих литий и борную кислоту. С помощью световой микроскопии по определенным признакам (длине корневой части волоса, наличию внутреннего и наружного корневых влагалищ, наличию или отсутствию пигмента в области волосяной колбы и др.) можно определить, на какой стадии произошло нарушение цикла развития волосяного фолликула.
Уменьшают продолжительность фазы роста (фазы анагена) пероральные контрацептивы [3]. Кроме повышения количества телогеновых волос в трихограмме, появления дистрофических волосяных фолликулов, возможно также изменение формы волосяного стержня (волнистые волосы становятся прямыми). В настоящее время причина этого не выяснена. Можно предположить, что так как форма волосяного стержня определяется наличием дисульфидных связей, образованных между прилежащими друг к другу серосодержащими аминокислотными остатками (в первую очередь цистеина и метионина) в полипептидах, входящих в структуру кератина, то изменение формы волоса происходит в результате полного или частичного разрушения этих связей. Это возможно, в частности, при изменении последовательности аминокислотных остатков, или, иными словами, первичной структуры кератина. Тот факт, что после отмены препаратов этой группы волосы не возвращаются к своему исходному состоянию в течение длительного периода времени (четырех и более лет), позволяет предположить развитие мутации в кератиновых генах. Кроме того, по данным клинических наблюдений, подобные нарушения формы волосяного стержня в основном отмечаются в лобно-теменной области, в то время как в затылочной области волосы сохраняют свой первоначальный вид. Как известно, при андрогенетической алопеции изменения волос (постепенное уменьшение размера волосянного фолликула и диаметра волосяного стержня с последующей заменой жесткого волоса на пушковый) наблюдаются также в лобно-теменной области, а затылочная остается интактной. Можно предположить, что в результате применения пероральных контрацептивов происходят изменения в рецепторном аппарате волосяного фолликула. Изменяется его чувствительность к действию гормонов, как и при андрогенетический алопеции, когда подобные изменения рецепторов детерминированы генетически.
Кроме того, пероральные контрацептивы способствуют снижению концентрации витамина В12 в сыворотке крови [8], что также ухудшает состояние волос.
Прием некоторых препаратов может вызвать избыточный рост волос, вначале пушковых, которые с течением времени трансформируются в жесткие. Этот эффект, который наиболее часто выражен в тех случаях, когда препарат назначается в значительных дозах и длительно, объясняется, вероятно, более быстрым переходом фазы телогена в фазу анагена. К ним относятся: кортикостероиды, миноксидил, циклоспорин А, D-пеницилламин, дифенилгидантоин, псорален.
Побочное действие этих препаратов давало возможность терапии некоторых форм алопеции, однако достигнутый эффект в подавляющем большинстве случаев оказывается нестойким, рецидив заболевания отмечается в среднем через три-четыре месяца после прекращения лечения. Кроме того, следует учитывать, что риск развития тяжелых побочных эффектов, которые наблюдаются практически у всех пациентов, в первую очередь у принимающих такие препараты, как системные кортикостероиды (а также местные при использовании их на больших поверхностях кожи) и циклоспорин А (в том числе и при локальном его применении), значительно превосходит положительное воздействие на течение алопеции.
Токсоплазмоз — широко распространенная зоонозная паразитарная инфекция, характеризующаяся полиморфизмом клинических проявлений и значительной вариабельностью течения процесса: от здорового, бессимптомного носительства до тяжелых, летальных форм болезни.
.jpg)
Токсоплазмоз — широко распространенная зоонозная паразитарная инфекция, характеризующаяся полиморфизмом клинических проявлений и значительной вариабельностью течения процесса: от здорового, бессимптомного носительства до тяжелых, летальных форм болезни.
Этиология. Возбудитель токсоплазмоза Toxoplasma gondii относится к царству Protozoa, классу Coccidia, отряду Eucoccidiorida, типу Apicomplexa. T. gondii — условно патогенный внутриклеточный паразит, поражающий в организме промежуточных хозяев, в том числе человека, любые ядерные клетки гистеофагоцитарной системы.
Эпидемиология. Пораженность или инфицированность токсоплазмами населения Российской Федерации в среднем составляет около 20,0%. Показатели пораженности выше в регионах с теплым климатом; среди лиц ряда профессиональных групп: рабочие мясокомбинатов и звероводческих ферм, животноводы, ветеринарные работники и др. Инфицированность женщин, как правило, в 2–3 раза выше, чем у мужчин.
Заболеваемость токсоплазмозом во много раз ниже показателей инфицированности, однако трудности диагностики, несмотря на обязательную регистрацию, не позволяют судить об истинном уровне инфекции.
Восприимчивость к токсоплазмозу — практически поголовная. Распространение инфекции — повсеместное в виде носительства и спорадических заболеваний. Основной источник инфекции — дикие и домашние кошки.
Основной фактор передачи токсоплазм — сырое или недостаточно термически обработанное мясо, мясные продукты с находящимися в нем цистами токсоплазм. К дополнительным факторам передачи инфекции относятся плохо вымытая зелень, овощи, фрукты (с земли), грязные руки с находящимися на них ооцистами возбудителя.
Основные пути передачи:
- пищевой — связанный с употреблением в пищу термически плохо обработанного мяса, содержащего цисты паразита;
- контактный — ассоциированный с больными кошками, выделяющими токсоплазмы с фекалиями;
- трансплацентарный — при котором становится возможным проникновение токсоплазм в плод, с последующим развитием врожденного токсоплазмоза у новорожденного;
- парентеральный — при котором не исключается передача инфекции реципиенту при переливании крови, пересадке органов и тканей.
Беременная с токсоплазмозом не представляет эпидемиологической опасности ни для окружающих, ни для медицинского персонала, что делает возможным лечение этих пациентов как в амбулаторных условиях, так и в любом соматическом стационаре.
Патогенез. Вышедшие из цист или ооцист возбудители внедряются в эпителиальные клетки тонкого кишечника, где они размножаются, образую первичный аффект и проникая затем в региональные лимфатические узлы, а из них с током лимфы — в кровь. Диссеминация возбудителя приводит к поражению самых различных органов и тканей.
При беременности, в условиях сниженного иммунитета, наряду с первичным заражением токсоплазмами, опасным является и реактивация паразита (при инфицировании до беременности), что в значительной степени определяет течение и исход беременности.
При выходе токсоплазм из цист происходит диссеминация возбудителей. Их концентрация в тканях ассоциирована со способностью токсоплазм проникать трансплацентарно, что приводит к развитию внутриутробной патологии на любом сроке беременности.
Заражение плода наблюдается у беременных как с первичным инфицированием токсоплазмами, так и реактивацией возбудителя во время беременности у серопозитивных женщин. Поражение плода может возникать на любом сроке гестации, но особую опасность представляет его инфицирование в первом и втором триместрах. При заражении в третьем триместре беременности преобладают бессимптомные формы течения заболевания, а поздние клинические признаки проявляются через месяцы и годы.
Заражение на ранних сроках эмбриогенеза заканчивается спонтанным выкидышем, мертворождением, вызывает тяжелые нарушения развития — анэнцефалию, анофтальмию, гидроцефалию, гепатоспленомегалию и др. (табл.).
Формирование иммунитета приводит к исчезновению возбудителя из крови, прекращается его размножение в клетках. Образуются истинные тканевые цисты, которые могут длительно, десятилетиями, в интактном состоянии сохраняться в организме (носительство токсоплазм).
Клиника. Приобретенный токсоплазмоз по характеру течения делится на острый и хронический. Кроме того, в зависимости от длительности болезни и выраженности клинических симптомов возможно подострое, а также инаппарантное (субклиническое) течение инфекции, которое характеризуется определенной динамикой либо высоким уровнем специфических антител в крови, при отсутствии клинических проявлений болезни. Таким образом, наиболее удобной для практического здравоохранения, с нашей точки зрения, является следующая классификация приобретенного токсоплазмоза: острый, подострый, хронический, инаппарантный и носительство.
Клинические проявления токсоплазмоза у беременных не имеют каких-либо существенных отличий от уже известной клинической картины заболевания.
Лабораторная диагностика. Для лабораторной диагностики токсоплазмоза чаще всего применяют серологические методы: реакцию непрямой иммунофлюоресценции (РНИФ) и иммуноферментный анализ (ИФА). Диагноз подтверждается достоверно нарастающей динамикой показателей этих тестов, их высоким уровнем либо наличием антител класса IgM. Существенное значение в диагностике токсоплазмоза, особенно в дифференциации острого и хронического процессов, имеет определение классов иммуноглобулинов, в частности антител класса IgM. Надежно диагностировать токсоплазменную инфекцию можно лишь при сравнении результатов серологических реакций в динамике. Антитела всех классов существенно повышаются к концу второй — началу третьей недели от момента инфицирования и достигают диагностического уровня. Диагноз токсоплазмоза при наличии соответствующей клиники может быть поставлен при положительной серологической конверсии, когда второй анализ сыворотки становится положительным.
Диагностика токсоплазмоза у беременных женщин включает в себя весь комплекс необходимых клинических, параклинических и специальных (иммунобиологических) исследований, которые применяются для диагностики токсоплазмоза вообще.
Обязательным условием обследования беременной на токсоплазмоз должна быть консультация врача-инфекциониста для подтверждения либо исключения текущего инфекционного манифестного или бессимптомного (инаппарантного) токсоплазменного процесса.
Учитывая исключительную важность результатов иммунологического обследования в диагностике токсоплазмоза у беременных, необходимо правильно интерпретировать полученные данные.
Вариант 3: клинические проявления инфекции отсутствуют; серологические реакции положительные в низких, средних, иногда высоких титрах (РНИФ 1:640, ИФА IgG ≥ 200 Ед/мл; ИФА IgM — положительно). При исследовании парных сывороток (через 3–4 недели) регистрируется достоверное нарастание уровня специфических антител класса IgM.
Заключение: инаппарантный токсоплазмоз — реальная угроза инфицирования плода.
Вариант 4: имеются клинические проявления токсоплазмоза; серологические реакции положительные в низких и средних (иногда высоких) титрах: РНИФ 1:1280, ИФА IgG ≥ 200 Eд/мл; ИФА IgM — положительно, при исследовании парных сывороток в динамике регистрируется достоверное нарастание уровня специфических антител; выявляются специфические антитела класса IgM-класса. Заключение: острый токсоплазмоз.
Рекомендации: экстренная превентивная этиотропная терапия (не ранее чем со II триместра беременности); в I триместр — рассмотреть вопрос о прерывании беременности; проводят кордо- и амниоцентез на 22–23 неделях беременности; новорожденный обследуется на токсоплазмоз, и при подтверждении диагноза проводится этиотропная терапия (диспансерное наблюдение 5 лет).
Вариант 5: имеются клинические проявления инфекции; серологические реакции положительные в высоких или средних показателях; при исследовании парных сывороток в динамике регистрируется снижение уровня специфических антител (РНИФ ≤ 1:1280, ИФА IgG — 200 Eд/мл; ИФА IgM — положительно). Заключение: подострый токсоплазмоз. Рекомендации: этиотропная терапия (не ранее чем со II триместра); в I триместр — ставится вопрос о прерывании беременности; новорожденный обследуется на токсоплазмоз и при подтверждении диагноза проводится этиотропная терапия (диспансерное наблюдение 5 лет).
Вариант 6: имеются клинические проявления токсоплазмоза; серологические реакции положительны в низких или средних показателях (РНИФ 1:640, ИФА IgG — 200 Eд/мл; ИФА IgM — отрицательно); при исследовании парных сывороток (через 3–4 недели) динамики уровня антител нет; антитела класса IgM отсутствуют. Заключение: хронический приобретенный токсоплазмоз. Рекомендации: этиотропная терапия не проводится; при необходимости специфическая терапия вне беременности; прерывание беременности не показано.
Лечение. Показанием к назначению этиотропной терапии у беременных женщин являются острый, подострый и инаппарантный токсоплазмоз. Лечение хронического токсоплазмоза следует проводить строго по клиническим показаниям либо до, либо после беременности. При отсутствии жалоб и клинических показаний не нуждаются в лечении женщины, переболевшие токсоплазмозом до беременности. Эти женщины расцениваются как практически здоровые лица, не требующие специального медицинского наблюдения. Лечение беременных женщин следует проводить не ранее 12–16 недель беременности (со II триместра беременности).
Назначаются препараты группы пириметамина (Фансидар, Ровамицин).
Фансидар содержит сульфадоксин 500 мг и пириметамин 25 мг. Этиотропная терапия состоит из 2–3 циклов. Назначается 1 таблетка 1 раз в 3 дня № 8 таблеток на цикл. Учитывая возможность угнетения кроветворения под действием этиотропных препаратов, рекомендуется назначение фолиевой кислоты (в средних терапевтических дозах), а также проведение общих анализов крови и мочи. При непереносимости препаратов группы пириметаминов назначают Ровамицин, 1 таблетка которого содержит спиромицина 3 млн МЕ. Назначают по 3 млн МЕ 3 раза в день с семидневным перерывом. Хорошая переносимость Ровамицина больными, отсутствие лекарственного взаимодействия, высокая эффективность позволяют назначать его для лечения токсоплазмоза у беременных. При непереносимости пириметаминов возможна замена на антибиотики, например, эритромицин.
Противопоказаниями для назначения Фансидара и его аналогов, а также сульфаниламидных препаратов и антибиотиков являются: нарушения эритропоэза с анемией, заболевания почек с нарушением их функций, заболевания печени, декомпенсация сердечной деятельности.
В зависимости от сроков беременности целесообразно проведение не менее двух полных курсов этиотропной терапии с перерывами между ними 1–1,5 месяца.
Как показала практика, у пациенток с инаппарантным течением острого токсоплазмоза хороший эффект дает комплексное применение Фансидара с иммуномодуляторами (Галовит, Полиоксидоний). Уже после первого цикла лечения наблюдается значительное снижение IgM.
Профилактика врожденного токсоплазмоза. Профилактика врожденного токсоплазмоза должна строиться с учетом того факта, что только первичное заражение женщины во время беременности может привести к инфицированию плода. Оптимально профилактика врожденного токсоплазмоза должна включать в себя обследование женщин детородного возраста на токсоплазмоз до или, в крайнем случае, во время беременности. Неиммунные беременные женщины должны быть обязательно взяты на диспансерное наблюдение и обследоваться на токсоплазмоз 1 раз в триместр.
Литература
- О выявлении и профилактике токсоплазмоза в Москве. Методические рекомендации (№ 25). М., 2007.
- Лысенко А. Я. Клиническая паразитология. Женева, 2002.
- Hill D., Dubey J. P. Toxoplasma gondii: transmission, diagnosis and prevention // Clin. Microbiol. Infect. 2002. № 10.
- Desmonts G., Couvreur J. Toxoplasmosis in pregnancy and its transmission to the fetus // Bull. N. Y. Acad. Med. 1974. № 2.
Ф. К. Дзуцева*
Г. Ю. Никитина**
Ю. В. Борисенко*
Л. П. Иванова***, кандидат медицинских наук, доцент
С. Х. Зембатова***
*Городской центр по токсоплазмозу, **ГКБ им. С. П. Боткина, ***РМАПО, Москва
Читайте также:

