Молекулярно биологические методы диагностики дерматомикозов
Обновлено: 24.04.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Полимеразную цепную реакцию (ПЦР, PCR) изобрёл в 1983 году Кэри Мюллис (американский учёный). Впоследствии он получил за это изобретение Нобелевскую премию. В настоящее время ПЦР-диагностика является, одним из самых точных и чувствительных методов диагностики инфекционных заболеваний.
Полимеразная цепная реакция (ПЦР) — экспериментальный метод молекулярной биологии, способ значительного увеличения малых концентраций определённых фрагментов нуклеиновой кислоты (ДНК) в биологическом материале (пробе).
В основе метода ПЦР лежит многократное удвоение определённого участка ДНК при помощи ферментов в искусственных условиях (in vitro). В результате нарабатываются количества ДНК, достаточные для визуальной детекции. При этом происходит копирование только того участка, который удовлетворяет заданным условиям, и только в том случае, если он присутствует в исследуемом образце.
Кроме простого увеличения числа копий ДНК (этот процесс называется амплификацией), ПЦР позволяет производить множество других манипуляций с генетическим материалом (введение мутаций, сращивание фрагментов ДНК), и широко используется в биологической и медицинской практике, например, для диагностики заболеваний (наследственных, инфекционных), для установления отцовства, для клонирования генов, введения мутаций, выделения новых генов.
Специфичность и применение
ПЦР позволяет диагностировать наличие долго растущих возбудителей, не прибегая к трудоёмким микробиологическим методам, что особенно актуально в гинекологии и урологии при диагностике урогенитальных инфекций, передающихся половым путем (ИППП).
-
Исследование урогенитального тракта методом ПЦР на ИППП ;
-
тест методом ПЦР на коронавирус Covid-19, мазок из носа и зева на определение РНК вируса SARS-CoV-2;
Для проведения исследования в медицинских офисах необходимо предъявить СНИЛС и документ удостоверяющий личность. Запись на исследование В случае получения положительного или сомнительного результата на COVID-19 и при необходимости проведения подтверждающего тестирования обра.
Особенно эффективен метод ПЦР для диагностики трудно культивируемых, некультивируемых и скрыто существующих форм микроорганизмов, с которыми часто приходится сталкиваться при латентных и хронических инфекциях, поскольку этот метод позволяет избежать сложностей, связанных с выращиванием таких микроорганизмов в лабораторных условиях.
Применение ПЦР-диагностики также очень эффективно в отношении возбудителей с высокой антигенной изменчивостью и внутриклеточных паразитов. Методом ПЦР возможно выявление возбудителей не только в клиническом материале, полученном от больного, но и в материале, получаемом из объектов внешней среды (вода, почва и т. д.). В урологической и гинекологической практике - для выявления хламидиоза, уреаплазмоза, гонореи, герпеса, гарднереллёза, микоплазменной инфекции, ВПЧ - вирусов папилломы человека; в пульмонологии - для дифференциальной диагностики вирусных и бактериальных пневмоний, туберкулёза; в гастроэнтерологии - для выявления хеликобактериоза; в клинике инфекционных заболеваний - в качестве экспресс-метода диагностики сальмонеллёза, дифтерии, вирусных гепатитов В, С и G; в гематологии - для выявления цитомегаловирусной инфекции, онковирусов.
Специфичность ПЦР основана на образовании комплементарных комплексов между матрицей и праймерами - короткими синтетическими олигонуклеотидами длиной 18 - 30 букв. Каждый из праймеров сопоставим (комплементарен) с одной из цепей двуцепочечной матрицы, обрамляя начало и конец амплифицируемого участка.
После соединения (гибридизации) матрицы с праймером (отжиг), последний служит затравкой для ДНК-полимеразы при синтезе комплементарной цепи матрицы.
Проведение ПЦР
Для проведения ПЦР в простейшем случае требуются следующие компоненты:
- ДНК-матрица, содержащая тот участок ДНК, который требуется амплифицировать;
- два праймера, комплементарные концам требуемого фрагмента;
- термостабильная ДНК-полимераза;
- дезоксинуклеотидтрифосфаты (A, G, C, T);
- ионы Mg2+, необходимые для работы полимеразы;
- буферный раствор.
ПЦР проводят в амплификаторе — приборе, обеспечивающем периодическое охлаждение и нагревание пробирок, обычно с точностью не менее 0,1°C. Чтобы избежать испарения реакционной смеси, в пробирку добавляют высококипящее масло, например, вазелиновое. Добавление специфичеких ферментов может увеличить выход ПЦР-реакции.
Ход реакции
Обычно при проведении ПЦР выполняется 20 - 35 циклов, каждый из которых состоит из трех стадий. Двухцепочечную ДНК-матрицу нагревают до 94 - 96°C (или до 98°C, если используется особенно термостабильная полимераза) на 0,5 - 2 минуты, чтобы цепи ДНК разошлись. Эта стадия называется денатурацией — разрушаются водородные связи между двумя цепями. Иногда перед первым циклом проводят предварительный прогрев реакционной смеси в течение 2 - 5 минут для полной денатурации матрицы и праймеров.
Когда цепи разошлись, температуру понижают, чтобы праймеры могли связаться с одноцепочечной матрицей. Эта стадия называется отжигом. Температура отжига зависит от праймеров и обычно выбирается на 4 - 5°С ниже их температуры плавления. Время стадии — 0,5 - 2 минут.
ДНК-полимераза реплицирует матричную цепь, используя праймер в качестве затравки. Это — стадия элонгации. Температура элонгации зависит от полимеразы. Часто используемые полимеразы наиболее активны при 72°C. Время элонгации зависит как от типа ДНК-полимеразы, так и от длины амплифицируемого фрагмента. Обычно время элонгации принимают равным одной минуте на каждую тысячу пар оснований. После окончания всех циклов часто проводят дополнительную стадию финальной элонгации, чтобы достроить все одноцепочечные фрагменты. Эта стадия длится 10 - 15 мин.
Подготовка материала к исследованию и транспорт его в лабораторию
Для успешного проведения анализа важно правильно собрать материал у пациента и правильно провести его подготовку. Известно, что в лабораторной диагностике большинство ошибок (до 70%) совершается именно на этапе пробоподготовки. Для взятия крови в лаборатории ИНВИТРО в настоящее время применяются вакуумные системы, которые с одной стороны минимально травмируют пациента, а с другой - позволяют произвести взятие материала таким образом, что он не контактирует ни с персоналом, ни с окружающей средой. Это позволяет избежать контаминации (загрязнения) материала и обеспечивает объективность анализа ПЦР.
ДНК – дезоксирибонуклеиновая кислота - биологический полимер, один из двух типов нуклеиновых кислот, обеспечивающих хранение, передачу из поколения в поколение и реализацию генетической программы развития и функционирования живых организмов. Основная роль ДНК в клетках — долговременное хранение информации о структуре РНК и белков.
РНК– рибонуклеиновая кислота - биологический полимер, близкий по своему химическому строению к ДНК. Молекула РНК построена из тех же мономерных звеньев - нуклеотидов, что и ДНК. В природе РНК, как правило, существует в виде одиночной цепочки. У некоторых вирусов РНК является носителем генетической информации. В клетке играет важную роль при передаче информации от ДНК к белку. РНК синтезируется на ДНК-матрице. Процесс этот называется транскрипцией. В ДНК имеются участки, где содержится информация, ответственная за синтез трех видов РНК, различающихся по выполняемым функциям: информационной или матричной РНК (мРНК), рибосомальной (рРНК) и транспортной (тРНК). Все три вида РНК тем или иным способом участвуют в синтезе белка. Однако информация по синтезу белка содержится только в мРНК.
Нуклеоти́ды - основная повторяющаяся единица в молекулах нуклеиновых кислот, продукт химического соединения азотистого основания, пятиуглеродного сахара (пентозы) и одной или нескольких фосфатных групп. Нуклеотиды, представленные в нуклеиновых кислотах, содержат одну фосфатную группу. Они называются по содержащемуся в них азотистому основанию - адениновый (A), содержащий аденин, гуаниновый (G) - гуанин, цитозиновый (C) - цитозин, тиминовый (Т) - тимин, урациловый (U) - урацил. В состав ДНК входят 4 типа нуклеотидов - A, T, G, C, в состав РНК также 4 типа - A, U, G, C. Сахаром в составе всех нуклеотидов ДНК является дезоксирибоза, РНК - рибоза. При образовании нуклеиновых кислот нуклеотиды, связываясь, образуют сахаро-фосфатный остов молекулы, по одну сторону которого находятся основания.
Праймер – котроткая ДНК, используемая для репликации матричной цепи. Каждый из праймеров комплементарен одной из цепей двуцепочечной матрицы, обрамляя начало и конец амплифицируемого участка.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
ИФА. В настоящее время уже появились коммерческие наборы для выявления Аг некоторых возбудителей, позволяющие их идентифицировать в течение 5-10 мин. Для выявления Аг на твёрдой фазе сорбируют известные AT и добавляют сыворотку, содержащую Аг; после инкубирования несвязанный Аг декантируют, систему промывают и вносят меченые AT, специфичные к сорбированным AT. Повторяют процедуру инкубирования и отмывания, вносят хромогенный субстрат, положительный результат фиксируют при изменении окраски системы.
Гибридизация ДНК — высокоспецифичный метод, позволяющий идентифицировать геном вируса после его гибридизации комплементарными молекулами ДНК. В качестве маркёра применяют ферменты и изотопы. Метод определяет способность вирусной ДНК гибридизиро-ваться с меченой комплементарной ДНК; специфичность метода прямо пропорциональна длине комплементарной цепочки. Перспективен метод гибридизации нуклеиновых кислот in situ. Для постановки реакции меченую ДНК наносят на биоптаты тканей (в том числе на фиксированные формалином или заключённые в парафиновые блоки) и регистрируют взаимодействие с комплементарной ДНК. Метод используют для выявления вирусов простого герпеса, папилломы человека, Эпстайна-Барр и др.
ПЦР. Метод значительно увеличивает чувствительность метода гибридизации, повышая содержание вирусной ДНК в материале, полученном от больного, а также ускоряет время получения результата.
Методы диагностики микозов ( грибковых заболеваний )
Микроскопия — один из основных методов выявления возбудителей микозов. Позволяет проводить экспресс-диагностику микозов и получать результат в течение 1—2 ч, тогда как для выделении культуры возбудителя необходимы недели. Для экспресс-диагностики препараты часто необходимо окрашивать специальными красителями, так как простая окраска гематоксилином и эозином часто не позволяет выявить клетки грибов.
Неокрашенные препараты грибов
Микроскопия методом висячей или раздавленной капли. Метод позволяет выявить структуры грибов в клинических образцах без предварительного окрашивания.
Обработка 10% едким калием (КОН). Метод используют в первую очередь для визуализации структур возбудителей в фрагментах кожи и её придатках (ногти, волосы), отделяемом очагов поражения и влагалища. В указанных образцах содержится большое количество клеток, в которых КОН разрушает кератин, оставляя неизменёнными клетки грибов.
Окрашенные препараты грибов. Окраска мазка грибов.
• Окраска мазка грибов по Граму. В мазках из клинического материала грибы представлены грамположительными клетками. Клетки Cryptococcus neoformans плохо воспринимают красители, что можно использовать как дифференциально-диагностический признак при микроскопии окрашенных мазков СМЖ.
• Окраска мазка грибов нигрозином или тушью по Бурри мазков СМЖ позволяет выявить капсулированные клетки Cryptococcus neoformans. Для идентификации этого микроорганизма можно использовать муцикармин или конго красный.
• Окраска мазка грибов по Романовскому-Гимзе или Райту мазков крови и костного мозга позволяет выявить дрожжевую форму Histoplasma capsulatum в цитоплазме фагоцитов.
• Окраска мазка грибов метенаминовым серебряным по Гомори. Метод включает предварительную обработку гистологических препаратов хромовой кислотой с последующим нанесением красителя (клетки грибов тёмно-серые или чёрные).
• Окраска мазка грибов по Гридли. Метод включает предварительную обработку препаратов хроматом лейко-фуксина с последующим нанесением фуксинового альдегида и метанилового жёлтого (клетки грибов розово-пурпурные на жёлтом фоне).
• Окрашивание перйодной кислотой и реактивом Шиффа (по Мак-Манусу). 1,2-Гликольные группировки полисахаридов клеточных стенок грибов сначала окисляются перйодной кислотой до альдегидов, реагирующих с сульфитом лейкофуксина реактива Шйффа; клетки окрашиваются в насыщенно розовый или красный цвет.
Иммунофлюоресцентная микроскопия грибов
Наибольшее распространение нашла РИФ. Применяют AT, меченные флюоресцеинами; для выявления грибковых Аг реагент наносят на гистологический препарат, инкубируют и проводят люминесцентную микроскопию.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Диагностика микозов - методы исследования, критерии
Прецизионная диагностика инвазивных микозов нелегка. Это объясняется не только трудностями в получении культуры грибов, но и в интерпретации результатов исследований, поскольку грибами, как дрожжевыми, так и мицелиальными, возможны колонизация слизистых оболочек, контаминация исследуемых образцов. В связи с этим диагностика инвазивных микозов базируется на комплексном подходе, включающем не только результаты микологических (культуральных) и серологических (определение антигена грибов) исследований, но и клинические симптомы грибковой инфекции, данные вспомогательных методов исследований (компьютерная или магнитно-резонансная томография, ультразвуковое исследование).
Европейско-американской кооперированной группой по изучению инвазивных микозов у иммунокомпрометированных больных разработаны критерии диагностики инвазивных микозов. Они представлены в 2001 г. на Международной конференции по антимикробным препаратам и химиотерапии (ICAAC, Chicago), а в 2002 г. в печати. Определены критерии доказанного, вероятного и возможного инвазивного микоза, которые рекомендуется использовать при клинических и эпидемиологических исследованиях
Доказанный инвазивный микоз, вызванный мицелиальными грибами: обнаружение мицелия грибов в биоптатах либо аспиратах при гистологическом или цитологическом исследовании или выделение культуры из образцов, полученных в асептических условиях из стерильного в норме очага, который по результатам клинического и радиологического исследований связан с инфекцией, за исключением исследований мочи и со слизистых оболочек.
Доказанный инвазивный микоз, вызванный дрожжевыми грибами: обнаружение дрожжевых клеток (грибы рода Candida могут формировать псевдомицелий или истинный мицелий) в биоптатах или аспиратах, за исключением образцов со слизистых оболочек, или выделение культуры из образцов, полученных в асептических условиях из стерильного в норме очага, который по результатам клинического и радиологического исследований связан с инфекцией, за исключением исследований мочи, образцов из пазух носа и со слизистых оболочек, или обнаружение при микроскопии и специфическом окрашивании (в капле туши, окраска муцикармином) дрожжевых клеток либо положительного антигена Cryptococcus spp. в цереброспинальной жидкости.
Фунгемия, обусловленная мицелиальными грибами: выделение гемокультуры грибов, за исключением Aspergillus spp. и Penicillium spp., включая Penicillium marneffei, в сочетании с клиническими симптомами инфекционного процесса, совместимыми с выделенным возбудителем.
Фунгемия, обусловленная дрожжевыми грибами: выделение гемокультуры грибов рода Candida или иных дрожжевых грибов у пациентов с клиническими признаками инфекции, связанными с данным возбудителем.
Комплекс диагностических исследований при инвазивных микозах
При микологическом исследовании стерильных аспиратов или биоптатов принимают во внимание выделение не только культуры грибов, но и обнаружение при микроскопии мицелия или псевдомицелия. В гистологических препаратах аспергиллы трудно дифференцировать от Fusarium spp., Sceclosporium apiospermum и некоторых других мицелиальных грибов. Для дифференциальной диагностики следует проводить иммуногистохимическое исследование с антителами к аспергиллам.
Иная интерпретация результатов в случае обнаружения мицелиальных грибов в крови. Высокая частота выделения мицелиальных грибов характерна для Fusarium spp. и составляет 40—60 %. Aspergillus обнаруживают крайне редко, в большинстве случаев это рассматривается как контаминация, за исключением Aspergillus terreus.
Выделение Aspergillus terreus из крови больных с гемобластозами может свидетельствовать об истинной аспергиллемии, а при наличии клинических симптомов инфекции является основанием для назначения антимикотиков.
Критерии инвазивного микоза
При выявлении в крови или иных стерильных биосубстратов дрожжевых грибов обязательно следует проводить идентификацию до вида и определять чувствительность к противогрибковым препаратам, при выделении мицелиальных (плесневых) грибов — только идентификацию до вида, чувствительность не определяют.
В клинической практике чувствительность мицелиальных грибов не исследуют по причине несовершенства стандартов по определению чувствительности таких грибов к антимикотикам. Более того, только в одном исследовании продемонстрирована корреляция между чувствительностью Aspergillus spp. и результатами лечения инвазивного аспергиллеза у больных с гемобластозами. Ни в одном из исследований, проведенных в последующем, не получено подобных результатов.
Идентификация грибов до вида, особенно полученных из стерильных локусов, необходима прежде всего для выбора антимикотика и проведения адекватной противогрибковой терапии. Так, Candida krusei устойчивы к флуконазолу и менее чувствительны, чем дрожжевые грибы другого вида, к амфотерицину В; Aspergillus terreus, Scedosporium apiospermum (Pseudallescheria boydii), Trichosporon beigelii, Scopulariopsis spp. резистентны к амфотерицину В; Mucorales резистентны к итраконазолу, вориконазолу, Candida glabrata проявляет дозозависимую чувствительность к флуконазолу, и при выделении этого вида гриба, даже чувствительных штаммов, дозу флуконазола следует увеличить (взрослым назначают 800 мг вместо 400 мг); Candida lusitaniae устойчивы к амфотерицину В.
Идентификация грибов до вида также важна для проведения эпидемиологического анализа в стационаре — определения возбудителей вспышек инфекции и по возможности источника инфекции. Описаны вспышки инфекции, вызванные такими редкими грибами, как С. lusitaniae, С. krusei, С. lipolytica.
На основании видовой идентификации грибов можно предположить инвазивный микоз или колонизацию грибами слизистых оболочек. Например, Aspergillus niger существенно реже, чем Aspergillus fumigatus, являются причиной инвазивного аспергиллеза у больных острыми лейкозами. Выделение из жидкости бронхоальвеолярного лаважа Aspergillus niger чаще всего расценивается как колонизация дыхательных путей, а из мокроты — как контаминация из воздуха и требует дополнительных исследований при подтверждении диагноза инвазивного аспергиллеза.
Выделение Cryptococcus neoformans у иммунокомпрометированных больных из респираторного тракта (смывы, лаваж) является диагностически значимым. Если идентификация дрожжевых грибов из жидкостей, полученных из дыхательных путей (смывы из трахеи, бронхов, бронхоальвеолярный лаваж) иммунокомпрометированных больных, не относится к обязательным исследованиям, то проведение скрининга по выявлению Cryptococcus neoformans из этих образцов является необходимым.
Обнаружение кандид в моче у больных с нейтропенией и лихорадкой, как правило, считается проявлением диссеминированной кандидозной инфекции.
В своевременной диагностике инвазивного аспергиллеза успешно пользуются коммерческим тестом по выявлению циркуляции специфического антигена грибов Aspergillus spp. галактоманна (полисахаридный водорастворимый компонент клеточной стенки гриба).
Галактоманн может быть определен двумя методами: методом латекс-агглютинации (Pastorex Aspergillus, фирмы BioRAD) и методом иммуноферментного анализа (Platelia Aspergillus, фирмы BioRAD).
Преимуществом иммуноферментного метода является более низкий порог чувствительности определения уровня галактоманна в крови — 1 нг/мл и менее, а с помощью латекс-агглютинации — 15 нг/мл. Диагностическое значение имеет определение галактоманна в крови (не менее чем в 2 образцах), цереброспинальной жидкости, бронхоальвеолярном лаваже. Чувствительность метода иммуноферментного анализа составляет около 90 %, специфичность 90—99 %, у реципиентов аллогенного костного мозга данные показатели ниже и равны соответственно 60—70 % и 80—90 % вследствие профилактического применения противогрибковых препаратов (антимикотики снижают пороговый уровень галактоманна).
В 40 % случаев выявление галактоманна в крови опережает проявления инвазивного аспергиллеза, определяемые при компьютерном исследовании легких, а в 70 % опережает клинические симптомы инфекции.
Диагностическую значимость тест по выявлению антигена Aspergillus имеет в том случае, если исследование проводят неоднократно. Определение антигена Aspergillus в крови следует проводить при лихорадке на фоне лечения антибиотиками широкого спектра действия у больных с нейтропенией 2 раза в неделю; при пневмониях, которые возникают или сохраняются на фоне антибактериальной терапии; при обнаружении очагов в легочной ткани (компьютерная томография).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Дерматомикозы — обширная группа поражений кожных покровов, вызываемых патогенными грибами.
Классификация • Кератомикозы (разноцветный лишай) • Дерматофитии: эпидермофития паховая; микоз, обусловленный интердигитальным трихофитоном (эпидермофития стоп); микоз, обусловленный красным трихофитоном (руброфития); трихофития; микроспория; фавус • Кандидоз • Глубокие микозы: бластомикоз, споротрихоз, хромомикоз и др.
Этиология. Основные возбудители — различные виды Trichophyton, Microsporum, а также несколько видов рода Epidermophyton, объединённые под общим названием дерматофиты. Морфологическая идентификация возбудителей в образцах тканей затруднена и требует выделения чистой культуры. В редких случаях поражения вызывают различные виды Candida.
Эпидемиология. Большинство возбудителей широко распространены в природе, возможно повсеместное инфицирование. Заболевания более часто регистрируют в странах с жарким влажным климатом. Среди возрастных групп инфицированию более подвержены дети. Заболевания возникают после контакта с активным очагом поражения. Выделяют следующие эпидемически значимые группы возбудителей: • Геофильные дерматофиты обитают в почве. Заражение возможно после контакта чувствительного организма с инфицированной землёй • Зоофильные дерматофиты — паразиты большинства домашних животных (кошек, собак, рогатого скота), источник заражения людей • Антропофильные дерматофиты — паразиты человека, передача инфекционного агента происходит в результате контакта с больным.
Патогенез. При дерматомикозах инфицирующие агенты представлены фрагментами гиф и конидиями, попавшими в кератинсодержащие ткани (роговой слой кожи, волосы, ногти). Вирулентность дерматофитов низкая, и поражения подлежащих тканей у здоровых лиц не наблюдают. Для всех возбудителей характерна способность разрушать и утилизировать кератин. По типу роста в волосяном стержне возбудителей разделяют на 2 группы: endothrix — прорастают из кожи в фолликулы и волосы, не выходя за пределы волосяного стержня; ectothrix — прорастают из волосяного фолликула в волос.
Клиническая картина. Возбудители размножаются в коже и её придатках; заболевания ограничены, не представляют угрозы для жизни, часто спонтанно ограничиваются и обусловливают преимущественно косметические проблемы. В редких случаях отмечают молниеносное поражение прилежащих тканей, особенно у лиц с иммунодефицитами. Характерны зудящие круглые, ярко-красные, чётко ограниченные чешуйчатые бляшки менее 5 см в диаметре, располагающиеся единично или группами.
• Дерматофитии волосистой части головы, вызванные грибками рода Microsporum и трихофитами из группы endothrix, проявляются ломкостью волос, обусловленной ростом возбудителя в волосяном стержне • Дерматофитии волосистой части головы, вызванные трихофитами из группы ectothrix, часто сопровождаются гнойным расплавлением волосяных фолликулов и выпадением волос.
• Дерматомикоз бороды и усов. Течение может быть острым или, реже, хроническим. Первоначальные проявления — папулы и пустулы; позднее присоединяются поражения волосяных фолликулов. В результате их инфицирования развиваются гранулематозные повреждения, нередко вторично инфицированные бактериями. Характерны отёки поражённых участков, последние покрыты кровянистыми корками. Основной возбудитель — Trichophyton verrucosum.
• Дерматомикоз тела (tinea corporis). На различных участках тела возникают локализованные очаги шелушения, пустулёзных высыпаний, эритемы и пиодермий. Основные возбудители — Trichophyton mentagrophytes, Trichophyton rubrum и Microsporum canis.
• Паховый дерматомикоз. Проявляется очагами шелушения, пустулёзными высыпаниями, эритемой и пиодермиями в области ног (включая внутреннюю поверхность бёдер), гениталий, промежности и паха. Основные возбудители — Trichophyton mentagrophytes, Trichophyton rubrum, Epidermophyton floccosum и виды Candida.
• Дерматомикоз стоп. Поражения локализованы в области подошв, преимущественно на коже между пальцами; характерны небольшие пузырьки, трещины, чешуйки, участки размягчения и эрозии. Основные возбудители — Trichophyton mentagrophytes, Trichophyton rubrum, Epidermophyton floccosum.
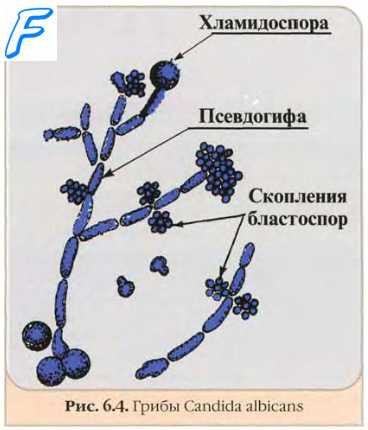
• Онихомикоз. Проявляется утолщением, огрубелостью и расслоением ногтей пальцев рук и ног. Основные возбудители — виды Trichophyton; в редких случаях поражения вызывают виды Candida. Подробнее см. Онихомикозы.
• Фавус — грибковое поражение кожи, волос и ногтей с длительным хроническим течением и рубцовой алопецией. Этиология: возбудитель — Trichophyton schoenleinii; заражение происходит при тесном и длительном контакте с больным человеком. Клиническая картина • Скутулярная форма. Через 1 нед после заражения вокруг волосяных фолликулов появляется эритема, на фоне которой формируются чешуйки, превращающиеся в псевдопустулы, а затем в мелкие, до нескольких миллиметров в диаметре, желтоватые овальные или округлые крошащиеся образования блюдцевидной формы — скутулы (скутулы — чистая культура возбудителя). При удалении или разрешении скутулы остаётся эрозивная или язвенная поверхность, в дальнейшем происходит рубцовая атрофия кожи и развивается окончательная алопеция. Волосы не обламываются, но теряют блеск, становятся тусклыми, напоминающими паклю • Питиреоидная форма. Эритематозные участки кожи покрыты плотно сидящими чешуйками, рубцовая алопеция развивается медленнее, чем при скутулярной форме • Импетигинозная форма. Мощные жёлто-коричневые корки, по отхождению которых развивается рубцовая алопеция • При фавусе могут поражаться ногти, которые становятся жёлтыми, ломкими, а под ними на ногтевом ложе видны скутулы. Поражение слизистых оболочек и внутренних органов обычно приводит к смерти. Методы исследования, лечение, профилактика см. ниже. Синонимы: парша, лишай фавусный. МКБ-10. B35 Дерматофития.
Диагностика поверхностных микозов основана на клинических проявлениях, данных микроскопии поражённых тканей и идентификации культур микроорганизмов, выделенных из них. Возбудителей микроспории достаточно легко выявляют облучением волосистой части кожи головы УФ лампой Вуда (свечение зелёным цветом).
Методы исследования
• Выявление возбудителя микроскопией. Материалы для микроскопии — фрагменты кожи и её придатков (ногти, волосы). Образец кожи помещают на предметное стекло и наносят каплю 10% р-ра KOH. Через 10–15 мин проводят микроскопию образца на наличие гиф или конидий. Микроскопия волос позволяет легко идентифицировать возбудителей типов endothrix и ectothrix. Для поражений, вызванных возбудителями типа endothrix, характерны ямки и полости в волосяном стержне, тогда как при возбудителях типа ectothrix гифы оплетают стержень волоса снаружи. Для усиления контраста используют сниженный конденсор и матовый свет.
• Выделение культуры. Помещают отдельные волосы или фрагменты кожи на питательные среды. Образцы кожи получают осторожной скарификацией очага поражения стерильным скальпелем или предметным стеклом. Возбудителя идентифицируют микроскопически и по морфологии колоний •• Виды Trichophyton вырастают за 2–3 нед; колонии разноцветные; конидии большие, гладкие и септированные (до 10 септ), по форме напоминают карандаши (10–50 мкм). Внутривидовая идентификация затруднена и требует изучения биохимических свойств •• Виды Microsporum растут также медленно; макроконидии толстостенные, многоклеточные, веретенообразные (30–160 мкм) и покрыты шипиками •• Epidermophyton floccosum образует белые, жёлтые или оливковые колонии; идентифицируют по наличию множества гладких конидий, напоминающих дубинки (7–20 мкм длиной).
Дифференциальная диагностика • Розовый лишай • Экзема себорейная • Контактный дерматит • Сифилис • Псориаз • СКВ.
Лечение • Синтетические противогрибковые препараты местно в виде мази (крема) — миконазол или клотримазол 2 р/сут в течение 2 нед, а также кетоконазол 4 р/сут в течение 2 нед (в течение 1 нед после выздоровления — для предупреждения рецидива). Назначают также эконазол и производные метилнафталина, например нафтифин • При дерматофитии волосистой части кожи головы — гризеофульвин по 1 г/сут (детям — 16 мг/кг, при микроспории — 22 мг/кг) внутрь ежедневно до первого отрицательного анализа на грибы, затем в той же дозе в течение 2 нед через день и 2 нед 2 р/нед или кетоконазол. Тербинафин 125-250 мг/сутки в течение 4–6 нед. Местно — 2–5% р-р йода, мазь с серой (10%) и салициловой кислотой (3–5%) • При онихомикозе — тербинафин по 250 мг/сут в течение 2–4 мес, итраконазол 200 мг/сут в течение 3 мес.
Синонимы • Дерматофития • Эпидермофития • Кольцеобразный дерматомикоз
МКБ-10 • B35 Дерматофития • B36 Другие поверхностные микозы
ПРИЛОЖЕНИЯ
Геотрихоз — системный микоз, вызванный дрожжеподобным грибком Geotrichum candidum, протекающий с поражением полости рта, бронхов, лёгких или кишечника. Симптомы: кашель со слизисто-гнойной вязкой мокротой (с прожилками крови), афтозный стоматит, лихорадка. Возможна вторичная или смешанная инфекция. Прогноз неблагоприятный. Лечение • генцианвиолет • перорально калия йодид при поражении лёгких. МКБ-10. В48.3 Геотрихоз.
Хромомикоз — системное грибковое заболевание, вызываемое некоторыми тёмными гифальными грибами (Fonsecaea pedrosoi, Fonsecaea compacta или Phialophora verrucosa), с преимущественными грубыми и деформирующими изменениями кожи. Характерна медленная трансформация в крупные и часто изъязвляющиеся папилломатозные разрастания (в виде цветной капусты). Протекает обычно хронически. Наблюдают повсеместно; наиболее часто в тропических и субтропических странах (Бразилия, Коста-Рика). Лечение: успешность лечения находится в обратной зависимости от продолжительности заболевания и активности процесса; противогрибковые средства (амфотерицин В, кетоконазол), противоглистные средства (тиабендазол). Синонимы: дерматит веррукозный, Педрозо болезнь, хромофитоз, хромобластомикоз. МКБ-10. B43 Хромомикоз и феомикотический абсцесс.
Эритразма — псевдомикоз, вызываемый бактерией Corynebacterium minutissimum, проявляющийся ограниченными очагами желтовато-коричневого или розового цвета с чёткими контурами и мелким отрубевидным шелушением на поверхности; локализуется почти исключительно на прилегающих к мошонке участках внутренней поверхности бёдер.
Читайте также:

