Моноклональные антитела к ротавирусу
Обновлено: 17.04.2024
Цель исследования — разработать набор реагентов, предназначенных для выявления антител классов G и М к ВГЧ-7, методами иммуноферментного анализа (ИФА) и иммунного блоттинга (ИБ).
Для разработки набора реагентов в формате ИФА использовали рекомбинантный антиген gB ВГЧ-7, полистироловые планшеты MaxiSorp, конъюгат мышиных антител к IgG человека с пероксидазой хрена, индикаторный раствор с тетраметилбензидином. Для разработки наборов реагентов в формате ИБ использовали лизат ВГЧ-7 штамма SB, нитроцеллюлозную мембрану с диаметром пор 0,45 мкм; конъюгат козьих антител к IgG и IgM человека с щелочной фосфатазой; субстратный раствор — 5-бром-4-хлор-3-индолилфосфат и нитроголубой тетразолий. Для отработки метода использовали непрямой иммуноферментный анализ; иммунный блоттинг. Разработаны 3 набора реагентов: ИФА-ВГЧ-7-IgG — для выявления IgG к ВГЧ-7 методом ИФА; ИФА-Блот-ВГЧ-7-IgG и ИФА-Блот-ВГЧ-7-IgМ — для выявления и подтверждения наличия IgG и IgM к отдельным антигенам ВГЧ-7 методом иммунного блоттинга в формате Western blot.
Вывод. После получения регистрационного удостоверения разработанные наборы реагентов могут быть использованы для лабораторной диагностики ВГЧ-7-инфекции.
Иммунохроматографический экспресс-тест для одновременного выявления ротавируса и аденовируса в кале
Ю.А. Акиншина
Rapid immunochromatographic test for the simultaneous detection of rotavirus and adenovirus antigens in human stool specimens
Yu. A. Akinshina
Ротавирусы группы, А и аденовирусы 40 и 41 типа являются причиной более половины случаев тяжелого гастроэнтерита у младенцев и детей младшего возраста. Клинически дифференцировать эти заболевания невозможно.
Цель исследования — разработка высокочувствительной экспрессной иммунохроматографической тест-системы для единовременного выявления ротавируса и аденовируса в образцах кала.
Разработка и характеристика иммуноферментных тест-систем для серологической диагностики лихорадки Денге
Ю.А. Акиншина
Development and characteristics of elisa-kits for serological diagnosis of Dengue fever
Yu.A. Akinshina
Лихорадка денге (ЛД) — острое природно-очаговое арбовирусное инфекционное заболевание с трансмиссивным механизмом передачи возбудителя. В мире, по данным ВОЗ, каждый год регистрируется 50—100 млн случаев Л.Д. Болезнь является эндемичной для населения более чем 100 тропических и субтропических стран. Выделяют 4 вируса денге, и все они способны вызвать ЛД, в том числе ее геморрагическую форму, летальность при которой может достигать 20%. В последнее время в связи с интенсификацией международных поездок возникла опасность завозных случаев этого заболевания на территорию РФ. В связи с этим актуальность приобрела разработка средств диагностики этого заболевания. Впервые в РФ разработаны четыре моновалентных ИФА-IgM (МАС-ELISA) для выявления специфических антител класса М к каждому из четырех вирусов денге и две поливалентных — для выявления группоспецифических IgG и IgM в сыворотке крови человека. Установлена 100% диагностическая эффективность тест-системы ИФА-IgM-денге для верификации клинического диагноза лихорадки денге у больных с 5 дня болезни. Метод ИФА-IgM (МАС-ELISA) с разработанными наборами реагентов позволяет осуществлять дифференциальную диагностику лихорадки денге от других флавивирусных инфекций, однако наличие перекрестных серологических реакций в 2,1% случаев обязывает проводить верификацию этиологического агента путем сравнительного анализа титров антител в гетерогенных тест-системах. Исследование сывороток крови от больных лихорадкой денге с использованием моновалентного варианта метода ИФА-IgM (МАС-ELISA) позволяет дифференцировать типы вируса денге, вызвавшего заболевание, только в 37% случаев. Применение ИФА тест-систем для выявления антител класса G к флавивирусам, как правило, не позволяет дифференцировать эти инфекции, но может использоваться для серо-эпидемиологических исследований и как дополнительный подтверждающий тест.
Иммунохроматографический тест для определения D-димера
Ю.А. Акиншина
Immunochromatographic test for the detection of D-dimer
Yu. A. Akinshina
Лабораторная диагностика ревматоидного артрита
Е.Н. Александрова
Laboratory diagnosis of rheumatoid arthritis
E.N. Aleksandrova
A.S. Loginov Moscow Clinical Research and Practical Center, Moscow Healthcare Department
Ревматоидный артрит (РА) — иммуновоспалительное (аутоиммунное) ревматическое заболевание (РЗ) неизвестной этиологии, характеризующееся хроническим эрозивным артритом и системным поражением внутренних органов. Основными диагностическими лабораторными маркерами РА являются IgM ревматоидный фактор (РФ), антитела к циклическому цитруллинированному пептиду (АЦЦП), СОЭ и С-реактивный белок (СРБ), которые входят в число международных классификационных критериев ACR/EULAR 2010 г. и должны определяться с использованием стандартизованных количественных методов. Рекомендуется выделение негативных (≤верхнего предела референтного интервала — ВПРИ); низко позитивных (≤3 ВПРИ) и высоко позитивных (>3 ВПРИ) уровней РФ и АЦЦП. IgM РФ — чувствительный, но недостаточно специфичный маркер для диагностики РА (диагностическая чувствительность (ДЧ) составляет 50—90%, диагностическая специфичность (ДС) — 80—93%, отношение правдоподобия положительных результатов (ОППР) — 4,86, отношение правдоподобия отрицательных результатов (ОПОР) — 0,38), т.к. обнаруживается в сыворотках при других РЗ, хронических инфекциях, злокачественных новообразованиях и у людей пожилого возраста. АЦЦП — более высокоспецифичный диагностический маркер РА (ДЧ: 49—91%, ДС: 73—99%, ОППР: 12,46—17,3, ОПОР: 0,36—0,2). Антитела к модифицированному цитруллинированному виментину (АМЦВ) служат дополнительным диагностическим маркером РА у пациентов, серонегативных по IgM РФ и АЦЦП. АМЦВ обладают более высокой или сходной ДЧ (77%), но меньшей ДС (89%) по сравнению с АЦЦП. Выделены новые потенциальные диагностические маркеры РА: антитела к цитруллинированным белкам с широкой эпитопной специфичностью, карбамилированным (CarP) и ацетилированным белкам, пептидил аргинин деиминазе (PAD) 4, сывороточный белок 14−3-3eta. Согласно международным клиническим рекомендациям 2019 г.: 1) наиболее полезным маркером для диагностики РА является высокая сывороточная концентрация АЦЦП (≥3ВПРИ); 2) серопозитивность по IgM РФ в сочетании с высокими уровнями АЦЦП позволяет лучше дифференцировать РА от других РЗ; 3) по мере развития патологического процесса и увеличения длительности РА наблюдается положительная корреляция высоких уровней АЦЦП и/или IgM РФ с воспалительной активностью и рентгенологическим прогрессированием заболевания; 4) высокие сывороточные уровни АЦЦП и IgM РФ служат предикторами хорошего ответа на анти-В-клеточную терапию ритуксимабом; 5) выраженная серопозитивность по АЦЦП ассоциируется с эффективным ответом на абатацепт (ингибитор Т-клеточной костимуляции); 6) антитела к CarP не имеют самостоятельного диагностического значения, но являются предикторами тяжелого рентгенологического прогрессирования и течения РА.
На результаты определения СОЭ влияют возраст, пол, уровень фибриногена, РФ, гипергаммаглобулинемия, анемия и др. факторы. Рекомендуется международный метод измерения СОЭ по Вестергрену.
СРБ, синтез которого происходит в гепатоцитах под действием провоспалительных цитокинов, является более стабильным, валидированным, воспроизводимым и специфичным маркером воспаления, чем СОЭ. Изменения сывороточного уровня СРБ развиваются быстрее, их диапазон значительно превышает таковой у СОЭ. Использование именно СРБ, а не СОЭ, при подсчете DAS28 позволяет более достоверно оценить минимальную активность заболевания при Р.А. По данным американского регистра CORRONA, среди пациентов с активным РА у 16% больных отмечается одновременное увеличение СОЭ и концентрации СРБ, у 26% — повышение какого-либо одного из острофазовых показателей, у 56% — нормальный уровень СОЭ и СРБ. Важными факторами несовпадения результатов определения СОЭ и СРБ у больных РА являются инфекции, почечная недостаточноcть и низкий уровень альбумина в крови. Увеличение концентрации СРБ ассоциируется с повышенным риском тяжелого деструктивного поражения суставов при раннем Р.А. Повышенный уровень другого маркера воспаления — сывороточного амилоидного белка, А позволяет прогнозировать развитие вторичного амилоидоза и снижение выживаемости у больных Р.А. Сывороточный белок кальпротектин (S100A8/A9, MRP8/MRP14), высвобождающийся активированными нейтрофилами и моноцитами синовиальной оболочки, рассматривается в качестве перспективного маркера для мониторинга активности и выраженности локального синовиального воспаления при Р.А. Прогностическое значение единственного клинически апробированного мультибиомаркерного индекса активности РА (Vectra DA, Crescendo Bioscience, США) нуждается в уточнении.
Вывод. Лабораторные биомаркеры играют важную роль в ранней диагностике, мониторинге активности, оценке риска рентгенологического прогрессирования и прогнозировании эффективности терапии при РА.
Ротавирусы. Виды ротавирусов. Строение ротавирусов.
11 геномных сегментов ротавирусов кодируют 13 белков, 2 из которых образуются в результате посттрансляционного расщепления.
Данные по характеристике белковой композиции ротавирусов основном получены на модели ротавирусов животных, в частности обезьян, крупного рогатого скота и свиней, которые адаптированы к культуре клеток и накапливаются в высоких титрах.
В вирионах ротавирусов обнаружено шесть полипептидов (VP1, VP2, VP3, VP4, VP6 и VP7) с молекулярной массой от 37 до 125 кД, один из которых (VP7) гликозилирован.
Два белка VP4 (90 кД) и VP7 (36-38 кД) являются компонентами наружного капсида и не обнаруживаются в однокапсидных частицах. Другие белки образуют внутренний капсид или ассоциированы с сердцевиной вируса. Мажорным белком вириона является полипептид внутреннего капсида VP6 (42 кД). Три белка VP1, VP2 и VP3 входят в состав сердцевины.
Полипептиды наружного капсида ротавирусов представляют особый интерес, поскольку играют основную роль в возникновении инфекционного процесса и развитии иммунитета. Они ответственны за осуществление ранних этапов взаимодействия вирионов с чувствительными клетками - адсорбцию и проникновение, с ними связывают вирулентность ротавирусов. Эти же белки (VP7 и VP4) вызывают образование специфических вируснейтрализующих антител. Они ответственны за иммуногенность ротавирусов. Вирусоподобные частицы ротавирусов, содержащие основные иммуногенные белки, могут служить своеобразными компонентными вакцинами.
Белок VP7 является основным протективным антигеном ротавирусов, ответственным за образование ВН-антител. С помощью моноклональных антител (МАТ) в его составе обнаружен большой домен нейтрализации, включающий несколько перекрывающихся эпитопов. Гликозилирование VP7 - необходимое условие для взаимодействия с клетками-мишенями и проявления инфекционности.
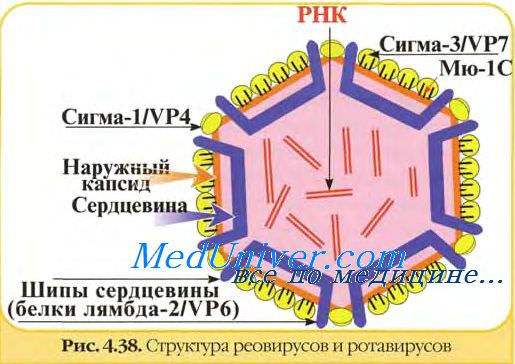
Другим важным белком наружного капсида является VP4. Он ответственен за адаптацию ротавирусов к росту in vitro, контролирует их вирулентность на уровне организма, к тому же является вирусным гемагглютинином и, по-видимому, осуществляет некоторые функции, что и гемагглютинин вируса гриппа, то есть является вирусным белком, обеспечивающим проникновение вируса в клетку. Гемагглютинирующий и нейтрализующий домены находятся в N-концевой половине VP4 ротавируса.
В отличие от гемагглютинина орто- и парамиксовирусов, гемагглютинин ротавирусов не является гликопротеином, хотя в первичной структуре этого белка обнаружены потенциальные сайты гликозирования. В результате протеолиза от полипептида VP4 отщепляется фрагмент — VP8, в котором обнаружено пять нейтрализующих эпитопов.
Нейтрализующие моноклональные антитела к VP7 и VP4 сообщали протективный иммунитет против гомологичного и некоторых гетерологичных серотипов ротавируса. Способность VP4 и VP7 к независимой и гетеротипической индукции синтеза протективных антител может иметь важное значение при конструировании современных ротавирусных вакцин.
Сравнительное изучение антигенных свойств ротавирусов различными методами показало наличие у них общих групповых антигенов. Групповое сходство определяется антигенной общностью внутреннего капсида, а антигенная специфичность связана с белками наружного капсида. Ротавирусы разделяют на группы, субгруппы и серотипы. Белки наружного капсида содержат типоспецифические антигенные детерминанты, а внутреннего — группоспецифические и субгруппоспецифические антигенные детерминанты. Групповая принадлежность определяется антигенной общностью белка VP6, субгрупповая — его антигенными различиями. Гликопротеин VP7 (главный белок нейтрализации) является типоспецифическим антигеном ротавирусов и определяет их серотиповую принадлежность. Серотиповая специфичность отличается высокой консервативностью. Критерием антигенного различия вирусов принята 20-кратная или большая разность титров вируса в РН с гомологичными и гетерологичными антителами.
Исходя из наличия общего группоспецифического антигена (VP6), все ротавирусы, независимо от вида естественного хозяина, разделены на шесть антигенных групп: А, В, С, D, Е и F. Наиболее многочисленна группа А, представители которой играют существенную роль в патологии человека и животных.
Большинство ротавирусов человека и животных относят к группе А, включающей так называемые типичные ротавирусы. Ротавирусы других групп называют атипичными, или параротавирусами. Они изучены недостаточно, поскольку, за небольшим исключением, их пока не удалось размножить in vitro. Каждая группа ротавирусов на основании типоспецифических антигенов делится на серотипы. Так, ротавирусы группы А разделены на 11 серотипов, получивших название G-серотипы.
В другие антигенные группы также входят ротавирусы, поражающие различных хозяев. Вирусы, имеющие одного хозяина, могут настолько сильно различаться между собой в антигенном отношении, что представляют различные антигенные группы. Штаммы ротавирусов, относящиеся к одному серотипу, но выделенные от различных видов животных, часто имеют более тесную антигенную связь, чем штаммы различных серотипов, выделенные от одного вида животных.
В группу В входят ротавирусы человека, крупного и мелкого рогатого скота, в группу С — человека и свиней, группы Е и F — свиней, группу D — птиц. В настоящее время различают не менее четырех серотипов ротавируса человека. Известно о существовании не менее трех серотипов ротавирусов группы А свиней. Кроме того, известны ротавирусы свиней, относящиеся к серогруппам В, С, Е. Серогрупповая серотиповая вариантность имеет место у ротавирусов крупного рогатого скота и других животных. В перекрестной реакции нейтрализации тесное антигенное родство выявлено между ротавирусами обезьян и свиней, а также между ними и ротавирусами крупного рогатого скота. Гомология первичной структуры VP7 различных серотипов достигает 71—85%. Различная степень антигенного родства по VP4 обнаружена между ротавирусами, выделенными от свиней, человека, обезьян и собак. Штамм (АН-1), выделенный от человека, характеризовался высокой гомологией с ротавирусом, выделенным от кошек (FRV-1). От крупного рогатого скота с диареей выделен ротавирус, геномная РНК которого была аналогична ротавирусу птиц. Ротавирусы человека и свиней имели высокую степень гомологии нуклеотидных последовательностей и, возможно, могли иметь общего предка.
Ротавирусы обезьян, свиней и кроликов легко инфицировали телят в экспериментальных условиях. Ротавирус человека вызывал летальную инфекцию у новорожденных поросят при оральном заражении. Существуют ротавирусы, обладающие двойной субгрупповой специфичностью. Такая уникальная способность обнаружена, например, у ротавируса лошадей (штамм FI-14), который взаимодействовал с антителами первой и второй субгрупп. Известен штамм ротавируса свиней с двойной серотипоспецифичностью (G3 и G5). Природа антигенного полиморфизма у ротавирусов пока не выяснена. Приведенные выше данные свидетельствуют о возможности пересечения ротавирусами видовых барьеров и их миграции между различными классами и видами млекопитающих в естественных условиях.
В последнее время у кур, свиней и человека были обнаружены атипичные ротавирусы, не имеющие группоспецифического антигена, несмотря на типичную для ротавирусов морфологию. Они были названы параротавирусами. Атипичные штаммы были обнаружены в 5% случаев при ротавирусных инфекциях у свиней и в 1% — ротавирусных диареях у крупного рогатого скота. При изучении с помощью ЭФ в ПААГ выявлены различия в профиле геномов этих штаммов и типичных ротавирусов. Параротавирусы свиней, в отличие от ротавирусов, вызывают образование синцития из энтероцитов в тонком кишечнике. Хемопротеин в тонком отделе кишечника удаляет наружный капсид ортореовирусов и ротавирусов и повышает их эффективность.
Колтивирусы и аквареовирусы по структуре и свойствам практически не отличаются от свойств, присущих семейству.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Моноклональные антитела (mAb) для лечения рака - эффективность
После многолетних исследований mAb заняли свое место среди противоопухолевых препаратов. Это стало возможным благодаря техническим достижениям, среди которых следующие.
1. Гуманизация мышиных антител, не приводящая к образованию к ним антител у человека.
2. Получение высокоаффинных антител с использованием бактериофагов.
3. Получение антител различного размера и обладающих различным сродством, а также различной способностью проникать в ткани.
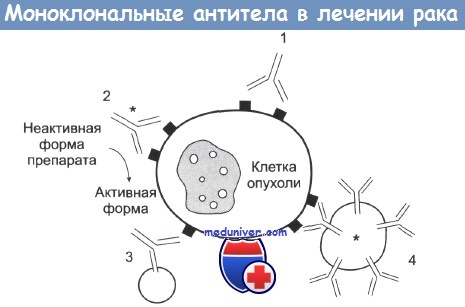
Действие mAb на клетку опухоли.
1 — антитело mAb связывается с антигеном опухолевой клетки и вызывает или ее комплемент-зависимую гибель, или гибель в результате антителозависимой атаки макрофагами.
2 — с mAb связан радиоактивный изотоп, токсин или цитокин, вызывающие гибель клетки. Также с антителами может быть связан фермент, участвующий в превращении препарата в активную форму.
3 — биспецифические mAb. Один сайт связывается с опухолевой клеткой, другой — с киллерной эффекторной клеткой.
4 — антитела mAb связаны с липосомами, которые содержат химотерапевтические препараты или токсины.
Существует много способов изменения антител для проявления у них противоопухолевого эффекта. Наиболее часто использующийся прием схематически представлен на рисунке. Подробности приведены в подписи к рисунку. Каждый из способов имеет свои возможности и ограничения.
1. Прямое цитотоксическое действие, вызываемое комплементом или антителами. При этом Fc-часть молекулы антитела должна связаться с Fc-рецептором (I или II) эффекторной клетки, но во избежание проявления ингибирующего эффекта не должна присоединяться к FcRIII. Таким механизмом цито-токсического действия обладает трастузумаб, который связывается с ERB В2 рецепторами опухоли молочной железы, а также ритуксимаб — mAb к CD20, применяющееся для лечении больных с В-клеточной лимфомой.
2. Примером mAb, доставляющих к раковой клетке токсин или радиоактивный изотоп, являются гуманизированные анти-CD33, конъюгированные с калихеамицином (гемтузумаб). Калихеамицин представляет собой агент, связывающийся с ДНК в области малой бороздки. CD33 экспрессируется на поверхности бластных клеток при остром миелоидном лейкозе. При рецидивах, устойчивых к медикаментозным препаратам, гемтузумаб вызывает ремиссию.
Подход с применением токсинов, например рицина, конъюгированных с mAb, не привел к получению клинических препаратов из-за высокой их токсичности для кровеносных сосудов. Присоединение к антителам радиоактивных изотопов (иттрия-90 или йода-131) представляет собой привлекательный путь, поскольку при этом появляется возможность воздействовать на опухолевые клетки, расположенные на некотором расстоянии от клетки-мишени. В настоящее время проходят клинические испытания aнmu-CD20, меченые иттрием-90 и анти-СЕА, меченые иодом-131.
Антитела, содержащие фермент, способный переводить лекарственный препарат в активную форму (ADEPT, antibody-dependent enzyme prodrug therapy), показали обнадеживающие результаты при лечении больных с метастазирующими колоректальными раками. Ферменты, конъюгированные с антителами, проявляют иммуногенные свойства, что ограничивает диапазон назначаемых доз.
3. Подход с использованием биспецифических антител пока еще находится на ранней стадии развития. Присоединение антител к эффекторным Т-клеткам вызывает мощный выброс цитокинов, приводящий к токсическим проявлениям. Это ограничивает применение подобных препаратов.
4. Иммунолипосомальные препараты являются эффективными средствами адресной доставки токсинов или радиоактивных изотопов к клеткам опухоли, однако получение их технически трудно. Эти препараты могут оказаться перспективными в случае, когда необходимо воздействовать на сосудистую систему опухоли.

Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Моноклональные антитела в биотехнологии. Использование моноклональных антител.
Люди обладают иммунной системой, которая способна отвечать на внедрение чужеродных молекул образованием антител. Молекулы, которые стимулируют образование антител, называются антигенами. Обычно это белки или гликопротеины. Каждый антиген стимулирует образование специфического антитела, которое точно ему соответствует и способно связываться с ним и разрушать его. Так, например, если чужеродное тело поступает с определенным видом бактерий, иммунная система распознает антигены на внешних мембранах бактериальных клеток как чужеродные и соответственно образуются антитела, специфичные к этим антигенам. Антитела продуцируются особыми лимфоцитами, которые называются В-клетками.
В 1970-х годах Цезарь Мильштейн (С. Milstein) и Георг Кёлер (G. Kohler), работавшие в Кембридже, пытались найти способ получения антител только одного типа. До того времени антитела выделяли из крови животных, которых специально подвергали действию нужного антигена. Однако конечный продукт получался недостаточно чистым и содержал сотни различных антител. Мильштейн и Кёлер решили проблему, разработав методику получения моноклональных антител, за которую в 1984 г. они были удостоены Нобелевской премии. Мо-ноклональный означает принадлежащий одному клону. Каждый тип антител продуцируется одним типом В-клеток, которые клонируют сами себя, другими словами, размножаются, образуя много идентичных копий самих себя в ответ на определенный антиген. Теоретически можно выделить и культивировать определенный тип В-клеток и получить большое количество чис-тых антител одного типа.
Поскольку все антитела, полученные таким путем, происходят от одного клона, они называются моноклональными. Однако в культуральной среде В-клетки могут поддерживаться лишь несколько дней. Мильш-тейн и Кёлер путем слияния В-клеток с раковыми клетками, которые являются бессмертными, получили клетки гибридомы. Эти клетки продолжают размножаться и могут быть клонированы, что позволяет получать большое количество антител.
Получение моноклональных антител
Получение моноклональных антител начинают с того, что определенный антиген вводят лабораторному животному (обычно это мышь). Спустя некоторое время, необходимое для иммунного ответа, из селезенки животного выделяют лимфоциты и смешивают их с особым типом раковых клеток в соответствующей культуральной среде. Чтобы стимулировать слияние лимфоцитов с раковыми клетками, в среду добавляют по-лиэтиленгликоль. Подбирают такие условия роста, которые позволяют выживать только гибридным клеткам. Из них выбирают клетки, производящие определенные антитела, и культивируют эти клетки отдельно. Клетки продолжают делиться независимо и являются постоянным источником чистых антител.

Использование моноклональных антител
ТЕСТ НА БЕРЕМЕННОСТЬ.
Из 150 диагностических моноклонапьных антител, применяемых в настоящее время, примерно одна треть используется для выявления беременности. Как только эмбрион достигает матки (в пределах четырех дней после зачатия), он прикрепляется к ее стенке. Этот процесс называется имплантацией. Информация об этом поступает в яичники женщины, чтобы они могли отреагировать соответствующим образом. При поступлении такого сигнала яичники производят гормоны, поддерживающие внутренний слой матки. При этом у женщины прекращаются менструации, и эмбрион сохраняется. Сигналом для яичников служит гормон, продуцируемый ворсинками хориона — органа, с помощью которого зародыш соединяется со стенкой матки. Название этого гормона — хори-онический гонадотропин человека (сокращенно ХГЧ). Он циркулирует в крови матери, откуда и поступает в яичники. Ко времени, когда у женщины в норме должна начаться менструация (примерно через 14 дней после зачатия), уровень ХГЧ повышается настолько, что его можно обнаружить в моче. ХГЧ является гликопротеином, и к нему можно получить антитела с помощью описанного выше метода.
Современные тесты на беременность основаны на выявлении ХГЧ в пробе мочи женщины с помощью моно-клональных антител. Процедура описана на рисунке. Набор для тестирования в домашних условиях, с помощью которого результат получают в течение 5 мин, имеется в продаже. Можно установить беременность даже раньше, если для исследования использовать кровь.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Аденовирус (аденовирусная инфекция) вызывает поражение дыхательных путей, желудочно – кишечного тракта, глаз.
Обе инфекции очень часто поражают детей раннего и дошкольного возраста, взрослых с ослабленным иммунитетом. Опасны они тем, что могут вызывать обезвоживание организма при выраженном диарейном синдроме, многократной рвоте. Около 50% клинических случаев диареи у детей раннего возраста и дошкольников, требующих госпитализации в стационар, вызваны ротавирусной и аденовирусной инфекциями.
Диагностика ротавирусных и аденовирусных гастроэнтеритов основана на выявлении вирусных частиц в кале с помощью электронной микроскопии и иммунологических методов. К иммунологическим методам диагностики относятся: метод иммунохроматографии и ИФА (иммуноферментный анализ) с использованием поликнональных и моноклональных антител к специфическим антигенам вируса. Вирусные частицы в больших количествах выделяются из организма с калом, что облегчает диагностику. С одним граммом испражнений больного человека в окружающую среду выделяется 10 9 – 10 11 вирусных частиц. Этим объясняется высокий риск заражения окружающих, членов семьи, контактирующих с больным.
Метод иммунохроматографии с использованием моноклональных антител предполагает определение антигенов вирусных частиц в кале при помощи иммунной реакции вирусных антигенов со специфическими антителами к ним. Высокая чувствительность и специфичность метода иммунохроматографии позволяет проводить быструю и точную диагностику заболевания. Врач может получить результат анализа в день взятия материала или на следующий день
От пациента не требуется подготовки. Материал для исследования: кал
- Диарейный синдром у детей до 3х летнего возраста
- Диарейный синдром у детей старшего возраста и у взрослых
- Диарейный синдром у контактировавших с больным (ротавирусная, аденовирусная инфекция)
- Дифференциальная диагностика заболеваний, сопровождающихся диареей, рвотой
- По требованию эпидемиологов в связи с эпидемиологической ситуацией
- Контроль эффективности лечения ротавирусной, аденовирусной инфекции
Результат анализа дается в виде информации о наличии (положительный результат) или отсутствии (отрицательный результат) вирусных антигенов в исследуемом материале (кал). Вирусные частицы могут быть обнаружены в образцах кала бессимптомных носителей.
Читайте также:

