Морфологические исследования при туберкулезе
Обновлено: 24.04.2024
ФГБУ "Санкт-Петербургский научно-исследовательский институт фтизиопульмонологии";
Медицинский факультет Санкт-Петербургского университета
Иркутская городская клиническая больница
Лаборатория патоморфологии Санкт-Петербургского НИИ фтизиопульмонологии
Морфологическая диагностика туберкулеза в современных условиях
Журнал: Архив патологии. 2015;77(3): 3‑9
ФГБУ "Санкт-Петербургский научно-исследовательский институт фтизиопульмонологии";
Медицинский факультет Санкт-Петербургского университета
Приведены основные статистические данные по заболеваемости и смертности от туберкулеза, которые в последние годы имеют положительную динамику, за исключением его сочетания с ВИЧ-инфекцией. Задачи морфологической диагностики туберкулеза разделены и разобраны на 4 группы: 1) уточнение подходов для выявления микобактерий в тканях; 2) оптимизация посмертной диагностики туберкулеза; 3) оптимизация прижизненной дифференциальной диагностики туберкулеза и разработка методов прогнозирования его течения; 4) изучение патогенеза туберкулеза в свете современных представлений об инфекционном процессе. Приведены данные, свидетельствующие, что тканевые формы микобактерий, варианты воспалительной реакции и особенности патогенеза туберкулеза нуждаются в дальнейшем изучении. В качестве важнейших задач при морфологическом изучении туберкулеза следует рассматривать также установление истинной роли нетуберкулезных микобактерий, изучение вероятности суперинфицирования пациентов другими генотипами M. tuberculosis, разработку единой (клинической, патогенетической и морфологической) классификации туберкулеза.
ФГБУ "Санкт-Петербургский научно-исследовательский институт фтизиопульмонологии";
Медицинский факультет Санкт-Петербургского университета
Иркутская городская клиническая больница
Лаборатория патоморфологии Санкт-Петербургского НИИ фтизиопульмонологии
Задачи, стоящие перед патологоанатомической службой во фтизиатрии, по нашему мнению, могут быть разделены на 4 группы:1) уточнение подходов для выявления микобактерий в тканях; 2) оптимизация посмертной диагностики туберкулеза; 3) оптимизация прижизненной дифференциальной диагностики туберкулеза и разработка методов прогнозирования его течения; 4) изучение патогенеза туберкулеза в свете современных представлений об инфекционном процессе.
1. Уточнение подходов для выявления микобактерий в тканях
Классическим и общепринятым методом диагностики туберкулеза является окраска срезов карболовым фуксином по методу Циля—Нильсена. В случае выявления кислотоустойчивых палочек в сравнительно больших количествах все обстоит относительно просто.
Однако при оценке результатов этой окраски приходится сталкиваться с рядом существенных трудностей. Так, в случаях бесспорного туберкулеза, в том числе подтвержденного с помощью полимеразно-цепной реакции (ПЦР), кислотоустойчивые палочки могут не выявляться или обнаруживаться лишь в очень небольшом количестве при повторном пересмотре микропрепаратов.
Для специального изучения этого вопроса нами было проанализировано 19 наблюдений лиц, умерших от генерализованного туберкулеза (табл. 1).

Таблица 1. Общая характеристика исследованных умерших
Парафиновые срезы повторно окрашивали карболовым фуксином по Цилю—Нильсену, азур-эозином, по Браун-Хоппсу, ставили иммуногистохимическую (ИГХ) реакцию с сывороткой к антигенам микобактерий туберкулезного комплекса. Полученные результаты представлены в табл. 2.

Таблица 2. Результаты гистобактериоскопического и ИГХ-исследований Примечание. Во всех исследованных микропрепаратах характерные для туберкулеза гистологические изменения: + — положительные результаты в единичных полях зрения, ++ — многочисленные положительные результаты во многих полях зрения.
При гистологическом исследовании различных органов (легких, головного мозга, селезенки, лимфатических узлов, почек, печени) определялись некротические участки, в зоне которых преобладали окрашенные гематоксилином глыбки, сходные с наблюдаемыми при кариорексисе и распаде нейтрофильных лейкоцитов. Такие же фиолетовые глыбки определялись при окраске по Цилю—Нильсену (рис. 1).

Рис. 1. Циль-отрицательные глыбки в зоне казеозного некроза в лимфатическом узле умершего от генерализованного туберкулеза, верифицированного ПЦР. Окраска по Цилю—Нильсену. ×1000.
Эпителиоидные и гигантские клетки практически отсутствовали. Кислотоустойчивые палочки либо не определяли вовсе, либо обнаруживали в минимальном количестве, в единичных случаях их количество оказалось значительно больше при повторном окрашивании срезов. При ИГХ-исследовании во всех наблюдениях выявлена резко положительная специфичная реакция преимущественно во внеклеточных коккоидных структурах (рис. 2). Для исключения артефициального окрашивания проводили ИГХ-исследование контрольных срезов и в параллельных препаратах, окрашенных гематоксилином и эозином, исключалось наличие угольного пигмента и гемосидерина. Число палочек было значительно меньше и коррелировало с результатом окрашивания по Цилю—Нильсену.

Рис. 2. Многочисленные кокковидные структуры, прокрашенные иммуногистохимической сывороткой к антигену микобактерий туберкулезного комплекса в параллельном срезе того же наблюдения. ×1000.

Рис. 3. Многочисленные, преимущественно внутриклеточные палочки в брыжеечном лимфатическом узле умершего от верифицированного микробиологически микобактериоза, вызванного M. avium у пациента с ВИЧ-инфекцией в стадии СПИДа. Окраска по Цилю—Нильсену. ×600.
2. Оптимизация посмертной диагностики туберкулеза
Как среди патологоанатомов, так и фтизиатров наиболее распространена точка зрения, что посмертная диагностика туберкулеза сравнительно проста и в типичных наблюдениях, безусловно, соответствует истине. К сожалению, детальный анализ летальности от туберкулеза, включающий морфологическую характеристику выявленных на вскрытии изменений, в России ни в рамках фтизиатрической, ни патологоанатомической служб не проводится и с удовлетворением констатируется совпадение клинического и патологоанатомического диагнозов практически во всех случаях. Следует отметить, что в подавляющем большинстве наблюдений, касающихся туберкулеза, особенно в сочетании с ВИЧ-инфекцией, даже при формальном совпадении патологоанатомического и клинического диагнозов последний практически всегда уточняется и дополняется зачастую весьма существенно [8]. Кроме того, современные формы туберкулеза не могут быть адекватно охарактеризованы с использованием существующих классификаций. Причины этого явления остаются не вполне ясными. Возможности клинической диагностики туберкулезных поражений печени, кишечника, селезенки, почек, щитовидной железы, надпочечников ограничены [9].
Значительно реже анализируются случаи клинической гипердиагностики туберкулеза. Вне всяких сомнений, в части случаев прижизненная диагностика туберкулеза (особенно со знаком вопроса) на фоне ВИЧ не базируется на каких-либо объективных данных, и он предполагается лишь в связи с их частым сочетанием. Кроме того, нам в единичных наблюдениях приходилось сталкиваться с такими комбинациями вторичных инфекций, которые симулировали как рентгенологическую, так и макроскопическую картину туберкулеза. Так, в одном из наших наблюдений, со стремительным развитием ВИЧ-инфекции (в течение 2 мес) изменения, похожие на инфильтративный туберкулез с формированием острых каверн (рис. 4), оказались связаны с аспергиллами (в зоне дефекта) (рис. 5) и пневмоцистами (в окружающей уплотненной ткани) (рис. 6), симулировавшими туберкулез клинически, рентгенологически и макроскопически. В других наблюдениях туберкулез имитировали септические отсевы при инфекционном эндокардите, метастатические поражения при лимфомах.

Рис. 4. Стенка полости, имитировавшей рентгенологически и макроскопически каверну у умершего от быстро прогрессировавшей ВИЧ-инфекции. Окраска гематоксилином и эозином. ×250.

Рис. 5. Многочисленные нити мицелия аспергилл по краю полости у того же пациента. Импрегнация по Гроккоту. ×600.

Рис. 6. Пенистые PАS-позитивные массы, характерные для пневмоцистоза, верифицированного также иммуногистохимически и электронно-микроскопически, в большей части легких у того же пациента. PAS-реакция. ×600.
Следует отметить, что в отдельных наблюдениях на фоне ВИЧ-инфекции туберкулез не прогрессировал, изредка на фоне лечения отмечалось его обратное развитие. Наблюдения такого рода нуждаются в специальном анализе.
3. Оптимизация прижизненной дифференциальной диагностики туберкулеза и разработка методов прогнозирования его течения
При ВИЧ-инфекции в стадии СПИДа зачастую речь идет о генерализованных формах заболевания с распространенным характером поражений, диагностика которых, особенно по биопсийному и операционному материалам, крайне затруднена из-за нетипичной микроскопической картины, в которой доминируют альтеративные изменения без типичных клеточных и тканевых реакций. Во многих случаях диагноз помогает поставить окраска по Цилю—Нильсену, что позволяет рекомендовать ее к более широкому использованию.
Одной из наиболее актуальных проблем современной медицины является дифференциальная диагностика гранулематозов. Несмотря на то что во всех современных руководствах по патологии легких указывается на широкий круг причинных факторов гранулематозов (туберкулез, саркоидоз, микозы, лепра, гранулематоз Вегенера, первичный билиарный цирроз на ранних стадиях, ревматические болезни и др.), а в единичных источниках он расширяется за счет хламидиоза и микоплазмоза [10], в клинической практике морфолог чаще проводит дифференциальную диагностику между туберкулезом и саркоидозом. В части случаев абсолютно уверенно различить эти заболевания только по морфологическим данным невозможно. В клинической практике нам приходилось сталкиваться с ошибочной диагностикой туберкулеза кожи при хромомикозе в связи с наличием в препарате многоядерных клеток Лангханса (рис. 7).

Рис. 7. Хромомикоз кожи у пациента, длительное время безрезультатно лечившегося от туберкулеза. а — окрашенные грибы в зоне нейтрофильной инфильтрации; б — гигантские клетки типа Лангханса в составе мононуклеарной инфильтрации в соседнем поле зрения. Окраска гематоксилином и эозином. ×600.
На нашем материале в рамках дифференциальной диагностики гранулематозных поражений легких на основании особенностей микроскопических изменений (появление значительного количества макрофагов с вакуолизированной цитоплазмой) в легких и лимфатических узлах высказывались предположения о возможной этиологической роли хламидий и микоплазм. В 5 наблюдениях при ИГХ-исследовании эти предположения были подтверждены.
При клинико-морфологических сопоставлениях, проводившихся в лаборатории патоморфологии Санкт-Петербургского НИИ фтизиопульмонологии, было показано, что течение фиброзно-кавернозного туберкулеза коррелирует с вовлечением в воспалительный процесс лимфатических узлов и стенки бронхов.
4. Изучение патогенеза туберкулеза в свете современных представлений об инфекционном процессе
Классические представления о патогенезе туберкулеза базируются на фундаментальных исследованиях, преимущественно выполненных в первой половине ХХ века. Любая инфекция по современным представлениям является результатом взаимодействия микро- и макроорганизма [11]. Современные исследования, посвященные механизмам развития этого заболевания, основаны преимущественно на изучении взаимодействия микобактерий с культурами клеток [12, 13]. Таким образом, одна из заинтересованных сторон — макроорганизм с совершенно разными конституциональными особенностями, преморбидным фоном и иммунным статусом — полностью выпадает из поля зрения, что обесценивает роль таких исследований.
В публикациях, посвященных характеристике генотипов микобактерий, приводятся сведения об их значительных различиях, в том числе по вирулентным свойствам. Особое внимание уделяется штамму Beijing (Пекин, генотип В), который известен с 90-х годов прошлого века как W-штамм, выявленный в США, обладающий лекарственной устойчивостью и выраженными патогенными свойствами [14]. Его отличает склонность к диссеминации и генерализации, при нем достоверно чаще встречаются внелегочные формы заболевания, клинически он может протекать с фебрилитетом [15—17]. Он экспрессирует гораздо большие количества провоспалительных цитокинов (IL-1β, IL-12, TNF-α), причем уровень экспрессии не зависит от числа инфекта, в связи с чем он способен инициировать воспаление ничтожно малыми количествами микробных тел [16]. В условиях нестерильного иммунитета, сформированного как вакциной БЦЖ, так и местными (аборигенными) штаммами, его воздействие на иммунную систему приводит к конфликту, следствием чего может быть реактивация дремлющего очага и/или суперинфицирование. По результатам исследования, проводимого в Иркутске на материале аутопсий, этот генотип был выявлен в 65% случаев. Кроме того, были получены данные, свидетельствующие о возможности одновременного инфицирования больных микобактериями разных типов и подтипов [18—20]. Этот феномен нуждается в дальнейшем изучении, поскольку он может внести ясность в понимание некоторых аспектов патогенеза.
Еще одной практически не обсуждаемой во фтизиатрической литературе является проблема смешанных инфекций. Если при туберкулезе в сочетании с ВИЧ-инфекцией это достаточно очевидно, то в других клинических ситуациях поиск нетуберкулезных возбудителей у больных туберкулезом практически не осуществляется. Вместе с тем наш опыт изучения операционного, биопсийного и аутопсийного материалов во многих случаях позволяет с разной степенью убедительности говорить о наличии в тканях поражений, связанных как с ДНК-, так и РНК-содержащими вирусами, микоплазмами, хламидиями и грибами. Клиническая значимость таких коинфекций не всегда бесспорна, но, безусловно, нуждается в дальнейшем комплексном изучении. При ВИЧ-инфекции на нашем материале встречаются наблюдения с одновременным наличием пяти инфекций. Хотя, очевидно, все они должны каким-то образом взаимодействовать друг с другом, фактические данные в этом отношении отсутствуют.
Говоря о свойствах макроорганизма, следует помнить, что к ним наряду с уровнем иммунокомпетентных клеток в периферической крови относятся также местная резистентность и конституциональная устойчивость. Иммуноморфологических исследований, направленных на изучение местной резистентности дыхательных и пищеварительных путей, сравнительно немного, а при туберкулезе такие подходы почти не использовались.
Важными, на наш взгляд, оказались результаты молекулярно-биологических исследований по адаптивному взаимодействию полиморфных локусов генов человека с эпидемическими штаммами М. tuberculosis, полученные нами в рамках того же исследования, проводимого в Иркутске. Особый интерес представлял ген DC-SIGN (Dendritic Cell-Special Intercellular adhesion molecule-3-Grabbing Non integrin) позиции -336A/G, более известный как CD209, отвечающий за захват инфекта. Известно, что эффективность захвата зависит от уровня лектинового рецептора, находящегося на поверхности дендритных клеток. Установлено, что у людей с генотипом AG и GG по гену CD209 количество этого рецептора значительно ниже [21, 22]. Результаты, полученные нами в ходе этого исследования, подтверждают это положение. Было установлено, что у мужчин с аллелью G (генотипы AG и GG) наиболее частой была комбинация с эпидемическим штаммом генотипа В (Beijing). При расчетах оказалось, что вероятность развития летального исхода в этой группе по сравнению с группой женщин с любым генотипом и мужчин с генотипом АА была выше в 6 раз, при этом отношение шансов (ОШ) = (р=0,0008) 1,9458—19,923 (95% ДИ) [21].
Требуют изучения и некоторые необъяснимые с точки зрения современных представлений о патогенезе туберкулеза факты. Прежде всего существование изолированных туберкулезных поражений отдельных органов: мягких мозговых оболочек, тел позвонков и других при отсутствии посттуберкулезных изменений в области обычно обсуждаемых локализаций первичного комплекса и при самом тщательном посмертном исследовании.
Заключение
Многие вопросы, связанные как с практической прижизненной и посмертной диагностикой туберкулеза, так и с пониманием его патогенеза, нуждаются в дальнейшем комплексном изучении с позиций современной инфектологии.
В нашем исследовании удалось доказать, что при тяжелых верифицированных с помощью ПЦР туберкулезных поражениях разных органов типичные кислотоустойчивые палочки могут либо отсутствовать, либо определяться в минимальных количествах, недостаточных для уверенной постановки диагноза. При этом в тканях, преимущественно внеклеточно, выявляются полиморфные кокки, специфически не окрашиваемые по Цилю—Нильсену, но верифицируемые иммуногистохимически как микобактерии. Часть этих микроорганизмов окрашивается азуром и дает феномен метахромазии. Вокруг некротических масс практически отсутствуют эпителиоидные и гигантские клетки Лангханса. Приведенные данные свидетельствуют, что тканевые формы микобактерий, варианты воспалительной реакции и особенности патогенеза туберкулеза нуждаются в дальнейшем изучении.
Перспективным представляется и продолжение морфологических исследований, направленных на оценку активности воспалительного процесса в разных органах, особенно в сопоставлении с клиническими, биохимическими, радиологическими данными.
В качестве важнейших задач при морфологическом изучении туберкулеза следует рассматривать оптимизацию методов выявления микобактерий в тканях и морфологической диагностики туберкулеза, установление истинной роли нетуберкулезных микобактерий, изучение вероятности суперинфицирования пациентов другими генотипами M. tuberculosis, разработку единой (клинической, патогенетической и морфологической) классификации туберкулеза.
Цитологические методы диагностики туберкулеза. Гистологические методы диагностики туберкулеза.
Цитологические и гистологические методы играют важную, а нередко и решающую роль в распознавании заболеваний органов дыхания. Большое значение имеет исследование клеточного состава мокроты. В нативных и специально окрашенных препаратах находят лейкоциты, эритроциты, клетки плоского и цилиндрического эпителия, альвеолярные макрофаги, пылевые, эпителиоидные, гигантские и опухолевые клетки, кристаллы холестерина и Шарко—Лейдена, неизмененные, обызвествленные коралловидные волокна, микобактерии туберкулеза, неспецифическую флору, друзы актиномицетов, аспергиллы, дрожжевые грибы, сферулы кокцидиоидногэ микоза и т. д.
Следует иметь в виду, что обызвествленные очаги в легких определяются иногда при хроническом абсцессе легкого и гистоплазмозе. Клетки метаплазированного эпителия бронхов со значительной атипией, весьма сходные с элементами злокачественного новообразования, встречаются при хронической пневмонии или бронхите.
Эпителиоидные и гигантские клетки Пирогова— Лангханса можно обнаружить не только при туберкулезе, но и при саркоидозе. Вот почему результаты цитологического анализа мокроты приобретают важное диагностическое значение, если они подтверждаются другими методами исследования.
Частота обнаружения тех или иных клеточных элементов в мокроте или в смывах из бронхов зависит от фазы и динамики процесса, локализации патологического образования в легких, например, при центральном или периферическом раке. Результативность цитологического диагноза, указывал в 1961 г. Umiker, обратно пропорциональна расстоянию опухоли от бифуркации трахеи. Этими факторами следует объяснить различную частоту выявления клеток опухоли при раке легких: в 70—87,6% по данным А. Я. Альтгаузена (1962), Н. Н. Шиллер-Волковой и соавт. (1964), в 24,6—38—45% по наблюдениям Р. Д. Блиновой (1972).
Тот же метод исследования оправдывает себя в диагностике периферических лимфаденитов. При туберкулезе характер обнаруживаемых тканевых изменений зависит от фазы процесса (Е. Д. Тимашева, 1953; М. Г. Абрамов, 1974). В I гиперпластической стадии определяется лишь гиперплазия лимфаденоидной ткани, во II стадии (гранулематозной) находят элементы туберкулезного бугорка, в III — массивный казеозный некроз, в IV — гной, в V (фиброзной) — соединительнотканные волокна, мелкие клеточные элементы.
При раке в пунктатах из лимфатических узлов обнаруживают клетки опухоли, при саркоидозе — эпителиоидные и гигантские клетки без признаков творожистого некроза, при лимфогранулематозе — клетки Березовского—Штернберга и большое число эозинофилов, при лимфолейкозе— картину мономорфной гиперплазии лимфоидной ткани и т. д.
Те или иные патологические изменения удается обнаружить при цитологическом исследовании пунктатов печени, селезенки, костного мозга. Пользуясь этим методом, Olderhauser и соавт. выявили туберкулезные бугорки в печени у 25,3 % больных диссеминированным туберкулезом и у 7,3% — при других его формах. Почти в 60% случаев при пункции печени находят гранулемы, характерные для саркоидоза, особенно при I его стадии (Scadding, 1967, и др.). Сочетая этот способ исследования с пери-тонеоскопией, Tachibana и соавт. (1971) выявили такие тканевые изменения в печени у 70%, a Liehr (1971) — у 90% больных саркоидозом.
Известное значение в дифференциальной диагностике приобретает цитологическое изучение материала, полученного при трансторакальной пункции легкого. Этот метод исследования, который впервые использовал Leyden .еще в 1883 г., в последнее время получил более широкое применение. В пунктате, помимо альвеолярного и бронхиального эпителия, можно обнаружить при туберкулезе эпителиоидные и гигантские клетки и элементы творожистого некроза, при саркоидозе — эпителиоидные и гигантские клетки, при раке и других злокачественных новообразованиях — клетки опухоли и т. д.
Sabow и соавт. при изучении пунктатов установили диагноз рака легкого у 117 больных, между тем как при бронхоскопии — у 81, а при цитологическом исследовании мокроты — лишь у 59 из них. По данным Р. Д. Блиновой (1972), диагноз рака удается верифицировать при пункции легкого у 91,9% больных, по наблюдениям И. С. Мечевой (1973), Н. А. Шмелева (1959) и др. — у 57—80%, а по материалам М. Г. Виннера и М. Л. Шулутко (1971) — у 50% больных. Менее результативна диагностическая пункция при аденоме, гамартохондроме и других доброкачественных образованиях легких. Однако Otto и Frick (1971) на обширном материале (1000 диагностических пункций легкого, произведенных на протяжении 1967—1971 гг. у больных со злокачественными и доброкачественными новообразованиями, туберкулезом, микозами, пневмокониозом, хроническим воспалительным процессом и т. д.) удалось подтвердить диагноз в среднем в 3/4 случаев.
Пункцию легкого целесообразно производить при периферической локализации процесса и достаточной величине патологического образования в легком. Не рекомендуется пользоваться этим методом при подозрении на асбсцесс или гангрену, кисту или эхинококкоз ввиду возможности инфицирования плевральной полости, а также при аневризме легочных сосудов. Его нельзя применять у больных с геморрагическим диатезом, при легочно-сердечной недостаточности у пожилых людей.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
а) Терминология:
1. Аббревиатуры:
• Туберкулез (ТБ)
• Микобактерии туберкулеза (МБТ)
2. Определения:
• МБТ: инфекция с аэрогенным (воздушно-капельным) механизмом передачи
• Гранулема: эпителиоидные гистиоциты, в т.ч, гигантские клетки Лангханса, окруженные лимфоцитами
• Очаг Гона: первичный легочный очаг ТБ
• Комплекс Ранке: очаг Гона + поражение лимфоузлов
б) Визуализация:
2. КТ легких при туберкулезе:
• ТБ лимфаденит:
о Гиподенсный участок в центре, контрастное усиление на периферии
о Типичная односторонняя лимфаденопатия корня легкого и/или паратрахеальная лимфаденопатия
• ВИЧ(+):
о Лимфаденопатия с вовлечением нескольких групп лимфоузлов
о Консолидация легочной ткани у пациентов с тяжелым иммунодефицитом (СПИД) и уровнем CD4
• ТБ плевры:
о Плевральный выпот, возможно, осумкованный
о Утолщение, контрастное усиление, обызвествление плевры
о Сопутствующий ТБ легких (часто):
- Субплевральные и перибронховаскулярные микроузелки, утолщение междольковых перегородок
- Может напоминать злокачественную опухоль
- Парадоксальный ответ: увеличение внутрилегочных очагов после начала эффективного лечения
о Плевральный выпот на стороне поражения
о Бронхоплевральный свищ:
- Гидропневмоторакс, возможно, напряженный
о Эмпиема плевры, сообщающаяся с внешней средой
- Жидкость и мягкотканный компонент с распространением из полости плевры в мягкие ткани грудной стенки ± свищ, открывающийся в коже
3. Сцинтиграфия:
• ПЭТ/КТ:
о Пораженные ткани при ТБ обычно накапливают ФДГ
в) Дифференциальная диагностика туберкулеза легких:
1. Нетуберкулезная микобактериальная инфекция легких:
• Mycobacterium avium-intracellularecomplex (MAC), Mycobacterium kansasii и др.
• Классическая или кавитирующая инфекция неотличима от кавитирующего ТБ на диагностических изображениях:
о Предполагайте ТБ, пока не доказано обратное
о Необходимо исследование мокроты и/или другие лабораторные исследования
3. Некротическая лимфаденопатия:
• Центральный некроз и периферическое контрастное усиление:
о Другие инфекции: грибки
о Метастатическая лимфаденопатия: рак легкого, плоскоклеточный рак головы и шеи
4. Милиарные микроузелки:
• Милиарная грибковая инфекция
• Милиарные метастазы:
о Папиллярный рак щитовидной железы
• Трансбронхиальная биопсия позволяет дать точный диагноз
г) Патология:
3. Микробиология:
• МБТ: облигатные патогены рода Mycobacteriaceae, вызывающие туберкулез
• Аэробные, требующие большого количества кислорода
• Окрашиваются по Цилю-Нильсену, являются кислотоустойчивыми
д) Клинические особенности:
2. Демография:
• Эпидемиология:
о ТБ эндемичен для всех стран мира; в Юго-Восточной и Западной Азии (Океании) и Африке: 58% и 28% новых случаев соответственно о 2014 год:
- 9,6 млн. новых случаев:
1,2 млн. (12%) пациентов с ТБ страдают СПИД
- 1,5 млн. летальных исходов
- 3,3% новых случаев ТБ обусловлены мультирезистентны-ми формами
3. Течение и прогноз:
• Смертность без лечения при ТБ, мазок(+): 70%
• Смертность без лечения при ТБ мазок(-), посев(+): 20%
• ТБ у ВИЧ-инфицированных быстро приводит к гибели, средняя выживаемость
4. Лечение:
• Принципы терапии:
о Множественные препараты (в зависимости от чувствительности); предпочтительные препараты: изониазид, рифампин, этамбутол, пиразинамид
5. Прогноз:
• Уровень успешности терапии-80%
• Предикторы летальности:
о ВИЧ-инфекция
о ТБ, мазок мокроты (+)
о Мультирезистентный ТБ
о ТБ в анамнезе
е) Диагностическая памятка. Следует учесть:
• Активный туберкулез при верхнедолевой пневмонии с кавитацией:
о При подозрении на кавитацию в верхней доле КТ помогает подтвердить патологические изменения
о Пациенты с кавитацией в верхних долях должны изолироваться, пока не исключен ТБ
ж) Список использованной литературы:
1. Rozenshtein A et al: Radiographic appearance of pulmonary tuberculosis: dogma disproved. AJR Am J Roentgenol. 204(5):974-8, 2015
2. Ко JM et al: Pulmonary changes of pleural ТВ: up-to-date CT imaging. Chest. 146(6):1604-11, 2014
3. LeeJY et al: Pulmonary tuberculosis: CT and pathologic correlation. J Comput Assist Tomogr. 24(5):691-8, 2000
Гистология активности туберкулеза. Классификация туберкулом
Предлагаемое деление на основании морфологических признаков имеет целью классифицировать туберкуломы по степени их активности и тяжести прогноза.
Действительно, к I группе отнесены случаи, где гистологические проявления активности туберкулеза несомненны. Оказалось, что чаще всего (в 44 случаях из 63) имеется то или иное их сочетание в капсуле, казеозных массах и окружающей ткани.
Значит, прогрессирование таких туберкулом возможно всеми путями: лимфогенным, бронхогенным (при прорыве расплавленных мате в бронх, и путем перехода воспаления с капсулы на прилегающую легочную ткань. В 78% случаев уже обычная бактериоскопия казеозных масс обнаружила здесь микобактерии туберкулеза и, как правило, в большом количестве.
Наоборот, отложения извести удалось выявить лишь в 4 случаях из 63. Высокая активность этих туберкулом подтверждается, наконец, и тем, что они сравнительно часто вызывали характерные клинические симптомы. Все это позволяет считать их прогноз плохим, а оперативное удаление — абсолютно показанным.
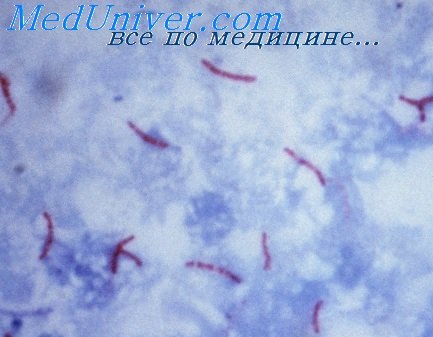
Отличительная особенность туберкулом II группы — сочетание старого расплавления творожистых масс с незначительными специфическими изменениями в капсуле. Расплавление, пусть и старое, повышает опасность кавернизации туберкуломы, тем более, что в подавляющем большинстве случаев (в 16 из 18 на нашем материале) оно захватывает либо всю туберкулому, либо ее краевые отделы.
Бактериоскопия казеозных масс выявила микобактерии туберкулеза в 61% наблюдений. Клинические проявления в виде бациллярности мокроты и рентгенологических симптомов распада, инфильтрации и свежих очагов вокруг были у каждого шестого больного. Все это дает основания для неблагоприятного прогноза: аппозиционный рост или лимфогенное распространение здесь маловероятны ввиду выраженности фиброзной капсулы, но бронхогенный путь вполне реален, а потому показания к хирургическому лечению вряд ли можно оспаривать.
В туберкуломах группы 3 морфологическая картина указывает на процессы заживления. В 8 туберкуломах из 22 найдены отложения извести. Рентгенологически определяемый распад был только у 1 больного, интоксикация тоже у одного. Наряду с этим, микобактерии туберкулеза в казеозных массах выявлены в 77% случаев, бациллярность мокроты отмечена у каждого четвертого больного, изменения рентгеновской тени в пределах последних 6 месяцев — у каждого третьего.
Ясно, что здесь еще необходимо лечение. Но не исключено, что к окончательной потере активности туберкулезного процесса могут привести консервативные меры, а, значит, показания к оперативному удалению становятся сомнительными.
В туберкуломах 4-й группы морфологических признаков активного специфического воспаления нет. В 11 из 12 таких туберкулом найдены отложения солей кальция. Микобактерии туберкулеза обнаружены лишь в каждой четвертой туберкуломе. Однократное бацилловыделение в дооперационном периоде было лишь у одного больного. По-видимому, такие туберкуломы, если они не сопровождаются клиническими проявлениями, не должны быть поводом ни для оперативного, ни для консервативного лечения.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Диагностика туберкулеза включает несколько последовательных этапов. При этом все методы исследований делят на 3 группы: обязательный диагностический минимум (ОДМ), дополнительные методы исследования неинвазивного (ДМИ-1) иинвазивного (ДМИ-2) характера и, наконец, и факультативные методы (ФМИ).
ОДМ включает изучение жалоб, анамнеза болезни и жизни, клинические анализы крови и мочи, микроскопию мокроты по Цилю-Нельсену не менее трех проб с количественной оценкой массивности бактериовыделения, рентгенографию органов грудной клетки в прямой и боковой проекциях и постановку пробы Манту с 2 ТЕ ППД-Л.
К ДМИ-1 относятся расширенная микробиологическая диагностика с исследованием мокроты методом ПЦР и посевом мокроты на питательные среды с определением лекарственной устойчивости МБТ к противотуберкулезным препаратам, а также посев мокроты на неспецифическую микрофлору и грибы; углубленная лучевая диагностика с использованием КТ легких и средостения, УЗИ при плеврите и субплеврально расположенных округлых образованиях; углубленная иммунодиагностика с применением иммуноферментнго анализа (ИФА) для выявления в крови противотуберкулезных антител (AT) и антигнов (АГ).
Кроме микроскопии мокроты и другого патологического материала как обязательного диагностического минимума, возможно исследование методом люминесцентной микроскопии, ПЦР и бактериологическим (культуральным) методом посева на питательные среды, которые осуществляются в специализированных лабораториях противотуберкулезных учреждений.
Эти методы дополняют результаты клинического обследования больных, при этом сочетанный анализ их дает возможность повысить чувствительность и специфичность, а при отрицательных данных микробиологического и морфологического исследования имеют решающее значение. Рентгеновская КТ легких при этом является ведущим диагностическим методом.
Рентгено-томографическая картина туберкулеза легких отличается полиморфизмом как по характеру инфильтративных изменений, так и по локализации специфических изменений, и требует целенаправленной дифференциальной диагностики.
Применяемые в настоящее время лабораторные и иммунологические методы диагностики туберкулеза легких носят в основном косвенный характер и применяются комплексно для повышения значимости верификации диагноза.
При заболевании туберкулезной этиологии отмечается частичное или полное рассасывание воспалительных изменений — это так называемый отсроченный диагноз. К этому времени удается получить результаты посева мокроты на питательные среды, сделанного перед началом химиотерапии. Рост культуры при наличии в материале МБТ обычно отмечается через 4—8 нед, что служит подтверждением диагноза.
ДМИ-2 включают бронхоскопию с различными видами биопсий (аспирационная, щеточная и др.) и БАЛ; пункцию плевральной полости и плевробиопсию; трансторакальную биопсию легкого; торакоскопию, медиастиноскопию и, наконец, открытую биопсию легкого с последующими цитологическими, гистологическими и микробиологическими исследованиями полученного материала.
Обнаружение в биоптате специфических элементов туберкулезной гранулемы (казеоз, эпителиоидные и многоядерные клетки) позволяет морфологически верифицировать туберкулез легких и своевременно начать противотуберкулезное лечение.
ФМИ весьма многочисленны и направлены не столько на диагностику туберкулеза, сколько на определение функционального состояния различных внутренних органов и обменных процессов. Исследуют уровень глюкозы в крови, функции печени, сердечно-сосудистой системы, функции внешнего дыхания, газовый состав крови, легочный кровоток и др.
Читайте также:

