Может ли дисбактериоз вызвать геморрой
Обновлено: 24.04.2024
Заболевания толстого кишечника не всегда проявляют себя однозначно и ярко. Чаще начальная фаза сопровождается смазанными симптомами, которым люди не придают значения. Это может быть ощущение жжения, дискомфорта в кишечнике, периодичное выделение слизи. Специфичность кишечника в том, что он может долго не давать таких признаков, которые укажут на необходимость посещения проктолога.
Даже когда человека начинает беспокоить боль, вздутие, выделения из заднего прохода и другие симптомы, он не спешит к врачу. Первое время пациент упорно пробует самолечение и те средства, которые навязчиво предлагает современная реклама. Между тем симптомы меняются, становятся более заметными, появляются боли и часто агрессивные.
Иногда симптоматика может косвенно не указывать на заболевания кишечника, симптомы могут быть специфичными:
- резкое похудение;
- слабость в теле;
- нарушения в обменных и гормональных процессах;
- выпадение волос.
Такими признаками сопровождаются наиболее тяжелые поражения кишечника: рак, злокачественные опухоли, полипоз. Кишечник - единственный орган, которые одновременно относится к двум важным системам организма: иммунной и ЖКТ. Для полноценной жизни и здоровья важно уметь узнавать те симптомы и признаки, которые подсказывают о патологическом процессе в толстом кишечнике:
- запоры;
- боли разной интенсивности в животе;
- кровянистые выделения при опорожнении кишечника;
- выделение прозрачной или гнойной слизи;
- анемия;
- метеоризм;
- непроходимость кишечника;
- расстройство стула;
- тенезмы;
- недержание.
Запор кишечника
При запорах наблюдаются сложности с дефекализацией, вплоть до полного исключения стула в течение нескольких дней. Запоры могут носить постоянный и упорный характер, не поддаваться действию слабительных препаратов. Расстройство стула может сменять запоры - это частая картина при синдроме раздраженного кишечника, дисбактериозе, функциональных нарушениях.
Интенсивность боли зависит от типа запора: атонический и спастический. В первом случае боль ноющая, чаще не агрессивная. При спастических запорах могут быть рези в паховой области непроходящего характера. Наличие частых запоров говорит о возможности образования каловых завалов или кишечной непроходимости. Состояния крайне опасные по характеру, способные угрожать жизни.
Боли в животе
Боли в животе и в паху часто сопровождают органические и функциональные нарушения в толстом кишечнике. Так, при болезни Крона и неспецифическом язвенном колите боль носит характер спастических схваток. Такие боли часто отдают в область поясницы, иррадиируют по внешней стороне ног. Определить локальность затруднительно, поскольку боль "растекается" по низу живота, часто вовлекая в процесс промежность.
Постоянные боли - признак прогрессирующего воспалительного процесса. Такие боли ноющие, тянущие, устойчивые. Проявляются при СРК, различных колитах, дивертикулезе. Характер болей говорит о вероятности развития перитонита или о гнойном очаге поражения.
Кровянистые выделение и кровотечения
Кровотечения встречаются при заболеваниях прямой и ободочной кишки. Обычно по цвету крови визуально определяется место поражения: чем ярче кровь, тем ближе к выходу очаг поражения. Так, появление чистой и ярко алой крови указывает на внутренний или внешний геморрой. Иногда кровопотеря может быть значительной и вызывать слабость, головокружения.
Если каловые массы однородные и в их составе равномерные кровянистые примеси, то это симптом образования опухоли в верхних отделах кишечника. Иногда такие массы бывают при неспецифическом колите и дивертикулезе. Чем выше отдел поражения, тем однороднее будут выглядеть кровяные сгустки в каловых массах и тем темнее их цвет.
При болезни Крона кровь может выделяться в чистом виде или обильными сгустками. В некоторых случаях алая кровь может быть признаком распадающейся опухоли в кишечнике.
Выделения слизи или гноя
Такие выделения бывают либо постоянными, либо появляются при опорожнении кишечника. Чаще всего это становится признаком образования свища в заднем проходе. При постоянном выделении слизи и болях можно предположить недостаточность сфинктера. В этом случае образуются многочисленные эрозии и трещины, что приносит зуд и боли.
Такие выделения характерны для синдрома раздраженного кишечника, проктита, при образовании опухолей в сигмовидной кишке. Часто выделения сочетаются с кровью, появлением сгустков.
Боли в заднем проходе
Боли могут быть ноющими и периодическими, распирающими область прохода. Так бывает при глубоких трещинах, заживают они трудно, особенно при наличии запоров. Дергающие и нестерпимые боли появляются при разрыве геморроя или наличии множественных узлов в кишечнике. Обычный геморрой без осложнений не вызывает таких болей, он ощущается только распиранием и набуханием в области ануса.
Анемия
Анемия развивается в том случае, когда человек потерял много крови. Это происходит при тяжелых поражениях кишечника, раковых образованиях, быстром прогрессировании опухоли.
Вздутие живота и метеоризм
Вздутие живота - частый признак для практически любой патологии в ЖКТ. Чувство вздутия и обильных газов характерно при запорах, непроходимости кишечника, каловых завалах. Часто метеоризм становится итогом ферментной недостаточности и может говорить о нарушениях в работе других внутренних органов.
Часто вздутие и метеоризм сопровождают тех, кто страдает дисбактериозом и неправильно питается. В некоторых случаях вздутие протекает с чувством дискомфорта и тяжести в желудке, но при избытке газов может появиться сильная боль в животе.
Непроходимость кишечника
Непроходимость кишечника может быть полной и частичной. Чаще приходится иметь дело с частичной, для которой характерны:
- вздутия;
- боли;
- метеоризм;
- длительные запоры;
- появление примесей и крови;
- рвота;
- потеря аппетита.
Чаще это говорит о тяжелом поражении толстого кишечника органического происхождения. Состояние крайне болезненное и опасное для здоровья человека. При прогрессировании появляются признаки отравления организма, воспаления брюшина. При частичной обструкции кишечника стул редкий, скудный, часто сменяется обильным расстройством. Временное улучшение наступает под воздействием приема слабительных препаратов или очистительных клизм.
Расстройство стула
Понос сопровождает более легкие заболевания кишечника, частый признак дисбактериоза. Также расстройство стула может сочетаться с другими симптомами, например запорами или различными выделениями. Так происходит при обострении колитов, СРК.
Тенезмы
Тенезмы - ложные позывы к опорожнению кишки. При таких позывах отделяется небольшое количество слизи, иногда вместе с поносом. Тенезмы обычно частые, настойчивые, утомляющие человека своей частотой. Характерны для возбужденной моторики прямой кишки, становятся следствием воспаления слизистой оболочки анального отдела.
Недержание
Недержание каловых масс отделяемых газов проявляется при врожденных или приобретенных изменениях в сфинктере. Другой причиной может быть нарушения регуляции из-за психологических факторов.
Что понимают под дисбактериозом? Какие методы диагностики являются современными и достоверными? Какие лекарственные препараты применяются при дисбактериозе? Вкишечнике человека находится свыше 500 различных видов микробов, общее количество которых
Что понимают под дисбактериозом?
Какие методы диагностики являются современными и достоверными?
Какие лекарственные препараты применяются при дисбактериозе?
Вкишечнике человека находится свыше 500 различных видов микробов, общее количество которых достигает 10 14 , что на порядок выше общей численности клеточного состава человеческого организма. Количество микроорганизмов увеличивается в дистальном направлении, и в толстой кишке в 1 г кала содержится 10 11 бактерий, что составляет 30% сухого остатка кишечного содержимого.
Нормальная микробная флора кишечника
В тощей кишке здоровых людей находится до 10 5 бактерий в 1 мл кишечного содержимого. Основную массу этих бактерий составляют стрептококки, стафилококки, молочнокислые палочки, другие грамположительные аэробные бактерии и грибы. В дистальном отделе подвздошной кишки количество микробов увеличивается до 10 7 –10 8 , в первую очередь за счет энтерококков, кишечной палочки, бактероидов и анаэробных бактерий. Недавно нами было установлено, что концентрация пристеночной микрофлоры тощей кишки на 6 порядков выше, чем в ее полости, и составляет 10 11 кл/мл. Около 50% биомассы пристеночной микрофлоры составляют актиномицеты, примерно 25% — аэробные кокки (стафилококки, стрептококки, энтерококки и коринеформные бактерии), от 20 до 30% приходится на бифидобактерии и лактобациллы.
Количество анаэробов (пептострептококки, бактероиды, клостридии, пропионобактерии) составляет около 10% в тонкой и до 20% в толстой кишке. На долю энтеробактерий приходится 1% от суммарной микрофлоры слизистой оболочки.
До 90-95% микробов в толстой кишке составляют анаэробы (бифидобактерии и бактероиды), и только 5-10% всех бактерий приходится на строгую аэробную и факультативную флору (молочнокислые и кишечные палочки, энтерококки, стафилококки, грибы, протей).
Кишечные палочки, энтерококки, бифидобактерии и ацидофильные палочки обладают выраженными антагонистическими свойствами. В условиях нормально функционирующего кишечника они способны подавлять рост несвойственных нормальной микрофлоре микроорганизмов.
Площадь внутренней поверхности кишечника составляет около 200 м 2 . Она надежно защищена от проникновения пищевых антигенов, микробов и вирусов. Важную роль в организации этой защиты играет иммунная система организма. Около 85% лимфатической ткани человека сосредоточено в стенке кишечника, где продуцируется секреторный IgA. Кишечная микрофлора стимулирует иммунную защиту. Кишечные антигены и токсины кишечных микробов значительно увеличивают секрецию IgA в просвет кишки.
Расщепление непереваренных пищевых веществ в толстой кишке осуществляется ферментами бактерий, при этом образуются разнообразные амины, фенолы, органические кислоты и другие соединения. Токсические продукты микробного метаболизма (кадаверин, гистамин и другие амины) выводятся с мочой и в норме не оказывают влияния на организм. При утилизации микробами неперевариваемых углеводов (клетчатки) образуются короткоцепочечные жирные кислоты. Они обеспечивают клетки кишки энергоносителями и, следовательно, улучшают трофику слизистой оболочки. При дефиците клетчатки может нарушаться проницаемость кишечного барьера вследствие дефицита короткоцепочечных жирных кислот. В результате кишечные микробы могут проникать в кровь.
Под влиянием микробных ферментов в дистальных отделах подвздошной кишки происходит деконъюгация желчных кислот и преобразование первичных желчных кислот во вторичные. В физиологических условиях от 80 до 95% желчных кислот реабсорбируется, остальные выделяются с фекалиями в виде бактериальных метаболитов. Последние способствуют нормальному формированию каловых масс: тормозят всасывание воды и тем самым препятствуют излишней дегидратации кала.
Дисбактериоз
В понятие дисбактериоза кишечника входит избыточное микробное обсеменение тонкой кишки и изменение микробного состава толстой кишки. Нарушение микробиоценоза происходит в той или иной степени у большинства больных с патологией кишечника и других органов пищеварения. Следовательно, дисбактериоз является бактериологическим понятием. Он может рассматриваться как одно из проявлений или осложнение заболевания, но не самостоятельная нозологическая форма.
Крайней степенью дисбактериоза кишечника является появление бактерий желудочно-кишечного тракта в крови (бактериемия) или даже развитие сепсиса.
Состав микрофлоры кишечника нарушается при болезнях кишечника и других органов пищеварения, лечении антибиотиками и иммунодепрессантами, воздействиях вредных факторов внешней среды.
Клинические проявления дисбактериоза зависят от локализации дисбиотических изменений.
Дисбактериоз тонкой кишки
При дисбактериозе тонкой кишки численность одних микробов в слизистой оболочке тонкой кишки увеличена, а других уменьшена. Отмечается увеличение Eubacterium (в 30 раз), α-стрептококков (в 25 раз), энтерококков (в 10 раз), кандид (в 15 раз), появление бактерий рода Acinetobacter и вирусов герпеса. Уменьшается от 2 до 30 раз количество большинства анаэробов, актиномицетов, клебсиелл и других микроорганизмов, являющихся естественными обитателями кишечника.
Причиной дисбактериоза могут быть: а) избыточное поступление микроорганизмов в тонкую кишку при ахилии и нарушении функции илеоцекального клапана; б) благоприятные условия для развития патологических микроорганизмов в случаях нарушения кишечного пищеварения и всасывания, развития иммунодефицита и нарушений проходимости кишечника.
Повышенная пролиферация микробов в тонкой кишке приводит к преждевременной деконъюгации желчных кислот и потере их с калом. Избыток желчных кислот усиливает моторику толстой кишки и вызывает диарею и стеаторею, а дефицит желчных кислот приводит к нарушению всасывания жирорастворимых витаминов и развитию желчнокаменной болезни.
Бактериальные токсины и метаболиты, например фенолы и биогенные амины, могут связывать витамин В12.
Некоторые микроорганизмы обладают цитотоксическим действием и повреждают эпителий тонкой кишки. Это ведет к уменьшению высоты ворсинок и углублению крипт. При электронной микроскопии выявляется дегенерация микроворсинок, митохондрий и эндоплазматической сети.
Дисбактериоз толстой кишки
Состав микрофлоры толстой кишки может меняться под влиянием различных факторов и неблагоприятных воздействий, ослабляющих защитные механизмы организма (экстремальные климатогеографические условия, загрязнение биосферы промышленными отходами и различными химическими веществами, инфекционные заболевания, болезни органов пищеварения, неполноценное питание, ионизирующая радиация).
В развитии дисбактериоза толстой кишки большую роль играют ятрогенные факторы: применение антибиотиков и сульфаниламидов, иммунодепрессантов, стероидных гормонов, рентгенотерапия, хирургические вмешательства. Антибактериальные препараты значительно подавляют не только патогенную микробную флору, но и рост нормальной микрофлоры в толстой кишке. В результате размножаются микробы, попавшие извне, или эндогенные виды, устойчивые к лекарственным препаратам (стафилококки, протей, дрожжевые грибы, энтерококки, синегнойная палочка).
Клинические особенности дисбактериоза
Клинические проявления чрезмерного роста микроорганизмов в тонкой кишке могут полностью отсутствовать, выступать в качестве одного из патогенетических факторов хронической рецидивирующей диареи, а при некоторых болезнях, например, дивертикулезе тонкой кишки, частичной кишечной непроходимости или после хирургических операций на желудке и кишечнике, приводить к тяжелой диарее, стеаторее и В 12 -дефицитной анемии.
Особенностей клинического течения заболевания у больных с различными вариантами дисбактериоза толстой кишки, по данным бактериологических анализов кала, в большинстве случаев установить не удается. Можно отметить, что больные хроническими заболеваниями кишечника чаще инфицируются острыми кишечными инфекциями по сравнению со здоровыми. Вероятно, это связано со снижением у них антагонистических свойств нормальной микрофлоры кишечника и, прежде всего, частым отсутствием бифидобактерий.
Особенно большую опасность представляет псевдомембранозный колит, развивающийся у некоторых больных, длительно лечившихся антибиотиками широкого спектра действия. Этот тяжелый вариант дисбактериоза вызывается токсинами, выделяемыми синегнойной палочкой Clostridium difficile, которая размножается в кишечнике при угнетении нормальной микробной флоры.
Очень редко наблюдается молниеносное течение псевдомембранозного колита, напоминающее холеру. Обезвоживание развивается в течение нескольких часов и заканчивается летальным исходом.
Таким образом, оценка клинической значимости дисбиотических изменений должна основываться прежде всего на клинических проявлениях, а не только на результатах исследования микрофлоры кала.
Методы диагностики
Диагностика дисбактериоза представляет собой сложную и трудоемкую задачу. Для диагностики дисбактериоза тонкой кишки применяют посев сока тонкой кишки, полученного с помощью стерильного зонда. Дисбактериоз толстой кишки выявляют с помощью бактериологических исследований кала.
Микробная флора образует большое количество газов, в том числе водорода. Это явление используют для диагностики дисбактериоза. Концентрация водорода в выдыхаемом воздухе натощак находится в прямой зависимости от выраженности бактериального обсеменения тонкой кишки. У больных с заболеваниями кишечника, протекающими с хронической рецидивирующей диареей и бактериальным обсеменением тонкой кишки, концентрация водорода в выдыхаемом воздухе значительно превышает 15 ppm.
Для диагностики дисбактериоза применяют также нагрузку лактулозой. В норме лактулоза не расщепляется в тонкой кишке и метаболизируется микробной флорой толстой кишки. В результате количество водорода в выдыхаемом воздухе повышается (рис. 1).
Наиболее частыми бактериологическими признаками дисбактериоза толстой кишки являются отсутствие основных бактериальных симбионтов — бифидобактерий и уменьшение количества молочнокислых палочек. Увеличивается количество кишечных палочек, энтерококков, клостридий, стафилококков, дрожжеподобных грибов и протея. У отдельных бактериальных симбионтов появляются патологические формы. К ним относятся гемолизирующая флора, кишечные палочки со слабо выраженными ферментативными свойствами, энтеропатогенные кишечные палочки и т. д.
Углубленное изучение микробиоценоза показало, что традиционные методы не позволяют получить истинную информацию о состоянии микрофлоры кишечника. Из 500 известных видов микробов в целях диагностики обычно изучаются лишь 10-20 микроорганизмов. Важно, в каком отделе — в тощей, подвздошной или толстой кишках — исследуется микробный состав. Поэтому перспективы разработки клинических проблем дисбактериоза в настоящее время связывают с применением химических методов дифференциации микроорганизмов, позволяющих получить универсальную информацию о состоянии микробиоценоза. Наиболее широко для этих целей используются газовая хроматография (ГХ) и газовая хроматография в сочетании с масс-спектрометрией (ГХ-МС). Этот метод позволяет получить уникальную информацию о составе мономерных химических компонентов микробной клетки и метаболитов. Маркеры такого рода могут быть определены и использованы для детектирования микроорганизмов. Главным преимуществом и принципиальным отличием этого метода от бактериологических является возможность количественного определения более 170 таксонов клинически значимых микроорганизмов в различных средах организма. При этом результаты исследования могут быть получены в течение нескольких часов.
Проведенные нами исследования микробиоценоза в крови и биоптатов слизистой оболочки тонкой и толстой кишок у больных с синдромом раздраженного кишечника позволили обнаружить отклонения от нормы до 30-кратного увеличения или уменьшения многих компонентов. Существует возможность оценки изменений микрофлоры кишечника на основании данных анализа крови методом ГХ-МС-микробных маркеров.
Лечение
Лечение дисбактериоза должно быть комплексным (схема) и включать в себя следующие мероприятия:
- устранение избыточного бактериального обсеменения тонкой кишки;
- восстановление нормальной микробной флоры толстой кишки;
- улучшение кишечного пищеварения и всасывания;
- восстановление нарушенной моторики кишечника;
- стимулирование реактивности организма.
Антибактериальные препараты
Антибактериальные препараты необходимы в первую очередь для подавления избыточного роста микробной флоры в тонкой кишке. Наиболее широко применяются антибиотики из группы тетрациклинов, пенициллинов, цефалоспорины, хинолоны (таривид, нитроксолин) и метронидазол.
Однако антибиотики широкого спектра действия в значительной степени нарушают эубиоз в толстой кишке. Поэтому они должны применяться только при заболеваниях, сопровождающихся нарушениями всасывания и моторики кишечника, при которых, как правило, отмечается выраженный рост микробной флоры в просвете тонкой кишки.
Антибиотики назначают внутрь в обычных дозах в течение 7–10 дней.
При заболеваниях, сопровождающихся дисбактериозом толстой кишки, лечение лучше проводить препаратами, которые оказывают минимальное влияние на симбионтную микробную флору и подавляют рост протея, стафилококков, дрожжевых грибов и других агрессивных штаммов микробов. К ним относятся антисептики: интетрикс, эрсефурил, нитроксолин, фуразолидон и др.
При тяжелых формах стафилококкового дисбактериоза применяют антибиотики: таривид, палин, метронидазол (трихопол), а также бисептол-480, невиграмон.
Антибактериальные препараты назначают в течение 10–14 дней. В случае появления в кале или кишечном соке грибов показано применение нистатина или леворина.
У всех больных с диареей, ассоциированной с антибиотиками, протекающей с интоксикацией и лейкоцитозом, возникновение острой диареи следует связывать с Cl. difficile.
В этом случае срочно делают посев кала на Cl. difficile и назначают ванкомицин по 125 мг внутрь 4 раза в сутки; при необходимости доза может быть увеличена до 500 мг 4 раза в день. Лечение продолжают в течение 7-10 суток. Эффективен также метронидазол в дозе 500 мг внутрь 2 раза в сутки, бацитрацин по 25 000 МЕ внутрь 4 раза в сутки. Бацитрацин почти не всасывается, в связи с чем в толстой кишке можно создать более высокую концентрацию препарата. При обезвоживании применяют адекватную инфузионную терапию для коррекции водно-электролитного баланса. Для связывания токсина Cl. difficile используют холестирамин (квестран).
Бактериальные препараты
Живые культуры нормальной микробной флоры выживают в кишечнике человека от 1 до 10% от общей дозы и способны в какой-то мере выполнять физиологическую функцию нормальной микробной флоры. Бактериальные препараты можно назначать без предварительной антибактериальной терапии или после нее. Применяют бифидумбактерин, бификол, лактобактерин, бактисубтил, линекс, энтерол и др. Курс лечения длится 1-2 месяца.
Возможен еще один способ устранения дисбактериоза — воздействие на патогенную микробную флору продуктами метаболизма нормальных микроорганизмов. К таким препаратам относится хилак форте. Он создан 50 лет назад и до настоящего времени применяется для лечения больных с патологией кишечника. Хилак форте представляет собой стерильный концентрат продуктов обмена веществ нормальной микрофлоры кишечника: молочной кислоты, лактозы, аминокислот и жирных кислот. Эти вещества способствуют восстановлению в кишечнике биологической среды, необходимой для существования нормальной микрофлоры, и подавляют рост патогенных бактерий. Возможно, продукты метаболизма улучшают трофику и функцию эпителиоцитов и колоноцитов. 1 мл препарата соответствует биосинтетическим активным веществам 100 млрд. нормальных микроорганизмов. Хилак форте назначают по 40–60 капель 3 раза в день на срок до 4 недель в сочетании с препаратами антибактериального действия или после их применения.
Регуляторы пищеварения и моторики кишечника
У больных с нарушением полостного пищеварения применяют креон, панцитрат и другие панкреатические ферменты. С целью улучшения функции всасывания назначают эссенциале, легалон или карсил, т. к. они стабилизируют мембраны кишечного эпителия. Пропульсивную функцию кишечника улучшают имодиум (лоперамид) и тримебутин (дебридат).
Стимуляторы реактивности организма
Для повышения реактивности организма ослабленным больным целесообразно применять тактивин, тималин, тимоген, иммунал, иммунофан и другие иммуностимулирующие средства. Курс лечения должен составлять в среднем 4 недели. Одновременно назначаются витамины.
Профилактика дисбактериоза
Первичная профилактика дисбактериоза представляет очень сложную задачу. Ее решение связано с общими профилактическими проблемами: улучшением экологии, рациональным питанием, улучшением благосостояния и прочими многочисленными факторами внешней и внутренней среды.
Вторичная профилактика предполагает рациональное применение антибиотиков и других медикаментов, нарушающих эубиоз, своевременное и оптимальное лечение болезней органов пищеварения, сопровождающихся нарушением микробиоценоза.
Изучено влияние пребиотического комплекса на результаты эрадикационной антихеликобактерной терапии и показана его эффективность по предупреждению развития антибиотикоассоциированной диареи у пациентов, имеющих прогностические факторы неблагоприятного тече
Meaning of dysbiotic disorders of large intestine in pathogenesis of gastroduodenal zone diseases associated with Helicobacter pylori. Meaning of prebiotics in increase of anti-helicobacter therapy efficiency
Influence of prebiotic complex on the results of eradication anti-helicobacter therapy was studied, and its efficiency in prevention of antibiotic-associated diarrhea in patients having forecasting factors of adverse clinical course of early post-eradication period was shown.
Инфекция Helicobacter pylori (Н. pylori) является ведущей причиной хронических заболеваний желудка и двенадцатиперстной кишки. Эрадикация Н. pylori является основным стандартом лечения хеликобактер-ассоциированных заболеваний гастродуоденальной зоны, что отражено в международных соглашениях (Маастрихтские соглашения 1–3, соответственно 1996, 2000 и 2005 гг.) [1].
Следует иметь в виду, что хеликобактериоз проявляется не только местными эрозивно-язвенными поражениями гастродуоденальной зоны, но и оказывает системное влияние на организм человека. Инфицирование макроорганизма и длительное персистирование H. pylori нарушает микроэкологию пищеварительного тракта и может рассматриваться в качестве фактора, инициирующего и усугубляющего нарушения микробиоценоза толстой кишки [2, 3]. При H. pylori-позитивной язвенной болезни дисбиоз кишечника выявляется у 92% пациентов (НИИ питания РАМН), выраженность дисбиотических изменений достоверно связана со степенью обсемененности H. pylori [4]. Антихеликобактерная терапия, включающая применение антибиотиков, также приводит к угнетению облигатной микрофлоры и последующей колонизации слизистой оболочки желудочно-кишечного тракта патогенной и условно-патогенной микрофлорой [5].
Дисбиоз толстой кишки может стать причиной развития вторичного иммунодефицита (местного и общего), что в свою очередь вызывает снижение защитных сил организма и является важным фактором в патогенезе H. pylori-ассоциированной патологии. При этом важно, что сопутствующие дисбиотические изменения кишечника могут достигать определенного критического уровня и превращаться в самостоятельный фактор агрессии. В этих условиях прогредиентно нарастает выраженность клинических симптомов воспалительных заболеваний гастродуоденальной области, удлиняются сроки их существования, утяжеляется общее состояние, ухудшаются показатели результатов лечения и качество жизни пациентов, клиническое течение приобретает часто рецидивирующий характер [6, 7].
Иммуногенная функция нормофлоры заключается в стимуляции синтеза иммуноглобулинов, интерферона, цитокинов; в активировании созревания системы фагоцитирующих мононуклеаров; в повышении содержания комплемента и пропердина, активности лизоцима; выработке бактериальных модулинов. В качестве медиаторов действия бактериальных метаболитов выступают гистамин, серотонин, простагландины, лейкотриены, короткоцепочные жирные кислоты. Воздействие микробных метаболитов и медиаторов их действия направлено на модуляцию пролиферации, дифференцировки, апоптоза и метаболических реакций эукариотических клеток. Нормофлора способна воздействовать на дифференцировку Т-хелперов и таким образом влиять на соотношение про- и противовоспалительных цитокинов. S. Roos, C. Johnson (2003 г.) показали, что некоторые штаммы лактобактерий обладают кислотоустойчивостью и антагонизмом к H. pylori in vivo и in vitro. Lactobacilli spp., как и Bifidobacterium spp., выделяют бактериоцины, способные ингибировать рост H. pylori и нарушать адгезию микроба к эпителиальным клеткам желудка [8–10].
Исследования последних лет показали, что препараты, улучшающие микробиоценоз кишечника, не только повышают эффективность эрадикационной терапии, но и предупреждают развитие и позволяют в значительной степени снизить побочные эффекты антибиотиков, входящих в стандартные схемы антихеликобактерной терапии, такие как антибиотикоассоциированная диарея, тошнота, неприятный привкус в ротовой полости и т. п. [10–14].
Независимо от индивидуальных различий в составе кишечной микрофлоры, кишечный микробиоценоз у каждого человека функционирует как единая экосистема и целостный метаболический орган, который обеспечивает необходимое количество и профиль конечных метаболитов, среди которых наиболее важную роль играют короткоцепочечные жирные кислоты (КЦЖК). КЦЖК — основной продукт микробной ферментации анаэробными бактериями углеводов, жиров и белков. К ним относятся уксусная (С2), пропионовая (С3), изомасляная, масляная (С4), изовалериановая, валериановая (С5), изокапроновая и капроновая (С6) кислоты [7, 15, 16].
Неразветвленные КЦЖК — уксусная, пропионовая и масляная — образуются при анаэробном брожении углеводов, тогда как метаболизм белков ведет к образованию разветвленных кислот — изомасляной (из валина) и изовалериановой (из лейцина). В течение суток синтезируется более 300 ммоль/л КЦЖК. Максимальная концентрация КЦЖК достигается в проксимальных отделах толстой кишки 70–140 ммоль/л — самом мощном биокорректорном участке желудочно-кишечного тракта. В дистальной части содержание КЦЖК снижается до 20–70 ммоль/л [16].
КЦЖК участвуют в регуляции большинства физиологических эффектов облигатной микрофлоры толстой кишки. Так, они являются основным источником питания для колоноцитов, обеспечивая их энергией (на 70%), стимулируют регенерацию эпителия, обладают антибактериальной активностью, обеспечивают баланс микробной экосистемы, препятствуя ее контаминации патогенной микрофлорой, поддерживают детоксицирующую функцию печени за счет участия в энтерогепатической циркуляции желчных кислот, обладают антиканцерогенным и антивирусным действием, оказывают влияние на экспрессию генов в колоноцитах, являются активным модулятором иммунной системы, регулируют моторную функцию кишечника (табл. 1) [16–18].
- Контроль структурной и функциональной целостности клеточного состава толстой кишки и всего организма.
- Модулирует распознавание и уничтожение собственных мутантных, в том числе и опухолевых клеток, а также вторгшихся микроорганизмов и образуемых ими токсических веществ, способных нарушить генетический гомеостаз.
- Продукция медиаторов межклеточного взаимодействия:
- снижение секреции провоспалительных цитокинов, таких как фактор некроза опухоли альфа, оксид азота, гамма-интерферон, интерлейкины ИЛ-2, ИЛ-1;
- стимулирование высвобождения противовоспалительного цитокина ИЛ-10 из моноцитов.
- Ингибирование адгезии эндотелиальных лейкоцитов посредством модуляции экспрессии ФМА-1 и МАСЭ-1 и активации макрофагального ядерного фактора NF-каппа-би.
- Уменьшает гамма-интерферон-индуцируемое высвобождение белка-10 в субэпителиальных миофибробластах кишечника человека.
- Снижает кишечную продукцию СЛК-зависимого ИЛ-8 и кишечную экспрессию Toll-подобного рецептора 4, который считается важным компонентом врожденного иммунитета и который, при избыточной продукции, приводит к проявлению воспалительных заболеваний кишечника.
Основными продуцентами бутирата являются не бифидо- и лактобактерии, а эубактерии, пептококки, фузобактерии и клостридии (поэтому большинство пробиотиков не влияют на синтез масляной кислоты). Эта КЦЖК активно абсорбируется в цитоплазму колоноцита, где в митохондриях из нее образуется АТФ. 70% энергии идет на обеспечение локальных процессов в толстой кишке, а оставшиеся 30% этой энергии расходуются на нужды целого организма. Рецептор-опосредованным путем масляная кислота инициирует активацию и/или ингибирование локальных и системных иммунных реакций [16].
В России с 2011 г. для лечения различных заболеваний ЖКТ применяется препарат Закофальк®. В состав препарата входит масляная кислота и инулин в дозе 250 мг, которые помещены в полимерную мультиматриксную капсулу NMX. В отличие от ранее известных про- и пребиотиков, которые стимулируют рост нормофлоры толстой кишки, что опосредованно приводит к образованию КЦЖК, в первую очередь ацетата и пропионата, Закофальк® напрямую доставляет масляную кислоту и инулин в толстую кишку в заданном количестве. Пребиотический комплекс Закофальк® обеспечивает возможность реализации сложного каскада иммунобиологических, метаболических и других свойств, присущих нормально функционирующему микробно-тканевому комплексу кишечника.
Инулин, (C6H10O5)n, органическое вещество из группы полисахаридов (фруктанов), полимер D-фруктозы, построенный из остатков D-фруктофуранозы, связанных 2,1-бета связями.
Что касается медицинской классификации инулина, в большинстве публикаций его относят к группе растворимых пищевых волокон (не целлюлозный полисахарид). Кроме того, способность инулина избирательно стимулировать бифидо- и лактобактерии, являющиеся представителями нормальной микрофлоры кишечника, позволяет назвать данное вещество истинным пребиотиком.
При попадании в пищеварительный тракт инулин проходит в неизмененном виде в желудок и тонкую кишку. В толстой кишке фруктоолигосахариды являются питательным субстратом исключительно для бифидобактерий и отдельных видов лактобацилл, которые обладают ферментной системой бета-фруктозидаз, позволяющей им расщеплять фруктоолигосахариды до масляной кислоты. Таким образом, инулин выступает не только как селективный пребиотический фактор для микрофлоры толстой кишки, но и как промоутер синтеза эндогенной масляной кислоты.
Растительные волокна инулина, будучи нерастворимыми в тонкой кишке, в толстой кишке создают дополнительные площади (помимо поверхности слизистой оболочки), к которым фиксируются сахаролитические бактерии. Благодаря этому в просвете толстой кишки во много раз возрастает число мест для адгезии и формирования микроколоний лакто- и бифидобактерий, что приводит к значительному увеличению количества присутствующих на единицу объема кишки микроорганизмов, и, как следствие этого, резко возрастает метаболическая активность кишечного содержимого с образованием различных важных для организма энергетических и пластических субстанций. Lactobacilli spp., как и Bifidobacterium spp., выделяют бактериоцины, способные ингибировать рост Н. pylori и нарушать адгезию микроба к эпителиальным клеткам желудка.
Масляная кислоты С3Н7СООН является органической кислотой, вырабатывающейся в просвете толстой кишки в процессе бактериальной ферментации неперевариваемых пищевых углеводородов. Бутират используется организмом в качестве энергетического субстрата для обеспечения процессов пролиферации и дифференцировки колоноцитов, для энергообеспечения ферментативных процессов индигенной флоры. Именно эта кислота контролирует механизмы, инициирующие апоптоз ненужных в функциональном отношении колоноцитов и раковых клеток, модулирует экспрессию генов, регулирующих клеточный цикл, нивелирует действие супероксидных радикалов. Масляная кислота играет основную роль в обеспечении локальных и системных иммунных механизмов: путем активации локальных макрофагов для увеличения презентации антигенов B-лимфоцитам и увеличения производства секреторного иммуноглобулина А местно и системно, модулирования цитокиновых профилей и активации синтеза интерферона. Масляная кислота, являясь универсальным сигнальным химическим носителем передачи информации в организме человека, регулирует адаптивные реакции не только на уровне микробиоценоза толстой кишки (предупреждает развитие кишечного дисбиоза), но и оказывает общее иммуномодулирующее действие.
Клинически манифестной формой кишечного дисбиоза при проведении эрадикационной терапии является антибиотикоассоциированная диарея. На базе городских поликлиник г. Москвы было проведено открытое сравнительное рандомизированное многоцентровое исследование по изучению влияния препарата Закофальк® на эффективность и переносимость эрадикационной терапии.
Целью настоящего исследования было изучение влияния пребиотического комплекса Закофальк® на результаты эрадикационной терапии и его эффективности по предупреждению развития антибиотикоассоциированной диареи при проведении антихеликобактерной терапии у пациентов, имеющих прогностические факторы неблагоприятного течения раннего постэрадикационного периода.
Материал и методы исследования
В рамках сравнительного открытого рандомизированного исследования было обследовано 115 человек (мужчин — 52, женщин — 63), средний возраст 42,5 лет (20–65 лет).
Критерии включения: больные язвенной болезнью, ассоциированной с Н. pylori, в стадии обострения с наличием язвенного дефекта в желудке или в двенадцатиперстной кишке; наличие не менее двух факторов риска развития антибиотикоассоциированной диареи (постинфекционный синдром раздраженного кишечника, сахарный диабет 2-го типа, указание в анамнезе на проведение антибактериальной терапии вне связи с основным заболеванием в течение ближайших 6 месяцев, хронические заболевания гепатобилиарной системы и поджелудочной железы, длительный прием гормональных или химиотерапевтических препаратов, синдром короткой тонкой кишки, дивертикулярная болезнь толстой кишки, онкологические заболевания толстой кишки в анамнезе).
Обследование включало: клиническое наблюдение в динамике, проведение эзофагогастродуоденоскопии с взятием гастробиоптатов слизистой оболочки края язвы с последующей их гистобактериоскопией и проведением уреазного теста (до и через 4 недели от окончания эрадикационной терапии). В ходе исследования анализировались результаты исследования состава кишечной микрофлоры. Исследование иммунного статуса включало определение в сыворотке крови IgG, IgM, IgA, IgE.
После включения в исследование больные были рандомизированы на две группы. Пациенты основной группы (60 человек) помимо препаратов эрадикационной терапии (Нексиум 20 мг 2 раза + кларитромицин 500 мг 2 раза + амоксициллин 1000 мг × 2 раза 14 дней) получали Закофальк® 3 таблетки в сутки, а больные группы сравнения (55 человек) — ту же терапию, но без применения препарата Закофальк®. До начала терапии нарушений кишечной моторики (поносов либо запоров) ни у кого не было.
Результаты и их обсуждение
Через 7 дней от включения в исследование при повторном опросе и осмотре синдром кишечной диспепсии, индуцированный проведением эрадикационной терапии, был отмечен у 34 (68%) пациентов группы сравнения: вздутие — 25, урчание — 28; жидкий стул до 3 раз в сутки — 25, жидкий стул более 3 раз в день — 9. Девять пациентов этой группы (18%) в течение первой недели лечения отказались от дальнейшего приема антибиотиков. При этом в основной группе, пациенты которой получали Закофальк®, не было зафиксировано возникновение диареи, а вздутие или урчание живота было отмечено лишь у 14 пациентов (23,3%). По завершении антибиотикотерапии на 14-й день лечения 41 (82%) пациент группы сравнения отмечал послабления стула от 3 до 5–7 раз в сутки. У 7 (11,7%) пациентов основной группы отмечалось учащение дефекаций до 5 раз в сутки. Таким образом, включение препарата Закофальк® в схему эрадикационной терапии улучшает переносимость лечения антибиотиками даже у пациентов с высоким риском антибиотикоассоциированной диареи (табл. 2).
Исходный уровень сывороточных иммуноглобулинов не имел значимых отличий в основной группе и группе сравнения, средние его значения были незначительно снижены. Уровень IgE был повышен только у больных язвенной болезнью двенадцатиперстной кишки с наличием участков лимфоидной гиперплазии в антральном отделе желудка, средний его уровень в основной группе составил 64,25 ± 11 кЕ/л и 55 ± 12 кЕ/л в группе сравнения. После проведения эрадикационной схемы лечения с включением препарата Закофальк® у пациентов основной группы наблюдалась небольшая тенденция к повышению уровня IgA до 3,0 ± 0,5 г/л (исходный 0,65 ± 0,2 г/л) и значительное снижение IgE до 43 ± 11 кЕ/л. У пациентов группы сравнения такой тенденции не наблюдалось. Повышение сывороточного IgA может отражать повышение секреторного IgA на слизистой оболочке желудка, что свидетельствует об усилении реакций местного иммунитета. Снижение уровня IgE, по-видимому, связано с усилением протективной и детоксицирующей функций эндосимбиотных бактерий. Повышение сывороточных IgA и снижение IgE после лечения препаратом Закофальк® сочеталось со стабильным исчезновением клинических признаков обострения и эндоскопически подтвержденным рубцеванием язв у всех пациентов основной группы (табл. 3).
При микробиологическом исследовании фекалий в исходном периоде достаточно выраженные изменения соотношения представителей кишечной микрофлоры выявлены у большинства обследованных больных в обеих группах, в первую очередь отмечалось снижение уровня бифидо- и лактобактерий. После курса эрадикационной терапии у пациентов, принимавших Закофальк®, выявлено достоверное увеличение количества бифидобактерий и лактобактерий, а также достоверное уменьшение количества патогенных и условно-патогенных бактерий. В группе сравнения обращает внимание угнетение микробного роста представителей нормальной кишечной микрофлоры и увеличение степени дисбиоза кишечника. Таким образом, полученные данные в очередной раз подтверждают отрицательное влияние стандартной эрадикационной терапии на микробный состав кишечника, что имеет особое значение для пациентов с сопутствующими заболеваниями ЖКТ, увеличивающими риск развития кишечного дисбиоза и его клиническое проявление — антибиотикоассоциированной диареи (табл. 4, 5).
Достижение эрадикации H. pylori было зафиксировано у 52 (86,7%) пациентов основной группы и у 17 (31%) из группы сравнения, что может зависеть от более четкого соблюдения комплаентности терапии, а также способности препарата Закофальк® потенцировать противовоспалительный эффект антибиотиков.
Проводилась морфологическая оценка из краев язвенных дефектов до начала антихеликобактерной терапии и по ее завершении. Полученные данные свидетельствуют, что включение в терапию препарата Закофальк® приводит к улучшению клеточного состава слизистой оболочки в краях язвы. Так, значительно уменьшается нейтрофильная и лимфоцитарная и плазмоцитарная инфильтрация, что свидетельствует об уменьшении воспалительного и иммуно-воспалительных процессов (табл. 6, 7).
Выводы
Результаты исследования показывают несомненное преимущество комплексного лечения язвенной болезни, ассоциированной с H. pylori, с включением пребиотика Закофальк® по сравнению со стандартной эрадикационной схемой.
На основании полученных данных можно сделать следующие выводы:
- Антихеликобактерная терапия сопровождается развитием антибиотико-ассоциированных нарушений кишечной микрофлоры у большинства пациентов.
- Назначение препарата Закофальк® снижает риск развития осложнений антихеликобактерной терапии; способствует улучшению показателей собственно эрадикации.
- Эффект препарата Закофальк® проявляется клиническим улучшением, нормализацией состава микрофлоры кишечника, а также восстановлением ее метаболической активности.
- Включение препарата Закофальк® позволяет существенно потенцировать противовоспалительный эффект эрадикационной терапии.
Литература
Л. И. Буторова*, кандидат медицинских наук
Т. А. Плавник**
Н. Г. Кадникова***
С. Р. Рекель****
* ГИУВ МО РФ; ГБУЗ ГП № 209 ДЗМ, Москва
** ГБУЗ ГП № 195 ДЗМ, Москва
*** ПК № 230 ДЗМ, Зеленоград
**** ФГБУ ПК № 2 УДП РФ, Москва
Что такое внутренний геморрой? Причины возникновения, диагностику и методы лечения разберем в статье доктора Овчинникова О. Л., проктолога со стажем в 16 лет.
Над статьей доктора Овчинникова О. Л. работали литературный редактор Елена Бережная , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Геморрой — это патология кавернозных сосудов подслизистого слоя нижней части прямой кишки, заложенных в процессе нормального эмбриогенеза. Варикозно-измененные узлы располагаются под слизистой оболочкой внутри просвета прямой кишки.
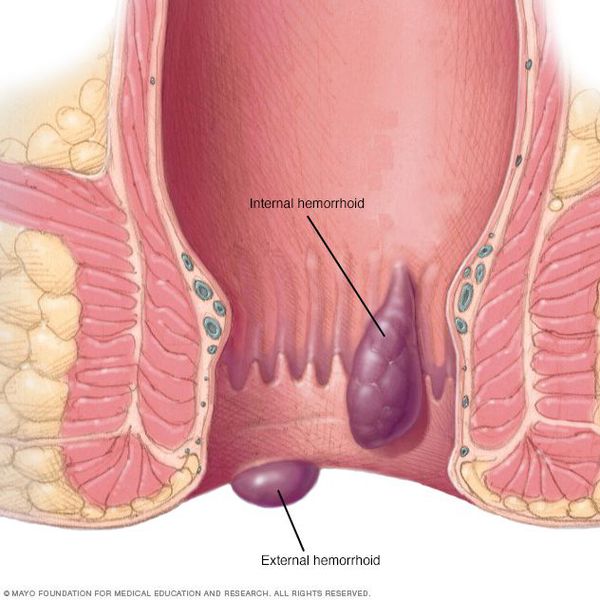
Причины:
- артериальная гипертензия;
- варикозное расширение вен нижних конечностей и малого таза;
- лишний вес;
- нарушение стула (как запор, так и понос);
- переедание, пристрастие к острой пище, алкоголь;
- наследственность;
- у мужчин часто приводят к геморрою физические перегрузки (в том числе и ненормированные занятия тяжелой атлетикой), любовь к чтению в туалете;
- у женщин основная причина — беременность и роды. Причем, чем больше число родов, тем выше риск развития геморроя.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы внутреннего геморроя
Симптомы заболевания можно разделить по стадиям, но все же есть у них и общая симптоматика. Рассмотрим, для начала, общие симптомы.
Патогенез внутреннего геморроя
При длительном воздействии неблагоприятных факторов происходит усиление притока артериальной крови в кавернозные вены прямой кишки по расширенным артериовенозным анастомозам (то есть приток повышен, а отток либо снижен, либо остался на прежнем уровне).
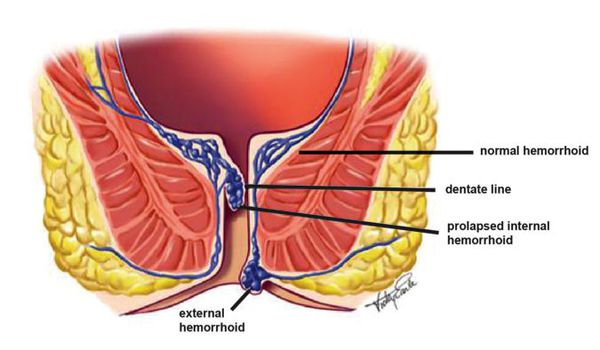
Это приводит к развитию гиперплазии кавернозных телец, которые увеличиваются в объеме, стенки их становятся более плотными. Из-за повреждения поверхностно расположенных кавернозных вен геморроидальных узлов во время дефекации возникает главный симптом геморроя — ректальные кровотечения. [4] [5]
Классификация и стадии развития внутреннего геморроя
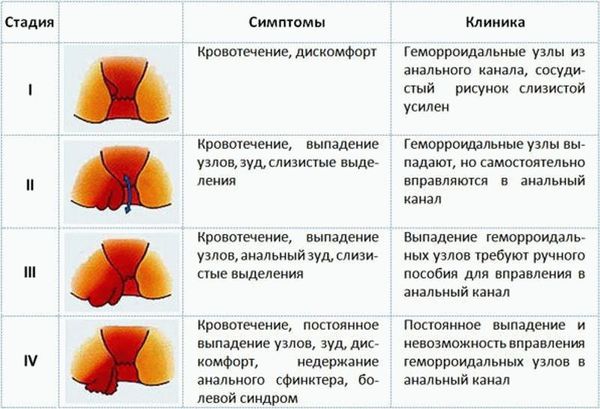
Осложнения внутреннего геморроя
Среди осложнений можно выделить:
Диагностика внутреннего геморроя
Эффективное лечение геморроя невозможно без диагностики, так как под маской внутреннего геморроя могут скрываться такие заболевания, как: анальная трещина, фиброзные полипы, свищи прямой кишки, доброкачественные и злокачественные опухоли. Поэтому, чтобы установить точный диагноз и назначить своевременное и более правильное лечение, необходима очная консультация колопроктолога.
Алгоритм диагностики заболевания выглядит примерно так:
- сбор индивидуального и семейного анамнеза;
- внешний осмотр перианальной области;
- пальпаторное исследование анального канала;
- аноскопия;
- ректоскопия;
- колоноскопия и ирригоскопия по показаниям
1. Сбор анамнеза очень важен, так как позволяет выявить факторы, которые непосредственно могли стать поводом для обращения пациента и причиной развития заболевания. Врач на приеме подробно расспрашивает пациента о жалобах, характере стула, длительности заболевания, обращался ли пациент для диагностики ранее, пробовал ли лечиться самостоятельно и чем. Также важны наличие сопутствующих патологий, аллергический анамнез, семейный анамнез по онкозаболеваемости.
При визуальном осмотре врач может выявить внешние повреждения кожи, мокнутие, какие-либо высыпания, покраснения и припухлости, асимметрию ягодиц и промежности, выделения гнойные, серозные или кровянистые.
3. Пальцевое исследование прямой кишки позволяет исследовать тонус анального сфинктера, болезненность стенок анального канала, выявление рубцов и дефекты слизистой, а также можно определить опухоли и полипы, расположенные на высоте пальца — до 10 см от ануса. У мужчин пальпируется простата, у женщин — передняя стенка прямой кишки, находящаяся по соседству с задней стенкой влагалища. Немаловажно осмотреть и копчик, так как очень часто с костными патологиями копчика и крестца пациенты в первую очередь приходят именно к проктологу. Здесь можно выявить боли при пальпации, вывих копчика и даже застарелые переломы, о чем может свидетельствовать деформация копчика.
4. Аноскопия: осмотр анальным зеркалом, до 10 см от ануса. При аноскопии врач может уже более внимательно рассмотреть геморроидальные узлы, их величину, расположение, состояние стенок узлов, наличие эрозий, язв, воспаление слизистой, внутренние тромбозы. Аноскопия очень важна и для дифференцировки диагноза, так как именно с помощью нее можно распознать трещины анального канала, фиброзные полипы и внутренний геморрой, а также опухоли. При необходимости аноскопия позволят провести и инцизионную биопсию.
5. Ректороманоскопия — осмотр прямой кишки ректосигмоидного отдела до 25 см. Ректоскоп представляет собой трубу с объективом и лампочкой на одном конце и окуляром и грушей — на другом.
Еще лет 5-10 назад ректоскопы были металлические, длина их составляла от 30 до 60 см, пациенты часто жаловались, что данный вид исследования приносил сильные боли и дискомфорт. В современном мире медицины ректоскопы тоже претерпели изменения — они стали уже, короче (25 см вместо 60-ти!) изготавливаются из пластика, и, естественно, это одноразовый инструмент, который после использования подлежит утилизации. [2]
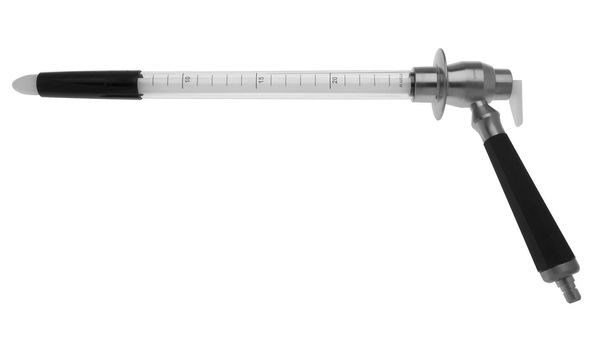
Таким образом, ректороманоскопия стала более щадящей для пациентов и при правильном ее проведении не приносит болевых ощущений. Дискомфорт возможен, но он не сравним с ощущениями от старых ректоскопов.
При ректороманоскопии можно выявить полипы, опухоли, наличие язв, эрозий, источник кровотечения. По необходимости ректороманоскопия позволяет провести и инцизионную биопсию.
6. Фиброколоноскопия (ФКС) — метод эндоскопического обследования слизистой толстого кишечника до купола слепой кишки.
К ФКС есть свои показания: выявленные на ректороманоскопии полипы, длительные запоры, болезнь Крона и язвенный колит, кровотечение из невыявленного источника, прицельная биопсия, удаление полипов и небольших доброкачественных опухолей, невозможность провести ирригоскопию, возраст после 40 лет.
Фиброколоноскопия в настоящее время проводится как под седацией, так и без.
Данная процедура имеет массу преимуществ: она проста в проведении, дает сравнительно точные результаты и редко сопряжена с дискомфортом или какими-то осложнениями.
Лечение внутреннего геморроя
Лечение в целом делится на оперативное и безоперативное.
Безоперативное лечение можно также разделить на консервативное и малоинвазивное.
1. Консервативная терапия: к ней относится симптоматическое лечение с помощью свечей, мазей, венотоников и, при необходимости, противовоспалительная терапия и применение обезболивающих препаратов. При выборе препаратов врачи основываются на жалобах пациента — в соответствии с ними могут быть назначены различные виды свечей, мазей или таблетированных препаратов — с обезболивающим эффектом, заживляющим или для остановки кровотечения.
Важно: самолечение может быть подобрано неверно, не иметь должного эффекта, а также ухудшить самочувствие пациента. Именно поэтому при любых симптомах геморроя необходимо показаться врачу!
2. Малоинвазивное лечение геморроя — широко используется во всем мире, успешно себя зарекомендовало. К малоинвазивным методикам относятся: лигирование узлов латексными кольцами, склерозирование геморроидальных узлов (в том числе с помощью ультразвуковой кавитации), их дезартеризация с помощью допплерографии, инфракрасная коагуляция, лазерная вапоризация.
- Склерозирование геморроидальных узлов
Данный метод применим на начальных стадиях геморроя, когда заболевание проявляется в основном кровянистыми выделениями из анального отверстия. Но методику иногда используют и на 2-й – 4-й стадии геморроя как дополнение к основному виду терапии.
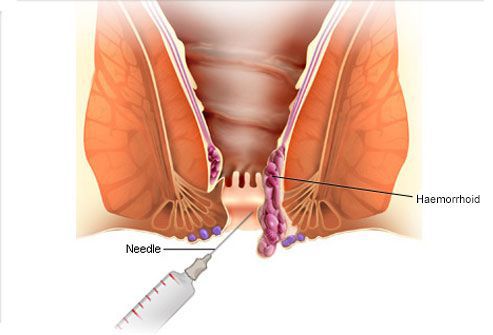
Суть процедуры: в геморроидальные узлы с помощью аноскопа и шприца вводят специальный склерозирующий препарат (Фибровейн или Этоксисклерол 3%), который воздействует на сосуды таким образом, что в них происходит асептическое воспаление, они склеиваются и впоследствии их замещает соединительная ткань. В результате сосуды полностью заживляются, кровотечение прекращается, происходит значительное уменьшение геморроидального узла в размерах. При необходимости процедуру можно назначить повторно.
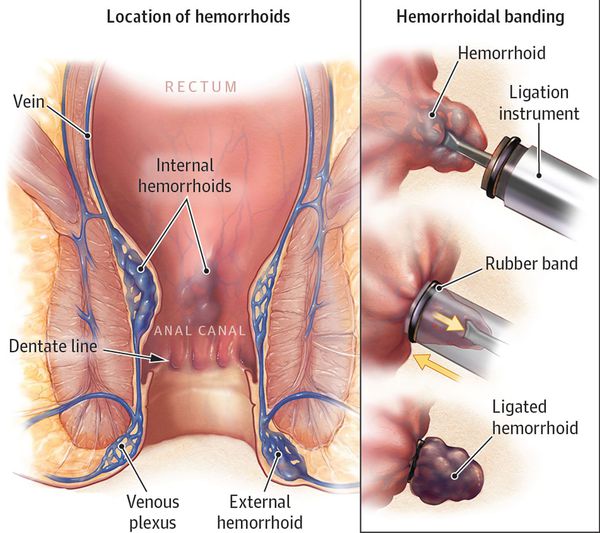
- Лигирование латексными кольцами (применяется с 1968 года)
Это наиболее популярная малоинвазивная методика лечения геморроя. Показана пациентам с выпадением геморроидальных узлов. Подходит больным с более поздней стадией заболевания, процедура эффективна и длительное восстановление не потребуется. Является методом выбора у тех, кому противопоказано оперативное вмешательство в связи с сопутствующей патологией. [8]
Суть метода: на ножку геморроидального узла надевается латексное кольцо, кровоток в узле прекращается. Узел отмирает и выходит вместе с кольцом при дефекации — происходит это на 2–3 день после манипуляции. В зависимости от стадии заболевания и величины узла может быть наложено 3 и более колец для достижения наибольшего эффекта. Промежуток между процедурами 1–2 недели, в зависимости от самочувствия пациента. Процедура безболезненна, может вызывать дискомфорт, чувство ложного позыва в туалет. Ощущения могут быть от 15 минут до нескольких часов — купируются самостоятельно либо после приема обезболивающих препаратов.
Кольца изготовлены из экологически чистого каучука, который абсолютно безвреден. Он эластичен, гипоаллергенен.
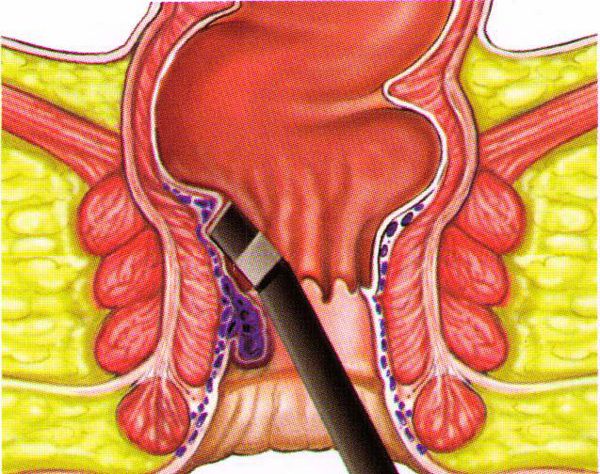
- Инфракрасная фотокоагуляция (стала применяться с 1989 года).
Применяется при лечении геморроя с кровотечениями. Как отдельная методика малоэффективна, в условиях нашей клиники доктора ее используют при подкравливании площадок после лигирования и других малоинвазивных методик, во время беременности, с целью остановки кровотечения.
- Дезартеризация геморроидальных узлов под допплер-контролем
Дезартеризация возможна на любой из стадий развития болезни, но более эффективна на 1–2 стадии заболевания
- Ультразвуковое склерозирование геморроидальных узлов
Минусы: высокий риск кровотечения после манипуляции.
- Лазерная вапоризация геморроидальных узлов
При этой бескровной процедуре происходит тепловое воздействие лазера и безболезненно удаляются внутренние и внешние геморроидальные узлы. Процедура проводится при помощи луча лазера, ювелирно вырезающего и прижигающего ткани.
Лазер способен избавить от геморроя на любой стадии заболевания, удаляя и наружные, и внутренние узлы, независимо от глубины их расположения. Лазерную вапоризацию можно делать даже при наличии тромбоза геморроидальных узлов. Врач с помощью лазера проводит выжигание внутреннего узла изнутри, и на его месте образуется соединительная ткань. Наружные узлы сфокусированным лазерным лучом отсекаются. Поскольку под действием лазера происходит спаивание кровеносных сосудов, процедура проходит без кровотечения. [10]
Это самая эффективная и безопасная процедура, при которой не бывает рецидивов и осложнений.
Оперативное лечение
Геморроидэктомия — это самый старый и травматичный метод удаления геморроя (проводится с 1937 г.), при котором иссекают геморроидальные узлы (геморроидэктомия по Миллигану-Моргану). В муниципальных клиниках она до сих пор стоит на первом месте.
Такое хирургическое вмешательство имеет и значительные недостатки:
- длительность подготовки и самой операции;
- использование анестезии;
- сильная кровопотеря;
- высокая травматичность;
- осложнения в виде недержания кала, стриктуры анального канала, кровотечения, расхождение и нагноение швов, формирование свищей
- длительное пребывание на листе нетрудоспособности
- болевой синдром после операции;
- длительная реабилитация;
Но бывают случаи, когда геморроидэктомия является единственным вариантом устранения заболевания. Для ее проведения все же должны быть веские причины и серьезные показания.
Прогноз. Профилактика
Прогноз заболевания зависит от своевременности выявления его на ранних стадиях, правильно подобранного лечения и качества проведенного лечения.
При соблюдении всех пунктов — прогноз благоприятный. У пациентов после любого правильно проведенного лечения симптомы заболевания могут исчезнуть, как минимум, на 5–10 лет.
Во избежание развития геморроя необходимо проводить профилактические мероприятия.
Для профилактики геморроя и его осложнений большое значение имеет диета. Пациента необходимо предупредить о вреде переедания, злоупотребления алкогольными напитками и острой пищей.
Рекомендуется избегать переедания, которое способствует приливам крови к геморроидальным сплетениям. Острая, жирная, пряная пища, алкоголь, кофе, твердые сыры и т.п. могут провоцировать возобновление выделения крови после дефекации.
Важным компонентом профилактики геморроя является предупреждение и лечение запора. Лечение запоров начинают с увеличения потребления жидкости и нормализации диеты. Для этого применяют пшеничные отруби, морскую капусту и льняное семя или масло в их природном виде или в форме лекарственных средств, обладающих высокой водоудерживающей способностью. [6] Регуляция плотности кишечного содержимого и его транзита по толстой кишке является непременным условием не только профилактики, но и успешного лечения геморроя.
При работе, связанной с длительным сидением, рекомендуются прогулки в течение 20 минут в день, 2 раза в сутки необходимо делать гимнастику в течение 5–7 минут.
Для профилактики геморроя существует следующий комплекс эффективных гимнастических упражнений:
1. ходьба с высоким подъемом ног, согнутых в коленях;
2. маховые движения попеременно правой и левой ногой вперед, назад и в сторону;
3. наклоны в стороны (ноги на ширине плеч, руки вдоль туловища);
4. напряжение ягодиц с одновременным втягиванием заднего прохода (руки на поясе, пятки и носки вместе);
Читайте также:

