Может ли хеликобактер вызывать головокружение
Обновлено: 24.04.2024
Изучено влияние пребиотического комплекса на результаты эрадикационной антихеликобактерной терапии и показана его эффективность по предупреждению развития антибиотикоассоциированной диареи у пациентов, имеющих прогностические факторы неблагоприятного тече
Meaning of dysbiotic disorders of large intestine in pathogenesis of gastroduodenal zone diseases associated with Helicobacter pylori. Meaning of prebiotics in increase of anti-helicobacter therapy efficiency
Influence of prebiotic complex on the results of eradication anti-helicobacter therapy was studied, and its efficiency in prevention of antibiotic-associated diarrhea in patients having forecasting factors of adverse clinical course of early post-eradication period was shown.
Инфекция Helicobacter pylori (Н. pylori) является ведущей причиной хронических заболеваний желудка и двенадцатиперстной кишки. Эрадикация Н. pylori является основным стандартом лечения хеликобактер-ассоциированных заболеваний гастродуоденальной зоны, что отражено в международных соглашениях (Маастрихтские соглашения 1–3, соответственно 1996, 2000 и 2005 гг.) [1].
Следует иметь в виду, что хеликобактериоз проявляется не только местными эрозивно-язвенными поражениями гастродуоденальной зоны, но и оказывает системное влияние на организм человека. Инфицирование макроорганизма и длительное персистирование H. pylori нарушает микроэкологию пищеварительного тракта и может рассматриваться в качестве фактора, инициирующего и усугубляющего нарушения микробиоценоза толстой кишки [2, 3]. При H. pylori-позитивной язвенной болезни дисбиоз кишечника выявляется у 92% пациентов (НИИ питания РАМН), выраженность дисбиотических изменений достоверно связана со степенью обсемененности H. pylori [4]. Антихеликобактерная терапия, включающая применение антибиотиков, также приводит к угнетению облигатной микрофлоры и последующей колонизации слизистой оболочки желудочно-кишечного тракта патогенной и условно-патогенной микрофлорой [5].
Дисбиоз толстой кишки может стать причиной развития вторичного иммунодефицита (местного и общего), что в свою очередь вызывает снижение защитных сил организма и является важным фактором в патогенезе H. pylori-ассоциированной патологии. При этом важно, что сопутствующие дисбиотические изменения кишечника могут достигать определенного критического уровня и превращаться в самостоятельный фактор агрессии. В этих условиях прогредиентно нарастает выраженность клинических симптомов воспалительных заболеваний гастродуоденальной области, удлиняются сроки их существования, утяжеляется общее состояние, ухудшаются показатели результатов лечения и качество жизни пациентов, клиническое течение приобретает часто рецидивирующий характер [6, 7].
Иммуногенная функция нормофлоры заключается в стимуляции синтеза иммуноглобулинов, интерферона, цитокинов; в активировании созревания системы фагоцитирующих мононуклеаров; в повышении содержания комплемента и пропердина, активности лизоцима; выработке бактериальных модулинов. В качестве медиаторов действия бактериальных метаболитов выступают гистамин, серотонин, простагландины, лейкотриены, короткоцепочные жирные кислоты. Воздействие микробных метаболитов и медиаторов их действия направлено на модуляцию пролиферации, дифференцировки, апоптоза и метаболических реакций эукариотических клеток. Нормофлора способна воздействовать на дифференцировку Т-хелперов и таким образом влиять на соотношение про- и противовоспалительных цитокинов. S. Roos, C. Johnson (2003 г.) показали, что некоторые штаммы лактобактерий обладают кислотоустойчивостью и антагонизмом к H. pylori in vivo и in vitro. Lactobacilli spp., как и Bifidobacterium spp., выделяют бактериоцины, способные ингибировать рост H. pylori и нарушать адгезию микроба к эпителиальным клеткам желудка [8–10].
Исследования последних лет показали, что препараты, улучшающие микробиоценоз кишечника, не только повышают эффективность эрадикационной терапии, но и предупреждают развитие и позволяют в значительной степени снизить побочные эффекты антибиотиков, входящих в стандартные схемы антихеликобактерной терапии, такие как антибиотикоассоциированная диарея, тошнота, неприятный привкус в ротовой полости и т. п. [10–14].
Независимо от индивидуальных различий в составе кишечной микрофлоры, кишечный микробиоценоз у каждого человека функционирует как единая экосистема и целостный метаболический орган, который обеспечивает необходимое количество и профиль конечных метаболитов, среди которых наиболее важную роль играют короткоцепочечные жирные кислоты (КЦЖК). КЦЖК — основной продукт микробной ферментации анаэробными бактериями углеводов, жиров и белков. К ним относятся уксусная (С2), пропионовая (С3), изомасляная, масляная (С4), изовалериановая, валериановая (С5), изокапроновая и капроновая (С6) кислоты [7, 15, 16].
Неразветвленные КЦЖК — уксусная, пропионовая и масляная — образуются при анаэробном брожении углеводов, тогда как метаболизм белков ведет к образованию разветвленных кислот — изомасляной (из валина) и изовалериановой (из лейцина). В течение суток синтезируется более 300 ммоль/л КЦЖК. Максимальная концентрация КЦЖК достигается в проксимальных отделах толстой кишки 70–140 ммоль/л — самом мощном биокорректорном участке желудочно-кишечного тракта. В дистальной части содержание КЦЖК снижается до 20–70 ммоль/л [16].
КЦЖК участвуют в регуляции большинства физиологических эффектов облигатной микрофлоры толстой кишки. Так, они являются основным источником питания для колоноцитов, обеспечивая их энергией (на 70%), стимулируют регенерацию эпителия, обладают антибактериальной активностью, обеспечивают баланс микробной экосистемы, препятствуя ее контаминации патогенной микрофлорой, поддерживают детоксицирующую функцию печени за счет участия в энтерогепатической циркуляции желчных кислот, обладают антиканцерогенным и антивирусным действием, оказывают влияние на экспрессию генов в колоноцитах, являются активным модулятором иммунной системы, регулируют моторную функцию кишечника (табл. 1) [16–18].
- Контроль структурной и функциональной целостности клеточного состава толстой кишки и всего организма.
- Модулирует распознавание и уничтожение собственных мутантных, в том числе и опухолевых клеток, а также вторгшихся микроорганизмов и образуемых ими токсических веществ, способных нарушить генетический гомеостаз.
- Продукция медиаторов межклеточного взаимодействия:
- снижение секреции провоспалительных цитокинов, таких как фактор некроза опухоли альфа, оксид азота, гамма-интерферон, интерлейкины ИЛ-2, ИЛ-1;
- стимулирование высвобождения противовоспалительного цитокина ИЛ-10 из моноцитов.
- Ингибирование адгезии эндотелиальных лейкоцитов посредством модуляции экспрессии ФМА-1 и МАСЭ-1 и активации макрофагального ядерного фактора NF-каппа-би.
- Уменьшает гамма-интерферон-индуцируемое высвобождение белка-10 в субэпителиальных миофибробластах кишечника человека.
- Снижает кишечную продукцию СЛК-зависимого ИЛ-8 и кишечную экспрессию Toll-подобного рецептора 4, который считается важным компонентом врожденного иммунитета и который, при избыточной продукции, приводит к проявлению воспалительных заболеваний кишечника.
Основными продуцентами бутирата являются не бифидо- и лактобактерии, а эубактерии, пептококки, фузобактерии и клостридии (поэтому большинство пробиотиков не влияют на синтез масляной кислоты). Эта КЦЖК активно абсорбируется в цитоплазму колоноцита, где в митохондриях из нее образуется АТФ. 70% энергии идет на обеспечение локальных процессов в толстой кишке, а оставшиеся 30% этой энергии расходуются на нужды целого организма. Рецептор-опосредованным путем масляная кислота инициирует активацию и/или ингибирование локальных и системных иммунных реакций [16].
В России с 2011 г. для лечения различных заболеваний ЖКТ применяется препарат Закофальк®. В состав препарата входит масляная кислота и инулин в дозе 250 мг, которые помещены в полимерную мультиматриксную капсулу NMX. В отличие от ранее известных про- и пребиотиков, которые стимулируют рост нормофлоры толстой кишки, что опосредованно приводит к образованию КЦЖК, в первую очередь ацетата и пропионата, Закофальк® напрямую доставляет масляную кислоту и инулин в толстую кишку в заданном количестве. Пребиотический комплекс Закофальк® обеспечивает возможность реализации сложного каскада иммунобиологических, метаболических и других свойств, присущих нормально функционирующему микробно-тканевому комплексу кишечника.
Инулин, (C6H10O5)n, органическое вещество из группы полисахаридов (фруктанов), полимер D-фруктозы, построенный из остатков D-фруктофуранозы, связанных 2,1-бета связями.
Что касается медицинской классификации инулина, в большинстве публикаций его относят к группе растворимых пищевых волокон (не целлюлозный полисахарид). Кроме того, способность инулина избирательно стимулировать бифидо- и лактобактерии, являющиеся представителями нормальной микрофлоры кишечника, позволяет назвать данное вещество истинным пребиотиком.
При попадании в пищеварительный тракт инулин проходит в неизмененном виде в желудок и тонкую кишку. В толстой кишке фруктоолигосахариды являются питательным субстратом исключительно для бифидобактерий и отдельных видов лактобацилл, которые обладают ферментной системой бета-фруктозидаз, позволяющей им расщеплять фруктоолигосахариды до масляной кислоты. Таким образом, инулин выступает не только как селективный пребиотический фактор для микрофлоры толстой кишки, но и как промоутер синтеза эндогенной масляной кислоты.
Растительные волокна инулина, будучи нерастворимыми в тонкой кишке, в толстой кишке создают дополнительные площади (помимо поверхности слизистой оболочки), к которым фиксируются сахаролитические бактерии. Благодаря этому в просвете толстой кишки во много раз возрастает число мест для адгезии и формирования микроколоний лакто- и бифидобактерий, что приводит к значительному увеличению количества присутствующих на единицу объема кишки микроорганизмов, и, как следствие этого, резко возрастает метаболическая активность кишечного содержимого с образованием различных важных для организма энергетических и пластических субстанций. Lactobacilli spp., как и Bifidobacterium spp., выделяют бактериоцины, способные ингибировать рост Н. pylori и нарушать адгезию микроба к эпителиальным клеткам желудка.
Масляная кислоты С3Н7СООН является органической кислотой, вырабатывающейся в просвете толстой кишки в процессе бактериальной ферментации неперевариваемых пищевых углеводородов. Бутират используется организмом в качестве энергетического субстрата для обеспечения процессов пролиферации и дифференцировки колоноцитов, для энергообеспечения ферментативных процессов индигенной флоры. Именно эта кислота контролирует механизмы, инициирующие апоптоз ненужных в функциональном отношении колоноцитов и раковых клеток, модулирует экспрессию генов, регулирующих клеточный цикл, нивелирует действие супероксидных радикалов. Масляная кислота играет основную роль в обеспечении локальных и системных иммунных механизмов: путем активации локальных макрофагов для увеличения презентации антигенов B-лимфоцитам и увеличения производства секреторного иммуноглобулина А местно и системно, модулирования цитокиновых профилей и активации синтеза интерферона. Масляная кислота, являясь универсальным сигнальным химическим носителем передачи информации в организме человека, регулирует адаптивные реакции не только на уровне микробиоценоза толстой кишки (предупреждает развитие кишечного дисбиоза), но и оказывает общее иммуномодулирующее действие.
Клинически манифестной формой кишечного дисбиоза при проведении эрадикационной терапии является антибиотикоассоциированная диарея. На базе городских поликлиник г. Москвы было проведено открытое сравнительное рандомизированное многоцентровое исследование по изучению влияния препарата Закофальк® на эффективность и переносимость эрадикационной терапии.
Целью настоящего исследования было изучение влияния пребиотического комплекса Закофальк® на результаты эрадикационной терапии и его эффективности по предупреждению развития антибиотикоассоциированной диареи при проведении антихеликобактерной терапии у пациентов, имеющих прогностические факторы неблагоприятного течения раннего постэрадикационного периода.
Материал и методы исследования
В рамках сравнительного открытого рандомизированного исследования было обследовано 115 человек (мужчин — 52, женщин — 63), средний возраст 42,5 лет (20–65 лет).
Критерии включения: больные язвенной болезнью, ассоциированной с Н. pylori, в стадии обострения с наличием язвенного дефекта в желудке или в двенадцатиперстной кишке; наличие не менее двух факторов риска развития антибиотикоассоциированной диареи (постинфекционный синдром раздраженного кишечника, сахарный диабет 2-го типа, указание в анамнезе на проведение антибактериальной терапии вне связи с основным заболеванием в течение ближайших 6 месяцев, хронические заболевания гепатобилиарной системы и поджелудочной железы, длительный прием гормональных или химиотерапевтических препаратов, синдром короткой тонкой кишки, дивертикулярная болезнь толстой кишки, онкологические заболевания толстой кишки в анамнезе).
Обследование включало: клиническое наблюдение в динамике, проведение эзофагогастродуоденоскопии с взятием гастробиоптатов слизистой оболочки края язвы с последующей их гистобактериоскопией и проведением уреазного теста (до и через 4 недели от окончания эрадикационной терапии). В ходе исследования анализировались результаты исследования состава кишечной микрофлоры. Исследование иммунного статуса включало определение в сыворотке крови IgG, IgM, IgA, IgE.
После включения в исследование больные были рандомизированы на две группы. Пациенты основной группы (60 человек) помимо препаратов эрадикационной терапии (Нексиум 20 мг 2 раза + кларитромицин 500 мг 2 раза + амоксициллин 1000 мг × 2 раза 14 дней) получали Закофальк® 3 таблетки в сутки, а больные группы сравнения (55 человек) — ту же терапию, но без применения препарата Закофальк®. До начала терапии нарушений кишечной моторики (поносов либо запоров) ни у кого не было.
Результаты и их обсуждение
Через 7 дней от включения в исследование при повторном опросе и осмотре синдром кишечной диспепсии, индуцированный проведением эрадикационной терапии, был отмечен у 34 (68%) пациентов группы сравнения: вздутие — 25, урчание — 28; жидкий стул до 3 раз в сутки — 25, жидкий стул более 3 раз в день — 9. Девять пациентов этой группы (18%) в течение первой недели лечения отказались от дальнейшего приема антибиотиков. При этом в основной группе, пациенты которой получали Закофальк®, не было зафиксировано возникновение диареи, а вздутие или урчание живота было отмечено лишь у 14 пациентов (23,3%). По завершении антибиотикотерапии на 14-й день лечения 41 (82%) пациент группы сравнения отмечал послабления стула от 3 до 5–7 раз в сутки. У 7 (11,7%) пациентов основной группы отмечалось учащение дефекаций до 5 раз в сутки. Таким образом, включение препарата Закофальк® в схему эрадикационной терапии улучшает переносимость лечения антибиотиками даже у пациентов с высоким риском антибиотикоассоциированной диареи (табл. 2).
Исходный уровень сывороточных иммуноглобулинов не имел значимых отличий в основной группе и группе сравнения, средние его значения были незначительно снижены. Уровень IgE был повышен только у больных язвенной болезнью двенадцатиперстной кишки с наличием участков лимфоидной гиперплазии в антральном отделе желудка, средний его уровень в основной группе составил 64,25 ± 11 кЕ/л и 55 ± 12 кЕ/л в группе сравнения. После проведения эрадикационной схемы лечения с включением препарата Закофальк® у пациентов основной группы наблюдалась небольшая тенденция к повышению уровня IgA до 3,0 ± 0,5 г/л (исходный 0,65 ± 0,2 г/л) и значительное снижение IgE до 43 ± 11 кЕ/л. У пациентов группы сравнения такой тенденции не наблюдалось. Повышение сывороточного IgA может отражать повышение секреторного IgA на слизистой оболочке желудка, что свидетельствует об усилении реакций местного иммунитета. Снижение уровня IgE, по-видимому, связано с усилением протективной и детоксицирующей функций эндосимбиотных бактерий. Повышение сывороточных IgA и снижение IgE после лечения препаратом Закофальк® сочеталось со стабильным исчезновением клинических признаков обострения и эндоскопически подтвержденным рубцеванием язв у всех пациентов основной группы (табл. 3).
При микробиологическом исследовании фекалий в исходном периоде достаточно выраженные изменения соотношения представителей кишечной микрофлоры выявлены у большинства обследованных больных в обеих группах, в первую очередь отмечалось снижение уровня бифидо- и лактобактерий. После курса эрадикационной терапии у пациентов, принимавших Закофальк®, выявлено достоверное увеличение количества бифидобактерий и лактобактерий, а также достоверное уменьшение количества патогенных и условно-патогенных бактерий. В группе сравнения обращает внимание угнетение микробного роста представителей нормальной кишечной микрофлоры и увеличение степени дисбиоза кишечника. Таким образом, полученные данные в очередной раз подтверждают отрицательное влияние стандартной эрадикационной терапии на микробный состав кишечника, что имеет особое значение для пациентов с сопутствующими заболеваниями ЖКТ, увеличивающими риск развития кишечного дисбиоза и его клиническое проявление — антибиотикоассоциированной диареи (табл. 4, 5).
Достижение эрадикации H. pylori было зафиксировано у 52 (86,7%) пациентов основной группы и у 17 (31%) из группы сравнения, что может зависеть от более четкого соблюдения комплаентности терапии, а также способности препарата Закофальк® потенцировать противовоспалительный эффект антибиотиков.
Проводилась морфологическая оценка из краев язвенных дефектов до начала антихеликобактерной терапии и по ее завершении. Полученные данные свидетельствуют, что включение в терапию препарата Закофальк® приводит к улучшению клеточного состава слизистой оболочки в краях язвы. Так, значительно уменьшается нейтрофильная и лимфоцитарная и плазмоцитарная инфильтрация, что свидетельствует об уменьшении воспалительного и иммуно-воспалительных процессов (табл. 6, 7).
Выводы
Результаты исследования показывают несомненное преимущество комплексного лечения язвенной болезни, ассоциированной с H. pylori, с включением пребиотика Закофальк® по сравнению со стандартной эрадикационной схемой.
На основании полученных данных можно сделать следующие выводы:
- Антихеликобактерная терапия сопровождается развитием антибиотико-ассоциированных нарушений кишечной микрофлоры у большинства пациентов.
- Назначение препарата Закофальк® снижает риск развития осложнений антихеликобактерной терапии; способствует улучшению показателей собственно эрадикации.
- Эффект препарата Закофальк® проявляется клиническим улучшением, нормализацией состава микрофлоры кишечника, а также восстановлением ее метаболической активности.
- Включение препарата Закофальк® позволяет существенно потенцировать противовоспалительный эффект эрадикационной терапии.
Литература
Л. И. Буторова*, кандидат медицинских наук
Т. А. Плавник**
Н. Г. Кадникова***
С. Р. Рекель****
* ГИУВ МО РФ; ГБУЗ ГП № 209 ДЗМ, Москва
** ГБУЗ ГП № 195 ДЗМ, Москва
*** ПК № 230 ДЗМ, Зеленоград
**** ФГБУ ПК № 2 УДП РФ, Москва
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Хеликобактериоз: причины появления, симптомы, диагностика и способы лечения.
Определение
Хеликобактериоз – инфекционное заболевание, поражающее пилорический отдел желудка, или привратник, и двенадцатиперстную кишку. Его возбудителем является уникальная патогенная микроаэрофильная грамотрицательная бактерия хеликобактер пилори (H. pylori). Свое название бактерия получила за счет отдела желудка, в котором она обитает – пилорического.
В результате микроорганизм еще сильнее колонизирует слизистую оболочку, формирует ее повышенную восприимчивость к соляной кислоте и провоцирует воспаление, приводящее к развитию язвенных дефектов.
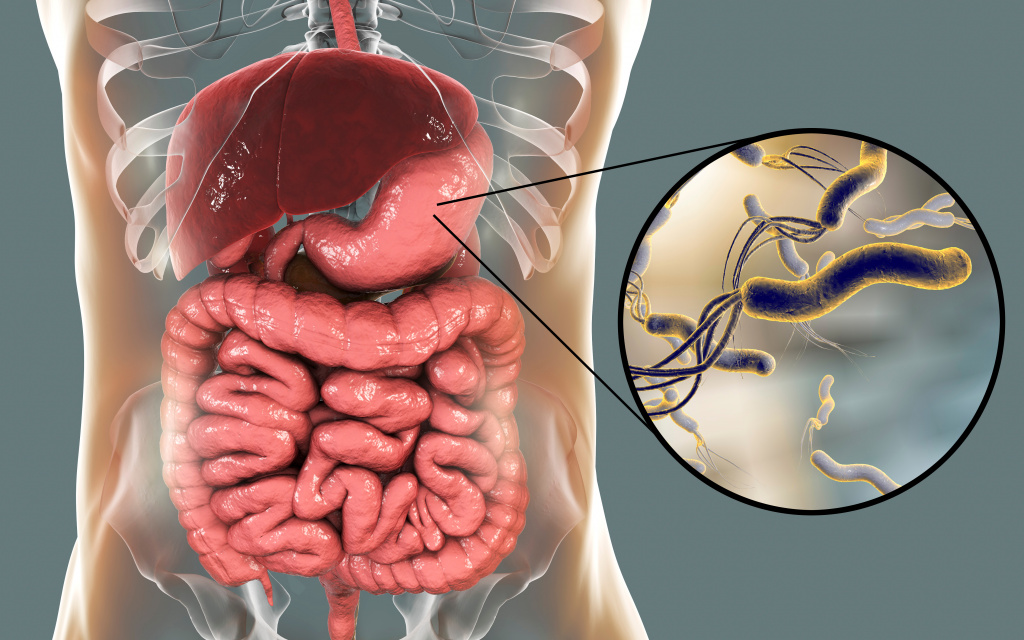
Хеликобактер пилори – спиралевидная бактерия длиной 3,5 и шириной 0,5 микрон. Она имеет жгутики, с помощью которых свободно перемещается по стенке желудка либо надежно на ней закрепляется. Бактерия H. pylori очень изменчива, ее штаммы (разновидности) отличаются друг от друга способностью прикрепляться к слизистой оболочке желудка, вызывать воспалительный процесс и обладают разной степенью патогенности.

Хеликобактер пилори, колонизирующая слизистую оболочку желудка, — частая причина ее воспалительных изменений, она признана этиологическим фактором гастрита, а сам гастрит — инфекционным заболеванием. В зависимости от состояния защитных факторов желудка возникший инфекционный процесс может протекать латентно или с выраженной клинической симптоматикой воспаления. Согласно современным представлениям, H. pylori вызывает хронический гастрит у всех зараженных лиц. Это может привести к язвенной болезни, атрофическому гастриту, аденокарциноме желудка или низкодифференцируемой лимфоме желудка. H. pylori относится к канцерогенам первого порядка.
Результаты многочисленных исследований дают основание предполагать возможную патогенетическую или опосредованную роль инфекции H. pylori в развитии и/или течении заболеваний, не относящихся к пищеварению: кардио-, цереброваскулярных, аутоиммунных заболеваний, заболеваний крови, кожи, нервной системы и многих других.
Патоген отличается относительной устойчивостью к окружающей среде: при кипячении хеликобактерии гибнут практически мгновенно, при обработке дезинфицирующими составами — в течение нескольких минут.
Причины появления хеликобактериоза
Заразиться бактерией можно при контакте с загрязненной водой или продуктами питания. Инфицирование возможно во время проведения эндоскопии и при использовании других плохо стерилизованных медицинских инструментов, которые имели прямой контакт со слизистой желудка пациента.
Бытовой способ передачи (например, через поцелуи, личные вещи и проч.) также возможен, о чем свидетельствует выделение бактерии из слюны и зубного налета.
Распространенность инфекции варьируется в зависимости от географического региона, возраста пациента, его этнической принадлежности и социально-экономического статуса. По данным Департамента здравоохранения г. Москвы (2019), распространенность этой инфекции в Москве составляет 60,7–88%, в Санкт-Петербурге - 63,6%, в Восточной Сибири достигает 90%.
Классификация заболеваний
Заболевания, связанные с H. pylori:
- гастрит,
- дуоденит,
- гастродуоденит,
- эзофагит,
- язвенная болезнь желудка,
- язвенная болезнь двенадцатиперстной кишки,
- железодефицитная анемия неясного генеза,
- рак желудка,
- рак двенадцатиперстной кишки.
Основной жалобой, с которой больные с признаками Helicobacter-инфекции обращаются к врачу, являются желудочные боли. Локализация симптома может меняться и переходить в область расположения двенадцатиперстной кишки.
Боли бывают острыми, ноющими, тупыми, возникают в верхних отделах живота слева и по центру в околопупочной области. Дискомфорт может возникать при длительном голодании, натощак или через определенное время после приема пищи.
Симптоматика хеликобактериоза зависит от клинической формы заболевания и может включать:
- чувство тяжести в животе после еды;
- нарушение аппетита, связанное с внезапными приступами тошноты (если слизистая желудка сильно травмирована);
- беспричинная рвота на фоне нормальной температуры тела;
- изжога (жгучие ощущения в пищеводе и даже гортани) и отрыжка с неприятным кислым или горьким привкусом;
- хронические запоры (отсутствие дефекации в течение трех суток и более);
- разжижение каловых масс, появление пенистой или водянистой консистенции;
- кишечные спазмы и вздутие живота.
- снижение аппетита до полного его отсутствия;
- тошнота может сменяться рвотой со сгустками крови;
- резкое снижение массы тела, не являющееся нормой;
- сухость во рту и привкус металла;
- появление белого налета на языке;
- неприятный запах изо рта при отсутствии кариеса;
- заеды в уголках рта;
- кровоточивость десен.
Диагностика хеликобактериоза
Долгое время хеликобактериоз может никак себя не проявлять, при этом провоцируя развитие язвы, аденокарциномы или мальтомы желудка. В особой зоне риска люди, чьи родственники имеют эти заболевания в анамнезе.
Диагностика может быть инвазивной (эндоскопия с последующей биопсией желудочных тканей) и неинвазивной (лабораторные исследования).
Согласно международным рекомендациям, методами выбора для диагностики бактерии и оценки эффективности лечения H. pylori служат дыхательный̆ тест с мочевиной, меченной 13С и определение специфических антигенов H. pylori в кале иммунохроматографическим методом.
Синонимы: Дыхательный тест с 13С-меченной мочевиной. 13 UBT; 13C-UBT. Краткая характеристика 13С-уреазного дыхательного теста Дыхательный тест в текущей модификации предназначен для лиц старше 12 лет. 13С-уреазный дыхательный тест относится к неинвазивным безопасным методам исследования.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Хеликобактериоз: причины появления, симптомы, диагностика и способы лечения.
Определение
Хеликобактериоз – инфекционное заболевание, поражающее пилорический отдел желудка, или привратник, и двенадцатиперстную кишку. Его возбудителем является уникальная патогенная микроаэрофильная грамотрицательная бактерия хеликобактер пилори (H. pylori). Свое название бактерия получила за счет отдела желудка, в котором она обитает – пилорического.
В результате микроорганизм еще сильнее колонизирует слизистую оболочку, формирует ее повышенную восприимчивость к соляной кислоте и провоцирует воспаление, приводящее к развитию язвенных дефектов.

Хеликобактер пилори – спиралевидная бактерия длиной 3,5 и шириной 0,5 микрон. Она имеет жгутики, с помощью которых свободно перемещается по стенке желудка либо надежно на ней закрепляется. Бактерия H. pylori очень изменчива, ее штаммы (разновидности) отличаются друг от друга способностью прикрепляться к слизистой оболочке желудка, вызывать воспалительный процесс и обладают разной степенью патогенности.

Хеликобактер пилори, колонизирующая слизистую оболочку желудка, — частая причина ее воспалительных изменений, она признана этиологическим фактором гастрита, а сам гастрит — инфекционным заболеванием. В зависимости от состояния защитных факторов желудка возникший инфекционный процесс может протекать латентно или с выраженной клинической симптоматикой воспаления. Согласно современным представлениям, H. pylori вызывает хронический гастрит у всех зараженных лиц. Это может привести к язвенной болезни, атрофическому гастриту, аденокарциноме желудка или низкодифференцируемой лимфоме желудка. H. pylori относится к канцерогенам первого порядка.
Результаты многочисленных исследований дают основание предполагать возможную патогенетическую или опосредованную роль инфекции H. pylori в развитии и/или течении заболеваний, не относящихся к пищеварению: кардио-, цереброваскулярных, аутоиммунных заболеваний, заболеваний крови, кожи, нервной системы и многих других.
Патоген отличается относительной устойчивостью к окружающей среде: при кипячении хеликобактерии гибнут практически мгновенно, при обработке дезинфицирующими составами — в течение нескольких минут.
Причины появления хеликобактериоза
Заразиться бактерией можно при контакте с загрязненной водой или продуктами питания. Инфицирование возможно во время проведения эндоскопии и при использовании других плохо стерилизованных медицинских инструментов, которые имели прямой контакт со слизистой желудка пациента.
Бытовой способ передачи (например, через поцелуи, личные вещи и проч.) также возможен, о чем свидетельствует выделение бактерии из слюны и зубного налета.
Распространенность инфекции варьируется в зависимости от географического региона, возраста пациента, его этнической принадлежности и социально-экономического статуса. По данным Департамента здравоохранения г. Москвы (2019), распространенность этой инфекции в Москве составляет 60,7–88%, в Санкт-Петербурге - 63,6%, в Восточной Сибири достигает 90%.
Классификация заболеваний
Заболевания, связанные с H. pylori:
- гастрит,
- дуоденит,
- гастродуоденит,
- эзофагит,
- язвенная болезнь желудка,
- язвенная болезнь двенадцатиперстной кишки,
- железодефицитная анемия неясного генеза,
- рак желудка,
- рак двенадцатиперстной кишки.
Основной жалобой, с которой больные с признаками Helicobacter-инфекции обращаются к врачу, являются желудочные боли. Локализация симптома может меняться и переходить в область расположения двенадцатиперстной кишки.
Боли бывают острыми, ноющими, тупыми, возникают в верхних отделах живота слева и по центру в околопупочной области. Дискомфорт может возникать при длительном голодании, натощак или через определенное время после приема пищи.
Симптоматика хеликобактериоза зависит от клинической формы заболевания и может включать:
- чувство тяжести в животе после еды;
- нарушение аппетита, связанное с внезапными приступами тошноты (если слизистая желудка сильно травмирована);
- беспричинная рвота на фоне нормальной температуры тела;
- изжога (жгучие ощущения в пищеводе и даже гортани) и отрыжка с неприятным кислым или горьким привкусом;
- хронические запоры (отсутствие дефекации в течение трех суток и более);
- разжижение каловых масс, появление пенистой или водянистой консистенции;
- кишечные спазмы и вздутие живота.
- снижение аппетита до полного его отсутствия;
- тошнота может сменяться рвотой со сгустками крови;
- резкое снижение массы тела, не являющееся нормой;
- сухость во рту и привкус металла;
- появление белого налета на языке;
- неприятный запах изо рта при отсутствии кариеса;
- заеды в уголках рта;
- кровоточивость десен.
Диагностика хеликобактериоза
Долгое время хеликобактериоз может никак себя не проявлять, при этом провоцируя развитие язвы, аденокарциномы или мальтомы желудка. В особой зоне риска люди, чьи родственники имеют эти заболевания в анамнезе.
Диагностика может быть инвазивной (эндоскопия с последующей биопсией желудочных тканей) и неинвазивной (лабораторные исследования).
Согласно международным рекомендациям, методами выбора для диагностики бактерии и оценки эффективности лечения H. pylori служат дыхательный̆ тест с мочевиной, меченной 13С и определение специфических антигенов H. pylori в кале иммунохроматографическим методом.
Синонимы: Дыхательный тест с 13С-меченной мочевиной. 13 UBT; 13C-UBT. Краткая характеристика 13С-уреазного дыхательного теста Дыхательный тест в текущей модификации предназначен для лиц старше 12 лет. 13С-уреазный дыхательный тест относится к неинвазивным безопасным методам исследования.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Вегетососудистая дистония: причины появления, при каких заболеваниях возникает, диагностика и способы лечения.
Определение
Вегетативная нервная система – это та часть нервной системы, которая регулирует работу внутренних органов, желез внутренней и внешней секреции, кровеносных и лимфатических сосудов. Она поддерживает уровень артериального давления, сократительную способность сердца, работу почек, отвечает за температуру тела, регулирует обменные процессы и т.д.
Вегетативная нервная система состоит из симпатического и парасимпатического отделов, чьи функции по большей части противоположны. Так, влияние симпатического отдела вегетативной нервной системы приводит к учащению сердцебиения во время выполнения физических упражнений или эмоционального напряжения. Активация парасимпатического отдела происходит, когда человек отдыхает – понижается давление, пульс становится реже.
По сути, ВСД – не заболевание, а синдром, при котором отсутствует органическая патология конкретного органа или системы, а нарушения носят функциональный характер.
Симптомы вегетососудистой дистонии
За этими жалобами может скрываться ряд серьезных заболеваний (анемия, заболевания щитовидной железы, артериальная гипертензия, ишемическая болезнь сердца, панические атаки, депрессивное или тревожное расстройство, и др.), которые нетрудно пропустить, объясняя симптомы пациента тем, что у него наблюдается расстройство вегетативной нервной системы.
При каких заболеваниях возникает вегетососудистая дистония
Железодефицитная анемия
Железодефицитная анемия (ЖДА) – это заболевание, характеризующееся снижением содержания железа в сыворотке крови, костном мозге и тканях и приводящее к нарушению синтеза гемоглобина и эритроцитов, развитию трофических расстройств.
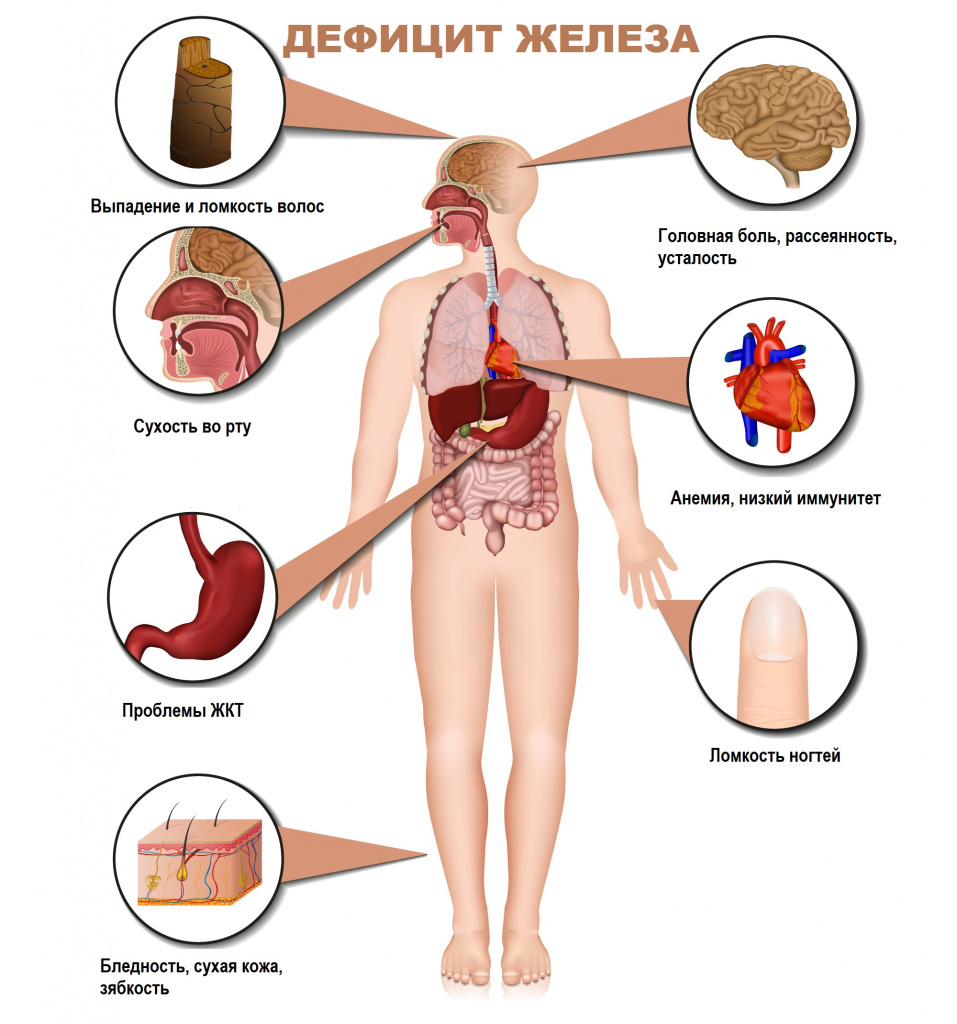
Для латентного железодефицита характерно истощение запасов железа в организме при нормальном уровне гемоглобина крови. Симптомами латентного дефицита или анемии являются слабость, повышенная утомляемость, сниженная работоспособность, бледность кожных покровов, головная боль, учащенное сердцебиение, низкое артериальное давление, сухость кожи, ломкость волос и ногтей, неприятные ощущения в животе.
Дефицит железа при анемии может быть вызван недостатком его поступления в организм, нарушением усвоения или повышенной потерей.
Основные причины ЖДА у женщин: обильные менструальные кровотечения, беременность, роды (особенно повторные) и лактация. Для женщин в постменопаузе и мужчин основная причина – кровотечения в ЖКТ. Дефицит железа может развиться в период интенсивного роста детей, при следовании растительной диете, после резекции желудка или кишечника, а также в результате нарушения всасывания железа у лиц с воспалительными заболеваниями ЖКТ.
Заболевания щитовидной железы
Нарушение выработки гормонов щитовидной железы (ЩЖ) могут приводить к их избытку (гипертиреоз) или недостатку (гипотиреоз) в крови. При гипотиреозе пациент ощущает апатию и сонливость, быструю утомляемость, снижение памяти, испытывает трудности в концентрации внимания, депрессию, зябкость, плохо переносит холод, у него наблюдается интенсивное выпадение волос, ломкость ногтей, отечность, боль в мышцах, повышение массы тела при сниженном аппетите, запоры. При избыточной выработке гормонов пациенты жалуются на учащенное сердцебиение, тремор конечностей, потливость, чувство жара и плохую переносимость жары, плаксивость, суетливость и раздражительность, снижение массы тела при повышенном аппетите, бессонницу.
У одних пациентов преобладает неврологическая симптоматика, у других повышается артериальное давление, у кого-то ведущими симптомами являются желудочно-кишечные расстройства – тошнота, метеоризм, запоры.
Функциональные расстройства нервной системы могут сопутствовать таким психическим расстройствам как панические атаки, тревожные или депрессивные расстройства и пр.
Присутствие у пациентов хотя бы четырех из приведенных ниже симптомов должно навести врача на мысль о возможном паническом расстройстве (а в некоторых случаях достаточно и двух):
- пульсация, сильное сердцебиение, учащенный пульс;
- потливость;
- озноб, тремор, ощущение внутренней дрожи;
- ощущение нехватки воздуха, одышка;
- удушье или затрудненное дыхание;
- боль или дискомфорт в левой половине грудной клетки;
- тошнота или дискомфорт в животе;
- ощущение головокружения, неустойчивость, легкость в голове или предобморочное состояние;
- ощущение деперсонализации и непонимание реальности происходящего;
- страх сойти с ума или совершить неконтролируемый поступок;
- страх смерти;
- ощущение онемения или покалывания (парестезии) в конечностях;
- ощущение прохождения по телу волн жара или холода.
Тревога при панической атаке может быть как выраженной, так и едва ощутимой – в этом случае на первый план выходят вегетативные симптомы. Продолжительность приступа составляет 15-30 минут.
Паническое расстройство характеризуется повторным возникновением панических атак, оно не обусловлено действием каких-либо веществ или соматическим заболеванием (нарушением ритма сердца, тиреотоксикозом, гипертоническим кризом), для него характерна постоянная озабоченность человека по поводу повторения атак. Обычно первая атака производит на пациента тягостное впечатление, приводит к постоянной тревоге и ожиданию повторов. Чем катастрофичнее человек оценивает первый эпизод (к примеру, считает, что у него развивается инфаркт или инсульт), тем тяжелее протекает паническое расстройство и тем быстрее могут присоединиться сопутствующие заболевания (депрессия, агорафобия, алкоголизм и др.).
Генерализованное тревожное расстройство
ГТР может иметь хроническое течение с периодами обострений и ремиссий. Тревожное состояние при ГТР длится минимум 6 месяцев, не поддается сознательному контролю (пациент не в состоянии подавить тревогу усилием воли или рациональными убеждениями), а интенсивность переживаний несоразмерна с реальностью жизненных обстоятельств.
Основной симптом генерализованного тревожного расстройства – диффузная тревога, не связанная с конкретными ситуациями, то есть пациент постоянно напряжен в ожидании чего-то плохого, беспокоен, озабочен по разным причинам.
Другими симптомами являются раздражительность, повышенная бдительность, больному трудно сосредоточиться, он чувствителен к шуму. Заболеванию свойственно мышечное напряжение, которое сопровождается тремором конечностей, неспособностью расслабиться, повышенным мышечным тонусом, головной болью, ноющими мышечными болями.
При генерализованном тревожном расстройстве очень распространены симптомы, связанные с повышенной активностью вегетативной нервной системы: сухость во рту, трудности при проглатывании пищи и воды, дискомфорт в животе, метеоризм, диарея, тошнота. Пациенты жалуются, что им тяжело делать вдох, ощущают дискомфорт в области сердца, перебои в его работе, пульсацию шейных сосудов. Кроме того, описаны случай нарушения эрекции, снижения либидо, задержки менструации, учащенного мочеиспускания.
Депрессивное расстройство
Депрессия – одно из самых распространенных расстройств психики. Эпизоды депрессии характеризуются ежедневным плохим настроением и длятся не менее 2 недель. У пациента наблюдается снижение интереса к работе, семье, повышенная утомляемость. Человеку в депрессивном эпизоде трудно сосредоточиться, у него занижена самооценка, он пессимистичен, у него нарушаются аппетит и сон.
Депрессия может проходить в так называемой скрытой форме, когда на первый план выходит не сниженное настроение, а ощущение физического нездоровья.
Диагностика при вегетососудистой дистонии
При подозрении на нарушения обмена железа в организме необходимо провести следующие обследования:
-
общий анализ крови с определением гематокрита, уровня эритроцитов в крови, исследование уровня ретикулоцитов в крови с определением среднего содержания и средней концентрации гемоглобина в эритроцитах, определение размеров эритроцитов;
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
Многочисленные исследования последних десятилетий показали, что Helicobacter pylori (НР), признаваемый большинством исследователей в качестве этиологического фактора развития хронического гастрита, язвенной болезни и ассоциированной с лимфоидной тканью о
Многочисленные исследования последних десятилетий показали, что Helicobacter pylori (НР), признаваемый большинством исследователей в качестве этиологического фактора развития хронического гастрита, язвенной болезни и ассоциированной с лимфоидной тканью опухоли MALTомы, может быть причиной заболеваний практически всех органов и систем. В последние годы пристально изучается роль НР в развитии ишемической болезни сердца, атеросклеротического поражения сосудов мозга, ряда аутоиммунных заболеваний, а также аллергических состояний.
Воздействие НР на макроорганизм может быть обусловлено различными механизмами. НР вызывает прямое повреждение слизистой оболочки желудочно-кишечного тракта, в результате которого повышается проницаемость его стенок для крупных молекул с развитием как истинной аллергии, так и псевдоаллергии. Изменение функции эпителия ведет к нарушению процессов переваривания и всасывания с изменением состава желудочного и кишечного содержимого, в том числе кишечной микрофлоры. Эти процессы усугубляют дисфункцию органов пищеварения, также способствуя развитию аллергии. Кроме того, возможна модификация поверхностных антигенов эпителиоцитов с последующей аутоиммунной реакцией. Показана определенная связь НР-инфицирования с развитием аутоиммунных процессов не только в желудочно-кишечном тракте, но и в других системах организма: сахарного диабета 1 типа, аутоиммунного тиреоидита, болезни Сьегрена, тромбоцитопенической пурпуры, аутоиммунных нефропатии и полинейропатии. Даже атеросклероз и ишемическая болезнь сердца могут рассматриваться как аутоиммунный процесс, индуцированный НР.
Чем более выражены факторы вирулентности НР, тем в большей степени вероятно развитие аллергического процесса у инфицированного больного. В то же время аллергические состояния, не связанные с НР, часто характеризуются повышенной проницаемостью кишечной стенки и снижением защитных механизмов, в том числе снижением уровня секреторного IgA. Последнее обстоятельство предрасполагает к инфицированию и колонизации НР в желудочно-кишечном тракте. Слизистая оболочка ЖКТ является барьером для алиментарных антигенов, и воспалительный процесс в желудочно-кишечном тракте любого происхождения может нарушать его целостность, повышать проницаемость слизистой оболочки и увеличивать прохождение через нее пищевых антигенов. Таким образом, НР-инфекция и аллергия представляют собой тесно связанные процессы.
В ряде исследований было показано, что воспалительный процесс в желудочно-кишечном тракте, связанный с НР, может быть причиной возникновения хронической крапивницы [1, 2, 3, 4, 5], которая, по разным данным,в 47% случаев сочетается с НР-инфекцией, в 50% — с выявлением антител к высокоафинному рецептору IgE, в 12–20% — с антитиреоидными антителами. Liutu M. и соавт. у 40 из 107 детей с хронической крапивницей выявили антитела класса IgG к НР. При этом активный гастрит был подтвержден у 30 из 32 НР-позитивных пациентов, а повышенный уровень IgE определялся у 64% НР-позитивных и у 39% НР-негативных пациентов [6]. Сочетание хронической крапивницы с аутоиммунным тиреоидитом достоверно ассоциируется с инфицированием CagA(+)-штаммами НР, но не CagA(-)-штаммами [7]. Эрадикация НР не приводит к полному излечению, но снижает тяжесть процесса и уменьшает потребность в антигистаминных препаратах, что, однако, может быть связано с излечением хеликобактерного гастрита [8].
Описана связь НР с развитием ангионевротического отека у детей, в основе которого лежат изменения в системе комплемента. Эрадикация НР приводит как к купированию клинических проявлений, так и к восстановлению иммунологических показателей [9].
У детей с атопическим дерматитом и пищевой аллергией очень часто встречаются антихеликобактерные антитела [10, 11, 12]. Показано также повышение эффективности лечения атопического дерматита при одновременной эрадикации НР [13].
Нами изучалась связь пищевой аллергии с язвенной болезнью двенадцатиперстной кишки (ЯДК) у 63 детей в возрасте 5–16 лет (средний возраст — 12,6±0,13 лет), а также у детей с хроническим гастродуоденитом. Мы дифференцировали явную и скрытую аллергию без клинических проявлений, но с повышением уровня IgE в крови, а также истинную и псевдоаллергию. Было установлено, что суммарная доля пациентов с явной истинной аллергией, со скрытой аллергизацией и с псевдоаллергическими реакциями среди детей с ЯДК в активной стадии заболевания достигает 71%, а при хроническом гастродуодените — 35%. Клинически аллергические проявления аллергии наблюдались у 23% детей с ЯДК в активной стадии и 14% — в стадии ремиссии. У большинства детей аллергия была вызвана пищевыми антигенами. Скрытая аллергия на фоне активной стадии язвенной болезни имела место у 48% больных, в период ремиссии — у 22%, псевдоаллергические реакции наблюдались у 14% детей в активной стадии и 8% — в стадии ремиссии (рис. 1). При этом для детей с ЯДК и пищевой аллергией характерна большая длительность болевого синдрома на фоне проводимого лечения, по сравнению с больными без пищевой аллергии.
Изучение кислотно-пептического фактора показало, что повышение его активности способствует развитию аллергических и, в большей степени, псевдоаллергических реакций, за счет прямого воздействия на слизистую оболочку желудочно-кишечного тракта. Важно также, что для инфицированных НР больных с пищевой аллергией характерны относительно более низкие значения антихеликобактерных IgA-антител в крови по сравнению с пациентами без пищевой аллергии, что говорит об относительном снижении барьерной функции слизистой оболочки желудочно-кишечного тракта у этих детей.
Связь НР и пищевой аллергии при ЯДК может быть представлена схематично (рис. 2 ). Как уже указывалось, пищевая аллергия характеризуется селективным снижением выработки антихеликобактерных IgA-антител, но значительным повышением в крови антихеликобактерных IgG-антител, что указывает на снижение барьерной функции слизистой оболочки желудочно-кишечного тракта, что само по себе провоцирует развитие аллергии. Воспалительный процесс на слизистой оболочке желудка и тонкой кишки (гастрит, дуоденит), индуцированный НР, способствует протеканию как аллергических, так и псевдоаллергических процессов за счет еще большего повышения проницаемости слизистой оболочки. Воспалительный процесс может быть связан как с прямым действием НР на слизистую оболочку желудка и, в меньшей степени, двенадцатиперстной кишки, так и возникать опосредованно, в результате повышения активности кислотно-пептического фактора. Последний механизм реализуется отчасти через активацию гастрин-продуцирующих клеток и повышение кислой секреции, а также секреции пепсиногена.
У многих инфицированных НР лиц отмечается положительный тест на специфические IgE. НР может индуцировать IgE-опосредованный выход гистамина из человеческих базофилов in vitro. Тучные клетки слизистой оболочки участвуют в пищевой аллергии. Ранее было показано, в частности, что у НР-позитивных больных ЯДК количество Ecl-клеток, продуцирующих гистамин, в 3 раза превышает таковое у НР-позитивных лиц без дуоденальной язвы. Уровень гастрина в крови и гистамина в слизистой оболочке желудка при ЯДК выше по сравнению с контрольной группой, тогда как у НР-позитивных лиц без дуоденальной язвы имеют место промежуточные значения. Наблюдения говорят о возможном гистамин-опосредованном действии НР [14].
В работе N. Figura et al. [15] исследовалось, в каких случаях НР-инфекция ассоциируется с пищевой аллергией у взрослых пациентов. Автор показал, что CagA-позитивные пациенты с пищевой аллергией достоверно преобладают по сравнению с инфицированными пациентами без аллергии (р = 0,030, Mantel-Haenszel test). Поскольку штаммы НР, экспрессирующие CagA, обладают более высоким провоспалительным потенциалом, правомерно сделать вывод, что выраженное воспалительное поражение слизистой оболочки желудка способно повышать трансэпителиальную проницаемость и способствовать неселективному пассажу аллергенов, которая у атопиков может прямо стимулировать IgE-опосредованный ответ. При этом CagA-положительная НР-инфекция способствует пищевой аллергии. Таким образом, с одной стороны, на фоне ЯДК или хронического гастродуоденита возможно обострение скрытой аллергии. С другой стороны, пищевая аллергия провоцирует развитие гастрита, дуоденита и поддерживает уже имеющийся процесс. В итоге замыкается порочный патогенетический круг.
На основании полученных данных можно утверждать, что у больных с ЯДК пищевая аллергия встречается достаточно часто и ее развитие непосредственно связано с НР-инфицированием. При этом истинно аллергический процесс регулируется существенно реже псевдоаллергического. ЯДК усугубляет течение пищевой аллергии, а успешное лечение язвенного процесса способствует снижению активности процесса аллергического. Хотя противоаллергическая терапия и не влияет на сроки заживления язвенного дефекта, однако она способствует улучшению самочувствия больного, уменьшая болевую симптоматику.
Исходя из этого, для лечения больных ЯДК в сочетании с ПА патогенетически обосновано проведение адекватной терапии язвенного процесса, включая, при необходимости, антихеликобактерную и антисекреторную терапию, в сочетании с противоаллергическими мероприятиями.
Таким образом, в настоящее время накоплены данные, указывающие на то, что инфицирование НР способствует развитию аллергии и псевдоаллергии как за счет прямого действия на слизистую оболочку, так и опосредованно, через активацию других патогенных факторов. Эрадикация НР способствует излечению больного, что следует учитывать при составлении плана диагностических и терапевтических мероприятий, включая тесты на НР-инфекцию, и назначении адекватных антихеликобактерных средств.
По вопросам литературы обращайтесь в редакцию.
С. В. Бельмер, доктор медицинских наук, профессор
Т. В. Гасилина, кандидат медицинских наук
М. Аль Хатиб, кандидат медицинских наук
РГМУ, Москва
Читайте также:

