Может ли после отравления отказать почки
Обновлено: 18.04.2024
Гемодиализ при отравлении. Перитонеальный диализ при интоксикации организма
Этим приемом можно удалить из организма диализирующиеся яды (вещества, способные проходить из крови через поры диализирующей мембраны в диализирующую жидкость). К ним относятся амидопирин, анальгин, бутадион и другие производные пиразолона, анилин, антибиотики, антифризы (содержащие этиленгликоль), барбитураты, барий и его соли, беллоид, медь и ее соединения, мепротан (андаксин), мышьяк и его соединения, пахикарпин, салицилаты, спирты (метиловый, этиловый и высшие), сулема, сульфаниламиды, уксусная эссенция, хинин, хлорированные углеводороды (дихлорэтан, четыреххлористый углерод и др.). Операция гемодиализа эффективна в ранние сроки после отравления (4—6—8 ч), когда в крови еще циркулирует значительное количество яда. В более поздние сроки эффективность метода при одних отравлениях, снижается значительно (отравление хлорированными углеводородами, этиленгликолем), при других — умеренно (отравления барбитуратами, тяжелыми металлами и их солями, мышьяком и др.).
Гемодиализ значительно уменьшает явление интоксикации и является лучшей профилактикой почечно-печеночной недостаточности.
Следует иметь в виду, что терапевтический эффект гемодиализа можно значительно усилить, если одновременно применять и другие методы дезинтоксикации, например, введение антидота — унитиола при отравлениях металлами (медью; ртутью), мышьяком и их солями. Унитиол вводится внутривенно непосредственно перед операцией и в больших дозах (100—200 мл 5% раствора).
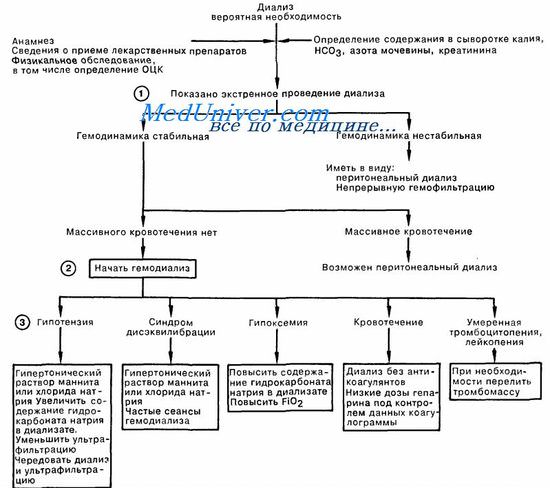
Тактика врача при неотложном гемодиализе
Гемодиализ может сочетаться с перитонеальным диализом (например, при отравлениях хлорированными углеводородами), дезинтоксикацией методом форсированного диуреза и др.
Перитонеальный диализ. Один из наиболее распространенных методов по удалению токсических веществ из крови. Его лечебный эффект при отравлениях основан на переходе токсического вещества из крови в перитонеальную жидкость. При некоторых пероральных отравлениях (хлорированными углеводородами, этаминалом натрия, ноксироном и др.) в системе портальных вен, в липоидах большого и малого сальника, в брыжейке кишечника концентрируется наибольшее количество токсического вещества, что создает относительно перитонеальной жидкости значительный перепад в концентрации яда. Последнее обстоятельство и прямой контакт ядовитых веществ с диализи-рующей жидкостью способствуют переходу токсических веществ в нее, и в целом — детоксикации организма. Кроме того, эффективность перитонеального диализа может быть повышена за счет ультрафильтрации (применение гипертонических диализирующих растворов) и создания так называемой ионной ловушки (например, переход нейтральных молекул барбитуровой кислоты в щелочной среде в ионизированное состояние).
Диализирующую жидкость перед введением в брюшную полость подогревают до температуры 37—37,5° С. Через 20—40—60 мин производят смену перитонеальной жидкости в брюшной полости (оптимальный срок экспозиции для метанола 20—30 мин; для сулемы 40—60 мин). Сеансы перитонеального диализа повторяют в зависимости от характера яда и тяжести интоксикации. Введенные в брюшную полость 2 л жидкости могут ограничивать движение диафрагмы. Поэтому во время операции желательно приподнимать головной конец кровати до угла в 10—15°. Операция перитонеального диализа по существу не имеет противопоказаний. Следует иметь в виду, что ее эффективность значительно увеличивается в комплексе с проведением других методов терапии (гемодиализ, форсированный диурез, искусственная вентиляция легких и др.). Целенаправленная и оптимальная терапия указанными методами возможна лишь при клиническом и биохимическом контроле крови, а также токсикологических исследованиях биосред (крови, мочи) и диализирующей жидкости.
Алкогольная нефропатия – это хроническое поражение почек воспалительного характера, в основе которого лежат аутоиммунные механизмы, индуцированные воздействием на организм этилового спирта и его метаболитов. Выраженность симптомов зависит от типа патологии, преобладает бессимптомное течение до момента развития признаков хронической почечной недостаточности, при некоторых формах наблюдается прогрессирующая гематурия и гипертензия. Диагностика алкогольной нефропатии производится на основании данных физикального осмотра, лабораторных и функциональных исследований. Лечение включает в себя запрет на прием алкогольных напитков и симптоматическую терапию.
МКБ-10
Общие сведения

Причины
Существует несколько основных теорий развития алкогольной нефропатии, достоверных и однозначных данных в пользу какой-либо из них пока нет. Причины отсутствия консенсуса заключаются в разнообразных клинических и морфологических проявлениях алкогольной нефропатии, что дает основание предполагать наличие нескольких механизмов поражения мочевыделительной системы. Диапазон мнений относительно характера заболевания довольно широкий – от утверждений, что нефропатия является частью алкогольной болезни до предложений разделить АН на несколько сходных по течению патологий с различной этиологией. Наиболее признанными теориями развития данного состояния в современной урологии считаются следующие:
- Иммунологические причины. Существует ряд иммунологических механизмов повреждения тканей почек, которые могут быть связаны с алкогольной интоксикацией. В первую очередь это сенсибилизация к антигенам алкогольного гиалина с выделением иммуноглобулинов А, способных повреждать мембраны нефронов. Похожий механизм – прямое цитотоксическое воздействие этанола и продуктов его метаболизма посредством стимуляции выделения цитокинов.
- Инфекционные причины. Некоторые исследователи полагают, что алкоголь снижает уровень защиты организма от инфекций, включая вирус гепатита С и некоторые бактерии (кишечную палочку). В результате этого наряду с прямым воздействием инфекционных агентов на различные органы-мишени возникает косвенное поражение почек.
- Системные причины. Этанол является системным ядом, при продолжительном употреблении провоцирует повышение артериального давления, поражение печени, ЖКТ, поджелудочной железы, метаболические нарушения (аномалии пуринового обмена). Существует мнение, что эти факторы играют определяющую роль в патогенезе алкогольной нефропатии.
Современные исследователи склоняются к мнению, что развитие АХГН имеет многофакторную природу, в патогенезе большей или меньшей степени участвуют все вышеперечисленные процессы. Неизвестна роль генетической предрасположенности, хотя наличие широкого спектра индивидуальных особенностей заболевания указывает на ее наличие. Факторами риска могут выступать ранее перенесенные патологии почек, сахарный диабет, артериальная гипертензия, однако в подобных случаях дифференцировать алкогольный гломерулонефрит от форм вторичной нефропатии иного типа крайне сложно.
Патогенез
Механизм развития алкогольной нефропатии очень сложен из-за многочисленности патогенетических факторов, влияние каждого из которых сильно различается у разных больных. Именно это дает некоторым исследователям основание полагать, что АХГН – лишь составная часть симптомокомплекса алкогольной болезни. Практически у всех пациентов обнаруживаются антитела IgA против компонентов нефрона, что говорит об аутоиммунном механизме патогенеза. При приеме больших доз этанола последний может прямо стимулировать выделение цитокинов в почках, что приводит к разрушению нефронов.
При систематическом употреблении спиртного метаболиты этанола вызывают повреждение печени, нервной системы, поджелудочной железы, сосудов микроциркуляторного русла. Это косвенно усиливает поражение органов мочевыделительной системы. Увеличение АД, типичное для хронического алкоголизма, само по себе способно привести к вторичной нефропатии. Метаболические сбои, в особенности обмен пуринов, повышают нагрузку на органы выделения и также ведут к нарушению их функций вплоть до хронической недостаточности. Выраженность и скорость развития проявлений АХГН зависит от объемов потребляемого алкоголя – критичной дозировкой считается цифра свыше 35 мл в сутки.
Классификация
Выделяют несколько форм алкогольной нефропатии, разница между ними заключается в клиническом течении, наличии или отсутствии сопутствующих заболеваний. Некоторые типы состояния довольно легко спутать с другими видами вторичной нефропатии из-за схожих проявлений и механизмов патогенеза. Отличительной особенностью АХГН является то обстоятельство, что первопричиной всех патологических изменений в организме, прямо или косвенно ухудшающих работу почек, является злоупотребление алкоголем. Общепризнано существование следующих типов заболевания:
- Латентная форма. Является наиболее распространенной и трудно поддающейся диагностике из-за практически полного отсутствия субъективных симптомов. Возникает не только у людей, постоянно употребляющих спиртные напитки, но и у тех, кто делает это с определенной периодичностью (1-2 раза в неделю). Характерны обострения вскоре после последнего приема алкоголя, проявляющиеся уменьшением функциональной активности почек, что подтверждается лабораторными исследованиями. В патогенезе преобладает роль прямого нефротоксического воздействия этанола.
- Гипертензивная форма. Более редкий тип патологии, в основном возникающий у лиц, страдающих алкоголизмом, ожирением и артериальной гипертензией. Последнее обстоятельство обуславливает трудности различения АХГН этого типа и вторичной гипертензивной нефропатии. Повреждение нефронов происходит при развитии гемодинамических и метаболических нарушений, канальцевого ацидоза.
- Нефротическая форма. Крайне редкая и наиболее тяжелая форма хронической алкогольной нефропатии. Сопровождается прогрессирующим диффузным гломерулонефритом, достаточно быстро приводящим к ХПН. Основное звено патогенеза – резкая сенсибилизация организма и аутоиммунное поражение тканей иммуноглобулинами А.
Некоторые авторы причисляют к алкогольной нефропатии острые состояния, например, острую почечную недостаточность при отравлении спиртными напитками. Несмотря на то, что при этом наиболее ярко проявляется прямая нефротоксическая активность этанола, ОПН при алкогольной интоксикации различается по своему механизму развития от других повреждений почек на фоне АХГН. Поэтому большинство специалистов не рассматривают такое состояние как классическую нефропатию.
Симптомы алкогольной нефропатии
В большинстве случаев болезнь протекает практически бессимптомно, проявления патологии регистрируются случайно при выполнении лабораторных исследований по иному поводу. Это особенно характерно для латентной формы – нередко бессимптомное течение может длиться на протяжении многих лет. Обострения, возникающие на 1-3 сутки после употребления этанола, могут проявляться только жалобами на снижение объема мочи (олигурией) и крайне редко – слабыми тянущими болями в пояснице. При длительном течении на первый план выступают проявления алкогольной болезни: эритема ладоней, гинекомастия у мужчин, симптомы поражения поджелудочной железы и печени (боли в подреберье и животе, желтуха).
Гипертензивный вариант алкогольной нефропатии на начальных этапах развития также характеризуется слабой выраженностью собственно нефрогенных симптомов. Пациент жалуется на головные боли, приливы крови к лицу, неприятные ощущения в области сердца и другие следствия повышенного давления крови. Нередко этот тип заболевания сопровождается ожирением. Для нефротической формы АХГН типично достаточно быстрое течение – обычно после эксцесса возникает олигурия, видимая гематурия, ухудшение общего состояния. Обязательно присутствуют экстраренальные проявления хронической интоксикации этанолом.
При отсутствии лечебных мер и продолжающемся поступлении этилового спирта в организм алкогольная нефропатия неизменно сводится к возникновению ХПН. Ее признаками являются усталость, разбитое состояние, головная боль, усиливающиеся после приема этилового спирта. Затем появляется аммиачный запах изо рта, сильная жажда, рвота, сухость кожи, воспаление слизистых оболочек. Количество выделяемой мочи резко снижается, на поверхности кожных покровов образуется беловатый налет из выделяемой потовыми железами мочевины.
Осложнения
Не всегда удается строго дифференцировать осложнения собственно алкогольной нефропатии и интоксикации этиловым спиртом. При АХГН намного легче возникает алкогольное отравление, сопровождающееся острой почечной недостаточностью с анурией, головной болью, рвотой, отеками и другими признаками уремии. Учитывая прогрессирующий характер состояния, к острому отравлению могут привести ранее привычные дозировки алкоголя, что повышает риск развития осложнения. Грозным и неблагоприятным осложнением может выступать уремическая кома, обусловленная интоксикацией не выведенными через почки продуктами обмена веществ.
Диагностика
Для диагностики алкогольной нефропатии используют методы физикального осмотра, ряд лабораторных анализов и инструментальных исследований. Необходима консультация врача-нефролога, иногда к определению состояния могут подключать нарколога. Обычно алгоритм диагностики АХГН включает следующие этапы:
В редких и спорных случаях производят биопсию печени и почек для гистологического изучения данных органов. При алкогольной нефропатии в печени будут определяться признаки гиалиново-капельной дистрофии, в почках – мезангиопролиферативного нефрита диффузного или очагового характера. Рентгеноконтрастные методы исследования (например, урографию) назначают с осторожностью из-за нефротоксичности большинства контрастных препаратов. Дифференциальный диагноз осуществляют с иными типами первичных и вторичных нефропатий, определяющим фактором часто становится факт наличия длительного злоупотребления алкоголем.
Лечение алкогольной нефропатии
Главным и основополагающим назначением является полный запрет употребления алкогольных напитков. Только при отказе от спиртного более чем у половины больных латентной формой алкогольной нефропатии наблюдается стойкое улучшение лабораторных показателей мочи и почти полная ремиссия. Несоблюдение этого предписания даже при выполнении других рекомендаций и терапевтических мер лишь несколько замедляет прогрессирование состояния. При запущенных случаях АХГН и наличии сопутствующих патологий помимо отказа от спиртных напитков назначают ряд вспомогательных терапевтических мер:
- Антигипертензивная терапия. Снижение артериального давления благотворно влияет на прогноз по причине устранения гемодинамических нарушений в почках. Особенно важен этот компонент лечения при гипертензивных формах нефропатии. При нарушениях работы выделительной системы для снижения давления используют ингибиторы АПФ, блокаторы кальциевых каналов и рецепторов к ангиотензину 2.
- Нормализация метаболизма. Последствием алкогольной интоксикации часто становятся нарушения обмена веществ: пуринов, углеводов, жиров. Посредством специальных диет нужно нормализовать метаболизм и снизить нагрузку на выделительную систему. Особенно пагубно на почки действует нарушение выделения пуринов, поэтому при недостаточной эффективности диетического питания могут назначаться антиподагрические препараты (аллопуринол).
- Противовоспалительные средства. При быстром прогрессировании состояния (нефротическая форма) используют кортикостероидные и цитостатические препараты. Цель их применения – снизить активность воспалительных процессов для уменьшения степени повреждения почек. На сегодняшний день их эффективность критикуется рядом исследователей.
При диагностировании ХПН рекомендуется проведение гемодиализа, частота которого зависит от степени поражения выделительной системы. Вспомогательную роль в лечении алкогольной нефропатии может играть врач-нарколог – с его помощью больному легче избавится от зависимости. Использование фармакологических средств в борьбе с алкоголизмом следует производить с учетом пониженной скорости клубочковой фильтрации.
Прогноз и профилактика
В случае строгого соблюдения запрета на прием алкоголя и раннего выявления патологического состояния прогноз алкогольной нефропатии практически всегда благоприятный – функции выделительной системы восстанавливаются почти в полном объеме. При наличии сопутствующих нарушений, вызванных злоупотреблением спиртосодержащей продукцией, исход патологии зависит от их качественного лечения. При ХПН восстановление нормальной работы почек почти всегда невозможно, но поддерживающее лечение способно сохранить приемлемое качество жизни больного еще на многие годы. Самым неблагоприятным прогнозом обладает сочетание АХГН и тяжелых проявлений алкогольной болезни: цирроза печени, алкогольного панкреатита, кардиомиопатии. Но и в этом случае длительное комплексное лечение может значительно улучшить состояние больного.
1. Морфологические аспекты нефротоксического действия крепких алкогольных напитков/ Бабаханян Р.В., Сафрай А.Е., Шевчук М.К., Ягмуров О.Д.// нефрология.- 1998.
2. Морфофункциональные изменения в мочеполовой системе женщин при алкогольной интоксикации/ Шелудько В.В.// Астраханский медицинский журнал. - 2013.
3. Морфология острых экзогенных нефротоксических воздействий/ Ягмуров О.Д., Петров Л.В.// Нефрология. - 2011.
Токсическая нефропатия — это повреждение гломерулярного аппарата и почечных канальцев, вызванное действием экзо- и эндотоксинов, гемодинамическими и метаболическими нарушениями при отравлениях. Проявляется болями в пояснице, астеническим синдромом, отечностью, олигоанурией, которая впоследствии сменяется полиурией, полиорганными нарушениями. Диагностируется при помощи общего, биохимического анализов крови и мочи, проб Реберга, Зимницкого, УЗИ и томографии почек, УЗДГ почечных сосудов, химико-токсикологических исследований. Лечение включает проведение дезинтоксикационной терапии, инфузионной коррекции нарушений метаболизма, ЗПТ.
МКБ-10
Общие сведения
Токсическая нефропатия — собирательное понятие, объединяющее ряд нефрологических заболеваний со сходным этиопатогенезом и клинической картиной. Распространенность патологии достигает 0,04%, что составляет до 20% всех регистрируемых случаев ОПН. Рост заболеваемости связан со все более широким применением химических веществ на различных производствах и в быту: по наблюдениям, ежегодно до 10 млн. человек постоянно контактирует с нефротоксичными химикатами. Кроме того, обратной стороной успехов фармацевтической отрасли стало появление новых лекарственных средств, оказывающих влияние на почки. Актуальность своевременного выявления токсической формы нефропатий обусловлена высоким уровнем смертности и тяжелыми исходами при необратимой деструкции ткани почек.

Причины
Поражение почечной паренхимы обусловлено воздействием химических веществ, оказывающих прямой или опосредованный нефротоксический эффект. В большинстве случаев ренальную дисфункцию, а в тяжелых случаях и деструкцию тканей, вызывают экзогенные производственные и бытовые яды, хотя у некоторых пациентов заболевание вызвано эндогенной интоксикацией. Специалисты в сфере урологии и нефрологии выделяют следующих группы причин, которые приводят к развитию нефропатии:
- Прием веществ с нефротоксическим эффектом. При попадании в почки ядов этой группы возникают острая гломерулопатия или тубулярный некроз, вызванный реабсорбцией большого количества токсических веществ. Непосредственным повреждающим эффектом на почечную ткань обладают соли тяжелых металлов (кадмия, свинца, ртути, золота, мышьяка, йода, висмута, хрома и др.), этиленгликоль, щавелевая и борная кислоты, бензин, фенол, толуол, орелланиновые грибные токсины, яды некоторых животных.
- Опосредованное токсическое повреждение почек. Отравления веществами с гемолитическим эффектом (уксусной кислотой, мышьяковистым водородом, медным купоросом, змеиным ядом и др.) осложняются закупоркой нефронов гемоглобином. Аналогичное повреждение вызывают массивное размозжение тканей и синдром длительного сдавления, при которых наблюдается миоглобинурия. При токсическом поражении печени ренальная паренхима вторично повреждается ксенобиотиками и эндогенными токсинами.
- Общие клинические проявления отравления. Ряд химических веществ не оказывают прямого нефротоксического эффекта, однако системные проявления, возникающие при их приеме, приводят к тяжелой ренальной дисфункции. Чаще всего токсические формы нефропатии развиваются на фоне отравлений с клиникой шока, некомпенсированного ацидоза, выраженных метаболических расстройств. Такая же ситуация возникает под влиянием эндо- и экзотоксинов патогенной и условно-патогенной микрофлоры.
Постоянное расширение ассортимента медикаментозных препаратов, в первую очередь антибактериальных и противоопухолевых средств, привело к увеличению количества случаев токсической лекарственной нефропатии. По результатам исследований, более чем у 30% пациентов неолигурическая почечная недостаточность связана с приемом фармацевтических препаратов.
Нефротоксичные медикаменты могут прямо повреждать почечные канальцы (аминогликозиды, амфотерицины, иммуноглобулины, НПВС и др.), вызывать их закупорку (сульфаниламиды, циклоспорины, производные пуриновых нуклеозидов), системно нарушать ренальную гемодинамику (β-адреноблокаторы, некоторые диуретики) или оказывать сочетанное действие. Развитие токсической ятрогенной нефропатии также возможно при проведении лучевой терапии.
Патогенез
Механизм развития токсической нефропатии определяется причинами, спровоцировавшими почечную дисфункцию. Патогенез расстройств, вызванных нефротоксинами прямого действия, основан на нарушении биохимических процессов в нефронах, эпителиоцитах проксимальных и дистальных канальцев. После фильтрации клубочками токсическое вещество попадает в канальцевую систему, где вследствие реабсорбции воды его уровень возрастает почти в 100 раз. Возникающий градиент концентрации способствует поступлению и накоплению ксенобиотика в канальцевом эпителии до определенного критического уровня.
В зависимости от типа экзотоксина в эпителиоцитах происходят процессы деструкции клеточных и митохондриальных мембран, лизосом, компонентов цитоплазмы, гладкого эндоплазматического ретикулума, рибосом и т. п. с развитием в наиболее тяжелых случаях острого тубулярного некроза. Некоторые нефротоксины за счет инициации гипериммунных процессов разрушают гломерулярный аппарат коркового слоя. Осаждение в клубочковых структурах иммунных комплексов или образование в мембранах комплексных антигенов с последующей атакой антител провоцируют начало острого гломерулонефрита или интерстициального нефрита без повреждения канальцевых эпителиоцитов. Важным фактором прямой нефротоксичности является способность некоторых веществ стимулировать образование свободных радикалов.
Патогенез опосредованного повреждения почек при закупорке канальцев основан на развитии в их клетках некротических процессов, нарушении реабсорбционной способности. Внутриренальный застой мочи сопровождается ретроградным током гломерулярного фильтрата и последующим повреждением нефронов. При нефропатиях, возникших на фоне общих отравлений, основой патоморфологических изменений обычно становится ишемия клеток и нарушение биохимических процессов за счет кислотно-щелочного и водно-электролитного дисбаланса. На начальном этапе возникает дисфункция эпителиоцитов, которая впоследствии может осложниться токсической дегенерацией и некрозом канальцевого эпителия, деструкцией гломерулярных базальных мембран, интерстициальным отеком.
Классификация
Систематизация форм токсической нефропатии проводится с учетом особенностей этиопатогенеза заболевания и тяжести симптоматики. Такой подход позволяет выработать оптимальную тактику ведения пациента, а в ряде случаев предупредить развитие необратимой деструкции тканей. С учетом этиологического фактора и механизма повреждения почек различают следующие формы заболевания:
- Токсическая специфическая нефропатия. Развивается под влиянием экзогенных и эндогенных веществ с прямыми и опосредованным нефротоксическим эффектом. Отличается быстрым развитием тканевой деструкции, которая у части пациентов является необратимой. Чаще требует раннего начала заместительной почечной терапии.
- Токсическая неспецифическая нефропатия. Осложняет течение отравлений и заболеваний с выраженным интоксикационным синдромом, при которых ведущими становятся гемодинамические и метаболические расстройства. На начальных этапах нарушения носят функциональный характер и лишь позднее начинается разрушение тканей.
При легком течении нефропатия выявляется лабораторно: в клиническом анализе мочи определяется повышенное содержание белка, лейкоцитов, эритроцитов, появляются цилиндры. Средняя степень характеризуется уменьшением количества мочи и нарушением фильтрационной функции с увеличением уровня мочевины, креатинина, калия в сыворотке крови. Для тяжелого течения характерна клиника ОПН, вплоть до наступления уремической комы.
Симптомы токсической нефропатии
Возникают тошнота, рвота, понос. Кожные покровы и видимые слизистые становятся сухими, желтушными. Нарастание почечной недостаточности сопровождается практически полным прекращением мочевыделения, усилением отечности, ее нисходящим распространением на другие отделы тела, появлением петехиальной сыпи. При тяжелых поражениях развивается мозговая симптоматика — вялость, заторможенность, оглушенность, слуховые, зрительные, тактильные галлюцинации, судорожный синдром. Признаки выраженной ренальной дисфункции обычно сохраняются в течение 7-14 суток.
На следующем этапе развития заболевания, длящемся от 10-15 до 30 дней, олигоанурия сменяется постепенным усилением диуреза. Больной выделяет за сутки от 1,8 до 5-8 л и более мочи. Сохраняются слабость, утомляемость, мучительная жажда, уменьшается масса тела. Длительность периода реконвалесценции при интоксикационной нефропатии зависит от объема и характера поражения. Обычно для восстановления функциональной состоятельности органа требуется от 6 месяцев до 2 лет.
Осложнения
В 20-70% случаев токсическая нефропатия завершается летальным исходом из-за массивной необратимой деструкции ренальной паренхимы. Снижение фильтрационной функции у пациентов с ОПН приводит к гиперкалиемии с замедлением сердечного ритма, фибрилляцией и асистолией желудочков. Нарушение работы сердца в сочетании с гипопротеинемией повышает риск развития отека легких.
Длительная уремия сопровождается усиленным выделением азотистых метаболитов через кожу, серозные и слизистые оболочки с развитием уремического перикардита, плеврита, гастрита, энтероколита, ларинготрахеита, токсическим поражением печени, костного мозга. При нарушении секреции компонентов ренин-ангиотензиновой системы возможно развитие артериальной гипертензии. Отдаленными последствиями токсического поражения почек являются хронический тубулоинтерстициальный нефрит, хроническая почечная недостаточность, новообразования органов мочевыделительного тракта.
Диагностика
Постановка диагноза токсической нефропатии обычно не представляет сложности в тех случаях, когда заболевание возникло после отравления химическим веществом. Диагностический поиск направлен на оценку характера, объема возможного повреждения тканей, определение выраженности ренальной дисфункции. Пациентам с нефропатией рекомендованы следующие лабораторно-инструментальные методы исследований:
- Общий анализ мочи. Определяются протеинурия, лейкоцитурия, микрогематурия, цилиндрурия. Относительная плотность мочи в олигоанурической фазе превышает 1030 г/л, в полиурической составляет ниже 1003 г/л. Дополнительное проведение пробы Зимницкого при полиурии выявляет снижение концентрационной функции.
- Биохимический анализ крови. До восстановления объема диуреза повышаются сывороточные уровни креатинина, мочевой кислоты, азота мочевины, калия, кальция, неорганического фосфора. Нарушение фильтрационной способности гломерул также подтверждается результатами нефрологического комплекса и пробы Реберга.
- УЗИ почек. При эхографии нефропатия токсического типа проявляется увеличением размеров почечной паренхимы за счет интерстициального и лимфостатического отека. Участки некроза имеют вид гипоэхогенных полостей или гиперэхогенных включений. УЗДГ ренальных сосудов выявляет гемодинамические нарушения.
- Томография почек. Компьютерная томография почек позволяет получить послойное изображение ренальных тканей и обнаружить даже небольшие участки деструкции. В целях безопасности при токсических поражениях исследование рекомендуется проводить без контраста или заменить его МРТ, хотя в таком случае информативность несколько снижается.
Для подтверждения токсического характера нефрологической патологии по возможности проводятся химико-токсикологические исследования, позволяющие установить химическое вещество, которое вызвало расстройство. Контрастные методы исследований (экскреторная урография, ангиография почек) применяют с осторожностью в связи с риском усугубления клинической ситуации контраст-индуцированными деструктивными процессами. Для контроля за состоянием других органов и систем проводятся биохимические пробы печени, коагулограмма, ЭКГ. Изменения общего анализа крови неспецифичны: могут выявляться анемия, умеренный лейкоцитоз, повышение СОЭ, тромбоцитопения.
Нефропатию токсического происхождения дифференцируют со вторичными нефропатиями другого генеза (контраст-индуцированной, диабетической, дисметаболической и др.), острым гломерулонефритом, ишемическим некрозом почек, травматическими повреждениями почечной паренхимы, атероэмболической болезнью. По назначению уролога-нефролога пациента консультируют токсиколог, анестезиолог-реаниматолог, невролог, терапевт, кардиолог, пульмонолог, гепатолог.
Лечение токсической нефропатии
Больных, почки которых повреждены в результате отравления экзо- или эндотоксинами, госпитализируют в палату интенсивной терапии. Основными терапевтическими задачами являются скорейшая элиминация химического вещества, коррекция метаболических расстройств, предупреждение возможных осложнений. С учетом этапа заболевания пациентам показаны:
- Дезинтоксикационная терапия. Проводится в первые часы и сутки после отравления. Для ускоренного выведения токсина проводят промывание желудка, форсированный диурез с назначением осмотических мочегонных и салуретиков, используют адсорбенты, слабительные средства, специфические антидоты. В сложных случаях эффективны плазмаферез, гемосорбция, гемофильтрация, ультрафильтрация, гемодиализ, перитонеальный диализ. Некоторым пациентам назначают переливание крови и ее компонентов.
- Инфузионная коррекция метаболических нарушений. Начинается сразу после госпитализации и продолжается в олигоанурическом периоде ОПН. Для восстановления электролитного баланса и кислотно-щелочного равновесия применяют антагонисты калия (обычно — препараты кальция), инфузию глюкозы с инсулином, ощелачивающие полиионные растворы. Возможен дальнейший прием энтеросорбентов, связывающих токсические метаболиты. При значительной ренальной дисфункции оправдано проведение ЗПТ.
При утяжелении состояния больного проводится комплексная противошоковая терапия, купируются неотложные состояния (уремическая кома, отек легких, судорожный синдром, гипертонический криз). В полиурической фазе продолжается массивная (до 5-6 л/сут) инфузионная терапия для поддержания ОЦК и физиологической концентрации метаболитов. На этапе восстановления проводится общеукрепляющее лечение и определяется тактика дальнейшего ведения пациента с учетом степени сохранности почечных функций.
Прогноз и профилактика
Токсическая нефропатия — тяжелое, прогностически неблагоприятное расстройство с высокими показателями летальности. Своевременное установление токсина, правильная оценка морфологической сохранности и функциональной состоятельности почечной паренхимы, проведение адекватной интенсивной терапии повышают шансы благоприятного исхода нефропатии. Профилактика заболевания направлена на предупреждение попадания в организм токсических веществ: ограничение времени контакта с нефротоксичными ядами, использование средств индивидуальной защиты (респираторов, защитной одежды), отказ от употребления в пищу незнакомых грибов.
Работникам предприятий с вредными условиями производства рекомендовано прохождение профилактических медосмотров для раннего выявления почечной дисфункции. Для снижения количества случаев гемодинамического и метаболического поражения почечных клеток при системных нарушениях пациентам с отравлениями рекомендован регулярный контроль функциональной состоятельности почек и адекватное купирование острого состояния. С учетом роста распространенности лекарственных нефропатий при назначении нефротоксичных лекарственных средств необходимо тщательное обследование пациента для выявления предпосылок к токсическому повреждению ренальной паренхимы.
2. Патогенез токсических нефропатий/ Гоженко А.И. // Актуальные проблемы транспортной медицины. — 2006 — № 2.
3. Клинико-морфологические изменения при токсической нефропатии, вызванной отравлением некоторыми спиртсодержащими жидкостями: Автореферат диссертации/ Морозов В.И. – 1996.
4. Механизмы хронической токсической нефропатии у рабочих химической промышленности: Автореферат диссертации/ Письменский А.В. – 2006.
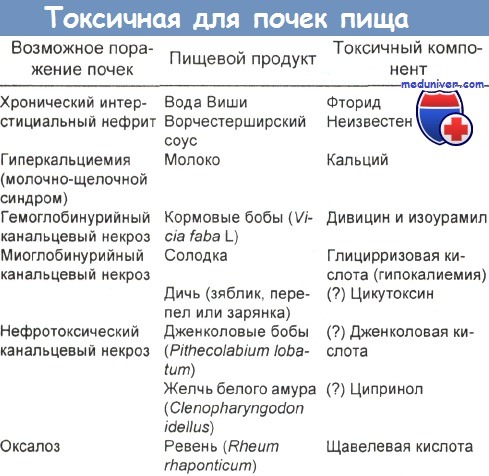
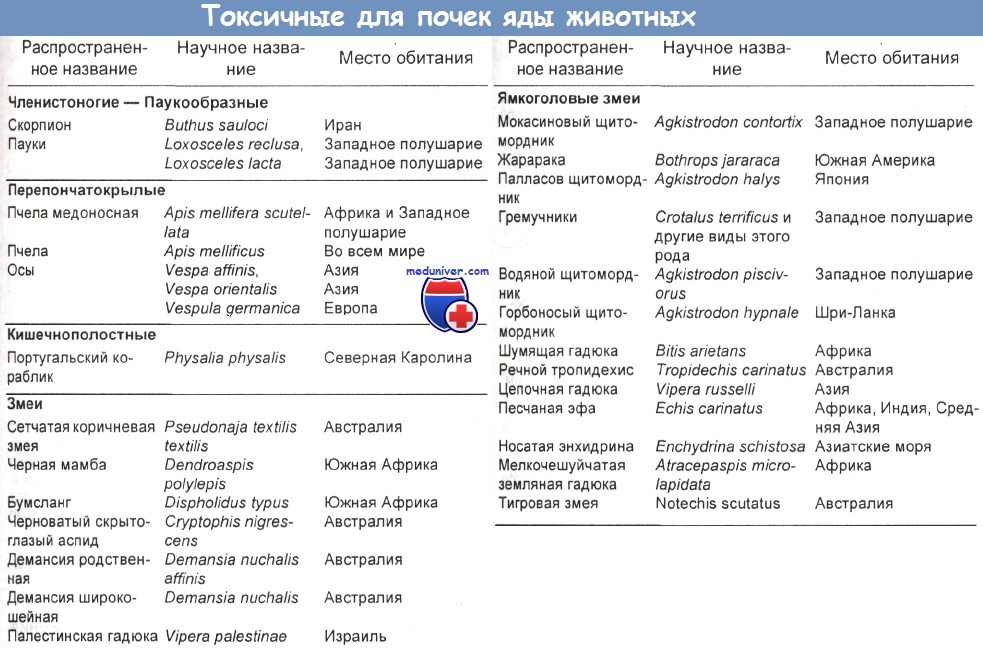
Поражение почек при отравлении - нефроктосичные яды
Подробный обзор потенциально нефротоксичных химикатов, пищевых продуктов, растений и животных ядов можно найти в работе Abuelo. Вдыхаемые, поглощаемые кожей и перорально попадающие в организм нефротоксичные химикаты приведены в таблице ниже.
Вдыхание или поглощение кожей нефротоксинов
| Возможные поражения почек | Химические вещества |
| Хронический интерстициальный нефрит | Уайтспирит |
| Гломерулонефрит | Углеводороды или силикон |
| Острый гемоглобинурийный канальцевый некроз | Газ арсин |
| Острый миоглобинурийный канальцевый некроз | Угарный газ |
| Псевдоазотемия | Ацетон (загрязняющий ацетилен) |
| Острая нефротоксическая почечная недостаточность | Борная кислота, кадмий, четыреххлористый углерод, хром, диэтиленгликоль, 1,2-дихлорпропан, дизельное топливо, диоксан, динамит, этилендибромид, бензин, лизол (британский), газообразный метилхлорид или метилбромид, метиленхлорид, фенол, полиэтиленгликоль, повидон-йод, тетрахлорэтилен,толуол,трихлорэтилен. |
Заглатывание нефротоксичных веществ
| Возможные поражения почек | Химические вещества |
| Хронический тубулоинтерстициальный нефрит | Кадмий, фторид, свинец |
| Гемоглобинурийный канальцевый некроз | Анилин, хлоратные соединения, сульфат меди, крезол, этиленгликольдинитрат, лизол (британский), нафталин, b-фенилендиамин, бромат калия или натрия, пропиленгликоль |
| Миоглобинурийный канальцевый некроз | Сульфат меди, линдан, хлорид ртути, р-фенилендиамин, фосфид цинка |
| Нефротоксический канальцевый некроз | Соли мышьяка, хлорид бария, четыреххлористый углерод, хлордан, хлороформ, 2,4-дихлорфеноксиуксусная и метилхлорфеноксиуксусная кислоты, соединения хрома, дикват, этилендихлорид, этилендибромид, соединения германия, соли ртути, метиленхлорид, щавелевая кислота, паракват, винная кислота, таллий, тетрахлорэтилен, трихлорэтилен, скипидар, желтый фосфор |
| Оксалоз | Диэтиленгликоль, этиленгликоль, этиленгликольбутиловый эфир |
| Псевдоазотемия | Изопропиловый спирт |
Нефротоксичные пищевые продукты и растения, а также животные, обладающие потенциально нефротоксичными ядами, — представлены ниже.

Лекарства, которые в слишком высоких дозах, назначенных врачом или принятых по ошибке больным, приводят к поражению почек, перечислены ниже. Гемолитикоуремический синдром связан с применением циклоспорина, противораковых средств (например, митомицина), тиклопидина и хинина.
Токсичные для почек лекарства
| Поражение почек | Вещество | Обстоятельства применения |
| Острый интерстициальный нефрит | Хлорпротиксен | Суицид |
| Острый канальцевый некроз | Ацетаминофен Аспирин Борная кислота Соли висмута Колхицин Свинец Номифензин Масло кудрявой мяты Паральдегид Триамтерен Уран | Суицид Суицид Опрелость От бородавок Суицид По незнанию введение вместе с опием Суицид Несостоявшийся аборт Передозировка Суицид Клиническое исследование |
| Хронический гломерулонефрит (героиновая нефропатия) | Героин Пентазоцин | Наркомания Наркомания |
| Хронический интерстициальный нефрит (аналгезическая нефропатия) | Нестероидные противовоспалительные средства | Злоупотребление анальгетиками |
| Гиперкальциемия | Витамин А Витамин D | Лечение акне Гипопаратиреоз и метаболическая остеопатия |
| Миоглобинурийный канальцевый некроз | Амоксапин Амфетамины Барбитураты Кокаин Диазепам Доксепина гидрохлорид или нитразепам Алкоголь Глютетимид Героин Метадон Фенциклидина гидрохлорид Фенилпропаноламина гидрохлорид Стрихнин | Суицид Передозировка Передозировка Передозировка Передозировка Суицид Алкоголизм Передозировка Передозировка Передозировка Передозировка Похудание, передозировка Ошибочное употребление вместо кокаина |
| Некротизирующий васкулит | Метамфетамин | Передозировка |
| Закупорка (камни) | Магниевый антацид | Злоупотребление антацидом |
| Осмотический нефроз | Маннитол | Передозировка |
| Оксалоз | Витамин С внутривенно | Передозировка |
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Поражение почек при отравлении ртутью
Почки при отравлении ртутью:
- Поражения почек. Нефротоксичность, обусловленная воздействием ртути, может проявляться или как острый некроз канальцев, или как иммунный комплексный гломерулонефрит. Нефротический синдром бывает вторичным относительно мембранозного гломерулонефрита (МГН). Комплемент-тесты (С3, С4, СН50) нормальны. Титр антинуклеарных антигенов (AHA) и титры LE в норме. Почечные венограммы и внутривенные пиелограммы нормальны. Моча иногда содержит овальные жировые тельца, жировые и гиалиновые цилиндры.
- Этиология. Развитие МГН наблюдалось после применения зубных порошков, содержащих ртуть, которые давали детям; осветляющих кожу кремов, применяемых чернокожими африканками, и ртутно-аммиачных мазей от псориаза. Такие поражения были также описаны после профессиональной экспозиции к ртути. В случаях нефротического синдрома, обусловленного металлическими загрязнителями, целесообразно исследовать неокрашенный материал с помощью электронной микроскопии и биопсийный материал с элементарным анализом.
- Почечная функция. Почки обладают выраженной способностью концентрировать ртуть. Этот орган всегда поражается после экспозиции к ртути. Способность солей ртути (например, ее хлорида) вызывать сильное повреждение почечных канальцев убедительно удостоверена документально. Данные о том, что экспозиция человека к парам металлической ртути вызывает поражение почек, менее убедительны.
По результатам исследования с участием рабочих химических предприятий, подвергавшихся воздействию неорганической ртути, повышенные уровни ртути в моче коррелировали с чрезмерными нейропсихологическими симптомами, повышенным уровнем в моче N-ацетил-бетa-D-гликозаминидазы (лизосомный фермент, присутствующий в клетках почечных канальцев) и пониженными средними скоростями проведения по двигательным нейронам; не выявлено никакой корреляции между уровнем ртути в моче и показаниями нейроповеденческих тестов, судорожными движениями глаз или помутнением хрусталика.
- Протеинурия. Существует 2 типа протеинурии, обусловленных отравлением ртутью, — клубочковая и канальцевая. Клубочковая протеинурия характеризуется вытеканием сывороточных белков (преимущественно с высокой молекулярной массой) через поврежденные клубочки, и предполагается, что это идиосинкразический иммунно-комплексный гломерулонефрит. Канальцевая протеинурия включает разнообразные белки и ферменты.
Многие из этих маркеров — белки с низкой молекулярной массой (например, b2-микроглобулин и белок, связывающий ретинол), обычно фильтрующиеся через клубочки и затем реабсорбирующиеся в проксимальных канальцах. Другие (например, NАГ) выделяются из пораженных клеток проксимальных канальцев прямо в мочу. Канальцевая протеинурия может быть более чувствительным маркером ртутной интоксикации. Повышенные уровни NАГ могут в большей степени отражать недавнюю активность нарушенного процесса, чем острую токсичность. Повышенное содержание в моче b2-микроглобулина (b2-М) может быть более показательным для хронической токсичности, чем для острой. Кроме того, поскольку они свободно фильтруются, содержащиеся в моче b2-М более чувствительны к сывороточным концентрациям.
Концентрации b2-М в сыворотке плохо коррелируют с количественными показателями экспозиции к ртути.
- Аналитические методы. Сывороточные белки с низкой молекулярной массой определяют методом электрофореза в акриламидном геле. Экскреция b2-микроглобулина измеряют специфическим методом радиоиммуноанализа.
- NАГ (N-ацетил-бета-D-гликозаминидаза). Несмотря на повышенное содержание ртути в крови и моче, показания рутинных клинических анализов, таких как объективное обследование, анализ крови и мочи, обычно нормальны. Более чувствительными показателями токсичности могут быть оценка нейропсихологических симптомов, повышенный уровень N-ацетил-беTa-D-гликозаминидазы (NАГ) в моче, пониженная скорость проведения двигательных нейронов и выявление помутнений хрусталика при обследовании с помощью щелевой лампы.
- Лабораторные данные. Концентрация ртути в моче, превышающая 150 мкг/л, — это уровень проявления ранних неврологических симптомов у взрослых. Он может соответствовать средневзвешенной во времени концентрации за 8 ч или концентрации паров элементарной ртути, равной 50 мкг/м3. По рекомендации Агентства охраны окружающей среды (США), концентрация ртути в окружающем нас воздухе должна быть ниже 1 мкг/м3.
- Хлорид ртути. Постоянный прием слабительных средств, содержащих хлорид ртути (например, 240 мг хлорида ртути в течение 6 или более лет), может привести к появлению многих классических признаков и симптомов отравления неорганической ртутью, включая такие, как эретизм (необычная робость, потеря памяти, рассеянное внимание, снижение интеллекта) и мелкое дрожание рук или мышц лица. Кроме того, могут наблюдаться интенционный тремор, миоклонические судороги, слабость, гипорефлексия и глухота, отмечаемые как при отравлении двухвалентной, так и одновалентной ртутью.

Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Читайте также:

