Может ли при дисбактериозе быть жжение в кишечнике
Обновлено: 23.04.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Диcбактериоз: причины появления, симптомы, диагностика и способы лечения.
Определение
Дисбактериоз, или дисбиоз – это качественное и количественное изменение микрофлоры в организме. Для него характерно увеличение или резкое уменьшение бактерий, снижение их разнообразия. Дисбактериоз может возникнуть на любом участке, где присутствуют бактерии, включая кожу, влагалище, ротовую полость и т.д.
Микрофлора играет важную роль в поддержании работы иммунной системы, но существует и обратная связь – при серьезном снижении иммунитета возникает дисбактериоз.
Причины появления дисбактериоза
В кишечнике человека присутствует от 70 до 80% клеток иммунной системы. Поэтому любая нестабильность кишечной микрофлоры может нарушить естественные защитные механизмы организма, настроенные против болезней и недомоганий.
Дисбактериоз кишечника связан не только с кишечными расстройствами, но и с множеством других состояний, на первый взгляд не относящихся к пищеварению, – кожными проблемами (акне, экзема), неврологическими расстройствами и т.д.
Среди причин развития дисбактериоза отмечают:
- Увеличение числа болезнетворных бактерий и дрожжевых грибов (например, кандида) и недостаток полезных микроорганизмов.
- Проникновение микроорганизмов, в норме находящихся в толстом отделе кишечника, в тонкий кишечник. Это происходит при хронических заболеваниях, характеризующихся поражением слизистой оболочки желудочно-кишечного тракта (болезнь Крона или неспецифический язвенный колит).
- К другим факторам врачи относят генетическую предрасположенность, несбалансированное питание с низким содержанием клетчатки, но с высоким содержанием сахара и обработанных продуктов, физический и психологический стресс, чрезмерное потребление алкоголя, частое применение антибактериальных препаратов и средств от изжоги, плохую гигиену полости рта.
- Дисбактериоз у практически здоровых лиц:
- возрастной дисбактериоз – изменения микрофлоры у людей пожилого возраста;
- сезонный дисбактериоз – изменения микрофлоры в холодное время года;
- нутритивный дисбактериоз – связанный с несбалансированным питанием;
- профессиональный дисбактериоз – при различных профессиональных вредностях.
- Дисбактериоз, сопровождающий различные заболевания органов пищеварения (желудка, поджелудочной железы, печени и желчевыводящих путей, кишечника, при синдроме мальабсорбции (нарушенном всасывании питательных веществ)).
- Дисбактериоз при других заболеваниях:
- инфекционных,
- иммунодефицитных,
- при гипо- и авитаминозах (уменьшенном поступлении в организм или плохой усвояемости необходимых витаминов),
- при интоксикациях и воздействии на организм человека радионуклидов (радиоактивных изотопов, которые можно встретить в местах с повышенным радиационным фоном, в ограниченном количестве и под строгим контролем они используются для диагностики и лечения некоторых заболеваний).
- Лекарственный дисбактериоз. Возникает вследствие приема антибиотиков, иммунодепрессантов, антацидов, антисекреторных, слабительных средств, химиотерапии и других лекарственных препаратов.
- Стрессорный дисбактериоз. Возникает как результат длительного эмоционального или физического стресса.
- Бессимптомная форма дисбактериоза.
- Локальная, или местная форма дисбактериоза. Наблюдается при развитии локального воспалительного процесса в кишечнике (у больного появляются симптомы колита или энтерита – воспалительных заболеваний толстого или тонкого кишечника).
- Распространенная форма дисбактериоза. Проявляется выраженными нарушениями пищеварения.
- 1-я степень тяжести;
- 2-я степень тяжести;
- 3-я степень тяжести;
- 4-я степень тяжести.
- участвует в пищеварении, способствуя переработке пищи и лучшему усвоению питательных веществ;
- стимулирует рост клеток кишечной стенки – энтероцитов;
- поддерживает иммунитет в активном состоянии;
- не допускает роста опасных микроорганизмов, способных вызвать воспаление и инфекционный процесс;
- контролирует метаболические процессы, энергетический и жировой обмены;
- синтезирует биологически активные вещества, участвующие в гормональной и нейрорегуляции.
- острый и хронический стресс;
- чрезмерная физическая нагрузка;
- неблагоприятные экологические условия, вредные производственные факторы;
- генетическая предрасположенность;
- иммунодефицитные состояния;
- беременность и гормональный дисбаланс, например, гиперандрогения у женщин;
- нарушение биоритмов, акклиматизация;
- активный прием антибиотиков, цитостатиков, сульфаниламидов, заместительная гормональная терапия;
- травмы и воспалительные заболевания, сопровождающиеся активацией иммунитета.
- присутствие в пище разного рода химических добавок – солей натрия и сернистой кислоты, наночастиц металлов и антибиотиков;
- голодание либо резкое изменение рациона, обилие в нем животных жиров и белков, сахара, крахмала, недостаток клетчатки, витаминов и минеральных веществ;
- инфекционные процессы, глистная инвазия в кишечнике;
- снижение пищеварительной функции внутренних органов при панкреатите, гепатите, гастрите и других заболеваниях;
- нарушение моторики кишечника;
- хирургические вмешательства на органах ЖКТ.
- кожи;
- половых органов;
- мочевыделительных путей;
- ротовой полости;
- органов дыхания.
- I степень — недостаток представителей нормальной микрофлоры;
- II степень — преобладание условно-патогенных микроорганизмов;
- III степень — присоединение патогенной флоры.
- Латентный дисбиоз. Клинические проявления патологии отсутствуют. Нарушение микрофлоры выявляется только по результатам анализов.
- Локальная или местная форма дисбиоза. Сопровождается симптоматикой колита или энтероколита.
- Стадия развития осложнений. Появляются признаки инсулинорезистентности, нейровегетативных нарушений, хронического колита, дерматита и вагинита.
- Диспепсический синдром – расстройство стула, иногда с чередованием запора и диареи, метеоризм, вздутие живота, отрыжка и неприятный привкус во рту, урчание в кишечнике.
- Повышенная чувствительность к определенной пище, в особенности к злакам и молочным продуктам, а также аллергическая реакция на переносимые ранее продукты. Наиболее часто встречается при дисбактериозе у детей. Проявления могут быть различными: крапивница, кожный зуд, приступы удушья, ангионевротический отек, жидкий пенящийся стул, резкая боль в животе, тошнота вплоть до рвоты, понижение артериального давления.
- Синдром мальабсорбции – нарушение всасывания питательных веществ проявляется их недостаточностью в организме. Развивается симптоматика белково-энергетической недостаточности, гиповитаминозов, преимущественно витаминов группы В, анемии, нарушения ионного баланса, дефицита кальция.
- Интоксикационный синдром. Характерны слабость, снижение аппетита, повышение температуры тела, головная боль.
- Частые ОРЗ, ОРВИ, обострения герпетической инфекции, грибковые заболевания вследствие снижения иммунитета.
- нейропсихические расстройства: депрессия, болезнь Альцгеймера, рассеянный склероз, шизофрения, аутизм, болезнь Паркинсона;
- инсулинорезистентность, дислипидемия, ожирение, сахарный диабет 2 типа, артериальная гипертензия, жировой гепатоз печени;
- аутоиммунные патологии: сахарный диабет I типа, ревматоидный артрит, системная красная волчанка, первичный склерозирующий холангит;
- аллергические заболевания: бронхиальная астма, атопический дерматит, аллергия на пищевые продукты;
- системные воспаления: болезнь Крона, неспецифический язвенный колит, синдром раздраженного кишечника, целиакия и колоректальный рак;
- заражение венерическими заболеваниями, в том числе ВИЧ-инфекцией;
- при генитальном дисбактериозе во время беременности – преждевременные роды;
- сердечно-сосудистые заболевания вследствие активации патогенных бактерий пародонта, способствующих атеросклеротическим процессам и развитию ИБС;
- аденокарцинома и плоскоклеточный рак пищевода при дисбактериозе полости рта.
- острой и жареной пищи, копченых деликатесов;
- продуктов, насыщенных сахарами;
- быстроусвояемых углеводов;
- яблок, бананов, винограда;
- а также ограничение молочных продуктов.
- Противомикробных средств синтетического происхождения – кишечных антисептиков.
- Пробиотиков. Это готовые лакто-бифидопробиотики в дозах свыше 10 9 в одной капсуле.
- Пребиотиков. Представляют собой вещества, способствующие росту и размножению полезной флоры.
- Синбиотиков. Комплексные препараты, содержащие как сами микроорганизмы, так и необходимые для их развития компоненты.
- Бактериофагов. Эффективны для борьбы с инфекцией при второй степени дисбаланса микрофлоры. Метод лечения чаще используют при дисбактериозе у грудничка, когда противопоказано применение антибиотиков.
- Иммуномодуляторов. Применяются для восстановления иммунитета.
- Антибиотиков. Назначаются при распространенной форме дисбактериоза – в случае выраженных симптомов интоксикации, продолжительной диареи, тяжелого иммунодефицита и лабораторно-подтвержденного дисбиоза третьей степени.
- устранение избыточного бактериального обсеменения тонкой кишки;
- восстановление нормальной микробной флоры толстой кишки;
- улучшение кишечного пищеварения и всасывания;
- восстановление нарушенной моторики кишечника;
- стимулирование реактивности организма.
- Контроль структурной и функциональной целостности клеточного состава толстой кишки и всего организма.
- Модулирует распознавание и уничтожение собственных мутантных, в том числе и опухолевых клеток, а также вторгшихся микроорганизмов и образуемых ими токсических веществ, способных нарушить генетический гомеостаз.
- Продукция медиаторов межклеточного взаимодействия:
- снижение секреции провоспалительных цитокинов, таких как фактор некроза опухоли альфа, оксид азота, гамма-интерферон, интерлейкины ИЛ-2, ИЛ-1;
- стимулирование высвобождения противовоспалительного цитокина ИЛ-10 из моноцитов.
- Ингибирование адгезии эндотелиальных лейкоцитов посредством модуляции экспрессии ФМА-1 и МАСЭ-1 и активации макрофагального ядерного фактора NF-каппа-би.
- Уменьшает гамма-интерферон-индуцируемое высвобождение белка-10 в субэпителиальных миофибробластах кишечника человека.
- Снижает кишечную продукцию СЛК-зависимого ИЛ-8 и кишечную экспрессию Toll-подобного рецептора 4, который считается важным компонентом врожденного иммунитета и который, при избыточной продукции, приводит к проявлению воспалительных заболеваний кишечника.
- Антихеликобактерная терапия сопровождается развитием антибиотико-ассоциированных нарушений кишечной микрофлоры у большинства пациентов.
- Назначение препарата Закофальк® снижает риск развития осложнений антихеликобактерной терапии; способствует улучшению показателей собственно эрадикации.
- Эффект препарата Закофальк® проявляется клиническим улучшением, нормализацией состава микрофлоры кишечника, а также восстановлением ее метаболической активности.
- Включение препарата Закофальк® позволяет существенно потенцировать противовоспалительный эффект эрадикационной терапии.
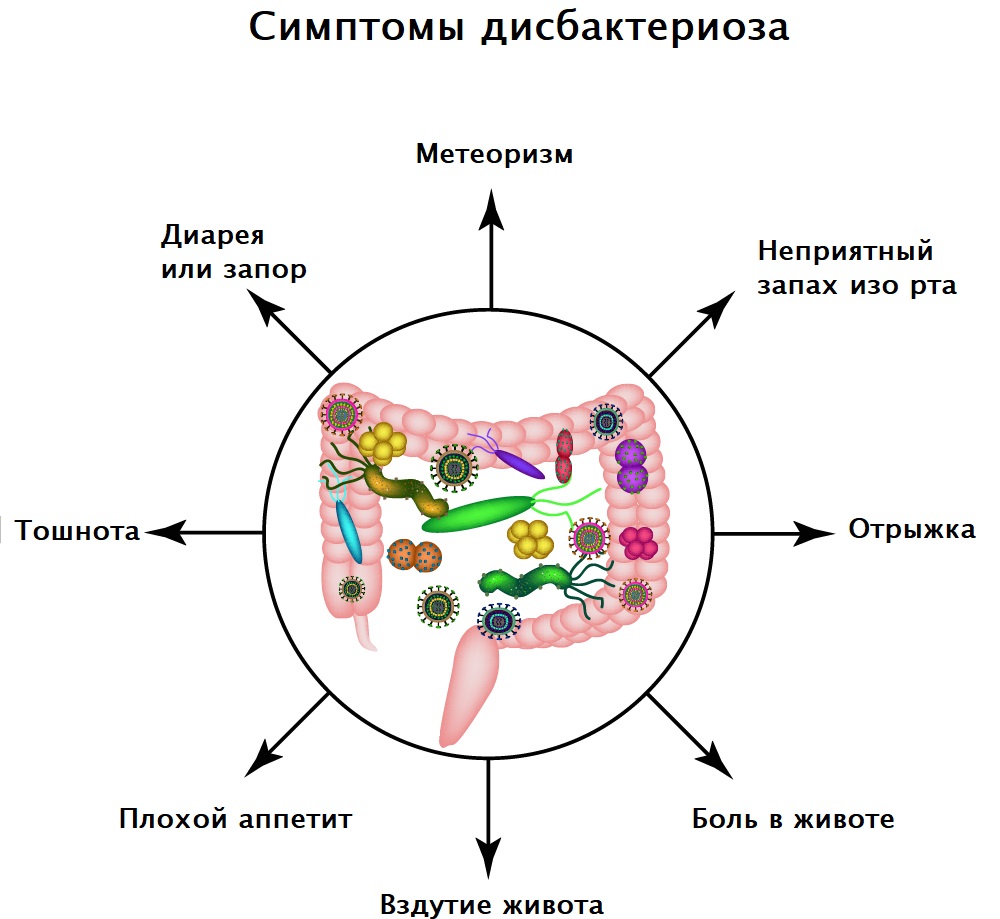
Симптомы дисбактериоза зависят от формы и степени тяжести течения заболевания. Пациенты могут предъявлять жалобы на расстройство желудка, тошноту, диарею или запор, повышенное газообразование и вздутие живота, снижение аппетита, необъяснимую усталость и проблемы с концентрацией внимания, неприятный запах изо рта, высыпания на коже.
Диагностика заболевания
При постановке диагноза врач обращает внимание на жалобы, симптомы заболевания и результаты осмотра. Но для оценки степени тяжести дисбактериоза обычно требуются лабораторные и инструментальные обследования.
-
Клинический анализ крови с развернутой лейкоцитарной формулой.
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.

В результате негативного изменения баланса и состава микроорганизмов, обитающих в кишечнике, возникает его дисбактериоз. Причинами данного синдрома могут быть чрезмерное и неправильное применение антибиотиков, ослабление иммунитета, нарушение режима питания, размножение в кишечнике вредоносных и условно-патогенных микроорганизмов (таких как золотистый стафилококк, грибки рода Candida, сальмонелла, стрептококк и другие). Также дисбактериоз возникает вследствие глистной инвазии, развития заболеваний желудочно-кишечного тракта, операций, совершенных на ЖКТ, и его врожденных пороков, длительных психических и физических стрессов.
Проявления кишечного дисбактериоза на разных его стадиях
Различают несколько этапов развития этого синдрома. Если с данной патологией не бороться, она будет усугубляться, и на каждой из ее стадий проявятся определенные симптомы.
На первом, начальном этапе этого синдрома происходят незначительные нарушения баланса и состава кишечной микрофлоры, чаще всего вследствие начала применения антибактериальных средств, а также в результате изменения привычной пищи или питья. На этой стадии признаки дисбактериоза выражены слабо. К ним относятся урчание в брюшной полости, ощущение в ней некоторого дискомфорта и незначительный метеоризм. Если организм адаптируется к изменению питания, либо прекращается применение антибиотиков, то оптимальный баланс кишечных микроорганизмов восстанавливается самостоятельно.
Следующая, вторая стадия дисбактериоза кишечника характеризуется более выраженными его проявлениями. К ним относятся тошнота, рвота, неприятные запах и вкус в ротовой полости, изжога, отрыжка, вздутие живота, нарушения дефекации (частый стул, понос, запор). Могут возникнуть аллергические реакции на обычные продукты питания. Иногда незначительно повышается температура тела. Данные симптомы дисбактериоза легко спутать с проявлениями другого развивающегося в ЖКТ заболевания. Поэтому требуется обратиться к врачу для постановки точного диагноза и назначения средств терапии бактериального дисбаланса кишечника.
На третьем этапе развития синдрома к вышеперечисленным его проявлениям добавляются острые боли в брюшной полости. Урчание в животе и диарея усиливаются. В кале содержатся частицы неусвоенной пищи. В такой ситуации требуется срочное и интенсивное лечение дисбактериоза, ведь организм ослаблен длительным и непрерывным воздействием на стенки желудка и на кишечник большого количества вредоносных микроорганизмов.
Если дисбактериоз не лечить или терапия недостаточна, развивается его четвертая стадия, особо опасная. На данном этапе болезнетворные микроорганизмы практически вытесняют полезную микрофлору. Это вызывает развитие таких патологий и синдромов, как гиповитаминоз, депрессия, кишечные заболевания, снижение иммунитета, истощение и обезвоживание организма, значительная потеря веса. Возникает угроза не только здоровью, но и жизни человека.
Успешное лечение дисбактериоза обусловлено устранением причин, вызвавших данный синдром, например, болезней ЖКТ или неправильного питания. Применение медикаментозных препаратов направлено на подавление вредоносных бактерий и уменьшение до необходимого минимума количества условно-патогенных микроорганизмов. На всех стадиях развития этого синдрома весьма эффективно применение пре- и пробиотиков, восстанавливающих баланс и оптимальный состав кишечной микрофлоры.
Дисбактериоз – качественное и количественное изменение микрофлоры в организме на любом его участке, включая кожные покровы, кишечник, полость рта, влагалище и другие области, населяемые микроорганизмами. Патология встречается при многих заболеваниях, длительном или неконтролируемом употреблении антибиотиков и иммунодепрессантов, развивается под влиянием вредных факторов окружающей среды.
Состояние опасно сопутствующим снижением иммунитета, нарушением барьерной функции кожи и слизистых оболочек, через которые патогенная флора проникает во внутренние органы.
Роль микробиоты в организме
Микробиота – это экосистема, внутри которой уживаются более семи тысяч видов микроорганизмов, включая бактерии, вирусы, бактериофаги, простейшие, археи и грибы. Они живут на кожных покровах, слизистых оболочках, в пищеварительном тракте и играют важную роль в поддержании иммунитета.
При снижении количества полезных микроорганизмов, таких как бифидо- и лактобактерии, кишечная палочка и других, занимаемые ими ранее участки активно заселяют патогенные бактерии – преимущественно пептококки, грибы рода Кандида, стафилококки и клостридии.
Причины дисбиоза
Дисбактериоз никогда не возникает первично, он развивается вследствие дисфункции органов и систем либо под действием медикаментов и химических веществ, отрицательно влияющих на микроорганизмы.
Одна из причин кожного дисбактериоза – чрезмерная гигиена, применение агрессивных уходовых средств, смывающих защитный водно-жировой слой с эпителия.
Классификация дисбактериоза
Также, в зависимости от длительности процесса и выраженности симптомов, выделяют острый и хронический дисбактериоз.
Кишечный дисбактериоз протекает в три стадии:
Симптомы нарушенной микрофлоры
Проявления дисбактериоза кишечника у взрослых зависят от пола пациента. У женщин болезненные ощущения в животе усиливаются перед менструацией. Наблюдается повышенная активность сальных желез, на лице и на теле появляются высыпания. Слизистая оболочка влагалища раздражается, больную беспокоит зуд и жжение вульвы. Кожа становится сухой, дряблой и шелушится. Дисбактериоз кишечника у мужчин сопровождается ухудшением потенции, проблемами с мочеиспусканием.
По мере прогрессирования дисбактериоза присоединяются и симптомы осложнений.
При нейропсихическом расстройстве появляются слабость, апатия, тревожность, пониженное настроение, снижение концентрации внимания и стрессоустойчивости, навязчивые мысли, судороги.
Для инсулинорезистентности характерны прибавка в весе, высокая концентрация глюкозы и липидов крови, ощущение тяжести в правом подреберье. При генерализованной воспалительной или аутоиммунной реакции возможно появление боли в суставах, сыпи на коже, примеси слизи либо крови в испражнениях, повышения температуры тела, озноба, быстрой утомляемости.
Для кожного дисбиоза характерны сыпь на теле, дряблость, краснота, зуд, сухость либо избыточная жирность кожных покровов. При дисбактериозе влагалища проявляются молочница – творожистые выделения белого цвета, жжение и зуд в области наружных половых органов. При дисбалансе флоры ротовой полости прогрессируют стоматит, пародонтоз и кариес, ощущаются неприятный привкус и запах изо рта, появляется белый налет на языке.
Осложнения дисбиоза
Диагностика дисбактериоза
-
. Обращают внимание на признаки анемии, уровень лейкоцитов в крови и их распределение по видам. . Выполняется для определения степени выраженности интоксикации и нарушения обмена веществ вследствие их неправильного всасывания в кишечнике. . Оценка физических и химических свойств кала, а также разнообразных компонентов и включений различного происхождения – копрограмма. . Бактериологический посев – это биологическое исследование испражнений с целью определения состава и количества микроорганизмов, обитающих в пищеварительном тракте человека. Также проводится биохимический анализ кала на предмет маркеров дисбиоза, таких как метаболиты летучих жирных кислот, производимых микроорганизмами. . Визуальная оценка состояния органов пищеварения. . Проводится преимущественно детям перед назначением соответствующего лечения.
Лечение дисбактериоза
Полезными для микрофлоры считаются продукты, обогащенные клетчаткой – цельнозерновая выпечка, крупы, за исключением белого риса, овощи, листовая зелень и сушеные фрукты. Рекомендована также кисломолочная продукция, содержащая пребиотики и стимулирующая рост полезной микрофлоры.
Также применяются средства патогенетической терапии для восстановления моторики кишечника, уменьшения воспаления и восстановления ферментной активности органов пищеварения. Для облегчения проявлений диареи, боли в животе, метеоризма назначаются препараты симптоматической терапии.
Профилактика
Профилактика дисбактериоза включает сбалансированное питание, активный образ жизни, минимизацию стрессов и факторов, способных спровоцировать кишечное расстройство и дисбаланс микрофлоры.
Для предотвращения нарушения микрофлоры у новорожденных рекомендуется отдавать предпочтение естественному родоразрешению и грудному вскармливанию.
Что понимают под дисбактериозом? Какие методы диагностики являются современными и достоверными? Какие лекарственные препараты применяются при дисбактериозе? Вкишечнике человека находится свыше 500 различных видов микробов, общее количество которых
Что понимают под дисбактериозом?
Какие методы диагностики являются современными и достоверными?
Какие лекарственные препараты применяются при дисбактериозе?
Вкишечнике человека находится свыше 500 различных видов микробов, общее количество которых достигает 10 14 , что на порядок выше общей численности клеточного состава человеческого организма. Количество микроорганизмов увеличивается в дистальном направлении, и в толстой кишке в 1 г кала содержится 10 11 бактерий, что составляет 30% сухого остатка кишечного содержимого.
Нормальная микробная флора кишечника
В тощей кишке здоровых людей находится до 10 5 бактерий в 1 мл кишечного содержимого. Основную массу этих бактерий составляют стрептококки, стафилококки, молочнокислые палочки, другие грамположительные аэробные бактерии и грибы. В дистальном отделе подвздошной кишки количество микробов увеличивается до 10 7 –10 8 , в первую очередь за счет энтерококков, кишечной палочки, бактероидов и анаэробных бактерий. Недавно нами было установлено, что концентрация пристеночной микрофлоры тощей кишки на 6 порядков выше, чем в ее полости, и составляет 10 11 кл/мл. Около 50% биомассы пристеночной микрофлоры составляют актиномицеты, примерно 25% — аэробные кокки (стафилококки, стрептококки, энтерококки и коринеформные бактерии), от 20 до 30% приходится на бифидобактерии и лактобациллы.
Количество анаэробов (пептострептококки, бактероиды, клостридии, пропионобактерии) составляет около 10% в тонкой и до 20% в толстой кишке. На долю энтеробактерий приходится 1% от суммарной микрофлоры слизистой оболочки.
До 90-95% микробов в толстой кишке составляют анаэробы (бифидобактерии и бактероиды), и только 5-10% всех бактерий приходится на строгую аэробную и факультативную флору (молочнокислые и кишечные палочки, энтерококки, стафилококки, грибы, протей).
Кишечные палочки, энтерококки, бифидобактерии и ацидофильные палочки обладают выраженными антагонистическими свойствами. В условиях нормально функционирующего кишечника они способны подавлять рост несвойственных нормальной микрофлоре микроорганизмов.
Площадь внутренней поверхности кишечника составляет около 200 м 2 . Она надежно защищена от проникновения пищевых антигенов, микробов и вирусов. Важную роль в организации этой защиты играет иммунная система организма. Около 85% лимфатической ткани человека сосредоточено в стенке кишечника, где продуцируется секреторный IgA. Кишечная микрофлора стимулирует иммунную защиту. Кишечные антигены и токсины кишечных микробов значительно увеличивают секрецию IgA в просвет кишки.
Расщепление непереваренных пищевых веществ в толстой кишке осуществляется ферментами бактерий, при этом образуются разнообразные амины, фенолы, органические кислоты и другие соединения. Токсические продукты микробного метаболизма (кадаверин, гистамин и другие амины) выводятся с мочой и в норме не оказывают влияния на организм. При утилизации микробами неперевариваемых углеводов (клетчатки) образуются короткоцепочечные жирные кислоты. Они обеспечивают клетки кишки энергоносителями и, следовательно, улучшают трофику слизистой оболочки. При дефиците клетчатки может нарушаться проницаемость кишечного барьера вследствие дефицита короткоцепочечных жирных кислот. В результате кишечные микробы могут проникать в кровь.
Под влиянием микробных ферментов в дистальных отделах подвздошной кишки происходит деконъюгация желчных кислот и преобразование первичных желчных кислот во вторичные. В физиологических условиях от 80 до 95% желчных кислот реабсорбируется, остальные выделяются с фекалиями в виде бактериальных метаболитов. Последние способствуют нормальному формированию каловых масс: тормозят всасывание воды и тем самым препятствуют излишней дегидратации кала.
Дисбактериоз
В понятие дисбактериоза кишечника входит избыточное микробное обсеменение тонкой кишки и изменение микробного состава толстой кишки. Нарушение микробиоценоза происходит в той или иной степени у большинства больных с патологией кишечника и других органов пищеварения. Следовательно, дисбактериоз является бактериологическим понятием. Он может рассматриваться как одно из проявлений или осложнение заболевания, но не самостоятельная нозологическая форма.
Крайней степенью дисбактериоза кишечника является появление бактерий желудочно-кишечного тракта в крови (бактериемия) или даже развитие сепсиса.
Состав микрофлоры кишечника нарушается при болезнях кишечника и других органов пищеварения, лечении антибиотиками и иммунодепрессантами, воздействиях вредных факторов внешней среды.
Клинические проявления дисбактериоза зависят от локализации дисбиотических изменений.
Дисбактериоз тонкой кишки
При дисбактериозе тонкой кишки численность одних микробов в слизистой оболочке тонкой кишки увеличена, а других уменьшена. Отмечается увеличение Eubacterium (в 30 раз), α-стрептококков (в 25 раз), энтерококков (в 10 раз), кандид (в 15 раз), появление бактерий рода Acinetobacter и вирусов герпеса. Уменьшается от 2 до 30 раз количество большинства анаэробов, актиномицетов, клебсиелл и других микроорганизмов, являющихся естественными обитателями кишечника.
Причиной дисбактериоза могут быть: а) избыточное поступление микроорганизмов в тонкую кишку при ахилии и нарушении функции илеоцекального клапана; б) благоприятные условия для развития патологических микроорганизмов в случаях нарушения кишечного пищеварения и всасывания, развития иммунодефицита и нарушений проходимости кишечника.
Повышенная пролиферация микробов в тонкой кишке приводит к преждевременной деконъюгации желчных кислот и потере их с калом. Избыток желчных кислот усиливает моторику толстой кишки и вызывает диарею и стеаторею, а дефицит желчных кислот приводит к нарушению всасывания жирорастворимых витаминов и развитию желчнокаменной болезни.
Бактериальные токсины и метаболиты, например фенолы и биогенные амины, могут связывать витамин В12.
Некоторые микроорганизмы обладают цитотоксическим действием и повреждают эпителий тонкой кишки. Это ведет к уменьшению высоты ворсинок и углублению крипт. При электронной микроскопии выявляется дегенерация микроворсинок, митохондрий и эндоплазматической сети.
Дисбактериоз толстой кишки
Состав микрофлоры толстой кишки может меняться под влиянием различных факторов и неблагоприятных воздействий, ослабляющих защитные механизмы организма (экстремальные климатогеографические условия, загрязнение биосферы промышленными отходами и различными химическими веществами, инфекционные заболевания, болезни органов пищеварения, неполноценное питание, ионизирующая радиация).
В развитии дисбактериоза толстой кишки большую роль играют ятрогенные факторы: применение антибиотиков и сульфаниламидов, иммунодепрессантов, стероидных гормонов, рентгенотерапия, хирургические вмешательства. Антибактериальные препараты значительно подавляют не только патогенную микробную флору, но и рост нормальной микрофлоры в толстой кишке. В результате размножаются микробы, попавшие извне, или эндогенные виды, устойчивые к лекарственным препаратам (стафилококки, протей, дрожжевые грибы, энтерококки, синегнойная палочка).
Клинические особенности дисбактериоза
Клинические проявления чрезмерного роста микроорганизмов в тонкой кишке могут полностью отсутствовать, выступать в качестве одного из патогенетических факторов хронической рецидивирующей диареи, а при некоторых болезнях, например, дивертикулезе тонкой кишки, частичной кишечной непроходимости или после хирургических операций на желудке и кишечнике, приводить к тяжелой диарее, стеаторее и В 12 -дефицитной анемии.
Особенностей клинического течения заболевания у больных с различными вариантами дисбактериоза толстой кишки, по данным бактериологических анализов кала, в большинстве случаев установить не удается. Можно отметить, что больные хроническими заболеваниями кишечника чаще инфицируются острыми кишечными инфекциями по сравнению со здоровыми. Вероятно, это связано со снижением у них антагонистических свойств нормальной микрофлоры кишечника и, прежде всего, частым отсутствием бифидобактерий.
Особенно большую опасность представляет псевдомембранозный колит, развивающийся у некоторых больных, длительно лечившихся антибиотиками широкого спектра действия. Этот тяжелый вариант дисбактериоза вызывается токсинами, выделяемыми синегнойной палочкой Clostridium difficile, которая размножается в кишечнике при угнетении нормальной микробной флоры.
Очень редко наблюдается молниеносное течение псевдомембранозного колита, напоминающее холеру. Обезвоживание развивается в течение нескольких часов и заканчивается летальным исходом.
Таким образом, оценка клинической значимости дисбиотических изменений должна основываться прежде всего на клинических проявлениях, а не только на результатах исследования микрофлоры кала.
Методы диагностики
Диагностика дисбактериоза представляет собой сложную и трудоемкую задачу. Для диагностики дисбактериоза тонкой кишки применяют посев сока тонкой кишки, полученного с помощью стерильного зонда. Дисбактериоз толстой кишки выявляют с помощью бактериологических исследований кала.
Микробная флора образует большое количество газов, в том числе водорода. Это явление используют для диагностики дисбактериоза. Концентрация водорода в выдыхаемом воздухе натощак находится в прямой зависимости от выраженности бактериального обсеменения тонкой кишки. У больных с заболеваниями кишечника, протекающими с хронической рецидивирующей диареей и бактериальным обсеменением тонкой кишки, концентрация водорода в выдыхаемом воздухе значительно превышает 15 ppm.
Для диагностики дисбактериоза применяют также нагрузку лактулозой. В норме лактулоза не расщепляется в тонкой кишке и метаболизируется микробной флорой толстой кишки. В результате количество водорода в выдыхаемом воздухе повышается (рис. 1).
Наиболее частыми бактериологическими признаками дисбактериоза толстой кишки являются отсутствие основных бактериальных симбионтов — бифидобактерий и уменьшение количества молочнокислых палочек. Увеличивается количество кишечных палочек, энтерококков, клостридий, стафилококков, дрожжеподобных грибов и протея. У отдельных бактериальных симбионтов появляются патологические формы. К ним относятся гемолизирующая флора, кишечные палочки со слабо выраженными ферментативными свойствами, энтеропатогенные кишечные палочки и т. д.
Углубленное изучение микробиоценоза показало, что традиционные методы не позволяют получить истинную информацию о состоянии микрофлоры кишечника. Из 500 известных видов микробов в целях диагностики обычно изучаются лишь 10-20 микроорганизмов. Важно, в каком отделе — в тощей, подвздошной или толстой кишках — исследуется микробный состав. Поэтому перспективы разработки клинических проблем дисбактериоза в настоящее время связывают с применением химических методов дифференциации микроорганизмов, позволяющих получить универсальную информацию о состоянии микробиоценоза. Наиболее широко для этих целей используются газовая хроматография (ГХ) и газовая хроматография в сочетании с масс-спектрометрией (ГХ-МС). Этот метод позволяет получить уникальную информацию о составе мономерных химических компонентов микробной клетки и метаболитов. Маркеры такого рода могут быть определены и использованы для детектирования микроорганизмов. Главным преимуществом и принципиальным отличием этого метода от бактериологических является возможность количественного определения более 170 таксонов клинически значимых микроорганизмов в различных средах организма. При этом результаты исследования могут быть получены в течение нескольких часов.
Проведенные нами исследования микробиоценоза в крови и биоптатов слизистой оболочки тонкой и толстой кишок у больных с синдромом раздраженного кишечника позволили обнаружить отклонения от нормы до 30-кратного увеличения или уменьшения многих компонентов. Существует возможность оценки изменений микрофлоры кишечника на основании данных анализа крови методом ГХ-МС-микробных маркеров.
Лечение
Лечение дисбактериоза должно быть комплексным (схема) и включать в себя следующие мероприятия:
Антибактериальные препараты
Антибактериальные препараты необходимы в первую очередь для подавления избыточного роста микробной флоры в тонкой кишке. Наиболее широко применяются антибиотики из группы тетрациклинов, пенициллинов, цефалоспорины, хинолоны (таривид, нитроксолин) и метронидазол.
Однако антибиотики широкого спектра действия в значительной степени нарушают эубиоз в толстой кишке. Поэтому они должны применяться только при заболеваниях, сопровождающихся нарушениями всасывания и моторики кишечника, при которых, как правило, отмечается выраженный рост микробной флоры в просвете тонкой кишки.
Антибиотики назначают внутрь в обычных дозах в течение 7–10 дней.
При заболеваниях, сопровождающихся дисбактериозом толстой кишки, лечение лучше проводить препаратами, которые оказывают минимальное влияние на симбионтную микробную флору и подавляют рост протея, стафилококков, дрожжевых грибов и других агрессивных штаммов микробов. К ним относятся антисептики: интетрикс, эрсефурил, нитроксолин, фуразолидон и др.
При тяжелых формах стафилококкового дисбактериоза применяют антибиотики: таривид, палин, метронидазол (трихопол), а также бисептол-480, невиграмон.
Антибактериальные препараты назначают в течение 10–14 дней. В случае появления в кале или кишечном соке грибов показано применение нистатина или леворина.
У всех больных с диареей, ассоциированной с антибиотиками, протекающей с интоксикацией и лейкоцитозом, возникновение острой диареи следует связывать с Cl. difficile.
В этом случае срочно делают посев кала на Cl. difficile и назначают ванкомицин по 125 мг внутрь 4 раза в сутки; при необходимости доза может быть увеличена до 500 мг 4 раза в день. Лечение продолжают в течение 7-10 суток. Эффективен также метронидазол в дозе 500 мг внутрь 2 раза в сутки, бацитрацин по 25 000 МЕ внутрь 4 раза в сутки. Бацитрацин почти не всасывается, в связи с чем в толстой кишке можно создать более высокую концентрацию препарата. При обезвоживании применяют адекватную инфузионную терапию для коррекции водно-электролитного баланса. Для связывания токсина Cl. difficile используют холестирамин (квестран).
Бактериальные препараты
Живые культуры нормальной микробной флоры выживают в кишечнике человека от 1 до 10% от общей дозы и способны в какой-то мере выполнять физиологическую функцию нормальной микробной флоры. Бактериальные препараты можно назначать без предварительной антибактериальной терапии или после нее. Применяют бифидумбактерин, бификол, лактобактерин, бактисубтил, линекс, энтерол и др. Курс лечения длится 1-2 месяца.
Возможен еще один способ устранения дисбактериоза — воздействие на патогенную микробную флору продуктами метаболизма нормальных микроорганизмов. К таким препаратам относится хилак форте. Он создан 50 лет назад и до настоящего времени применяется для лечения больных с патологией кишечника. Хилак форте представляет собой стерильный концентрат продуктов обмена веществ нормальной микрофлоры кишечника: молочной кислоты, лактозы, аминокислот и жирных кислот. Эти вещества способствуют восстановлению в кишечнике биологической среды, необходимой для существования нормальной микрофлоры, и подавляют рост патогенных бактерий. Возможно, продукты метаболизма улучшают трофику и функцию эпителиоцитов и колоноцитов. 1 мл препарата соответствует биосинтетическим активным веществам 100 млрд. нормальных микроорганизмов. Хилак форте назначают по 40–60 капель 3 раза в день на срок до 4 недель в сочетании с препаратами антибактериального действия или после их применения.
Регуляторы пищеварения и моторики кишечника
У больных с нарушением полостного пищеварения применяют креон, панцитрат и другие панкреатические ферменты. С целью улучшения функции всасывания назначают эссенциале, легалон или карсил, т. к. они стабилизируют мембраны кишечного эпителия. Пропульсивную функцию кишечника улучшают имодиум (лоперамид) и тримебутин (дебридат).
Стимуляторы реактивности организма
Для повышения реактивности организма ослабленным больным целесообразно применять тактивин, тималин, тимоген, иммунал, иммунофан и другие иммуностимулирующие средства. Курс лечения должен составлять в среднем 4 недели. Одновременно назначаются витамины.
Профилактика дисбактериоза
Первичная профилактика дисбактериоза представляет очень сложную задачу. Ее решение связано с общими профилактическими проблемами: улучшением экологии, рациональным питанием, улучшением благосостояния и прочими многочисленными факторами внешней и внутренней среды.
Вторичная профилактика предполагает рациональное применение антибиотиков и других медикаментов, нарушающих эубиоз, своевременное и оптимальное лечение болезней органов пищеварения, сопровождающихся нарушением микробиоценоза.
Изучено влияние пребиотического комплекса на результаты эрадикационной антихеликобактерной терапии и показана его эффективность по предупреждению развития антибиотикоассоциированной диареи у пациентов, имеющих прогностические факторы неблагоприятного тече
Meaning of dysbiotic disorders of large intestine in pathogenesis of gastroduodenal zone diseases associated with Helicobacter pylori. Meaning of prebiotics in increase of anti-helicobacter therapy efficiency
Influence of prebiotic complex on the results of eradication anti-helicobacter therapy was studied, and its efficiency in prevention of antibiotic-associated diarrhea in patients having forecasting factors of adverse clinical course of early post-eradication period was shown.
Инфекция Helicobacter pylori (Н. pylori) является ведущей причиной хронических заболеваний желудка и двенадцатиперстной кишки. Эрадикация Н. pylori является основным стандартом лечения хеликобактер-ассоциированных заболеваний гастродуоденальной зоны, что отражено в международных соглашениях (Маастрихтские соглашения 1–3, соответственно 1996, 2000 и 2005 гг.) [1].
Следует иметь в виду, что хеликобактериоз проявляется не только местными эрозивно-язвенными поражениями гастродуоденальной зоны, но и оказывает системное влияние на организм человека. Инфицирование макроорганизма и длительное персистирование H. pylori нарушает микроэкологию пищеварительного тракта и может рассматриваться в качестве фактора, инициирующего и усугубляющего нарушения микробиоценоза толстой кишки [2, 3]. При H. pylori-позитивной язвенной болезни дисбиоз кишечника выявляется у 92% пациентов (НИИ питания РАМН), выраженность дисбиотических изменений достоверно связана со степенью обсемененности H. pylori [4]. Антихеликобактерная терапия, включающая применение антибиотиков, также приводит к угнетению облигатной микрофлоры и последующей колонизации слизистой оболочки желудочно-кишечного тракта патогенной и условно-патогенной микрофлорой [5].
Дисбиоз толстой кишки может стать причиной развития вторичного иммунодефицита (местного и общего), что в свою очередь вызывает снижение защитных сил организма и является важным фактором в патогенезе H. pylori-ассоциированной патологии. При этом важно, что сопутствующие дисбиотические изменения кишечника могут достигать определенного критического уровня и превращаться в самостоятельный фактор агрессии. В этих условиях прогредиентно нарастает выраженность клинических симптомов воспалительных заболеваний гастродуоденальной области, удлиняются сроки их существования, утяжеляется общее состояние, ухудшаются показатели результатов лечения и качество жизни пациентов, клиническое течение приобретает часто рецидивирующий характер [6, 7].
Иммуногенная функция нормофлоры заключается в стимуляции синтеза иммуноглобулинов, интерферона, цитокинов; в активировании созревания системы фагоцитирующих мононуклеаров; в повышении содержания комплемента и пропердина, активности лизоцима; выработке бактериальных модулинов. В качестве медиаторов действия бактериальных метаболитов выступают гистамин, серотонин, простагландины, лейкотриены, короткоцепочные жирные кислоты. Воздействие микробных метаболитов и медиаторов их действия направлено на модуляцию пролиферации, дифференцировки, апоптоза и метаболических реакций эукариотических клеток. Нормофлора способна воздействовать на дифференцировку Т-хелперов и таким образом влиять на соотношение про- и противовоспалительных цитокинов. S. Roos, C. Johnson (2003 г.) показали, что некоторые штаммы лактобактерий обладают кислотоустойчивостью и антагонизмом к H. pylori in vivo и in vitro. Lactobacilli spp., как и Bifidobacterium spp., выделяют бактериоцины, способные ингибировать рост H. pylori и нарушать адгезию микроба к эпителиальным клеткам желудка [8–10].
Исследования последних лет показали, что препараты, улучшающие микробиоценоз кишечника, не только повышают эффективность эрадикационной терапии, но и предупреждают развитие и позволяют в значительной степени снизить побочные эффекты антибиотиков, входящих в стандартные схемы антихеликобактерной терапии, такие как антибиотикоассоциированная диарея, тошнота, неприятный привкус в ротовой полости и т. п. [10–14].
Независимо от индивидуальных различий в составе кишечной микрофлоры, кишечный микробиоценоз у каждого человека функционирует как единая экосистема и целостный метаболический орган, который обеспечивает необходимое количество и профиль конечных метаболитов, среди которых наиболее важную роль играют короткоцепочечные жирные кислоты (КЦЖК). КЦЖК — основной продукт микробной ферментации анаэробными бактериями углеводов, жиров и белков. К ним относятся уксусная (С2), пропионовая (С3), изомасляная, масляная (С4), изовалериановая, валериановая (С5), изокапроновая и капроновая (С6) кислоты [7, 15, 16].
Неразветвленные КЦЖК — уксусная, пропионовая и масляная — образуются при анаэробном брожении углеводов, тогда как метаболизм белков ведет к образованию разветвленных кислот — изомасляной (из валина) и изовалериановой (из лейцина). В течение суток синтезируется более 300 ммоль/л КЦЖК. Максимальная концентрация КЦЖК достигается в проксимальных отделах толстой кишки 70–140 ммоль/л — самом мощном биокорректорном участке желудочно-кишечного тракта. В дистальной части содержание КЦЖК снижается до 20–70 ммоль/л [16].
КЦЖК участвуют в регуляции большинства физиологических эффектов облигатной микрофлоры толстой кишки. Так, они являются основным источником питания для колоноцитов, обеспечивая их энергией (на 70%), стимулируют регенерацию эпителия, обладают антибактериальной активностью, обеспечивают баланс микробной экосистемы, препятствуя ее контаминации патогенной микрофлорой, поддерживают детоксицирующую функцию печени за счет участия в энтерогепатической циркуляции желчных кислот, обладают антиканцерогенным и антивирусным действием, оказывают влияние на экспрессию генов в колоноцитах, являются активным модулятором иммунной системы, регулируют моторную функцию кишечника (табл. 1) [16–18].
Основными продуцентами бутирата являются не бифидо- и лактобактерии, а эубактерии, пептококки, фузобактерии и клостридии (поэтому большинство пробиотиков не влияют на синтез масляной кислоты). Эта КЦЖК активно абсорбируется в цитоплазму колоноцита, где в митохондриях из нее образуется АТФ. 70% энергии идет на обеспечение локальных процессов в толстой кишке, а оставшиеся 30% этой энергии расходуются на нужды целого организма. Рецептор-опосредованным путем масляная кислота инициирует активацию и/или ингибирование локальных и системных иммунных реакций [16].
В России с 2011 г. для лечения различных заболеваний ЖКТ применяется препарат Закофальк®. В состав препарата входит масляная кислота и инулин в дозе 250 мг, которые помещены в полимерную мультиматриксную капсулу NMX. В отличие от ранее известных про- и пребиотиков, которые стимулируют рост нормофлоры толстой кишки, что опосредованно приводит к образованию КЦЖК, в первую очередь ацетата и пропионата, Закофальк® напрямую доставляет масляную кислоту и инулин в толстую кишку в заданном количестве. Пребиотический комплекс Закофальк® обеспечивает возможность реализации сложного каскада иммунобиологических, метаболических и других свойств, присущих нормально функционирующему микробно-тканевому комплексу кишечника.
Инулин, (C6H10O5)n, органическое вещество из группы полисахаридов (фруктанов), полимер D-фруктозы, построенный из остатков D-фруктофуранозы, связанных 2,1-бета связями.
Что касается медицинской классификации инулина, в большинстве публикаций его относят к группе растворимых пищевых волокон (не целлюлозный полисахарид). Кроме того, способность инулина избирательно стимулировать бифидо- и лактобактерии, являющиеся представителями нормальной микрофлоры кишечника, позволяет назвать данное вещество истинным пребиотиком.
При попадании в пищеварительный тракт инулин проходит в неизмененном виде в желудок и тонкую кишку. В толстой кишке фруктоолигосахариды являются питательным субстратом исключительно для бифидобактерий и отдельных видов лактобацилл, которые обладают ферментной системой бета-фруктозидаз, позволяющей им расщеплять фруктоолигосахариды до масляной кислоты. Таким образом, инулин выступает не только как селективный пребиотический фактор для микрофлоры толстой кишки, но и как промоутер синтеза эндогенной масляной кислоты.
Растительные волокна инулина, будучи нерастворимыми в тонкой кишке, в толстой кишке создают дополнительные площади (помимо поверхности слизистой оболочки), к которым фиксируются сахаролитические бактерии. Благодаря этому в просвете толстой кишки во много раз возрастает число мест для адгезии и формирования микроколоний лакто- и бифидобактерий, что приводит к значительному увеличению количества присутствующих на единицу объема кишки микроорганизмов, и, как следствие этого, резко возрастает метаболическая активность кишечного содержимого с образованием различных важных для организма энергетических и пластических субстанций. Lactobacilli spp., как и Bifidobacterium spp., выделяют бактериоцины, способные ингибировать рост Н. pylori и нарушать адгезию микроба к эпителиальным клеткам желудка.
Масляная кислоты С3Н7СООН является органической кислотой, вырабатывающейся в просвете толстой кишки в процессе бактериальной ферментации неперевариваемых пищевых углеводородов. Бутират используется организмом в качестве энергетического субстрата для обеспечения процессов пролиферации и дифференцировки колоноцитов, для энергообеспечения ферментативных процессов индигенной флоры. Именно эта кислота контролирует механизмы, инициирующие апоптоз ненужных в функциональном отношении колоноцитов и раковых клеток, модулирует экспрессию генов, регулирующих клеточный цикл, нивелирует действие супероксидных радикалов. Масляная кислота играет основную роль в обеспечении локальных и системных иммунных механизмов: путем активации локальных макрофагов для увеличения презентации антигенов B-лимфоцитам и увеличения производства секреторного иммуноглобулина А местно и системно, модулирования цитокиновых профилей и активации синтеза интерферона. Масляная кислота, являясь универсальным сигнальным химическим носителем передачи информации в организме человека, регулирует адаптивные реакции не только на уровне микробиоценоза толстой кишки (предупреждает развитие кишечного дисбиоза), но и оказывает общее иммуномодулирующее действие.
Клинически манифестной формой кишечного дисбиоза при проведении эрадикационной терапии является антибиотикоассоциированная диарея. На базе городских поликлиник г. Москвы было проведено открытое сравнительное рандомизированное многоцентровое исследование по изучению влияния препарата Закофальк® на эффективность и переносимость эрадикационной терапии.
Целью настоящего исследования было изучение влияния пребиотического комплекса Закофальк® на результаты эрадикационной терапии и его эффективности по предупреждению развития антибиотикоассоциированной диареи при проведении антихеликобактерной терапии у пациентов, имеющих прогностические факторы неблагоприятного течения раннего постэрадикационного периода.
Материал и методы исследования
В рамках сравнительного открытого рандомизированного исследования было обследовано 115 человек (мужчин — 52, женщин — 63), средний возраст 42,5 лет (20–65 лет).
Критерии включения: больные язвенной болезнью, ассоциированной с Н. pylori, в стадии обострения с наличием язвенного дефекта в желудке или в двенадцатиперстной кишке; наличие не менее двух факторов риска развития антибиотикоассоциированной диареи (постинфекционный синдром раздраженного кишечника, сахарный диабет 2-го типа, указание в анамнезе на проведение антибактериальной терапии вне связи с основным заболеванием в течение ближайших 6 месяцев, хронические заболевания гепатобилиарной системы и поджелудочной железы, длительный прием гормональных или химиотерапевтических препаратов, синдром короткой тонкой кишки, дивертикулярная болезнь толстой кишки, онкологические заболевания толстой кишки в анамнезе).
Обследование включало: клиническое наблюдение в динамике, проведение эзофагогастродуоденоскопии с взятием гастробиоптатов слизистой оболочки края язвы с последующей их гистобактериоскопией и проведением уреазного теста (до и через 4 недели от окончания эрадикационной терапии). В ходе исследования анализировались результаты исследования состава кишечной микрофлоры. Исследование иммунного статуса включало определение в сыворотке крови IgG, IgM, IgA, IgE.
После включения в исследование больные были рандомизированы на две группы. Пациенты основной группы (60 человек) помимо препаратов эрадикационной терапии (Нексиум 20 мг 2 раза + кларитромицин 500 мг 2 раза + амоксициллин 1000 мг × 2 раза 14 дней) получали Закофальк® 3 таблетки в сутки, а больные группы сравнения (55 человек) — ту же терапию, но без применения препарата Закофальк®. До начала терапии нарушений кишечной моторики (поносов либо запоров) ни у кого не было.
Результаты и их обсуждение
Через 7 дней от включения в исследование при повторном опросе и осмотре синдром кишечной диспепсии, индуцированный проведением эрадикационной терапии, был отмечен у 34 (68%) пациентов группы сравнения: вздутие — 25, урчание — 28; жидкий стул до 3 раз в сутки — 25, жидкий стул более 3 раз в день — 9. Девять пациентов этой группы (18%) в течение первой недели лечения отказались от дальнейшего приема антибиотиков. При этом в основной группе, пациенты которой получали Закофальк®, не было зафиксировано возникновение диареи, а вздутие или урчание живота было отмечено лишь у 14 пациентов (23,3%). По завершении антибиотикотерапии на 14-й день лечения 41 (82%) пациент группы сравнения отмечал послабления стула от 3 до 5–7 раз в сутки. У 7 (11,7%) пациентов основной группы отмечалось учащение дефекаций до 5 раз в сутки. Таким образом, включение препарата Закофальк® в схему эрадикационной терапии улучшает переносимость лечения антибиотиками даже у пациентов с высоким риском антибиотикоассоциированной диареи (табл. 2).
Исходный уровень сывороточных иммуноглобулинов не имел значимых отличий в основной группе и группе сравнения, средние его значения были незначительно снижены. Уровень IgE был повышен только у больных язвенной болезнью двенадцатиперстной кишки с наличием участков лимфоидной гиперплазии в антральном отделе желудка, средний его уровень в основной группе составил 64,25 ± 11 кЕ/л и 55 ± 12 кЕ/л в группе сравнения. После проведения эрадикационной схемы лечения с включением препарата Закофальк® у пациентов основной группы наблюдалась небольшая тенденция к повышению уровня IgA до 3,0 ± 0,5 г/л (исходный 0,65 ± 0,2 г/л) и значительное снижение IgE до 43 ± 11 кЕ/л. У пациентов группы сравнения такой тенденции не наблюдалось. Повышение сывороточного IgA может отражать повышение секреторного IgA на слизистой оболочке желудка, что свидетельствует об усилении реакций местного иммунитета. Снижение уровня IgE, по-видимому, связано с усилением протективной и детоксицирующей функций эндосимбиотных бактерий. Повышение сывороточных IgA и снижение IgE после лечения препаратом Закофальк® сочеталось со стабильным исчезновением клинических признаков обострения и эндоскопически подтвержденным рубцеванием язв у всех пациентов основной группы (табл. 3).
При микробиологическом исследовании фекалий в исходном периоде достаточно выраженные изменения соотношения представителей кишечной микрофлоры выявлены у большинства обследованных больных в обеих группах, в первую очередь отмечалось снижение уровня бифидо- и лактобактерий. После курса эрадикационной терапии у пациентов, принимавших Закофальк®, выявлено достоверное увеличение количества бифидобактерий и лактобактерий, а также достоверное уменьшение количества патогенных и условно-патогенных бактерий. В группе сравнения обращает внимание угнетение микробного роста представителей нормальной кишечной микрофлоры и увеличение степени дисбиоза кишечника. Таким образом, полученные данные в очередной раз подтверждают отрицательное влияние стандартной эрадикационной терапии на микробный состав кишечника, что имеет особое значение для пациентов с сопутствующими заболеваниями ЖКТ, увеличивающими риск развития кишечного дисбиоза и его клиническое проявление — антибиотикоассоциированной диареи (табл. 4, 5).
Достижение эрадикации H. pylori было зафиксировано у 52 (86,7%) пациентов основной группы и у 17 (31%) из группы сравнения, что может зависеть от более четкого соблюдения комплаентности терапии, а также способности препарата Закофальк® потенцировать противовоспалительный эффект антибиотиков.
Проводилась морфологическая оценка из краев язвенных дефектов до начала антихеликобактерной терапии и по ее завершении. Полученные данные свидетельствуют, что включение в терапию препарата Закофальк® приводит к улучшению клеточного состава слизистой оболочки в краях язвы. Так, значительно уменьшается нейтрофильная и лимфоцитарная и плазмоцитарная инфильтрация, что свидетельствует об уменьшении воспалительного и иммуно-воспалительных процессов (табл. 6, 7).
Выводы
Результаты исследования показывают несомненное преимущество комплексного лечения язвенной болезни, ассоциированной с H. pylori, с включением пребиотика Закофальк® по сравнению со стандартной эрадикационной схемой.
На основании полученных данных можно сделать следующие выводы:
Литература
Л. И. Буторова*, кандидат медицинских наук
Т. А. Плавник**
Н. Г. Кадникова***
С. Р. Рекель****
* ГИУВ МО РФ; ГБУЗ ГП № 209 ДЗМ, Москва
** ГБУЗ ГП № 195 ДЗМ, Москва
*** ПК № 230 ДЗМ, Зеленоград
**** ФГБУ ПК № 2 УДП РФ, Москва
Читайте также:

