Может ли вич быть причиной бесплодия
Обновлено: 12.05.2024
Наличие ВИЧ не является признаком сексуального нездоровья, а выступает особенностью партнера, к которой следует адаптироваться для достижения сексуальной гармонии, т. е. адаптировать свое сексуальное поведение к поведению партнера.
Для людей, живущих с ВИЧ, важным является соблюдение правил сексуального поведения, связанных с предупреждением инфицирования.
К таким правилам относят:
- раскрытие ВИЧ-статуса сексуальному партнеру;
- правильное и постоянное использование презервативов;
- регулярное обследование на инфекции, передающиеся половым путем;
- учет возможности передачи ВИЧ даже при получении ВААРТ;
- равноправные отношения между партнерами, отсутствие принуждения.
- непроникающий секс, включая мастурбацию, взаимную мастурбацию, поцелуи, массажи и другие формы прикосновений;
- верность партнеру;
- использование презервативов – единственный способ, который может гарантировать, что неинфицированный ВИЧ партнер останется неинфицированным. Применение презервативов предупреждает заражение другими штаммами ВИЧ, когда оба партнера инфицированы.
При незащищенных половых контактах в дискордантных парах (пары, в которых один из партнеров ВИЧ-положительный, а другой ВИЧ-отрицательный) может быть назначена ПКП (постконтактная профилактика) препаратами АРВ. ПКП назначается не всегда, назначение не является обыденной практикой. Решение о назначении ПКП принимает только подготовленный специалист согласно утвержденным Минздравом схемам Национальных протоколов АРТ. При принятии решения о применении ПКП значительное внимание уделяется оценке возможности развития медикаментозной резистентности к препаратам в основном лечении, оценке побочных эффектов принимаемой терапии. Для ВИЧ-отрицательного партнера осложнения ПКП в основном сводятся к побочным эффектам антиретровирусных средств. Чаще всего это желудочно-кишечные нарушения: тошнота, рвота или диарея. Возможны также изменения состава крови.
Зачатие ребенка
Для пар, живущих с ВИЧ, существуют следующие способы стать родителями:
- Зачатие ребенка при незащищенном половом акте.
- Использование различных методов искусственного оплодотворения.
- Инсеминация донорской спермой.
Парам, где один или оба партнера живут с ВИЧ, не рекомендуется зачатие ребенка в открытом половом акте. Стоит прибегнуть к вспомогательным репродуктивным технологиям.
Вариант 1 – дискордантная пара: ВИЧ(+) мужчина и ВИЧ(–) женщина (отмывание сперматозоидов + внутриматочная инсеминация).
Вариант 2 – дискордантная пара: ВИЧ(+) женщина и ВИЧ(–) мужчина (искусственное осеменение нативной спермой).
Вариант 3 – ВИЧ(+) оба партнера (см. вариант 1).
ЖЕНЩИНА(+)
Способ зачатия – внутриматочная инсеминация спермой мужа. Внутриматочная инсеминация позволяет свести к минимуму риск передачи ВИЧ-инфекции партнеру.
Современные методы профилактики передачи ВИЧ позволяют уменьшить риск передачи ВИЧ-инфекции ребенку от 40 % до 2 % .
Беременность и родоразрешение женщин, живущих с ВИЧ. Профилактика передачи ВИЧ от матери к ребенку
Беременность. Если мать ВИЧ-положительна, то без специальных мер профилактики риск передачи инфекции малышу во время беременности и родов составляет 20 – 45 %. Существующая профилактика антиретровирусной терапией, адекватное вирусной нагрузке родоразрешение и отказ от грудного вскармливания позволяют уменьшить риск передачи ВИЧ до 1–2 %.
Вероятность передачи ВИЧ-инфекции ребенку зависит от вирусной нагрузки матери. Если вовремя начат прием АРТ и вирусная нагрузка не определяется, вероятность передачи ВИЧ низка, но возможна.
Примерно в 75 % случаев передача ВИЧ ребенку происходит в последние недели перед родами или в родах. Около 10 % случаев происходят в первые два триместра беременности и 10–15 % – во время грудного вскармливания.
Беременность и бесплодие при ВИЧ и СПИДе
Поскольку эпидемическое распространение ВИЧ-инфекции/СПИДа захватывает все большее количество женщин, а современные методы лечения позволяют продлить жизнь и здоровье пациенток на гораздо больший период времени, возник вопрос о беременности и бесплодии при заболевании ВИЧ-инфекцией/СПИДом. Хотя некоторые данные противоречивы, пока не было доказательств влияния самого ВИЧ на репродуктивную функцию.
Важно еще до зачатия ребенка рассказывать женщинам о риске передачи инфекции и способах лечения, снижающих этот риск.
Для ВИЧ-инфицированных пациенток, желающих иметь ребенка, наибольший риск состоит в вертикальном заражении плода и заражении здорового партнера. Если женщина твердо придерживается данных ей рекомендаций, риск заражения плода становится достаточно низким. Это придает большую значимость лечения бесплодных ВИЧ-инфицированных женщин. Без врачебного вмешательства риск вертикального заражения составляет около 25%. При использовании зидовудина частота заражения снижается до 8,3%. Применение высокоактивной антиретровирусной терапии или комбинированного лечения может при оптимальном контроле над пациенткой уменьшить уровень заражения до 1-2%.
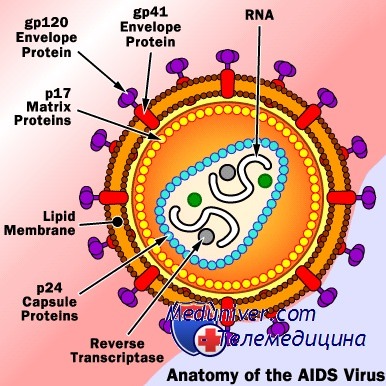
Если один из партнеров инфицирован, а другой здоров, еще одна из целей состоит в том, чтобы оградить его от возможности заражения. Вероятность заражения ВИЧ без использования презервативов составляет 0,1-0,5% за один половой акт. Если мужчина ВИЧ-отрицательный, а женщина ВИЧ-положительна, сперма может быть введена во влагалище методами, которые позволяют избежать полового контакта с незараженным мужчиной, например с помощью искусственного оплодотворения. Эту процедуру также лучше всего провести в тот момент, когда ВИЧ-инфекция у женщины оптимально контролируется, чтобы снизить вероятность заражения плода.
Если мужчина ВИЧ-инфицирован, а женщина здорова, ситуация сильно усложняется. Вирус содержится в крови, а также в плазме и лейкоцитах семенной жидкости. Хотя это не было точно установлено, считают, что сперматозоиды не являются переносчиками вирусов. Отмывание спермы выполняют путем отделения сперматозоидов от жидкой части спермы и лейкоцитов, оно оказывается эффективным в 90% порций. После отмывания сперму проверяют на отсутствие вирусов с помощью метода обратной транскрипции и гнездовой ПЦР.
По всему миру было проведено несколько тысяч курсов ВРТ с применением отмытой спермы без передачи инфекции, но все же пока еще слишком рано говорить с уверенностью, что это процедура совершенно безопасна. Для более точного определения риска заражения необходимо большее количество клинических испытаний.
Заключительный вопрос, касающийся всех передающихся с кровью вирусов и ВРТ, состоит в потенциальной возможности перекрестного заражения в лаборатории. Для достижения достаточной степени безопасности этой технологии, чтобы предложить ее больным с такими вирусами, вероятно, потребуется разделить лабораторию на хорошо защищенные сектора.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Инфекционные причины бесплодия. Диагностика
Ряд паразитарных инфекций может снижать репродуктивную функцию женщин из-за ослабления сопротивляемости к заболеваниям, ведущим к нарушению деятельности гипоталамо-гипофизарно-яичниковой системы. Сюда входят амебиаз, лямблиоз, лейшманиоз, малярия, трипаносоматоз и гельминтозы — аскаридоз и трихоцефалез. Кроме того, амебиаз, аскаридоз, энтеробиоз, филяриоз, шистосомоз и эхинококкоз могут непосредственно поражать репродуктивные органы, что также приводит к нарушению детородной функции.
Исследователи в Брюсселе обнаружили, что заражение мышей Trypanosoma cruzi, простейшим, вызывающим болезнь Шагаса в Латинской Америке, приводит у 80% из них к бесплодию.
Были описаны многочисленные инфекционные причины бесплодия. В настоящее время в США самой частой из них бывает Chlamydia salpingitis. При обследовании больной необходимо принимать во внимание и возможность наличия других возбудителей, особенно если пациентка происходит из другой части мира. Обследование семейной пары на инфекционную причину бесплодия следует начинать с подробного сбора анамнеза, включающего сведения о заражении и лечении перенесенных ЗППП, возможном заражении туберкулезом, стране происхождения супругов и об их путешествиях.
Следующим шагом должно быть тщательное обследование, включающее изучение цервикальной слизи на признаки хронического воспаления и осмотр шейки матки для выявления поражений, вызванных ВПЧ, новообразованиями, сифилисом, туберкулезом, или рубцов после перенесенных лечебных процедур. При этом нужно обратить особое внимание на хламидиоз и гонорею. Выделение культур микоплазмы и уреаплазмы не имеет большого значения для оценки бесплодия, но может оказаться полезным при обследовании больных с повторными выкидышами.
Другие пробы следует применять при наличии специфических клинических признаков. К примеру, пробу Манту ставят при подозрении на туберкулез, а тест с быстрым плазменным реагином крови — при подозрении на сифилис. Обнаружение кальциноза яичников при лапароскопии может указывать на туберкулез, и после операции женщину необходимо соответствующим образом обследовать.
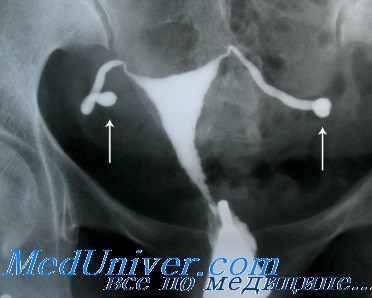
Серологические исследования на хламидии также могут сыграть свою роль при обследовании бесплодной пары. К примеру, если результаты первичного обследования, включающего ГСГ, оказались в пределах нормы, традиционно следующим шагом становится лапароскопия. Однако остается неясным, стоит ли применять лапароскопию в том случае, если у пациентки не было ЗППП или хронических болей, так как нет точной уверенности, что вероятность обнаружения какого-либо заболевания перевесит риск самой процедуры. В такой ситуации принять решение поможет анализ на антитела к хламидиям.
Проба на антитела к хламидиям — серологическая реакция, определяющая титр антихламидийных антител, состоящих из иммуноглобулина G. Эффективность этой реакции в определении вероятности поражения фаллопиевых труб хламидиями изучали в течение многих лет. Соображения о чувствительности этого метода основаны на следующем. Во-первых, серологическое исследование не дает возможности отличить существующую хламидийную инфекцию нижней части полового тракта от существующего либо перенесенного поражения трубы. Также, по некоторым оценкам, существует перекрестная реактивность между Chlamydia pneumoniae и полисахаридами грамотрицательных бактерий.
Метаанализ 23 исследований с общим количеством 2729 пациенток, прошедших лапароскопию и тест на антихламидийные антитела сыворотки крови, показал, что проба с энзимосвязанным иммуносорбентом и реакция иммунофлюоресценции оказались самыми точными в диагностике какой-либо трубной патологии: они могут быть сравнимы с гистеросальпингографией (ГСГ).
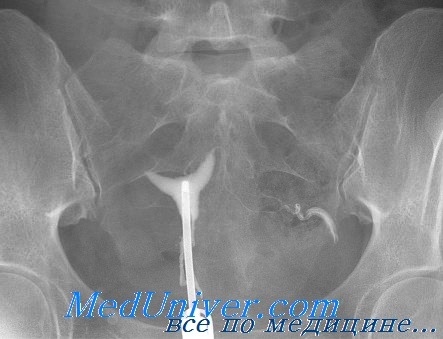
Подытоживая, можно сказать, что проба на антитела к хламидиям имеет свои ограничения, но оказывается полезным инструментом для скрининга применительно к определенной подгруппе (бесплодные женщины), помогая выделить из них тех, кому потребуются инвазивные методы обследования.
Некоторые специалисты в области лечения бесплодия предложили методику изучения патологии маточных труб, начинающуюся с серологического анализа на хламидии. Если результат отрицательный, считают они, то в дальнейшей ГСГ нет необходимости. Если же серьезные подозрения вызывает наличие в анамнезе пациентки перенесенных инфекционных заболеваний или серологический анализ дал значительные показатели, для дальнейшего исследования можно применить ГСГ или лапароскопию. Последний метод позволит получить патогенные микроорганизмы из маточных труб или Дагласова кармана.
Современное состояние проблемы инфекционных заболеваний органов малого таза (ВЗОТ):
• Neisseria gonorrhoeae поражает главным образом клетки цилиндрического и кубического эпителия, не затрагивая плоский эпителий, у девушек, достигших половой зрелости. У женщин инфекция локализуется прежде всего в слизистой оболочке канала шейки матки.
• Как и N. gonorrhoeae, Chlamydia trachomatis относится к восходящим инфекциям.
• Mycoplasma hominis была обнаружена у двух третей или более женщин, больных бактериальным вагинозом с патологическими вагинальными выделениями.
• Гепатит С — самая распространенная хроническая передающаяся с кровью инфекция в США.
• Туберкулез обычно передается воздушно-капельным путем. Из легких инфекция переносится кровью в слизистую оболочку маточной трубы, откуда может распространиться в эндометрий, яичники, шейку матки или влагалище.
• Туберкулез может быть диагностирован на основе выделения культуры из менструальной крови и гистологического исследования ткани эндометрия.
• Подсчитано, что после единичного эпизода ВЗОТ вероятность развития бесплодия из-за непроходимости маточной трубы составляет 13%, после двух эпизодов — 35%, а после трех достигает 75%.
• Хронический эндометрит связывают с N. gonorrheae, С. trachomatis, Mycobacterium tuberculosis, Mycoplasma, грибками, вирусами и паразитами.
• ВИЧ содержится в секрете и лейкоцитах семенной жидкости, но, вероятно, его нет в сперматозоидах.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Ключевые слова
Список литературы
1. Marques C., Guerreiro K., Soares S. Lights and shadows about the effectiveness of IVF in HIV infected women: A systematic review. Infect. Dis. Obstet. Gynecol. 2015; 2015: 517208.
2. Lampe M.A., Smith D.K., Anderson G.J., Edwards A.E., Nesheim S.R. Achieving safe conception in HIV-discordant couples: the potential role of oral preexposure prophylaxis (PrEP) in the United States. Am. J. Obstet. Gynecol. 2011; 204(6): 488. e1-8.
4. Savasi V., Mandia L., Laoreti A., Cetin I. Reproductive assistance in HIV serodiscordant couples. Hum. Reprod. Update. 2013; 19(2): 136-50.
5. Stora C., Epelboin S., Devouche E., Matheron S., Epelboin L., Yazbeck C. et al. Women infected with human immunodeficiency virus type 1 have poorer assisted reproduction outcomes: a case-control study. Fertil. Steril. 2016; 105(5): 1193-201.
8. Englert Y., Lesage B., Van Vooren J.P., Liesnard C., Place I., Vannin A.S. et al. Medically assisted reproduction in the presence of chronic viral diseases. Hum. Reprod. Update. 2004; 10(2): 149-62.
10. Coll O., Suy A., Figueras F., Vernaeve V., Martı´nez E., Mataro´ D. et al. Decreased pregnancy rate after in-vitro fertilization in HIV-infected women receiving HAART. .AIDS. 2006; 20(1): 121-3.
11. Martinet V., Manigart Y., Rozenberg S., Becker B., Gerard M., Delvigne A. Ovarian response to stimulation of HIV-positive patients during IVF treatment: a matched, controlled study. Hum. Reprod. 2006; 21(5): 1212-7.
12. Frodsham L., Cox A.D., Almeida A., Rozis G., Gilling-Smith C. In vitro fertilization in HIV positive women: potential mother and embryo viral transmission risk. Hum. Reprod. 2004; 19(Suppl. 1): abstr. 103.
13. Bagratee J.S. HIV/AIDS and reproduction: Background and indication for treatment. In: Kruger T.E., van der Spuy Z.M., Kempers R.D., eds. Advances in fertility studies and reproductive medicine. Cape Town: Juta Juta & Co Ltd; 2007: 414-9.
15. Santulli P., Chopin N., Patrat C., Marcellin L., Wolf J.P., Chapron C. de Ziegler D. IVF-ICSI in HIV positive and sero-discordant couples: results of five-years of experience. Hum. Reprod. 2009; 24: Abstract Book 1: 342
16. Santulli P., Gayet V., Fauque P., Chopin N., Dulioust E., Wolf J.P. et al. HIV-positive patients undertaking ART have longer infertility histories than agematched control subjects. Fertil. Steril. 2011; 95(2): 507-12.
17. Savasi V., Antonazzo P., Personeni C. Pelvic inflammatory disease. N. Engl. J. Med. 2015; 372(21): 2039-48.
19. Massad L.S., Springer G., Jacobson L., Watts H., Anastos K., Korn A. et al. Pregnancy rates and predictors of conception, miscarriage and abortion in US women with HIV. AIDS. 2004; 189(2): 281-6.
20. Nurudeen S.K., Grossman L.S., Bourne L., Guarnaccia M.M., Sauer M.V., Douglas N.C. Reproductive outcomes of HIV seropositive women treated by assisted reproduction. J. Womens Health. 2013; 22(3): 243-9.
22. Manigart Y., Rozenberg S., Barlow P., Gerard M., Bertrand E., Delvigne A. ART outcome in HIV-infected patients. Hum. Reprod. 2006; 21(11): 2935-40.
23. Douglas N.C., Wang J.G., Yu B., Gaddipati S., Guarnaccia M., Sauer M.V. A systematic, multidisciplinary approach to address the reproductive needs of HIV-seropositive women. Reprod. BioMed. Online. 2009; 19(2): 257-63.
24. Prisant N., Tubiana R., Lefebvre G., Lebray P., Marcelin A.G., Thibault V. et al. HIV-1 or hepatitis C chronic infection in serodiscordant infertile couples has no impact on infertility treatment outcome. Fertil. Steril. 2010; 93(3):1020-3.
26. Краснопольская К.В., Назаренко Т.А., Гафуров Ю.Т. Место вспомогательных репродуктивных технологий в реализации репродуктивной функции у ВИЧ-инфицированных лиц. Российский вестник акушера-гинеколога. 2013; 13(3): 47-55.
27. Назаренко Т.А., Краснопольская К.В., Исакова К.М. Программа ЭКО у ВИЧ-инфицированных пациентов (отбор больных и особенности проведения). Проблемы репродукции. 2016; 22(4): 60-5. [Nazarenko T.A., Krasnopolskaya K.V., Isakova K.M. The IVF program in HIV-infected patients (selection of patients and peculiarities of conduction). Problemyi reproduktsii. 2016; 22(4): 60-5.
28. Reynier P., May-Panloup P., Chrétien M.F., Morgan C.J., Jean M., Savagner F. et al. Mitochondrial DNA content affects the fertilizability of human oocytes. Mol. Hum. Reprod. 2001; 7(5): 425-9.
Принята в печать 23.06.2017
Об авторах / Для корреспонденции
В настоящее время ВИЧ-инфекция у детей является одной из актуальнейших проблем во всем мире.
В настоящее время ВИЧ-инфекция у детей является одной из актуальнейших проблем во всем мире. Первоначально в нашей стране она была обусловлена внутрибольничной заболеваемостью, а в последние годы — рождением детей ВИЧ-инфицированными женщинами. Более 90% детской ВИЧ-инфекции является результатом именно перинатальной трансмиссии вируса.
По данным МГЦ СПИД за последние 10 лет произошло уменьшение числа детей с врожденной ВИЧ-инфекцией. Так, если в 2001 году, когда химиопрофилактика вертикальной трансмиссии ВИЧ-инфекции только начинала проводиться, число ВИЧ-инфицированных детей составляло 8%, то в 2006 году — всего 1,5%. Таких результатов удалось добиться благодаря введению в практику схемы профилактики согласно протоколу от 1996 г. PACTG 076 (Pediatric AIDS Clinical Trial Group), который основан на назначении беременной женщине Азидотимидина — антиретровирусного препарата из группы нуклеозидных ингибиторов обратной транскриптазы.
Однако даже своевременное проведение химиопрофилактики не исключает полностью возможность перинатальной передачи ВИЧ-инфекции от матери плоду.
К факторам, повышающим риск передачи ВИЧ от матери к ребенку, относятся:
родоразрешение через естественные родовые пути (при вирусной нагрузке более 1000 копий/мл перед родами);
При отсутствии профилактики перинатальной передачи ВИЧ, риск заражения составляет 30–40% [3].
Причинами отсутствия химиопрофилактики во время беременности и родов могут быть: диагностика ВИЧ-инфекции только во время родов, употребление наркотических веществ во время беременности, добровольный отказ от профилактики, в т. ч. по религиозным убеждениям, беременность до внедрения в практику профилактики вертикальной передачи ВИЧ и домашние роды.
Особенности клинических проявлений ВИЧ-инфекции у детей определяются стадией онтогенеза, на которой произошло инфицирование плода ВИЧ в организм (внутриутробно или интранатально) и от возраста ребенка в случае постнатального заражения.
При заражении плода в позднем перинатальном периоде или ребенка после рождения течение ВИЧ-инфекции почти не отличается от взрослых.
Целью данной работы является оценка эффективности общей и высокоактивной антиретровирусной терапии (ВААРТ) у детей с врожденной ВИЧ-инфекцией.
Задачи
Нами проанализированы 60 случаев врожденной ВИЧ-инфекции у детей в возрасте от 1 месяца до 7 лет, в т. ч.: 30 амбулаторных карт детей, состоящих на диспансерном учете в московском городском центре СПИД (МГЦ СПИД); 30 историй болезни детей, находящихся на стационарном лечении в МГЦ СПИД.
По результатам анализа амбулаторных карт и историй болезни нами были выявлены следующие наиболее часто встречающиеся клинические проявления врожденной ВИЧ-инфекции у детей: поражение ЦНС, лимфаденопатия, гепатолиенальный синдром, интерстициальные изменения в легких, анемия, гипотрофия, недоношенность.
Поражение ЦНС в нашем исследовании наблюдалось у 75% детей. Установлено, что ВИЧ является не только иммунотропным, но и нейротропным вирусом и проникает через гематоэнцефалический барьер на ранних этапах инфекционного процесса в организме, поражая олигодендроциты и астроциты, нейроциты, микроглию, макрофаги, клетки эндотелия кровеносных сосудов, фибробластоподобные клетки мозга. Указанные клетки имеют рецептор CD4 и считаются прямыми клетками-мишенями для ВИЧ. Патоморфологические изменения головного мозга при ВИЧ-инфекции могут быть охарактеризованы как альтернативно-дистрофические, с периваскулярным отеком, дистрофией нейронов, очаговой демиелинизацией и циркуляторными нарушениями.
У обследованных нами ВИЧ-инфицированных детей наблюдался полиморфизм клинических неврологических проявлений.
В начале заболевания отмечались астеноневротический и цереброастенический синдромы. Для этой стадии СПИДа характерной была ВИЧ-энцефалопатия. Также было установлено, что тяжесть поражения нервной системы более выражена у детей первого года жизни.
ВИЧ-энцефалопатия — тяжелое заболевание, затрагивающее все функции ЦНС. При подострой прогрессирующей энцефалопатии утрачиваются ранее приобретенные умения и навыки. Вялотекущая прогрессирующая энцефалопатия замедляет или прекращает формирование новых навыков, не затрагивая при этом старых. Обе формы прогрессирующей энцефалопатии резко замедляют психомоторное развитие. Дети с непрогрессирующей энцефалопатией продолжают приобретать новые навыки, но медленнее, чем здоровые сверстники.
Одновременно поражение ЦНС проявлялось грубой задержкой психомоторного развития, синдромом гипервозбудимости и гидроцефальным синдромом.
Клиническая манифестация ВИЧ-инфекции у детей разнообразна и зачастую неспецифична. Нами установлено, что лимфаденопатия, ассоциированная с гепатоспленомегалией, является одним из наиболее ранних признаков врожденной ВИЧ-инфекции. Так, персистирующая генерализованная лимфаденопатия выявлена в 64% случаев, а гепатолиенальный синдром — в 38% случаев. Сочетание обоих синдромов наблюдалось у 36% детей.
Интерстициальные изменения в легких были у 25% детей, они развивались в результате многократно перенесенных ранее пневмоний различной этиологии.
Гипотрофия (от I до III степени) была выявлена у 18% больных, недоношенность отмечалась в 14% случаев.
Из сопутствующих заболеваний чаще встречались хронический вирусный гепатит С и туберкулез, а из оппортунистических заболеваний — грибковые поражения кожи и слизистых, пневмоцистная пневмония, герпетическая инфекция, цитомегаловирусная инфекция.
Грибковые поражения кожи и слизистых отмечались у 38% детей.
Наиболее частая этиология — грибы рода Candida.
Чаще всего наблюдался оральный кандидоз, которому сопутствовал ангулярный хейлит, когда в углах рта возникали мацерации, эрозии, трещины. По краям трещин иногда отмечался гиперкератоз. Для детей, больных ВИЧ/СПИДом, характерно рецидивирующее течение орофарингеального кандидоза. В зависимости от степени иммунодефицита (определяется по количеству CD4-лимфоциов), было отмечено возникновение рецидивов через несколько месяцев, недель, а иногда и дней после отмены антимикотической терапии. Продолжительность периодов ремиссии была индивидуальна у каждого больного.
Наиболее опасная оппортунистическая инфекция, пневмоцистная пневмония, наблюдалась у 26% детей. Пневмоцистная пневмония может развиться в любом возрасте, но у наблюдавшихся нами больных почти в половине случаев приходилась на первые 6 месяцев жизни.
Обычно она развивалась остро, проявляясь одышкой и кашлем. Однако в некоторых случаях сначала появлялся кашель, и в течение нескольких дней к нему присоединялось постепенно нарастающее тахипноэ. Вначале появлялось навязчивое покашливание, затем кашель становился коклюшеподобным, особенно в ночное время. У ребенка отмечалась прогрессирующая слабость, снижение аппетита, бледность кожного покрова, цианоз носогубного треугольника. Температура тела в начале заболевания была нормальной или субфебрильной [1, 5].
При физикальном исследовании выявлялись тахипноэ, одышка, влажные и сухие хрипы. При прогрессировании пневмонии, возможно, возникала легочно-сердечная недостаточность.
Диагноз пневмоцистной пневмонии был основан на обнаружении возбудителя в мокроте, в материале, полученном при бронхоальвеолярном лаваже или биопсии легкого. У большинства детей пневмоцистная пневмония сочеталась с другими оппортунистическими заболеваниями.
У ВИЧ-инфицированных детей могут наблюдаться различные поражения кожи.
В 8% случаев была выявлена инфекция кожного покрова, обусловленная вирусом Varicella-Zoster. На фоне иммунодефицита наблюдалось тяжелое генерализованное течение инфекции с полиорганными поражениями.
Цитомегаловирусная инфекция отмечалась у 7% детей. Клинически манифестация заболевания сопровождалась разнообразной симптоматикой — от сиалоаденита и лимфаденита до тяжелых диссеминированных форм.
Хронический вирусный гепатит С был выявлен у 16% детей и обусловлен вертикальной трансмиссией вируса от матери плоду.
Туберкулез отмечался в 5% случаев. Случаи заболевания были обусловлены трансплацентарным путем инфицирования.
Диагностика врожденной ВИЧ-инфекции
Диагноз ВИЧ-инфекции у ребенка может быть установлен при получении двух положительных результатов ПЦР в двух образцах крови, взятых в разные дни. ПЦР-диагностика проводится: в первые 48 часов жизни, в 14 дней жизни, в 1–2 месяца, в 3–6 месяцев [5].
ВИЧ-инфекцию можно исключить: при 2 и более отрицательных результатах ПЦР на ВИЧ (один в возрасте до 1 месяца, один — старше 4 месяцев); при 2 и более отрицательных серологических тестах на антитела к ВИЧ в возрасте старше 6 месяцев при отсутствии грудного вскармливания.
На основании приказа Минздрава РФ № 606 от 19.12.2003 г., ребенок может быть снят с диспансерного учета по ВИЧ-инфекции в возрасте 18 месяцев при отрицательном результате исследования на антитела к ВИЧ методом ИФА, отсутствии гипогаммаглобулинемии, отсутствии клинических проявлений ВИЧ-инфекции.
Лечение
Основным компонентом лечения больных ВИЧ-инфекцией является антиретровирусная терапия, с помощью которой можно добиться контролируемого течения заболевания, то есть состояния, при котором удается остановить прогрессирование болезни. Антиретровирусная терапия должна проводиться пожизненно, непрерывно. В процессе лечения проводятся обследования, цель которых — контроль его эффективности и безопасности. В плановом порядке эти обследования проводятся через 4 и 12 недель после начала лечения, впоследствии — каждые 12 недель.
Лекарственная терапия ВИЧ-инфекции включает в себя базисную терапию (которая определяется стадией заболевания и уровнем CD4-лимфоцитов), а также терапию вторичных и сопутствующих заболеваний [2].
В настоящее время придерживаются рекомендаций, разработанных Рабочей группой по антиретровирусной терапии и лечению ВИЧ-инфекции у детей (создана Национальным центром ресурсов Центра Франсуа-Ксавье Банью, Медицинским и стоматологическим университетом Нью-Джерси (UMDNJ), Управлением ресурсов и служб здравоохранения (HRSA) и Национальным институтом здравоохранения (NIH) США), согласно которым всех ВИЧ-инфицированных детей разделяют на 3 возрастных группы (до 12 месяцев, от 1 года до 5 лет и 5 лет и старше) [5].
Детям до 12 месяцев рекомендуется начинать антиретровирусную терапию, независимо от клинических проявлений, количества CD4-лимфоцитов и уровня вирусной нагрузки.
Детям от 1 года до 5 лет и старше 5 лет проведение антиретровирусной терапии рекомендуется:
при наличии СПИДа или наличии симптомов, соответствующих стадии С и большей части симптомов стадии B (по классификации CDC, 1994 г.), независимо от количества CD4-лимфоцитов и уровня вирусной нагрузки;
детям в возрасте 1 год и старше, которые находятся на стадиях N, A или имеют следующие симптомы стадии В: единственный эпизод тяжелой бактериальной инфекции или лимфоидную интерстициальную пневмонию при уровне CD4-лимфоцитов ≥ 25% у детей от 1 года до 5 лет или уровне CD4-лимфоцитов ≥ 350 клеток/мм3 у детей > 5 лет и уровне вирусной нагрузки ≥ 100 000 копий/мл.
Антиретровирусную терапию можно временно не назначать детям, у которых нет клинических проявлений ВИЧ-инфекции или они слабо выражены, при уровне CD4-лимфоцитов ≥ 25% у детей от 1 года до 5 лет или уровне CD4-лимфоцитов ≥ 350 клеток/мм3 у детей > 5 лет и уровне вирусной нагрузки < 100 000 копий/мл.
ВААРТ назначается ребенку пожизненно.
Терапия проводится не менее чем тремя препаратами с режимом приема 2–3 раза в день.
Применяются следующие группы антиретровирусных препаратов:
Препараты, блокирующие процесс обратной транскрипции (синтез вирусной ДНК на матрице вирусной РНК), — ингибиторы обратной транскриптазы. Среди них выделяют две группы препаратов:
нуклеозидные ингибиторы обратной транскриптазы (НИОТ) (измененные молекулы нуклеозидов), встраивающиеся в синтезируемую цепочку ДНК и прекращающие ее дальнейшую сборку: зидовудин (Азидотимидин)**, фосфазид*, ставудин*, диданозин**, зальцитабин*, ламивудин**, абакавир*, Комбивир (ламивудин + зидовудин);
ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ), блокирующие необходимый для осуществления обратной транскрипции вирусный фермент — обратную транскриптазу: эфавиренз*, невирапин**.
Препараты, блокирующие процесс формирования полноценных протеинов ВИЧ и, в конечном итоге, сборку новых вирусов — ингибиторы протеазы (ИП) ВИЧ: саквинавир, индинавир, нелфинавир**, ритонавир*, лопинавир/ритонавир**.
Препараты, воздействующие на рецепторы, используемые вирусом для проникновения ВИЧ в клетку хозяина, — ингибиторы слияния.
При выборе оптимальной схемы терапии для конкретного больного принимается во внимание: эффективность и токсичность препаратов, возможность их сочетания между собой, переносимость препаратов пациентом, удобство приема препаратов — кратность приема, сочетание антиретровирусных препаратов с препаратами, которые применяются (или, возможно, будут применяться) для лечения имеющихся у пациента вторичных и сопутствующих заболеваний.
Комбинация из двух препаратов НИОТ является основой различных схем антиретровирусной терапии.
Для детей рекомендуются схемы терапии, включающие 2 НИОТ и 1 ИП или 2 НИОТ и 1 ННИОТ.
В дальнейшем, при эффективной ВААРТ, уровень вирусной нагрузки должен быть ниже уровня определения, но возможны подъемы, не превышающие 1000 копий/мл (рис. 1).
В результате проведенного анализа амбулаторных карт и историй болезни детей с врожденной ВИЧ-инфекцией, получающих антиретровирусную терапию, было установлено, что в среднем уже через 3 месяца от начала лечения наблюдалось снижение уровня вирусной нагрузки ниже уровня определения (ниже 400 копий в мл), а количество CD4-лимфоцитов повышалось (рис. 2).
Эффективность специфической терапии определялась:
Если ВААРТ является неэффективной и это не связано с нарушением режима приема препарата, приемом лекарств антагонистов и т. п., рекомендуется проведение теста на резистентность вируса к лекарственным препаратам и назначение новой схемы терапии с учетом результатов этого теста.
На 2007 г. из 169 детей, состоящих на учете в МГЦ СПИД, 100 детей получают ВААРТ. Отсутствие приверженности, т. е. неготовность семьи к проведению ВААРТ, несоблюдение режима приема препаратов было в 1-м случае, что привело к летальному исходу.
Положительный тест на резистентность к ВААРТ был у 5 детей (13%). Схема лечения была пересмотрена.
Клинический пример. М. А., 2 года 11 месяцев. Дата рождения: 18.03.05 г. Находилась в детском отделении с 31.03.05 г. по 3.03.06 г. с диагнозом: ВИЧ-инфекция, стадия вторичных заболеваний IIIВ: генерализованная цитомегаловирусная инфекция, рецидивирующая пневмония, распространенная грибковая инфекция, анемия, энцефалопатия смешанного генеза, грубая задержка психомоторного и физического развития, истощение IV ст., гидроцефальный синдром, глубокая недоношенность, лимфаденопатия, гепатолиенальный синдром.
Ребенок от ВИЧ-инфицированной матери 25 лет, 7 беременностей (5 медицинских абортов), 2 преждевременных родов в домашних условиях, в женской консультации не наблюдалась. Профилактику во время беременности не получала. Вес при рождении 1280 г, рост 42 см. Состояние при поступлении тяжелое за счет острой дыхательной недостаточности, обусловленной пневмонией с ателектазами.
За время нахождения в стационаре многократно болела ОРЗ и пневмониями с обструктивным синдромом. С сентября 2005 г. полисегметарная пневмония рецидивирующего течения, плевропневмония, в ноябре 2005 г. деструктивная правосторонняя пневмония. С января 2006 г. интерстициальные изменения в легких, плевральные спайки.
Иммунный статус на 18.06.05 г.: CD4 – 920 (19%), вирусная нагрузка 6 000 000 копий/мл. С мая 2005 г. проводилась специфическая терапия: Вирасепт + Эпивир ТриТиСи + Калетра. Иммунный статус на 3.03.06 г.: CD4 – 1480 (20%), вирусная нагрузка 7300 копий/мл. На фоне лечения состояние стабилизировалось, ребенок выписан в удовлетворительном состоянии под амбулаторное наблюдение.
Выводы:
Чаще всего врожденная ВИЧ-инфекция проявляется симптомами поражения ЦНС, лимфаденопатией, гепатоспленомегалией.
Из оппортунистических инфекций ведущими являются грибковые поражения кожи и слизистых, пневмоцистная пневмония, а из сопутствующих заболеваний — хронический вирусный гепатит С.
На фоне приема ВААРТ отмечалась положительная клиническая динамика и улучшение специфических лабораторных показателей: на 12–24 неделе лечения количество CD4-лимфоцитов повысилось в среднем на 5% от исходного уровня, в то время как уровень вирусной нагрузки снизился до неопределяемого (< 400 копий/мл).
Отмечался постепенный регресс вторичных заболеваний в результате проводимой специфической терапии в сочетании с ВААРТ.
— отсутствие приверженности;
— развитие резистентности к проводимой терапии (отмечалось в 13% случаев).
Литература
Покровский В. В., Ермак Т. Н., Беляева В. В., Юрин О. Г. ВИЧ-инфекция: клиника, диагностика и лечение. 2000.
Покровский В. В., Ладная Н. Н., Соколова Е. В., Буравцова Е. В., Кравченко А. В. ВИЧ-инфекция. Информационный бюллетень № 30. 2007.
Peter Havens, Russell Van Dyke, Geoffrey Weinberg. Guidelines for the Use of Antiretroviral Agents inPediatric HIV Infection. 2008.
Н. О. Голохвастова, студентка 6 курса МГМСУ, Москва
Читайте также:

