Можно ли принимать парацетамол при вич
Обновлено: 22.04.2024
Больные, находящиеся на лечении по поводу злокачественных новообразований, за счет измененного иммунного статуса подвержены простудным заболеваниям, которые в свою очередь еще больше истощают защитные силы организма и затрудняют терапию основного диагноза
ОРВИ при злокачественных новообразованиях: риски и сложности терапии
Острые респираторные вирусные инфекции (ОРВИ), в том числе и грипп, составляющие основную долю инфекционной патологии населения всех возрастов, представляют существенную угрозу пациентам из групп риска: пожилым, беременным, детям младшего возраста и пациентам с хроническими заболеваниями, в том числе онкологическими.
Больные, находящиеся на лечении по поводу злокачественных новообразований, за счет измененного иммунного статуса подвержены простудным заболеваниям, которые в свою очередь еще больше истощают защитные силы организма и затрудняют терапию основного диагноза.
При ОРВИ на фоне онкологического процесса лечащий врач сталкивается со следующими трудностями:
- Длительность ОРВИ у иммунокомпрометированных пациентов может достигать нескольких недель, в течение которых состояние больных значительно ухудшается, и не только по иммунным показателям.
- Инфекционный процесс заставляет откладывать очередной курс химиотерапии, что сильно сказывается на прогнозе.
- Назначение противовирусной терапии может вызвать осложнения, а в частности лекарственную гепатотоксичность, так как ее эффект накладывается на гепатотоксичное действие фармакотерапии злокачественного заболевания 1 .
Таким образом, можно сказать, что необходимость в профилактике и терапии ОРВИ у онкологических пациентов неоспорима, но последнее упомянутое обстоятельство резко ограничивает выбор конкретного средства.
Варианты противовирусной терапии
Вирус-специфические препараты римантадин, занамивир и осельтамивир доказали свою эффективность, которая распространяется однако только на вирус гриппа. Кроме того, эти средства имеют ряд противопоказаний, которые зачастую делают невозможным их применение у онкологических пациентов.
В случае назначения средств, действующих на определенные вирусные белки, следует учитывать также проблему резистентности, которую вырабатывают к ним вирусы 2 . Так, появились данные о повышении до 18% частоты устойчивости вирусов гриппа А (H3N2) к осельтамивиру среди детей, получавших данный препарат для лечения гриппа 3 .
В связи с вышесказанным сегодня как никогда высока потребность в противовирусных препаратах, действующих не на инфекционный агент, а на иммунные защитные механизмы.
Оптимальное противовирусное средство, которое может быть рекомендовано для онкологической практики, должно:
- не вызывать резистентности, вероятно вследствие отличного механизма действия;
- быть безопасным, в частности при длительном применении;
- иметь минимальный риск побочных эффектов при лекарственном взаимодействии.
Перспективы использования иммуномодуляторов
Указанным критериям в полной мере соответствуют иммуномодулирующие средства, благодаря чему интерес к ним клиницистов-онкологов в последние годы резко возрос.
Иммуномодуляторы – это лекарственные средства, которые обладают иммунотропной активностью и в терапевтических дозах восстанавливают эффективную иммунную защиту. Растущая опухоль вызывает существенные изменения в иммунном ответе, а проводимая химио- и лучевая терапия, а также любые оперативные вмешательства вызывают или усугубляют иммунную недостаточность 4 . Поэтому использование иммуномодуляторов, в частности для лечения сопутствующих инфекций, является оправданным.
Эргоферон: элегантное решение непростого вопроса
Главной особенностью релиз-активных препаратов является способность воздействовать на биологически активные молекулы мишени (эндогенные регуляторы), модифицируя их физико-химические свойства. Эффект проявляется не только на молекулярном, но и на клеточном, органном, системном и организменном уровнях.
Так, прием Эргоферона усиливает функциональную активность макрофагов, натуральных киллеров и ИФН при помощи релиз-активных антител к ИФН-γ и CD4+. На этапе цитотоксических клеточных реакций CD8+ и CD4+ Т-лимфоцитов Эргоферон поддерживает противовирусный иммунитет при участии компонента релиз-активных антител к CD4+. На более поздних этапах релиз-активные антитела к CD4+ через стимуляцию рецепторов CD4 Тх2 поддерживают гуморальный противовирусный иммунитет.
Третий компонент Эргоферона – релиз-активные антитела к гистамину – обеспечивает противовоспалительный и антигистаминный эффекты, которые проявляются уменьшением длительности и выраженности катаральных симптомов и аллергических реакций, сопутствующих инфекционному процессу 7 . Это является важным преимуществом Эргоферона перед другими противовирусными препаратами, так как позволяет снизить потребление других средств и нивелировать риск лекарственного взаимодействия при параллельно проводящейся противоопухолевой терапии.
Клинический опыт
Эргоферон применяется в клинической практике с 2011 года, и его эффективность была доказана в ходе рандомизированных клинических исследований. На данный момент завершено 3 клинических исследования и продолжаются еще 4.
Исследований по лечению ОРВИ именно у онкологических больных не проводилось. Однако в клинической практике накоплен опыт назначения Эргоферона госпитализированным больным с солидными опухолями (Шаповалова Ю.С). Учитывая актуальность проблемы отсрочек курсов химиотерапии и продления сроков госпитализации, в 2012 г. был разработан внутрибольничный протокол лечения ОРВИ у госпитализированных пациентов с солидными злокачественными новообразованиями. В него включены следующие противовирусные препараты: для лечения гриппа – ингибиторы нейраминидазы занамивир и осельтамивир, а также римантадин, умифеновир и Эргоферон; для лечения ОРВИ – умифеновир и Эргоферон. Эргоферон применялся в виде монотерапии (37 пациентов) или в комбинации с римантадином (14 пациентов) в течение первых 48 часов от начала проявления симптомов заболевания. Все пациенты выздоровели через 5-9 дней лечения; нежелательных реакций, связанных с изучаемой терапией, отмечено не было. Учитывая благоприятный профиль переносимости Эргоферона и отсутствие гепатотоксичности, его применение может быть востребовано для лечения ОРВИ у пациентов онкологического профиля, в том числе находящихся в процессе химиотерапии.
Следует также отметить, что согласно экспериментам использование релиз-активных антител к ИФН-γ не приводит к гиперпродукции ИФН-γ. Этот факт немаловажен в свете недавних исследований, показавших, что ИФН-γ в больших дозах может приводить к увеличению метастазирования в легкие и резистентности клеток меланомы к терапии 11 .
Учитывая безопасность Эргоферона, доказанную в исследованиях высокого методологического качества, можно сделать вывод, что препарат стоит рекомендовать для лечения ОРВИ у пациентов со злокачественными новообразованиями 12 .
Выводы
Как доказали результаты экспериментальных и клинических исследований Эргоферон является перспективным противовирусным препаратом с принципиально новым механизмом и мишенями воздействия, и он может помочь решить проблему лечения больных в условиях изменчивости антигенных свойств вирусов и исходно скомпрометированного иммунного статуса. Комплексный препарат, сочетающий противовирусное, иммуномодулирующее, противовоспалительное и антигистаминное действие, оказывает выраженный терапевтический эффект при ОРВИ у пациентов с онкологической патологией. Препарат имеет благоприятный профиль безопасности, и его назначение позволяет снизить лекарственную нагрузку и риск лекарственного взаимодействия с противоопухолевыми препаратами.
2 Heaton NS et al. Genome-wide mutagenesis of influenza virus reveals unique plasticity of the hemagglutinin and NS1 proteins. Proc Natl Acad Sci USA 2013; 25.
3 Антимикробная терапия по Джею Сэнфорду. Под ред. Д.Гилберта, Р.Меллеринга мл., Дж.Элиопулоса и др. М.: ГРАНАТ, 2013.
5 Сыроешкин А.В., Никифорова М.В., Колдина А.М., Горнак А.А., Тарабрина И.В. Лекарственные препараты на основе релиз-активных антител. Справочник поликлинического врача. 2018 (3):15-20
6 Эпштейн О.И. Сверхмалые дозы (история одного исследования). М.: Изд-во РАМН, 2008.
7 Жавберт Е.С., Дугина Ю.Л., Эпштейн О.И. Противовоспалительные и противоаллергические свойства антител к гистамину в релиз-активной форме: обзор экспериментальных и клинических исследований. Детские инфекции. 2014; 1: 40-3.
8 Архивъ внутренней медицины. 2013; 14 (6): 46.
9 Шиловский И.П., Корнилаева Г. В., Хаитов М.Р. Новые возможности в терапии респираторно-синцитиальной вирусной инфекции: данные доклинического исследования препарата Эргоферон. Иммунология. 2012; 33 (3): 144-8.
11 Taniguchi K, Petersson M, Höglund P et al. Interferon gamma induces lung colonization by intravenously inoculated B16 melanoma cells in parallel with enhanced expression of class I major histocompatibility complex antigens. Proc Natl Acad Sci USA 1987; 84 (10): 3405-9.
На сегодняшний день ВИЧ-инфекция неизлечима полностью. Но своевременная и грамотно подобранная высокоактивная антиретровирусная терапия (ВААРТ), успешно сдерживает прогрессирование заболевания и его переход в стадию СПИД. Прием терапии позволяет ВИЧ-инфицированному пациенту жить полноценной жизнью – учится, работать, создавать семью, заниматься любимым делом и даже иметь здоровых детей. При своевременном выявлении ВИЧ, на время приема терапии вирус в крови не обнаруживается, человек безопасен для окружающих, инфекция не влияет на продолжительность жизни.

Каждый год для борьбы с ВИЧ разрабатывают новые препараты.
Что такое антиретровирусная терапия?
Высокоактивная антиретровирусная терапия – это современный метод терапии ВИЧ-инфекции. Она подразумевает прием 3-4 препаратов, действие которых направлено на подавление вируса иммунодефицита. Проводимая терапия преследует сразу 3 жизненно важных цели.
- Вирусологическая – подавляет самовоспроизведение вирионов вируса в организме пациента.
- Иммунологическая – поддерживает стабильность иммунной системы для формирования адекватного иммунного ответа.
- Клиническая – тормозит развитие СПИДа и сопутствующих ему заболеваний, тем самым повышая качество жизни и увеличивая ее продолжительность.
Отказ от терапии неизбежно приводит к осложнениям и развитию СПИДа. Люди, живущие без терапии, сталкиваются с онкологическими патологиями и оппортунистическими инфекциями, вызывающими развитие туберкулеза, менингита, энцефалита, пневмонии и других заболеваний. Продолжительность жизни на стадии СПИД без лечения не превышает 6-9 месяцев.
Принцип действия терапии анти-ВИЧ
В основе ВААРТ лежит комбинация 3-4 препаратов, действие которых подавляет ВИЧ на всех стадиях развития, в том числе и его мутации. Проблема в том, что помимо способности создавать собственные копии (репликации), вирус иммунодефицита характеризуется высокой мутагенностью – он способен подстраиваться под любые неблагоприятные условия, продолжая создавать свои репликации и мутации.
Как принимать АРВТ?
Антиретровирусная терапия проводится с соблюдением следующих принципов.
- Лекарства принимаются в строго определенное время!
- Пропускать прием препаратов нельзя!
- Самостоятельно увеличивать или уменьшать дозу препарата недопустимо!
- Препараты, режим приема и дозу препарата назначает только врач!
В процессе лечения состав АРВТ может корректироваться, что позволяет добиться максимальной эффективности проводимого лечения.
Важно понимать, что вопросы по типу, “принимать ли мне сегодня лекарства или не принимать?”, в данном случае не уместны. Конечно, соблюдать столь строгий режим, по понятным причинам, по силу не каждому пациенту. Но жить с ВИЧ без терапии – это равносильно собственноручно подписанному смертному приговору, когда у человека есть выбор и возможности для спасения.
Где выписать лекарства от ВИЧ?
Лечением ВИЧ-инфекции занимается врач-инфекционист Свердловского областного центра профилактики и борьбы со СПИД. Главное помнить – самолечение не допустимо! При подозрении на ВИЧ и после подтверждения диагноза, лечением инфекции должен заниматься исключительно профильный специалист.
Большая часть лекарств от ВИЧ находятся в списке жизненно необходимых и важнейших лекарственных препаратов. Поэтому расходы на лечение пациентов оплачиваются государством – за счет федерального и регионального бюджета. Препараты выдаются ВИЧ-позитивным пациентам в Свердловском областном центре профилактике и борьбе со СПИДили в аптеках при наличии рецепта от лечащего врача. Для их получения, пациента в обязательном порядке ставят на диспансерный учет.
Какие лекарства лечат ВИЧ?
Для общего ознакомления перечислим классы лекарств, принцип их действия и препараты с помощью наглядной таблицы.
Нуклеозидные ингибиторы* обратной транскриптазы
Подавляют обратную транскриптазу - фермент ВИЧ, который отвечает за создание ДНК репликаций
Абакавир, Зальцитабин, Ламивудин, Ставудин и др.
Ненуклеозидные ингибиторы обратной транскриптазы
Воздействуют на обратную транскриптазу
Невирапин, Рилпивирин, Эфавиренз, Элсульфавирин и др.
Блокируют фермент-протеазу вируса, в результате чего образуются вирионы, не способные заражать новые клетки организма
Ампренавир, Индинавир, Нелфинавир, Ритонавир и др.
Блокируют фермент вируса, который участвует в процессе встраивания вирусной ДНК в геном клетки-мишени
Ралтегравир, Долутегравир, Элвитегравир.
Препятствуют проникновению вирионов ВИЧ в клетку-мишень
Блокируют последний этап проникновения вирионов ВИЧ в клетку-мишень
*Ингибиторы – вещества, подавляющие течение физиологических процессов.
Несмотря на важность и жизненную необходимость лечения, в некоторых случаях, пациенты могут не выдерживать график приема лекарств, что затрудняет проведение терапии и снижает ее эффективность. Поэтому сегодня специалисты активно разрабатывают новые схемы ВААРТ, предполагающие однократный прием препарата - 1 раз в сутки. Для однократного приема уже одобрены такие лекарства, как Атазанавир, Абакавир, Диданозин, Тенофовир, Ламивудин, Эмтрицитабин, Эфавиренз и другие самые современные антиретровирусные средства.
Популярные вопросы и проблемы ВААРТ
Можно ли заразиться, если партнер принимает терапию?
Грамотно проводимая ВААРТ угнетает активность вируса, поэтому риск заражения минимальный. Но только в том случае, если у ВИЧ-позитивного пациента зафиксированы низкие или неопределяемые показатели вирусной нагрузки на организм. Если же вирусная нагрузка высокая, то риск инфицирования возрастает.
Половые партнеры должны быть информированы о ВИЧ-статусе друг друга. Наличие сопутствующих инфекций, передающихся половым путем, а также гепатита, увеличивает вероятность передачи инфекции в 3-5 раз. Даже при условии, что уровень вирусной нагрузки снижается до 3500 копий РНК ВИЧ и ниже в 1 мл крови, все равно риск передачи инфекции сохраняется. Поэтому половым партнерам необходимо использовать презервативы при любой форме полового акта.
Можно ли пить алкоголь во время терапии?
Препараты антиретровирусной терапии не совместимы с алкоголем. Более того! Прием алкоголя угнетает функции и без того ослабленной иммунной системы, создает повышенную нагрузку на организм и усиливает токсическое влияние ингибиторов – принимаемые в ходе ВААРТ препараты.
Можно ли родить здорового ребенка, если принимать ВИЧ терапию?
Применение грамотной ВААРТ позволяет снизить риск передачи инфекции до 2% и ниже. Поэтому у новорожденных от ВИЧ-инфицированной матери есть все шансы не унаследовать заболевание. Подтвердить или опровергнуть ранний диагноз позволяет своевременная диагностика методом ПЦР (полимеразной цепной реакции). Для этого кровь малыша исследуют два раза - в возрасте 1-4 месяцев, и в возрасте старше 4 месяцев. Если оба раза результаты ПЦР отрицательные, то можно говорить о том, что ребенок родился здоровым.
Мне назначили ВААРТ, но мне от нее хуже, что делать?
Антиретровирусные препараты для лечения ВИЧ обладают побочным действием, собственно, как и любые лекарства. Часть побочных эффектов проявляется практически сразу. Например, у пациента повышается температура, появляются проблемы с желудочно-кишечным трактом, кожные высыпания, увеличивается уровень инсулина в крови. ВИЧ-позитивный пациент может заметно худеть или набирать вес. Возникающие побочные эффекты создают дополнительную нагрузку на организм. Чтобы избежать этого, необходимо регулярно проходить обследование и при необходимости корректировать схему проводимой ВААРТ. Именно корректировать, а не отказываться от лечения!
Можно ли заразиться ВИЧ, если принять терапию после вероятного заражения?
У моего полового партнера ВИЧ, нужно ли мне проходить терапию, чтобы не заразиться?
Проходить ВААРТ здоровому человеку с целью профилактики ВИЧ не нужно. Достаточно использовать презерватив во время каждого полового контакта в любой форме.
Важно знать! Продолжительность жизни ВИЧ-инфицированного пациента зависит не только от эффективности ВААРТ, но и общего состояние здоровья и иммунитета. Организм людей с крепким иммунитетом, которые не имеют в своем анамнезе хронических заболеваний и врожденных патологий, лучше противостоит развитию ВИЧ-инфекции. И наоборот, ослабленный организм не в состоянии бороться с вирусом. Поэтому помимо антиретровирусной терапии, всем ВИЧ-положительным пациентам рекомендован здоровый образ жизни и правильное питание. Они должны беречь себя от инфекционных и простудных заболеваний. Укреплять свой иммунитет и в обязательном порядке проходить регулярное обследование организма.
Все интересующие вопросы лучше задавать профильным специалистам Свердловского СПИД-центра или лечащему врачу по месту жительства.
Oдним из первых препаратов, использованных для лечения ВИЧ-инфекции, был азидотимидин (АЗТ). У нас он выпускался под названием тимозид, на Западе известен как ретровир, зидовудин (ЗДВ). Суточная доза определяется стадией инфекции и переносимостью препара
Oдним из первых препаратов, использованных для лечения ВИЧ-инфекции, был азидотимидин (АЗТ). У нас он выпускался под названием тимозид, на Западе известен как ретровир, зидовудин (ЗДВ). Суточная доза определяется стадией инфекции и переносимостью препарата. Препарат относится к ингибиторам обратной траскриптазы.
Препаратами второго поколения являются дидеоксииназин (ДДИ), дидеоксицитидин (ДДС). В настоящее время спектр препаратов этой группы значительно расширился (ставудин-ДДТ, хивид, фосфозид и другие).
Эта группа лекарственных средств (ЛС) имеет ряд существенных недостатков. Указанные ЛС не подавляют полностью репликацию вируса, который может быть выделен у большинства больных во время терапии.
Как показали исследования, к ЗДВ достаточно быстро развивается устойчивость, в особенности на поздних стадиях болезни с усиленной репликацией ВИЧ, когда, по-видимому, возникает резистентность и к другим аналогам нуклеозидов.
Обычный фактор, существенно ограничивающий применение ЛС этой группы, — их токсичность. Для ЗДВ характерно главным образом токсическое действие на костный мозг, тогда как ДДИ и ДДС обладают нейротоксическим действием. Кроме того, ДДИ может вызывать тяжелый острый геморрагический панкреатит.
Установлена тесная связь между клинической неэффективностью ЗДВ и резистентностью к нему in vitro.
Вторая группа препаратов, открытая сравнительно недавно и уже широко используемая, — это ингибиторы протеаз: индиновир (криксиван), инвираза (саквиновир), вирасепт (нельфиновир) и другие.
В настоящее время речь не идет уже о монотерапии антиретровирусными средствами, а только о ди-, три- и даже тетратерапии. Такие методики позволяют снижать концентрацию вируса до величин, не определяемых с помощью современных тест-систем (< 200 копий/1 мл).
Предпочтительность комбинированной терапии обосновывается следующими положениями (В. В. Покровский).
- Использование многих этиотропных агентов более эффективно подавляет жизнедеятельность вируса, воздействуя на различные болевые точки или синергически воздействуя на одну из них.
- Это позволяет снизить дозы препаратов, что уменьшает частоту и выраженность побочных эффектов.
- Различные лекарства имеют различную способность проникать в ткани (головной мозг и т. д.).
- Комбинация лекарств затрудняет формирование устойчивости, или она появляется позднее.
Все описанные выше подходы к терапии ВИЧ-инфекции предполагали непосредственное воздействие на репликацию вируса. Другая возможная методика лечения ВИЧ-инфекции состоит в усилении защитных сил макроорганизма. Некоторые варианты такого подхода в большинстве случаев неспецифические, изредка специфические и могут воздействовать на защитные свойства клетки-хозяина.
Интерфероны, как природные, так и рекомбинантные, имеют ряд недостатков: антигенность, необходимость многократного введения для поддержания достаточной концентрации в организме, большое количество побочных эффектов и т. д.
Этих недостатков лишены многие индукторы эндогенного интерферона, некоторые из них способны включаться в синтез ИФН в некоторых популяциях клеток, что в ряде случаев имеет определенное преимущество перед поликлональной стимуляцией иммуноцитов интерфероном.
Специфическая активность циклоферона при ВИЧ-инфекции изучена в 1997 году в Институте гриппа РАМН
- Выявлена выраженная ингибирующая активность циклоферона на репродукцию ВИЧ в культуре клеток моноцитов.
- По показателям ингибирующей активности циклоферон значительно превосходит азидотимидин.
- Представленные экспериментальные данные обосновывают клиническое использование циклоферона для лечения больных ВИЧ-инфекцией.
Пятилетний опыт применения циклоферона у ВИЧ-инфицированных позволяет оценить результаты этой работы.
В период 1992 – 1997 годы в Санкт-петербургском городском центре по профилактике и борьбе со СПИД циклоферон получили 40 пациентов с разными стадиями ВИЧ-инфекции. Следует отметить, что 11 больных прошли два курса терапии циклофероном, в связи с чем общее число лиц, получивших один курс лечения циклофероном, составило 29 человек. В основном это были молодые люди в возрасте до 40 лет (20 человек), в том числе трое детей до 14 лет.
Все больные отмечали хорошую переносимость циклоферона, отсутствие пирогенных реакций после его введения.
Пациенты также констатировали улучшение общего состояния, сна и аппетита, повышение жизненного тонуса, работоспособности. 30% из числа получавших препарат и перенесших в осенне-зимний период грипп или ОРВИ отметили, что заболевание протекало непривычно легко и выздоровление наступило быстрее обычного.
Из клинической практики
После курса циклоферона отмечалось существенное снижение вирусной нагрузки (в 3,6 раза). Число CD4+ возросло на 62%. Монотерапия циклофероном оказала положительное стабильное влияние на изученные показатели у пациентов.
Определенный интерес представляют результаты многолетнего наблюдения больных ВИЧ-инфекцией, которые получали длительно циклоферон в своеобразном профилактическом режиме с целью стабилизации процесса и профилактики прогрессирования заболеваний.
В 1998 году на базе Российского научно-методического Центра по профилактике и борьбе со СПИД (руководитель член-корр. АМН В. В. Покровский) была изучена динамика суррогатных маркеров ВИЧ-инфекций (уровень CD4+) и вирусная нагрузка у больных ВИЧ-инфекцией при лечении циклофероном.
Оценка достоверности полученных результатов проводилась с помощью непараметрических критериев (критерий знаков, максимум-критерий, критерий Вилкоксона для сопряженных совокупностей).
В испытуемую группу вошли 10 взрослых больных ВИЧ-инфекцией в стадии первичных проявлений по Российской классификации ВИЧ-инфекции (В. И. Покровский, 1989 г.). Результаты исследования уровня CD4-лимфоцитов представлены в таблице и на рисунке, из которых видно, что после первых четырех недель исследования наметилась тенденция к повышению среднего уровня CD4-лимфоцитов, которое к 12-й неделе стало статистически достоверным. Это повышение сохранилось до конца исследования, несмотря на
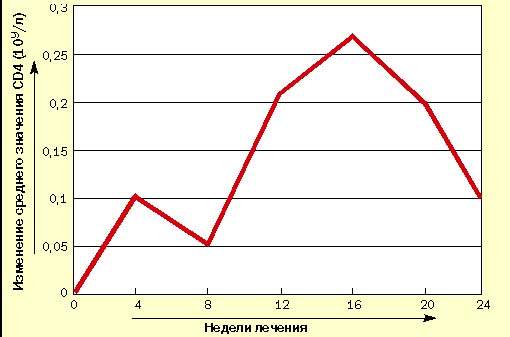 |
| Рисунок 1. Изменение уровня CD4-лимфоцитов у больных ВИЧ-инфекцией при лечении циклофероном (в сравнении с исходным уровнем) |
 |
| Рисунок 2. Средние значения изменения концентрации РНК ВИЧ (log10/мл) |
Таким образом, применение циклоферона в терапии ВИЧ-инфекций сопровождается стабилизацией клинических проявлений заболевания, улучшением состояния, а также гематологических и иммунологических показателей больных.
Циклоферон как монопрепарат оказывает иммуномодулирующее и противовирусное действие при лечении ВИЧ-инфицированных (стадии А1 3Б) в тех случаях, когда нет значительного снижения числа CD4+ клеток (<200). Хорошо зарекомендовало себя назначение циклоферона по следующей схеме.
- По 4 мл препарата в 1, 2, 4, 6, 8, 10, 13, 16, 19 и 22-й дни лечения (у детей по 2 мл). Первые две инъекции могут вводиться внутривенно, остальные внутримышечно. Повторные курсы циклоферона рекомендуется проводить через 6 месяцев под иммунологическим контролем.
- Циклоферон хорошо сочетается со всеми основными лекарственными средствами, его рекомендуется использовать в случае, когда имеются признаки активной репликации ВИЧ (высокие показатели вирусной нагрузки), у больных с обострениями различных оппортунистических заболеваний.
Исчезновение у некоторых больных иммунологических и вирусологических показаний для проведения противоретровирусной терапии может иметь важное значение для разработки новых подходов к проведению лечения больных ВИЧ-инфекцией, для снижения стоимости терапии и отсрочки развития резистентности к ней или преодолению последней.
Циклоферон может оказаться перспективным профилактическим средством при сомнительных контактах и контактах с заведомо ВИЧ-инфицированными партнерами.
Рисунок 1. Зачастую у больных астмой снижены виды на будущее, хотя некоторые склонны недооценивать тяжесть симптомов своего заболевания Какова дифференциальная диагностика между бронхиальной астмой и ХОЗЛ? С чем связаны возможны
 |
| Рисунок 1. Зачастую у больных астмой снижены виды на будущее, хотя некоторые склонны недооценивать тяжесть симптомов своего заболевания |
Какова дифференциальная диагностика между бронхиальной астмой и ХОЗЛ?
С чем связаны возможные ошибки в диагностике?
Какова основная роль b-агонистов в терапии бронхиальной астмы?
Как назначаются кортикостероиды?
Несмотря на возросшую компетентность врачей и доступность эффективных методов лечения, смертность от бронхиальной астмы остается высокой. Предотвратить многие смертельные исходы и даже избежать большинства случаев госпитализации можно было бы при проведении правильного лечения.
Необходимо помнить, что ведение больных астмой — процесс сложный и длительный.
Недооценка степени несостоятельности дыхания. Тяжесть состояния пациента и степень несостоятельности его дыхательной системы можно не распознать, если пренебречь тщательным выяснением всех проявлений болезни и построением диаграммы измерений максимальной скорости потока (МСП) выдыхаемого воздуха.
Зачастую у больных астмой снижены виды на будущее, хотя некоторые и склонны недооценивать серьезность симптомов своего заболевания. Чтобы выявить такую недооценку, нужно подробно расспросить пациента, бывает ли у него кашель или хриплое дыхание ночью или при физической нагрузке.
Если пациентам не удается достичь наилучшей возможной функции легких, то для коррекции этого состояния необходимо для начала вычислить нормальную МСП выдыхаемого воздуха для данного пациента, пользуясь диаграммой, прилагаемой к пикфлуометру.
Если измеренная МСП более чем на 20% меньше вычисленной, стоит провести исследование обратимости этого состояния, что делается путем сопоставления МСП или жизненной емкости легких (ЖЕЛ) до и после лечения.
Необходимая терапия может состоять всего лишь в однократном приеме бронходилятатора, но если это не увеличивает МСП на 20%, то есть до вычисленного уровня, могут понадобиться более серьезные меры, например трехнедельный курс системных кортикостероидов (30 мг преднизолона в день для взрослых). Таким образом выясняется наилучший достижимый уровень МСП, на который ориентируются в последующем лечении.
Иногда пациенты сообщают об уменьшении одышки, но при этом значения МСП не изменяются. В таких случаях необходимо провести измерение ЖЕЛ с помощью спирометра, которое может подтвердить улучшение, не определяемое по МСП (рис. 2). Спирометрами в настоящее время укомплектованы все врачебные приемные.
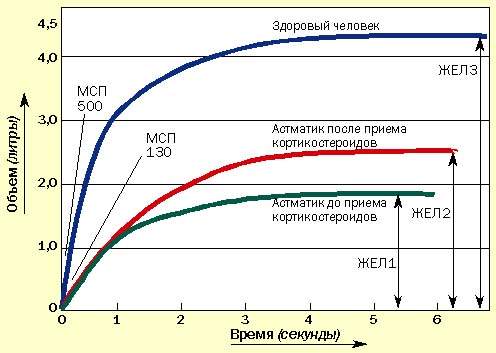 |
| Рисунок 2. Изменение ЖЕЛ под влиянием курса кортикостероидов. МСП может не измениться, но увеличение ЖЕЛ свидетельствует об улучшении состояния |
Бронхиальная астма, замаскированная под хроническое обструктивное заболевание легких (ХОЗЛ). Страдающие одышкой пациенты, которым поставлен диагноз ХОЗЛ или эмфизема, могут иметь скрытый бронхоспастический элемент, обусловленный бронхиальной астмой.
Таким пациентам необходимо провести исследование обратимости процесса, как описано выше. Любое улучшение функции легких можно поддержать, проводя адекватное лечение бронхиальной астмы. При отсутствии улучшения легочной функции назначение кортикостероидов ничем не оправдано, а только приводит к нежелательным побочным эффектам, таким как остеопороз.
Что должен помнить врач, наблюдающий больных с бронхиальной астмой
- Сказал ли я, что нужно применять спейсер при ингалировании кортикостероидов?
- Проверил ли я навыки ингаляции?
- Осмотрел ли я всех пациентов, недавно перенесших тяжелые приступы или госпитализацию?
- Все ли пациенты с повторными назначениями регулярно приходят на прием?
- Все ли я сделал, чтобы исключить астму у пациентов с ХОЗЛ?
- Проводятся ли регулярные проверки для достижения единообразного подхода к ведению астматиков?
Постоянный прием b-агонистов короткого действия. Показано, что лечение астмы постоянным приемом b-агонистов увеличивает гиперреактивность легких и утяжеляет бронхиальную астму [1]. Если пациент использует b-агонисты скорее регулярно, чем случайно, их применение должно сопровождаться назначением ингаляционных кортикостероидов или, если кортикостероиды уже применяются, увеличением их дозы до достаточной, чтобы контролировать астму. Таким образом, b-агонисты оставляют на случаи одышки и хрипов.
Последние методические указания по лечению бронхиальной астмы в Британии рекомендуют начинать с высокой дозы ингаляционных или системных кортикостероидов для достижения быстрого контроля, затем постепенно снижать дозу до минимальной, обеспечивающей нормальное самочувствие пациента и оптимальные значения МСП или ЖЕЛ на фоне минимального применения бронходилятатора (рис. 3). Быстрое облегчение состояния, достигаемое при применении кортикостероидов, улучшает настроение пациента и увеличивает его доверие к лечению.
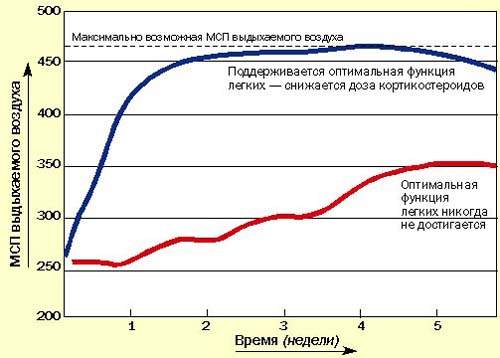 |
| Рисунок 3. Рекомендуется начинать с высоких доз кортикостероидов, а затем постепенно снижать дозу до минимальной (оптимальные значения МСП или ЖЕЛ) |
Последние данные свидетельствуют о том, что назначать кортикостероиды нужно как можно раньше всем астматикам, и не только для контролирования симптомов, но и для предотвращения прогрессирующих структурных повреждений легких, обусловленных хроническим воспалением [2,3]. Это означает, что кортикостероиды следует предпочесть b-агонистам, как только диагноз подтверждается МСП-диаграммой. b-агонисты остаются препаратами резерва на крайний случай.
Возможность альтернативного лечения. Хотя ингалируемые кортикостероиды должны быть краеугольным камнем в лечении астмы, в случаях, трудно поддающихся лечению, можно использовать и некоторые другие препараты. Доказано, что противовоспалительным эффектом обладают теофиллины в достаточно небольших дозах, но надо учитывать в каждом индивидуальном случае их возможное взаимодействие с другими препаратами.
Пожилым пациентам целесообразно назначать ипратропиум. Иногда оказываются эффективными недокромил и кромогликат.
Бронходилятаторы длительного действия, такие как сальметерол, могут облегчать состояние, особенно ночью, блокируя бронхоконстрикторные механизмы. Однако необходимо, чтобы все вышеперечисленные препараты сопровождались применением адекватных доз кортикостероидов.
Техника ингаляции. Нужно добиться, чтобы у пациентов выработались правильные навыки обращения с ингалятором. Врач должен помочь подобрать тот тип ингалятора, который наиболее удобен пациенту, и проверить его работоспособность. Для этого в кабинете врача должен быть полный набор ингаляторов.
Спейсеры. Применяемые вместе с аэрозольными ингаляторами, спейсеры облегчают проникновение препарата в легкие и снижают как накопление его в глотке, так и системное всасывание за счет проглатывания.
Спейсеры помогают координировать выброс препарата со вдохом. Это особенно важно при ингалировании кортикостероидов. Так как кортикостероиды применяются только дважды в день, громоздкий спейсер можно хранить дома.
Спейсеры обеспечивают лучшее накопление препарата в легких, чем распылители. Необходимо правильно их применять: встряхнуть ингалятор, чтобы лекарство смешалось с носителем, и однократно впрыснуть смесь с последующим скорейшим вдохом [4].
Триггерные факторы. Нераспознанные триггерные факторы могут быть и дома, и на работе, и на отдыхе, то есть практически в любом месте. Выявить источник поможет анамнез. Например, при профессиональной бронхиальной астме состояние улучшается во время отпуска и в выходные дни. Отсутствие раздражителя уменьшает или устраняет проявления болезни и снижает необходимость в лекарствах.
Проблемой, которую часто не принимают во внимание, может быть пассивное курение. Такие препараты, как b-блокаторы и нестероидные противовоспалительные средства (НПВС), также могут вызывать астму.
Использование распылителей (небулайзеров) без фоновой кортикостероидной терапии. При лечении острого астматического приступа без назначения пероральных кортикостероидов все еще используют распылители, которые обеспечивают проникновение более высокой дозы b-агонистов. Это действительно снимает бронхоспазм, но поскольку высокая доза b-агонистов не воздействует на сопутствующий воспалительный процесс, необходимо сразу же дать больному кортикостероиды внутрь, чтобы предотвратить нарастание приступа; эффект бронходилятаторов снижается по мере увеличения отека слизистой.
Если тяжесть приступа такова, что требуется небулайзер, необходимо назначить системные кортикостероиды. Даже при умеренном приступе бронходилятаторы сами по себе приносят лишь временное облегчение и есть опасность повторения приступа — возможно, глубокой ночью!
Несвоевременное назначение оральных кортикостероидов. Если не проводить противовоспалительной терапии, у больных нарастает отек слизистой, что приводит к повторению приступов. Такие пациенты часто нуждаются в госпитализации и назначении высоких доз кортикостероидов в течение нескольких дней, прежде чем у них наступит стабилизация состояния.
Пациенты, подверженные быстроразвивающимся приступам, нуждаются в как можно более раннем назначении кортикостероидов и бронходилятаторов. Они должны уметь распознавать ухудшение состояния, всегда иметь под рукой кортикостероиды и знать, как их использовать. Не следует заставлять этих пациентов дожидаться прихода к ним врача (рис. 4).
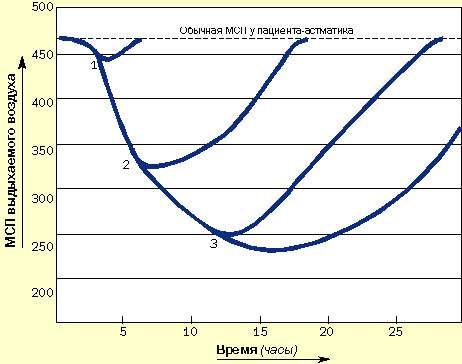 |
| Рисунок 4. Зависимость развития острых приступов от времени назначения кортикостероидов и как результат применения длительных курсов системной кортикостероидной терапии. (1) Кортикостероиды назначены сразу после возникновения приступа: выздоровление наступает быстро. (2) Кортикостероиды назначены через 6 часов: выздоровление замедлено. (3) Кортикостероиды назначены позже чем через 12 часов: приступ тяжелый и длительный, выздоровление наступает медленно |
Пациенты с постепенным развитием приступов могут подождать и посмотреть, помогает ли увеличенная доза ингаляционных кортикостероидов в сочетании с бронходилятаторами.
Неадекватный курс системных кортикостероидов. Иногда назначенные кортикостероиды отменяют до полного купирования приступа, что ведет к сохранению гиперреактивности бронхов и очередному приступу.
Подобная цепь событий может привести пациента к ложному заключению, что у него бронхиальная астма, трудно поддающаяся лечению.
Прекращение наблюдения за пациентом после острого приступа или госпитализации. Трудности возникают при отмене системного кортикостероида и назначении ингаляционного. В этот переходный период необходимо тщательное наблюдение; по достижении стабилизации состояния дозу ингалируемого кортикостероида постепенно снижают до минимально необходимой, чтобы заболевание никак себя не проявляло и функция легких была оптимальной.
Целью последующего лечения становится поддержание наивысшей МСП, достигнутой в больнице после курса системных кортикостероидов.
Консультация, проведенная через некоторое время после выписки, дает хорошую возможность проверить план ведения пациента, выяснить, что не так, и внести соответствующие поправки.
Кашель и хрипы с гнойной мокротой иногда принимают за легочную инфекцию. Однако мокрота больных астмой содержит гораздо больше эозинофилов, чем полиморфных клеток и бактерий. В пожилом возрасте левожелудочковая недостаточность и сердечная астма должны наводить на мысль о предшествующей бронхиальной астме. Будьте осторожны с b-блокаторами!
Внезапная одышка может быть обусловлена пневмотораксом или легочной эмболией. Хрипы встречаются при туберкулезе легких, бронхиальной карциноме или инородном теле и могут быть четко локализованы. Следовательно, у любого пациента с астмой, развившейся во взрослом возрасте, необходимо провести рентгенологическое исследование органов грудной клетки.
После установления диагноза основная цель врача — освободить пациента от проявлений болезни и оптимизировать функцию легких, а также установить контроль за болезнью. Для этого специально обученный медперсонал должен обучать больных и проверять правильность выполнения ими всех назначений.
Конечно, в некоторых случаях это может оказаться затруднительным, однако план предписанных действий способно усвоить абсолютное большинство больных.
Все пациенты должны:
- уметь распознать начало приступа
- знать, как применять высокие дозы b-агонистов;
- самостоятельно начать прием преднизолона внутрь;
- знать, когда звонить врачу или отправляться в больницу;
- все страдающие от приступов, должны быть обеспечены кортикостероидами.
Литература
1. Sears M. R., Taylor D. R. et al. Regular inhaled b-agonist treatment in bronchial asthma. Lancet 1990;336:1491–1396.
2. Tari Haahtela et al. Comparinson of terbutaline with budesonide in newly detected asthma. N Engl J Med 1991;325:388–392.
3. Redingon A. K., Howarth P. H. Airway remodelling in asthma. Thorax 1997;52:310–312.
4. O'Callaghan C., Barry P. Spacer devices in the treatment of asthma. BMJ 1997;314:1061–1062.
Спирометрия при хронической бронхиальной астме
Бочкообразная грудная клетка при хронической бронхиальной астме возникает из-за задержки воздуха в периферических отделах легких, что приводит к постоянному поддержанию грудной клетки в состоянии вдоха. Задержанный воздух не выдыхается и бесполезно занимает большую часть легких (остаточный объем). Это снижает объем воздуха (жизненную емкость легких), входящего в легкое.
Воздух задерживается из-за хронического воспаления, вызывающего отек слизистой периферических бронхиол. При лечении кортикостероидами отек спадает и воздух высвобождается. Это доказывается увеличением ЖЕЛ, определенной спирометрически. МСП может не изменяться (см. рис. 2.)
Читайте также:

