Можно ли вылечить ребенка от вич
Обновлено: 12.05.2024
Oдним из первых препаратов, использованных для лечения ВИЧ-инфекции, был азидотимидин (АЗТ). У нас он выпускался под названием тимозид, на Западе известен как ретровир, зидовудин (ЗДВ). Суточная доза определяется стадией инфекции и переносимостью препара
Oдним из первых препаратов, использованных для лечения ВИЧ-инфекции, был азидотимидин (АЗТ). У нас он выпускался под названием тимозид, на Западе известен как ретровир, зидовудин (ЗДВ). Суточная доза определяется стадией инфекции и переносимостью препарата. Препарат относится к ингибиторам обратной траскриптазы.
Препаратами второго поколения являются дидеоксииназин (ДДИ), дидеоксицитидин (ДДС). В настоящее время спектр препаратов этой группы значительно расширился (ставудин-ДДТ, хивид, фосфозид и другие).
Эта группа лекарственных средств (ЛС) имеет ряд существенных недостатков. Указанные ЛС не подавляют полностью репликацию вируса, который может быть выделен у большинства больных во время терапии.
Как показали исследования, к ЗДВ достаточно быстро развивается устойчивость, в особенности на поздних стадиях болезни с усиленной репликацией ВИЧ, когда, по-видимому, возникает резистентность и к другим аналогам нуклеозидов.
Обычный фактор, существенно ограничивающий применение ЛС этой группы, — их токсичность. Для ЗДВ характерно главным образом токсическое действие на костный мозг, тогда как ДДИ и ДДС обладают нейротоксическим действием. Кроме того, ДДИ может вызывать тяжелый острый геморрагический панкреатит.
Установлена тесная связь между клинической неэффективностью ЗДВ и резистентностью к нему in vitro.
Вторая группа препаратов, открытая сравнительно недавно и уже широко используемая, — это ингибиторы протеаз: индиновир (криксиван), инвираза (саквиновир), вирасепт (нельфиновир) и другие.
В настоящее время речь не идет уже о монотерапии антиретровирусными средствами, а только о ди-, три- и даже тетратерапии. Такие методики позволяют снижать концентрацию вируса до величин, не определяемых с помощью современных тест-систем (< 200 копий/1 мл).
Предпочтительность комбинированной терапии обосновывается следующими положениями (В. В. Покровский).
- Использование многих этиотропных агентов более эффективно подавляет жизнедеятельность вируса, воздействуя на различные болевые точки или синергически воздействуя на одну из них.
- Это позволяет снизить дозы препаратов, что уменьшает частоту и выраженность побочных эффектов.
- Различные лекарства имеют различную способность проникать в ткани (головной мозг и т. д.).
- Комбинация лекарств затрудняет формирование устойчивости, или она появляется позднее.
Все описанные выше подходы к терапии ВИЧ-инфекции предполагали непосредственное воздействие на репликацию вируса. Другая возможная методика лечения ВИЧ-инфекции состоит в усилении защитных сил макроорганизма. Некоторые варианты такого подхода в большинстве случаев неспецифические, изредка специфические и могут воздействовать на защитные свойства клетки-хозяина.
Интерфероны, как природные, так и рекомбинантные, имеют ряд недостатков: антигенность, необходимость многократного введения для поддержания достаточной концентрации в организме, большое количество побочных эффектов и т. д.
Этих недостатков лишены многие индукторы эндогенного интерферона, некоторые из них способны включаться в синтез ИФН в некоторых популяциях клеток, что в ряде случаев имеет определенное преимущество перед поликлональной стимуляцией иммуноцитов интерфероном.
Специфическая активность циклоферона при ВИЧ-инфекции изучена в 1997 году в Институте гриппа РАМН
- Выявлена выраженная ингибирующая активность циклоферона на репродукцию ВИЧ в культуре клеток моноцитов.
- По показателям ингибирующей активности циклоферон значительно превосходит азидотимидин.
- Представленные экспериментальные данные обосновывают клиническое использование циклоферона для лечения больных ВИЧ-инфекцией.
Пятилетний опыт применения циклоферона у ВИЧ-инфицированных позволяет оценить результаты этой работы.
В период 1992 – 1997 годы в Санкт-петербургском городском центре по профилактике и борьбе со СПИД циклоферон получили 40 пациентов с разными стадиями ВИЧ-инфекции. Следует отметить, что 11 больных прошли два курса терапии циклофероном, в связи с чем общее число лиц, получивших один курс лечения циклофероном, составило 29 человек. В основном это были молодые люди в возрасте до 40 лет (20 человек), в том числе трое детей до 14 лет.
Все больные отмечали хорошую переносимость циклоферона, отсутствие пирогенных реакций после его введения.
Пациенты также констатировали улучшение общего состояния, сна и аппетита, повышение жизненного тонуса, работоспособности. 30% из числа получавших препарат и перенесших в осенне-зимний период грипп или ОРВИ отметили, что заболевание протекало непривычно легко и выздоровление наступило быстрее обычного.
Из клинической практики
После курса циклоферона отмечалось существенное снижение вирусной нагрузки (в 3,6 раза). Число CD4+ возросло на 62%. Монотерапия циклофероном оказала положительное стабильное влияние на изученные показатели у пациентов.
Определенный интерес представляют результаты многолетнего наблюдения больных ВИЧ-инфекцией, которые получали длительно циклоферон в своеобразном профилактическом режиме с целью стабилизации процесса и профилактики прогрессирования заболеваний.
В 1998 году на базе Российского научно-методического Центра по профилактике и борьбе со СПИД (руководитель член-корр. АМН В. В. Покровский) была изучена динамика суррогатных маркеров ВИЧ-инфекций (уровень CD4+) и вирусная нагрузка у больных ВИЧ-инфекцией при лечении циклофероном.
Оценка достоверности полученных результатов проводилась с помощью непараметрических критериев (критерий знаков, максимум-критерий, критерий Вилкоксона для сопряженных совокупностей).
В испытуемую группу вошли 10 взрослых больных ВИЧ-инфекцией в стадии первичных проявлений по Российской классификации ВИЧ-инфекции (В. И. Покровский, 1989 г.). Результаты исследования уровня CD4-лимфоцитов представлены в таблице и на рисунке, из которых видно, что после первых четырех недель исследования наметилась тенденция к повышению среднего уровня CD4-лимфоцитов, которое к 12-й неделе стало статистически достоверным. Это повышение сохранилось до конца исследования, несмотря на
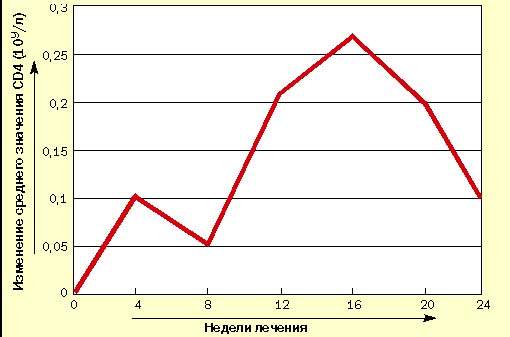 |
| Рисунок 1. Изменение уровня CD4-лимфоцитов у больных ВИЧ-инфекцией при лечении циклофероном (в сравнении с исходным уровнем) |
 |
| Рисунок 2. Средние значения изменения концентрации РНК ВИЧ (log10/мл) |
Таким образом, применение циклоферона в терапии ВИЧ-инфекций сопровождается стабилизацией клинических проявлений заболевания, улучшением состояния, а также гематологических и иммунологических показателей больных.
Циклоферон как монопрепарат оказывает иммуномодулирующее и противовирусное действие при лечении ВИЧ-инфицированных (стадии А1 3Б) в тех случаях, когда нет значительного снижения числа CD4+ клеток (<200). Хорошо зарекомендовало себя назначение циклоферона по следующей схеме.
- По 4 мл препарата в 1, 2, 4, 6, 8, 10, 13, 16, 19 и 22-й дни лечения (у детей по 2 мл). Первые две инъекции могут вводиться внутривенно, остальные внутримышечно. Повторные курсы циклоферона рекомендуется проводить через 6 месяцев под иммунологическим контролем.
- Циклоферон хорошо сочетается со всеми основными лекарственными средствами, его рекомендуется использовать в случае, когда имеются признаки активной репликации ВИЧ (высокие показатели вирусной нагрузки), у больных с обострениями различных оппортунистических заболеваний.
Исчезновение у некоторых больных иммунологических и вирусологических показаний для проведения противоретровирусной терапии может иметь важное значение для разработки новых подходов к проведению лечения больных ВИЧ-инфекцией, для снижения стоимости терапии и отсрочки развития резистентности к ней или преодолению последней.
Циклоферон может оказаться перспективным профилактическим средством при сомнительных контактах и контактах с заведомо ВИЧ-инфицированными партнерами.
В настоящее время ВИЧ-инфекция у детей является одной из актуальнейших проблем во всем мире.
В настоящее время ВИЧ-инфекция у детей является одной из актуальнейших проблем во всем мире. Первоначально в нашей стране она была обусловлена внутрибольничной заболеваемостью, а в последние годы — рождением детей ВИЧ-инфицированными женщинами. Более 90% детской ВИЧ-инфекции является результатом именно перинатальной трансмиссии вируса.
По данным МГЦ СПИД за последние 10 лет произошло уменьшение числа детей с врожденной ВИЧ-инфекцией. Так, если в 2001 году, когда химиопрофилактика вертикальной трансмиссии ВИЧ-инфекции только начинала проводиться, число ВИЧ-инфицированных детей составляло 8%, то в 2006 году — всего 1,5%. Таких результатов удалось добиться благодаря введению в практику схемы профилактики согласно протоколу от 1996 г. PACTG 076 (Pediatric AIDS Clinical Trial Group), который основан на назначении беременной женщине Азидотимидина — антиретровирусного препарата из группы нуклеозидных ингибиторов обратной транскриптазы.
Однако даже своевременное проведение химиопрофилактики не исключает полностью возможность перинатальной передачи ВИЧ-инфекции от матери плоду.
К факторам, повышающим риск передачи ВИЧ от матери к ребенку, относятся:
родоразрешение через естественные родовые пути (при вирусной нагрузке более 1000 копий/мл перед родами);
При отсутствии профилактики перинатальной передачи ВИЧ, риск заражения составляет 30–40% [3].
Причинами отсутствия химиопрофилактики во время беременности и родов могут быть: диагностика ВИЧ-инфекции только во время родов, употребление наркотических веществ во время беременности, добровольный отказ от профилактики, в т. ч. по религиозным убеждениям, беременность до внедрения в практику профилактики вертикальной передачи ВИЧ и домашние роды.
Особенности клинических проявлений ВИЧ-инфекции у детей определяются стадией онтогенеза, на которой произошло инфицирование плода ВИЧ в организм (внутриутробно или интранатально) и от возраста ребенка в случае постнатального заражения.
При заражении плода в позднем перинатальном периоде или ребенка после рождения течение ВИЧ-инфекции почти не отличается от взрослых.
Целью данной работы является оценка эффективности общей и высокоактивной антиретровирусной терапии (ВААРТ) у детей с врожденной ВИЧ-инфекцией.
Задачи
Нами проанализированы 60 случаев врожденной ВИЧ-инфекции у детей в возрасте от 1 месяца до 7 лет, в т. ч.: 30 амбулаторных карт детей, состоящих на диспансерном учете в московском городском центре СПИД (МГЦ СПИД); 30 историй болезни детей, находящихся на стационарном лечении в МГЦ СПИД.
По результатам анализа амбулаторных карт и историй болезни нами были выявлены следующие наиболее часто встречающиеся клинические проявления врожденной ВИЧ-инфекции у детей: поражение ЦНС, лимфаденопатия, гепатолиенальный синдром, интерстициальные изменения в легких, анемия, гипотрофия, недоношенность.
Поражение ЦНС в нашем исследовании наблюдалось у 75% детей. Установлено, что ВИЧ является не только иммунотропным, но и нейротропным вирусом и проникает через гематоэнцефалический барьер на ранних этапах инфекционного процесса в организме, поражая олигодендроциты и астроциты, нейроциты, микроглию, макрофаги, клетки эндотелия кровеносных сосудов, фибробластоподобные клетки мозга. Указанные клетки имеют рецептор CD4 и считаются прямыми клетками-мишенями для ВИЧ. Патоморфологические изменения головного мозга при ВИЧ-инфекции могут быть охарактеризованы как альтернативно-дистрофические, с периваскулярным отеком, дистрофией нейронов, очаговой демиелинизацией и циркуляторными нарушениями.
У обследованных нами ВИЧ-инфицированных детей наблюдался полиморфизм клинических неврологических проявлений.
В начале заболевания отмечались астеноневротический и цереброастенический синдромы. Для этой стадии СПИДа характерной была ВИЧ-энцефалопатия. Также было установлено, что тяжесть поражения нервной системы более выражена у детей первого года жизни.
ВИЧ-энцефалопатия — тяжелое заболевание, затрагивающее все функции ЦНС. При подострой прогрессирующей энцефалопатии утрачиваются ранее приобретенные умения и навыки. Вялотекущая прогрессирующая энцефалопатия замедляет или прекращает формирование новых навыков, не затрагивая при этом старых. Обе формы прогрессирующей энцефалопатии резко замедляют психомоторное развитие. Дети с непрогрессирующей энцефалопатией продолжают приобретать новые навыки, но медленнее, чем здоровые сверстники.
Одновременно поражение ЦНС проявлялось грубой задержкой психомоторного развития, синдромом гипервозбудимости и гидроцефальным синдромом.
Клиническая манифестация ВИЧ-инфекции у детей разнообразна и зачастую неспецифична. Нами установлено, что лимфаденопатия, ассоциированная с гепатоспленомегалией, является одним из наиболее ранних признаков врожденной ВИЧ-инфекции. Так, персистирующая генерализованная лимфаденопатия выявлена в 64% случаев, а гепатолиенальный синдром — в 38% случаев. Сочетание обоих синдромов наблюдалось у 36% детей.
Интерстициальные изменения в легких были у 25% детей, они развивались в результате многократно перенесенных ранее пневмоний различной этиологии.
Гипотрофия (от I до III степени) была выявлена у 18% больных, недоношенность отмечалась в 14% случаев.
Из сопутствующих заболеваний чаще встречались хронический вирусный гепатит С и туберкулез, а из оппортунистических заболеваний — грибковые поражения кожи и слизистых, пневмоцистная пневмония, герпетическая инфекция, цитомегаловирусная инфекция.
Грибковые поражения кожи и слизистых отмечались у 38% детей.
Наиболее частая этиология — грибы рода Candida.
Чаще всего наблюдался оральный кандидоз, которому сопутствовал ангулярный хейлит, когда в углах рта возникали мацерации, эрозии, трещины. По краям трещин иногда отмечался гиперкератоз. Для детей, больных ВИЧ/СПИДом, характерно рецидивирующее течение орофарингеального кандидоза. В зависимости от степени иммунодефицита (определяется по количеству CD4-лимфоциов), было отмечено возникновение рецидивов через несколько месяцев, недель, а иногда и дней после отмены антимикотической терапии. Продолжительность периодов ремиссии была индивидуальна у каждого больного.
Наиболее опасная оппортунистическая инфекция, пневмоцистная пневмония, наблюдалась у 26% детей. Пневмоцистная пневмония может развиться в любом возрасте, но у наблюдавшихся нами больных почти в половине случаев приходилась на первые 6 месяцев жизни.
Обычно она развивалась остро, проявляясь одышкой и кашлем. Однако в некоторых случаях сначала появлялся кашель, и в течение нескольких дней к нему присоединялось постепенно нарастающее тахипноэ. Вначале появлялось навязчивое покашливание, затем кашель становился коклюшеподобным, особенно в ночное время. У ребенка отмечалась прогрессирующая слабость, снижение аппетита, бледность кожного покрова, цианоз носогубного треугольника. Температура тела в начале заболевания была нормальной или субфебрильной [1, 5].
При физикальном исследовании выявлялись тахипноэ, одышка, влажные и сухие хрипы. При прогрессировании пневмонии, возможно, возникала легочно-сердечная недостаточность.
Диагноз пневмоцистной пневмонии был основан на обнаружении возбудителя в мокроте, в материале, полученном при бронхоальвеолярном лаваже или биопсии легкого. У большинства детей пневмоцистная пневмония сочеталась с другими оппортунистическими заболеваниями.
У ВИЧ-инфицированных детей могут наблюдаться различные поражения кожи.
В 8% случаев была выявлена инфекция кожного покрова, обусловленная вирусом Varicella-Zoster. На фоне иммунодефицита наблюдалось тяжелое генерализованное течение инфекции с полиорганными поражениями.
Цитомегаловирусная инфекция отмечалась у 7% детей. Клинически манифестация заболевания сопровождалась разнообразной симптоматикой — от сиалоаденита и лимфаденита до тяжелых диссеминированных форм.
Хронический вирусный гепатит С был выявлен у 16% детей и обусловлен вертикальной трансмиссией вируса от матери плоду.
Туберкулез отмечался в 5% случаев. Случаи заболевания были обусловлены трансплацентарным путем инфицирования.
Диагностика врожденной ВИЧ-инфекции
Диагноз ВИЧ-инфекции у ребенка может быть установлен при получении двух положительных результатов ПЦР в двух образцах крови, взятых в разные дни. ПЦР-диагностика проводится: в первые 48 часов жизни, в 14 дней жизни, в 1–2 месяца, в 3–6 месяцев [5].
ВИЧ-инфекцию можно исключить: при 2 и более отрицательных результатах ПЦР на ВИЧ (один в возрасте до 1 месяца, один — старше 4 месяцев); при 2 и более отрицательных серологических тестах на антитела к ВИЧ в возрасте старше 6 месяцев при отсутствии грудного вскармливания.
На основании приказа Минздрава РФ № 606 от 19.12.2003 г., ребенок может быть снят с диспансерного учета по ВИЧ-инфекции в возрасте 18 месяцев при отрицательном результате исследования на антитела к ВИЧ методом ИФА, отсутствии гипогаммаглобулинемии, отсутствии клинических проявлений ВИЧ-инфекции.
Лечение
Основным компонентом лечения больных ВИЧ-инфекцией является антиретровирусная терапия, с помощью которой можно добиться контролируемого течения заболевания, то есть состояния, при котором удается остановить прогрессирование болезни. Антиретровирусная терапия должна проводиться пожизненно, непрерывно. В процессе лечения проводятся обследования, цель которых — контроль его эффективности и безопасности. В плановом порядке эти обследования проводятся через 4 и 12 недель после начала лечения, впоследствии — каждые 12 недель.
Лекарственная терапия ВИЧ-инфекции включает в себя базисную терапию (которая определяется стадией заболевания и уровнем CD4-лимфоцитов), а также терапию вторичных и сопутствующих заболеваний [2].
В настоящее время придерживаются рекомендаций, разработанных Рабочей группой по антиретровирусной терапии и лечению ВИЧ-инфекции у детей (создана Национальным центром ресурсов Центра Франсуа-Ксавье Банью, Медицинским и стоматологическим университетом Нью-Джерси (UMDNJ), Управлением ресурсов и служб здравоохранения (HRSA) и Национальным институтом здравоохранения (NIH) США), согласно которым всех ВИЧ-инфицированных детей разделяют на 3 возрастных группы (до 12 месяцев, от 1 года до 5 лет и 5 лет и старше) [5].
Детям до 12 месяцев рекомендуется начинать антиретровирусную терапию, независимо от клинических проявлений, количества CD4-лимфоцитов и уровня вирусной нагрузки.
Детям от 1 года до 5 лет и старше 5 лет проведение антиретровирусной терапии рекомендуется:
при наличии СПИДа или наличии симптомов, соответствующих стадии С и большей части симптомов стадии B (по классификации CDC, 1994 г.), независимо от количества CD4-лимфоцитов и уровня вирусной нагрузки;
детям в возрасте 1 год и старше, которые находятся на стадиях N, A или имеют следующие симптомы стадии В: единственный эпизод тяжелой бактериальной инфекции или лимфоидную интерстициальную пневмонию при уровне CD4-лимфоцитов ≥ 25% у детей от 1 года до 5 лет или уровне CD4-лимфоцитов ≥ 350 клеток/мм3 у детей > 5 лет и уровне вирусной нагрузки ≥ 100 000 копий/мл.
Антиретровирусную терапию можно временно не назначать детям, у которых нет клинических проявлений ВИЧ-инфекции или они слабо выражены, при уровне CD4-лимфоцитов ≥ 25% у детей от 1 года до 5 лет или уровне CD4-лимфоцитов ≥ 350 клеток/мм3 у детей > 5 лет и уровне вирусной нагрузки < 100 000 копий/мл.
ВААРТ назначается ребенку пожизненно.
Терапия проводится не менее чем тремя препаратами с режимом приема 2–3 раза в день.
Применяются следующие группы антиретровирусных препаратов:
Препараты, блокирующие процесс обратной транскрипции (синтез вирусной ДНК на матрице вирусной РНК), — ингибиторы обратной транскриптазы. Среди них выделяют две группы препаратов:
нуклеозидные ингибиторы обратной транскриптазы (НИОТ) (измененные молекулы нуклеозидов), встраивающиеся в синтезируемую цепочку ДНК и прекращающие ее дальнейшую сборку: зидовудин (Азидотимидин)**, фосфазид*, ставудин*, диданозин**, зальцитабин*, ламивудин**, абакавир*, Комбивир (ламивудин + зидовудин);
ненуклеозидные ингибиторы обратной транскриптазы (ННИОТ), блокирующие необходимый для осуществления обратной транскрипции вирусный фермент — обратную транскриптазу: эфавиренз*, невирапин**.
Препараты, блокирующие процесс формирования полноценных протеинов ВИЧ и, в конечном итоге, сборку новых вирусов — ингибиторы протеазы (ИП) ВИЧ: саквинавир, индинавир, нелфинавир**, ритонавир*, лопинавир/ритонавир**.
Препараты, воздействующие на рецепторы, используемые вирусом для проникновения ВИЧ в клетку хозяина, — ингибиторы слияния.
При выборе оптимальной схемы терапии для конкретного больного принимается во внимание: эффективность и токсичность препаратов, возможность их сочетания между собой, переносимость препаратов пациентом, удобство приема препаратов — кратность приема, сочетание антиретровирусных препаратов с препаратами, которые применяются (или, возможно, будут применяться) для лечения имеющихся у пациента вторичных и сопутствующих заболеваний.
Комбинация из двух препаратов НИОТ является основой различных схем антиретровирусной терапии.
Для детей рекомендуются схемы терапии, включающие 2 НИОТ и 1 ИП или 2 НИОТ и 1 ННИОТ.
В дальнейшем, при эффективной ВААРТ, уровень вирусной нагрузки должен быть ниже уровня определения, но возможны подъемы, не превышающие 1000 копий/мл (рис. 1).
В результате проведенного анализа амбулаторных карт и историй болезни детей с врожденной ВИЧ-инфекцией, получающих антиретровирусную терапию, было установлено, что в среднем уже через 3 месяца от начала лечения наблюдалось снижение уровня вирусной нагрузки ниже уровня определения (ниже 400 копий в мл), а количество CD4-лимфоцитов повышалось (рис. 2).
Эффективность специфической терапии определялась:
Если ВААРТ является неэффективной и это не связано с нарушением режима приема препарата, приемом лекарств антагонистов и т. п., рекомендуется проведение теста на резистентность вируса к лекарственным препаратам и назначение новой схемы терапии с учетом результатов этого теста.
На 2007 г. из 169 детей, состоящих на учете в МГЦ СПИД, 100 детей получают ВААРТ. Отсутствие приверженности, т. е. неготовность семьи к проведению ВААРТ, несоблюдение режима приема препаратов было в 1-м случае, что привело к летальному исходу.
Положительный тест на резистентность к ВААРТ был у 5 детей (13%). Схема лечения была пересмотрена.
Клинический пример. М. А., 2 года 11 месяцев. Дата рождения: 18.03.05 г. Находилась в детском отделении с 31.03.05 г. по 3.03.06 г. с диагнозом: ВИЧ-инфекция, стадия вторичных заболеваний IIIВ: генерализованная цитомегаловирусная инфекция, рецидивирующая пневмония, распространенная грибковая инфекция, анемия, энцефалопатия смешанного генеза, грубая задержка психомоторного и физического развития, истощение IV ст., гидроцефальный синдром, глубокая недоношенность, лимфаденопатия, гепатолиенальный синдром.
Ребенок от ВИЧ-инфицированной матери 25 лет, 7 беременностей (5 медицинских абортов), 2 преждевременных родов в домашних условиях, в женской консультации не наблюдалась. Профилактику во время беременности не получала. Вес при рождении 1280 г, рост 42 см. Состояние при поступлении тяжелое за счет острой дыхательной недостаточности, обусловленной пневмонией с ателектазами.
За время нахождения в стационаре многократно болела ОРЗ и пневмониями с обструктивным синдромом. С сентября 2005 г. полисегметарная пневмония рецидивирующего течения, плевропневмония, в ноябре 2005 г. деструктивная правосторонняя пневмония. С января 2006 г. интерстициальные изменения в легких, плевральные спайки.
Иммунный статус на 18.06.05 г.: CD4 – 920 (19%), вирусная нагрузка 6 000 000 копий/мл. С мая 2005 г. проводилась специфическая терапия: Вирасепт + Эпивир ТриТиСи + Калетра. Иммунный статус на 3.03.06 г.: CD4 – 1480 (20%), вирусная нагрузка 7300 копий/мл. На фоне лечения состояние стабилизировалось, ребенок выписан в удовлетворительном состоянии под амбулаторное наблюдение.
Выводы:
Чаще всего врожденная ВИЧ-инфекция проявляется симптомами поражения ЦНС, лимфаденопатией, гепатоспленомегалией.
Из оппортунистических инфекций ведущими являются грибковые поражения кожи и слизистых, пневмоцистная пневмония, а из сопутствующих заболеваний — хронический вирусный гепатит С.
На фоне приема ВААРТ отмечалась положительная клиническая динамика и улучшение специфических лабораторных показателей: на 12–24 неделе лечения количество CD4-лимфоцитов повысилось в среднем на 5% от исходного уровня, в то время как уровень вирусной нагрузки снизился до неопределяемого (< 400 копий/мл).
Отмечался постепенный регресс вторичных заболеваний в результате проводимой специфической терапии в сочетании с ВААРТ.
— отсутствие приверженности;
— развитие резистентности к проводимой терапии (отмечалось в 13% случаев).
Литература
Покровский В. В., Ермак Т. Н., Беляева В. В., Юрин О. Г. ВИЧ-инфекция: клиника, диагностика и лечение. 2000.
Покровский В. В., Ладная Н. Н., Соколова Е. В., Буравцова Е. В., Кравченко А. В. ВИЧ-инфекция. Информационный бюллетень № 30. 2007.
Peter Havens, Russell Van Dyke, Geoffrey Weinberg. Guidelines for the Use of Antiretroviral Agents inPediatric HIV Infection. 2008.
Н. О. Голохвастова, студентка 6 курса МГМСУ, Москва

Возможно ли полное выздоровление от ВИЧ-инфекции, как, например, это происходит при лечении гепатита С?
Чтобы снизить риск развития негативных последствий, пациенту дают иммуносупрессивные (подавляющие действие клеток трансплантата) препараты. В этот период человек становится крайне уязвим к инфекциям, его помещают в специальный стерильный бокс; также нередко требуются переливания крови и тромбоцитарной массы.
Каким образом трансплантация способствовала излечению от ВИЧ-инфекции
После трансплантации мужчина перестал принимать антиретровирусную терапию (АРВТ), и вирус в организме больше не выявлялся. К сожалению, в сентябре 2020 года Тимоти Рэй Браун скончался в возрасте 54 лет: смерть была вызвана рецидивом лейкоза.
Другие случаи выздоровления от иммунодефицита
К сожалению, данная манипуляция является слишком сложной, опасной и дорогостоящей для того, чтобы таким образом лечить всех пациентов с ВИЧ. Выздоровление может наступить, но польза от операции существенно меньше рисков, которые возникают при трансплантации костного мозга. Это тем более актуально сегодня, когда мы имеем большое количество высокоэффективных и безопасных антиретровирусных препаратов. Однако сам факт выздоровления пациентов дает надежду на то, что в будущем излечение от ВИЧ-инфекции возможно.
Несколько лет к случаям выздоровления ВИЧ-инфицированного человека относили ситуацию пациента из Сан-Паулу, который, согласно протоколу клинического исследования, получал интенсифицированный режим АРВТ (5 препаратов и никотинамид). После прерывания терапии у него длительное время сохранялась неопределяемая вирусная нагрузка и не определялась ДНК вируса в мононуклеарах крови (один из резервуаров ВИЧ в организме). Но в ноябре 2020 года (через 6 лет после прерывания терапии) исследование крови на вирусную нагрузку ВИЧ вновь показало положительный результат — 6300 коп/мл.
По сравнению с вирусом, который выявлялся у пациента на момент начала терапии, выявленные копии имеют генетические отличия в структуре РНК ВИЧ. Было ли выздоровление у пациента из Бразилии? Отличия в геноме могут быть связаны с эволюцией вируса внутри организма или с тем, что изначально произошло инфицирование несколькими штаммами, с последующей активацией другого субтипа вируса (в обоих случаях мы говорим о рецидиве инфекции). Кроме того, могла иметь место реинфекция (повторное проникновение вируса в организм).
В настоящее время активно ведутся разработки, которые помогут достичь полного излечения от ВИЧ-инфекции. Но мы узнаем лишь в будущем, какие из них окажутся действительно эффективными.
Автор: врач-инфекционист Университетской клиники H-Clinic Светлана Юрьевна Дегтярева
Медицинский редактор: руководитель Университетской клиники H-Clinic, к.м.н., врач-инфекционист Коннов Данила Сергеевич.

Исследование CHER показало, что начало терапии в возрасте от 1,5 до 3 месяцев даже при нормальном уровне CD4-лимфоцитов снижает на 75% раннюю детскую смертность по сравнению с теми, кто начинал терапию отсрочено, так, как это практиковалось в прошлом. Кроме того, дети при раннем начале терапии значимо лучше растут, развиваются физически и особенно психически.
Если же ребенок по неким причинам не получает терапию в первый год жизни, и все риски, связанные с первым годом жизни, миновали его, то при невысоких темпах развития заболевания выгоды от начала терапии в возрасте от года до двух не столь яркие, как в меньшем возрасте, однако, и там они явно прослеживаются. И исследования в других возрастных группах показывают, что даже при очень благоприятном течении заболевания антиретровирусная терапия и подавление ВИЧ обеспечивают детям своевременное и гармоничное развитие, заметно снижают риски различных неврологических состояний, которые несут большие риски в детском возрасте, когда идет активное формирование центральной нервной системы.
Американские и европейские руководства предельно совпадают в своих рекомендациях, Paediatric European Network for Treatment of AIDS в 2016 году сформулировала предельно близкие рекомендации и пришла к аналогичным выводам.
Арсенал средств для терапии у детей заметно уже того, что доступен для взрослых. Дело вовсе не в том, что для детей опасны те препараты, что получают взрослые, дело во времени – чтобы доказать безопасность у детей разных возрастных групп, требуется куда больше времени и денег. В Российской Федерации на эту проблему накладывается отставание с доступом к новым детским формам и дозировкам, а также крайняя неповоротливость регуляторов.
В возрасте до 14 дней в качестве третьего компонента схемы в США используют невирапин и ралтегравир. С двухнедельного возраста невирапин уже обычно не используют, а применяют усиленный лопинавир (Калетра) или ралтегравир. После трех месяцев доступен усиленный атазанавир или дарунавир, с шести лет добавяется опция долутегравира, и после 12 лет доступен усиленный элвитегравир.
Задача управления терапией у детей непростая, ее эффективное и безопасное решение требует высокой квалификации врача и весьма регулярного контакта с маленьким пациентом. Выбирайте врачей правильно, начинайте терапию у ваших детей так рано, как это возможно.
Shiau S. и др. Early age at start of antiretroviral therapy associated with better virologic control after initial suppression in HIV-infected infants. AIDS. 2017 Jan 28;31(3):355-364.PMID: 27828785.
Violari A. и др. Early antiretroviral therapy and mortality among HIV-infected infants. N Engl J Med. 2008 Nov 20;359(21):2233-44. PMID:19020325.
Читайте также:

