Можно ли вылечить сепсис после операции
Обновлено: 25.04.2024
В том же 2016 году в США было проведено исследование затратности медицинской помощи, оказываемой в интенсивном краткосрочном режиме. Среди состояний, требующих наиболее дорогостоящего неотложного ответа, сепсис оказался на первом месте (остеоартрит на втором, перинатальная патология на третьем, осложнения имплантации на четвертом, инфаркт миокарда на пятом).
В 2018 году было доказано, что внедрение новых протоколов интенсивной терапии сепсиса достоверно снижает летальность. Тем не менее, она остается высокой и оценивается на уровне 20-35%, а при септическом шоке (наиболее тяжелой, предельно выраженной форме сепсиса) варьирует в диапазоне 30-70%.
С 2015 года в Санкт-Петербурге активно работает мультидисциплинарное Общество специалистов по сепсису.
13 сентября отмечается Всемирный день борьбы с сепсисом.
Причины
Причиной сепсиса теоретически может быть любой микроорганизм, – будь то бактерия, вирус, грибок, простейшее, – способный вызывать у человека инфекционно-воспалительный процесс.
На практике чаще всего выявляются гноеродные стрептококки и стафилококки, менингококки, пневмококки, клебсиелла, кишечная палочка и др. Первичным очагом примерно в половине диагностированных случаев оказывается легочная инфекция, затем следуют кишечные и урогенитальные инфекции. Однако диагностировать определенный первичный очаг не удается, по меньшей мере, в каждом третьем случае.
Главными факторами риска выступают ослабленный иммунитет (в частности, именно поэтому высока частота постоперационных, послеродовых, посттравматических сепсисов, а также сепсисов у пожилых и новорожденных, больных ВИЧ/СПИД, онкопатологией, заболеваниями печени и почек).
В основе патогенеза лежат грубые нарушения тканевой микроциркуляции крови, запускающие каскад взаимопотенцирующих патологических процессов (орган за органом, система за системой начинают дисфункционировать и угрожают полным отказом), а также общая интоксикация продуктами жизнедеятельности возбудителя инфекции (экзо- и эндотоксинами). Тем и определяется клиническая картина сепсиса.
Симптоматика
В ряде случаев при выраженной почечной, печеночной, легочной, сердечной недостаточности на фоне сепсиса изменения в тканях становятся необратимыми и спасти больного не удается.
Диагностика
Лечение
Первоочередными направлениями интенсивной терапии при сепсисе и/или септическом шоке включают санацию первичного очага инфекции (в ряде случаев необходимо экстренное хирургическое вмешательство или ударные дозы мощных бактериостатиков); восстановление нормальной гемодинамики и, в частности, микроциркуляции, а также сердечной деятельности и дыхания; детоксикация; предотвращение тромбоза, геморрагий, дегидратации (обезвоживания); нормализация психического статуса, стабилизация общего состояния пациента.
Дальнейшие реабилитационные мероприятия разрабатываются в каждом случае индивидуально.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
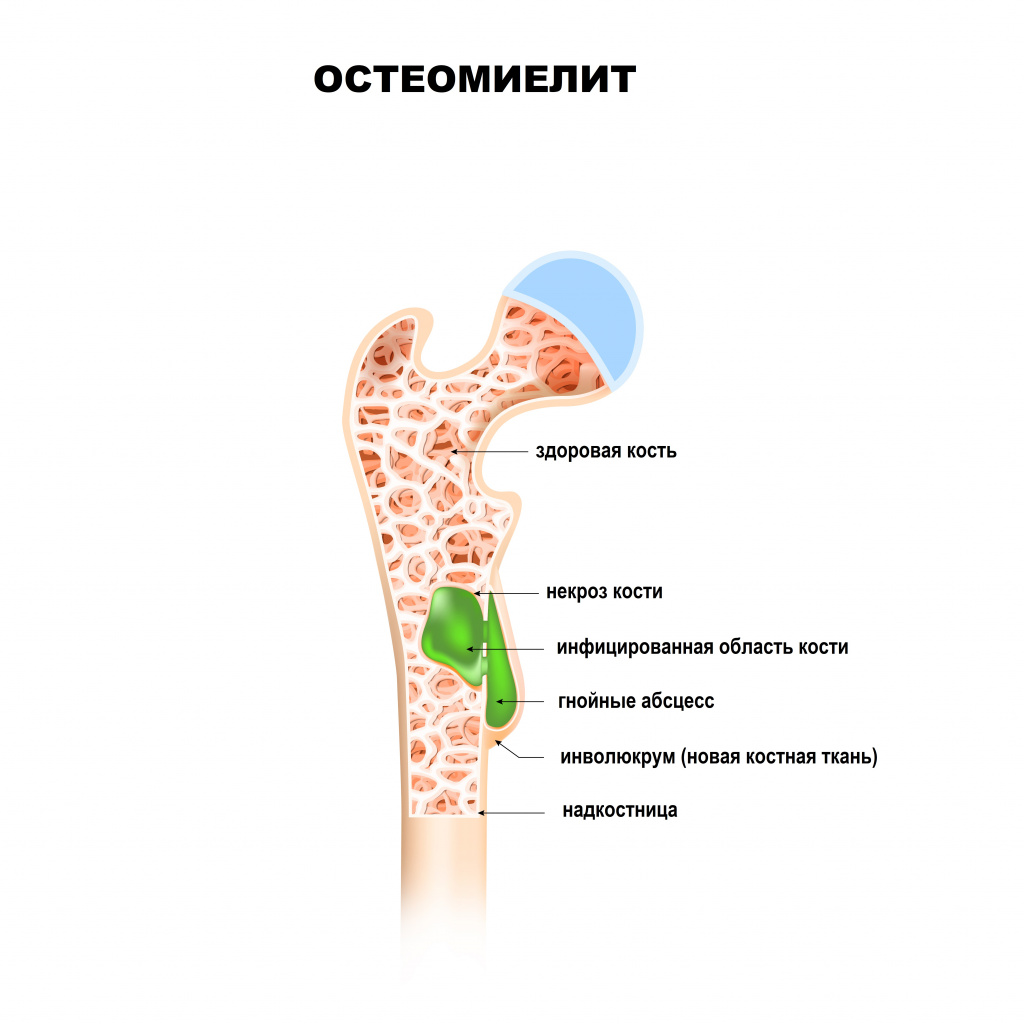
Остеомиелит: причины появления, симптомы, диагностика и способы лечения.
Определение
Причины появления остеомиелита
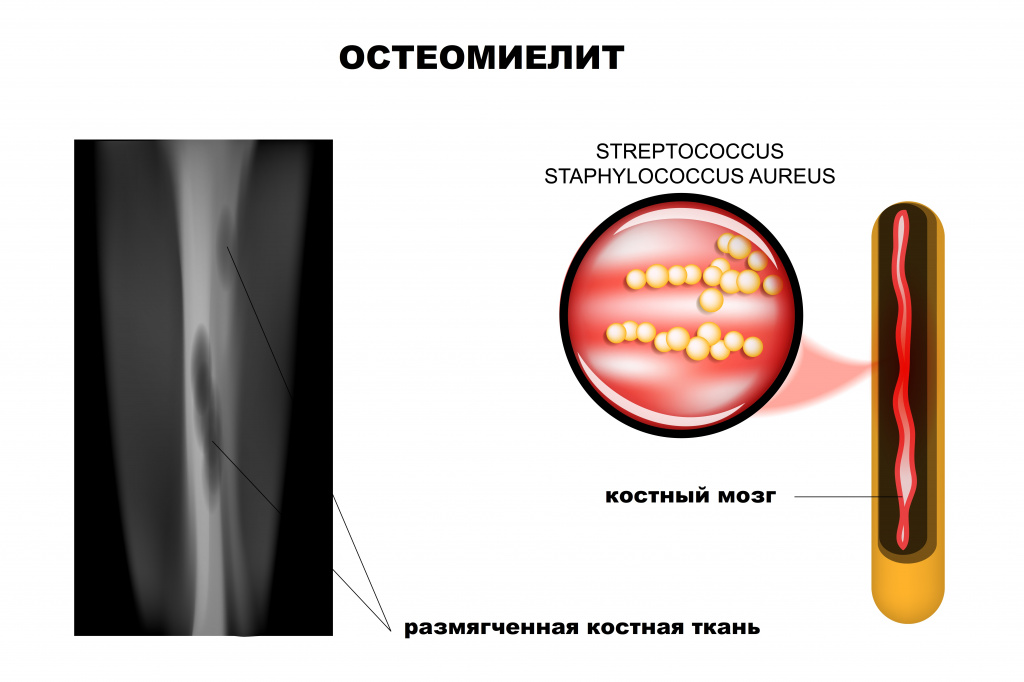
Ведущая роль в развитии заболевания принадлежит патогенным стафилококкам (золотистый стафилококк обнаруживается почти у 90% больных остеомиелитом), гемолитическим стрептококкам, грамотрицательной кишечной и анаэробной микрофлоре, грибковым инфекциям.
Специалисты считают, что в развитии остеомиелита имеют значение снижение реактивности организма больного (в результате травмы, переохлаждения, сенсибилизации) и нарушение кровоснабжения поражаемого отдела кости.
Основными путями проникновения инфекции в костную ткань являются:
- Гематогенный – патогенные микроорганизмы из какого-либо источника инфекции (например, фурункулов, кариозных зубов, воспалительных очагов в деснах, миндалинах или придаточных пазухах, легких, мочеполового тракта и др.) с током крови проникают в костную ткань, приводя к развитию остеомиелита. Воспалительный процесс начинается с внутренних слоев кости – в первую очередь поражается костный мозг, губчатое вещество кости. В последующем процесс переходит на компактное вещество (наружный плотный слой кости) и надкостницу. Данный вид остеомиелита часто встречается в детском возрасте. Особенностью костной ткани у детей является ее обильное кровоснабжение. В большинстве случаев остеомиелит развивается в зонах роста костей (метафизах). При этом чаще поражаются длинные (большеберцовая, бедренная или плечевая) кости конечностей ребенка. У взрослых гематогенный остеомиелит, как правило, поражает тело позвонков.
- Прямое инфицирование костной ткани может наблюдаться при открытых переломах, обширных, глубоких ранах. Посттравматический остеомиелит развивается вторично после открытых переломов. Особую группу составляет остеомиелитическое повреждение костей после ДТП, спортивных травм, огнестрельных и минно-взрывных ранений, поскольку в характере перелома играет роль обширное поражение окружающих тканей. При этом возникает не только дефицит костной, но и мягких тканей с образованием больших дефектов. В некоторых случаях данным путем может происходить проникновение патогенных бактерий при различных хирургических ортопедических вмешательствах.
- Инфицирование из близлежащих гнойных очагов (контактный путь) – патогенные бактерии проникают в костную ткань из длительно существующих гнойно-воспалительных очагов в окружающих мягких тканях. Данная форма в основном встречается у взрослых. В процесс обычно вовлечена одна кость, но иногда наблюдается поражение нескольких участков. Экзогенное распространение инфекции от сопредельных зараженных тканей или открытых ран вызывает около 80% случаев остеомиелита и часто имеет полимикробный характер. Факторами риска у взрослых являются мужской пол, пожилой возраст, истощение, ослабленный иммунитет, длительный прием глюкокортикоидов, гемодиализ, серповидноклеточная анемия (наследственное заболевание, которое характеризуется образованием патологического белка гемоглобина в эритроцитах) и употребление инъекционных наркотиков. Травмы, ишемия, инородные тела, пролежни, повреждение тканей лучевой терапией также предрасполагают к остеомиелиту.
Остеомиелит, обусловленный инфицированием окружающих тканей, часто локализуется в области стоп (у больных с сахарным диабетом или заболеваниями периферических сосудов).
Любой остеомиелит может перейти в хроническую форму, имея, в конечном счете, общую патофизиологию с нарушением целостности оболочки мягких тканей, наличием окружающей омертвевшей, инфицированной и реактивной новой костной ткани.
Классификация заболевания
Остеомиелит различают:
- по пути инфицирования: экзогенный и эндогенный;
- по этиологии:
- острый гематогенный остеомиелит, вызванный золотистым стафилококком, стрептококками, коагулаза-отрицательными стафилококками, Haemophilus influenzae, грамотрицательными микроорганизмами;
- остеомиелит позвоночника, вызванный золотистым стафилококком, грамотрицательными кишечными палочками, микобактериями туберкулеза, грибами;
- остеомиелит при наличии местного очага или сосудистой недостаточности, вызванный комбинацией аэробных и анаэробных микроорганизмов;
- остеомиелит, развившийся на фоне инфекции протезных аппаратов, вызванной коагулаза-отрицательными стафилококками, золотистым стафилококком, коринеформными бактериями, грамотрицательными микроорганизмами.
- острый гематогенный остеомиелит:
- генерализованный (септикотоксемия, септикопиемия),
- очаговая форма;
- после перелома,
- огнестрельный,
- послеоперационный;
- абсцесс Броди,
- альбуминозный (Оллье),
- склерозирующий (Гарре).
- острая (2-4 недели);
- подострая (от 2 недель и более):
- выздоровление,
- продолжение процесса;
- обострение,
- ремиссия,
- выздоровление.
- остеомиелит трубчатых костей (эпифизарный, метафизарный, диафизарный, тотальный);
- остеомиелит плоских костей.
К симптомам заболевания относят боль в области пораженной кости, сопровождающуюся общей реакцией организма (при остром остеомиелите) или без нее (при хроническом остеомиелите).
Первые признаки остеомиелита в острой форме:
- сильная распирающая боль в пораженной кости;
- выраженный локальный отек, который приводит к натяжению кожного покрова;
- температура тела поднимается до 38оС;
- при постукивании можно определить очаг воспаления – в этом месте пациент чувствует наибольшую болезненность.
![Кость.jpg]()
Признаки остеомиелита кости часто дополняются симптомами общей интоксикации, если инфекция распространяется на соседние ткани или проникает в кровь. У пациента в таком случае наблюдаются:
- высокая температура (около 39оС);
- сильная головная боль;
- лихорадка, озноб;
- бледные кожные покровы;
- учащенное сердцебиение;
- тошнота и рвота.
Если у пациента наблюдается хронический остеомиелит, симптомы кардинально меняются. Клиническая картина становится стертой. Основные признаки остеомиелита хронической формы:
- боль уменьшается, приобретает ноющий характер;
- появляются свищи (каналы, соединяющие гнойный очаг с внешней средой) с гнойным отделяемым, которые часто имеют выход далеко от локализации воспаления.
Развитие остеомиелита у детей сопровождается теми же симптомами что и у взрослых, хотя патология чаще протекает в легкой форме без общей интоксикации и осложнений.
Остеомиелит позвоночника обычно вызывает локальную боль в спине с паравертебральным (по сторонам позвоночного столба) мышечным спазмом, которые не поддаются консервативному лечению. На поздних стадиях заболевание может привести к компрессии спинного мозга или нервных корешков с радикулопатией и слабостью или онемением конечностей. Повышения температуры тела, как правило, не наблюдается.
Диагностика остеомиелита
При подозрении на остеомиелит необходимо выполнить следующие лабораторные исследования:
-
общий анализ крови и определение скорости оседания эритроцитов;
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
С-реактивный белок – белок острой фазы, чувствительный индикатор повреждения тканей при воспалении, некрозе, травме. Синонимы: Анализ крови на СРБ; С-реактивный белок сыворотки крови. C-reactive Protein (CRP), quantitative; C-reactive protein test; CRP test. Краткое описание опред.
Рентгенологическое исследование считается одним из наиболее эффективных методов диагностики остеомиелита. Признаки патологии у детей видны на снимке уже на 5-й день, а у взрослых — только через 2 недели от начала воспалительного процесса.
Самым точным и эффективным видом диагностики является радионуклидная сцинтиграфия костей. С помощью специальных препаратов, накапливающихся в зоне очага болезни, можно точно выявить начало поражения кости. Однако этот метод не позволяет провести дифференциальную диагностику между инфекцией, переломами и опухолями.
Скопление гноя в мягких тканях выявляют с помощью ультразвукового исследования.
Исследование мягких тканей для выявления патологических изменений и диагностики новообразований.
Для лечения большое значение имеет биопсия очага воспаления костной ткани (аспирационная или открытая) и посев гнойного отделяемого на флору с определением чувствительности к антибиотикам и бактериофагам.
К каким врачам обращаться
Лечение остеомиелита
Консервативные методы лечения в большинстве случаев стандартизированы и включают антибиотикотерапию с определением микробного возбудителя и чувствительности микроорганизмов к антибактериальным препаратам, противовоспалительную терапию. Большое значение имеет проведение иммуномодулирующей терапии, в том числе с использованием методов квантовой гемотерапии (реинфузия обработанной ауто- и донорской крови и др.), а в отдельных случаях гормонотерапии.
В большинстве случаев хирургическое лечение остеомиелита направлено, прежде всего, на ликвидацию очага гнойно-некротического поражения, замещение остаточных полостей или образовавшихся дефектов.
При остром гематогенном остеомиелите начальная антибиотикотерапия должна включать полусинтетические пенициллины или ванкомицин и цефалоспорины 3-го или 4-го поколения. При хроническом остеомиелите, возникающем в результате распространения инфекции с окружающих мягких тканей, особенно у больных диабетом, лечение проводят с использованием препаратов, эффективных как против грамположительных и грамотрицательных аэробов, так и против анаэробной флоры.
Осложняет лечение хронической формы заболевания нарушение кровоснабжения кости, которое затрудняет проникновение антибактериальных препаратов, снижает эффективность местного иммунного ответа в костной ткани.
Некоторые симптомы остеомиелита свидетельствуют о том, что болезнь перешла в крайне тяжелую форму. Нередко единственным выходом в этой ситуации становится хирургическое вмешательство. Главная его цель — удаление гнойного очага воспаления. Это в разы ускоряет процесс выздоровления и улучшает общее самочувствие больного.
Показания к операции:
- гнойная форма заболевания;
- флегмона надкостницы;
- наличие свищей и секвестров;
- обширное гнойное течение заболевания.
В последние годы широко разрабатываются методы закрытия костной полости, такие как мышечная или кожно-мышечная пластика.
Существуют современные методы, которые позволяют сохранить имплантаты при остеосинтезе (хирургической репозиции костных отломков при помощи различных фиксирующих металлических конструкций) в случае ранних нагноений. Это вакуумная терапия, применение гидрохирургической системы, ультразвуковой кавитации и других методов обработки ран, которые дают возможность предотвратить развитие так называемой бактериальной биопленки на поверхности имплантата, что, в свою очередь, позволяет сохранить имплантат и конечность.
Остеомиелит – тяжелое заболевание, поэтому даже при своевременном и компетентном лечении есть риск возникновения нежелательных последствий. Остеомиелит кости может вызвать как самостоятельные осложнения, так и такие, которые возникают как следствие хирургического вмешательства. Некоторые из них требуют отельного лечения. Прогрессирование гнойно-воспалительного процесса приводит к разрушению костной ткани, нарушается ее кровоснабжение, что еще больше усиливает некротические процессы в кости. Заболевание может вызвать такие нарушения:
- развитие абсцессов и свищей, нарывов в мягких тканях и на коже;
- возникновение флегмоны — пропитывания мышечных волокон гноем;
- развитие артрита с образованием гнойных масс в полостях;
- самопроизвольные переломы;
- анкилозные сращивания суставных частей;
- контрактурная неподвижность мышечных соединений.
Гнойно-воспалительные поражения костей приводят к инвалидизации около 55% пациентов. Остеомиелит может закончиться потерей конечности, если речь идет о поражении руки или ноги.
В связи с особенностью локализации остеомиелитического процесса у детей в последующем может наблюдаться замедление развития костей за счет повреждения воспалительным процессом зон роста.
Разрушение позвонков, сдавливание спинного мозга может приводить к двигательным и чувствительным нарушениям.
Профилактика остеомиелита
Для снижения риска развития остеомиелита рекомендуется:
- своевременно реагировать на возникновение инфекционных процессов в организме;
- проводить лечение гайморита, кариеса, воспаления носоглотки и верхних дыхательных путей;
- осуществлять тщательную обработку ран, обморожений и ожогов, чтобы исключить возможность их инфицирования;
- вести здоровый образ жизни, избегать чрезмерных физических нагрузок, недоедания, следить за сбалансированностью питания;
- не допускать переохлаждения организма.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
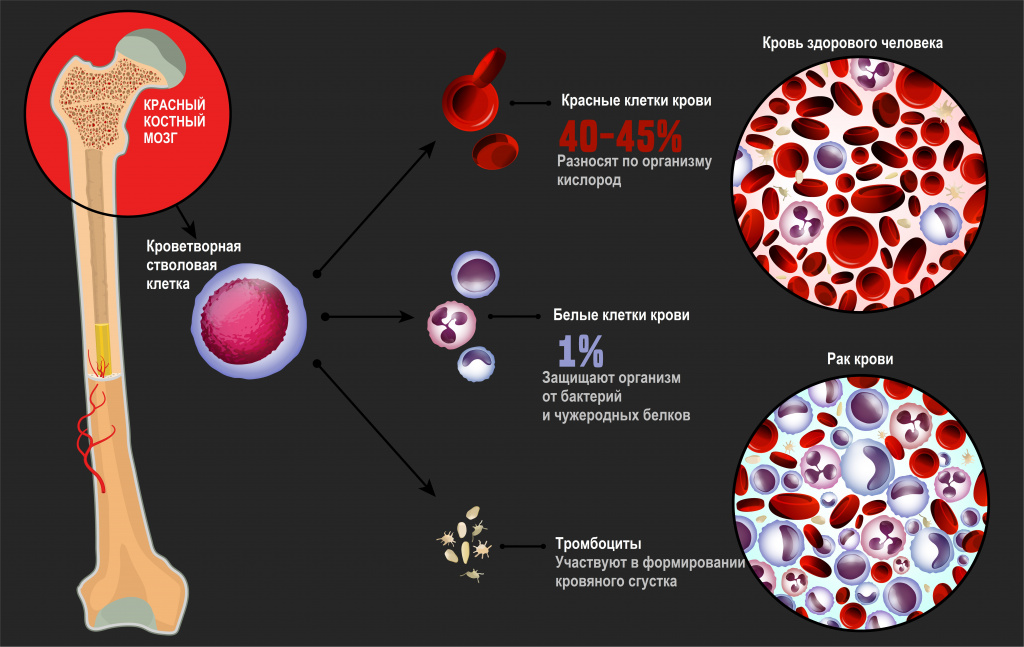
Лейкоз: причины появления, симптомы, диагностика и способы лечения.
Определение
Лейкозы – большая группа заболеваний кроветворной системы. Кроветворение (гемопоэз) – это многоэтапный процесс образования форменных элементов крови в специализированных органах кроветворения. К форменным элементам крови относятся лейкоциты (белые кровяные тельца), которые участвуют во врожденном и приобретенном иммунитете, эритроциты (красные кровяные тельца), которые осуществляют транспорт кислорода и углекислого газа, и тромбоциты, обеспечивающие свертываемость крови.Главный орган, где располагаются полипотентные стволовые клетки, - костный мозг, который как раз и поражается при лейкозах.
В результате повреждения (мутации) в генетическом материале полипотентной стволовой клетки-предшественницы нарушается процесс созревания клеток. При остром лейкозе возникает большое количество незрелых (бластных) клеток, из которых образуется опухоль, разрастается в костном мозге, замещает нормальные ростки кроветворения и имеет тенденцию к метастазированию – распространению с током крови или лимфы в здоровые органы. При хронических лейкозах заболевание течет годами, происходит частичная задержка созревания клеток и опухоль образуется из созревающих и зрелых клеток.
![Рак крови.jpg]()
Причины возникновения лейкозов
К факторам риска развития лейкоза относятся:
- ионизирующая радиация: лучевая терапия по поводу других опухолей, облучение на рабочем месте, ультрафиолетовое излучение;
- воздействие на организм химических канцерогенных веществ;
- некоторые вирусы: HTLV (Т-лимфотропный вирус человека);
- бытовые факторы: добавки в пищевые продукты, курение, плохая экологическая обстановка;
- наследственная предрасположенность к раковым заболеваниям.
Лейкозы подразделяют на острые и хронические, а по типу поражения ростка кроветворения - на лимфоидные и миелоидные. Острый лейкоз никогда не переходит в хронический, а хронический не может стать острым (но его развитие может перейти в стадию бластного криза).
В зависимости от преобладания тех или иных опухолевых клеток выделяют бластные, цитарные и недифференцированные лейкозы.
Острый лимфобластный лейкоз (ОЛЛ) диагностируется у лиц любого возраста, начиная с младенческого и заканчивая пожилым, однако пик заболеваемости приходятся на детский возраст (60% пациентов с ОЛЛ моложе 20 лет). Острый лимфобластный лейкоз – самая распространенная опухоль кроветворной ткани у детей, которая составляет 30% всех злокачественных опухолей детского возраста. Заболеваемость ОЛЛ у пациентов пожилого возраста неуклонно возрастает: так, ежегодная частота ОЛЛ увеличивается с 0,39 случая на 100 тыс. населения в возрасте 35–39 лет, до 2,1 случая на 100 тыс. населения в возрасте ≥85 лет. Кроме того, приблизительно 30% ОЛЛ диагностируются в возрасте ≥60 лет.
Острым миелоидным лейкозом (ОМЛ) страдает в среднем 3-5 человек на 100 тыс. населения в год. Заболеваемость резко возрастает в возрасте старше 60 лет и составляет 12–13 случаев на 100 тыс. населения у лиц в возрасте старше 80 лет.
Хронический лимфобластный лейкоз (ХЛЛ) – самый частый вид лейкозов у взрослых, в то время как у детей этот вид опухоли не регистрируется. В европейских странах его частота составляет 4 случая на 100 тыс. населения в год и непосредственно связана с возрастом. У лиц старше 80 лет она составляет более 30 случаев на 100 тыс. в год.
Хронический миелолейкоз (ХМЛ) – редкое заболевание: 0,7 на 100 тыс. взрослого населения, пик заболеваемости приходится на 50-59 лет, однако до 33% больных ОМЛ - люди моложе 40 лет.
Симптомы лейкозов
Острый лейкоз в большинстве случаев дебютирует резко - внезапно повышается температура, появляются озноб, боль в горле, в суставах, отмечается резко выраженная слабость. Реже острый лейкоз может проявиться кровотечением. Иногда острый лейкоз начинается с постепенного ухудшения состояния больного, появления невыраженной боли в суставах и костях, кровоточивости. В единичных случаях возможно бессимптомное начало заболевания. У многих больных увеличиваются лимфоузлы и селезенка.
При хроническом лейкозе на начальной стадии, которая длится от года до трех лет, пациенты могут ни на что не жаловаться. Иногда беспокоят слабость, потливость, частые простудные заболевания, могут отмечаться тупые, ноющие боли в костях.
При подавлении эритроидного ростка, дающего красные кровяные тельца, возникает анемия и гемическая гипоксия (снижение количества кислорода в крови). При этом пациенты отмечают слабость, утомляемость, бледность кожных покровов.
При поражении мегакариоцитарного ростка падает количество тромбоцитов, поэтому возникает кровоточивость десен, слизистой оболочки носа, пищеварительного тракта, образуются синяки, кровоизлияния в различные органы. При прогрессировании лейкоза могут развиваться массивные кровотечения в результате ДВС синдрома (синдрома диссеминированного внутрисосудистого свертывания).
В результате недостатка лейкоцитов и снижения иммунитета развиваются инфекционные осложнения различной степени тяжести, что чаще всего проявляется лихорадкой.
Могут возникать язвенно-некротическая ангина, перитонзиллярные абсцессы, некротический гингивит, стоматит, пиодермия, параректальные абсцессы, пневмония, пиелонефрит. Существует значимый риск тяжелого течения инфекционных осложнений вплоть до развития сепсиса.
С током крови и лимфы опухолевые клетки попадают в здоровые органы, нарушают их структуру и функцию - наиболее подвержены метастатическим процессам печень, селезенка, лимфатические узлы, но метастазы могут поражать и кожу, и мозговые оболочки, и почки, и легкие.
Основные причины летальности у пациентов с лейкозом связаны с тем, что осложнения могут спровоцировать развитие сепсиса, полиорганную недостаточность, кровоизлияния в различные органы. Острый лейкоз без лечения приводит к смертельному исходу в течение нескольких недель или месяцев.
Диагностика лейкозов
Диагностика лейкозов основывается на оценке морфологических особенностей клеток костного мозга и периферической крови. Поэтому всем пациентам с подозрением на лейкоз назначают общий анализ крови с подсчетом лейкоцитарной формулы и определением числа тромбоцитов.
Синонимы: Общий анализ крови (ОАК); Гемограмма; КАК; Развернутый анализ крови. Full blood count; FBC; Complete Blood Count (CBC); Hemogram; CBC with White Blood Cell Differential Count; Peripheral Blood Smear; Blood Film Examination; Complete blood count (CBC) with differential white blood cell coun.
Для определения объема опухолевого поражения, вероятности развития синдрома лизиса опухоли рекомендовано выполнение общетерапевтического биохимического анализа крови: АСТ, АЛТ, общий билирубин, глюкоза, мочевина, креатинин, общий белок, ЛДГ, магний, натрий, калий, кальций.
Аланинаминотрансфераза − внутриклеточный фермент, участвующий в метаболизме аминокислот. Тест используют в диагностике поражений печени, сердечной и скелетных мышц. Синонимы: Глутамат-пируват-трансаминаза; Глутамат-пируват-трансаминаза в сыворотке; СГПТ. Alanine aminotransferase; S.
Синонимы: Глутамино-щавелевоуксусная трансаминаза; Глутамат-оксалоацетат-трансаминаза сыворотки крови (СГОТ); L-аспартат 2-оксоглутарат аминотрансфераза; ГЩТ. Aspartateaminotransferase; Serum Glutamicoxaloacetic Transaminase; SGOT; GOT. Краткая характеристика определяемого вещества АсАТ .
Синонимы: Общий билирубин крови; Общий билирубин сыворотки. Totalbilirubin; TBIL. Краткая характеристика определяемого вещества Билирубин общий Билирубин – пигмент коричневато-желтого цвета, основное количество которого образуется в результате метаболизма гемовой части гемоглобина при дест.
Материал для исследования Сыворотка или плазма крови. Если нет возможности центрифугировать пробу через 30 минут после взятия для отделения сыворотки/плазмы от клеток, пробу берут в специальную пробирку, содержащую ингибитор гликолиза (флюорид натрия). Синони.
Синонимы: Диамид угольной кислоты; Карбамид; Мочевина в крови; Азот мочевины. Urea nitrogen; Urea; Blood Urea Nitrogen (BUN); Urea; Plasma Urea. Краткая характеристика аналита Мочевина Мочевина является основным азотсодержащим продуктом катаболизма белков и аминокислот в организме человека. .
Синонимы: Анализ крови на креатинин; Сывороточный креатинин; Креатинин сыворотки, оценка СКФ. Сreat; Сre; Blood Creatinine; Serum Creatinine; Serum Creat. Краткая характеристика определяемого вещества Креатинин Креатинин – низкомолекулярное азотсодержащее вещество, продукт метаболизма креа.
Синонимы: Общий белок сыворотки крови; Общий сывороточный белок. Total Protein; Serum Тotal Protein; Total Serum Protein; TProt; ТР. Краткая характеристика определяемого вещества Общий белок Сыворотка крови (плазма крови, лишенная фибриногена) содержит множество белков, выполняющих разнообразны.
Синонимы: Анализ крови на ЛДГ; Лактатдегидрогеназа; L-лактат; НАД+Оксидоредуктаза; Дегидрогеназа молочной кислоты. Lactate dehydrogenase, Total; Lactic dehydrogenase; LDH; LD. Краткая характеристика определяемого вещества Лактатдегидрогеназа ЛДГ – цитоплазматический.
Синонимы: Анализ крови на магний; Общий магний; Ионы магния. Serum Magnesium Test; Magnesium test; Magnesium, blood; Serum magnesium. Краткая характеристика определяемого аналита Магний Магний, как и калий, содержится преимущественно внутри клеток. 1/3-1/2 всего магния организма .
Синонимы: Анализ крови на электролиты; Электролиты в сыворотке крови. Electrolyte Panel; Serum electrolyte test; Sodium, Potassium, Chloride; Na/K/Cl. Краткая характеристика определяемых веществ (Калий, Натрий, Хлор) Калий (К+) Основной внутриклеточный катион. Кал.
Общий кальций – основной компонент костной ткани и важнейший биогенный элемент, обладающий важными структурными, метаболическими и регуляторными функциями в организме. Синонимы: Анализ крови на общий кальций; Общий кальций в сыворотке. Total blood calcium; Total calcium; Bl.
Для определения вероятности развития тяжелых коагуляционных нарушений (как геморрагических, так и тромботических) рекомендовано исследование свертывающей системы крови.
С целью исключения поражения почек выполняют общий анализ мочи.
Диагностику хронического лейкоза проводят с помощью иммунофенотипического исследования лимфоцитов крови (ИФТ) методом проточной цитометрии.
Рекомендовано проведение стернальной пункции (пункции грудины) для получения цитологического препарата костного мозга и цитологическое и цитохимическое исследование мазка с целью уточнения диагноза и определения прогноза.
В ряде случаев показана биопсия опухолевого образования или лимфатического узла (или другого метастатического очага) и патологоанатомическое исследование полученного биопсийного материала.
Кроме того, врач может рекомендовать проведение иммунофенотипирования гемопоэтических клеток-предшественниц в костном мозге, цитогенетическое исследование аспирата костного мозга, молекулярно-генетические исследования мутаций в генах и др.
Из инструментальных методов диагностики проводятся:
-
эхокардиография для оценки функционального состояния сердечной мышцы;
Исследование, позволяющее оценить функциональные и органические изменения сердца, его сократимость, а также состояние клапанного аппарата.
Сканирование головного мозга, черепа и окружающих их тканей, позволяющее диагностировать различные патологии.
Исследование, позволяющее получить данные о состоянии органов грудной клетки и средостения.
Сканирование внутренних органов брюшной полости для оценки его функционального состояния и наличия патологии.
Лечение лейкозов
Лечение лейкозов проводится в стационаре. Медикаментозное воздействие на опухоль специальными препаратами, губительно действующими на быстро делящиеся клетки, называется химиотерапией. При лечении острых лейкозов химиотерапию проводят в несколько этапов: индукция ремиссии, консолидация (закрепление) ремиссии, поддерживающая терапия и профилактика нейролейкемии (метастазирования опухолевых лейкозных клеток в головной и спинной мозг).
Период индукции ремиссии - это начальный этап, цель которого максимально уменьшить опухолевую массу и достичь ремиссии. Обычно для этого требуется 1-2 курса химиотерапии. Далее идет консолидация достигнутого эффекта - наиболее агрессивный и высокодозный этап лечения, задачей которого является по возможности еще большее уменьшение числа остающихся после индукции лейкемических клеток. Этот этап также занимает 1-2 курса. За ним следует противорецидивное или поддерживающее лечение. При некоторых вариантах острых лейкозов требуется профилактика или, при необходимости, лечение нейролейкемии.
Для разных видов лейкозов у разных возрастных групп профессиональными сообществами разработаны схемы химиотерапии.
При лечении ХМЛ основными препаратами выбора являются ингибиторы тирозинкиназы, применяемые в непрерывном режиме – ежедневно, длительно, постоянно. Перерывы в приеме могут способствовать снижению эффективности терапии и прогрессированию заболевания. В случае неэффективности терапии может быть проведена трансплантацию гемопоэтических стволовых клеток или костного мозга.
В терапии ХЛЛ цели и схемы терапии химиотерапии определены возрастом пациента, числом и тяжестью сопутствующих заболеваний. Разработаны протоколы лечения для разных пациентов, в том числе схемы моно- и полихимиотерапии. Для профилактики инфекционных осложнений применяют внутривенное введение иммуноглобулина, рекомендована вакцинация от гриппа и пневмококковой инфекции.
Помимо химиотерапии пациенту может потребоваться трансфузионная терапия: переливание эритроцитарной массы, тромбоцитарной массы, изотонических растворов.
При присоединении инфекций показана антибиотикотерапия. На фоне лечения могут возникать тромботические осложнения, что требует антикоагулянтной терапии. Пациентам высокого риска в связи с вероятностью рецидива лейкоза применяют трансплантацию гемопоэтических стволовых клеток.
Профилактика лейкозов
Так как причины возникновения лейкозов не установлены, методов специфической профилактики до сих пор не существует.
Однако доказано, что между курением и риском развития острого лейкоза существует дозовая зависимость, которая особенно очевидна для лиц старше 60 лет.
Ряд исследователей предполагают, что около 20% случаев ОМЛ являются следствием курения.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
![Сепсис]()
Заражение крови (сепсис) – это острое или хроническое заболевание, которое возникает вследствие проникновения в организм бактериальной, вирусной или грибковой флоры.
![]()
Что это такое?
Сепсис – это тяжелый инфекционный процесс, который формируется в результате постоянного нахождения или периодического попадания различного рода возбудителей в систему кровообращения человека.
В клинической картине преобладают симптомы нарушения работы всего организма, а не местные реакции.
Классификация
В зависимости от скорости развития инфекционного процесса выделяют следующие виды септических состояний:
- Молниеносный сепсис , который развивается в течение трех суток после инфицирования патогенными возбудителями;
- Острый , при котором клиническая симптоматика развивается не ранее, чем через неделю после выявления первичного очага инфекции;
- Подострое септическое состояние формируется от недели и до четырех месяцев;
- Хроническим сепсис у взрослых будет считаться при появлении первой симптоматики не ранее чем через полгода; он, как правило, развивается у больных с иммунодефицитами различной этиологии.
В эпидемиологическом плане при характеристике данной патологии выделяют следующие виды:
- Внутрибольничное инфицирование . Оно развивается в результате хирургических, гинекологических, диагностических или других медицинских манипуляций, возникающих после оказания медицинской помощи.
- Внебольничное инфицирование . Причиной становится какое-либо инфекционное заболевание, например, кишечная инфекция, менингит, лор-патология и т. д.
По особенностям проявления клинических симптомов сепсиса выделяют:
- Токсимию , при которой развивается системный воспалительный процесс, обусловленный распространением инфекции из первичного очага;
- Септицемию , которая характеризуется отсутствием формирования вторичных гнойных очагов;
- Септикопиемию , при ней такие очаги присутствуют.
Причины заражения крови
В качестве возбудителей сепсиса выступают самые разные микроорганизмы: стафилококки, менингококки, пневмококки, кишечная палочка, микобактерия туберкулеза, клебсиелла, грибы типа Candida, вирусы герпетиморфной группы.
Стоит отметить, что развитие сепсиса связано не столько с свойствами самих возбудителей, сколько с состоянием организма человека и его иммунитета. Снижение эффективности защитных барьеров приводит к тому, что наши охранные системы уже не могут вовремя локализовать вредных возбудителей и тем более предотвратить их проникновение внутрь различных органов.
Если же говорить о наиболее распространенных способах заражения сепсисом, то стоит отметить, что они зависят от типа конкретного возбудителя. Для каждого из них характерны свои особенности и эпидемиологические предпосылки. Особняком стоят лишь случаи, когда у больных развивается внутрибольничный сепсис, симптомы которого иногда дают о себе знать даже после вдыхания плохо очищенного воздуха в палатах (в 60% проб выявляются потенциально опасные микроорганизмы).
Также можно выделить и другие пути инфицирования, определяющие основные симптомы сепсиса:
- акушерско-гинекологический;
- отогенный;
- криптогенный;
- черезкожный сепсис;
- оральный;
- заражение крови, происходящее вследствие хирургических и диагностических манипуляций.
Как мы уже сказали выше, для развития сепсиса необходимо соблюдение некоторых условий, в частности:
- формирование вторичных очагов, которые в дальнейшем также поставляют возбудителей;
- наличие первичного очага (он должен быть связан с кровеносной системой или лимфатическими сосудами);
- многократное проникновение возбудителей в кровь;
- неспособность организма организовать необходимую иммунную защиту и спровоцировать реакции против вредных микробов.
Только если все эти условия соблюдены и у больного имеются соответствующие клинические признаки инфекции, врачи диагностируют сепсис крови. Развитие сепсиса провоцируется тяжелыми заболеваниями (диабет, раковые опухоли, рахит, ВИЧ, врожденные дефекты иммунной системы), терапевтическими мероприятиями, травмами, длительным приемом иммунодепрессивных препаратов, рентгенотерапией и некоторыми другими факторами.
Первые симптомы сепсиса
Сепсис (см. фото) может протекать с образованием местных гнойников в различных органах и тканях (занос инфекции из первичного очага) — т. н. септикопиемия, при которой течение сепсиса зависит от расположения гнойников (например, гнойник в мозге с соответствующими неврологическими расстройствами), и без метастатических гнойников — т. н. септицемия, нередко с более бурным течением, резко выраженными общими симптомами. При развитии сепсиса у новорождённых (источник — гнойный процесс в тканях и сосудах пуповины— пупочный сепсис) характерны рвота, понос, полный отказ ребёнка от груди, быстрое похудение, обезвоживание; кожные покровы теряют эластичность, становятся сухими, иногда землистого цвета; нередко определяются местное нагноение в области пупка, глубокие флегмоны и абсцессы различной локализации.
При диагностике заражения крови различают:
- Синдром системной воспалительной реакции . Характеризуется изменением температуры тела (как в сторону повышения, более 38 °C, так и в сторону понижения — ниже 36 °C), учащенным сердцебиением (более 90 ударов в минуту) и дыханием (более 20 вдохов в минуту), изменением количества лейкоцитов в крови (менее 4×109 или более 12×109 клеток на литр крови).
- Сепсис . При тех же симптомах, что и в случае системного воспалительного синдрома, в одной из стерильных в норме тканей (в крови, цереброспинальной жидкости, в моче…) обнаруживают один из известных патогенов, выявляют признаки перитонита, пневмонии, пурпуры и других местных воспалительных процессов.
- Тяжелый сепсис . Характеризуется так же, как обычный сепсис, но с гипотензией, гипоперфузией или дисфункцией отдельных органов.
- Септический шок . Наиболее тяжелое состояние, после которого у каждого второго больного из-за нарушения кровоснабжения органов и тканей наступает смерть. Определяется теми же симптомами, что и сепсис, когда интенсивные реанимационные мероприятия не приводят к нормализации кровотока и уровня артериального давления. Другими признаками септического шока являются замедление образования мочи и спутанность сознания.
В феврале 2016 года понятия и диагностические критерии сепсиса были пересмотрены. Понятие синдрома системной воспалительной реакции и тяжелого сепсиса признаны неактуальными, понятиям сепсиса и септического шока даны новые определения.
Для выявления и диагностики сепсиса рекомендовано использовать шкалы SOFA и qSOFA.
Сепсис новорожденных
У детей вследствие сепсиса происходит нарушение многих процессов в организме (движение крови, перфузия). Статистика показывает, что частота случаев заболевания у новорожденных остается высокой, но эта проблема активно изучается.
Сепсис у детей способен развиться в качестве сопутствующего другим заболеваниям симптома и может не иметь собственных признаков. Это заболевание является реакцией организма на попадание в него патогенной микрофлоры. При воспалительном процессе происходит неконтролируемое образование гноя. У новорожденных сепсис может возникнуть при воздействии клебсиеллы и синегнойной палочки, а также стрептококков, энтеробактерий или кандиды. Иногда болезнь возникает при воздействии нескольких микроорганизмов. Чаще всего сепсис поражает детей до одного года с низкой массой тела.
При развитии молниеносной формы сепсиса возникает септический шок, который в большинстве случаев заканчивается летально. Болезнь приводит к резкому снижению температуры тела, сопровождается сильной слабостью, вялостью, повышенной кровоточивостью, отеком легких, сердечно-сосудистыми нарушениями, острой почечной недостаточностью.
Диагностика
Заражение крови диагностируют, основываясь на симптомах и данных исследований крови на наличие бактерий, учитывая, что на этапе токсико-резорбтивной лихорадки и при хроническом течении на этапе ремиссии бактериемия (наличие в крови микробов), не выявляется.
При диагностировании обязательно учитывают изменения показателей крови, для которых характерно:
- высокие показатели уровня билирубина и остаточного азота;
- сниженное содержание кальция и хлоридов;
- прогрессирующая анемия;
- высокий лейкоцитоз (ненормально высокое содержание лейкоцитов) или, в случае ослабленных пациентов – лейкопения (снижение количества белых клеток крови);
- тромбоцитопения — уменьшенное содержание тромбоцитов.
В моче выявляется белок, лейкоциты, эритроциты, повышенное количество мочевины и мочевой кислоты.
К лабораторным методам относят:
- Определение в крови количества прокальцитонина: его повышенное содержание рассматривается как характерный признак заражения крови
- Выделение генетического материала патогена, вызвавшего сепсис, с помощью полимеразно-цепной реакции (ПЦР) путем экспресс-методов. В течение 2 часов возможна идентификация до 25 видов микроорганизмов и болезнетворных грибков.
- Бактериологический анализ крови для выявления активного микроба и его реакции на действие разных антибактериальных лекарств (антибиотикограмма) для разработки оптимальной схемы лечения. Забор проводят из двух разных подкожных вен в объеме 5 – 10 мл, проводя посев в питательную среду.
![]()
Какие последствия?
Осложнения сепсиса крайне опасны, тяжело поддаются лечению даже в условиях интенсивной терапии. Рассмотрим подробнее самые распространенные из них.
- Сильное кровотечение – может резвиться в результате дефицита специальных веществ (факторов свертывания крови и тромбоцитов), вырабатываемых печенью.
- Острая почечная и печеночная недостаточность – развивается под прямым воздействием токсинов на почку, или в результате закупорки фильтрующего аппарата почек микробными фрагментами и гноем. Нарушается и полностью прекращается выведение из организма продуктов обмена, что еще больше усугубляет состояние.
- Инфекционно-токсический шок (ИТШ) — резкое падение артериального давления, под воздействием большого количества микробных токсинов. Без оказания экстренной медицинской помощи можно умереть в течение часа или даже нескольких минут. Лечат ИТШ в условиях реанимационного отделения.
- Бактериальный эндокардит – развивается при попадании микробов в полость сердца. Вызвав воспаление, они способствуют образованию тромбов в его полости. Впоследствии эти тромбы, отрываясь и попадая с током крови в сосуды головного мозга, могут привести к инсульту.
В целом сепсис приводит к нарушению функций и повреждению всех внутренних органов.
Что нужно для лечения сепсиса?
Общеизвестно, что сепсис крайне тяжело поддается лечению. Смертность при нем крайне высока и в некоторых ситуациях достигает 50%. Впрочем, своевременно оказанная помощь снижает этот показатель в разы.
Согласно клиническим рекомендациям в 2019 году больных сепсисом лечат в отделениях интенсивной терапии или реанимации. Это вызвано необходимостью постоянного контроля жизненных показателей. В течение первых 6 часов усилия врачей направлены на доведение этих цифр до определенного значения и стабилизации их:
Лечение заключается в ликвидации возникших осложнений, которые в большинстве своём являются реанимационными.
Так например при возникновении острой почечной недостаточности применяют гемофильтрацию, гепатопротекторы и гемодиализ, при нарушениях гемодинамики – восстановление сосудистой проницаемости и объёма циркулирующей крови, при кардионедостаточности – кардиостимулирующие и вазотропные средства, при легочной недостаточности применяют ИВЛ, при стрессовом кровотечении применяют Н2 гистаминовые блокаторы/ блокаторы протонной помпы/ сукральфат. Что касается антибиотико-терапии, то антибиотики должны назначаться по результатам бактериальных исследований или против наиболее вероятных возбудителей.
Для последнего случая также создана таблица:
Локализация первичного очага Наиболее вероятные возбудители Лёгкие (нозокомиальная пневмония развившаяся вне ОРИТ) Streptococcus pneumonia, Enterobacteriaceae (E.colli), Staphylococcus aureus Лёгкие (нозокомиальная пневмония развившаяся в ОРИТ) Pseudomonias aeruginosa, Acinetobacter spp, а также вышеперчисленные возбудители Брюшная полость Bacteroides spp, Enterococcus spp, Streptococcus spp, Pseudomonias aeruginosa, Staphylococcus aureus Кожа и мягкие ткани Streptococcus spp, Staphylococcus aureus,
EnterobacteriaceaeПочки Enterobacteriaceae, Enterococcus spp Ротоглотка Staphylococcus spp, Streptococcus spp, анаэробы После спленэктомии Streptococcus pneumonia, Haemophilis influenzae Внутривенный катетер Staphylococcus epidermididis, Staphylococcus aureus, энтерококки и кандиды При формировании вторичных гнойных очагов необходимо их хирургическое лечение – вскрытие абсцессов, удаление гноя и промывание ран, иссечение пораженных участков.
![]()
Профилактика
Предотвратить заражение крови помогут следующие меры:
- грамотное применение антибиотиков;
- соблюдение основных правил гигиены;
- своевременное лечение процессов гнойного характера;
- соблюдение асептических условий при проведении медицинских манипуляций;
- иммунизация людей, относящихся к группам риска.
Гнойно-септические заболевания значительно легче предотвратить, чем вылечить, поэтому больным нужно не только выполнять индивидуальные меры профилактики, но и следить за тем, как проходит процедура в медицинском кабинете. Соблюдение этих простых мер поможет предотвратить развитие заболевания.
Прогноз при сепсисе
Исход сепсиса определяется вирулентностью микрофлоры, общим состоянием организма, своевременностью и адекватностью проводимой терапии. К развитию осложнений и неблагоприятному прогнозу предрасположены больные пожилого возраста, с сопутствующими общими заболеваниями, иммунодефицитами. При различных видах сепсиса летальность составляет 15-50%.
При развитии септического шока вероятность летального исхода крайне высока.
Читайте также: