Можно ли вылечить волчанку гомеопатией
Обновлено: 24.04.2024

Эта статья была написана, чтобы помочь Вам больше узнать о дискоидной красной волчанке. Она расскажет Вам, что это такое, что ее вызывает, какие процедуры доступны, и где Вы можете узнать больше об этом.
Что такое дискоидная красная волчанка?
Что вызывает дискоидную красную волчанку?
Причина дискоидной красной волчанки до конца не изучена, но считается аутоиммунным заболеванием. У всех нас есть иммунная система, которая вырабатывает антитела, необходимые для борьбы с инфекциями.
Факторы, которые могут увеличить риск дискоидной красной волчанки или усугубить ее течение, включают стресс, инфекцию и травму. Некоторые лекарства также считаются пусковым механизмом. Состояние не является заразным и не связано с пищевой аллергией. Дискоидная красная волчанка редко поражает детей; хотя это заболевание в равной степени может развиваться у мужчин и женщин, есть доказательства того, что женщины в возрасте от 20 до 40 лет более склонны к этому состоянию.
Является ли дискоидная красная волчанка наследственной?
В некоторых семьях может быть генетическая предрасположенность, повышающая риск развития дискоидной красной волчанки. Однако не совсем ясно, как это передается или в какой степени влияет на болезнь. Считается, что сочетание факторов окружающей среды и генетики, скорее всего, способствует развитию дискоидной красной волчанки.
Каковы симптомы дискоидной красной волчанки?
Иногда пятна могут вызывать некоторый дискомфорт и зуд. Когда высыпания лопаются, они могут образовывать рубцы и постоянные изменения цвета вовлеченной кожи. У большинства пациентов нет никакого влияния на общее состояние здоровья.
Как выглядит дискоидная красная волчанка?
Дискоидная красная волчанка обычно поражает лицо и волосистые участки кожи головы, но иногда может распространяться на другие участки тела, включая руки, ноги и туловище.
Сыпь состоит из красных чешуйчатых (шелушащихся) пятен, которые, как правило, в конечном итоге очищаются, что приводит к истончению, рубцеванию или изменению цвета кожи. Уплотнение иногда может быть довольно толстым и напоминать бородавку. При распространении на кожу головы волосы в пораженной области могут быть потеряны навсегда.
Как можно диагностировать дискоидную красную волчанку?
Врач общей практики или дерматолог сможет поставить диагноз по внешнему виду Вашей кожи, однако иногда могут потребоваться исследования, и Ваш доктор может затем обратиться к дерматологу для постоянного наблюдения. Иногда исследование включает биопсию кожи (удаление небольшого образца кожи для анализа под микроскопом), анализы крови и мочи.
Можно ли вылечить дискоидную красную волчанку?
Нет. Как и многие аутоиммунные состояния, дискоидная красная волчанка обычно является пожизненным состоянием. Тем не менее, есть доступные процедуры, которые эффективны и могут помочь поддерживать состояние под контролем.
Самостоятельный уход
Если Вы курите
Мы настоятельно рекомендуем прекратить. Курение может ухудшить это состояние и привести к негативной реакции на лечение.
Защита от солнца
Это должно стать частью Вашей повседневной жизни: защитите свою кожу одеждой и не забывайте носить шляпу, которая защищает Ваше лицо, шею и уши, а также солнцезащитные очки от ультрафиолетового излучения.
Рекомендуется ежедневный солнцезащитный крем
При выборе солнцезащитного крема посмотрите на SPF (SPF 30 и более) для защиты от UVB и UVA. Нанесите достаточное количество солнцезащитного крема за 15-30 минут до выхода на солнце и повторно наносите его каждые два часа и сразу после купания или вытирания полотенцем.
Одежда может быть очень эффективным солнцезащитным средством
Особенно для Ваших плеч и рук. Однако если Ваша рубашка или блузка прозрачна, солнечный свет может проникнуть в Вашу кожу. Лучше всего использовать белую, плотную, но свободно облегающую одежду.
Постоянная нехватка солнечного света может снизить уровень витамина D, поэтому, возможно, стоит принимать добавки витамина D, доступные в аптеках и супермаркетах.
Как можно лечить красную волчанку?
Существует два основных вида лечения:
1) Местные
2) Лечение, действующее на весь организм (таблетки и инъекции)
- Антималярийные таблетки , содержащие гидроксихлорохин и мепакрин. Эти лекарства были первоначально созданы для лечения малярии, но было также обнаружено сильное влияние на воспаление, и поэтому они помогают контролировать дискоидную красную волчанку. Эти таблетки обычно безопасны в обозначенной дозировке. Вам понадобится проверить состояние зрения перед началом лечения и через 5 лет, если Вы все еще будете лечиться. Пожалуйста, сообщите своему врачу, если у Вас возникнут какие-либо проблемы с глазами при приеме лекарств.
- Стероидные таблетки . Курс таблеток может принести пользу пациентам с тяжелой, обширной или дискоидной красной волчанкой.
- Лекарства, изменяющие иммунную систему . Когда нет реакции на стандартную терапию, могут использоваться иные лекарства; например, метотрексат или мофетила микофенолат. Существуют риски, связанные с этими видами лечения, поэтому они применяются для отдельных серьезных случаев и требуют дополнительного мониторинга.
Рекомендации по витамину D
Свидетельства, касающиеся влияния уровня сыворотки витамина D, воздействия солнечного света и потребления витамина D на здоровье, остаются неубедительными. Избегая воздействия солнечного света, если Вы страдаете от легкой восприимчивости или сокращаете риск возникновения меланомы и других раков кожи, Вы можете испытать дефицит витамина D.
Лица, полностью избегающие воздействия солнца, должны рассмотреть возможность измерения уровня витамина D. Если уровень уменьшен или недостаточен, они, возможно, пожелают рассмотреть возможность приема дополнительного витамина D3, 10-25 микрограммов в день и увеличения потребления продуктов с высоким содержанием витамина D, таких как жирная рыба, яйца, мясо, обогащенные маргарины и злаки. Добавки витамина D3 широкодоступны в магазинах здорового питания.
Будьте здоровы и привлекательны!
Обращайтесь только к профессионалам.
Используйте при изучении информации о вашей проблеме только данные доказательной медицины, такие, как приведены в этой статье.

Новость
Автор
Редакторы
Системная красная волчанка — это мультифакторное заболевание, развивающееся на основе генетического несовершенства иммунной системы и характеризующееся выработкой широкого спектра аутоантител к компонентам клеточного ядра. Молекулярно-генетические основы болезни изучены довольно плохо, в связи с чем специфического лечения до сих пор не создано, а в основе проводимой в клинике патогенетической терапии лежат иммунодепрессанты — глюкокортикостероиды и цитостатики. И вот, после более чем 50 лет попыток разработать специфическое лечение волчанки, произошел сдвиг: Управление по контролю за качеством пищевых продуктов и лекарств США официально утвердило в качестве лекарства от волчанки препарат Бенлиста (Benlysta) на основе моноклональных антител, специфически блокирующих B-лимфоцит-стимулирующий белок (BLyS).
Системная красная волчанка (СКВ) — одно из самых распространённых аутоиммуных заболеваний, в основе которого лежит генетически обусловленное комплексное нарушение иммунорегуляторных механизмов. При заболевании происходит образование широкого спектра аутоантител к различным компонентам ядра клеток и формирование иммунных комплексов. Развивающееся в различных органах и тканях иммунное воспаление приводит к обширным поражениям микроциркуляторного кровяного русла и системной дезорганизации соединительной ткани [1], [2].
Патогенез СКВ

Рисунок 1. Патогенез СКВ
Волчанка во многом связана с нарушениями на уровне пролиферации различных клонов В-клеток, активируемых многочисленными антигенами, в роли которых могут выступать медицинские препараты, бактериальная или вирусная ДНК и даже фосфолипиды мембраны митохондрий. Взаимодействие антигенов с лейкоцитами связано либо с поглощением антигенов антиген-презентирующими клетками (АПК), либо с взаимодействием антигена с антителом на поверхности В-клетки.
В результате поочередной активации то T-, то B-клеток увеличивается продукция антител (в том числе, аутоантител), наступает гипергаммаглобулинемия, образуются иммунные комплексы, чрезмерно и неконтролируемо дифференцируются Т-хелперы. Разнообразные дефекты иммунорегуляции, свойственные СКВ, связаны также с гиперпродукцией цитокинов Th2-типа (IL-2, IL-6, IL-4, IL-10 IL-12).
Одним из ключевых моментов в нарушении иммунной регуляции при СКВ является затрудненное расщепление (клиренс) иммунных комплексов, — возможно, вследствие их недостаточного фагоцитоза, связанного, в частности, с уменьшением экспрессии CR1-рецепторов комплемента на фагоцитах и с функциональными рецепторными дефектами.
Распространённость СКВ колеблется в пределах 4–250 случаев на 100 000 населения; пик заболеваемости приходится на возраст 15–25 лет при соотношении заболевших женщин к мужчинам 18:1. Наиболее часто заболевание развивается у женщин репродуктивного возраста с увеличением риска обострения во время беременности, в послеродовом периоде, а также после инсоляции и вакцинации.
СКВ часто становится причиной инвалидности. В развитых странах в среднем через 3,5 года после постановки диагноза 40% больных СКВ полностью прекращают работать, — в основном, в связи с нейрокогнитивными дисфункциями и повышенной утомляемостью. К потере трудоспособности чаще всего приводят дискоидная волчанка и волчаночный нефрит.
Клинические проявления СКВ чрезвычайно разнообразны: поражение кожи, суставов, мышц, слизистых оболочек, лёгких, сердца, нервной системы и т.д. У одного пациента можно наблюдать различные, сменяющие друг друга варианты течения и активности заболевания; у большинства больных периоды обострения заболевания чередуются с ремиссией. Более чем у половины больных есть признаки поражения почек, сопровождающиеся ухудшением реологических свойств крови [4].
Поскольку молекулярные и генетические механизмы, лежащие в основе заболевания, до сих пор как следует не изучены, специфического лечения волчанки до недавнего времени не существовало. Базисная терапия основана на приёме противовоспалительных препаратов, действие которых направлено на подавление иммунокомплексного воспаления, как в период обострения, так и во время ремиссии. Основными препаратами для лечения СКВ являются:
- глюкокортикоиды (преднизолон, метилпреднизолон);
- цитостатические препараты (циклофосфамид, азатиоприн, метотрексат, мофетила микофенолат, циклоспорин).
Исследователи, желая специфически блокировать BLyS, сделали ставку на человеческое моноклональное антитело, разработанное совместно с английской биотехнологической фирмой Cambridge Antibody Technology, и названное белимумаб (belimumab). В начале марта 2011 года американское Управление по контролю за качеством пищевых продуктов и лекарственных препаратов (FDA) впервые за 56 лет одобрило препарат, предназначенный для специфического лечения системной красной волчанки. Эти препаратом стал Бенлиста — коммерческое название антитела белимумаба, производством которого уже занимается компания GlaxoSmithKline. До того FDA одобряла для терапии СКВ гидроксихлорохин — лекарство от малярии; было это в 1956 году.
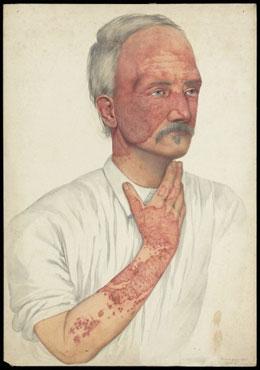
Рисунок 2. Человек, больной системной красной волчанкой (акварель 1902 года кисти Мэйбл Грин). Свое название заболевание получило ещё в средневековье, когда людям казалось, что характерная волчаночная сыпь на переносице напоминает волчьи укусы.
Целенаправленная терапия
Следующие на очереди

Обзор
Моноклональные антитела — новая надежда в лечении ревматических заболеваний.
Автор
Редакторы


Теорию аутоиммунитета сформулировал еще столетие назад немецкий исследователь Пауль Эрлих. За последующие годы описано множество аутоиммунных заболеваний. К ним относятся ревматоидный артрит, системная красная волчанка (СКВ), системная склеродермия, миопатии, васкулиты и прочие патологии .
Болезни, ассоциированные с аутоиммунным компонентом, — серьезная проблема современного общества . Их распространенность в мировой популяции составляет примерно 5%. Заболевания быстро переходят в хроническую форму, из-за чего снижается качество жизни пациентов. Аутоиммунные патологии часто приводят к инвалидизации больных [1], [4].
Несмотря на многолетний поиск новых путей фармакотерапии, современная медицина не может предложить способов лечения, непосредственно влияющих на причину возникновения аутоиммунитета. Врачи способны лишь замедлить прогрессирование патологии и снизить выраженность клиники — провести патогенетическое и симптоматическое лечение. Для этого разработана базисная терапия, которая применяется уже многие годы. Однако не всегда проверенные препараты работают так, как надо.
Почему необходимо искать новые способы лечения?
Для лечения аутоиммунных заболеваний используют широкий арсенал противоревматических лекарств. Классическая терапия включает нестероидные противовоспалительные средства, глюкокортикоиды, цитостатики. В зависимости от особенностей развития заболевания подбирают препараты из той или иной группы [4].
Лекарства, применяемые при ревматических болезнях
- Большие иммунодепрессанты:
- глюкокортикоиды (преднизолон, дексаметазон);
- антибиотики (циклоспорин, такролимус);
- антиметаболиты (метотрексат, азатиоприн, меркаптопурин);
- цитостатики (циклофосфан).
- Малые иммунодепрессанты:
- плаквенил, хингамин;
- купренил;
- препараты золота (ауронофин);
- гепарин;
- нестероидные противовоспалительные средства.

Рисунок 2. Структурные формулы метотрексата и фолиевой кислоты. Препарат (а) по строению похож на фолиевую кислоту (б). Он состоит из птеридиновых групп и парааминобензойной кислоты. Действующий компонент метотрексата отличается от структуры фолата отсутствием гидроксильной группы (–OH) и наличием дополнительного метильного радикала (–CH3).
По механизму действия метотрексат относится к антиметаболитам. Препараты этой группы тормозят физиологические реакции в организме, связываясь с ферментами и выключая их активность. Вещество, которое в норме участвует в реакции, уже не может попасть в биохимический круговорот из-за повышенной конкуренции с компонентами лекарства. Основной мишенью для действия метотрексата является фермент, расщепляющий фолиевую кислоту, — дигидрофолатредуктаза (ДГФ). Этот белок воздействует на поступающий в организм фолат, переводя его в активную форму. При этом образуется тетрагидрофолиевая кислота. Она участвуют в синтезе строительного материала для ДНК — пуриновых оснований и тимидилата.
Метотрексат вклинивается в цепочку реакций благодаря структурному сходству с молекулой фолиевой кислоты (рис. 2). Конкуренция за фермент приводит к тому, что содержание активного фолата в ткани значительно снижается. Нет строительного материала — нет и новых молекул ДНК, без которых клетки не могут размножаться. Повышенной чувствительностью к воздействию лекарства обладают те ткани, структурные элементы которых постоянно делятся. К ним относятся и компоненты костного мозга, из которых формируются будущие иммунные клетки.
Еще один важный момент в работе метотрексата связан с активностью его полиглутамированных метаболитов. Эти молекулы формируются после активации препарата непосредственно в клетках человеческого организма. Они ингибируют другие ферменты, которые взаимодействуют с фолиевой кислотой. В эту группу входят тимидилсинтетаза и АИКАР-трансамилаза. Активность производных метотрексата запускает процесс выработки аденозина. Он оказывает мощное противовоспалительное действие, благодаря чему снижается выраженность симптомов ревматоидного артрита [7].
Метотрексат удобно использовать — он легко дозируется и может назначаться длительными курсами. Кроме того, важное преимущество этого препарата — низкая цена, в сравнении с современными лекарствами импортных фармкомпаний [8]. Несмотря на все достоинства, лечение метотрексатом не всегда приводит к снижению активности заболевания. У многих пациентов использование препарата неэффективно даже в комбинации с другими классическими средствами [5]. Это подтверждается при анализе статистики. Исследования показали, что при проведении лечения метотрексатом и комбинациями базисных препаратов только половина пациентов достигла ремиссии [9], [10].
Несостоятельность классической терапии заставляет ученых искать новые способы лечения ревматоидного артрита. Стоит отметить, что, несмотря на новые разработки, борьбу с заболеванием все же начинают с назначения метотрексата и его аналогов. Дополнительные препараты используют только при высокой активности аутоиммунного процесса. У таких пациентов применение одного лекарства часто бывает неэффективно [7]. В зависимости от особенностей течения патологии подбирают подходящую схему терапии (рис. 3).

Рисунок 3. Тактика ведения пациента с ревматоидным артритом при неэффективности использования метотрексата.
Неэффективность препаратов базисной терапии встречается не только при ревматоидном артрите, но и при других заболеваниях аутоиммунного происхождения (системной красной волчанке, склеродермии, болезни Бехтерева). Это мотивирует специалистов-ревматологов разрабатывать другие лекарства и подбирать новые схемы терапии.
Генно-инженерные препараты: дополнение к базисной терапии
По-новому взглянуть на лечение аутоиммунных заболеваний позволила разработка терапевтических моноклональных антител [11]. Принципиально новый класс препаратов получен благодаря достижениям генной инженерии. Для понимания механизма действия этих лекарств стоит вспомнить о том, как работают иммунные клетки в норме и при патологии [1], [12].
При аутоиммунных заболеваниях можно подавлять сразу весь сложный механизм иммунитета, что и делают препараты классической терапии. Но это оставляет человека без защиты от вражеских агентов — бактериальных инфекций, вирусов и прочих патогенов. Поэтому предпочтительнее сохранить активность иммунной системы в целом, избавив человека от аутоагрессии определенных ее компонентов. Именно так работают новые препараты — моноклональные антитела.
- Ингибиторы ФНО (фактора некроза опухолей) — инфликсимаб, этанерцепт, цертолизумаб, голимумаб, адалимумаб.
- Блокаторы интерлейкиновых рецепторов — тоцилизумаб (ИЛ-6R), канакинумаб (ИЛ-1R), секукинумаб (ИЛ-17R).
- Анти-В-клеточные антитела (антитела к мембранным молекулам CD20) — ритуксимаб, белимумаб [17].
- Анти-Т-клеточные антитела (антитела к молекулам CD80 и CD86) — абатацепт [18].
Ингибиторы ФНО
Ингибиторы фактора некроза опухолей — это первые моноклональные антитела, внедренные в ревматологическую практику. В эту группу входят инфликсимаб, этанерцепт, цертолизумаб, голимумаб, адалимумаб.
Фактор некроза опухолей (ФНО) — это провоспалительный цитокин (вещество, которое стимулирует развитие воспалительной реакции). В норме при его выделении происходит пролиферация клеток сосудов, активация макрофагов, лизис опухолевых агентов. Эти эффекты играют важную роль в защите организма от патогенов. Воспаление можно считать ответной реакцией на воздействие повреждающих факторов.

Рисунок 5. Патологические изменения в суставе при ревматоидном артрите. Аутоиммунный процесс вызывает появление эрозий, синовит (воспаление синовиальной оболочки), разрушение суставного хряща.
Такое строение связано с механизмом получения препарата. Первоначально синтезируют антитело к фактору некроза опухолей в организме мыши. Полученный иммуноглобулин специфичен к ФНО и уже может его обезвреживать, но полностью чужеродные белки вводить в организм пациентов, конечно, нельзя. Это вызовет активную иммунную реакцию — выработку антител уже против терапевтических агентов. Поэтому домены мышиного иммуноглобулина заменяют сходными участками человеческих белков. Антитела, имеющие фрагменты разного происхождения, называются химерными. Фактически, они берут лучшие качества своих предшественников. Мышиная часть обеспечивает высокую чувствительность к ФНО, а человеческие фрагменты снижают иммуногенность — вероятность развития иммунного ответа.

Рисунок 6. Основные эффекты ФНО и блокирующие его моноклональные антитела (инфликсимаб и этанерцепт). Мишенями для моноклональных антител являются свободная и мембраноассоциированная формы фактора некроза опухолей. Лекарства препятствуют связыванию цитокина с рецептором, благодаря чему снижается активность ревматоидного артрита.
Блокаторы интерлейкиновых рецепторов
В развитии аутоиммунного воспаления важную роль играют интерлейкины, которые, как и ФНО, относятся к провоспалительным цитокинам (рис. 7). Основными представителями этой группы являются ИЛ-6, ИЛ-1, ИЛ-17. Функция интерлейкинов — это контроль процессов дифференцировки, пролиферации и гибели (апоптоза) иммунных клеток, который осуществляется через соответствующие гены-мишени [20].

Рисунок 7. Механизм действия интерлейкинов при аутоиммунном воспалении (на примере ИЛ-6). Цитокин влияет на T- и B-лимфоциты, гемопоэтические клетки, гепатоциты. Он стимулирует выработку аутоантител В-клетками, а также формирование аутореактивных Т-клонов, которые непосредственно участвуют в аутоиммунном процессе. Влияние на костный мозг заключается в стимуляции выработки новых клеток крови — повышается число лейкоцитов и тромбоцитов. Воспаление сопровождается ответной реакцией клеток печени, появлением характерных симптомов аутоиммунного заболевания.
Тоцилизумаб — это препарат, который блокирует работу ИЛ-6. Рецептор этого вещества состоит из двух компонентов — мембранного ИЛ-6R (α-цепь) и гликопротеина g130 (β-цепь). Мембранная часть рецептора связывается с ИЛ-6, образуя устойчивый комплекс. Вместе они активируют компонент g130, вызывая изменение его структуры (гомодимеризацию). Образуется рецепторный комплекс из двух молекул g130, который в свою очередь активирует JAK1-киназу. Этот фермент запускает каскад реакций в клетке, который приводит к появлению биологического эффекта цитокина — развитию воспаления. В некоторых случаях ИЛ-6 связывает не мембранная, а растворимая форма α-цепи (рис. 8). Механизм действия рецептора при этом не меняется [21].
В основе работы тоцилизумаба лежит конкуретное ингибирование. Сигнальные молекулы активно связываются с моноклональным антителом. Вакантное место занято — интерлейкин не может образовать комплекс с рецептором, а значит, он не способен активировать процесс воспаления.

Рисунок 8. Механизм действия тоцилизумаба. Препарат связывает растворимые и мембранные рецепторы ИЛ-6, блокируя передачу сигналов.
Тоцилизумаб считается одним из самых безопасных препаратов, входящих в группу моноклональных антител. Это позволяет применять его при ювенильном идиопатическом артрите, который возникает в возрасте до 16 лет. Дети особенно остро реагируют на токсические воздействия, поэтому препараты, которые используют при их лечении, должны иметь минимальное число побочных реакций. Применение тоцилизумаба позволяет достигнуть необходимого эффекта лечения, не вызвав тяжелых осложнений.
Анти-B-клеточная терапия
Препараты из группы анти-B-клеточной терапии (ритуксимаб и белимумаб) блокируют активность В-лимфоцитов путем связывания их мембранных молекул CD20. Эти вещества есть только у определенных категорий В-клеток. Они специфичны для пре-В-лимфоцитов и зрелых В-лимфоцитов. CD20 нет у стволовых элементов и про-В-клеток, из которых будут образовываться новые лимфоцитарные элементы. Мембранные молекулы данного типа не содержатся и у плазматических клеток, которые вырабатывают иммуноглобулины [22].

Рисунок 9. Механизм работы ритуксимаба. Fab-фрагмент моноклонального антитела связывается с CD20 на поверхности B-лимфоцита. Это запускает лизис клетки, который может осуществляться несколькими путями: через систему комплемента, программу апоптоза или агрессию натуральных киллеров и макрофагов.
Анти-Т-клеточная терапия
Блокировка действия Т-лимфоцитов возможна благодаря особенностям их активации. Чтобы Т-лимфоцит вступил в аутоиммунный процесс и связался с антигеном, он должен получить два сигнала от антигенпрезентирующих клеток (АПК). Первый сигнал обеспечивает распознавание специфического аутоантигена Т-клеточными рецепторами. Второй сигнал — это неспецифический процесс связывания мембранных молекул CD80 и CD86 на поверхности АПК с рецептором CD28 лимфоцита. Сочетание этих взаимодействий вызывает активацию Т-клеток, которые в свою очередь стимулируют выработку провоспалительных цитокинов. Это и есть основной вклад Т-лимфоцитов в аутоиммунный процесс.
Знания о механизме активации Т-клеток использовали при разработке моноклональных антител. Основной представитель анти-Т-клеточных агентов — это абатацепт. Препарат представляет собой белок, состоящий из двух частей. Специфическая часть образована молекулой CTLA-4 (антиген 4 цитотоксических лимфоцитов). Неспецифическая область — это Fc-фрагмент человеческого иммуноглобулина G1 [23].
Воздействие абатацепта направлено как раз на неспецифический (костимулирующий) сигнал. Компонент CTLA-4 связывает белки CD80 и CD86 на поверхности антигенпрезентирующих клеток. Рецептор лимфоцита CD28 уже не может взаимодействовать с ними, из-за чего активация Т-клетки не завершается (рис. 10).

Рисунок 10. Механизм действия абатацепта. Абатацепт модулирует иммунный ответ через связывание с CD80/CD86 на антигенпрезентирующих клетках. Это препятствует связыванию CD80/CD86 с CD28 T-клеток, то есть активация Т-клеток отменяется через блокировку костимуляции.
Не всё так просто: возможные проблемы при использовании моноклональных антител
Например, одна пачка метотрексата стоит примерно 200 рублей. Цена упаковки инфликсимаба — около 43 тыс. рублей. Разница очевидна. За год лечения метотрексатом даже в максимальной дозировке пациент потратит на лекарство 1–2 тыс. рублей (в зависимости от фирмы-производителя, схемы лечения и стоимости препарата в местных аптеках). Цена годовой терапии инфликсимабом составляет примерно 700 тыс. рублей. Понятно, что самостоятельно обеспечить себя этим лекарством сможет только очень ограниченная группа пациентов.
Использование биологических препаратов допустимо в тех случаях, когда к базисным средствам у пациента развивается непереносимость. Больные испытывают тяжелое побочное воздействие лекарства, которое еще сильнее ухудшает их состояние. Применение препаратов с другим механизмом действия, в том числе и моноклональных антител, позволяет минимизировать побочные эффекты [18].
Другая сложность, с которой можно столкнуться при использовании биологических препаратов, — это побочные реакции. Параллельно с накоплением данных об эффективности использования лекарств выявляют все новые нежелательные эффекты от их применения. Большая часть таких реакций связана с процессом иммуносупрессии. Подавляя активность иммунных клеток, моноклональные антитела снижают защитную функцию организма. В первую очередь страдают противоинфекционный и противоопухолевый иммунитеты [18], [24].
Парадоксально, но применение новых лекарств против аутоиммунитета может вызвать острые аутоиммунные реакции. Все биологические препараты представляют собой белковые молекулы, которые в той или иной степени чужеродны для организма. Поэтому при проникновении терапевтических агентов в тело больного иммунитет может распознать их как антигены. Появляется активный иммунный ответ — вырабатываются антитела уже против компонентов препарата.
Несмотря на все возможные сложности, моноклональные антитела прочно вошли в регистр лекарств, применяющихся в ревматологии. Перспектива использования биологических препаратов и их место в ревматологии будет зависеть от результатов многолетних исследований, которые еще предстоит провести. Но даже сейчас можно сказать, что разработка терапевтических моноклональных антител является важным шагом на пути к победе над аутоиммунным воспалением.

Обновлено: 01.11.2021

ЗАПИСАТЬСЯ НА ПРИЁМ
Бесплатная консультация или второе мнение врача-хирурга перед операцией в Клиническом госпитале на Яузе! подробнее
Получите консультацию ревматолога
Обслуживание на двух языках: русский, английский.
Оставьте свой номер телефона, и мы обязательно перезвоним вам.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначить только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Статья проверена врачом-ревматологом Филатовой Е.Е., носит общий информационный характер, не заменяет консультацию специалиста.
Для рекомендаций по диагностике и лечению необходима консультация врача.
Мы проводим экспертную диагностику и лечение красной волчанки. Симптомы заболевания, данные анализов позволяют врачу уточнить форму и течение СКВ и назначить современную эффективную терапию, которая может включать прием, в том числе инновационных генно-инженерных лекарственных препаратов, проведение сеансов гемокоррекции.
Системная красная волчанка (СКВ) — хроническое воспалительное аутоиммунное заболевание. Чаще встречается у женщин.
Разновидности течения системной красной волчанки
Симптомы СКВ, жалобы и клинические проявления
Покраснение (эритема) кожи лица в области щек и носа
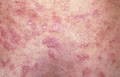
Боли и воспаление (отек) суставов
Встречаются часто, но не приводят к разрушению суставных структур, как это бывает при ревматоидном артрите. Наиболее часто поражаются мелкие суставы кистей, но возможны также артриты и крупных суставов. Характерными признаками воспалительной боли в суставах являются утренняя скованность (> 1 часа), нарастание болей в покое и ослабление их при движении.
Плеврит и перикардит
Частый симптом при волчанке — воспаление плевральных оболочек, выстилающих изнутри грудную клетку (плеврит), и сердечной сумки (перикардит), что может проявляться болями в грудной клетке при дыхательных движениях.
Поражение почек
При вовлечении в процесс внутренних органов наиболее часто происходит поражение почек, обычно при СКВ протекающее незаметно. Отеки и стойкое повышение артериального давления являются косвенными признаками этого тяжелого осложнения.
Воспалительные изменения нервной системы. Могут проявляться самым разнообразным образом (от головных болей и нарушений психоэмоциональной сферы до судорожных припадков).
Неспецифические жалобы. Многие пациенты в начале заболевания замечают лишь неспецифические симптомы заболевания, такие, как общая слабость, повышение температуры тела, снижение веса, отсутствие аппетита.
Диагностика и лечение СКВ в Клиническом госпитале на Яузе
Диагностика системной красной волчанки на начальной стадии развития позволяет достичь быстрой и стойкой ремиссии заболевания и избежать развития тяжелых осложнений. При лечении волчанки мы применяем медикаментозную терапию (стероидные и нестероидные препараты, биологические генно-инженерные препараты), методы экстракорпоральной гемокоррекции.
При появлении симптомов СКВ обратитесь к ревматологам Клинического госпиталя на Яузе. Современные методы лечения при соблюдении профилактических мер позволяют годами и даже десятилетиями поддерживать состояние ремиссии, рожать детей, вести обычную нормальную жизнь.
Цены на услуги Вы можете посмотреть в прайсе или уточнить по телефону, указанному на сайте.
Цены на услуги ревматолога
- Стандартные консультации
- Прием (осмотр, консультация) врача-ревматолога первичный 3 900 руб.
- Прием (осмотр, консультация) врача-ревматолога повторный 3 600 руб.
- Консультации экспертов
- Прием (осмотр, консультация) врача-ревматолога Бородина О.О. 7 000 руб.
- Телеконсультации
- Удаленная консультация врача-ревматолога первичная 2 500 руб.
- Удаленная консультация врача-ревматолога повторная 2 500 руб.
- Помощь на дому
- Прием (осмотр, консультация) врача-терапевта с выездом на дом в пределах МКАД 10 500 руб.
Внимание! Цены на сайте могут отличаться.
Пожалуйста, уточняйте актуальную стоимость у администраторов по телефону.
Наши специалисты:

БородинОлег Олегович Врач-ревматолог
Прием пациентов с 16 лет
Стоимость приема: 7000 ₽
Читайте также:

