Можно ли заразиться цитомегаловирусом от кошки
Обновлено: 19.04.2024
- Половой путь передачи цитомегаловируса (через сперму или секреты, выделяемые половыми органами, при половом контакте)
Заражение возможно не только при генитальном контакте, но и во время незащищенного презервативом анального или орального секса.
- Трансплацентарный путь передачи цитомегаловируса (через плаценту беременной женщиной будущему ребенку)
Кроме того, ребенок может заразиться от матери во время родов при прохождении по родовым путям или через материнское молоко при грудном вскармливании. Этот путь заражения наиболее опасен, так как приводит к развитию врожденной цитомегаловирусной инфекции, чреватой самыми тяжелыми последствиями.
- Гемотрансфузионный путь передачи цитомегаловируса (через кровь больного человека)
Известны случаи, когда цитомегаловирус попадал в организм при переливании инфицированной донорской крови и ее компонентов; при пересадке органов и тканей, применении донорской спермы или яйцеклеток; при введении препаратов через не стерильный шприц. Бывает и так, что ЦМВ заражаются медики (акушеры-гинекологи, хирурги, стоматологи) при непосредственном контакте с кровью, слюной, слизью больного.
Разнообразие путей передачи цитомегаловируса обусловлено тем, что вирус у инфицированного человека может находиться в слюне, моче, влагалищном секрете, сперме, грудном молоке, слезах, крови. Поэтому заражение возможно при любом близком контакте: половом или бытовом. Заражение происходит еще и потому, что человек-носитель цитомегаловируса часто не знает о том, что инфицирован сам и является источником инфицирования для близких людей.
Но все же основной источник заражения — это не пассивный вирусоноситель, а человек, больной цитомегалией, в период обострения заболевания. Если острой формой ЦМВ заболевает беременная женщина, это в большинстве случаев ведет к трансплацентарному заражению плода. Грудные дети могут получить цитомегаловирус с молоком матери.
Основной путь заражения цитомегаловирусом среди взрослых — половой. Это объясняется тем, что обычно максимальное количество вирусов находится в сперме у мужчин или во влагалищном секрете у женщин.
Поэтому, как и при других инфекциях, передающихся половым путем, можно выделить определенную группу риска цитомегалии. В группу риска входят члены семей больных острой формой цитомегалии, люди, часто меняющие половых партнеров, наркоманы, пользующиеся одним шприцем.
Кто предупрежден — то вооружен. Теперь вы знаете, как обезопасить себя от цитомегаловируса. Но сдавать анализ на цитомегаловирус обязательно нужно при подозрении на полове инфекции, при воспалительных заболеваниях и при планировании беременности. Этот вирус осложняет как течение и лечение ЗППП, так и течение беременности.
Цитомегаловирусная инфекция (ЦМВИ) – хроническая инфекционная болезнь вирусной этиологии, характеризующаяся многообразием форм патологического процесса от латентной инфекции до клинически выраженного генерализованного заболевания (цитомегаловирусная болезнь). Тяжесть и спектр проявлений ЦМВИ весьма разнообразны.
Продолжительность инкубационного периода при заражении ЦМВ составляет 4-12 недель. Клиническая картина приобретенной ЦМВИ у взрослых зависит от формы инфекции (первичное заражение, реинфекция, реактивация латентного вируса), путей и механизмов заражения (аспирация инфицированной слюны, гемотрансфузии, половой путь, трансплантация инфицированного органа), состояния иммунной системы (отсутствие или наличие иммуносупрессии и степень ее выраженности).
Первично латентная цитомегалия – самая частая форма инфекции. Латентная цитомегаловирусная инфекция продолжается пожизненно и клинически не проявляется, однако под влиянием каких-либо причин может активизироваться и переходить в манифестную клинически выраженную форму.
Первичное инфицирование ЦМВ иммунокомпетентных лиц обычно протекает бессимптомно или с нерезко выраженным мононуклеозоподобным синдромом. Данным синдромом острая ЦМВИ проявляется лишь у 5% взрослых (соответственно, не более, чем у 3-5% беременных). Основные отличительные признаки — высокая лихорадка, слабость, утомляемость, сильное недомогание, выраженный и длительный астенический синдром, в крови — относительный лимфоцитоз, атипичные лимфоциты.
Острая форма ЦМВИ чаще всего наблюдается у лиц, зараженных вирусом при переливании крови от больного человека или половым путем. Обычно ее течение похоже на простуду и сопровождается такими симптомами, как слабость, общее недомогание, головные боли и насморк. Часто возникает воспаление и увеличение слюнных желез с обильным отделением слюны и белесоватыми налетами на деснах и языке.
Характерны высокая лихорадка длительностью более двух недель, общее недомогание, выраженная утомляемость, лимфаденопатия. Отмечаются головная боль, миалгии, артралгии, гепатоспленомегалия, повышение активности аминотрансфераз и щелочной фосфатазы. Возможно развитие гепатита и пневмонии. Большинство больных выздоравливает полностью, хотя астенический синдром сохраняется длительное время. При отсутствии выраженных иммунологических нарушений острая ЦМВИ переходит в латентную с пожизненным присутствием
Острая ЦМВИ у беременных протекает бессимптомно или с умеренно выраженными признаками фарингита, незначительного повышения температуры тела, признаками астении. Заражение вирусом в первые 20 недель беременности может быть причиной самопроизвольного выкидыша, внутриутробной гибели плода, мертворождения, пороков развития. При заражении в более поздние сроки у ребенка может быть врожденная цитомегалия, симптомы которой обнаруживаются с первых дней внеутробной жизни.
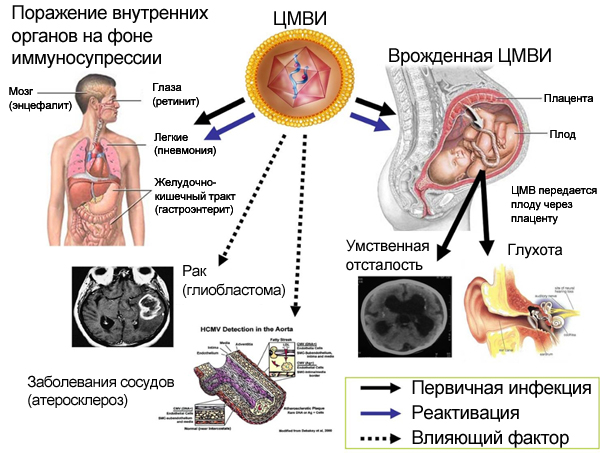
У людей с нормальным иммунитетом (иммунокомпетентных) ЦМВИ, как правило, протекает латентно. Однако на фоне имеющихся иммунологических нарушений резко повышается риск развития клинически выраженных (манифестных) форм заболевания. Например, манифестная ЦМВИ занимает одно из первых мест в структуре оппортунистических заболеваний у ВИЧ-инфицированных пациентов. Кроме того, клинически выраженная ЦМВИ — одно из самых частых и серьёзных инфекционных осложнений при трансплантации органов или в случае проведения длительной иммуносупрессивной терапии.
Развитие тяжёлой ЦМВИ описано у онкогематологических больных, пациентов, страдавших пневмоцистной пневмонией, туберкулёзом, лучевой болезнью, ожоговой травмой, у лиц, находящихся на длительной кортикостероидной терапии, перенёсших различные стрессовые ситуации.
Развитие манифестной ЦМВИ в этом случае может быть обусловлено первичным инфицированием ЦМВ, повторным попаданием вируса в организм (реинфекцией) или реактивацией вируса в заражённом организме . Вероятность возникновения и тяжесть течения ЦМВИ связывают со степенью иммуносупрессии.
Через 1-3 месяца при наличии выраженной иммуносупрессии наступает тяжелая органная патология с тенденцией к генерализации процесса.
При генерализованной форме чаще наблюдается поражение легких, почек и кишечника, реже - печени и других органов. Один из тяжёлых признаков ЦМВИ — ретинит. Потеря зрения необратима, поскольку данный процесс развивается в результате воспаления и некроза сетчатки. Как возможные клинические симптомы ЦМВИ диагностируют также восходящий миелит и полиневропатию (подострого течения); энцефалит, характеризующийся деменцией; цитомегаловирусный гепатит с одновременным поражением жёлчных путей и развитием склерозирующего холангита; адреналит, проявляющийся резкой слабостью и снижением АД. Иногда возникает эпидидимит, цервицит, панкреатит.
По оценкам специалистов, только в США ежегодно рождается 30—40 тысяч детей с врожденной ЦМВ-инфекцией, т. е. она далеко опережает по частоте и значимости все остальные врожденные инфекции. Важно отметить, что врожденная цитомегаловирусная инфекция всегда имеет генерализованный характер, тогда как приобретенная может быть локализованной с изолированным поражением слюнных желез.
Для врожденной цитомегалии характерна внутриутробная задержка развития, желтуха, увеличение печени и селезенки, уменьшение числа тромбоцитов, ретикулоцитоз и прогрессирующая анемия. Врожденная генерализованная ЦМВИ характеризуется также геморрагическими высыпаниями на коже и слизистых оболочках, кровоизлияниями во внутренние органы и головной мозг, значительной анемией, развитием очагов миелоэритробластоза в печени и почках.
Самое тяжелое проявление данной формы — энцефалит, который практически не встречается при приобретенной цитомегаловирусной инфекции. Часто развиваются микроцефалия, расширение желудочков мозга, нейросенсорная тугоухость. Отмечается поражение глаз - увеит, помутнение хрусталика и субатрофия радужной оболочки.
Цитомегаловирусная инфекция (ЦМВИ) – вирусное инфекционное заболевание, вызываемое цитомегаловирусом (ЦМВ). ЦМВ - это разновидность вируса герпеса человека, герпесвирус 5-го типа, который относится к семейству Herpesviridae, подсемейству β-герпесвирусов.
Источником инфекции является человек, зараженный цитомегаловирусом. Наличие в крови специфических антител в абсолютном большинстве случаев означает присутствие в организме самого вируса. У 20–30% здоровых беременных ЦМВ присутствует в слюне, 3-10% - в моче, 5-20% - в цервикальном канале или вагинальном секрете. Вирус обнаруживают в грудном молоке 20-60% серопозитивных матерей. Установлена значительная частота выявления (до 35%) и длительность присутствия (в среднем, до 22 месяцев) ЦМВ в сперме. Кровь около 1% доноров содержит ЦМВ.
Для ЦМВ характерен широкий спектр путей передачи – воздушно-капельный, контактный (при сексуальных и бытовых контактах), внутриутробный, пероральный, парентеральный, через компоненты крови при переливании крови, а также при пересадке органов.
Группу наибольшего риска по отношению к ЦМВИ составляют лица с искусственной или естественной иммуносупрессией (т.е. люди с угнетенным иммунитетом): реципиенты органов и тканей, ВИЧ-инфицированные, онкологические больные, пациенты, перенесшие тяжелые хирургические операции; а также беременные женщины.
Выделяют два периода жизни человека, наиболее уязвимые для инфицирования ЦМВ. Первый достигается к трехлетнему возрасту, при этом заражение происходит контактно-бытовым путем. Дети младшего возраста заражаются друг от друга в домах ребенка, детских садах; вирус передается от матери к ребенку и от инфицированного ребенка матери. Заражение происходит при непосредственном контакте с источником инфекции или опосредованно через контаминированную вирусом посуду, зубные щетки, игрушки.
Другим критическим периодом заражения ЦМВ является возраст 16–30 лет, который является периодом половой зрелости и половой активности В данной группе лиц передача вируса осуществляется главным образом при близком контакте через поцелуи и половым путем, причем как при гетеро- , так и гомосексуальных контактах.
Беременным принадлежит значительная роль в эпидемиологии ЦМВИ, которая обнаруживается у них в 2 раза чаще, чем краснуха. Частота обнаружения ЦМВ в цервикальном канале, вагинальном секрете здоровых беременных составляет от 2-8% до 18–20%. ЦМВ обладает высокой способностью проникать от женщины к плоду. Наличие ЦМВ в генитальном тракте у беременных может служить причиной заражения ребенка во время родов. Риск интранатального инфицирования ребенка при наличии вируса в генитальном тракте матери составляет 50–57%.
Серьезной проблемой является заражение цитомегаловирусом реципиентов крови, являющееся одним из путей передачи инфекции. В случае, если доноры не обследуются на ЦМВИ, гемотрансфузии и парентеральные манипуляции могут приводить к заражению ЦМВ. Переливание цельной крови и ее компонентов, содержащих лейкоциты, ведет к передаче вируса с частотой 0.14 – 10 на 100 доз. Риск инфицирования ЦМВ с каждой гемотрансфузией возрастает на 5–12%.
Еще более сложные проблемы связаны с трансплантацией органов, поскольку фактором передачи инфекции может быть не только перелитая кровь, но и пересаженный орган.
Выявлена зависимость между частотой распространенности ЦМВ среди населения, с одной стороны, и условиями и уровнем жизни, с другой. Так, антитела к цитомегаловирусу класса IgG выявляются чаще среди жителей городов, что обусловлено более высокой плотностью населения и большей долей лиц с иммунодепрессией среди городских жителей, а также среди населения с низким уровнем жизни. У последних в 40–60% случаев до 5 лет происходит инфицирование цитомегаловирусом, а к 15–19 годам уже у 50–88% обнаруживаются антитела к ЦМВ.
Что такое токсоплазмоз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Александрова Павла Андреевича, паразитолога со стажем в 14 лет.
Над статьей доктора Александрова Павла Андреевича работали литературный редактор Маргарита Тихонова , научный редактор Сергей Федосов

Определение болезни. Причины заболевания
Токсоплазмоз — это острое и хроническое паразитарное заболевание человека в виде манифестных форм или носительства, вызываемое простейшими внутриклеточными паразитами — токсоплазмами, которые попадая в организм человека могут при условиях иммунодефицита поражать нервную ткань, среды глаза, сердечно-сосудистую и ретикулоэндотелиальную системы, вызывая поражение организма той или иной степени тяжести. Болезнь относится к группе TORCH-комплекса, т. е. вызывает врождённую патологию.
Этиология
Таксономия:
Вид — Toxoplasma gondii
Токсоплазмы обитают в мире в трёх формах:
- трофозоиты (тахизоиты);
- цисты (брадизоиты);
- ооцисты.
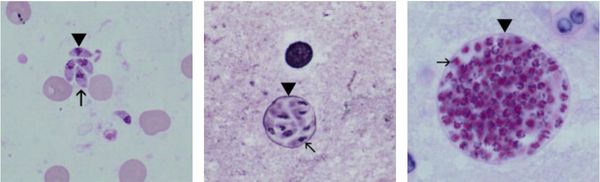
Трофозоиты достигают 4-7 мкм в длину и 2-4 мкм в ширину. Их тело по форме напоминает полумесяц с заострённым передним и закруглённым задним концами, состоит из пелликулы (покровной ткани) и различных органелл. Такие паразиты обитают во всех клетках млекопитающих кроме эритроцитов, размножаются путём деления. Могут создавать движение, активно проникая в клетки хозяина через клеточную мембрану или посредством фагоцитоза (захвата и переваривания клетки). Обнаруживаются в тканях в острой стадии инфекции. Их скопление внутри одной клетки называют псевдоцистой. Трофозоиты неустойчивы вне клетки и во внешней среде, быстро погибают при высушивании, прогревании и применении дезинфицирующих средств. Хорошо окрашиваются по Романовскому. Чувствительны к различным химиопрепаратам (сульфаниламидам, некоторым макролидам и другим).
Цисты размерами до 100 мкм отличаются плотной оболочкой, через которую не могут проникнуть антитела или лекарственные препараты. Внутри оболочки сосредоточено 3000-5000 паразитов, со временем они увеличиваются. Цисты формируются в организме хозяина (в основном в скелетных мышцах, миокарде и ЦНС) и живут там десятки лет. Чрезвычайно устойчивы к воздействиям внешних факторов. При адекватной иммунной системе могут пожизненно находиться в состоянии функционального покоя и не приносить никакого вреда организму человека.
Ооцисты играют основную роль в передаче инфекции. Они представляют собой овальные образования 10-12 мкм в диаметре. Их развитие и формирование длится 3-24 дня и проходит в слизистой оболочке тонкой кишки кошек. Затем в течение 7-20 дней паразиты выделяются с испражнениями, после этого срока новые фекалии кошки уже не заразны. За сутки с испражнениях животного выделяется до 10 миллионов ооцист. Спустя 2-3 дня при температуре 24 °C происходит споруляция ооцист — образование спор. При благоприятных условиях микроорганизмы сохраняются во внешней среде до года и дольше.
Существует множество штаммов токсоплазм, одни из которых отличаются высокой вирулентностью, а другие относительно маловирулентны. [1] [2] [7] [9]
Эпидемиология
Учитывая большое количество латентных форм, заболевание не поддаётся общему исчислению — им может быть заражено не менее 1,5 миллиардов человек. Только ежегодно регистрируется около 200 тысяч случаев внутриутробного инфицирования.
Распространение возбудителя повсеместное — токсоплазма обнаружена на всех материках. После заражения паразиты способны пожизненно сохранятся в организме большинства животных и птиц. Количество случаев приобретённого токсоплазмоза в разных странах колеблется: от 85 % во Франции и Мадагаскаре до 15 % в США и Англии.
- Фекально-оральный:
- водный и пищевой путь — при недостаточной термической обработке, чаще при употреблении сырого мяса и фарша;
- контактно-бытовой путь — при несоблюдении санитарных норм в повседневной жизни, например, при общении с кошками.
- Вертикальный путь (от матери к плоду) — преимущественно при первичном заражении матери во время беременности, часто у ВИЧ-инфицированных в стадии СПИДа.
- Артифициальный путь — при пересадке органов, в которых расположены цисты, пациенту с плохим иммунитету.
- Аэрогенный путь — при попадании инфицированной ооцистами пыли в рот человека.
- Контактный путь — при повреждении целостности кожных покровов. Встречается крайне редко, в основном у работников лабораторий и скотобоен, отмечен лишь в некоторых источниках, явного практического значения не имеет.
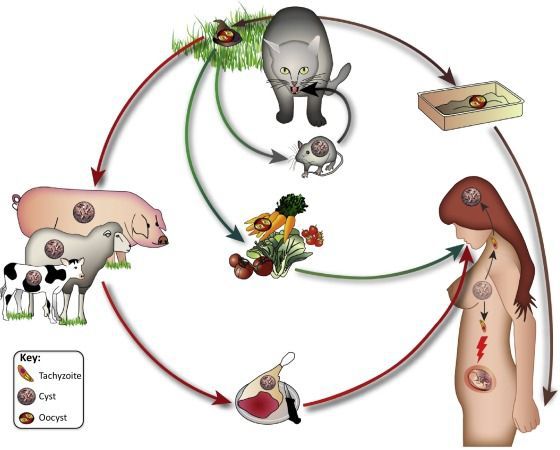
От человека к человеку заболевание не предаётся (кроме случаев каннибализма). Нельзя заразиться посредством укуса насекомых и при половом контакте.
Инфицирование токсоплазмой вызывает устойчивый пожизненный иммунитет к повторному заражению, однако известны случаи рецидива первичной инфекции при заражении другим высоковирулентным штаммом (у беременных, заразившихся при употреблении сырого мяса с другого континента). [1] [3] [5] [8] [9]
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением - это опасно для вашего здоровья!
Симптомы токсоплазмоза
Инкубационный период при манифестных формах (явных проявлениях болезни) длится от двух недель до двух месяцев.
Специфичных симптомов, характерных именно для токсоплазмоза, не существует.
В большинстве случаев приобретённого токсоплазмоза заболевание протекает бессимптомно или со стёртой клиникой, напоминающей нетяжёлое ОРЗ: кратковременная лихорадка, слабость, недомогание, повышение температуры до 38,0 °C, увеличение периферических лимфоузлов, небольшое увеличение печени и селезёнки.
Доказано, что токсоплазма может оказывать влияние на психику человека. Это выражается в учащении рискованных действий, снижении концентрации внимания, повышенной нервозности, у лиц с тяжёлым острым или длительным хроническим активным течением повышен риск развития шизофрении.
Иногда заболевание проявляется изолированной глазной формой — длительно текущие увеиты, иридоциклиты и хориоретиниты. Как правило, эти нарушения являются поздними проявлениями нераспознанного ранее врождённого процесса.
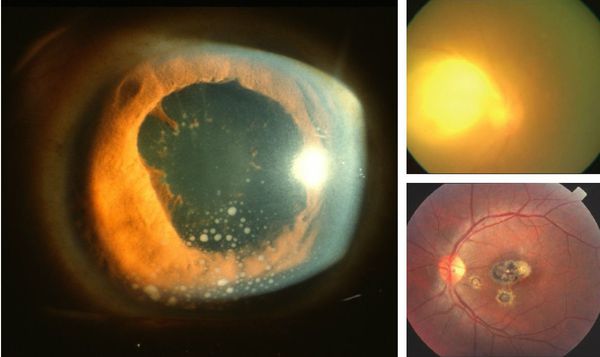
У людей с выраженным иммунодефицитом (ВИЧ, пересадка органов с последующей цитостатической терапией) возможно развитие генерализованного процесса с поражением нескольких органов (головного мозга, сердца, печени, почек, лёгких), нередко очень тяжёлого течения, проявляющегося в виде синдрома полиорганной недостаточности.
Токсоплазмоз у беременных может протекать в различных клинических вариантах и представляет опасность не столько для самой беременной (исключая тяжело протекающие патологии у беременных со СПИДом), сколько для плода.
При первичном заражении беременной токсоплазмозом имеет значение срок гестации:
- При инфицировании в первом триместре передача возбудителя плоду происходит лишь в 4 % случаев (к 13 неделе — в 6 %), но заканчивается, как правило, гибелью плода и выкидышем на ранних сроках. Если первичная инфекция у матери в первом триместре доказано, но выкидыш до 13 недели беременности не произошёл, то крайне высока вероятность, что внутриутробной передачи не было и ребёнок будет здоров.
- При инфицировании во втором триместре (особенно на 24-26 неделях) риск внутриутробной передачи резко возрастает и достигает 30-40 %, причём сопровождается развитием тяжёлых проявлений заболевания — одновременное увеличение селезёнки и печени, воспаление сосудистой оболочки и сетчатки глаза, поражения ЦНС в виде гидроцефалии, кальцификация, сыпь, миокардит, пневмония и другие.
- При заражении матери в третьем триместре передача инфекции ребёнку происходит с частотой до 90 %, однако проявления заболевания являются латентными или субклиническими и могут появиться спустя годы после рождения (отставание в развитии, нарушения зрения). [1][2][4][9]
Патогенез токсоплазмоза
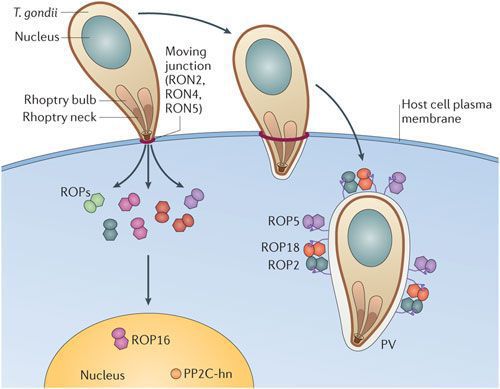
По мере развития и размножения токсоплазм поражённые клетки разрушаются, происходит заражение новых здоровых клеток, и при попадании возбудителя в кровоток паразиты разносятся по всему организму. Образуются некрозы с формированием фиброзной ткани и кальцификацией (отложение солей кальция в организме).
Под воздействием иммунитета безоболочечные трофозоиты превращаются в брадизоиты (оболочечные скопления токсоплазм), т.е. в тканевые цисты, которые сохраняются десятками лет в неактивном состоянии и при значительном снижении иммунитета способны к обратной трансформации с развитием обострения.
При первичной инфекции у беременных возбудитель проникает в ткани плода и вызывает воспалительный процесс, причём в разные периоды развития наблюдается различный характер воспаления: у эмбриона происходит лишь альтерация (дистрофия и некроз ткани без фиброза), в раннем фетальном периоде дополняется повышенным образованием соединительной ткани (фиброзом), а в позднем фетальном периоде присоединяется сосудистый компонент. Отсюда вытекают различные по характеру и тяжести поражения плода, которые зависят от сроков инфицирования матери. [1] [2]
Классификация и стадии развития токсоплазмоза
По течению процесса токсоплазмоз бывает:
- острым — до одного месяца;
- подострым - 1-3 месяц;
- хроническим — более трёх месяцев.
По клиническим признакам выделяют пять форм заболевания:
- Врождённый острый токсоплазмоз:
- манифестная форма (с указанием ведущих проявлений);
- субклиническая форма (с указанием способа верификации диагноза).
- Врождённый хронический токсоплазмоз:
- обострение / ремиссия;
- с резидуальными (остаточными) явлениями / без резидуальных явлений.
- Врождённый латентный токсоплазмоз.
- Приобретённый острый токсоплазмоз.
- Приобретённый хронический токсоплазмоз.
По степени тяжести заболевание бывает:
- лёгким;
- среднетяжёлым;
- тяжёлым (врождённая инфекция, токсоплазмоз при СПИДе).
По наличию осложнений выделяют:
- осложнённый токсоплазмоз;
- неосложнённый токсоплазмоз.
В Международной классификации болезней 10 пересмотра выделены шесть типов заболевания:
- B58.0 Токсоплазмозная окулопатия;
- B58.1 Токсоплазмозный гепатит (K77.0*);
- B58.2 Токсоплазмозный менингоэнцефалит (G05.2*);
- B58.3 Легочный токсоплазмоз (J17.3*);
- B58.8 Токсоплазмоз с поражением других органов;
- B58.9 Токсоплазмоз неуточнённый. [1][2][3]
Осложнения токсоплазмоза
При врождённой форме может возникнуть гидроцефалия, микроцефалия, задержка психомоторного развития и слепота. Эти осложнения сопровождаются увеличением или уменьшением размеров черепа, различными неврологическими расстройствами — косоглазием, судорогами, трудностью с сидением и держанием головы, рвотой и другими.
При глазной форме заболевания развивается слепота, снижение остроты зрения и воспалительные явления всех сред глаза. Причём возможно как рождение с грубыми дефектами зрения, так и появление воспалительных явлений и нарушения зрения спустя много лет после рождения.
Токсоплазмоз у иммунокомпрометированных людей осложняется шизофренией, токсоплазменный энцефалитом и полиорганной недостаточностью — тяжёлой патологией различных органов при выраженном иммунодефиците. При этом свойственна картина тяжёлого энцефалита. Прогноз, как правило, неблагоприятный. [1] [5] [8] [9]
Диагностика токсоплазмоза
Лабораторная диагностика:
- Клинический анализ крови: снижение уровня тромбоцитов, увеличение количества лимфоцитов и эозинофилов.
- Биохимический анализ крови: возможно повышение уровня трансаминаз и билирубина.
- Иммуноферментный анализ (ИФА):
- Выявление специфических антител класса M — острая инфекция или её реактивация. Имеет ряд недостатков — низкая специфичность, длительная циркуляция в организме, иногда до года после острого процесса. В сложных случаях уточнение следует производить при помощи метода "двойной сэндвич" или "иммунозахват" IgM ELISA.
- Выявление специфических антител класса G (клеток памяти) — носительство, инфицированность — появляются в среднем со второй недели заболевания и достигают пика на 1-2 месяце, сохраняются пожизненно, за исключением СПИД-ассоциированных заболеваний.
- Авидность IgG — уточнение давности заболевания. Недостатком является отсутствие стандартизации результатов, что зачастую приводит к различным ошибкам интерпретации. Наибольшее значение имеет высокая авидность, остальные результаты низкой и слабой авидности могут быть ошибочными и не должны трактоваться как недавно перенесённое заболевание при отсутствии других подтверждающих этот факт тестов.
- ПЦР-диагностика: выявление ДНК токсоплазмы в крови, других жидкостях и тканях человеческого организма. Особенно информативна в диагностике генерализованного, глазного и врождённого токсоплазмоза, в т. ч. в антенатальном периоде путём проведения амнио (не ранее 16 недель) и кордоцентеза (с 18 недели беременности).
- УЗИ-диагностика: внутриутробное выявление гидро- и микроцефалии, кальцификатов, гепатоспленомегалии и выраженной задержки развития. [1][2][4][5][6]
Дифференциальная диагностика
Токсоплазмоз — это инфекция с необычайно разнообразными проявлениями, поэтому ввиду неспецифичности проявлений основное место в дифференциальной диагностике отводиться лабораторному обследованию, а именно специфическим серологическим тестам.
Необходимо исключить следующие заболевания:
-
(ВЭБ-инфекцию) — боли в горле, преимущественное увеличение затылочных и заднешейных лимфоузлов, характерные изменения гемограммы (появление большого количества атипичных мононуклеаров и отсутствие столь выраженных изменений при врождённом течении), положительные IgM и ПЦР крови; — лимфоцитарный характер гемограммы, частое поражение слюнных желёз, положительные IgM, ПЦР крови;
- туберкулёз — длительное постепенное начало, лёгкий субфебрилитет (до 38,0 °C), ночная потливость, нездоровый румянец на щеках, кашель, специфические изменения в лёгких, положительные пробы на туберкулёз, выявление бациллы Коха в мокроте;
- лимфопролиферативные заболевания (лимфома Ходжкина, неходжкинские лимфомы) — специфические изменения при биопсии поражённой ткани (лимфоузлов);
- ВИЧ-инфекция — наличие факта возможного заражения, увеличение всех групп лимфоузлов, положительная серология;
- саркоидоз — специфические изменения в лёгких, положительные результаты гистологического исследования. [1][2][5]
Лечение токсоплазмоза
Большинство случаев приобретённого токсоплазмоза протекают в лёгкой или бессимптомной форме, они не регистрируются и, по-видимому, не нуждаются в каком-либо лечении.
Необходимость проведения специфической этиотропной терапии возникает лишь у некоторых групп пациентов:
- беременные с доказанным первичным инфицированием (в ряде случаев при реактивации хронической инфекции);
- дети с врождённой формой токсоплазмоза (при наличии явных клинических и лабораторных проявлений заболевания, субклинических и инаппарантных формах) — сроки и объём терапии зависят от конкретных данных;
- иммунокомпрометированные люди, у которых токсоплазмоз (острый или в фазе реактивации хронического процесса) протекает с выраженными клинико-лабораторными проявлениями. Основное направление воздействия в этом случае должно быть на устранение причины иммунодефицита, повышение уровня СД4 клеток.
Проведение лечения может осуществляться как в стационаре, так и амбулаторно в зависимости от выраженности процесса, реакции пациента на вводимые препараты, необходимости тех или иных вариантов патогенетического и симптоматического обеспечения. [1] [4] [7]
Прогноз. Профилактика
При приобретённом токсоплазмозе у иммунокомпетентных лиц прогноз благоприятный, у иммунокомпрометированных лиц (СПИД) прогноз серьёзен, нередки летальные исходы.
При врождённом токсоплазмозе исход заболевания зависит от сроков инфицирования плода:
- при инфицировании в первом триместре, как правило, происходит выкидыш;
- в более поздние сроки последствия варьируются от тяжёлых до резидуальных форм.
Основным методом профилактики приобретённого и врождённого токсоплазмоза является соблюдение санитарно-гигиенических правил, особенно беременными, не имеющими антител класса G к токсоплазмам:
- ограничение контакта с кошками;
- запрет на употребление сырого мяса, фарша и морепродуктов;
- тщательная промывка зелени, фруктов и овощей;
- мытьё рук перед едой;
- работа на приусадебном участке только в перчатках.
Для беременных особенно важен скрининг антител к токсоплазме, позволяющий выявить активно протекающее заболевание или риск его возникновения, а также вовремя провести медикаментозную профилактику острого токсоплазмоза беременной и снизить риск врождённой инфекции на 60 %. При отсутствии антител класса G в первом триместре необходимо отслеживать антитела IgM и IgG не только в тертьем, но и во втором триместре беременности.
В очаге токсоплазмоза противоэпидемические мероприятия не проводятся, вакцина на разработана. [2] [3]
Читайте также:

