Му по лабораторной диагностике хламидийных инфекций у животных
Обновлено: 24.04.2024
1.1. Лабораторные методы исследования на хламидийные инфекции животных включают:
- выявление специфических антител в сыворотке крови больных животных в РСК (РДСК) или ИФА;
- обнаружение хламидий и их антигенов в патологическом материале методом световой или люминесцентной микроскопии;
- выделение хламидий на куриных эмбрионах, в культуре клеток или лабораторных животных с последующей их идентификацией;
- выявление ДНК хламидий в патологическом материале методом полимеразной цепной реакции (ПЦР).
1.2. В лабораторию для исследования на хламидийные инфекции направляют:
- сыворотку крови в количестве 3-5 куб. см от абортировавших или подозрительных по заболеванию животных, а также во всех случаях, предусмотренных действующей инструкцией. Кровь от абортировавших животных берут дважды: в период клинического проявления болезни и повторно, от них же, через 14-21 день. Сыворотки направляют в лабораторию в количестве 1-2 куб. см. Сыворотки хранят при температуре минус 20°С и исследуют одномоментно. Сыворотки гемолизированные или контаминированные бактериальной и грибковой флорой не пригодны;
- патологический материал (соскобы с конъюнктивы, гениталий, фекалии) берут только одноразовыми или стерильными инструментами в одноразовые пластиковые пробирки с крышками или в стерильные пробирки (флаконы) с резиновыми пробками с физраствором в количестве 1 куб. см и доставляют в лабораторию в емкости со льдом в течение 24 часов. Хранить материал можно не более 7 суток при 4°С и 10-12 мес. при температуре минус 20°С;
- пробы эякулята или замороженной спермы, полученные от производителей, подозрительных по заболеванию. Пробы эякулята направляют для исследования в количестве 1 куб. см; замороженную сперму в количестве не менее 2 гранул доставляют в лабораторию в контейнере с жидким азотом или в пробирке с сухим льдом;
- патологический материал от павших или убитых больных животных (кусочки паренхиматозных органов, лимфатических узлов и семенников), от абортировавших животных (кусочки плаценты);
- абортированные плоды целиком или паренхиматозные органы и сычуг плода.
Патологический материал отбирают в стерильные, герметически закрывающиеся флаконы не позднее двух часов после гибели, убоя животного или аборта.
Флаконы с патматериалом помещают в термос со льдом, а абортированные плоды во влагонепроницаемую тару и в тот же день, но не позже 24 часов, доставляют в лабораторию с соблюдением мер, исключающих распространение возбудителя инфекции.
2. Серологические исследования
2.1. Серологические исследования на хламидийные инфекции основаны на выявлении специфических антител в сыворотке крови животных в реакции связывания комплемента (РСК), реакции длительного связывания комплемента (РДСК) и методом иммуноферментного анализа (ИФА); у абортировавших животных - на установлении нарастания титра антител в 4 и более раз.
Животных, вакцинированных против хламидийного аборта, серологически не исследуют в течение 1 года после вакцинации.
2.2. В РСК, РДСК используют следующие компоненты:
- комплементсвязывающий группоспецифический хламидийный антиген;
- позитивную (иммунную) сыворотку крови овец, содержащую группо-специфические хламидийные антитела;
- негативную (отрицательную) сыворотку крови овец;
- комплемент (свежая, консервированная или лиофильно высушенная сыворотка крови морской свинки);
- гемолизин (сыворотка крови кролика, иммунизированного эритроцитами барана);
- физиологический раствор, рН 7,0-7,2.
Специфический и контрольный антигены, позитивную и негативную сыворотки изготавливают биофабрики, выпускающие их в специальных наборах.
Антиген разводят в дистиллированной воде и применяют в РСК, РДСК в рабочих титрах, указанных на этикетке.
2.3. Гемолизин в РСК и РДСК используют в удвоенном титре (например, при титре гемолизина 1:1000 его берут 2:1000).
2.4. Эритроциты барана отмывают физиологическим раствором путем центрифугирования при 2500-3000 об/мин. в течение 10-15 мин. до полной прозрачности над осад очной жидкости.
Для РСК применяют 2,5%-ную, для РДСК - 3%-ную взвесь эритроцитов из осадка.
Перед работой взвесь эритроцитов и гемолитическую сыворотку в рабочем разведении смешивают в равных объемах, полученную гемолитическую систему ставят в термостат при 37°С на 20-30 мин. для сенсибилизации. Во время работы гемолитическую систему хранят при комнатной температуре или в холодильнике при 2-4°С.
2.5. Для серологического исследования пригодны лишь свежие испытуемые сыворотки. Допускаются к исследованию и однократно замороженные, а также сыворотки, консервированные борной кислотой (2% к объему) или мертиолятом (1:10000).
Мутные, проросшие или гемолизированные сыворотки для исследования непригодны.
2.6. Физиологический раствор для разведения компонентов (0,85% раствор химически чистого хлорида натрия в дистиллированной воде, рН 7,2-7,4) готовят и кипятят в течение 5 минут за день или в день постановки реакции.
2.7. Постановка реакции связывания комплемента (РСК).
2.7.1. Реакцию ставят в объеме 1 куб. см (по 0,2 куб. см каждого компонента). Комплемент титруют каждый раз перед постановкой главного опыта на позитивной и 1-2 испытуемых сыворотках.
2.7.2. Титрование комплемента. Сухой биофабричный комплемент растворяют физиологическим раствором до первоначального объема, указанного на этикетке, и готовят основное разведение 1:20.
Затем во все пробирки разливают гемолитическую систему по 0,4 куб. см, встряхивают и ставят в водяную баню на 20 мин при 37-38°С (схему титрования комплемента см. в таблице 1).
Титром (единицей) комплемента считают наименьшую дозу его, которая дает полный гемолиз эритроцитов с испытуемыми сыворотками в пробирках первого и второго рядов и позитивной сывороткой - в пробирках второго ряда (без антигена).
В примере, приведенном в таблице 2, титр комплемента, разведенного 1:20, равен 0,1 куб. см, что и будет является его рабочей дозой.
Примечание : если в первом ряду пробирок с сыворотками из опыта получена ясно выраженная задержка гемолиза эритроцитов более, чем на два интервала по сравнению с безантигенным рядом, это значит, что испытуемые сыворотки содержат специфические к данному антигену антитела и, в таком случае, рабочую дозу комплемента определяют по безантигенным рядам позитивной и испытуемых сывороток.
Расчет количества чистого комплемента необходимого для постановки главного опыта, делают по формуле:
где А - рабочая доза комплемента;
В - количество пробирок, занятых в реакции;
С - основное разведение комплемента.
Пример : (0,1 х 100):20 = 0,5.
Количество разведенного комплемента, требуемое для всей реакции (в данном примере 100 пробирок), равно 20 куб. см (0,2 х 100), поэтому к 0,5 куб. см чистого комплемента следует добавить 19,5 куб. см физиологического раствора.
2.7.3. Главный опыт РСК. Испытуемые сыворотки исследуют в разведении 1:5 и 1:10 (доза сыворотки 0,04 куб. см и 0,02 куб. см со специфическим антигеном, в разведении 1:5 с контрольным антигеном (на специфичность) и без антигена (на антикомплементарность).
Испытуемые и контрольные сыворотки инактивируют в день постановки реакции в разведенном виде при 56-65 °С (в зависимости от вида животных) в течение 30 мин. (также в РДСК).
Оба этапа реакции проводят в водяной бане при 37-38°С, бактериолитическую систему выдерживают 60 мин, второй этап реакции (с гемолитической системой) - 20 мин.
Контроли главного опыта РСК:
- позитивная сыворотка в разведении 1:5 без антигена и с контрольным антигеном; в разведениях от 1:5 до ее титра со специфическим антигеном;
- негативная сыворотка в разведениях 1:5 и 1:10 со специфическим антигеном, в разведении 1:5 с контрольным антигеном и без антигена - антигены специфический и контрольный в двойной дозе - на антикомплементарность (комплемент +) и на гемотоксичность (комплемент -);
- гемолитическая система на гемотоксичность (комплемент -).
Схема постановки главного опыта представлена в таблице 3.
2.8. Постановка реакции длительного связывания комплемента (РДСК).
2.8.1. Первую фазу реакции проводят в холодильнике при 2-6°С в течение 16-18 час., вторую фазу в водяной бане 20 мин при 37-38°С.
Комплемент применяют в рабочем разведении 1:25 или 1:30 (при определении его рабочего разведения). Если рабочий титр комплемента неизвестен или вызывает сомнение, перед титрованием гемолитической системы для РДСК определяют его рабочее разведение по схеме, представленной в таблице 4.
2.8.2. Титрование гемолитической системы. Дозу гемолитической системы для главного опыта РДСК определяют путем титрования ее на 3-4 сыворотках: позитивной и 1-2 испытуемых из партии, поступившей на исследование.
Инактивированные сыворотки (позитивную и испытуемые) в разведении 1:5 разливают каждую в два ряда пробирок штатива Флоринского по 0,2 куб. см.
Затем в первые ряды пробирок каждой сыворотки вносят по 0,2 куб. см антигена в рабочем разведении, а во вторые ряды - 0,2 куб. см физиологического раствора; во все пробирки разливают по 0,2 куб. см комплемента в зависимости от его рабочего разведения, встряхивают и помещают в холодильник на 16-18 час. при температуре 2-6°С.
На следующий день штативы вынимают из холодильника и выдерживают в течение 20-30 мин. при комнатной температуре.
Затем в первые пробирки с позитивной и испытуемыми сыворотками разливают гемолитическую систему (приготовленную согласно пунктам 2.3 и 2.4) по 0,1 куб. см, во вторые пробирки - по 0,2 куб. см, в третьи - по 0,3 куб. см и т.д. до 1 куб. см.
Пробирки встряхивают, ставят в водяную баню на 20 мин. при 37-38°С, после чего определяют титр гемолитической системы.
Схема титрования гемолитической системы представлена в таблице 5.
Титром гемолитической системы считают наибольшее ее количество, в котором получен полный гемолиз эритроцитов в обоих рядах пробирок с негативной и испытуемой сыворотками и в безантигенном ряду с позитивной сывороткой, при полной задержке гемолиза в ряду с позитивной сывороткой и антигеном. В приведенном примере (таблица 5) титр гемолитической системы равен 0,6 куб. см.
2.8.3. Главный опыт РДСК. В первый день одновременно с разливом сывороток для титрования гемолитической системы, разливают сыворотки и антиген для главного опыта, как указано в пункте 2.7.3.
Затем во все пробирки главного опыта и соответствующих контролей разливают комплемент по 0,2 куб. см в зависимости от его рабочего разведения, пробирки встряхивают и помещают в холодильник на 16-18 час. при 2-6°С.
На следующий день штативы с первой фазой вынимают из холодильника и после выдерживания в течение 20-30 мин. при комнатной температуре во все пробирки разливают гемолитическую систему в дозе, полученной при титровании (в приведенном примере - 0,6 куб. см). Штативы встряхивают и помещают в водяную баню на 20 мин. при 37-38°С.
Схема главного опыта РДСК представлена в таблице 6.
2.9. При массовых постановках РДСК испытуемые сыворотки исследуют только со специфическим антигеном в разведении сыворотки 1:5 (0,05 куб. см сыворотки + 0,2 куб. см физиологического раствора), с последующей перестановкой сомнительно и положительно реагирующих проб, как указано в п. 2.7 и 2.8.
- при работе с аппаратом Флоринского для разведения сыворотки 1:5 к 0,05 куб. см сыворотки добавлять 0,2 куб. см физраствора;
- перед разливом компонентов в РСК и РДСК - смешивание равных объемов антигена и комплемента в рабочих разведениях.
2.10. Учет результатов РСК, РДСК проводят дважды: первый раз - сразу после водяной бани, второй - после оседания эритроцитов на дно пробирки (через 3-4 часа после водяной бани) или на следующий день при хранении в холодильнике от 2° до 6°С.
Для объективного определения результатов реакции оценку рекомендуется проводить в процентах гемолиза. Для этого из реакции выбирают 5 пробирок с полным (100%) гемолизом и жидкость из них сливают в одну пробирку. Из нее готовят разведения с меньшим процентом гемолиза по следующей схеме:
1.1. Смешанная кишечная инфекция - остропротекающая инфекционная болезнь молодняка разных видов сельскохозяйственных животных, которая имеет полиэтиологическую природу и вызывается двумя-тремя и более видами патогенных энтеробактерий, относящимся к родам Escherichia, Citrobacter, Proteus, Morganella, Klebsiella, Salmonella. Помимо указанных микроорганизмов возбудителями болезни могут быть также бактерии других родов и семейств - Yersinia, Pseudomonas, Staphylococcus, Streptococcus, Clostridium и пр. Наряду с бактериальными агентами нередко (особенно на крупных фермах) болезнь обусловливают корона- и ротавирусы.
1.2. Болезнь возникает в первые дни и недели жизни животных и проявляется чаще в виде энзоотической вспышки, развитию которой способствуют различные факторы, связанные с несоблюдением технологических и ветеринарно-санитарных требований воспроизводства стада, а также нарушением режимов содержания и кормления молодняка.
1.3. Смешанная кишечная инфекция может протекать в кишечной (энтеритной) и септической формах. При кишечной форме возбудители болезни локализуются только в желудочно-кишечном тракте и брыжеечных лимфоузлах, регионарных поражённым участкам кишечника; при септической форме - в паренхиматозных органах, различных тканях, а также в кишечнике и брыжеечных лимфоузлах. Основными клиническими признаками болезни являются: потеря аппетита, понос, переходящий в профузный, нарастающая слабость, депрессия, учащенное дыхание и сердцебиение, обезвоживание организма (при затяжном течении); нередко наблюдается поражение центральной нервной системы (возбуждение, судороги), иногда пневмония, артриты; температура тела в пределах нормы, в отдельных случаях повышена на 0,5 - 1 °С, в предагональном состоянии она снижается ниже нормы.
1.4. Патологоанатомические изменения у погибших животных имеют картину катарального или катарально-геморрагического гастроэнтерита, на слизистой желудка, тонкого отдела кишечника и слепой кишки могут встречаться язвы, нередко отмечаются множественные точечные, полосчатые и пятнистые кровоизлияния на слизистой желудка, толстого и тонкого отделов кишечника, под капсулой селезенки, эпи- и эндокарде (клапанах); иногда отмечается очаговая катаральная пневмония и отек легких, дистрофия печени; регионарные брыжеечные лимфатические узлы как правило увеличены, отечны, на разрезе розового или красно-вишневого цвета; при вскрытии черепной коробки - гиперемия кровеносных сосудов и отек ткани головного мозга. Указанные изменения могут быть в отдельных или одновременно в нескольких органах.
1.5. Диагноз на смешанную кишечную инфекцию в хозяйствах устанавливают на основании совокупности эпизоотологических данных (возраст заболевших животных, массовость поражения, стационарность и др.), клинических признаков болезни, патологоанатомической картины и результатов бактериологического (при необходимости еще и вирусологического) исследования патологического материала от больных или погибших животных.
2.1. Для посмертной бактериологической диагностики в лабораторию направляют 2 - 4 свежих трупа погибших или убитых с диагностической целью больных животных (желательно не подвергавшихся лечению антибактериальными препаратами). В случае невозможности доставки целого трупа посылают следующий патологический материал: голову, трубчатую кость, сердце, перевязанное лигатурой вблизи разреза сосудов и аорты, селезенку, долю печени с желчным пузырем, брыжеечные лимфатические узлы, регионарные воспаленному участку кишечника, а также пораженный отрезок тонкого отдела кишечника, перевязанный с двух концов лигатурой (в отдельной таре или полиэтиленовом пакете). Указанный патологический материал исследуют в день поступления его в лабораторию.
2.2. Для прижизненной бактериологической диагностики в лабораторию направляют фекалии больных диареей животных, не подвергавшихся лечению антибактериальными препаратами. Пробы фекалий берут от 5 - 6 больных животных одной фермы в стерильные пробирки по 2 - 3 г непосредственно из прямой кишки с помощью прокипяченного резинового катетера. Пробирки вместе с сопроводительной запиской упаковывают в полиэтиленовый пакет или картонную коробку.
При невозможности быстрой доставки проб фекалий в лабораторию (через 3 - 4 часа после взятия) их консервируют стерильным 30 %-ным глицериновым раствором в соотношении 1:2 (см. приложение).
2.3. Пробы фекалий и содержимого тонкого отдела кишечника (в количестве не более 0,5 г) разводят в 10 см 3 стерильного 0,85 %-ного раствора хлорида натрия, тщательно размешивают и затем выдерживают 10 - 15 минут при комнатной температуре для осаждения крупных частиц. Надосадочную жидкость используют для посева на питательные среды не позднее 1 - 2 часов после приготовления взвесей. При исследовании консервированных фекалий, их тщательно размешивают, после чего разводят физиологическим раствором в 5 - 10 раз.
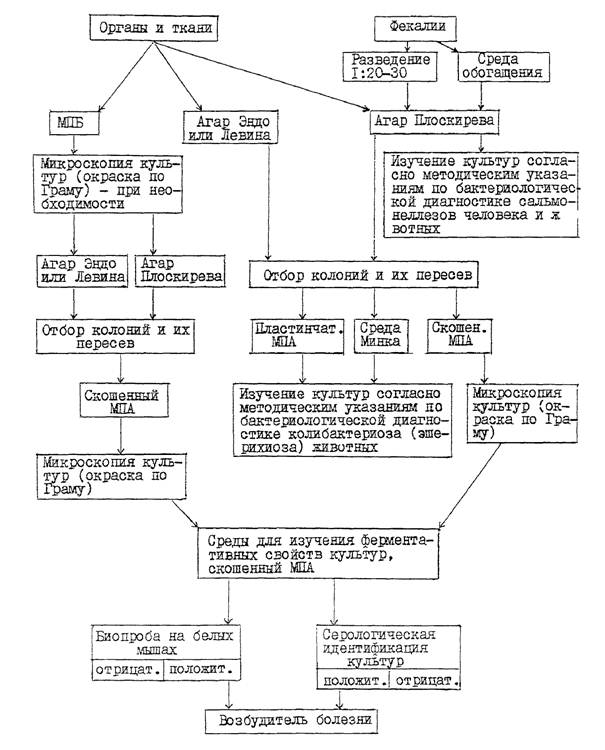
3.1. Патологический материал (за исключением содержимого тонкого отдела кишечника и фекалий) засевают в пробирки с МПБ и на плотные дифференциально-диагностические среды в чашках: Эндо (или Левина) и среду Плоскирева (или висмут-сульфит агар). Содержимое тонкого отдела кишечника и фекалий засевают только на указанные выше плотные среды в чашках. Кроме того для выделения из фекалий сальмонелл неразведенные пробы фекалий засевают еще в одну из сред обогащения (селенитовый бульон, магниевую, Мюллера или др.) в соотношении 1:5.
3.1.1. Посев материала в МПБ проводят пастеровской пипеткой. Посевы на плотные среды в чашках из внутренних органов и тканей, указанных в п. 2.3, делают путем отпечатков разрезанной поверхностью кусочка органа из предварительно профламбированного участка на подсушенную питательную среду или вносят материал пастеровской пипеткой на поверхность среды, а затем равномерно растирают его стеклянным шпателем.
3.1.2. Содержимое тонкого отдела кишечника, взятое путем соскоба с пораженного участка слизистой оболочки, суспендируют в 10 см 3 стерильного 0,85 %-ного раствора хлорида натрия, затем засевают суспензию бактериологической петлей на подсушенные в термостате плотные дифференциально-диагностические среды в чашках широким частым штрихом по всей поверхности среды. Аналогичным образом проводят посев разведенных фекалий.
3.2. Пробирки с посевами в МПБ из внутренних органов и тканей инкубируют при температуре 37 - 38 °С в течение 18 - 24 часов. При наличии в МПБ помутнения среды культуру микроскопируют и в случае обнаружения мелких грамотрицательных палочек пересевают ее на агар Эндо (или Левина) и среду Плоскирева (или висмут-сульфит агар) в чашках, которые помещают в термостат (37 - 38 °С ) на 18 - 24 часа.
Пересев культур, полученных в МПБ, на плотные селективные среды проводят в том случае, если отсутствует рост колоний на этих средах в первичных посевах из соответствующих органов и тканей.
При наличии на агаре Эндо (или Левина) роящегося налета, характерного для протея, пересевают его на скошенный МПА (культуры из двух-трех внутренних органов, тканей или фекалий). Чашки и пробирки с посевами инкубируют 18 - 20 часов при той же температуре.
3.4. Чашки с первичными посевами на агаре Плоскирева инкубируют при температуре 37 - 38 °С в течение 24 - 36 часов. После просмотра культур пересевают мелкие круглые колонии S-формы полупрозрачные, сероватого цвета с голубым оттенком в пробирки со скошенным МПА (по 1 - 2 колонии с культур из двух-трех внутренних органов, тканей или фекалий, каждую колонию в отдельную пробирку), которые помещают в термостат на 18 - 24 часа.
В том случае, если пересев проводят на комбинированную среду (Олькеницкого, Клиглера), то каждую колонию пересевают в одну пробирку с этой средой и в одну пробирку со скошенным МПА.
3.5. Суточные культуры бактерий на скошенном МПА или комбинированной среде, выделенные из внутренних органов, тканей или фекалий, микроскопируют (окраска по Граму) и при наличии в мазках однородных мелких грамотрицательных палочек, не образующих спор и капсул (бактерии вида Klebsiella pneumoniae образуют капсулу), используют для изучения ферментативных, патогенных, антигенных свойств, а также (при необходимости) определения подвижности в полужидком МПА. Для выявления у культур клебсиелл капсулы окраску мазков проводят по методу Гинса (тушью).
3.6. Ферментативные свойства изучают у 2 - 6 агаровых (в порядке исключения у бульонных) культур бактерий, выделенных из одного патологического материала, на наборе сред с углеводами и индикатором Андреде или полужидких средах с индикатором ВР, куда входят среды с глюкозой, лактозой, сахарозой, маннитом, мальтозой, а также на средах с мочевиной, сернокислым железом (определение сероводорода), агаре Симонса, в бульоне Хоттингера или МПБ (определение индола), мясопептонной желатине, среде с фенилаланином.
При использовании комбинированной среды Олькеницкого или Клиглера учитывают изменения, вызываемые представителями разных родов энтеробактерий в этой среде, после чего данную культуру изучают по другим необходимым биохимическим тестам.
Засеянные пробирки инкубируют при температуре 37 - 38 °С.
Предварительные результаты изучения ферментативных свойств культур учитывают через 24 часа, окончательные результаты - через 48 часов. Изучение ферментативных свойств культур энтеробактерий можно проводить также с помощью тест-системы для биохимической идентификации энтеробактерий. Родовую и видовую принадлежность культур устанавливают по показателям таблицы.
Следует учитывать, что у бактерий рода Proteus встречаются нероящиеся штаммы, образующие при росте на плотных питательных средах мелкие круглые колонии S-формы сероватого цвета. Важными признаками родовой идентификации таких штаммов является их способность дезаминировать фенилаланин и разжижать желатин.
При наличии у культур отклонений от основных показателей таблицы используют дополнительные тесты: реакции с метилротом и Фогес-Проскауэра, наличия образования оксидазы, определение подвижности и др.
СХЕМА
БАКТЕРИОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ ПАТОЛОГИЧЕСКОГО
МАТЕРИАЛА НА СМЕШАННУЮ КИШЕЧНУЮ ИНФЕКЦИЮ
Дифференциальные признаки энтеробактерий по ферментативным свойствам
1.1. Лабораторные методы исследования на хламидийные инфекции животных включают:
- выявление специфических антител в сыворотке крови больных животных в РСК (РДСК) или ИФА;
- обнаружение хламидий и их антигенов в патологическом материале методом световой или люминесцентной микроскопии;
- выделение хламидий на куриных эмбрионах, в культуре клеток или лабораторных животных с последующей их идентификацией;
- выявление ДНК хламидий в патологическом материале методом полимеразной цепной реакции (ПЦР).
1.2. В лабораторию для исследования на хламидийные инфекции направляют:
- сыворотку крови в количестве 3-5 куб. см от абортировавших или подозрительных по заболеванию животных, а также во всех случаях, предусмотренных действующей инструкцией. Кровь от абортировавших животных берут дважды: в период клинического проявления болезни и повторно, от них же, через 14-21 день. Сыворотки направляют в лабораторию в количестве 1-2 куб. см. Сыворотки хранят при температуре минус 20°С и исследуют одномоментно. Сыворотки гемолизированные или контаминированные бактериальной и грибковой флорой не пригодны;
- патологический материал (соскобы с конъюнктивы, гениталий, фекалии) берут только одноразовыми или стерильными инструментами в одноразовые пластиковые пробирки с крышками или в стерильные пробирки (флаконы) с резиновыми пробками с физраствором в количестве 1 куб. см и доставляют в лабораторию в емкости со льдом в течение 24 часов. Хранить материал можно не более 7 суток при 4°С и 10-12 мес. при температуре минус 20°С;
- пробы эякулята или замороженной спермы, полученные от производителей, подозрительных по заболеванию. Пробы эякулята направляют для исследования в количестве 1 куб. см; замороженную сперму в количестве не менее 2 гранул доставляют в лабораторию в контейнере с жидким азотом или в пробирке с сухим льдом;
- патологический материал от павших или убитых больных животных (кусочки паренхиматозных органов, лимфатических узлов и семенников), от абортировавших животных (кусочки плаценты);
- абортированные плоды целиком или паренхиматозные органы и сычуг плода.
Патологический материал отбирают в стерильные, герметически закрывающиеся флаконы не позднее двух часов после гибели, убоя животного или аборта.
Флаконы с патматериалом помещают в термос со льдом, а абортированные плоды во влагонепроницаемую тару и в тот же день, но не позже 24 часов, доставляют в лабораторию с соблюдением мер, исключающих распространение возбудителя инфекции.
2. Серологические исследования
2.1. Серологические исследования на хламидийные инфекции основаны на выявлении специфических антител в сыворотке крови животных в реакции связывания комплемента (РСК), реакции длительного связывания комплемента (РДСК) и методом иммуноферментного анализа (ИФА); у абортировавших животных - на установлении нарастания титра антител в 4 и более раз.
Животных, вакцинированных против хламидийного аборта, серологически не исследуют в течение 1 года после вакцинации.
2.2. В РСК, РДСК используют следующие компоненты:
- комплементсвязывающий группоспецифический хламидийный антиген;
- позитивную (иммунную) сыворотку крови овец, содержащую группо-специфические хламидийные антитела;
- негативную (отрицательную) сыворотку крови овец;
- комплемент (свежая, консервированная или лиофильно высушенная сыворотка крови морской свинки);
- гемолизин (сыворотка крови кролика, иммунизированного эритроцитами барана);
- физиологический раствор, рН 7,0-7,2.
Специфический и контрольный антигены, позитивную и негативную сыворотки изготавливают биофабрики, выпускающие их в специальных наборах.
Антиген разводят в дистиллированной воде и применяют в РСК, РДСК в рабочих титрах, указанных на этикетке.
2.3. Гемолизин в РСК и РДСК используют в удвоенном титре (например, при титре гемолизина 1:1000 его берут 2:1000).
2.4. Эритроциты барана отмывают физиологическим раствором путем центрифугирования при 2500-3000 об/мин. в течение 10-15 мин. до полной прозрачности над осад очной жидкости.
Для РСК применяют 2,5%-ную, для РДСК - 3%-ную взвесь эритроцитов из осадка.
Перед работой взвесь эритроцитов и гемолитическую сыворотку в рабочем разведении смешивают в равных объемах, полученную гемолитическую систему ставят в термостат при 37°С на 20-30 мин. для сенсибилизации. Во время работы гемолитическую систему хранят при комнатной температуре или в холодильнике при 2-4°С.
2.5. Для серологического исследования пригодны лишь свежие испытуемые сыворотки. Допускаются к исследованию и однократно замороженные, а также сыворотки, консервированные борной кислотой (2% к объему) или мертиолятом (1:10000).
Мутные, проросшие или гемолизированные сыворотки для исследования непригодны.
2.6. Физиологический раствор для разведения компонентов (0,85% раствор химически чистого хлорида натрия в дистиллированной воде, рН 7,2-7,4) готовят и кипятят в течение 5 минут за день или в день постановки реакции.
2.7. Постановка реакции связывания комплемента (РСК).
2.7.1. Реакцию ставят в объеме 1 куб. см (по 0,2 куб. см каждого компонента). Комплемент титруют каждый раз перед постановкой главного опыта на позитивной и 1-2 испытуемых сыворотках.
2.7.2. Титрование комплемента. Сухой биофабричный комплемент растворяют физиологическим раствором до первоначального объема, указанного на этикетке, и готовят основное разведение 1:20.
Затем во все пробирки разливают гемолитическую систему по 0,4 куб. см, встряхивают и ставят в водяную баню на 20 мин при 37-38°С (схему титрования комплемента см. в таблице 1).
Титром (единицей) комплемента считают наименьшую дозу его, которая дает полный гемолиз эритроцитов с испытуемыми сыворотками в пробирках первого и второго рядов и позитивной сывороткой - в пробирках второго ряда (без антигена).
В примере, приведенном в таблице 2, титр комплемента, разведенного 1:20, равен 0,1 куб. см, что и будет является его рабочей дозой.
Примечание : если в первом ряду пробирок с сыворотками из опыта получена ясно выраженная задержка гемолиза эритроцитов более, чем на два интервала по сравнению с безантигенным рядом, это значит, что испытуемые сыворотки содержат специфические к данному антигену антитела и, в таком случае, рабочую дозу комплемента определяют по безантигенным рядам позитивной и испытуемых сывороток.
Расчет количества чистого комплемента необходимого для постановки главного опыта, делают по формуле:
где А - рабочая доза комплемента;
В - количество пробирок, занятых в реакции;
С - основное разведение комплемента.
Пример : (0,1 х 100):20 = 0,5.
Количество разведенного комплемента, требуемое для всей реакции (в данном примере 100 пробирок), равно 20 куб. см (0,2 х 100), поэтому к 0,5 куб. см чистого комплемента следует добавить 19,5 куб. см физиологического раствора.
2.7.3. Главный опыт РСК. Испытуемые сыворотки исследуют в разведении 1:5 и 1:10 (доза сыворотки 0,04 куб. см и 0,02 куб. см со специфическим антигеном, в разведении 1:5 с контрольным антигеном (на специфичность) и без антигена (на антикомплементарность).
Испытуемые и контрольные сыворотки инактивируют в день постановки реакции в разведенном виде при 56-65 °С (в зависимости от вида животных) в течение 30 мин. (также в РДСК).
Оба этапа реакции проводят в водяной бане при 37-38°С, бактериолитическую систему выдерживают 60 мин, второй этап реакции (с гемолитической системой) - 20 мин.
Контроли главного опыта РСК:
- позитивная сыворотка в разведении 1:5 без антигена и с контрольным антигеном; в разведениях от 1:5 до ее титра со специфическим антигеном;
- негативная сыворотка в разведениях 1:5 и 1:10 со специфическим антигеном, в разведении 1:5 с контрольным антигеном и без антигена - антигены специфический и контрольный в двойной дозе - на антикомплементарность (комплемент +) и на гемотоксичность (комплемент -);
- гемолитическая система на гемотоксичность (комплемент -).
Схема постановки главного опыта представлена в таблице 3.
2.8. Постановка реакции длительного связывания комплемента (РДСК).
2.8.1. Первую фазу реакции проводят в холодильнике при 2-6°С в течение 16-18 час., вторую фазу в водяной бане 20 мин при 37-38°С.
Комплемент применяют в рабочем разведении 1:25 или 1:30 (при определении его рабочего разведения). Если рабочий титр комплемента неизвестен или вызывает сомнение, перед титрованием гемолитической системы для РДСК определяют его рабочее разведение по схеме, представленной в таблице 4.
2.8.2. Титрование гемолитической системы. Дозу гемолитической системы для главного опыта РДСК определяют путем титрования ее на 3-4 сыворотках: позитивной и 1-2 испытуемых из партии, поступившей на исследование.
Инактивированные сыворотки (позитивную и испытуемые) в разведении 1:5 разливают каждую в два ряда пробирок штатива Флоринского по 0,2 куб. см.
Затем в первые ряды пробирок каждой сыворотки вносят по 0,2 куб. см антигена в рабочем разведении, а во вторые ряды - 0,2 куб. см физиологического раствора; во все пробирки разливают по 0,2 куб. см комплемента в зависимости от его рабочего разведения, встряхивают и помещают в холодильник на 16-18 час. при температуре 2-6°С.
На следующий день штативы вынимают из холодильника и выдерживают в течение 20-30 мин. при комнатной температуре.
Затем в первые пробирки с позитивной и испытуемыми сыворотками разливают гемолитическую систему (приготовленную согласно пунктам 2.3 и 2.4) по 0,1 куб. см, во вторые пробирки - по 0,2 куб. см, в третьи - по 0,3 куб. см и т.д. до 1 куб. см.
Пробирки встряхивают, ставят в водяную баню на 20 мин. при 37-38°С, после чего определяют титр гемолитической системы.
Схема титрования гемолитической системы представлена в таблице 5.
Титром гемолитической системы считают наибольшее ее количество, в котором получен полный гемолиз эритроцитов в обоих рядах пробирок с негативной и испытуемой сыворотками и в безантигенном ряду с позитивной сывороткой, при полной задержке гемолиза в ряду с позитивной сывороткой и антигеном. В приведенном примере (таблица 5) титр гемолитической системы равен 0,6 куб. см.
2.8.3. Главный опыт РДСК. В первый день одновременно с разливом сывороток для титрования гемолитической системы, разливают сыворотки и антиген для главного опыта, как указано в пункте 2.7.3.
Затем во все пробирки главного опыта и соответствующих контролей разливают комплемент по 0,2 куб. см в зависимости от его рабочего разведения, пробирки встряхивают и помещают в холодильник на 16-18 час. при 2-6°С.
На следующий день штативы с первой фазой вынимают из холодильника и после выдерживания в течение 20-30 мин. при комнатной температуре во все пробирки разливают гемолитическую систему в дозе, полученной при титровании (в приведенном примере - 0,6 куб. см). Штативы встряхивают и помещают в водяную баню на 20 мин. при 37-38°С.
Схема главного опыта РДСК представлена в таблице 6.
2.9. При массовых постановках РДСК испытуемые сыворотки исследуют только со специфическим антигеном в разведении сыворотки 1:5 (0,05 куб. см сыворотки + 0,2 куб. см физиологического раствора), с последующей перестановкой сомнительно и положительно реагирующих проб, как указано в п. 2.7 и 2.8.
- при работе с аппаратом Флоринского для разведения сыворотки 1:5 к 0,05 куб. см сыворотки добавлять 0,2 куб. см физраствора;
- перед разливом компонентов в РСК и РДСК - смешивание равных объемов антигена и комплемента в рабочих разведениях.
2.10. Учет результатов РСК, РДСК проводят дважды: первый раз - сразу после водяной бани, второй - после оседания эритроцитов на дно пробирки (через 3-4 часа после водяной бани) или на следующий день при хранении в холодильнике от 2° до 6°С.
Для объективного определения результатов реакции оценку рекомендуется проводить в процентах гемолиза. Для этого из реакции выбирают 5 пробирок с полным (100%) гемолизом и жидкость из них сливают в одну пробирку. Из нее готовят разведения с меньшим процентом гемолиза по следующей схеме:
Постановка окончательного диагноза на инфекционные болезни невозможна без обнаружения ее возбудителя.
Лабораторная диагностика хламидиоза
- сыворотку крови в количестве 3-5 см3 от абортировавших или подозрительных по заболеванию животных, а также во всех случаях, предусмотренных действующей инструкцией. Кровь от абортировавших животных берут дважды: в период клинического проявления болезни и повторно, от них же, через 14-21 день. Сыворотки направляют в лабораторию в количестве 1-2 см3;
- патологический материал (соскобы с конъюнктивы, гениталий, фекалии берут только одноразовыми или стерильными инструментами в одноразовые пластиковые пробирки с крышками или в стерильные пробирки (флаконы) с резиновыми пробками с физраствором в количестве 1 см3 и доставляют в лабораторию в емкости со льдом в течение 24 часов. Хранить материал можно не более 7 суток при 4 оС и 10-12 мес при температуре минус 20 оС;
- пробы эякулята или замороженной спермы, полученные от производителей, подозрительных по заболеванию. Пробы эякулята направляют для исследования в количестве 1 см3; замороженную сперму в количестве не менее 2 гранул доставляют в лабораторию в контейнере с жидким азотом или в пробирке с сухим льдом;
- патологический материал от павших или убитых больных животных (кусочки паренхиматозных органов, лимфатических узлов и семенников), от абортировавших животных (кусочки плаценты);
- абортированные плоды целиком или паренхиматозные органы и сычуг плода.
Патологический материал отбирают в стерильные, герметически закрывающиеся флаконы не позднее двух часов после гибели, убоя животного или аборта.
Флаконы с патматериалом помещают в термос со льдом, а абортированные плоды во влагонепроницаемую тару и в тот же день, но не позже 24 часов, доставляют в лабораторию с соблюдением мер, исключающих распространение возбудителя инфекции.
Данные о существующих методах диагностики хламидиозов, используемом материале и продолжительности исследования приведены в таблице.
Методы лабораторной диагностики хламидиозов
Диагноз на хламидийные инфекции считают предварительным при выявлении специфических антител в сыворотке крови в РСК (РДСК) или ИФА. Диагноз на хламидийные инфекции считают окончательным при применении любого прямого метода диагностики, который выявляет хламидии, антигены хламидий или ДНК хламидий в исследуемом материале.
Не рекомендуем применять световую микроскопия хламидиоза в связи с высоким процентом ложноположительных результатов, причиной которых является наличие другой микрофлоры. Эта методика обладает недостаточной специфичностью, особенно в случаях малой распространенности возбудителя в слизистых.
- быстрота – вся диагностическая процедура с использованием моноклональных антител в среднем от момента забора материала до постановки диагноза занимает не более 40 мин.;
- возможность интерпретации результатов на основе регистрации элементарных и ретикулярных телец, расположенных внутри- и внеклеточно при сохранении высокой степени чувствительности и специфичности;
- относительная проста техники проведения анализа.
Однако этот метод дает в ряде случаев ложноотрицательные результаты, связанные с неправильной техникой забора образцов для исследования и с диагностикой хронических и вялотекущих форм хламидиоза, когда возбудитель, прячась от антител и антибиотиков уходит в подслизистый слой, где вокруг него начинает формироваться воспалительный вал из нейтрофилов и возбудитель оказывается внутри инкапсулированного пространства.
Ложноположительные результаты возможны при наличии в образце нежизнеспособных возбудителей или их антигенных структур, а также других бактерий, имеющих перекрестно-реагирующие антигены с антигенами хламидий. Следующей причиной, которая может привести к ошибке, является наличие острого воспалительного процесса на слизистой, когда за счет большого количества лейкоцитов и белка ИФА дает ложноположительные результаты.
Сегодня одним из наиболее перспективных подходов к прямой диагностике инфекций считают специфическую амплификацию нуклеиновых кислот in vitro и, в частности, наиболее разработанный вариант такой амплификации – метод полимеразной цепной реакции (ПЦР), позволяющий в пробирке всего за несколько часов произвести изолированное умножение (амплификацию) любого гена или его фрагмента во много миллионов раз (Обухов И.Л. и др., 1996).
ПЦР, являясь самым чувствительным на сегодняшний день методом прямого обнаружения хламидий, не требует иммунологического ответа на проникновение возбудителя в организм хозяина, что дает возможность следить за ранними стадиями развития инфекции.
Для выявления патогенных микроорганизмов методом ПЦР не требуется их размножения, следовательно, так можно диагностировать инфекцию в латентной стадии. Необходимо также отметить простоту отбора материала для проведения ПЦР-диагностики на хламидиоз, т.к. можно достоверно судить об инфицированности животного по исследованию соскобов с конъюнктивы или слизистых урогенитального тракта. Клинический материал для ПЦР отбирают в пробирки с буферным раствором.
На сегодняшний день производятся тест-системы для выявления хламидий методом ПЦР, которые обладают 100% специфичностью и чувствительностью 10 копий ДНК на 1 мл образца (Обухов И.Л., 1994). Таким образом, ПЦР превосходит все биохимические и иммуноферментные методы лабораторной диагностики инфекций, в частности хламидиоза, т.к. позволяет определять единичные копии инфекционного возбудителя в исследуемом образце клинического материала.
Высокая чувствительность ПЦР становится недостатком, когда при исследовании животных после курса лечения появляются ложноположительные результаты в связи с невозможностью оценить жизнеспособность и патогенность клетки только на основании выявления фрагмента ее генома.
В связи с вышеизложенным, рекомендуем для лабораторной диагностики хламидиозов отбирать материал и направлять его для исследования, используя ИФА + ПЦР, а для контроля результатов лечения после курса терапии – ИФА.
1.1. Смешанная кишечная инфекция - остропротекающая инфекционная болезнь молодняка разных видов сельскохозяйственных животных, которая имеет полиэтиологическую природу и вызывается двумя-тремя и более видами патогенных энтеробактерий, относящимся к родам Escherichia, Citrobacter, Proteus, Morganella, Klebsiella, Salmonella. Помимо указанных микроорганизмов возбудителями болезни могут быть также бактерии других родов и семейств - Yersinia, Pseudomonas, Staphylococcus, Streptococcus, Clostridium и пр. Наряду с бактериальными агентами нередко (особенно на крупных фермах) болезнь обусловливают корона- и ротавирусы.
1.2. Болезнь возникает в первые дни и недели жизни животных и проявляется чаще в виде энзоотической вспышки, развитию которой способствуют различные факторы, связанные с несоблюдением технологических и ветеринарно-санитарных требований воспроизводства стада, а также нарушением режимов содержания и кормления молодняка.
1.3. Смешанная кишечная инфекция может протекать в кишечной (энтеритной) и септической формах. При кишечной форме возбудители болезни локализуются только в желудочно-кишечном тракте и брыжеечных лимфоузлах, регионарных поражённым участкам кишечника; при септической форме - в паренхиматозных органах, различных тканях, а также в кишечнике и брыжеечных лимфоузлах. Основными клиническими признаками болезни являются: потеря аппетита, понос, переходящий в профузный, нарастающая слабость, депрессия, учащенное дыхание и сердцебиение, обезвоживание организма (при затяжном течении); нередко наблюдается поражение центральной нервной системы (возбуждение, судороги), иногда пневмония, артриты; температура тела в пределах нормы, в отдельных случаях повышена на 0,5 - 1 °С, в предагональном состоянии она снижается ниже нормы.
1.4. Патологоанатомические изменения у погибших животных имеют картину катарального или катарально-геморрагического гастроэнтерита, на слизистой желудка, тонкого отдела кишечника и слепой кишки могут встречаться язвы, нередко отмечаются множественные точечные, полосчатые и пятнистые кровоизлияния на слизистой желудка, толстого и тонкого отделов кишечника, под капсулой селезенки, эпи- и эндокарде (клапанах); иногда отмечается очаговая катаральная пневмония и отек легких, дистрофия печени; регионарные брыжеечные лимфатические узлы как правило увеличены, отечны, на разрезе розового или красно-вишневого цвета; при вскрытии черепной коробки - гиперемия кровеносных сосудов и отек ткани головного мозга. Указанные изменения могут быть в отдельных или одновременно в нескольких органах.
1.5. Диагноз на смешанную кишечную инфекцию в хозяйствах устанавливают на основании совокупности эпизоотологических данных (возраст заболевших животных, массовость поражения, стационарность и др.), клинических признаков болезни, патологоанатомической картины и результатов бактериологического (при необходимости еще и вирусологического) исследования патологического материала от больных или погибших животных.
2.1. Для посмертной бактериологической диагностики в лабораторию направляют 2 - 4 свежих трупа погибших или убитых с диагностической целью больных животных (желательно не подвергавшихся лечению антибактериальными препаратами). В случае невозможности доставки целого трупа посылают следующий патологический материал: голову, трубчатую кость, сердце, перевязанное лигатурой вблизи разреза сосудов и аорты, селезенку, долю печени с желчным пузырем, брыжеечные лимфатические узлы, регионарные воспаленному участку кишечника, а также пораженный отрезок тонкого отдела кишечника, перевязанный с двух концов лигатурой (в отдельной таре или полиэтиленовом пакете). Указанный патологический материал исследуют в день поступления его в лабораторию.
2.2. Для прижизненной бактериологической диагностики в лабораторию направляют фекалии больных диареей животных, не подвергавшихся лечению антибактериальными препаратами. Пробы фекалий берут от 5 - 6 больных животных одной фермы в стерильные пробирки по 2 - 3 г непосредственно из прямой кишки с помощью прокипяченного резинового катетера. Пробирки вместе с сопроводительной запиской упаковывают в полиэтиленовый пакет или картонную коробку.
При невозможности быстрой доставки проб фекалий в лабораторию (через 3 - 4 часа после взятия) их консервируют стерильным 30 %-ным глицериновым раствором в соотношении 1:2 (см. приложение).
2.3. Пробы фекалий и содержимого тонкого отдела кишечника (в количестве не более 0,5 г) разводят в 10 см 3 стерильного 0,85 %-ного раствора хлорида натрия, тщательно размешивают и затем выдерживают 10 - 15 минут при комнатной температуре для осаждения крупных частиц. Надосадочную жидкость используют для посева на питательные среды не позднее 1 - 2 часов после приготовления взвесей. При исследовании консервированных фекалий, их тщательно размешивают, после чего разводят физиологическим раствором в 5 - 10 раз.
3.1. Патологический материал (за исключением содержимого тонкого отдела кишечника и фекалий) засевают в пробирки с МПБ и на плотные дифференциально-диагностические среды в чашках: Эндо (или Левина) и среду Плоскирева (или висмут-сульфит агар). Содержимое тонкого отдела кишечника и фекалий засевают только на указанные выше плотные среды в чашках. Кроме того для выделения из фекалий сальмонелл неразведенные пробы фекалий засевают еще в одну из сред обогащения (селенитовый бульон, магниевую, Мюллера или др.) в соотношении 1:5.
3.1.1. Посев материала в МПБ проводят пастеровской пипеткой. Посевы на плотные среды в чашках из внутренних органов и тканей, указанных в п. 2.3, делают путем отпечатков разрезанной поверхностью кусочка органа из предварительно профламбированного участка на подсушенную питательную среду или вносят материал пастеровской пипеткой на поверхность среды, а затем равномерно растирают его стеклянным шпателем.
3.1.2. Содержимое тонкого отдела кишечника, взятое путем соскоба с пораженного участка слизистой оболочки, суспендируют в 10 см 3 стерильного 0,85 %-ного раствора хлорида натрия, затем засевают суспензию бактериологической петлей на подсушенные в термостате плотные дифференциально-диагностические среды в чашках широким частым штрихом по всей поверхности среды. Аналогичным образом проводят посев разведенных фекалий.
3.2. Пробирки с посевами в МПБ из внутренних органов и тканей инкубируют при температуре 37 - 38 °С в течение 18 - 24 часов. При наличии в МПБ помутнения среды культуру микроскопируют и в случае обнаружения мелких грамотрицательных палочек пересевают ее на агар Эндо (или Левина) и среду Плоскирева (или висмут-сульфит агар) в чашках, которые помещают в термостат (37 - 38 °С ) на 18 - 24 часа.
Пересев культур, полученных в МПБ, на плотные селективные среды проводят в том случае, если отсутствует рост колоний на этих средах в первичных посевах из соответствующих органов и тканей.
При наличии на агаре Эндо (или Левина) роящегося налета, характерного для протея, пересевают его на скошенный МПА (культуры из двух-трех внутренних органов, тканей или фекалий). Чашки и пробирки с посевами инкубируют 18 - 20 часов при той же температуре.
3.4. Чашки с первичными посевами на агаре Плоскирева инкубируют при температуре 37 - 38 °С в течение 24 - 36 часов. После просмотра культур пересевают мелкие круглые колонии S-формы полупрозрачные, сероватого цвета с голубым оттенком в пробирки со скошенным МПА (по 1 - 2 колонии с культур из двух-трех внутренних органов, тканей или фекалий, каждую колонию в отдельную пробирку), которые помещают в термостат на 18 - 24 часа.
В том случае, если пересев проводят на комбинированную среду (Олькеницкого, Клиглера), то каждую колонию пересевают в одну пробирку с этой средой и в одну пробирку со скошенным МПА.
3.5. Суточные культуры бактерий на скошенном МПА или комбинированной среде, выделенные из внутренних органов, тканей или фекалий, микроскопируют (окраска по Граму) и при наличии в мазках однородных мелких грамотрицательных палочек, не образующих спор и капсул (бактерии вида Klebsiella pneumoniae образуют капсулу), используют для изучения ферментативных, патогенных, антигенных свойств, а также (при необходимости) определения подвижности в полужидком МПА. Для выявления у культур клебсиелл капсулы окраску мазков проводят по методу Гинса (тушью).
3.6. Ферментативные свойства изучают у 2 - 6 агаровых (в порядке исключения у бульонных) культур бактерий, выделенных из одного патологического материала, на наборе сред с углеводами и индикатором Андреде или полужидких средах с индикатором ВР, куда входят среды с глюкозой, лактозой, сахарозой, маннитом, мальтозой, а также на средах с мочевиной, сернокислым железом (определение сероводорода), агаре Симонса, в бульоне Хоттингера или МПБ (определение индола), мясопептонной желатине, среде с фенилаланином.
При использовании комбинированной среды Олькеницкого или Клиглера учитывают изменения, вызываемые представителями разных родов энтеробактерий в этой среде, после чего данную культуру изучают по другим необходимым биохимическим тестам.
Засеянные пробирки инкубируют при температуре 37 - 38 °С.
Предварительные результаты изучения ферментативных свойств культур учитывают через 24 часа, окончательные результаты - через 48 часов. Изучение ферментативных свойств культур энтеробактерий можно проводить также с помощью тест-системы для биохимической идентификации энтеробактерий. Родовую и видовую принадлежность культур устанавливают по показателям таблицы.
Следует учитывать, что у бактерий рода Proteus встречаются нероящиеся штаммы, образующие при росте на плотных питательных средах мелкие круглые колонии S-формы сероватого цвета. Важными признаками родовой идентификации таких штаммов является их способность дезаминировать фенилаланин и разжижать желатин.
При наличии у культур отклонений от основных показателей таблицы используют дополнительные тесты: реакции с метилротом и Фогес-Проскауэра, наличия образования оксидазы, определение подвижности и др.
СХЕМА
БАКТЕРИОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ ПАТОЛОГИЧЕСКОГО
МАТЕРИАЛА НА СМЕШАННУЮ КИШЕЧНУЮ ИНФЕКЦИЮ

Дифференциальные признаки энтеробактерий по ферментативным свойствам
Читайте также:

