Наследственная предрасположенность к туберкулезу
Обновлено: 23.04.2024
Признаки наследственной предрасположенности к гипероксалурической хронической обструктивной болезни легких.
Приведенные выше данные об одновременном нарушении функционирования нескольких органов, относящихся к различным физиологическим системам: бронхи, почки, печень и макрофагальные клетки, позволяют предположить возможность наследственной природы выявляемой патологии - нарушения оксалатного обмена у больных гипероксалурической хронической обструктивной болезнью легких. При этом необходимо обсудить возможность простого сочетания патологии различных систем: органов дыхания, мочевыведения, печени и макрофагов.
Было проведено определение HLA антигенов I класса тканевой совместимости у 69 больных гипероксалурической хронической обструктивной болезнью легких (Р+), которые имели все признаки гипероксалурической хронической обструктивной болезни легких, включая инверсию миграции мононуклеаров в тесте с ФГА, ускорение накопления и выведения радионуклидной метки Р31-гиппурана. У всех исследованных в этой группе больных имелись рыжеволосые кровные родственники. Результаты определения HLA антигенов у больных данной группы свидетельствует о повышенной частоте встречаемости антигена В13, а также гаплотипа В138.
В качестве маркеров наследственного предрасположения к нарушению оксалатного метаболизма у больных ХОБЛ могут рассматриваться рыжеволосые кровные родственники пробанда и локально-гнездная пигментация на верхней трети спины у больных ХОБЛ.
Наличие рыжеволосых кровных родственников присуще больным гипероксалурической хронической обструктивной болезнью легких (Р+) с более благоприятным течением болезни, они отличаются от больных гипероксалурической хронической обструктивной болезнью легких (Р-) инверсией миграции мононуклеаров в тесте с ФГА, более выраженной оксалурией и по другим показателям, которые описаны выше.
Рыжеволосые кровные родственники среди всех больных ХНЗЛ встречаются с частотой 0,4%. Согласно принятым правилам оценки генетической зависимости признака наличие рыжего цвета волос у кровных родственников пробанда является свидетельством мутации в гомозиготном состоянии, а локально-гнездная пигментация оценивается как генетический маркер гетерозиготного состояния.
Характерная особенность больных гипероксалурической хронической обструктивной болезнью легких-фертильность. Все родители пробандов женщин имели от семи до двенадцати братьев и сестер (сибсов).
При изучении генеалогического древа трех поколений пробанда Г.А. было установлено явление антиципатии - снижения возраста, в котором появлялись симптомы гипероксалурической хронической обструктивной болезнью легких у потомков: у пробанда - в возрасте 62 лет, у ее дочери - в 36 лет, у внука - в 3 года. У матери пробанда Г.А. волосы рыжего цвета, болезнь почек, оксалурия, у отца - бронхиальная астма.
В этой семье была проанализирована частота проявлений гипероксалурической хронической обструктивной болезнью легких в зависимости от степени родства. Оказалось, что число признаков, характерных для гипероксалурической хронической обструктивной болезнью легких на одного родственника I степени родства составляет - 7,6; II степени родства - 5,0; III степени родства - 4,0. Установленная зависимость частоты наличия признаков гипероксалурической хронической обструктивной болезнью легких от степени родства может рассматриваться как подтверждение роли наследственного предрасположения к возникновению гипероксалурической хронической обструктивной болезнью легких.
Для подтверждения роли наследственного предрасположения к гипероксалурической хронической обструктивной болезни легких приводим генеалогическое древо больной Г.А., 62 года.
При анализе генеалогических карт были установлены следующие особенности наследственной предрасположенности к гипероксалурической хронической обструктивной болезни легких:
1) дети больных матерей (Р+) в 50% случаев заболевают гипероксалурической хронической обструктивной болезнью легких;
2) здоровые родители детям гипероксалурической хронической обструктивной болезни легких не передают;
3) больные отцы детям гипероксалурической хронической обструктивной болезни легких не передают;
4) из группы 10 сибсов 9 были больны;
5) больные гипероксалурической хронической обструктивной болезнью легких (Р-) женщины при отсутствии рыжеволосых кровных родственников не передавали стойкую оксалурию и бронхоспа-стический синдром своим детям.
Перечисленные выше особенности возникновения и течения гипероксалурической хронической обструктивной болезни легких позволяют высказать предположение о значительной роли наследственного предрасположения в развитии этого заболевания, которое осуществляется, вероятно, по аутосомнодоминантному типу.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
В статье приведены результаты исследования локуса DRB1 главного комплекса гистосовместимости (HLA) и NRAMP1 у детей, проживающих на территории Краснодарского края. Установлено наличие положительных и отрицательных ассоциаций некоторых аллелей HLA DRB1и генотипов NRAMP1с заболеваемостью туберкулезом, что позволило рассматривать их как факторы устойчивости и предрасположенности к туберкулезу.

В XXI век человечество вступило с высокой заболеваемостью туберкулезом. Предполагалось, что туберкулез останется одним из самых тяжелых заболеваний в мире до 2010 года [3]. Однако появление и быстрое распространение в мире туберкулеза с обширной лекарственной устойчивостью (XDR-TB) обусловило анонсирование новой стратегии ВОЗ, рассчитанной на период до 2015 года, центральным положением которой объявлено продолжение интенсивных исследований в области туберкулеза [9].
Ухудшение эпидемиологической ситуации привело к увеличению числа инфицированных туберкулезом лиц. Согласно официальным статистическим данным, за последнее 10-летие инфицированность туберкулезом детей в России увеличилась в 2,5 раза и в настоящее время в 10 раз превышает аналогичный показатель в развитых странах [1].
Персистирование жизнеспособных M. tuberculosis на протяжении всей жизни в зараженном организме определяет особенность инфекционного процесса - как малую болезнь, с длительным скрытым течением и постоянной угрозой развития заболевания при снижении сопротивляемости инфекции [8].
Обобщенное представление об этапности в патогенезе туберкулеза [4] возродило интерес среди исследователей к проблеме латентной (скрытой) туберкулезной инфекции (LBTI) в отличие от манифестной (явной).
Цель исследования
Разработать способ определения риска прогрессирования латентной туберкулезной инфекции у детей с учетом генетической устойчивости/предрасположенности к заболеванию.
Материалы и методы
В ходе работы сформированы следующие клинические группы:
Дети славянской национальности, больные различными формами туберкулеза органов дыхания - 129 человек.
Дети с латентной туберкулезной инфекцией (LTBI), здоровые инфицированные - 118 человек славянской национальности.
С целью формирования группы контроля для молекулярно-генетических исследований проведена случайная выборка из новорожденных популяции славянской национальности. Отобрано 109 здоровых новорожденных детей с отсутствием у родителей рентгенологических признаков локального туберкулеза органов дыхания.
Контролем для сравнительного исследования цитокинового профиля служили результаты исследования у 30 здоровых неинфицированных детей из регионального банка данных кафедры аллергологии и иммунологии КГМУ.
У всех детей проводили общепринятый комплекс клинико-лабораторного обследования с применением обязательных, дополнительных и факультативных методов исследования. В каждом случае обращали внимание на семейный анамнез и возможный контакт с больными туберкулезом.
Генотипирование локуса DRB1HLA и локуса INT4 NRAMP1 проводили по методике C. Søborg et al. (2002).
Результаты исследования и их обсуждение
Исследование ассоциации антигенов системы HLA локуса DRB1у детей, больных локальными формами туберкулеза органов дыхания, показало, что для них характерно увеличение частоты встречаемости аллельных специфичностей *04 и *16 по сравнению со здоровыми новорожденными детьми из популяции в 4,4 и 3,5 раза и здоровыми детьми, инфицированными микобактериями туберкулеза, в 2,2-1,6 раза соответственно (р<0,05) (рис.1).

Рис. 1. Частота встречаемости аллелей гена HLA локуса DRB1 у больных туберкулезом, здоровых новорожденных из популяции и инфицированных МБТ детей
Полученные результаты исследования позволили нам рассматривать аллельные специфичности в генотипе HLA DRB1 *03, *11, *12 как генетические факторы устойчивости, а *04 и *16 - как генетические факторы предрасположенности к заболеванию туберкулезом. Обнаруженные в значительном количестве аллельные специфичности HLA DRB1, одинаково часто встречающиеся у больных и здоровых детей, мы назвали нейтральными и отнесли к этой группе аллели *01, *07, *08, *10,*13, *14, *15.
Следует отметить полное отсутствие у жителей Краснодарского края специфичностей HLA DRB1 *02, *05, *06, *09.
Сравнительный анализ вариантов генотипа, то есть сочетания двух аллелей системы HLA DRB1 локуса, на устойчивость/ предрасположенность у детей, заболевших локальным туберкулезом, в сравнении со здоровыми новорожденными из популяции и здоровыми, инфицированными МБТ показал, что для больных больше характерен наследственный фактор парности двух аллелей DRB1 *04/*04, *04/*16, *16/*16 с маркерным признаком предрасположенности к заболеванию (17,8%), тогда как у здоровых новорожденных детей из популяции подобные наследственные компоненты вообще не обнаружены, а у здоровых инфицированных МБТ, составили 9,3% (р<0,05).
Кроме того, среди больных детей сочетание специфичностей с признаками, ассоциированными с высокой вероятностью развития туберкулеза - DRB1 *04 и*16, с аллелями, имеющими другие признаки (устойчивости, нейтральности), обнаружено в 2 раза чаще по сравнению с группой здоровых новорожденных и здоровых, инфицированных МБТ детей (38,0±4,2 против 18,3±3,7 и 18,6±3,5 соответственно, р<0,05).
Вместе с тем существенной разницы между изучаемыми показателями в контрольной группе новорожденных из популяции и в группе здоровых, инфицированных МБТ детей не установлено, кроме полного отсутствия генотипа HLA DRB1 с наличием обеих аллелей предрасположенности к заболеванию у новорожденных.
Генетическое сочетание аллелей, наделенных маркерными признаками нейтральности - DRB1 *01, *07, *08, *10, *13,*14, *15, обнаруживалось у больных так же часто, как и у здоровых новорожденных детей из популяции и здоровых, инфицированных МБТ (36,4 против 26,6 и 28,0%, р>0,05).
Анализ вариантов генотипа DRB1 с сочетанием антигенов устойчивости и предрасположенности показал, что количественный показатель сочетания этих наследственных компонент только у здоровых новорожденных детей из популяции существенно превосходит таковой у больных (11,9 против 4,7%, р<0,05).
Таким образом, результаты исследования позволяют прийти к выводу о влиянии наследственной компоненты HLA DRB1 локуса на прогрессирование возникшей туберкулезной инфекции.
В ходе изучения ассоциации полиморфизмов генов-кандидатов проведено исследование одной из самых распространенных мутаций гена NRAMP1 - в интроне 4 (INT4).
Прежде всего мы установили частоту встречаемости аллельных специфичностей NRAMP1 INT4 у наблюдаемых детей (табл. 1).
Таблица 1
Частота встречаемости аллельных специфичностей NRAMP1 локуса INT4 у здоровых и больных туберкулезом детей (%, М±m), n=356
1. Что такое туберкулез? Туберкулез – инфекционное заболевание, возбудителем которого является микобактерия туберкулеза (в народе ее называют палочкой Коха). Эта болезнь поражает все органы и системы, но в 90% случаев поражаются легкие.
2. Как можно заразиться туберкулезом? Основной источник инфекции – больной с открытой формой туберкулеза. Микобактерии туберкулеза переносятся по воздуху невидимыми мельчайшими капельками мокроты, которые выделяются при кашле, чихании, разговоре. При вдыхании зараженного воздуха микробактерии туберкулеза попадают в организм здорового человека и вызывают заболевание. Реже встречается пищевой путь передачи инфекции – через сырое молоко, мясо, яйца от больных туберкулезом животных и птиц. Заразиться также можно при пользовании полотенцем, посудой, постелью больного.
3. Устойчива ли палочка Коха во внешней среде?
Микобактерии туберкулеза достаточно устойчивы во внешней среде. Например: в высохшей мокроте сохраняет свою жизнеспособность до 1,5 лет, на страницах книг – до 1,5 месяцев, достаточно быстро погибает при попадании прямых солнечных лучей (через 1-2 часа), при ультрафиолетовом облучении они погибают спустя несколько минут, под воздействием хлорсодержащих препаратов – через 6 часов.
4. Какие факторы способствуют развитию туберкулеза?
К факторам, способствующим развитию туберкулеза, относятся: недостаточное и неполноценное питание, недостаток витаминов, частые простудные заболевания, постоянный стресс и курение.
Существует также группа соматического риска заболевания туберкулезом – это больные сахарным диабетом, язвенной болезнью желудка и 12-перстной кишки, оперированным желудком, хроническими неспецифическими заболеваниями легких (например, хронический бронхит), с ВИЧ-инфекцией. Велик риск заболевания туберкул¸зом среди группы социального риска: это мигранты, лица без определенного места жительства, лица, прибывшие из исправительно-трудовых учреждений, наркоманы и злоупотребляющие алкоголем.
5. Каковы основные признаки туберкулеза? К основным признакам туберкул¸за относятся: длительный кашель более 2-3 лет, потеря аппетита, похудание, боль в грудной клетке, кровохарканье, общая слабость, периодическое или постоянное повышение температуры тела.
6. Что нужно делать, если возникло подозрение на туберкулез?
При появлении первых же признаков заболевания необходимо немедленно обратиться в лечебное учреждение и обследоваться на туберкулез. Основным методом ранней диагностики туберкулеза у взрослых является флюорографическое обследование органов грудной клетки, а среди детей и подростков — туберкулинодиагностика (проба Манту с 2ТЕ).
7. Может ли туберкулез протекать без жалоб?
У 10 – 15% больных на начальной стадии туберкулез ничем не проявляется и является случайной находкой при профилактическом флюорографическом обследовании. У 1/3 больных отмечаются только симптомы функционального характера – быстрая утомляемость, повышенная раздражительность, снижение трудоспособности, слабость. Эти больные длительно считают себя здоровыми, за медицинской помощью не обращаются и представляют опасность для окружающих.
8. Как оградить себя от заражения туберкулезом?
Профилактика туберкулеза включает в себя несколько направлений:
- санитарная – это обучение больного правилам поведения в обществе, влажная уборка в помещении, где находится больной и своевременное полноценное лечение самого больного;
- специфическая: а) вакцинация и ревакцинация БЦЖ, б) химиопрофилактика – лицам из контакта с туберкулезной инфекцией и инфицированным лицам;
- общие мероприятия – рациональный режим труда и отдыха, рациональное питание, отказ от курения и алкоголя.
9. Излечим ли туберкулез? При своевременном выявлении туберкулеза и неукоснительном соблюдении предписанного врачом режима лечения туберкулез излечим. Лечение длится 6-8 месяцев, реже до 1 года и более. Если больной прерывает лечение, туберкулез вспыхивает вновь, но с большей силой. При этом микобактерии могут приобрести устойчивость к противотуберкулезным препаратам, развивается лекарственно устойчивый туберкулез, полностью излечить который очень трудно, а иногда невозможно.
10. Применяются ли лекарственные травы при туберкулезе?
Лекарственные травы при туберкулезе применяются в качестве вспомогательного средства. Наиболее часто применяются препараты алоэ древовидного, алтея лекарственного. В качестве отхаркивающего и дезинфицирующего средства используется отвар из почек сосны. Из рецептов народной медицины также при туберкул¸зе используются препараты переработки пчел, в частности прополиса.
Распространение палочки туберкулеза по организму
Туберкулезная палочка с кровью и лимфой разносится по организму. Места внедрения отмечены воспалением. При туберкулезе воспаление носит аллергический характер, образуются бугорки. Кроме того, для туберкулеза характерен тип воспаления, связанный с появлением участков распавшейся ткани, напоминающих творог. Этот процесс при туберкулезе называется казеозом. Затем эти творожистые комочки рассасываются или наоборот окружаются плотной оболочкой и затвердевают из-за накопления кальция (обызвествление). В этих участках палочка туберкулеза может сохраняться очень долго.
Ранние признаки туберкулеза.
К ранним признакам туберкулеза относятся симптомы отравления – температура все время немного повышена, исчезает интерес к еде, школьник хуже учится. Часто увеличены лимфоузлы, пораженные туберкулезной палочкой, иногда наблюдаются воспалительные процессы в глазах, сердце бьется чаще, прослушиваются небольшие легочные хрипы, со стороны крови – неспецифические признаки воспаления. У детей туберкулезом обычно поражаются в первую очередь легкие, особенно их верхушечные части.
Предрасположенность к туберкулезу.
Сила иммунной защиты зависит от устойчивости или подверженности к туберкулезу, которые передаются по наследству, а также от возраста, условий жизни, вредностей, способности бронхов выводить загрязнения, а кишечника – расщеплять попавшие в него вредные элементы и, главное, состоянием особых клеток иммунной системы – фагоцитов.
Важно, что существует генетическая предраcположенность к туберкулезу. Показано, что туберкулезом чаще болеют те люди, у кого есть родственники, больные туберкулезом, причем речь не идет о заражении при контакте с больным. Несколько чаще туберкулезом болеют люди с первой группой крови, а также страдающие другими болезнями легких.
Первичный и вторичный туберкулез. Первичный туберкулез, то есть туберкулез после свежего заражения, возникает лишь у каждого десятого зараженного человека или даже реже (и заболеть он может в течение года или двух после заражения). Заражение проявляется только повышенным иммунным ответом на палочку туберкулеза, видным в пробах. Но туберкулезная палочка может затаиться и неожиданно, при стечении обстоятельств, стать очень активной. К этим неблагоприятным обстоятельствам, способствующим активации туберкулеза (то есть, вторичному туберкулезу), относятся эндокринные болезни, стресс, алкоголизм и любые тяжелые заболевания. Вторичный туберкулез может развиваться и другим путем – при повторном заражении палочкой туберкулеза, но факторы риска остаются теми же, ведущими к ослаблению организма.
Виды туберкулеза.
Для безопасности окружающих очень важно, какая форма туберкулеза у больного – с выделением палочки туберкулеза или без. А с точки зрения клиники туберкулеза выделяют следующие его виды.
Первичный туберкулез.
В настоящее время у детей туберкулез может проявляться воспалением грудных лимфоузлов и творожистым некрозом в них, а в легких воспаления может не быть. Если воспаление разрушает стенку бронха, творожистая масса распространяется по всему легкому. Если участок воспаления заживает, он уплотняется и меняет форму бронхов, что может привести к их закупорке. Если ребенок ослаблен, сразу поражается легкое, а вместе с ним и ближайший лимфоузел. При обоих вариантах первичного туберкулеза инфекция может попасть в кровь, а с ней – в любой орган.
Диссеминированый (рассеянный) туберкулез.
Рассеивание туберкулеза может идти через лимфу, кровь или бронхи. Первые две формы представляют собой нечто среднее между первичным туберкулезом и вторичным туберкулезом. Иногда они объединяются, поражая не только верхушечные отделы легких, но и другие органы, так туберкулез чаще протекает у взрослых людей. В легких образуются особые поражения – каверны.
Очаговый туберкулез.
Очаговая форма туберкулеза – самая распространенная. Обычно связана с разносом туберкулезной палочки из первичных очагов поражения через лимфу. Чаще всего множество участков творожистого расплавления сосредоточены в верхушке правого легкого. Если эти участки туберкулеза постепенно заменятся плотной соединительной тканью, то исход считается неплохим.
Инфильтративный (проникающий) туберкулез.
Этот вид туберкул¸за возникает, если очаговый туберкулез разрастается и занимает все легкое. К этой форме часто присоединяется воспаление легких, большие творожистые участки расплавляются и после них остаются настоящие дыры в легких.
Туберкулема.
Если образовались творожистые участки размером с монету, окруженные уплотнением, говорят о туберкулеме легких.
Деструктивный туберкулез.
Туберкулезное расплавление может наблюдаться при неблагоприятном течении всех форм туберкулеза. Каверны (полости) могут меняться по нескольким сценариям, приводя к грубым изменениям ткани легких.
Осложнения и внелегочные формы туберкулеза.
К осложнениям туберкулеза относится кровотечение из легких, пневмоторакс (то есть, нарушение герметичности плевральной полости), спадение легких и т.д.
Особые формы туберкулеза не связаны с поражением легких – туберкулез почек, костный туберкулез. В последнее время частота костно-суставного туберкулеза увеличилась.
Какие болезни могут передаваться ребенку от родителей? Генетические заболевания
К сожалению, ребенок получает от родителей не только черты внешности и особенности характера, но и болезни, которыми страдали они и их близкие родственники. Учеными выявлено, что передаваться по наследству могут более 6 тысяч заболеваний. Большинство из них проявляются после 35 лет, а некоторые могут заявить о себе только через поколения. Чаще всего в наследство от родителей человек получает сахарный диабет, псориаз, ожирение, шизофрению, эпилепсию и болезнь Альцгеймера, но передаваться от родителей могут и следующие болезни:
1. Гипертония. Если в вашей семье кто-нибудь страдал гипертонией с юности, если у кого-то из родственников был инфаркт или инсульт до 40 лет, если мать или отец не дожили до 60 лет из-за этих опасных заболеваний, то риск заболеть гипертонической болезнью у вас велика.
Гипертония чаще всего передается по материнской линии, но может наследоваться человеком и по линии обоих родителей. Конечно, повышаться артериальное давление может и у людей, которые не имеют генетической предрасположенности к гипертонии. Но наследственность значительно увеличивает риск развития этой болезни.
Учеными установлено, если у отца случился инфаркт после 55 лет или у матери после 65 лет, и они умерли до 75 лет, то риск развития инфаркта у их сына или дочери для них во много раз ниже, чем если бы они умерли в более раннем возрасте.
2. Онкология. Онкологические заболевания тоже могут носить наследственный характер. Доказано, даже единичный случай онкологии в семье может в 2 раза увеличить риск того, что рак может быть диагностирован у их детей или внуков. При этом установлено, что если у матери или отца был выявлен рак какого-то органа или ткани, то у их детей чаще всего обнаруживается именно эта патология. Связано это с тем, что в роду наследуется примерно одинаковый по строению набор генов с небольшими различиями, поэтому и развиваются злокачественные опухоли в одних и те же областях.
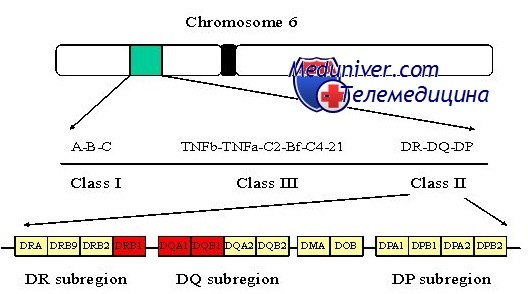
Хромосома 6 как причина сахарного диабета 1 типа
Если в семье бабушка или дедушка умерли от рака, или один из родителей страдает этой болезнью, то стоит насторожиться, а если обнаружили злокачественную опухоль у обоих родителей, то выход в данной ситуации один - это регулярно проходить обследования и сдавать анализы, то есть держать свое здоровье под постоянным контролем.
3. Остеопророз. Остеопороз чаще всего передается от матери к дочери, риск его возникновения увеличивается почти в 3 раза, если мать страдает этой болезнью. Победить наследственную предрасположенность к этой болезни и избежать ее развития можно с помощью правильного питания и регулярных физических упражнений, которые помогут сохранить здоровье костей до преклонного возраста.
4. Сахарный диабет. Если мама и папа страдают сахарным диабетом, то риск развития этой болезни у их ребенка около 70%. Если же болеет только отец, то риск снижается до 10%, если только мать - до 7%. Поэтому если у вас диагностировали сахарный диабет, то почти всегда причина этого генетическая предрасположенность к этому заболеванию. При этом чем ближе степень родства, тем выше риск.
Часто бывает так, что родители здоровые, а их дети болеют сахарным диабетом. Причина этого в том, что эта болезнь нередко передается через поколение - от бабушек и дедушек. Унаследовать ребенок может оба типа диабета, но чаще передается по наследству инсулинозависимовая форма. Сахарный диабет сегодня хорошо поддается лечению, если держать его под постоянным контролем и соблюдать все рекомендации врачей.
5. Близорукость. Вы, наверно, замечали, если мама или папа носит очки, то их ребенок тоже в их возрасте не может обходиться без них. Причина этого - наследственная предрасположенность к близорукости. Установлено, если родители в детстве страдали близорукостью, то риск ухудшения зрения у их детей в начальных классах возрастает в 23 раза. Вместе с тем, передачи близорукости от родителей к детям можно избежать, если ограничить ребенка от чрезмерной зрительной нагрузки и регулярно выполнять упражнения, направленные на укрепление глазных мышц.
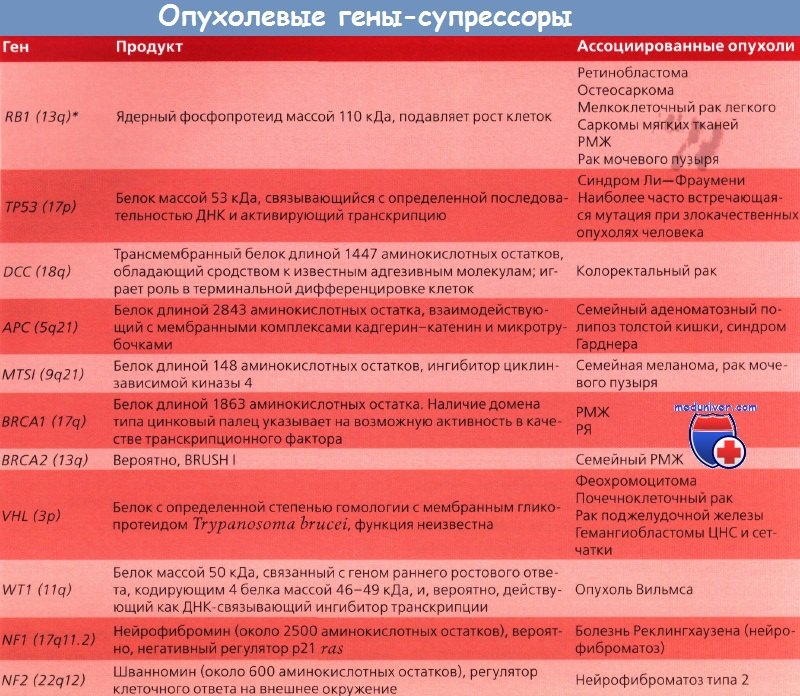
*Локализация на хромосоме. Известные гены, отвечающие за развитие онкологического заболевания.
6. Аллергия. Если оба родителя страдают аллергией, то в 80% случаев у их ребенка возникает атопический дерматит или "детская экзема". Если же аллергией страдает только один из родителей, то вероятность развития этих болезней у ребенка составляет 50%. При этом важно знать, что по наследству передается не аллергия, а способность организма противостоять воздействию неблагоприятных факторов.
Наличие наследственной предрасположенности вовсе не значит, что человек обязательно заболеет аллергией. Многое зависит от целого ряда факторов. Например, аллергия на укусы комаров, пчел, ос и прочих насекомых в 100% случаев передается по наследству даже в тех случаях, если такой реакцией страдает только один из родителей. А вот бронхиальная астма, которая тоже является разновидностью аллергии, передается по наследству, только если будут созданы условия для развития патологической реакции.
7. Мигрень. Ученые определили, что причиной возникновения мигрени тоже является наследственная предрасположенность. При этом если мигренью страдает только один из родителей, то риск развития этого заболевания у ребенка составляет 14%, а если больны оба родителя, то мигрень грозит их потомству в 80% случаев. Ведь особенности сосудистого строения у родителей и детей обычно схожи, а это значит, риск развития болезни сосудов у детей по аналогичной схеме, что и у родителей, заметно возрастает.
Поэтому можно смело утверждать, что по наследству могут передаваться также варикоз, тромбофлебит, болезни почек, гастрит, язвенная болезнь желудка и двенадцатиперстной кишки. К сожалению, наследственность нельзя устранить или изменить. Ее приходится принять как должный факт и действовать, чтобы не допустить развития генетических заболеваний. А для этого важно держать свое здоровье под постоянным контролем.
Генетические аспекты специфического воспаления.
Особого упоминания требуют генетические аспекты специфического воспаления, в частности при туберкулезе, имеющего сугубо определенную этиологию (М. tuberculosis) и характерные клинико-морфологические особенности. Выше мы уже касались роли наследственного предрасположения при туберкулезе. Сегодня эта роль не вызывает сомнения и доказана классическими методами клинической генетики.

В русской популяции высокодостоверная ассоциация была найдена с антигеном Cw1 (р
Одним из наименее освещенных аспектов рассматриваемой проблемы остаются нарушения цитогенетического гомеостаза при формировании воспаления. Связь изменений цитогенетического аппарата клеток с воспалением в настоящее время установлена. В частности, в литературе описано повышение уровня хромосомных перестроек при таких воспалительных заболеваниях бронхолегочной системы, как хроничекий бронхит, бронхиальная астма, острая пневмония. Вместе с тем, при-чичинно-следственные взаимоотношения воспалительного процесса и цитогенетических альтераций не до конца ясны.
Такого рода исследования проводились нами на кафедре госпитальной терапии им. акад. М.В. Черноруцкого СПб ГМУ им. акад. И.П. Павлова в содружестве с Институтом цитологии РАН. Полученные результаты выявили в клетках больных бронхиальной астмой достоверное по сравнению со здоровыми повышение частоты аберраций (ХА) и сестринских хроматидных обменов (СХО) (табл. 2), а также изменения ДНК-репаративной активности. Последние заключались в достоверном увеличении интенсивности спонтанного внепланового синтеза (ВС) ДНК и снжениии индекса стимуляции репарации (ИСР) ДНК. ИСР определяли по отношению значений индуцированного ВС ДНК к спонтанному ВС ДНК.
Важно подчеркнуть выявленную нами зависимость степени выраженности цитогенетических изменений от ведущего клинико-патогенетического варианта заболевания. Значения показателей, характеризующих ДНК-репаративную способность клеток, различались у больных атопической и инфекционно-зависимой бронхиальной астмой. Так, значения ИВС ДНК составили соответственно 7,2±0,58 и 5,6±0,56 (р>0,05), а ИСР ДНК - 2,7±0,24 и 2,1±0,13 (р 0,05).
Среди факторов, способных участвовать в формировании цитогенетических изменений при воспалительной патологии бронхов и легких выделяют следующие: влияние инфекции, включая прямое цитогенетическое действие вирусов, а также косвенные эффекты бактериальных и вирусных агентов; повышенный выброс медиаторов воспаления; эндокринные нарушения, в частности глюкокортикоидная недостаточность и дисбаланс половых гормонов; количественная и функциональная недостаточность клеточного звена имунитета; интенсификация перекисного окисления липидов и депрессия антиоксидантной защиты. Перечисленные и, возможно, некоторые другие гомеостатические нарушения, связанные с воспалением, способны прямо или косвенно влиять на процессы репарации ДНК, нарушение которых рассматривается как один из интегральных механизмов реализации цитогенетических повреждений (Михельсон В.М., 1979; Умнова Н.В., 1986).
Активность системы репарации ДНК сама по себе отражает функциональное состояние иммуноцитов (Сильвестров В.П. и др., 1985). Кроме того, концепция иммунного контроля за цитогенетическим гомеостазом рассматривает цитогенетические нарушения во взаимосвязи с функционированием иммунной системы (распознавание измененных антигенных детерминант клеток с хромосомными нарушениями и их элиминация). Иными словами, при снижении активности иммунной системы закономерно нарастает число клеток с хромосомными перестройками, которые, будучи функционально неполноценными, усугубляют иммунодепрессию, и "порочный круг" замыкается.
Отсюда логично заключить, что изменения цитогенетического гомеостаза являются не только следствием воспалительного процесса, но могут выступать и в качестве участников его формирования, в частности, за счет вклада в несостоятельность функции иммунокомпетентных клеток. Подтверждением сказанного могут служить полученные нами данные о сопряженности клинической эффективности иммунокорригурющей терапии с уменьшением уровня структурных мутаций хромосом в лимфоцитах у больных бронхиальной астмой.

Любопытно отметить, что повышенная частота спонтанных хромосомных повреждений обнаружена также у больных системной склеродермией (Rittner G. et al., 1988). Примечательно, что хромосомные изменения выявлялись не только у больных, но и у здоровых кровных родственников, и были связаны с определенным HLA-гаплотипом.
Данное наблюдение приведено в качестве дополнительного аргумента в пользу возможности первичного патогенетического значения цитогенетических изменений при воспалительной патологии. В контексте рассматриваемой проблемы такими аргументами (по крайней мере, косвенными) может служить установленная нами связь уровня ДНК-репаративной способности клеток с HLA-фенотипом и количества клеток с хромосомными перестройками - с основными клинико-патогенетическими вариантами бронхиальной астмы. Для уточнения возможной патогенетической роли цитогенетических изменений в отношении воспаления бронхов и легких поиск целесообразно продолжить в направлении обследования практически здоровых кровных родственников больных с данной патологией.
Подводя итог всему изложенному выше, можно, как нам представляется, заключить, в частности, следующее.
В развитии воспаления бронхов и легких - на различных этапах его формирования - значительная роль принадлежит генетически обусловленным факторам.
Обращает на себя внимание выраженная неоднородность генетических дефектов, участвующих в развитии даже отдельно взятого варианта воспалительного процесса; это обосновывает необходимость дифференцированного поиска методов и средств лечения.
Генетические факторы способны не только инициировать или поддерживать отдельные этапы формирования воспалительного процесса, но и определять особенности его течения.
Приведенные данные вполне укладываются в представление о биологических дефектах как доклиническом этапе формирования патологического процесса, что, по нашему мнению, применимо не только к воспалению в бронхолегочной системе, но, по-видимому, и к патогенезу любой мультифакториальной патологии.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Читайте также:

