Назовите основной дифференциально-диагностический признак сепсиса
Обновлено: 24.04.2024
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
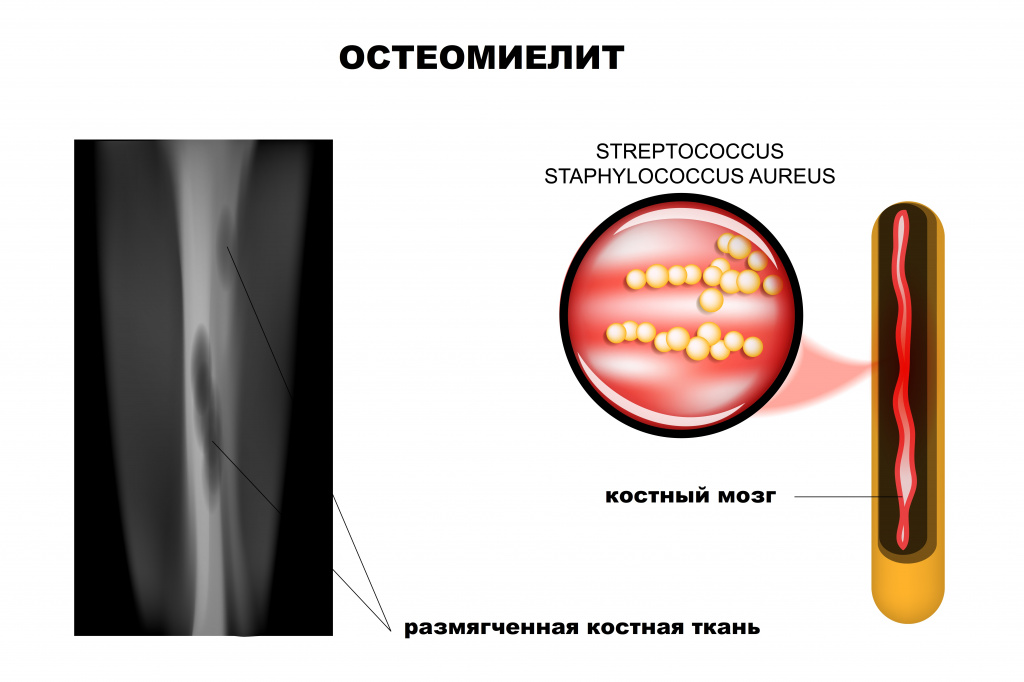
Остеомиелит: причины появления, симптомы, диагностика и способы лечения.
Определение
Причины появления остеомиелита
Ведущая роль в развитии заболевания принадлежит патогенным стафилококкам (золотистый стафилококк обнаруживается почти у 90% больных остеомиелитом), гемолитическим стрептококкам, грамотрицательной кишечной и анаэробной микрофлоре, грибковым инфекциям.
Специалисты считают, что в развитии остеомиелита имеют значение снижение реактивности организма больного (в результате травмы, переохлаждения, сенсибилизации) и нарушение кровоснабжения поражаемого отдела кости.
Основными путями проникновения инфекции в костную ткань являются:
- Гематогенный – патогенные микроорганизмы из какого-либо источника инфекции (например, фурункулов, кариозных зубов, воспалительных очагов в деснах, миндалинах или придаточных пазухах, легких, мочеполового тракта и др.) с током крови проникают в костную ткань, приводя к развитию остеомиелита. Воспалительный процесс начинается с внутренних слоев кости – в первую очередь поражается костный мозг, губчатое вещество кости. В последующем процесс переходит на компактное вещество (наружный плотный слой кости) и надкостницу. Данный вид остеомиелита часто встречается в детском возрасте. Особенностью костной ткани у детей является ее обильное кровоснабжение. В большинстве случаев остеомиелит развивается в зонах роста костей (метафизах). При этом чаще поражаются длинные (большеберцовая, бедренная или плечевая) кости конечностей ребенка. У взрослых гематогенный остеомиелит, как правило, поражает тело позвонков.
- Прямое инфицирование костной ткани может наблюдаться при открытых переломах, обширных, глубоких ранах. Посттравматический остеомиелит развивается вторично после открытых переломов. Особую группу составляет остеомиелитическое повреждение костей после ДТП, спортивных травм, огнестрельных и минно-взрывных ранений, поскольку в характере перелома играет роль обширное поражение окружающих тканей. При этом возникает не только дефицит костной, но и мягких тканей с образованием больших дефектов. В некоторых случаях данным путем может происходить проникновение патогенных бактерий при различных хирургических ортопедических вмешательствах.
- Инфицирование из близлежащих гнойных очагов (контактный путь) – патогенные бактерии проникают в костную ткань из длительно существующих гнойно-воспалительных очагов в окружающих мягких тканях. Данная форма в основном встречается у взрослых. В процесс обычно вовлечена одна кость, но иногда наблюдается поражение нескольких участков. Экзогенное распространение инфекции от сопредельных зараженных тканей или открытых ран вызывает около 80% случаев остеомиелита и часто имеет полимикробный характер. Факторами риска у взрослых являются мужской пол, пожилой возраст, истощение, ослабленный иммунитет, длительный прием глюкокортикоидов, гемодиализ, серповидноклеточная анемия (наследственное заболевание, которое характеризуется образованием патологического белка гемоглобина в эритроцитах) и употребление инъекционных наркотиков. Травмы, ишемия, инородные тела, пролежни, повреждение тканей лучевой терапией также предрасполагают к остеомиелиту.
Остеомиелит, обусловленный инфицированием окружающих тканей, часто локализуется в области стоп (у больных с сахарным диабетом или заболеваниями периферических сосудов).
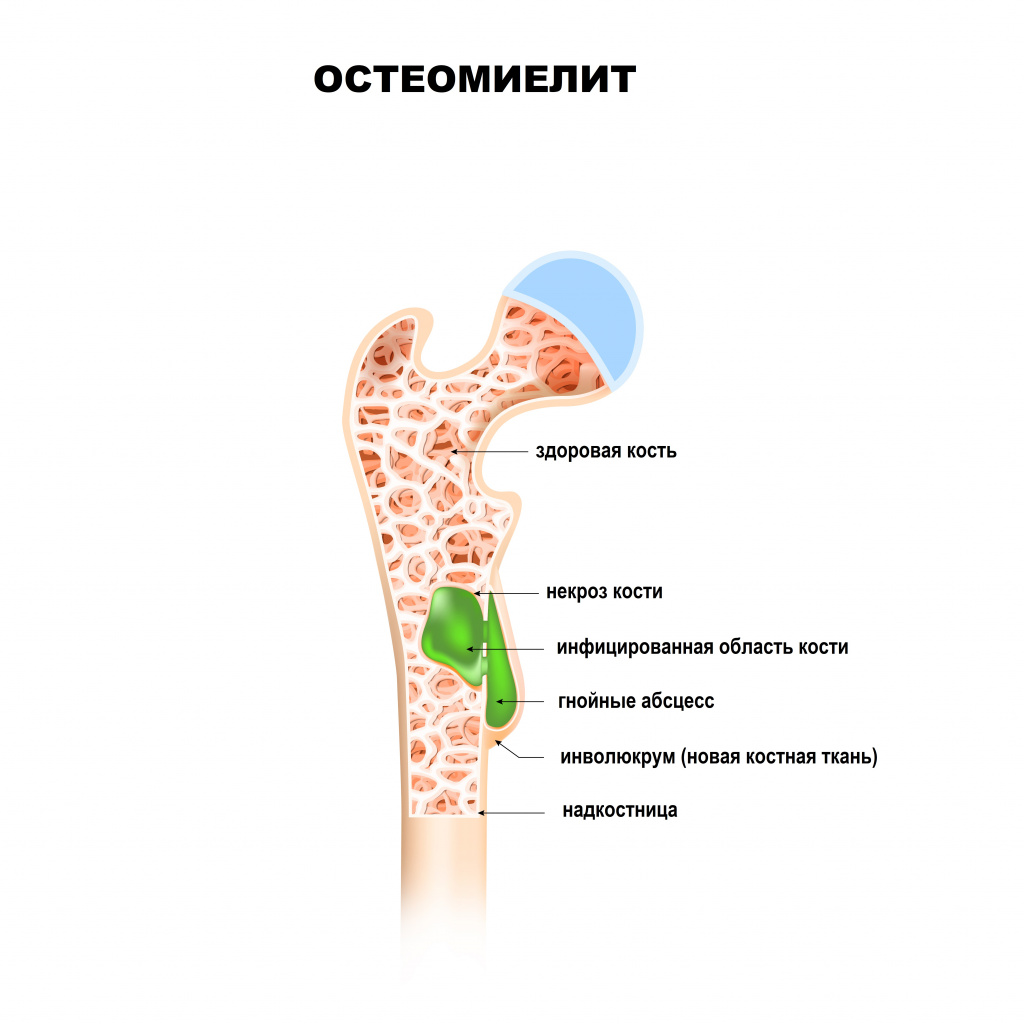
Любой остеомиелит может перейти в хроническую форму, имея, в конечном счете, общую патофизиологию с нарушением целостности оболочки мягких тканей, наличием окружающей омертвевшей, инфицированной и реактивной новой костной ткани.
Классификация заболевания
Остеомиелит различают:
- по пути инфицирования: экзогенный и эндогенный;
- по этиологии:
- острый гематогенный остеомиелит, вызванный золотистым стафилококком, стрептококками, коагулаза-отрицательными стафилококками, Haemophilus influenzae, грамотрицательными микроорганизмами;
- остеомиелит позвоночника, вызванный золотистым стафилококком, грамотрицательными кишечными палочками, микобактериями туберкулеза, грибами;
- остеомиелит при наличии местного очага или сосудистой недостаточности, вызванный комбинацией аэробных и анаэробных микроорганизмов;
- остеомиелит, развившийся на фоне инфекции протезных аппаратов, вызванной коагулаза-отрицательными стафилококками, золотистым стафилококком, коринеформными бактериями, грамотрицательными микроорганизмами.
- острый гематогенный остеомиелит:
- генерализованный (септикотоксемия, септикопиемия),
- очаговая форма;
- после перелома,
- огнестрельный,
- послеоперационный;
- абсцесс Броди,
- альбуминозный (Оллье),
- склерозирующий (Гарре).
- острая (2-4 недели);
- подострая (от 2 недель и более):
- выздоровление,
- продолжение процесса;
- обострение,
- ремиссия,
- выздоровление.
- остеомиелит трубчатых костей (эпифизарный, метафизарный, диафизарный, тотальный);
- остеомиелит плоских костей.
К симптомам заболевания относят боль в области пораженной кости, сопровождающуюся общей реакцией организма (при остром остеомиелите) или без нее (при хроническом остеомиелите).
Первые признаки остеомиелита в острой форме:
- сильная распирающая боль в пораженной кости;
- выраженный локальный отек, который приводит к натяжению кожного покрова;
- температура тела поднимается до 38оС;
- при постукивании можно определить очаг воспаления – в этом месте пациент чувствует наибольшую болезненность.
![Кость.jpg]()
Признаки остеомиелита кости часто дополняются симптомами общей интоксикации, если инфекция распространяется на соседние ткани или проникает в кровь. У пациента в таком случае наблюдаются:
- высокая температура (около 39оС);
- сильная головная боль;
- лихорадка, озноб;
- бледные кожные покровы;
- учащенное сердцебиение;
- тошнота и рвота.
Если у пациента наблюдается хронический остеомиелит, симптомы кардинально меняются. Клиническая картина становится стертой. Основные признаки остеомиелита хронической формы:
- боль уменьшается, приобретает ноющий характер;
- появляются свищи (каналы, соединяющие гнойный очаг с внешней средой) с гнойным отделяемым, которые часто имеют выход далеко от локализации воспаления.
Развитие остеомиелита у детей сопровождается теми же симптомами что и у взрослых, хотя патология чаще протекает в легкой форме без общей интоксикации и осложнений.
Остеомиелит позвоночника обычно вызывает локальную боль в спине с паравертебральным (по сторонам позвоночного столба) мышечным спазмом, которые не поддаются консервативному лечению. На поздних стадиях заболевание может привести к компрессии спинного мозга или нервных корешков с радикулопатией и слабостью или онемением конечностей. Повышения температуры тела, как правило, не наблюдается.
Диагностика остеомиелита
При подозрении на остеомиелит необходимо выполнить следующие лабораторные исследования:
-
общий анализ крови и определение скорости оседания эритроцитов;
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
С-реактивный белок – белок острой фазы, чувствительный индикатор повреждения тканей при воспалении, некрозе, травме. Синонимы: Анализ крови на СРБ; С-реактивный белок сыворотки крови. C-reactive Protein (CRP), quantitative; C-reactive protein test; CRP test. Краткое описание опред.
Рентгенологическое исследование считается одним из наиболее эффективных методов диагностики остеомиелита. Признаки патологии у детей видны на снимке уже на 5-й день, а у взрослых — только через 2 недели от начала воспалительного процесса.
Самым точным и эффективным видом диагностики является радионуклидная сцинтиграфия костей. С помощью специальных препаратов, накапливающихся в зоне очага болезни, можно точно выявить начало поражения кости. Однако этот метод не позволяет провести дифференциальную диагностику между инфекцией, переломами и опухолями.
Скопление гноя в мягких тканях выявляют с помощью ультразвукового исследования.
Исследование мягких тканей для выявления патологических изменений и диагностики новообразований.
Для лечения большое значение имеет биопсия очага воспаления костной ткани (аспирационная или открытая) и посев гнойного отделяемого на флору с определением чувствительности к антибиотикам и бактериофагам.
К каким врачам обращаться
Лечение остеомиелита
Консервативные методы лечения в большинстве случаев стандартизированы и включают антибиотикотерапию с определением микробного возбудителя и чувствительности микроорганизмов к антибактериальным препаратам, противовоспалительную терапию. Большое значение имеет проведение иммуномодулирующей терапии, в том числе с использованием методов квантовой гемотерапии (реинфузия обработанной ауто- и донорской крови и др.), а в отдельных случаях гормонотерапии.
В большинстве случаев хирургическое лечение остеомиелита направлено, прежде всего, на ликвидацию очага гнойно-некротического поражения, замещение остаточных полостей или образовавшихся дефектов.
При остром гематогенном остеомиелите начальная антибиотикотерапия должна включать полусинтетические пенициллины или ванкомицин и цефалоспорины 3-го или 4-го поколения. При хроническом остеомиелите, возникающем в результате распространения инфекции с окружающих мягких тканей, особенно у больных диабетом, лечение проводят с использованием препаратов, эффективных как против грамположительных и грамотрицательных аэробов, так и против анаэробной флоры.
Осложняет лечение хронической формы заболевания нарушение кровоснабжения кости, которое затрудняет проникновение антибактериальных препаратов, снижает эффективность местного иммунного ответа в костной ткани.
Некоторые симптомы остеомиелита свидетельствуют о том, что болезнь перешла в крайне тяжелую форму. Нередко единственным выходом в этой ситуации становится хирургическое вмешательство. Главная его цель — удаление гнойного очага воспаления. Это в разы ускоряет процесс выздоровления и улучшает общее самочувствие больного.
Показания к операции:
- гнойная форма заболевания;
- флегмона надкостницы;
- наличие свищей и секвестров;
- обширное гнойное течение заболевания.
В последние годы широко разрабатываются методы закрытия костной полости, такие как мышечная или кожно-мышечная пластика.
Существуют современные методы, которые позволяют сохранить имплантаты при остеосинтезе (хирургической репозиции костных отломков при помощи различных фиксирующих металлических конструкций) в случае ранних нагноений. Это вакуумная терапия, применение гидрохирургической системы, ультразвуковой кавитации и других методов обработки ран, которые дают возможность предотвратить развитие так называемой бактериальной биопленки на поверхности имплантата, что, в свою очередь, позволяет сохранить имплантат и конечность.
Остеомиелит – тяжелое заболевание, поэтому даже при своевременном и компетентном лечении есть риск возникновения нежелательных последствий. Остеомиелит кости может вызвать как самостоятельные осложнения, так и такие, которые возникают как следствие хирургического вмешательства. Некоторые из них требуют отельного лечения. Прогрессирование гнойно-воспалительного процесса приводит к разрушению костной ткани, нарушается ее кровоснабжение, что еще больше усиливает некротические процессы в кости. Заболевание может вызвать такие нарушения:
- развитие абсцессов и свищей, нарывов в мягких тканях и на коже;
- возникновение флегмоны — пропитывания мышечных волокон гноем;
- развитие артрита с образованием гнойных масс в полостях;
- самопроизвольные переломы;
- анкилозные сращивания суставных частей;
- контрактурная неподвижность мышечных соединений.
Гнойно-воспалительные поражения костей приводят к инвалидизации около 55% пациентов. Остеомиелит может закончиться потерей конечности, если речь идет о поражении руки или ноги.
В связи с особенностью локализации остеомиелитического процесса у детей в последующем может наблюдаться замедление развития костей за счет повреждения воспалительным процессом зон роста.
Разрушение позвонков, сдавливание спинного мозга может приводить к двигательным и чувствительным нарушениям.
Профилактика остеомиелита
Для снижения риска развития остеомиелита рекомендуется:
- своевременно реагировать на возникновение инфекционных процессов в организме;
- проводить лечение гайморита, кариеса, воспаления носоглотки и верхних дыхательных путей;
- осуществлять тщательную обработку ран, обморожений и ожогов, чтобы исключить возможность их инфицирования;
- вести здоровый образ жизни, избегать чрезмерных физических нагрузок, недоедания, следить за сбалансированностью питания;
- не допускать переохлаждения организма.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Неонатальный сепсис – системное инфекционное заболевание у ребенка первых 28 дней жизни, проявляющееся характерными клиническими симптомами и подтвержденное одной или несколькими положительными культурами крови (ЕРБ ВОЗ, 2002 г.).Р 36.3 Сепсис новорожденного, обусловленный другими и неуточненными стафилококками
Р 36.4 Сепсис новорожденного, обусловленный кишечной палочкой (Escherichia coli)Классификация
Этиология и патогенез
Факторы и группы риска
Диагностика
Физикальное обследование:
- нестабильность температуры;
- изменения в поведении / мышечном тонусе;
- бледность кожных покровов;
- плохо сосет, теряет в массе;
- рвота / диарея;
- тахикардия.- лейкоцитарный индекс (ЛИ - сумма молодых форм нейтрофильных лейкоцитов, деленная на общую сумму молодых и зрелых нейтрофильных лейкоцитов) > 0,2-0,3;
Инструментальные исследования
Рентгенография органов грудной клетки и люмбальная пункция (ЛП) при наличии показаний (цитоз > 20/3, белок > 1 г/л):1. Показания к ЛП: симптомы сепсиса + любой из симптомов менингита (выбухание родничка, любые неврологические симптомы и рвота) + лейкоцитов < 5 тыс. или >30 тыс. в 1-е сутки жизни или > 20 тыс. со 2-х суток жизни, или ЛИ > 0,4, или СРБ > 10 мг/100 мл, или ≥ 2 лабораторных показателя с явным отклонением от нормы.
2. У новорожденных с массой тела при рождении менее 1500 г с наличием симптомов сепсиса – люмбальная пункция рекомендуется в комплексном обследовании на сепсис.
Лечение
Цели лечения: улучшить диагностику и исходы, а также проведение своевременной адекватной терапии сепсиса.
3. Настоящая беременность с положительным результатом на СГБ (за исключением планового кесарева сечения при отсутствии родовой деятельности).
Алгоритм оказания помощи младенцам, рожденным матерями с вышеперечисленными факторами:
АБП* ≥ 4 час после введения АБ роженице.
** Факторы риска: СГВ+, хориоамнионит, длительность безводного периода > 18 час., температура у матери в родах ≥ 38ºС, гестационный возраст < 37 недель.
– цефалоспорины третьей генерации дополнительно используются при подозрении или при подтвержденном диагнозе менингита.
Общие принципы организации помощи новорожденному с сепсисом:
3. Проводить мониторинг жизненно важных функций (ЧД и тяжесть ДР, ЧСС, температура тела младенца; диурез; по возможности – SpO2, АД).
9. При наличии признаков улучшения в течение 3-х дней – продолжить антибактериальную терапию до конца 10 дня.
10. При отсутствии признаков улучшения или при ухудшении состояния новорожденного после 3-го дня лечения:
- при их отсутствии – назначить цефотаксим вместо ампициллина и продолжить лечение (цефотаксим + аминогликозид), в течение 7 дней после появления симптомов улучшения;
- решить вопрос о переводе ребенка в стационар третьего уровня или в отделение патологии новорожденных детской больницы.
11. После 12 часов лечения антибиотиками или как только состояние ребенка начнет улучшаться – попробовать приложить его к груди матери или использовать альтернативный метод кормления сцеженным материнским молоком.
13. После прекращения антибактериальной терапии наблюдать за ребенком в течение как минимум 24 часов. Если в течение этого времени состояние ребенка удовлетворительное и у него нет других проблем – выписать домой.
- учесть результаты бактериологического исследования крови и, в случае несоответствия, внести изменения в проводимую терапию.
Дальнейшее ведение: нет.
Индикаторы эффективности лечения: улучшение качества жизни.
Сепсис новорожденных – генерализованная гнойно-септическая инфекция, характеризующаяся наличием первичного очага и циркуляцией инфекции в крови. Сепсис новорожденных проявляется признаками инфекционного токсикоза (температурной реакцией, вялостью, диспепсией, землистой окраской кожных покровов) и образованием гнойных метастатических очагов в различных органах (мозговых оболочках, легких, костях, печени и пр.). Диагноз сепсиса у новорожденных устанавливается на основании клинических критериев и выделения возбудителя при бактериологическом посеве крови. Лечение сепсиса новорожденных включает системную антибиотикотерапию, санацию первичного и метастатических гнойных очагов, посиндромную терапию.
![Сепсис новорожденных]()
Общие сведения
Сепсис новорожденных – общий инфекционный процесс, обусловленный попаданием условно-патогенной и гноеродной микрофлоры из локальных очагов в кровяное русло и сопровождающийся тяжелыми системными проявлениями. По данным зарубежной педиатрии, частота сепсиса новорожденных составляет 0,1-0,8%; среди недоношенных и детей с перинатальной патологией, находящихся в ОРИТ, - 14%. Неонатальная смертность, обусловленная сепсисом новорожденных, высока и стабильна – около 30-40%. Развитию сепсиса способствуют недостаточная сформированность барьерных механизмов и иммунитета у новорожденных, пограничные состояния периода новорожденности, патологическое протекание перинатального периода, сложность ранней диагностики септических состояний.
![Сепсис новорожденных]()
Причины
В настоящее время доминирующее место (около 50%) среди возбудителей сепсиса новорожденных принадлежит грамположительной флоре (главным образом, стафилококкам, гемолитическому стрептококку группы А). Чуть реже (до 40% случаев) выявляется грамотрицательная микрофлора (кишечная палочка, синегнойная палочка, клебсиелла и др.); в 10% этиологическими агентами выступает смешанная флора (часто ассоциация стафилококка с грибами Candida).
Со стороны матери факторами, способствующими бактериальной контаминации новорожденного, выступают бактериальный вагиноз, кольпиты, эндометрит. Большое значение имеет степень и характер иммуносупрессии у новорожденного, которые могут быть связаны с неполноценным питанием или приемом лекарств беременной, наследственным иммунодефицитом или ВИЧ-инфекцией. В отдельных случаях причиной вспышек сепсиса новорожденных становится несоблюдение санитарного режима в родильных или детских отделениях.
Классификация
По времени развития выделяют внутриутробный и постнатальный (ранний неонатальный и поздний неонатальный) сепсис новорожденных. Внутриутробный сепсис предполагает антенатальное или интранатальное инфицирование плода; при этом первичный гнойно-септический очаг располагается вне организма ребенка (чаще всего в его роли выступает плацентит, хорионит, хориоамнионит и т. д.). В случае постнатального сепсиса первичный гнойно-воспалительный очаг всегда располагается в организме самого новорожденного.
Ранний неонатальный сепсис новорожденных развивается в первые 4-ро суток жизни ребенка. Клинические течение заболевания обычно молниеносное, с быстрым развитием полиорганнной недостаточности, летальным исходом в 5-20% случаев. Поздний неонатальный сепсис новорожденных манифестирует на 5-й день и позднее. Характеризуется медленно прогрессирующим течением, возникновением вторичных септических очагов, 5-10%-ной летальностью.
Течение сепсиса новорожденных может быть молниеносным (3-7 дней), острым (до 4-8 недель), подострым (до 1,5-3 месяцев), затяжным (более 3 месяцев). С учетом локализации первичного септического очага и входных ворот различают: пупочный, кожный, легочный, ринофарингеальный, отогенный, риноконъюнктивальный, кишечный, урогенный, катетеризационный и др. виды сепсиса новорожденных. Сепсис новорожденных может протекать в форме септицемии или септикопиемии.
Симптомы сепсиса новорожденных
Септицемия или сепсис новорожденных без метастазов обычно развивается на фоне предшествующего мокнущего пупка, конъюнктивита, гнойничковой сыпи, опрелостей, стоматита. Предвестниками сепсиса новорожденных могут выступать вялость или беспокойство, снижение аппетита, обильные частые срыгивания, плохая прибавка в весе. В период разгара развивается температурная реакция (гипер- или гипотермия), отечный синдром или эксикоз, гипотрофия. Характерным признаком сепсиса новорожденных является грязновато-серый (землистый) оттенок кожных покровов, желтушность, мраморность кожи, сыпь.
Вследствие токсического поражения различных органов возникают гепатоспленомегалия, пневмопатия (тахипноэ, цианоз), кардиопатия (тахикардия или брадикардия, артериальная гипотензия), диспепсия, мочевой синдром (олигурия, анурия, ОПН), геморрагический синдром, надпочечниковая недостаточность. Чаще всего септицемия осложняется присоединением пневмонии, которая выступает как самостоятельное интеркуррентное заболевание.
Септикопиемия или сепсис новорожденных с гнойными метастазами характеризуется возникновением на фоне интоксикации вторичных очагов отсева в мозговых оболочках, легких, костях, печени, других органах. Чаще всего септикопиемия протекает с развитием гнойного менингита, абсцедирующей пневмонии, остеомиелита; реже – с формированием абсцесса печени, гнойного артрита, панофтальмита, медиастинита, флегмоны желудка или кишечника. В восстановительном периоде происходит санация пиемических очагов, стихание токсикоза, постепенное восстановление нарушенных функций.
Молниеносная форма сепсиса новорожденных протекает с развитием септического шока: стремительным ухудшением состояния ребенка, снижением температуры тела, брадикардией, кровоточивостью, отеком легких, острой почечной недостаточностью. Летальный исход при молниеносном течении сепсиса новорожденных наступает в течение 3-5 суток.
Диагностика сепсиса новорожденных
Диагноз сепсиса новорожденного может быть заподозрен неонатологом или педиатром на основании лихорадки свыше 3 дней или прогрессирующей гипотермии; гиперлейкоцитоза, сменяющегося лейкопенией; повышением содержания в крови маркеров инфекционного процесса (СРБ, интерлейкина-8, прокальцитонина).
Факт бактериемии при сепсисе новорожденных подтверждается путем посева крови на стерильность. Важное значение имеет выявление первичного гнойного очага и метастатических очагов, микробиологического исследование отделяемого из них (бактериологическое исследование мазка с конъюнктивы, мочи на микрофлору, соскоба/отделяемого с кожи на микрофлору, мазка из глотки, кала на дисбактериоз и т. п.).
Дифференциальная диагностика сепсиса новорожденных осуществляется с локализованными гнойно-воспалительными заболеваниями (пневмонией, медиастинитом, перитонитом, менингитом, энтероколитом), генерализованными вирусными инфекциями (цитомегалией, герпесом, энтеровирусной инфекцией) и микозами (кандидозом, аспергиллезом) и др. Для этого используются дополнительные лабораторные методы – ПЦР, ИФА, микроскопия.
Лечение сепсиса новорожденных
Терапия при сепсисе новорожденных проводится одновременно в нескольких направлениях и включает санацию септического и пиемических очагов, подавление циркуляции возбудителя в крови, коррекцию нарушенных функций.
Основу этиологического лечения сепсиса новорожденных составляет антибиотикотерапия: эмпирическая комбинированная до уточнения характера микрофлоры) и целенаправленная после получения антибиотикограммы. Противомикробные препараты вводятся внутривенно, в максимальных возрастных дозировках в течение 10-15 суток с последующей сменой. Чаще всего в клинической практике для лечения сепсиса новорожденных в различных сочетаниях используются цефалоспорины, аминогликозиды, аминопенициллины, карбапенемы и др.
С целью местного лечения гнойных очагов производится вскрытие фурункулов и абсцессов, перевязки с антибактериальными и ферментными препаратами; назначается УВЧ, СВЧ, электрофорез.
Патогенетическая терапия сепсиса новорожденных включает иммунокоррекцию (плазмаферез, гемосорбцию, введение иммуноглобулинов), проведение дезинтоксикационной терапии (внутривенной инфузии глюкозо-солевых растворов и свежезамороженной плазмы), адекватную кислородотерапию и т. д. При сепсисе новорожденных обязательно проводится мониторинг состояния жизненно-важных функций: АД, ЧСС, ЭКГ, КОС и газового состава крови, биохимических показателей (сахара крови, креатинина, электролитов), гематокрита.
В остром периоде сепсиса целесообразно пребывание новорожденных в кувезе, кормление материнским молоком, тщательный уход. В восстановительном периоде к лечению подключается гимнастика, массаж, лечебные ванны.
Прогноз и профилактика сепсиса новорожденных
Прогноз сепсиса новорожденных серьезный: летальность составляет от 30-40% до 60% среди глубоко недоношенных детей. У выздоровевших детей в отделенном периоде могут отмечаться частые ОРВИ, пиелонефрит, анемия, перинатальная энцефалопатия.
Профилактика сепсиса новорожденных включает выявление и санацию инфекций мочеполовой сферы у беременной, соблюдение противоэпидемических мероприятий медперсоналом родильных домов и отделений новорожденных, тщательный гигиенических уход за новорожденным, естественное вскармливание. Вопрос о сроках вакцинации новорожденных с сепсисом против туберкулеза и против гепатита В , проводимой в первые дни жизни, решается в индивидуальном порядке.
Уросепсис — это генерализованный неспецифический инфекционно-воспалительный процесс, вызванный проникновением в кровяное русло уроинфекционных патогенов и их токсинов. Проявляется внезапным ухудшением состояния, гипертермией, ознобами, тахикардией, олигурией, симптомами общей интоксикации, усугубляющими основную уропатологию. Диагностируется с помощью общего и биохимического анализов крови и мочи, УЗИ, КТ мочевыводящих органов, экскреторной урографии, микробиологических методов исследования. Для лечения уросепсиса проводится хирургическая санация очага инфекции в комбинации с антибактериальной, инфузионной, дезинтоксикационной, иммуномодулирующей терапией.
МКБ-10
![Уросепсис]()
Общие сведения
Впервые о лихорадочных приступах, возникших после катетеризации и операций на уретре, в 1833-1837 годах сообщили французские хирурги А. Вельпо и Ж. Сивиаль. В 1899 году были описаны острая и хроническая формы мочевой лихорадки. В настоящее время распространенность уросепсиса в индустриально развитых европейских странах достигает 16,5-33 случаев на 100 тысяч населения, показатель продолжает ежегодно увеличиваться, при этом возрастает количество заболеваний, вызванных грамположительной флорой и кандидами.
По данным российских исследований, летальность при урогенной форме сепсиса остается стабильно высокой и составляет от 35 до 65%. Заболевание больше распространено у мужчин, что связано с более частым проведением эндоскопических инвазивных вмешательств у пациентов мужского пола.
![Уросепсис]()
Причины уросепсиса
Возбудителями заболевания являются те же микроорганизмы, которые обычно высеиваются у пациентов, страдающих острыми и хроническими инфекционными болезнями мочевыделительных органов. В 79-80% случаев уросепсис вызывается грамотрицательной условно-патогенной микрофлорой, в первую очередь – кишечной палочкой, реже — протеем, синегнойной палочкой, клебсиеллой, серратией, у 10-10,5% больных — грамположительными бактериями (энтерококками, эпидермальным стафилококком), в 0,75% наблюдений — кандидами. У 9% пациентов определяются полимикробные ассоциации. По мнению специалистов в сфере урологии и нефрологии, предпосылками, способствующими генерализации уроинфекции, являются:
- Воспалительные урологические заболевания. Обычно септическое состояние осложняет уже существующий инфекционный процесс. Более чем у половины больных уросепсис развивается на фоне острого и хронического пиелонефрита, особенно их апостематозных форм. Основной для генерализации инфекции также могут стать пионефроз, карбункул почки, паранефрит, острый абсцедирующий простатит, эпидидимит, гангрена Фурнье и др.
- Уростаз. Провоцирующим фактором активного размножения патогенной флоры является нарушение естественного пассажа мочи, обусловленное ренальными и постренальными причинами. Наиболее высок риск возникновения уросепсиса у пациентов с мочекаменной болезнью и обструкцией камнем мочеточника. Застой мочи возможен при стриктурах уретры, сморщенном мочевом пузыре, мочеточниково-влагалищных свищах, других обтурационных процессах.
- Медицинские манипуляции. Распространению инфекции способствует недостаточная санация мочевыводящих путей перед урологическими вмешательствами и нарушение техники их выполнения. Уросепсис может диагностироваться после грубой катетеризации мочевого пузыря, уретроскопии, цистоскопии, трансуретральной резекции простаты, мочевого пузыря, чрескожной нефролитотомии, других диагностических и лечебных вмешательств.
- Сопутствующая патология. Условно-патогенная микрофлора чаще активируется и бурно размножается у больных сахарным диабетом, хронической печеночной недостаточностью, кардиопатологией. Снижению иммунитета способствует прием иммуносупрессивных препаратов, применяемых для лечения аутоиммунных заболеваний, злокачественных опухолей, предотвращения отторжения трансплантированной почки или других органов.
Патогенез
По результатам последних исследований в области иммунологии и генетики, при уросепсисе бактериальный агент играет роль пускового фактора, запускающего каскадную гиперергическую воспалительную реакцию. В ответ на действие микробных эндотоксинов происходит активация комплемента, стимулирующая выделение гистамина. На фоне эндотоксемии повышается активность свертывающей системы крови, усиливаются адгезивные свойства тромбоцитов и нейтрофилов, в больших количествах выделяются медиаторы воспаления, кислородные радикалы, протеазы. В конечном итоге это приводит к множественному повреждению сосудистого эндотелия с последующим развитием полиорганной недостаточности. У части больных на фоне септицемии формируются вторичные гнойные метастазы в других органах.
Классификация
При выделении различных форм уросепсиса учитывают тип возбудителя, механизм его проникновения в кровоток, фазу и особенности клинического течения септического процесса. Различают бактериальные, вирусные, грибковые варианты заболевания. При наличии источника инфекции в органах мочевыводящего тракта уросепсис называют эндогенным, при инфицировании во время инвазивных процедур — экзогенным. Наиболее значимой для прогнозирования исхода и разработки оптимальной врачебной тактики является классификация процесса по динамике нарастания и выраженности симптоматики. Существуют следующие клинические формы септического состояния:
- Бактериемический уросептический шок. Самый неблагоприятный вариант течения расстройства. Отличается молниеносным нарастанием симптомов, выраженной полиорганной недостаточностью, высокими (до 60-65%) показателями летальности. Выявляется у 9,1% пациентов.
- Острый уросепсис. Обычно проявляется 2-3 общетоксическими атаками с ознобом и выраженной гипертермической реакцией. Хорошо поддается лечению. У некоторых больных принимает затяжной характер. Диагностируется в 56,6% случаев урогенных септических процессов.
- Подострый уросепсис. Интоксикационная симптоматика менее выражена. Заболевание имеет затяжной характер без четко ограниченных атак. Ведущим клиническим проявлением является стойкая гипертермия, сохраняющаяся до 2-3 месяцев. Определяется у 30% больных.
- Хронический уросепсис. Встречается у 4,3% пациентов. Не имеет острого периода. Симптоматика нарастает постепенно или проявляется волнообразно в виде обострений. Температура обычно повышается до субфебрильных цифр. Часто возникает почечная недостаточность.
Септический процесс развивается поэтапно и может быть стабилизирован на любой стадии. Начальная токсемическая фаза уросепсиса (синдром системной воспалительной реакции) характеризуется циркулированием в крови бактериальных эндотоксинов и развитием гиперергического воспаления. В септицемической фазе отмечается бактериемия, которая в дальнейшем может осложниться формированием гнойных метастазов (фаза септикопиемии).
Симптомы уросепсиса
Основными клиническими проявлениями молниеносной и острой форм заболевания являются резкое ухудшение состояния больного, длительно страдающего урологическим заболеванием либо перенесшего инвазивное вмешательство на мочевыводящих органах, высокая температура тела, сильный озноб, судороги, значительная тахикардия. Прогностически неблагоприятным симптомом считается гипотермия ниже 35,5° С. При уросепсисе часто наблюдается нарушение оттока мочи, уменьшение ее количества. Появляются и нарастают признаки общей интоксикации в виде головных болей, слабости, тошноты.
При присоединении сосудистых нарушений отмечается падение артериального давления, побледнение кожных покровов, оглушенность, спутанность, потеря сознания, мелкоточечные кровоизлияния. Для подострой и хронической форм уросепсиса характерен длительный субфебрилитет, который периодически можно сменяться кратковременными подъемами температуры до фебрильных цифр. У таких пациентов на фоне клинической симптоматики основного урологического расстройства сильно выражены интоксикационные астеновегетативные нарушения — быстрая утомляемость, слабость, головокружения, потливость, сердцебиение.
Осложнения
При стремительном прогрессировании симптомов, неадекватной терапии, нарастании коагулопатических расстройств уросепсис осложняется ДВС-синдромом. У 58,7% пациентов выявляется почечная недостаточность, у 55,5% появляются метастатические гнойные очаги в различных органах, у 42,2% поражается печень — возникает токсический гепатит, острая печеночная недостаточность, гепаторенальный синдром. В 14,8% случаев наблюдаются кровотечения разной локализации, в том числе из стрессовых язв желудка. На фоне полиорганной недостаточности повышается риск развития респираторного дистресс-синдрома, тяжелой энцефалопатии вплоть до септического психоза и мозговой комы. Уровень смертности при тяжелых септических процессах достигает 65%.
Диагностика
О возможном начале уросепсиса свидетельствует связь общетоксической реакции с предшествующим урологическим заболеванием или инвазивным вмешательством на органах мочевыделительной системы. Диагностический поиск направлен на выявление признаков системного воспаления, первичного инфекционного очага, определение возбудителя инфекционного процесса и его чувствительности к антибиотикам, оценку функциональной состоятельности почек. Рекомендованными методами обследований при подозрении на уросепсис являются:
- Общий анализ мочи. При наличии бактериальной уроинфекции определяется лейкоцитурия, бактериурия, возможна протеинурия. У пациентов, которые страдают мочекаменной болезнью, при микроскопии выявляют кристаллы солей (оксалатов, фосфатов, уратов). Присутствие неизмененных эритроцитов может указывать на травматическое повреждение слизистых при эндоскопии.
- Общий анализ крови. О развитии уросепсиса свидетельствуют выраженные воспалительные изменения показателей. Диагностически значимым является лейкоцитоз до 12х10 9 /л и более, лейкопения менее 4х10 9 /л, выявление более 10% незрелых форм лейкоцитов. СОЭ обычно ускоряется до 20 мм/ч и выше. При тяжелом течении снижаются уровни тромбоцитов и лимфоцитов.
- Сонография. УЗИ забрюшинного пространства позволяет обнаружить морфологические изменения почечной паренхимы, конкременты, обструкцию, скопления гноя. Преимуществами сонографии являются неинвазивность и возможность использования в качестве скринингового метода диагностики уропатологии. При необходимости УЗИ дополняют УЗДГ почек.
- Контрастная рентгенография. На основании данных о естественном пассаже рентгеноконтрастного вещества по мочевыводящему тракту оценивают особенности строения и функциональную активность почечной паренхимы, определяют конкременты в чашечно-лоханочной системе. В ходе экскреторной урографии выявляют обтурацию мочеточников и другие причины застоя мочи.
- КТ-урография. Благодаря созданию послойных изображений органов и тканей КТ мочевыделительных органов позволяет визуализировать абсцессы, кисты, опухоли, расширение чашечек и лоханок, другие морфологические нарушения в почках, забрюшинном пространстве. С учетом возможного нарушения фильтрации предпочтительным является бесконтрастное сканирование.
В качестве альтернативных или дополнительных методов диагностики могут быть рекомендованы МСКТ почек, МСКТ цистоуретрография, МРТ урография. Для определения возбудителя выполняется посев мочи на микрофлору и трехкратный бактериологический посев крови. Поскольку даже при самом тщательном проведении исследования микробиологическая верификация уросепсиса возможна лишь у половины пациентов, для выявления системного воспаления оценивают содержание в сыворотке крови прокальцитонина — суррогатного маркера генерализованной инфекционно-воспалительной реакции.
Меньшей специфичностью отличается повышение концентрации С-реактивного белка, альбуминов, отдельных фракций глобулинов. Для обнаружения возможной почечной дисфункции применяют биохимический анализ крови на креатинин, азот мочевины, мочевую кислоту, калий, назначают нефрологический комплекс. Дифференциальную диагностику уросепсиса проводят с хирургическими, акушерскими септическими состояниями, перитонитом, тяжелыми формами пиелонефрита, пионефроза, паранефрита, карбункулом и абсцессом почки, эндогенными интоксикациями (уремической, раковой). Диагностику и лечение осуществляет специалист-уролог или нефролог, по показаниям назначаются консультации других специалистов.
Лечение уросепсиса
Основными задачами при урогенных септических состояниях являются элиминация возбудителя, коррекция полиорганных расстройств, восстановление гомеостаза. С учетом тяжести состояния пациента рекомендуется госпитализация в палату интенсивной терапии урологического или реанимационного отделения и соблюдение строгого постельного режима. Этиотропное лечение уросепсиса предполагает эффективную санацию инфекционного очага и проведение адекватной антибактериальной терапии. Антибиотики назначают в два этапа:
- Эмпирическая антибиотикотерапия. Осуществляется до получения результатов бактериологического исследования. Схема лечения обычно включает комбинацию цефалоспоринов IV поколения с аминогликозидами или карбапенемы. При возможном инфицировании грамположительными микроорганизмами терапию дополняют трициклическими гликопептидами.
- Целенаправленная антибиотикотерапия. После получения данных о чувствительности возбудителя уросепсиса применяют соответствующий антибактериальный препарат узконаправленного действия. Во избежание формирования терапевтически резистентных штаммов микроорганизмов противомикробную терапию продолжают до 4-6 дня нормализации температуры.
Чтобы восстановить адекватную тканевую и органную перфузию, корректировать расстройства гомеостаза, уменьшить токсемию, проводят активную инфузионную и противошоковую терапию. При значительной артериальной гипотензии и дефиците ОЦК под контролем диуреза вводят кристаллоидные и коллоидные растворы, плазмозаменители, альбумин, прямые антикоагулянты, ксантиновые ингибиторы фосфодиэстеразы, селективные β₁-адреномиметики.
Пациенту с уросепсисом обеспечивают адекватное энтеральное питание специальными сбалансированными смесями. Для усиления иммунитета назначают заместительную терапию специфическими иммуноглобулинами, используют иммуномодуляторы. Эффективность лечения существенно возрастает при хирургической санации очага инфекции не позднее двух часов после диагностирования уросепсиса. С учетом состояния пациента выполняют чрескожную пункционную или классическую открытую нефростомию.
Для нормализации пассажа мочи при обструктивных состояниях может применяться эпицистостомия, уретеролитотомия, уретеролитоэкстракция. При значительной деструкции печеночной паренхимы показана экстренная нефрэктомия. С детоксикационной целью в предоперационном периоде и после операции рекомендованы экстракорпоральные методы: плазмаферез, плазмосорбция, гемофильтрация, гемодиафильтрация.
Прогноз и профилактика
Хотя при поздней диагностике и неэффективной терапии уросепсис характеризуется высокой вероятностью летального исхода, выявление расстройства на стадии токсемии позволяет снизить смертность с 65% до 7,5%. Профилактика основана на грамотной санации очагов уроинфекции, устранении обструкции мочевыводящих путей, проведении превентивной антибиотикотерапии перед диагностическими и лечебными урологическими вмешательствами, соблюдении техники выполнения медицинских процедур. Важную роль в предупреждении уросепсиса играют контроль своевременного опорожнения мочевого пузыря, снижающий риск избыточного накопления патогенов, укрепление иммунитета, исключение переохлаждений.
2. Уросепсис - актуальная проблема современной урологии/ Учваткин Г.В., Гайворонский Е.А. // Урологические ведомости. – 2017.
3. Этиопатогенетические аспекты развития гнойно-септических осложнений и уросепсиса у пациентов с урологическими заболеваниями до и после трансплантации почки: современный взгляд на проблему/ Крстич М., Зулькарнаев А.Б.// Альманах клинической медицины. - 2013 - №28.
4. Патогенетическое обоснование коррекции нарушений системного кровообращения в периоперационном периоде у больных с уросепсисом: Автореферат диссертации/ Адилбеков Е.А. – 2006.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Сепсис: причины появления, симптомы, диагностика и способы лечения.
Определение
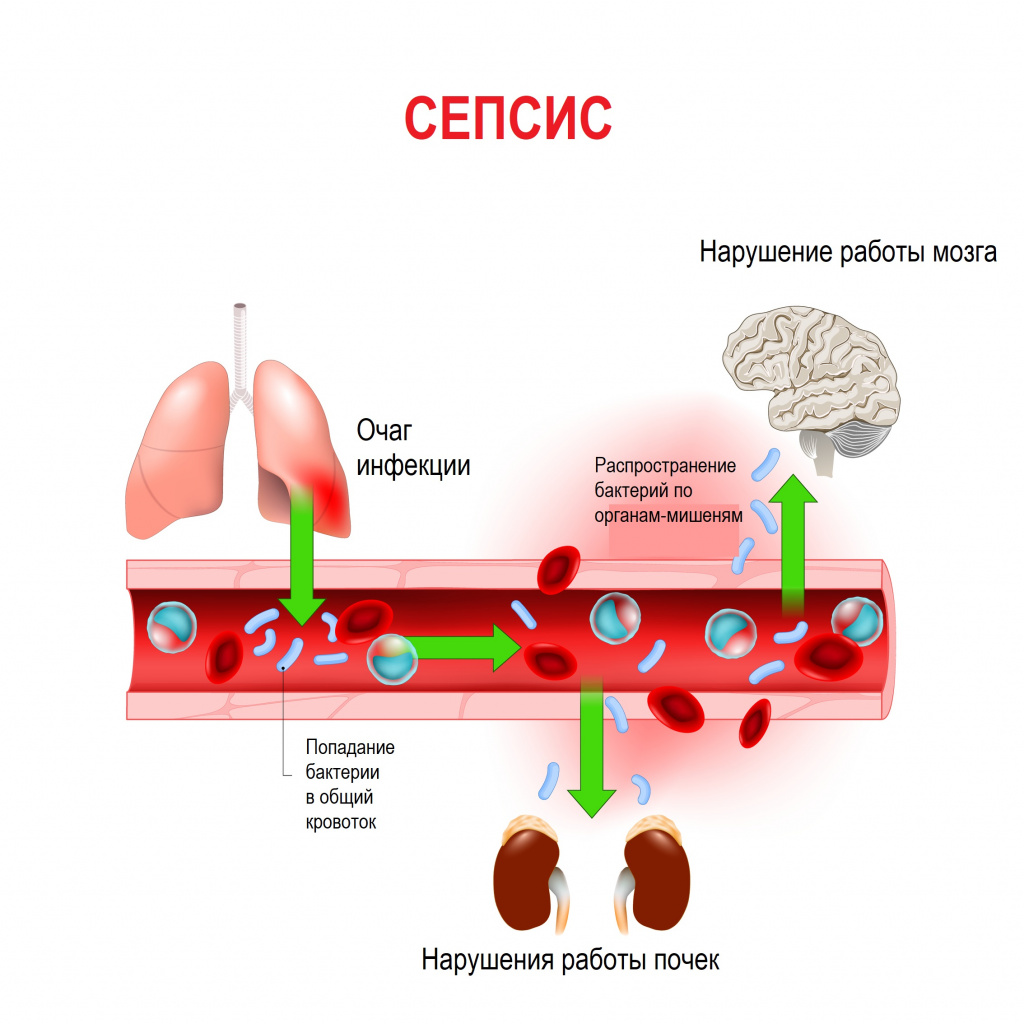
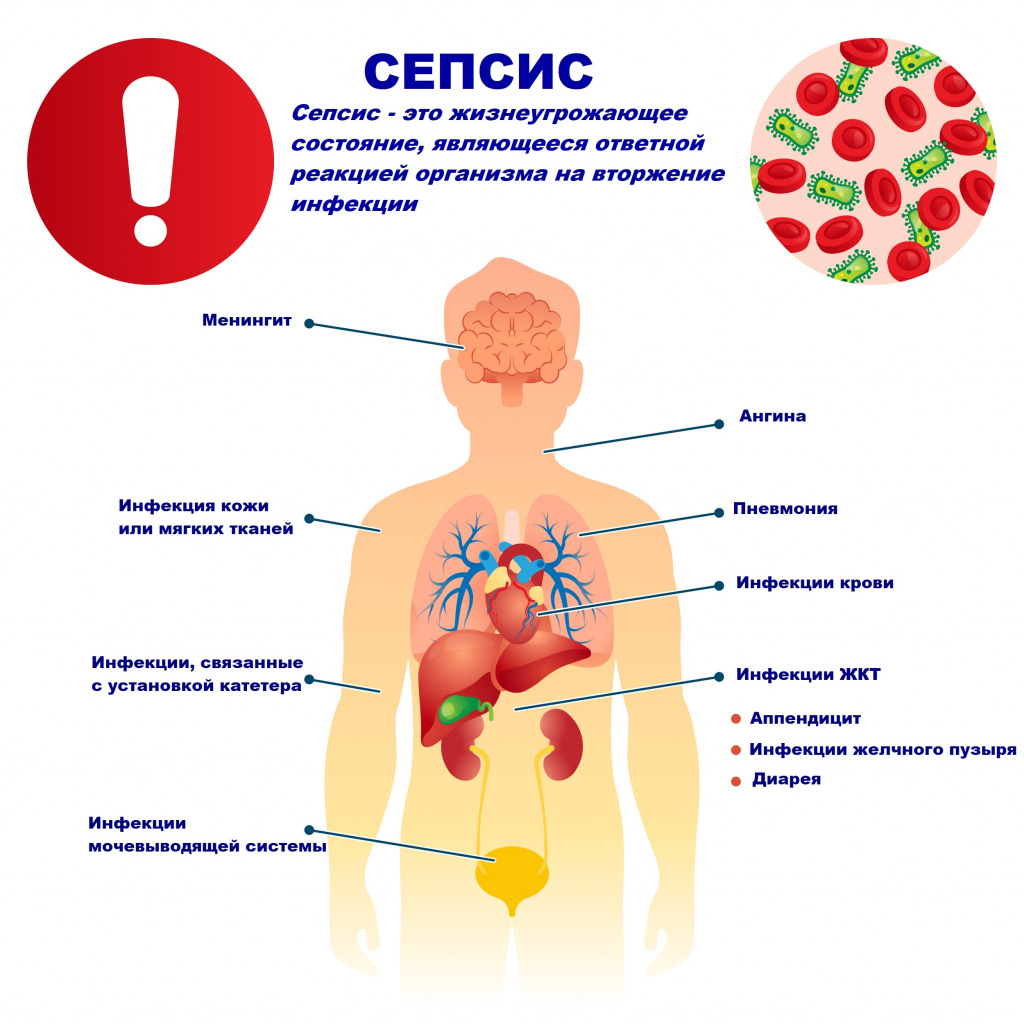
Сепсис – это патологический процесс, в основе которого лежит реакция организма в виде генерализованного воспаления на инфекцию различной природы. При сепсисе бактерии преодолевают иммунную защиту человека и распространяются из очага воспаления по всему организму. Местное воспаление, сепсис, тяжелый сепсис и септический шок – это различные формы выраженности воспалительной реакции организма на инфекционный процесс.
![Сепсис_дисфункция.jpg]()
Истинная частота возникновения случаев сепсиса остается неизвестной, однако по оценкам исследователей, во всем мире сепсис является лидирующей причиной летальности у пациентов в критическом состоянии. Согласно результатам большого европейского исследования SOAP, включившего 3147 пациентов из 198 европейских медицинских центров, сепсис развился в 37,4% случаев, а госпитальная летальность от него колебалась от 14% случаев в Швейцарии до 41% в Португалии, в среднем составив 24,1%. Данные другого крупного исследования PROGRES (12 881 больной тяжелым сепсисом в 37 странах) показали, что госпитальная летальность в среднем составила 49,6%.
Причины возникновения сепсиса
Возбудителями сепсиса могут быть бактерии, вирусы или грибы. Но чаще сепсис имеет бактериальную природу - его причиной становятся стафилококки, стрептококки, пневмококки, менингококки, сальмонеллы, синегнойная палочка и др.
В большинстве случаев патологический процесс вызывают условно-патогенные микроорганизмы, которые присутствуют на коже, слизистых оболочках дыхательного и пищеварительного трактов, мочевыводящих путей и половых органов. Иногда при сепсисе выделяют сразу 2-3 микроорганизма.
Причиной сепсиса могут стать гнойно-воспалительные заболевания кожи (абсцессы, фурункулы, флегмоны), обширные травмы, ожоги, инфекционно-воспалительные заболевания мочевыводящей системы (пиелонефрит), живота (например, гнойно-некротический деструктивный панкреатит), тяжелая ангина, гнойный отит, пневмония, инфицирование во время родов или абортов и др.
![Сепсис.jpg]()
Возможность возникновения сепсиса зависит не только от свойств возбудителя, но и от состояния иммунной системы человека - нарушения в ее работе предрасполагают к распространению инфекции. Причинами таких нарушений могут быть врожденные дефекты иммунитета, хронические инфекционные болезни (ВИЧ, гнойные процессы), эндокринные заболевания (сахарный диабет), онкологические болезни, хронические интоксикации (алкоголизм, наркомания), проникающая радиация, прием иммуносупрессоров (кортикостероидов, цитостатиков) и др.
В ответ на внедрение возбудителя вырабатываются цитокины – особые белковые молекулы, которые выполняют защитные функции сначала на местном уровне, а затем, попадая в системный кровоток, продолжают работать уже на уровне всего организма. Цитокины бывают провоспалительными и противовоспалительными. В самом начале инфекционного процесса их количество находится в равновесии. Если регулирующие системы организма не способны поддерживать это равновесие, то цитокины накапливаются в кровотоке в сверхвысоких объемах, начинают доминировать их деструктивные, разрушающие эффекты, в результате повреждается сосудистая стенка, запускается синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром) и полиорганная дисфункция. Вследствие полиорганной дисфункции печени, почек, кишечника появляются новые повреждающие факторы (лактат, мочевина, билирубин и др.), которые усиливают деструктивные процессы. При ДВС-синдроме в сосудах микроциркуляторного русла образуются множественные тромбы в сочетании с несвёртываемостью крови, приводящей к множественным кровоизлияниям.
Классификация заболевания
В зависимости от локализации входных ворот и первичного очага сепсис подразделяют на:
- перкутанный (чрескожный) – развивается при попадании возбудителя в организм через поврежденный кожный покров (ранки, царапины, фурункулы и др.);
- акушерско-гинекологический – развивается после родов и абортов;
- оральный (одонтогенный и тонзиллогенный) – развивается в результате первичной инфекции в полости рта;
- оториногенный – развивается в результате распространения инфекции из полости уха и/или носа;
- пневмогенный – при наличии инфекционного очага в нижних дыхательных путях;
- хирургический;
- урологический;
- пупочный – развивается у новорожденных вследствие проникновения инфекционных агентов в кровь через пупочную ранку;
- криптогенный (идиопатический, эссенциальный, генуинный) – сепсис неизвестного происхождения: первичный очаг гнойного воспаления неизвестен.
- молниеносный сепсис,
- острый сепсис,
- подострый сепсис,
- хронический сепсис (хрониосепсис).
По клиническим признакам:
1. Синдром системного воспалительного ответа (ССВО) – системная реакция организма на воздействие различных сильных раздражителей (инфекции, травмы, операции и др.) характеризуется двумя или более признаками:
- температура тела ≥ 38°С или ≤ 36°С;
- частота сердечных сокращений (ЧСС) ≥ 90 ударов в минуту;
- частота дыхания (ЧД) > 20 в минуту или гипервентиляция (РаСО2 ≤ 32 мм рт. ст.);
- лейкоциты крови > 12х109 /л или < 4х109 /л, или незрелых форм >10%.
По виду и характеру возбудителя:
- аэробный сепсис,
- анаэробный сепсис,
- смешанный сепсис,
- грибковый сепсис,
- вирусный сепсис.
Клинические проявления сепсиса могут варьировать от незначительных до критических. При молниеносном течении патологическое состояние развивается бурно - за несколько часов или суток. При остром сепсисе симптомы развиваются за несколько дней. Для хрониосепсиса характерно вялое течение и наличие малозаметных изменений, формирующихся месяцами. Рецидивирующий сепсис протекает с эпизодами обострений и затуханий.
Инкубационный период после выявления ворот инфекции или первичного очага составляет от 1 до 3-5 суток. Начало сепсиса, как правило, острое, хотя иногда может быть подострым или постепенным. Интоксикация проявляется резкой слабостью, адинамией, анорексией, нарушением сна, головной болью, расстройством сознания, менингеальным синдромом (поражением оболочек головного и спинного мозга), тахикардией, артериальной гипотензией. Температура тела держится высокой, со скачками утром и вечером. Признаки интоксикации особенно выражены на высоте лихорадки. На коже у трети больных появляется геморрагическая сыпь.
Со стороны дыхательной системы наблюдаются одышка и хрипы в легких. При нарушении функции почек снижается количество выделяемой мочи (олигурия) вплоть до полного прекращения мочеиспускания (анурия), в моче появляются следы крови, гноя. Наблюдается ухудшение функции печени с развитием желтухи и явлениями гепатита, увеличивается селезенка. Повреждение органов ЖКТ проявляется нарушением пищеварения, отсутствием аппетита, язык сухой, обложенный, нередко наблюдаются упорные септические поносы, тошнота и рвота. Метастазирование возбудителя из первичного очага с образованием вторичных очагов инфекции может приводить к инфаркту легкого, гангрене легкого, гнойному плевриту, эндокардиту (поражению внутренней оболочки сердца), воспалению сердечной мышцы (миокардиту), воспалению околосердечной сумки (перикардиту), гнойному циститу, абсцессам мозга и воспалению оболочек мозга (гнойному менингиту), гнойным артритам, флегмонам и абсцессам в мышцах.
Недостаточность функции одного органа длительностью более суток сопровождается летальностью до 35%, при недостаточности двух органов – 55%, при недостаточности функции трех и более органов летальность к четвертому дню возрастает до 85%.
Производят посевы крови, мочи, ликвора, мокроты, гнойного экссудата из элементов сыпи, абсцессов, пунктатов плевры, суставов и других септических очагов. Посевы делают многократно, чтобы определить чувствительность к максимальному количеству антибиотиков. Используется также обнаружение антигенов в крови методом ИФА и определение генома возбудителя методом ПЦР.
Одним из наиболее специфичных и чувствительных маркеров бактериальной инфекции служит прокальцитониновый тест. Прокальцитонин – один из основных маркёров системного воспаления, вызванного бактериями.
Синонимы: Анализ крови на прокальцитонин; ПКТ. Procalcitonin; PCT. Краткая характеристика определяемого вещества Прокальцитонин Прокальцитонин является прогормоном кальцитонина, состоящим из 116 аминокислот с молекулярной массой 14,5 кDa. Биосинтез прокальцитонина в физиологических условиях прои.
Читайте также: