Некротизированная инфекция мягких тканей
Обновлено: 23.04.2024
ОБИККС (ABSSSI) ─ это комплекс бактериальных кожных инфекций. Они включают:
Стафилококковый синдром ошпаренной кожи Стафилококковый синдром ошпаренной кожи Стафилококковый синдром ошпаренной кожи – это острый эпидермолиз, вызванный стафилококковым токсином. Наиболее склонны к развитию этого заболевания новорожденные и дети. Симптомами являются. Прочитайте дополнительные сведения , скарлатина Скарлатина Стрептококки – грамположительные аэробные организмы, вызывающие множество заболеваний, включая фарингит, пневмонию, инфекции ран и кожи, сепсис и эндокардит. Симптомы изменяются в зависимости. Прочитайте дополнительные сведения , и токсический шок Синдром токсического шока (СТШ) Синдром токсического шока обусловлен экзотоксинами стафилококков или стрептококков. Проявления включают высокую температуру, гипотонию, диффузную эритематозную сыпь и полиорганную недостаточность. Прочитайте дополнительные сведения являются кожными последствиями бактериальных инфекций.
Первичными патогенами при ИКМТ являются стрептококки (Streptococcus Стрептококковые инфекции Стрептококки – грамположительные аэробные организмы, вызывающие множество заболеваний, включая фарингит, пневмонию, инфекции ран и кожи, сепсис и эндокардит. Симптомы изменяются в зависимости. Прочитайте дополнительные сведения ) и стафилококки (Staphylococcus Стафилококковые инфекции Стафилококки – грамположительные аэробные микроорганизмы. Staphylococcus aureus наиболее патогенный; как правило, он вызывает инфекции кожи, может вызывать пневмонию, эндокардит. Прочитайте дополнительные сведения ) , включая метициллин-резистентный Staphylococcus aureus (МРЗС). МРЗС ─ широко распространенный патоген в США. Однако в других частях земного шара доля случаев, связанных с МРЗС, существенно отличается. Поскольку МРЗС может быть устойчив к ряду антибиотиков, рекомендуемые антибиотики для лечения бактериальной инфекции кожи и мягких тканей в значительной степени зависят от показателей распространенности и резистентности МРЗС на местах.
Руководство по диагностике и лечению инфекционных заболеваний кожи и мягких тканей Американского общества инфекционных болезней (The Infectious Diseases Society of Americ [IDSA] guidelines for the diagnosis and management of skin and soft tissue infections) рекомендует, чтобы лечение от легкой до умеренной негнойной формы ОБИККС производилось бета-лактамом или клиндамицином для ограничения распространения стрептококков. Распространение МРЗС следует предполагать также у пациентов с дополнительными рисками (например, после травмы, с подозрением на назальное носительство МРЗС или получающих внутривенные инъекции лекарств). Гнойные ОБИККС считаются тяжелыми, если у пациентов есть признаки системной токсичности (например, лихорадка, тахикардия, тахипноэ, бред, лейкоцитоз). В таком случае рекомендуется использовать окраску по Грамму, бактериальный посев и антибиотикотерапию. Обычно антибиотиком выбора является ванкомицин. Однако возможны несколько альтернативных вариантов
Дополнительная информация
Ниже следуют англоязычные ресурсы, которые могут быть информативными. Обратите внимание, что The manual не несет ответственности за содержание этих ресурсов.
Рекомендации по лечению инфекций кожи и мягких тканей (2018): Консенсусная конференция Всемирного сообщества экстренной хирургии (WSES) и Европейского сообщества хирургических инфекций (SIS-E)

Клостридиальные инфекции мягкой ткани включают целлюлит, миозит и клостридиальный мионекроз. Эти нарушения обычно являются следствием травмы. Симптомы могут включать отек, боль, эмфизему с крепитацией, неприятный запах эксудата, изменение цвета кожи, может прогрессировать до шока, почечной недостаточности и в ряде случаев приводить к смерти. Диагноз ставится на основании осмотра, запаха, окраски по Граму и подтверждается при посеве на культуры. Лечение – пенициллин и хирургическая санация. Иногда полезен кислород под повышенным давлением.
Клостридиальные инфекции мягких тканей могут возникнуть как после травмы, так и спонтанно. Они, как правило, приводят к накоплению газов в мягких тканях.
Clostridium perfringens – наиболее распространенная разновидность при этом заболевании.
Клостридиальная инфекция мягких тканей обычно развивается в течение часов или дней при серьезных размозженных ранах конечностей либо проникающих травмах, что создает анаэробные условия и приводит к девитализации тканей. Присутствие инородного материала (даже стерильного) заметно увеличивает риск клостридиальной инфекции. Заражение может также произойти в операционных ранах, особенно у пациентов с основным окклюзионным заболеванием сосудов.
Изредка возникают спонтанные случаи заболевания, вызванные, как правило, бактериемией C. septicum, микроорганизмы поступают из скрытой перфорации толстой кишки у пациентов с раком толстой кишки, дивертикулитом или ишемией кишечника. Поскольку C. septicum является аэротолерантным, инфекция может широко распространяться на неповрежденную кожу и мягкие ткани. Сопутствующая нейтропения, независимо от причины, предрасполагает к бактериемии C. septicum, что приводит к плохому прогнозу; прогноз хуже, если имеется внутрисосудистый гемолиз.
В подходящих условиях (низкий потенциал сокращения окисления, низкий pH фактор), как это происходит в лишенной жизнеспособности ткани, инфекция прогрессирует быстро, от начальной раны до шока, комы и смерти в течение всего 1 дня.
Симптоматика клостридиальных инфекций мягких тканей
Клостридиальный целлюлит, локализованная инфекция в поверхностной ране, обычно наступает спустя ≥ 3 дня после травмы. Инфекция может распространяться поверхностно вдоль фасциальных плоскостей, часто с явной крепитацией и обильными пузырьками газа, но токсичность гораздо менее серьезна, чем при обширном мионекрозе, и боль минимальна. Буллы часто явные, с неприятным запахом, серозным, коричневым эксудатом. Обесцвечивание и сильный отек конечности редки. Клостридиальные инфекции кожи, протекающие на фоне нарушения кровообращения конечностей редко прогрессируют до тяжелого токсического мионекроза или выходят за линии демаркации.
Клостридиальный миозит (сопутствующая инфекция мышцы без некроза) наиболее распространен среди применяющих парентеральные препараты. Напоминает стафилококковый пиомиозит и имеет недостаточно системных признаков по сравнению с клостридиальным мионекрозом. Отек, боль и часто газ в тканях присутствуют. Инфекция распространяется быстро и может прогрессировать до мионекроза.
При клостридиальном мионекрозе (газовой гангрене) распространена изначальная тяжелая боль, иногда даже перед появлением других показателей. Место раны может быть бледным первоначально, но затем становится красным или бронзовым, часто с волдырями или буллами, а в итоге приобретает черновато-зеленый цвет. Область с плотным отеком и болезненна при пальпации. Крепитация менее очевидна на ранней стадии по сравнению с клостридиальным целлюлитом, но в конечном счете ощутима приблизительно в 80%. От ран и их отделяемого обычно имеет место неприятный запах.
При прогрессировании болезни у пациентов наблюдается интоксикация, тахикардия, бледность и гипотония. Характерны шок и почечная недостаточность. Бактериемия, иногда с выраженным гемолизом, встречается примерно у 15% пациентов с травматической газовой гангреной.
Всякий раз, когда происходит массивный гемолиз, ожидается смертность 70–100% из-за острой почечной недостаточности и сепсиса.
Диагностика клостридиальных инфекций мягких тканей
Цитобактерископия мазков, окрашенных по Граму, и посев на обогащенные питательные среды
Ранняя диагностика и терапия важны; клостридиальный целлюлит хорошо лечится, а мионекроз заканчивается летально в ≥ 40% при лечении и 100% без лечения.
Предполагается, что клостридиальные инфекции мягких тканей диагностируются на основе клинического обследования, прежде всего, на основе осмотра раны и окружающей ее области (включая запах).
Хотя локальный целлюлит, миозит и распространенный мионекроз могут клинически отличаться, их дифференцирование часто требует хирургического обследования. При мионекрозе мышечная ткань визуально некротическая; пораженная мышца матово-розовая, затем темно-красная, и, наконец, серо-зеленая или пятнисто-фиолетового цвета и не сокращается при стимуляции. Рентген может выявить место продуцирования газа, а КT и MРТ определяют степень выделения газа и некроза.

Отделяемое раны должно быть взято на посев на предмет анаэробных и аэробных организмов. Поскольку количество клостридий удваивается каждые 7 минут, анаэробные культуры Clostridia могут давать положительный результат уже через 6 часов. Однако другие анаэробные и аэробные бактерии, включая членов семейства Enterobacteriaceae и Bacteroides, Streptococcus, и Staphylococcus изолированно или в комплексе, могут вызывать тяжелый клостридиально-подобный целлюлит, обширный фасциит или мионекроз ( Некротизирующая инфекция мягких тканей Некротизирующая инфекция мягких тканей Возбудителями некротизирующей инфекции мягких тканей обычно являются аэробные и анаэробные микроорганизмы (в комбинации), вызывающие некроз подкожной жировой клетчатки, обычно затрагивающий. Прочитайте дополнительные сведения ). Кроме того, множественные раны, особенно открытые, поражаются и патогенными и непатогенными клостридиями, которые не вызывают инфекцию.
Наличие клостридий является существенным, когда
Окраска по Граму показывает их в больших количествах.
Небольшое количество полиморфноядерных нейтрофилов (ПМН) выявляется в выпотах.
Свободные глобулы жира становятся видимыми при окрашивании суданом.
Однако, если полиморфноядерные нейтрофилы в изобилии, а мазок показывает много цепочек кокков, следует подозревать анаэробную стрептококковую или стафилококковую инфекцию. Обилие грамотрицательных бацилл может указывать на инфекцию, обусловленную разновидностью Enterobacteriaceae или Bacteroides sp ( Смешанные анаэробные инфекции Смешанные анаэробные инфекции Анаэробы могут вызывать инфекцию у человека с нормальным иммунным ответом и у иммунокомпроментированных лиц. Смешанные анаэробные инфекции могут включать в себя как анаэробные бактерии одного. Прочитайте дополнительные сведения ).
Лечение клостридиальных инфекций мягких тканей
Дренирование и санация раневой полости
Пенициллин плюс клиндамицин
Когда присутствуют клинические симптомы клостридиальной инфекции (например, газ, мионекроз), обязательно быстрое, агрессивное вмешательство. Полное дренирование и санация важны так же, как и антибиотики; и то, и другое должно быть назначено незамедлительно.
При тяжелой флегмоне и мионекрозе немедленно назначают бензилпенициллина по 3–4 миллиона единиц внутривенно каждые 4-6 часов и клиндамицин внутривенно по 600-900 мг каждые 6-8 часов (который ингибирует выработку токсина). Назначение одного только клиндамицина неэффективно. Если грамотрицательные микроорганизмы выявлены или подозреваются, то к клиндамицину должен быть добавлен антибиотик широкого спектра действия (например, тикарциллин плюс клавуланат, ампициллин плюс сульбактам, пиперациллин плюс тазобактам, карбапенем). Если пациенты с аллергией на пенициллин имеют опасную для жизни клостридиальную инфекцию, можно использовать клиндамицин с метронидазолом по 500 мг в/в каждые 6 часов; если присутствуют другие организмы, следует добавить не-бета-лактамный антибиотик широкого спектра действия, такой как фторхинолон, вместе с ванкомицином для Staphylococcus aureus.
Гипербарическая оксигенотерапия может быть полезной при обширном мионекрозе, особенно в конечностях, в качестве дополнения к антибиотикам и хирургическому лечению. Гипербарическая оксигенотерапия, при условии ее проведения на ранних сроках, может спасти ткань и уменьшить смертность и заболеваемость, но она не должна препятствовать хирургической обработке раны.
Ключевые моменты клостридиальных инфекций мягких тканей
Быстро прогрессирующая инфекция развивается в течение нескольких часов или дней после травмы, особенно если это компрессионная или проникающая травма, лишающая ткань жизнеспособности, создающая анаэробную среду.
Клостридиальный целлюлит часто сопровождается минимальной болью, однако миозит и мионекроз, как правило, болезненны; крепитация из-за скопления газа в тканях типична для всех форм заболеваний.
Следует быстро дренировать и тщательно очистить рану.
Необходимо назначить пенициллин с клиндамицином.
При обширном мионекрозе следует рассмотреть применение гипербарической оксигенации (терапию кислородом), но не следует позволять процедуре отсрочить хирургическое лечение.
(Некротическая флегмона или некротический фасциит; некротическая подкожная инфекция)
, MD, MPH, University of British Columbia
- 3D модель (0)
- Аудио (0)
- Видео (0)
- Изображения (7)
- Клинический калькулятор (0)
- Лабораторное исследование (0)
- Таблица (0)








Возбудителями некротизирующей инфекции мягких тканей обычно являются аэробные и анаэробные микроорганизмы (в комбинации), вызывающие некроз подкожной жировой клетчатки, обычно затрагивающий фасцию. Это инфекционное заболевание чаще всего поражает конечности и область промежности. Пострадавшие ткани становятся красными, воспаленными и опухшими, напоминая тяжелую флегмону Флегмона Флегмона – это острая бактериальная инфекция кожи подкожных тканей, чаще всего обусловленная стрептококками или стафилококками. Симптомы и признаки – это боль, приливы жара, быстро распространяющаяся. Прочитайте дополнительные сведения , а боль развивается непропорционально клиническим результатам. Во время хирургического исследования наблюдается серый экссудат, рыхлая поверхностная фасция и отсутствие гноя. Без своевременного лечения наступает гангренизация пораженной области. Пациент остро болен. Диагноз устанавливается при сборе анамнеза и обследовании и подтверждается доказательством наличия массивного инфекционного процесса. Лечение включает антибиотикотерапию и хирургическую обработку раны. Без раннего начала агрессивной терапии прогноз плохой.
Этиология некротической инфекции мягких тканей
Существует три подтипа некротизирующей инфекции мягких тканей (НИМТ):
НИМТ. Тип I обычно появляется на торсе и в промежности в результате полимикробной инфекции, обычно включающей стрептококки группы А (например, Streptococcus pyogenes) или ассоциацией аэробных и анаэробных бактерий (например, вид Bacteroides). Эти возбудители обычно распространяются в подкожную жировую клетчатку из прилегающей язвы или очага инфекции, либо после травмы. Стрептококки могут поступать из отдаленных очагов инфекции с кровотоком. Поражение области промежности (также называемое гангрена Фурнье) обычно является осложнением недавно проведенного оперативного вмешательства, периректального абсцесса, инфицирования периуретральных желез или ретроперитонеального источника инфекции, что возникает из-за перфорированных органов брюшной полости. Больные диабетом подвержены особо высокому риску развития НИМТ I типа. При инфекциях 1 типа в мягких тканях часто образуется газ, что делает их проявление сходным с проявлением газовой гангрены (клостридиальный мионекроз Клостридиальные инфекции мягкой ткани Клостридиальные инфекции мягкой ткани включают целлюлит, миозит и клостридиальный мионекроз. Эти нарушения обычно являются следствием травмы. Симптомы могут включать отек, боль, эмфизему с крепитацией. Прочитайте дополнительные сведения ), которая представляет собой мономикробную инфекцию (1 Справочные материалы по этиологии Возбудителями некротизирующей инфекции мягких тканей обычно являются аэробные и анаэробные микроорганизмы (в комбинации), вызывающие некроз подкожной жировой клетчатки, обычно затрагивающий. Прочитайте дополнительные сведения ).

На данной фотографии показана угрожающая жизни инфекция подкожно-жировой клетчатки и мышечной ткани, вызванная стрептококками группы А, приведшая к обширному некрозу нижней части спины.
© Springer Science+Business Media

У данного пациента – некротическая подкожная инфекция с изменением цвета и отеком мошонки.
LIVING ART ENTERPRISES, LLC/SCIENCE PHOTO LIBRARY

Гангрена Фурнье - некротический фасциит промежности.
Изображение предоставлено при согласии Ноэля Арменакас, врача (Noel Armenakas, MD).

На первой фотографии слева показано предоперационное изображение тыльной поверхности правой руки с геморрагическими буллами и синюшными поражениями кожи. На второй фотографии слева видны лопнувшие пузырьки на середине руки. 3-я и 4-я фотографии показывают послеоперационные изменения с обширным некрозом кожи на тыльной стороне и мионекрозом и цианотическими изменениями основных мышц-сгибателей в средней части.
© Springer Science+Business Media
Тип II НИМТ вызывается одним возбудителем, и чаще всего бета-гемолитическим стрептококкоком группы A; второе место по распространенности среди патогенов занимает Staphylococcus aureus. Пациенты, как правило, моложе и с единичными документально подтвержденными проблемами со здоровьем, но в анамнезе может быть внутривенное введение наркотиков, травма или недавно перенесенная операция. Инфекция может быстро распространяться и вызывать системные осложнения, такие как токсический шок.
Тип III НИМТ обычно ассоциируется с водными травмами, полученными в более теплых прибрежных районах. Обычным возбудителем является Vibrio vulnificus. Инфекции типа III имеют клиническое сходство с инфекциями типа II и могут быстро распространяться.
Справочные материалы по этиологии
1. Stevens DL, Bryant AE: Necrotizing soft-tissue infections. N Engl J Med 377(23):2253–2265, 2017. doi: 10.1056/NEJMra1600673
Патофизиология некротизирующей инфекции мягких тканей
Некротизирующая инфекция мягких тканей вызывает ишемию тканей посредством обширной окклюзии мелких сосудов подкожной жировой клетчатки. Окклюзия сосудов приводит к инфаркту и некрозу ткани, что способствует росту облигатных анаэробов (например, Bacteroides) и стимулирует анаэробный метаболизм факультативных микроорганизмов (например, Escherichia coli), приводя к развитию гангрены. При анаэробном метаболизме образуются водород и азот, относительно нерастворимые газы, которые могут накапливаться в тканях подкожной жировой клетчатки.
Симптомы и признаки некротизирующей инфекции мягких тканей

Основным симптомом некротической инфекции мягких тканей является сильная боль. У пациентов с нормальной чувствительностью непропорциональная к клиническим данным боль может быть ранней подсказкой. Тем не менее, в денервированных участках в результате периферической нейропатии боль может быть минимально выражена или вовсе отсутствовать. Пораженные ткани имеют красный цвет, горячие на ощупь и отечные и быстро теряют цвет. Могут возникать волдыри, крепитация (з-за газа в мягких тканях) и гангрена. Подкожная жировая клетчатка (включая прилежащую фасцию) некротизируется, процесс быстро распространяется в окружающие ткани. Вначале мышцы могут не поражаться, но по мере прогрессирования заболевания могут быть вовлечены в патологический процесс. Пациенты остро больны, отмечается лихорадка до фебрильных цифр, тахикардия, изменение психического статуса, варьирующего от спутанности сознания до оглушения и падение артериального давления. У больных может развиваться бактериемия или сепсис и может понадобиться агрессивная гемодинамическая поддержка. Может развиваться стрептококковый синдром токсического шока Токсический шок, вызванный стрептококками Синдром токсического шока обусловлен экзотоксинами стафилококков или стрептококков. Проявления включают высокую температуру, гипотонию, диффузную эритематозную сыпь и полиорганную недостаточность. Прочитайте дополнительные сведения .
Диагностика некротизирующей инфекции мягких тканей
Культуральное исследование крови и пораженной ткани
Диагноз НИМТ, установленный на основании данных анамнеза и клинического обследования, подтверждается при выявлении лейкоцитоза, повышенных показателей С-реактивного белка, газа в мягких тканях при рентгенографическом исследовании, получении положительных результатов исследования культуры крови и обнаружении нарушения метаболического и гемодинамического статуса.
Для выявления заболевания могут быть использованы КТ и МРТ, но лечение не следует откладывать до получения результатов визуализации.
Во время хирургического исследования наблюдается серый экссудат, рыхлая поверхностная фасция и отсутствие гноя.
Прогноз при некротизирующей инфекции мягких тканей
Для всех случаев частота летальных исходов составляет около 30%. Пожилой возраст, сопутствующие заболевания, позднее установление диагноза и начало терапии, а также недостаточная хирургическая обработка раны ухудшают прогноз.
Лечение некротизирующей инфекции мягких тканей
Хирургическая обработка раны
При необходимости ампутация
Лечение ранних стадий некротизирующей инфекции мягких тканей в основном хирургическое, которое не следует откладывать из-за диагностических исследований.
Признаки образования пузырей, экхимозы, флуктуация, крепитация и системное распространение инфекции требуют немедленного хирургического обследования и хирургической обработки раны. Первоначальный надрез следует удлинять до тех пор, пока инструментом или пальцем можно отделять кожу с подкожной жировой клетчаткой от глубокой фасции. Наиболее частой ошибкой является недостаточно обширное хирургическое вмешательство; операцию следует повторять каждые 1–2 дня, продлевая надрез с хирургической обработкой раны, которые должны стать рутинной процедурой. Лечение ран отрицательным давлением (NPWT или ТРОТ, также известная, как вакуумирование раны или VAC), при которой применяется отсасывание (вакуумирование) вакуумным насосом из раны, было использовано в качестве дополнения к уходу между перевязками с санацией раны.
Может понадобиться ампутация конечности.
Внутривенные антибиотики являются вспомогательными препаратами, обычно включающими 2 или более препарата. Эмпирический режим должен включать препараты, эффективные в отношении аэробных и анаэробных микроорганизмов. Текущие рекомендации Американского общества инфекционистов (АОИ) предлагают использовать ванкомицин, линезолид или даптомицин в сочетании с пиперациллином/тазобактамом, карбапенемом, цефтриаксоном плюс метронидазол или фторхинолоном плюс метронидазол. Спектр активности антибиотика должен быть сужен на основании результатов посева крови и тканей, как только они станут доступны. (См. the IDSA's practice guidelines for the diagnosis and management of skin and soft-tissue infections.)

Может понадобиться внутривенное введение больших объемов жидкости до и после хирургического вмешательства. Адъювантная гипербарическая кислородотерапия может также быть полезной, хотя доказательства ее эффективности пока не убедительны. Рекомендуется внутривенно прием иммуноглобулина для лечения стрептококкового синдрома токсического шока Токсический шок, вызванный стрептококками Синдром токсического шока обусловлен экзотоксинами стафилококков или стрептококков. Проявления включают высокую температуру, гипотонию, диффузную эритематозную сыпь и полиорганную недостаточность. Прочитайте дополнительные сведения с НИМТ.
Здравый смысл и предостережения
Если результаты исследований свидетельствуют о некротизирующей инфекции мягких тканей, необходимо без промедления назначить хирургическое лечение для тестирования, внутриочаговое введение жидкости и антибактериальную терапию. Самая распространенная ошибка –несоответствующее хирургическое вмешательство.
Ключевые моменты касательно некротизирующей инфекции мягких тканей
Некротизирующая инфекция мягких тканей (НИМТ) может развиваться из контагиозных язв или инфекции, гематогенного распространения или после травмы.
НИМТ следует подозревать у пациентов с характерными признаками или болью, непропорциональной относительно клинических данных, в частности, у пациентов с сахарным диабетом или другими факторами риска.
Во время внутривенного введения жидкости и проведения терапии антибиотиками, назначьте хирургическое лечение без задержки для проведения исследований.
Анаэробная инфекция – это инфекционный процесс, вызываемый спорообразующими или неспорообразующими микроорганизмами в условиях, благоприятных для их жизнедеятельности. Характерными клиническими признаками анаэробной инфекции служат преобладание симптомов эндогенной интоксикации над местными проявлениями, гнилостный характер экссудата, газообразующие процессы в ране, быстро прогрессирующий некроз тканей. Анаэробная инфекция распознается на основании клинической картины, подтвержденной результатами микробиологической диагностики, газожидкостной хроматографии, масс-спектрометрии, иммуноэлектрофореза, ПЦР, ИФА и др. Лечение анаэробной инфекции предполагает радикальную хирургическую обработку гнойного очага, интенсивную дезинтоксикационную и антибактериальную терапию.
МКБ-10
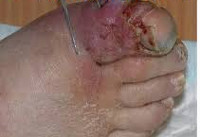
Общие сведения
Анаэробная инфекция – патологический процесс, возбудителями которого выступают анаэробные бактерии, развивающиеся в условиях аноксии (отсутствия кислорода) или гипоксии (низкого напряжения кислорода). Анаэробная инфекция представляет собой тяжелую форму инфекционного процесса, сопровождающуюся поражением жизненно важных органов и высоким процентом летальности. В клинической практике с анаэробной инфекцией приходится сталкиваться специалистам в области хирургии, травматологии, педиатрии, нейрохиругии, отоларингологии, стоматологии, пульмонологии, гинекологии и других медицинских направлений. Анаэробная инфекция может возникнуть у пациентов любого возраста. Доля заболеваний, вызываемых анаэробной инфекцией, точно не известна; из гнойных очагов в мягких тканях, костях или суставах анаэробы высеваются примерно в 30% случаев; анаэробная бактериемия подтверждается в 2-5% случаев.

Причины
Анаэробы входят в состав нормальной микрофлоры кожи, слизистых оболочек, желудочно-кишечного тракта, органов мочеполовой системы и по своим вирулентным свойствам являются условно-патогенными. При определенных условиях они становятся возбудителями эндогенной анаэробной инфекции. Экзогенные анаэробы присутствуют в почве и разлагающихся органических массах и вызывают патологический процесс при попадании в рану извне. Анаэробные микроорганизмы делятся на:
- Факультативные. Способны выживать как в отсутствии, так и в присутствии кислорода. К ним принадлежат кишечная палочка, шигеллы, иерсинии, стрептококки, стафилококки и др.
- Облигатные. Их развитие и размножение осуществляется в бескислородной среде. Облигатные возбудители делятся на две группы:
- спорообразующие (клостридии) - являются возбудителями клостридиозов экзогенного происхождения (столбняка, газовой гангрены, ботулизма, пищевых токсикоинфекций и др.);
- неспорообразующие (неклостридиальные) анаэробы (фузобактерии, бактероиды, вейллонеллы, пропионибактерии, пептострептококки и др.). В большинстве случаев вызывают гнойно-воспалительные процессы эндогенной природы (абсцессы внутренних органов, перитонит, пневмонию, флегмоны челюстно-лицевой области, отит, сепсис и др.).
Факторы риска
Условиями, благоприятствующими развитию анаэробной инфекции, являются повреждение анатомических барьеров с проникновением анаэробов в ткани и кровеносное русло, а также снижение окислительно-восстановительного потенциала тканей (ишемия, кровотечение, некроз). Попадание анаэробов в ткани может происходить при оперативных вмешательствах, инвазивных манипуляциях (пункциях, биопсии, экстракции зуба и др.), перфорации внутренних органов, открытых травмах, ранениях, ожогах, укусах животных, синдроме длительного сдавления, криминальных абортах и т. д. Факторами, способствующими возникновению анаэробной инфекции, выступают:
- массивное загрязнение ран землей;
- наличие инородных тел в ране;
- гиповолемический и травматический шок;
- сопутствующие заболевания (коллагенозы, сахарный диабет, опухоли);
- иммунодефицит.
Кроме этого, большое значение имеет нерациональная антибиотикотерапия, направленная на подавление сопутствующей аэробной микрофлоры.
Патогенез
Основными факторами патогенности анаэробных микроорганизмов служат их количество в патологическом очаге, биологические свойства возбудителей, наличие бактерий-ассоциантов. В патогенезе анаэробной инфекции ведущая роль принадлежит продуцируемым микроорганизмами ферментам, эндо- и экзотоксинам, неспецифическим факторам метаболизма. Так, ферменты (гепариназа, гиалуронидаза, коллагеназа, дезоксирибонуклеаза) способны усиливать вирулентность анаэробов, деструкцию мышечной и соединительной тканей.
Эндо- и экзотоксины вызывают повреждение эндотелия сосудов, внутрисосудистый гемолиз и тромбоз. Кроме этого, некоторые клостридиальные токисины обладают нефротропным, нейротропным, кардиотропным действием. Также токсическое влияние на организм оказывают и неспецифические факторы метаболизма анаэробов - индол, жирные кислоты, сероводород, аммиак.
Классификация
В зависимости от локализации различают анаэробную инфекцию:
- центральной нервной системы (абсцесс мозга, менингит, субдуральная эмпиема и др.)
- головы и шеи (пародонтальный абсцесс, ангина Людвига, средний отит, синусит, флегмона шеи и т. д.)
- дыхательных путей и плевры (аспирационная пневмония, абсцесс легкого, эмпиема плевры и пр.)
- женской половой системы (сальпингит, аднексит, эндометрит, пельвиоперитонит)
- брюшной полости (абсцесс брюшной полости, перитонит)
- кожи и мягких тканей (клостридиальный целлюлит, газовая гангрена, некротизирующий фасциит, абсцессы и др.)
- костей и суставов (остеомиелит, гнойный артрит)
- бактериемию.
Течение анаэробной инфекции может быть молниеносным (в течение 1 суток с момента операции или травмы), острым (в течение 3-4 суток), подострым (более 4 суток).
Симптомы анаэробной инфекции
Независимо от вида возбудителя и локализации инфекционного очага, различным клиническим формам свойственны некоторые общие черты. В большинстве случаев анаэробная инфекция имеет острое начало и характеризуется сочетанием местных и общих симптомов. Инкубационный период может составлять от нескольких часов до нескольких суток (в среднем около 3-х дней).
Типичным признаком анаэробной инфекции служит преобладание симптомов общей интоксикации над местными воспалительными явлениями. Резкое ухудшение общего состояния больного обычно наступает еще до возникновения локальных симптомов. Проявлением тяжелого эндотоксикоза служит высокая лихорадка с ознобами, выраженная слабость, тошнота, головная боль, заторможенность. Характерны артериальная гипотония, тахипноэ, тахикардия, гемолитическая анемия, иктеричность кожи и склер, акроцианоз.
При раневой анаэробной инфекции ранним местным симптомом выступает сильная, нарастающая боль распирающего характера, эмфизема и крепитация мягких тканей, обусловленные газообразующими процессами в ране. К числу постоянных признаков относится зловонный ихорозный запах экссудата, связанный с выделением азота, водорода и метана при анаэробном окислении белкового субстрата. Экссудат имеет жидкую консистенцию, серозно-геморрагический, гнойно-геморрагический или гнойный характер, неоднородную окраску с вкраплениями жира и наличием пузырьков газа. На гнилостный характер воспаления также указывает внешний вид раны, содержащей ткани серо-зеленого или серо-коричневого цвета, иногда струпы черного цвета.
Осложнения
Анаэробная инфекция часто сопровождается развитием полиорганной недостаточности (почечной, печеночной, сердечно-легочной), инфекционно-токсического шока, тяжелого сепсиса, являющихся причиной летального исхода.
Диагностика
Для своевременной диагностики анаэробной инфекции большое значение имеет правильная оценка клинических симптомов, позволяющая своевременно оказать необходимую медицинскую помощь. В зависимости от локализации инфекционного очага диагностикой и лечением анаэробной инфекции могут заниматься клиницисты различных специальностей – общие хирурги, травматологи, нейрохирурги, гинекологи, отоларингологи, челюстно-лицевые и торакальные хирурги. С целью определения патогенного агента и тяжести инфекционного процесса используют:
- Методы детекции возбудителя. Методы экспресс-диагностики анаэробной инфекции включают бактериоскопию раневого отделяемого с окраской мазка по Грамму и газожидкостную хроматографию. В верификации возбудителя ведущая роль принадлежит бактериологическому посеву отделяемого раны или содержимого абсцесса, анализу плевральной жидкости, посеву крови на аэробные и анаэробные бактерии, иммуноферментному анализу, ПЦР.
- Другие анализы. В биохимических показателях крови при анаэробной инфекции обнаруживается снижение концентрации белков, увеличение уровня креатинина, мочевины, билирубина, активности трансаминаз и щелочной фосфатазы.
- Инструментальную диагностику. Наряду с клиническими и лабораторными исследования, выполняется рентгенография, при которой обнаруживается скопление газа в пораженных тканях или полостях.
Анаэробную инфекцию необходимо дифференцировать от рожистого воспаления мягких тканей, полиморфной экссудативной эритемы, тромбоза глубоких вен, пневмоторакса, пневмоперитонеума, перфорации полых органов брюшной полости.
Лечение анаэробной инфекции
Комплексный подход к лечению анаэробной инфекции предполагает проведение радикальной хирургической обработки гнойного очага, интенсивной дезинтоксикационной и антибактериальной терапии. Хирургический этап должен быть выполнен как можно раньше – от этого зависит жизнь больного. Как правило, он заключается в широком рассечении очага поражения с удалением некротизированных тканей, декомпрессии окружающих тканей, открытом дренировании с промыванием полостей и ран растворами антисептиков. Особенности течения анаэробной инфекции нередко требуют проведения повторных некрэктомий, раскрытия гнойных карманов, обработки ран ультразвуком и лазером, озонотерапии и т. д. При обширной деструкции тканей может быть показана ампутация или экзартикуляция конечности.
Важнейшими составляющими лечения анаэробной инфекции являются интенсивная инфузионная терапия и антибиотикотерапия препаратами широкого спектра действия, высокотропными к анаэробам. В рамках комплексного лечения анаэробной инфекции находят свое применение гипербарическая оксигенация, УФОК, экстракорпоральная гемокоррекция (гемосорбция, плазмаферез и др.). При необходимости пациенту вводится антитоксическая противогангренозная сыворотка.
Прогноз и профилактика
Исход анаэробной инфекции во многом зависит от клинической формы патологического процесса, преморбидного фона, своевременности установления диагноза и начала лечения. Уровень летальности при некоторых формах анаэробной инфекции превышает 20%. Профилактика анаэробной инфекции заключается в своевременной и адекватной ПХО ран, удалении инородных тел мягких тканей, соблюдении требований асептики и антисептики при проведении операций. При обширных раневых повреждениях и высоком риске развития анаэробной инфекции необходимо проведение специфической иммунизации и противомикробной профилактики.
Некротизирующий фасциит – это гнойное воспаление фасций и подкожной клетчатки стрептококковой или полимикробной этиологии. Локальные симптомы включают отек, изменение окраски кожных покровов, характерное уплотнение подлежащих тканей, болевой синдром, который в последующем сменяется отсутствием чувствительности в зоне поражения. Наблюдается выраженная общая интоксикация, существует высокая вероятность развития сепсиса. Некротизирующий фасциит диагностируется с учетом объективных данных и результатов лабораторных исследований. Лечение – вскрытие, дренирование гнойника на фоне антибиотикотерапии.
МКБ-10
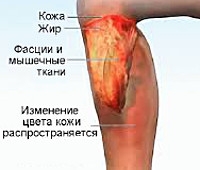
Общие сведения

Причины
Вероятность развития некротизирующего фасциита повышается при состояниях, оказывающих негативное влияние на способность организма сопротивляться воздействию инфекционных агентов, в том числе – условно-патогенных. Перечень факторов риска включает возраст старше 60 лет, сахарный диабет, истощение, злокачественные новообразования, травмы, алкоголизм, иммуносупрессивные состояния, продолжительный прием глюкокортикоидных препаратов, ожирение, период восстановления после травм и операций, болезни периферических сосудов, субкомпенсированные хронические соматические заболевания, внутривенное введение раздражающих лекарственных средств (преимущественно наркотиков). Специалисты указывают, что причинами повышения заболеваемости в последние годы являются увеличение продолжительности жизни, рост количества случаев сахарного диабета и появление высоковирулентных штаммов пиогенного стрептококка.
Патогенез
Ведущую роль в патогенезе некротизирующего фасциита играет тромбоз сосудов, питающих кожу, фасцию и подкожную жировую клетчатку. В результате образования тромбов возникает нарушение перфузии, резко снижается количество кислорода, поступающего к мягким тканям, формируются участки некроза. Из-за достаточно глубокого расположения первичного воспалительного очага патогномоничные клинические проявления на начальных стадиях отсутствуют или выражены незначительно, что обуславливает запоздалую диагностику патологии. При этом некроз распространяется вдоль фасциального футляра с большой скоростью: по наблюдениям специалистов, в течение одного часа омертвению подвергается около 2,5 см фасции. Подлежащие мышцы в процесс не вовлекаются.
Симптомы некротизирующего фасциита
Топография патологического процесса отличается значительной вариабельностью. Возможно поражение любой области тела, однако чаще всего некротические изменения выявляются в области конечностей, передней брюшной стенки, ягодиц и половых органов. Начало внезапное. Первым симптомом становятся усиливающие боли в области поражения. Возникает нарастающий отек мягких тканей. Образуется очаг нерезко выраженной эритемы, в области которого в последующем появляется геморрагическая сыпь, формируются буллы с серозным или геморрагическим содержимым, сменяющиеся участками некроза.
Вначале пальпация пораженного участка болезненна, в последующем из-за гибели нервных окончаний чувствительность утрачивается. При ощупывании определяется деревянистая плотность ткани. Часто обнаруживается крепитация, обусловленная скоплением пузырьков газа. Флюктуация нетипична, обычно выявляется только при развитии некротизирующего фасциита на фоне гнойно-воспалительного процесса. Зона поражения подлежащих тканей по площади значительно превышает размеры очага кожных изменений. Регионарный лимфангит и лимфангиит отсутствует.
Наблюдается общая гипертермия до 39-40 и более градусов Цельсия. Характерны значительные суточные колебания температуры тела. Синдром интоксикации включает общую слабость, сильную головную боль, бессонницу, заторможенность, отсутствие аппетита, тошноту, рвоту. Отмечается тахикардия, гипотония, учащение дыхания, гематурия, олигурия, выраженная дегидратация, парез кишечника. Существует вероятность образования острых язв желудка и кишечника с последующим кровотечением.
Отдельной формой некротизирующего фасциита является гангрена Фурье, локализующаяся в области половых органов и поражающая преимущественно мужчин (98% от всего числа пациентов с данным типом патологии). Симптомы появляются на фоне заболеваний половых органов (трещин, фимоза, парафимоза) и общих процессов (например, тяжелого сахарного диабета) или возникают без предшествующих изменений. Мошонка отекает, становится болезненной, гиперемированной. На коже образуется черная зона некроза, быстро распространяющаяся на промежность, переднюю брюшную стенку и область бедер. В остальном гангрена Фурье протекает с теми же симптомами, что и некротический фасциит других локализаций.
Осложнения
Осложнения включают быстро развивающийся сепсис и септицемию с возникновением инфекционно-токсического шока, грубыми нарушениями водно-солевого и кислотно-щелочного равновесия, полиорганной недостаточностью. Даже при своевременном начале лечения существует риск летального исхода. В послеоперационном периоде возможна декомпенсация имеющихся хронических заболеваний, развитие интеркуррентных инфекций, тромбозов, застойной пневмонии и других осложнений, связанных с общим тяжелым состоянием, резким ослаблением организма, нарушением деятельности всех органов и систем.
Диагностика
Из-за неспецифичности полученных данных, сложностей при проведении или длительности подготовки результатов большинства дополнительных исследований основную роль в постановке диагноза играет характерная клиническая симптоматика. Патогномоничными проявлениями некротизирующего фасциита считаются быстрая трансформация очага эритемы в пузыри или зоны некроза, деревянистая плотность подлежащих тканей как в области кожных изменений, так и за ее пределами, крепитация и интенсивный болевой синдром, сменяющийся кожной анестезией. Программа обследования включает следующие дополнительные методики:
- Визуализационные методы. Рентгенография на ранних стадиях без изменений, в последующем на снимках просматривается свободный газ. КТ и МРТ свидетельствуют о наличии свободного газа и неравномерном утолщении фасции, позволяют уточнить границы зоны поражения.
- Общие лабораторные исследования. В общем анализе крови обнаруживается лейкоцитоз, тромбоцитопения, снижение уровня гемоглобина. В биохимическом анализе крови определяется гипопротеинемия, гипоальбуминемия, гипокальциемия, гипонатриемия, повышение уровня мочевины, креатинина, мочевой кислоты, большое количество С-реактивного белка.
- Гистологическое и микробиологическое исследования. В образце ткани выявляются некротические изменения жировой клетчатки и фасции, признаки васкулита, локальные кровоизлияния. При посеве на питательные среды обычно наблюдается рост стрептококков. Возможно обнаружение бактероидов, энтеробактерий и некоторых других микроорганизмов в составе микробных ассоциаций.
Дифференциальную диагностику проводят с другими инфекционными процессами, поражающими мягкие ткани. Для целлюлита и индуративной эритемы характерно отсутствие системной токсичности, интенсивного болевого синдрома и омертвения тканей. При индуративной эритеме в анамнезе у больных нередко выявляется туберкулез. При клостридиальном мионекрозе также возникают очаги некроза в мягких тканях, но поражаются мышцы, а не фасции. Дифференцировка мионекроза и фасциита производится на основании результатов микробиологического исследования и данных, полученных во время хирургического вмешательства. При синдроме токсического шока иной этиологии отсутствуют симптомы, патогномоничные для некротического поражения фасции.
Лечение некротизирующего фасциита
Лечение заболевания осуществляют специалисты в области гнойной хирургии. При выявлении симптомов данной патологии показана экстренная госпитализация в стационар с возможностью проведения реанимационных мероприятий. Инфузионную терапию начинают на этапе транспортировки. Переливают водно-солевые растворы, вводят гормональные препараты. При дыхательных нарушениях требуется срочная интубация трахеи с искусственной поддержкой дыхания. План лечения включает:
- Оперативное вмешательство. По жизненным показаниям в кратчайшие сроки после доставки больного в хирургическое отделение производят некрэктомию. Некротизированные участки иссекают до неизменных тканей, рану оставляют открытой. В течение суток выполняют повторную ревизию. При прогрессировании патологического процесса может потребоваться ампутация.
- Антибиотикотерапию. Введение антибактериальных средств начинают с момента поступления. Вначале используют антибиотики широкого спектра действия, после определения чувствительности возбудителей выполняют коррекцию назначений.
- Системную терапию. Во время проведения операции и пребывания в отделении продолжают инфузионную терапию для коррекции кислотно-щелочного и водно-солевого баланса. Назначают витамины и микроэлементы. Для стимуляции иммунитета вводят донорскую плазму. Для ускорения заживления раны, нейтрализации эндотоксинов, устранения тканевой гипоксии производят гипербарическую оксигенацию.
Прогноз и профилактика
Прогноз при некротизирующем фасциите всегда серьезный. По различным данным, от 20 до 47% случаев заболевания заканчиваются гибелью больного. В остальных случаях в исходе могут наблюдаться нарушения со стороны различных органов, обусловленные сепсисом и острой полиогранной недостаточностью в период болезни. После удаления очагов некроза образуются обширные раневые поверхности, требующие закрытия путем проведения пластических операций. Возможно рубцевание с возникновением грубых косметических дефектов, ограничением функции конечности. Профилактика включает меры по предупреждению иммунных нарушений, исключению или минимизации других факторов риска. При подозрении на некротизирующий фасциит необходима срочная транспортировка в хирургический стационар и проведение ургентных лечебных мероприятий сразу при поступлении.
1. Некротизирующий фасциит — ургентное состояние в медицине/ Николов В.В.// Интенсивная терапия - 2015 - №2
2. Некротизирующий фасциит/ Гринев М.В., Будько О.А., Гринев К.М.// Вестник хирургии им. И.И. Грекова - 2005- ;1
4. Некротизирующий фасциит: ранняя диагностика и хирургическое лечение/ Шагинян Г.Г., Чеканов М.Н., Штофин С.Г.// Сибирское медицинское обозрение. – 2011.
Читайте также:

