Нематодозы с трансмиссивным путем передачи
Обновлено: 19.04.2024
Для цитирования: Бронштейн А.М., Малышев Н.А. Гельминтозы органов пищеварения: кишечные нематодозы, трематодозы печени и ларвальные цестодозы (эхинококкозы). РМЖ. 2004;4:208.
ММА имени И.М. Сеченова
Клиническая инфекционная больница № 1, Москва
Г ельминтозы широко распространены среди населения земного шара. Наиболее часто встречаются гельминтозы органов пищеварения, которыми, по оценкам Всемирной Организации Здравоохранения инфицирована четвертая часть населения Земли.
Патогенное воздействие гельминтов на организм человека связано не только с патологией тех органов, где они локализуются (табл. 1,2), но и с общим воздействием на организм человека. При гельминтозах отмечается уменьшение выработки инсулин–подобного фактора роста (IGF–1) и увеличение фактора некроза опухоли- a (TNT- a ), а также уменьшение синтеза коллагена, что способствует снижению аппетита, уменьшению процессов всасывания в кишечнике, задержке роста и отставанию в умственном и физическом развитии. Существенное значение имеет также хроническая постоянная микрокровопотеря, в частности, из кишечника при анкилостомидозах и через желчные протоки при трематодозах печени, при которых также происходит и потеря с желчью аминокислот [3,6,7].
Новые данные, полученные группой авторов, показали, что кишечные гельминты способствуют высвобождению Th2 цитокинов, которые подавляют цитокины Th1, в связи с чем лица, инвазированные гельминтозами, более подвержены инфицированию, в частности, заболеванию туберкулезом после инфицирования M. tuberculosis. В связи с широким распространением штаммов M. tuberculosis, резистентных к антибиотикам, эти наблюдения подтверждают необходимость более активных мероприятий по борьбе с гельминтозами, распространенными в регионах, где среди населения высокий уровень пораженности туберкулезом. [2].
В наибольшей степени патогенное влияние гельминтозов отражается на беременных и детях из бедных слоев населения с неполноценным питанием. Инвазии ведут к снижению трудовой деятельности в старших возрастах и в целом наносят существенный медико–социальный и экономический ущерб.
Для Российской Федерации в этом отношении наиболее неблагополучными являются эндемичные по гельминтозам регионы Сибири и Дальнего Востока, где среди коренных народностей отмечается высокий уровень пораженности гельминтозами органов пищеварения (описторхоз, дифиллоботриоз, клонорхоз, метагонимоз, нанофиетоз, эхинококкозы) и туберкулезом на фоне широкого распространения алкоголизма и алкогольной патологии. Под действием комплекса экстремальных климато–метеорологических условий этих регионов патогенное влияние вышеуказанных факторов существенно усиливается.
Клинические проявления паразитозов характеризуются, как правило, неспецифичностью клинической симптоматики, хроническим течением с относительно медленным нарушением функции различных органов и систем за счет кумулятивного эффекта, часто латентным течением с субклиническими проявлениями болезни. Указанные особенности маскируют их негативный эффект и создают впечатление слабой патогенности по сравнению с другими заболеваниями. Наиболее часто паразиты обитают в органах пищеварения (табл.1,2) и имитируют заболевания этих органов. Поэтому наблюдаемые в клинической практике расстройства со стороны желудочно–кишечного тракта могут являться в ряде случаев замаскированными формами паразитарных болезней.
Клинические проявления паразитарных болезней органов пищеварения в начальных стадиях болезни обычно проявляются неспецифической неврологической симптоматикой – повышенная слабость, утомляемость, раздражительность, плохой сон. В дальнейшем, по мере увеличения длительности болезни развиваются симптомы, свидетельствующие о заболеваниях органов пищеварения: снижение аппетита, тошнота, боли в животе, неустойчивый стул.
Стоимость разработки новых лекарственных средств за последние десятилетия значительно возросла, и фармацевтические фирмы не относят работы по созданию новых антигельминтиков к числу приоритетных, поскольку в центре их внимания находятся другие заболевания. Ситуация с разработкой новых препаратов усугубляется тем, что паразитарные заболевания распространены в странах с низким социально–экономическим уровнем развития. В связи с этим фармацевтические фирмы не имеют достаточных экономических стимулов в исследованиях и производстве новых противопаразитарных препаратов.
Тем не менее за последние годы в результате синтеза новых препаратов роль химиотерапии в борьбе с некоторыми паразитарными заболеваниями значительно возросла и появилась реальная возможность в снижении заболеваемости путем проведения массовых химиотерапевтических мероприятий. Появившиеся за последние годы антигельминтики получены либо путем модификации известных соединений с антигельминтной активностью, либо в результате изучения новых классов химических соединений. В таблице 3 представлены наиболее широко используемые в настоящее время антигельминтики, спектр их действия и эффективность в отношении основных гельминтозов органов пишеварения.
Использование современных препаратов позволяет успешно лечить наиболее распространенные кишечные гельминтозы. Однако следует иметь в виду, что ни один из самых современных препаратов не может гарантировать 100% излечение после применения одного курса. Эффективность одного курса лечения обычно не превышает 90%, а полное излечение, как правило, достигается при повторных курсах.
В связи с наличием множества факторов, влияющих на эффективность лечения (высокая частота реинвазий, наличие географических штаммов, резистентных к стандартным схемам химиотерапии и др.), стандартные схемы (табл. 4) в ряде случаев требуют изменений с учетом опыта, накопленного в конкретном регионе.
Результаты многочисленных исследований, проведенных в различных регионах мира, свидетельствуют, что препаратом выбора для лечения большинства кишечных нематодозов является албендазол (Немозол) [4], а для лечения трематодозов – празиквантел [1].
Трематодозы печени. Существенную медико–социальную значимость для многих регионов мира составляют трематоды печени, относящиеся к семейству Opisthorchiidae (Opisthorchis felineus, Opisthorchis viverrini, Clonorchis sinensis), заражение которыми происходит при употреблении в пищу инвазированной рыбы (табл. 2). Ориентировочно трематодозами печени поражены около 17 млн. человек, а риску заражения подвержены 350 млн. жителей 13 стран [3]. Для населения России негативный эффект описторхоза усугубляется его преимущественным распространением в северных, в том числе приполярных районах, зонах нового промышленного освоения и проживания народностей Севера, где отмечается запаздывание социально–гигиенических мероприятий, относительно низкий уровень инфраструктуры здравоохранения, высокая детская смертность, распространены другие инфекционные заболевания, алкоголизм [1].
Особый аспект составляют паразитарно–онкологические ассоциации трематодозов печени с канцерогенезом. Например, в России наибольшая частота холангиокарциномы отмечается в интенсивных очагах описторхоза в Обь–Иртышском регионе. Развитие холангиокарциномы при трематодозах печени – многофакторный процесс, в котором паразиты играют роль стимуляторов злокачественного роста [5].
Основным патологическим процессом являются хронический пролиферативный холангит и каналикулит поджелудочной железы, сопровождающийся различной степенью фиброза этих органов. В ряде случаев течение болезни может быть тяжелым – с обструкцией желчных протоков, развитием желтухи, рецидивирующего холангита, абсцессов печени, острого панкреатита и желчного перитонита.
Лечение описторхоза и клонорхоза должно быть комплексным и наряду со специфическими препаратами включать патогенетическое лечение. В острой стадии при тяжелом течении проводится десенсибилизирующая и дезинтоксикационная терапия. Клиника хронической стадии обусловлена главным образом поражением органов дуоденохоледохопанкреатической зоны, и поэтому проводится комплексная терапия в соответствии с общими принципами лечения больных гастроэнтерологического профиля [1,3]. В настоящее время единственным средством для специфической терапии описторхоза и клонорхоза является празиквантел (табл. 3,4).
Эхинококкозы. Возбудителями эхинококкозов у человека являются гельминты семейства Taeniidae: Echinococcus granulosus и E. multilocularis. Инвазия E. granulosus вызывает у человека гидатидозный эхинококкоз, а инвазия E. multilocularis – альвеолярный эхинококкоз (альвеококкоз).
Гидатидозный эхинококкоз широко распространен во всем мире, особенно в странах Южной Америки, Средиземноморских странах, включая страны Европы, в ряде стран Азии и Северной Африки. В России и сопредельных государствах эхинококкоз регистрируется повсеместно.
Длительное время болезнь может протекать бессимптомно. Клинические проявления определяются локализацией, множественностью и размерами кист, а также возможными осложнениями в виде нагноения, разрывов, желтухи и др. Локализация эхинококковых кист возможна в любых органах, при этом нередко сочетание кист в различных органах у одного больного. Наиболее часто наблюдаются эхинококкоз печени. При сдавлении кистой крупных сосудов портальной системы и желчных протоков возможно развитие портальной гипертензии и механической желтухи. Одним из тяжелых осложнений является нагноение кисты и ее инфицирование. При распространении процесса на ткани печени может развиться гнойный холангит и абсцесс печени. Существенную опасность представляет разрыв кисты. Клиническая картина при перфорации кист определяется тем, в каком направлении и в какой орган произошел разрыв кисты. В этих случаях возможно развитие анафилактического шока, гнойного перитонита и плеврита, гнойного холангита, тампонады сердца. Разрывы кист ведут к диссеминации возбудителя и развитию вторичного множественного эхинококкоза.
Альвеококкоз, вызываемый E. multilocularis, регистрируется преимущественно в альпийских районах некоторых стран Европы. В России альвеококкоз встречается чаще в Якутии, Магаданской и Камчатской областях, а также в Красноярском крае, Новосибирской, Омской и Томской областях, в Поволжье, Хабаровском крае.
Особенностью E. multilocularis является инфильтративный рост и способность метастазировать. Наиболее часто первичные поражения отмечаются в правой доле печени, реже в левой. Альвеококкоз печени длительно, иногда многие годы протекает бессимптомно. Это обусловлено медленным ростом паразита. Клинические симптомы неспецифичны и определяются главным образом объемом и локализацией поражения. Наиболее частым осложнением альвеококкоза является механическая желтуха и портальная гипертензия. Вследствие способности к инфильтративному росту возможно прорастание альвеококка в близлежащие органы – диафрагму, почки, легкие, забрюшинное пространство и образование полостей распада в толще паразитарной опухоли. Также может отмечаться метастазирование в любые органы (чаще в легкие).
Лечение эхинококкозов проводится путем хирургического вмешательства и химиотерапии. В последние годы при гидатидозном эхинококкозе печени в случаях соответствующей локализации и относительно небольших размерах кист начали успешно применять дренирование эхинококковых кист путем чрескожной аспирации и обработки полости гипертоническим раствором с последующей химиотерапией.
Показания к консервативной терапии эхинококкозов: множественные поражения печени, легких и других органов, оперативное удаление которых сопряжено с высоким риском для жизни больного или технически невозможно, а также в качестве противорецидивного лечения, особенно показанного при разрыве эхинококковых кист.
Схемы химиотерапии эхинококкозов окончательно не разработаны. В настоящее время химиотерапия эхинококкозов проводится албендазолом. Используют различные схемы лечения албендазолом (Немозол): от 10 до 20 мг на 1 кг массы тела в сутки. Длительность одного непрерывного цикла лечения колеблется от 21 дней до нескольких лет; число циклов от 1 до 20 и более; интервалы между циклами от 21 до 28 дней или непрерывно в течение нескольких лет.
Эффективность лечения албендазолом гидатидозного эхинококкоза печени и легких колеблется от 41 до 72%; рецидивы отмечаются в среднем у 25%. Изменения в эхинококковых кистах (уменьшение размеров, кальцификация и др.) – относительно медленный процесс, и оценка эффективности лечения обычно возможна не ранее, чем через 6 мес.–1 год после завершения курса албендазола.
В процессе химиотерапии могут возникнуть осложнения, связанные со снижением жизнедеятельности и гибелью паразита: нагноение кист, спонтанные разрывы, возникновение полостей распада альвеолярного эхинококкоза с последующим абсцедированием. В связи с высокими дозами албендазола, используемыми для химиотерапии эхинококкозов, и длительностью курса лечения могут развиться осложнения, связанные с гепатотоксическим действием препарата – лейкопения и агранулоцитоз, токсический гепатит, лихорадка, алопеция и др., в ряде случаев ведущие к летальному исходу. Частота возникновения гепатоцеллюлярной токсичности при применения албендазола в дозе 10 мг/кг, по данным ряда авторов, достигает 15%.
Консервативное и хирургическое лечение эхинококкозов дополняет друг друга и требует индивидуального подхода. В частности, некоторым больным с хорошей эффективностью консервативной терапии может потребоваться хирургическое лечение осложнений, а другим – необходима консервативная терапия после успешного оперативного лечения.
Заключение. Всемирная Организация Здравоохранения сообщила о первых данных, свидетельствующих о возможности развития резистентности у кишечных нематод к антигельминтикам, в частности, при некаторозе к мебендазолу и при анкилостомозе – к пирантелу. Поэтому стратегия и тактика химиотерапии должны быть направлены на то, чтобы предотвратить развитие химиорезистентности. Должны назначаться наиболее эффективные антигельминтики и таким образом, чтобы риск развития химиорезистентности был минимальным. При назначении недостаточно эффективных препаратов в популяции гельминтов происходит отбор особей, имеющих резистентность к определенным препаратам или к группе препаратов сходной химической структуры. Идеальный антигельминтик должен быть высокоэффективным, хорошо переноситься больными и иметь низкую стоимость. Его антигельминтный спектр должен включать наиболее распространенные гельминтозы человека. В настоящее время этим требованиям соответствует и стал препаратом выбора для лечения гельминтозов органов пищеварения (кишечных нематодозов, трематодозов печени и ларвальных цестодозов) албендазол (Немозол), обладающий широким спектром действия и наиболее высокой эффективностью по сравнению с другими антигельминтиками, а также возможностью лечения большинства кишечных нематодозов путем назначения одной дозы.
1. Бронштейн А.М., Лучшев В.И. Трематодозы печени: описторхоз, клонорхоз. Русский мед. журнал 1998; 3(63): 140–148
2. Beyers A, Helden P., Beyers N. Cross–regulation of Th1 and Th2 responses. The Wellcome Trust Rev 1999; 48–52.
3. Control of foodborne trematode infections. WHO Techn Rep Ser,1995, N 849.
4. Horton J. Albendazole: a review of anthelmintic efficacy and safety in humans. Parasitology 2000; 121 Suppl: S 113 – 132
5. Schistosomes, liver flukes and Helicobacter pylori. Lyon, International Agency for Research on Cancer, 1994 (IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, Vol. 61).
6. Stephensen L.S. Optimising the benefits of anthelmintic treatment in children. Paediatr Drugs 2001; 3: 495 – 508.
7. Stephensen L.S., Holland C.V., Cooper E.S. The public health significance of Trichuris trichiura. Parasitology 2000; 121 Suppl: S 73 – 95
Контактный адрес:
Александр Маркович Бронштейн
127015, Москва, ул. Писцовая 10, ГКБ № 24
Тел/факс (095) 285–2669
Нематодозы – это гельминтозы, которые вызваны круглыми червями класса Nematoda. Они возникают при заражении паразитами фекально-оральным или трансмиссивным способом. К самым распространенным представителям этой группы заболеваний относят энтеробиоз, аскаридоз, стронгилоидоз. Симптомы нематодозов включают токсико-аллергический синдром, диспепсические расстройства, органные поражения с учетом мест паразитирования половозрелых особей. Для диагностики глистной инвазии используют микроскопию кала, серологические реакции, инструментальную визуализацию органов грудной и брюшной полости. Лечение проводится этиотропными противогельминтными средствами.
МКБ-10



Общие сведения
В микробиологии описано более 24000 видов нематод, среди которых более половины способны вызывать паразитарные заболевания. Круглые черви поражают практически все отделы тела: внутренние органы, кровеносные и лимфатические сосуды, мышцы и другие соединительные ткани. В развитых странах удельный вес гельминтозов в инфектологии составляет около 4%. По данным Росстата, энтеробиоз и аскаридоз – типичные представители нематодозов – занимают 1-е и 4-е места в структуре паразитарных заболеваний в России. Число ежегодно выявляемых случаев составляет 222,7 тыс. и 18,6 тыс. соответственно.

Причины нематодозов
Представители класса Нематода имеют удлиненное веретеновидное тело с круглым поперечным сечением. Их размеры варьируются от нескольких миллиметров до 6-8 м. Наиболее крупные особи встречаются у паразитических червей, поражающих человека и позвоночных животных. Паразиты покрыты кожно-мускульным мешком, имеют первичную полость тела (схизоцель). Пищеварительная система представлена трубкой, кровеносная и дыхательная системы отсутствует.
Самыми распространенными у человека признаны такие нематодозы:
- аскаридоз (Ascaris lumbricoides);
- энтеробиоз (Enterobius vermicularis);
- стронгилоидоз (Strongyloides stercoralis);
- разнообразные филяриатозы (Filariata).
К более редким представителям этой группы гельминтозов относят трихинеллез (Trichinella), дракункулез (Dracunculus medinensis), трихоцефалез (Trichocephalus trichiurus), токсокароз (Toxocara canis).
Группы риска
Наиболее уязвимой группой риска по развитию нематодозов считаются дети дошкольного и младшего школьного возраста. Высокая частота глистных инвазий в этом периоде обусловлена неразвитостью навыков гигиены, играми в песочницах и на земле, привычкой облизывать пальцы и грызть ногти. Также к группам риска относят людей, которые посещают экзотические страны, проживают в условиях скученности и антисанитарии.
Патогенез
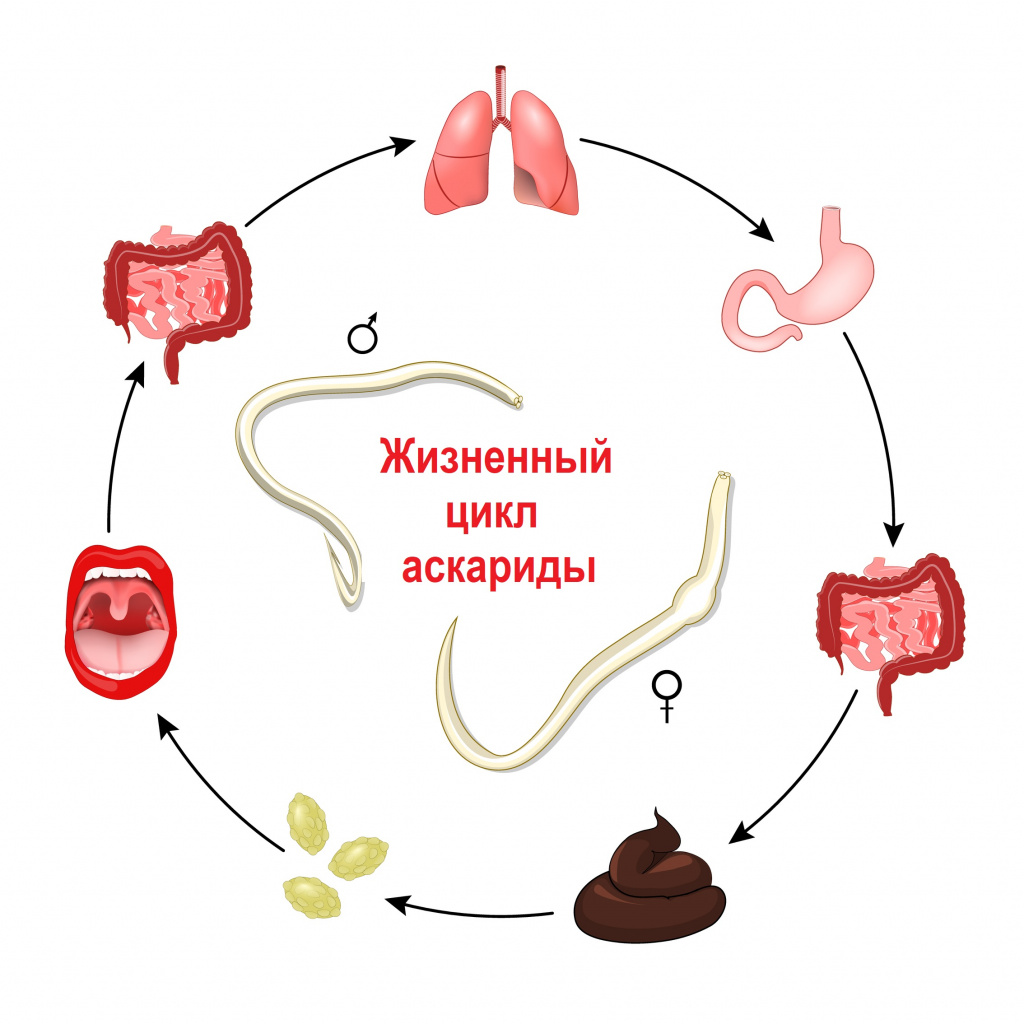
Заражение большинством видов нематодозов происходит по фекально-оральному механизму. Факторами передачи выступают загрязненная вода, зараженные продукты питания, немытые руки. Инвазионной стадией для круглых червей являются яйца или личинки, которые после заглатывания попадают в ЖКТ, где начинают паразитировать и/или внедряются через стенку кишечника в кровеносные сосуды, разносятся с током крови к другим органам.
У большой группы филяриатозов наблюдается особый жизненный цикл. Это трансмиссивные паразитозы, которые передаются человеку от мошек, москитов, слепней и других кровососущих насекомых. По системе кровеносных сосудов они достигают лимфатических узлов, подкожной клетчатки и полостей тела, где паразитируют долгие годы. Срок жизни некоторых видов филярий достигает 20 лет.
В патогенезе нематодозов выделяют иммунные реакции организма в ответ на проникновение круглых червей и локальные патоморфологические изменения в месте их паразитирования. При длительной инвазии присоединяется нарушение обменных процессов, поскольку гельминты потребляют питательные вещества хозяина. Ситуация усугубляется на фоне нервно-рефлекторного влияния нематодозов – раздражения нервных окончаний, стимулирующего вегетативные расстройства.

Симптомы нематодозов
Большинство видов гельминтозов имеют раннюю и позднюю клиническую фазу. На начальном этапе симптоматика обусловлена общим аллергическим и токсическим влиянием круглых червей на организм. Поздние стадии характеризуются синдромами поражения желудочно-кишечного тракта, гепатобилиарной системы, ЦНС и других органов. Длительность этих фаз зависит от вида паразитирующего гельминта и согласуется с его жизненным циклом.
Для ранней фазы аскаридоза, стронгилоидоза, филяриатозов и токсокароза характерны кожные высыпания по типу крапивницы, повышение температуры тела, мышечные и суставные боли. Нередко развивается бронхолегочный синдром, который проявляется сухим кашлем, одышкой, болями в груди. При нематодозах возникают головные боли, нарушения сна, повышенная раздражительность и снижение работоспособности. Подобная симптоматика продолжается несколько недель.
При переходе болезни во вторую фазу все нематодозы с фекально-оральным путем передачи проявляются расстройствами ЖКТ. Пациенты жалуются на схваткообразные боли в животе, частый и жидкий стул, урчание в кишечнике. Характерна тошнота, рвота, снижение аппетита. Вследствие мальдигестии и мальабсорбции развиваются авитаминозы, белково-энергетическая недостаточность. При энтеробиозе симптомы сопровождаются мучительным анальным зудом.
Осложнения
Тяжелым формам нематодозов подвержены пациенты с иммуносупрессией. Такая закономерность особенно типична для стронгилоидоза, гиперинвазивные и генерализованные формы которого встречаются в основном у людей с ВИЧ/СПИД. Вероятность тяжелой формы гельминтоза повышается при сочетанном заражении, например, при одновременном паразитировании власоглава и аскарид в кишечнике. Усугубить ситуацию способны присоединившиеся бактериальные кишечные инфекции.
При нелеченых нематодозах с массивной глистной инвазией есть риск развития кишечной непроходимости, механической желтухи, острого панкреатита и перитонита. При аскаридозе возможна дыхательная недостаточность и асфиксия в легочной фазе миграции возбудителя. При длительном существовании болезни наблюдаются поражения нервной системы, бессонница, менингизм и эпилептиформные судороги.
Диагностика
Основой для постановки диагноза служат клинико-анамнестические данные. На первичном приеме инфекциониста уточняется время появления симптомов и возможные факторы риска, собирается информация о недавних путешествиях пациента, выполняется стандартный физикальный осмотр. Чтобы подтвердить паразитирование конкретного вида гельминта, назначаются следующие методы диагностики:
Дифференциальная диагностика
Раннюю фазу нематодозов необходимо дифференцировать с аллергическими бронхитами, пневмонией, обострением легочного туберкулеза. Также исключают острые бактериальные инфекции, новообразования легких и средостения. В поздней фазе проводят дифференциальную диагностику с другими видами паразитозов: амебиазом, балантидиазом, тениозом и тениаринхозом. Обязательно исключают НЯК и болезнь Крона, хронический гепатит, нейроциркуляторную дисфункцию.

Лечение нематодозов
Консервативная терапия
Неосложненные формы глистной инвазии лечат в амбулаторных условиях, остальным пациентам требуется госпитализация в инфекционный стационар. Немедикаментозные меры включают щадящий режим, диету согласно степени нарушения пищеварения, поддержание водного баланса. Основу терапии при нематодозах составляют медикаменты следующих групп:
- Этиотропные средства. Для уничтожения и удаления из организма паразитов используются противогельминтные препараты, которые нарушают нервно-мышечную передачу у круглых червей либо негативно влияют на их энергетические процессы. Конкретное лекарство и схема его приема подбираются индивидуально.
- Патогенетические препараты. С учетом клинических особенностей нематодоза используют дезинтоксикационные растворы, антигистаминные препараты, глюкокортикостероиды. Для устранения дисфункции ЖКТ в поздней фазе используются энтеросорбенты, спазмолитики, пробиотики и ферментные препараты. При многократной рвоте применяются прокинетики.
При лимфедеме, вызванной филяриатозами, показана комплексная консервативная терапия. Из лекарственных средств пациентам назначают диуретики, лимфокинетики и венотоники, медикаментозную симпатэктомию раствором прокаина. Проводится эластическое бинтование конечности, медицинский лимфодренажный массаж, специальные комплексы ЛФК. Чтобы предупредить фиброзирование тканей, выполняются инъекции фибролитических ферментов.
Хирургическое лечение
Прогноз и профилактика
При своевременном и адекватном лечении у большинства пациентов достигают дегельминтизации, после чего нарушенные функции организма восстанавливаются. За выздоровевшими пациентами устанавливают диспансерное наблюдение сроком до 3 лет. Для профилактики нематодозов необходимо соблюдать стандартные меры: следить за личной гигиеной, избегать употребления воды из неизвестных источников, тщательно мыть и по возможности термически обрабатывать продукты.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Вирус в настоящее время известен как коронавирус 2 тяжелого острого респираторного синдрома (Severe acute respiratory syndrome-related coronavirus 2 - SARS-CoV-2), и вызванное им заболевание называется коронавирусной болезнью 2019 (COronaVIrus Disease 2019 - COVID-19).
Механизм передачи инфекции — это способ перемещения инфекционного возбудителя из зараженного организма в восприимчивый. Каждое инфекционное заболевание имеет свой характерный путь передачи возбудителя, который сформировался в процессе эволюции для сохранения возбудителя как вида. Механизм передачи возбудителя включает три фазы:
- Выведение возбудителя из организма хозяина в окружающую среду.
- Пребывание возбудителя в окружающей среде.
- Внедрение возбудителя в новый восприимчивый организм.
Основной механизм передачи коронавирусной инфекции – воздушно-капельный (или воздушно-пылевой), при котором возбудители локализуются в слизистой оболочке дыхательных путей и переносятся в новый организм через воздух.
При этом пути передачи возбудитель поступает во внешнюю среду при чихании и кашле с каплями жидкости и внедряется в организм человека при вдыхании воздуха, содержащего инфицированные частицы. Если частицы маленькие, они какое-то время находятся в воздухе в виде аэрозоля (капли, взвешенные в воздухе), а если частицы крупнее, то они оседают на различные поверхности на расстоянии до двух метров вокруг больного человека. Очень часто это предметы частого пользования: ручки двери, поручни в транспорте, мобильные телефоны и т.д. Прикасаясь к своему лицу человек заносит вирус на слизистые носа, рта, глаз.

Рисунок 1. Схема движения жидкого секрета (который может содержать вирусы) при кашле, чихании или разговоре.
1 – Крупные частицы, которые оседают на поверхностях на расстоянии до двух метров вокруг больного человека.
2 – Движение мелких частиц, которые некоторое время находятся в воздухе в виде аэрозоля (3)
Пребывание вируса в окружающей среде
- Нахождение вируса в воздухе В эксперименте, проведенном учеными – биологами, было обнаружено, что вирус может оставаться в воздухе в течение трех часов. Результаты других исследований говорят о том, что в большинстве реальных ситуаций вирус находится в воздухе до 30 минут, прежде чем осесть на какую-либо поверхность.
- Нахождение вируса на различных поверхностях Большие исследования, которые проводились после предыдущих вспышек коронавирусной инфекции, показали, что на стальных поверхностях некоторые из коронавирусов могут сохраняться до 4 дней даже при температуре 40°С. На бумаге, при комнатной температуре, вирус может сохраняться 4-5 дней, на стеклянных поверхностях – 4 дня, на пластике -6 дней.
На основе этих данных ученые предположили такую же устойчивость и у COVID-19.
Инкубационный период
Инкубационный период – это период времени от момента внедрения возбудителя в организм и до появления первых клинических симптомов болезни.
Для COVID-19 (на основании полученных данных) инкубационный период составляет от 2 до 14 дней, в среднем для большинства заболевших – 5,2 дня.
Длительность инкубационного периода зависит от ряда факторов:
- Вида микроорганизма
- Инфицирующей дозы (минимальное количество патогена, которое способно вызвать болезнь)
- Вирулентности (степени способности вируса заражать организм)
- Пути проникновения в организм
- От состояния организма, в который внедряется вирус
Во время инкубационного периода коронавирус проникает в эпителиальные клетки слизистой оболочки бронхолегочной системы и начинает свое воспроизведение. В процессе воспроизведения новых вирусов зараженная клетка чаще всего погибает.
Симптомов заболевания в инкубационном периоде еще нет, но в организме уже происходят патологические реакции, которые направлены на борьбу с инфекционным агентом и если этих мер защиты оказывается недостаточно, то инфекционный процесс развивается дальше.
Кто может быть заразен?
Период времени в течение которого человек заразен точно не определен, но данные некоторых исследований указывают на то, что человек с COVID-19 способен распространять вирус до появления каких-либо симптомов (за 1-3 дня до первых признаков болезни). Наиболее заразными считаются люди в момент, когда заканчивается инкубационный период и появляются симптомы заболевания.
Продолжительность выделения вируса может быть различна и зависеть от тяжести течения заболевания. На практике, если пациент находился в больнице, то он считается здоровым после двух отрицательных тестов на COVID-19, взятых с интервалом в 24 часа. При лечении в домашних условиях необходимо соблюдение трех условий:
- С момента появления симптомов прошло не менее 7 дней.
- Нет симптомов коронавирусной инфекции (кашель, одышка и др.).
- В течение трех суток температура тела не повышалась.
Базовое репродуктивное число показывает то количество человек, которых может заразить вокруг себя один заболевший. Например, базовое репродуктивное число для гриппа равно 1-2, для кори - 12-18. Для COVID-19 (по оценке китайских эпидемиологов) – около 4. Таким образом, можно сделать вывод о том, что новый коронавирус в 3-4 раза менее заразен, чем корь и в 2-3 раза более заразен, чем грипп.
Тяжесть течения заболевания, симптомы, возрастные особенности и группы риска
В феврале 2020 года китайские ученые опубликовали отчет, который был составлен на анализе более 70 тыс. случаев COVID-19. В настоящее время это самое крупное исследование.
Статистические данные этого исследования таковы:
Возрастные особенности:
Основная группа заболевших -87% - это были люди в возрасте от 30 до 79 лет, старше 80 лет - 3 % пациентов, заболевшие дети до 10 лет составляли 1%, подростки (от 10 до 19 лет) – 1% заболевших.
Основываясь на имеющейся в настоящее время информации и клиническом опыте, пожилые люди и люди любого возраста, которые имеют серьезные основные заболевания, подвержены высокому риску тяжелого течения COVID19.
Данные исследований однозначно выделяют в основную группу высокого риска тяжелого течения коронавирусной инфекции следующие заболевания:
- Гипертоническая болезнь (артериальная гипертензия)
- Ишемическая болезнь сердца
- Бронхиальная астма (средней и тяжёлой степени течения заболевания)
- Хроническая обструктивная болезнь легких (ХОБЛ) и другие заболевания легких
- Сахарный диабет
- Ожирение (ИМТ более 40)
- Хронические болезни почек, в том числе находящиеся на программном гемодиализе
- Люди с хроническими заболеваниями печени
Состояния, которые существенно утяжеляют течение COVID-19 связаны с заболеваниями, влияющими на иммунную систему человека: онкологические заболевания и проводимая химиотерапия, прием препаратов, подавляющих иммунитет (пациенты после трансплантации органов и тканей) и иммунодефицитные состояния.
Некоторые исследователи выделяют лабораторные данные, которые также в свою очередь могут повышать риск тяжелых осложнений коронавирусной инфекции. К ним относится низкое содержание лимфоцитов (лимфопения); увеличение уровня лактатдегидрогеназы и креатининфосфокиназы; повышение уровня маркеров воспаления (С- реактивного белка); изменение в системе гемостаза (удлинение протромбинового времени, повышение D- димера).
- Официальный сайт Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека .
- Kampf G, Todt D, Pfaender S, Steinmann E. Persistence of coronaviruses on inanimate surfaces and their inactivation with biocidal agents. J Hosp Infect, 2020 тMar;104(3):246-251
- Xiaobo Yang, Yuan Yu et al. Clinical course and outcomes of critically ill patients with SARS-CoV-2 pneumonia in Wuhan, China: a single-centered, retrospective, observational study. The Lancet, 2020.
- Рекомендации ВОЗ для населения. Вопросы и ответы о коронавирусной инфекции COVID-19.
- Zhou F, Yu T, Du R, Fan G, Liu Y, Liu Z, Xiang J, Wang Y, Song B, Gu X, Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet. 2020 Mar 28;395(10229):1054-1062
- Zunyou Wu, MD, PhD; Jennifer M. McGoogan, PhD. Characteristics of and Important Lessons From the Coronavirus Disease 2019 (COVID-19) Outbreak in ChinaSummary of a Report of 72 314 Cases From the Chinese Center for Disease Control and Prevention. JAMA. 2020;323(13):1239-1242.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Гельминтоз (глистная инвазия): причины появления, симптомы, диагностика и способы лечения.
Определение
Гельминтозы - болезни человека, животных и растений, вызываемые паразитическими червями (гельминтами).
Причины появления гельминтозов
В настоящее время в России встречается более 70 видов из известных 250 гельминтов, паразитирующих в организме человека. Наиболее распространены круглые черви (аскариды, острицы, трихинеллы, власоглав), ленточные черви (свиной, бычий и карликовый цепни, широкий лентец, эхинококки), сосальщики (печеночная и кошачья двуустки).
Заражение гельминтами чаще всего происходит после попадания в организм их яиц и/или личинок. В зависимости от механизма заражения и путей передачи гельминтозы подразделяются на: геогельминтозы, биогельминтозы и контактные гельминтозы. Геогельминты развиваются без промежуточных хозяев, биогельминты - с последовательной сменой одного-двух-трех хозяев, контактные гельминты передаются контактным путем.
Свиной цепень, бычий цепень, эхинококк и другие виды червей развиваются с последовательной сменой одного-двух-трех хозяев. Промежуточными хозяевами могут быть рыбы, моллюски, ракообразные, насекомые. Человек заражается этими гельминтами, употребляя в пищу продукты, не прошедшие полноценную термическую обработку:
- мясо говядины, инфицированную финнами (личинками) бычьего цепня;
- свинину, пораженную финнами свиного цепня;
- малосоленую и сырую рыбу с личинками описторхиса или широкого лентеца;
- сырую воду или обработанные этой водой овощи, фрукты.
Контактным путем - то есть при личном контакте здорового человека с зараженным, при пользовании общей посудой, предметами туалета, бельем, при вдыхании пыли в помещении, где находится зараженный человек - передаются энтеробиоз (возбудитель – острица) и гименолепидоз (возбудитель – карликовый цепень). В случае энтеробиоза часто случается самозаражение.
Гельминты определенного вида паразитируют в определенных органах, вызывая различные гельминтозы:
- в толстой кишке - свиной, бычий, карликовый цепни, нематоды (анкилостомы, аскариды, стронгилоиды), острицы, власоглав. Из просвета кишки личинки свиного цепня могут попадать в кровоток и распространяться по организму, оседая в жировой клетчатке, сосудах мышц, камерах глаза, мозге;
- в печени и желчных путях - трематоды (описторхис, клонорхис, фасциола). В печени первично располагаются эхинококковые кисты, а после их разрыва дочерние пузыри можно обнаружить в брыжейке, листках брюшины, селезенке и других органах;
- в органах дыхания - эхинококки, альвеококки, легочные сосальщики, вызывающие парагонимоз;
- в нервной системе - шистосомозы, парагонимоз, эхинококкоз и альвеококкоз;
- в органах зрения - онкоцеркоз, лоаоз, осложненные формы тениоза;
- в органах кровообращения - некатороз, шистосомозы, дифиллоботриоз;
- в лимфатической системе - филяриатозы, трихинеллез;
- в коже и подкожной клетчатке - анкилостомидоз, онкоцеркоз, лоаоз, личиночная стадия шистосомозов;
- в костной системе - эхинококкоз;
- в скелетной мускулатуре - трихинеллез, цистицеркоз мышечной ткани.
Срок жизни гельминтов в организме окончательного хозяина может быть различным, зависит от вида паразита и колеблется от нескольких недель (острицы) до нескольких лет (цепни) и десятилетий (фасциолы).
Классификация заболевания
У человека паразитируют черви двух видов:
- Nemathelminthes – круглые черви, класс Nematoda;
- Plathelminthes – плоские черви, которые включают в себя классы
- Cestoidea – ленточных червей,
- Trematoda – класс сосальщиков.
- биогельминтозы;
- геогельминтозы;
- контактные гельминтозы.
На организм человека гельминты оказывают различное воздействие:
- антигенное воздействие, когда развиваются местные и общие аллергические реакции;
- токсическое действие (продукты жизнедеятельности гельминтов вызывают недомогание, слабость, диспепсические явления);
- травмирующее действие (при фиксации паразитов к стенке кишечника происходит нарушение кровоснабжения с некрозом и последующей атрофией слизистой оболочки; могут нарушаться процессы всасывания; механическое сдавление тканей гельминтами);
- вторичное воспаление в результате проникновение бактерий вслед за мигрирующими личинками гельминтов;
- нарушение обменных процессов;
- в результате поглощения крови некоторыми гельминтами возникает анемия;
- нервно-рефлекторное влияние - раздражение гельминтами нервных окончаний провоцирует бронхоспазм, дисфункцию кишечника и т.д.;
- психогенное действие, проявляющееся невротическими состояниями, нарушением сна;
- иммуносупрессивное действие.
Для гельминтозов характерна стадийность развития. Каждая стадия характеризуется своими клиническими симптомами.
Жалобы пациентов в острой стадии:
- повышение температуры от нескольких дней до двух месяцев (субфебрильная или выше 38ºС, сопровождающаяся ознобом, резкой слабостью и потливостью);
- зудящие рецидивирующие высыпания на коже;
- локальные или генерализованные отеки;
- увеличение регионарных лимфатических узлов;
- боли в мышцах и суставах;
- кашель, приступы удушья, боль в грудной клетке, длительные катаральные явления, бронхит, трахеит, симптомы, симулирующие пневмонию, астматический синдром, кровохарканье;
- боль в животе, тошнота, рвота, расстройства стула.
Для кишечных гельминтозов характерны следующие синдромы:
- диспепсический (дискомфорт в животе, чувство переполнения после еды, раннее насыщение, вздутие живота, тошнота);
- болевой;
- астеноневротический (чувство сильной усталости, повышенная нервная возбудимость и раздражительность).
Кишечные цестодозы (тениаринхоз, дифиллоботриоз, гименолепидоз, тениоз и другие) протекают бессимптомно или с малым количеством симптомов (с явлениями диспепсии, болевым синдромом, анемией).
Трематодозы печени (фасциолез, описторхоз, клонорхоз) вызывают:
- хронический панкреатит;
- гепатит;
- холецистохолангит;
- неврологические нарушения.
Мочеполовой шистомоз проявляется появлением в самом конце мочеиспускания крови, частыми позывами к мочеиспусканию, болью во время мочеиспускания.
Альвеококкоз, цистицеркоз, эхинококкоз могут длительное время протекать бессимптомно. На позднем этапе нагноение или разрыв кист, содержащих паразитов, приводит к анафилактическому шоку, перитониту, плевриту и другим тяжелейшим последствиям.
Для заболеваний, обусловленных паразитированием мигрирующих личинок зоогельминтов, когда человек не является естественным хозяином, различают кожную и висцеральную формы. Кожная форма обусловлена проникновением под кожу человека некоторых гельминтов животных: шистосоматид водоплавающих птиц (трематоды), анкилостоматид собак и кошек, стронгилид (нематоды). При контакте человека с почвой или водой личинки гельминтов проникают в кожу. Возникает чувство жжения, покалывания или зуда в месте внедрения гельминта. Может наблюдаться кратковременная лихорадка, признаки общего недомогания. Через 1-2 недели (реже 5-6 недель) наступает выздоровление.
Висцеральная форма развивается в результате заглатывания яиц гельминтов с водой и пищевыми продуктами. В начале заболевания может быть недомогание, аллергическая экзантема (кожная сыпь). В кишечнике человека из яиц гельминтов выходят личинки, которые проникают через кишечную стенку в кровь, достигают внутренних органов, где растут и достигают 5-10 см в диаметре, сдавливают ткани и нарушают функцию органов. При расположении личинок цепней (цистицерки, ценура) в оболочках и веществе головного мозга наблюдается головная боль, признаки церебральной гипертензии, парезы и параличи, эпилептиформные судороги. Личинки также могут располагаться в спинном мозге, глазном яблоке, серозных оболочках, межмышечной соединительной ткани и др.
Исходом гельминтозов может быть полное выздоровление с ликвидацией гельминтов или развитие необратимых изменений в организме хозяина.
Диагностика гельминтоза
Диагноз гельминтоза устанавливается на основании совокупности жалоб, полученных от пациента сведений о течении болезни, данных лабораторных и инструментальных методов обследования.В острой фазе гельминтозов имеется реакция крови на присутствие гельминта в организме, поэтому рекомендованы следующие исследования:
-
клинический анализ крови: общий анализ, лейкоформула, СОЭ (с микроскопией мазка крови при наличии патологических сдвигов);
Синонимы: Общий анализ крови, ОАК. Full blood count, FBC, Complete blood count (CBC) with differential white blood cell count (CBC with diff), Hemogram. Краткое описание исследования Клинический анализ крови: общий анализ, лейкоформула, СОЭ См. также: Общий анализ – см. тест № 5, Лейкоцит.
11 случаев церебральных нематодозов наблюдались в течение 2014–2017 гг. Во всех случаях нематодозов отмечались специфические радиологические симптомы туннеля и визуализации гельминта; в 9 из 11 случаев отмечен ранее не описываемый симптом «клубка в разрез
Церебральные гельминтозы могут быть представлены как цестодами, так и нематодами. У детей за последние годы церебральные гельминтозы диагностируется все чаще, и не только в развивающихся странах [1–4].
Церебральная симптоматика гельминтозов различна, зависит от расположения гельминта (в паренхиме мозга, субарахноидальном пространстве, желудочковой системе) и характера и распространенности травматической или воспалительной иммунной реакции (при гибели паразита).
Из нейровизуализационных симптомов нематод абсолютными диагностическими критериями являются симптомы:
Ниже приводятся критерии валидности параклинической диагностики церебральных гельминтозов, правда, для плоских червей (в данном случае это пристрастие автора к определенному роду паразитов), но это положение справедливо для всего семейства гельминтов (точно так же, как принципы параклинической диагностики справедливы для любой инфекции — вирусной, бактериальной, протозойной и т. д.).
Диагностические критерии и их валидность при нейроцистицеркозе (плоские черви), предложенные Del Brutto [7, 8].
Абсолютные критерии:
А. Гистологическая демонстрация паразита в мозге.
Б. Наличие кисты со сколексом при нейровизуализации.
В. Визуализация паразита при офтальмоскопическом исследовании.Большие критерии:
А. Наличие высокоподозрительного на паразитарный генез очага поражения мозга при нейровизуализации.
Б. Позитивный серологический анализ (иммуноблот) на антипаразитарные антитела.
В. Разрешение внутричерепного кистозного образования после лечения альбендазолом или празиквантелом.Малые критерии:
А. Наличие подозрительного на паразитарный генез очага поражения мозга при нейровизуализации.
Б. Наличие клинической симптоматики, подозрительной на цистицеркоз.
В. Позитивный анализ ликвора (ELISA) на паразитарный антиген или антипаразитарные антитела.
Г. Наличие цистицерка вне нервной системы.Эпидемиологические критерии:
А. Проживание в эндемичном районе.
Б. Частое посещение эндемичного района.
В. Наличие домашнего контакта с паразитарной инфекцией.Степени диагностической валидности (достоверности) критериев:
А. Наличие одного абсолютного критерия.
Б. Наличие двух больших и одного эпидемиологического критерия.А. Наличие одного большого и двух малых критериев.
Б. Наличие одного большого, одного малого и эпидемиологического критерия.
В. Наличие трех малых и одного эпидемиологического критерия.Анализируя приводимые диагностические критерии, несложно сделать вывод, что нейровизуализационное обнаружение характерного для гельминтов симптома является абсолютным критерием для достоверного диагноза и прочих критериев уже не требуется.
Серологическая диагностика гельминтоза осуществляется только методами иммуноблота и ELISA. Чувствительность данных методик достаточно низкая — не более 50% (о банальном иммуноферментном методе речь вообще не идет) [2, 7–10]. Высокую чувствительность и специфичность показал метод полимеразной цепной реакции (ПЦР) к паразитарным антигенам в ликворе, но в РФ отсутствует ПЦР на гельминты и антигеном служит митохондриальная ДНК только погибшего паразита, но не живого.
Материал и методы исследования
Методы исследования: основной — МРТ (Тoshiba Aquilon 1,5 Т, Mаgnetom Vision 1,5 Т, GENSOV 1,5 Т); дополнительные — ЭЭГ; стандартный анализ ликвора; рентгенография легких; УЗИ внутренних органов; исследование прозрачных сред глаза и глазного дна; общий анализ крови; исследования кала на яйца глист.
Полученные результаты
Пациент Д., 9 лет, находилась в ДКБ № 9 с 27.07.16 по 03.09.16.
Анамнез жизни — без особенностей.
Проводится дифференциальный диагноз между парциальными эпилептическими приступами и преходящими нарушениями мозгового кровообращения.
При поступлении: в соматическом и неврологическом статусе патологии не выявлено. Общий анализ крови, мочи, биохимия крови — патологии не выявляют. Анализ кала на простейшие, яйца глист — без патологии.
Осмотр окулиста — без патологии.
С момента установления (по данным клиники и МРТ) диагноза ОНМК пациенту проводится лечение в соответствии со стандартами медицинского обязательного страхования, в том числе с профилактикой тромбообразования антикоагулянтами.
А что надо делать в действительности? Проводить на фоне парентерального введения кортикостероидов (для профилактики и коррекции воспаления, которое неизбежно возникнет при гибели паразита) антипаразитарную терапию — альбендазол парентерально.
Симптом туннеля (специфический симптом!) вдоль стенки левого бокового желудочка от лобной доли в затылочную трактовки не получает. Очаг корково-подкоркового отека с геморрагией в левой гемисфере, соответствующий некротизирующему васкулиту [11, 12], — ситуация, давно известная при гельминтозах [6], трактовки не получает. На представленных снимках гельминт уже не визуализируется (погиб), но имеется текущее воспаление (в теменной, затылочной областях мозга), на которые можно и должно воздействовать — кортикостероиды парентерально.
Анализ на наиболее частые мутации митохондриальной ДНК (№ 11) при тромбофилиях патологии не выявил.
Через полгода пациент поступает снова для контроля состояния и реабилитации. В статусе — левосторонний грубый гемипарез, сила в руке — 3 балла, в ноге — 3 балла, спастический тонус в левых конечностях, поза Вернике–Манна, ходьба с костылем.
На МРТ головного мозга картина очагов локальной атрофии в лобной, теменной и затылочной долях слева, сохраняется линейная атрофия на месте хода нематоды из лобной доли в затылочную (туннель) (рис. 4, нижний ряд). Имевшееся сегментарное сужение проксимальной части левой средней мозговой артерии сохраняется без динамики. Степень расстройства функции (теперь уже невзирая на данные МРТ) не позволяет надеяться на клиническое восстановление, пациент обречен на инвалидизацию…
Прочие параклинические данные (кроме МРТ) наблюдавшихся 11 пациентов уже не имеют значения для обсуждаемого материала, как не несущие достоверной информации [3, 4].
Паразитарное поражение мозга гельминтами составило неожиданно актуальную проблему детской неврологии. Только за 2014–2017 гг. на двух клинических базах кафедры (многопрофильные детские больницы г. Москвы) выявлен 31 случай заболевания с поражением мозга. Откуда возникло такое количество пациентов — вопрос не к неврологу, а скорее к санитарному врачу; материал наблюдений (наличие у всех абсолютных диагностических критериев церебрального гельминтоза) ставит нас перед фактом.
Клиническая картина была чрезвычайно разнообразной, и ее описание не входит в задачи данной публикации.
Вернемся к публикациям Del Brutto (только потому, что он предложил развернутые критерии диагностики церебральных гельминтозов. Диагностические критерии нейроцистицеркоза — профессиональное увлечение Del Brutto, но, что справедливо для одних гельминтов, справедливо и для других (аналогично методам диагностики различных инфекционных агентов — вирусов или бактерий), и они подчеркивают приоритет методов нейровизуализации перед серологическими исследованиями.
В то же время у клиницистов бытует мнение, что для диагностики паразитоза обязательно серологическое подтверждение.
Следует подчеркнуть, что для серологических исследований рекомендуются методики ELISA и иммуноблота как более чувствительные, чем обычный иммуноферментный анализ. В г. Москве ни в одной лаборатории (как находящейся на бюджетном финансировании, так и коммерческих) методики ELISA и иммуноблота для гельминтов не применяются. Предвидя реакцию инфекционистов по вопросам серологической диагностики, позволительно задать вопрос, насколько достоверным является иммуноферментный анализ (ИФА) при диагностике, скажем, церебрального боррелиоза или туберкулеза [13, 14]. Например, мы в сентябре 2016 г. наблюдали только в одном стационаре 7 случаев классического нейроборрелиоза (острый менингит, поражение черепных нервов и радикулопатия с периферическими парезами конечностей), и ни в одном случае в остром периоде заболевания ИФА не дал положительного результата.
При отсутствии своевременного противоотечного (при живом) и противовоспалительного (при погибающем паразите) лечения высок риск развития стойких морфологических изменений мозговой ткани — атрофии и склероза, соответственно могущих приводить к стойкому дефекту нарушенной в остром периоде функции.
В то же время специфическое лечение назначает паразитолог или инфекционист (по существующим стандартам обязательного медицинского страхования невролог самостоятельно не имеет права как ставить диагноз церебрального нематодоза, так и назначать антипаразитарные препараты), незнакомый с абсолютными диагностическими критериями церебральных гельминтозов и ориентирующийся исключительно на серологическую диагностику. И если паразит погиб, то на имеющееся воспаление невролог может воздействовать, а как быть в том случае, если паразит жив, — воздействовать только на травматический (оставляемый движением паразита по мозговой ткани) отек и оставлять в покое инфекционный агент?
Данная проблема может быть решена только усилением внимания радиологов к нейровизуализационным проявлениям гельминтозов, а также санкцией инфекционистов на проведение антипаразитарной терапии.
Вывод
Литература
- Del Brutto O. H. Neurocysticercosis in infants and toddlers: report of seven cases and review of published patients // Pediatr. Neurol. 2013; 48; 6: 432–435.
- Del Brutto O. H. Neurocysticercosis // Neurophospitalist. 2014; 4; 4: 2005–2012.
- Чучин М. Ю. Церебральные гельминтозы и рассеянный склероз у детей. Дифференциальная диагностика и лечение // Клиническая неврология. 2015; 2: 23–30.
- Чучин М. Ю. Нейроцистицеркоз и другие церебральные гельминтозы у детей. Проблемы диагностики и лечения // Современная медицина. 2016; 4: 37–42.
- Song W. S., Wang B. R., Zhou W. W. et al. CT and MR characteristics of cerebral spranganosis // Am. J. Neuro Radiology. 2007; 28; 9: 1700–1705.
- Xinou E., Lefkopoulos A., Gelagoti M. et al. CT and MR imaging findings in cerebral toxocaral disease // Am. J. Neuroradiology. 2003; 24: 714–716.
- Del Brutto O. H. Neurocysticercosis // Continuum (Minneap. Minn.). 2012; 18: 1392–1416.
- Del Brutto O. H. Diagnostic criteria for neurocysticercosis, revisited // Pathol. Glob. Health. 2012; 106; 5: 299-30-45.
- Zibaci M., Frovech F., Bahrami P., Sadjadi S. M. Investigation of anti-toxocara antibodies in epileptic patients and comparison of two methods: ELISA and Western Blotting // Epilepsy Res. Treat. 2013. PMC 3654325; Pub. Online 2013; Apr. 22. DOI: 10. 1155/2013/156815.
- Zibaci M., Sadjadi S. M., Sarcari B., Uga S. Evoluation of Toxocara catis excretory-secretory larval antigens in serodiagnosis of human toxocariasis // J. Clin. Lab. Anal. 2016; 30; 3: 248–253.
- Aviv R. I., Benseler S. M., Silverman E. D. et al. MR imaging and angiography of primary CNS vasculities in childhood // Am. Journal Radiology. 2006, 27: 192–199.
- Benseler S. M, Silverman E., Aviv R. I. et al. Primary central nervous system vasculitis in children // Arthritis Rheumatology. 2006; 54: 1291–1297.
- Sousa V. M., de Carvalho L. I., Nucio S. M., Conceicao C., Silva R., Gouveia C. Meningomyeloradiculitis as an unusual presentation of neuroborreliosis in children // Pediatr. Infect. Des. 2015; 34; 10: 1132–1133.
- Ramachandran R., Muniyandi M., Iver V., Sripiya T., Priva B., Gouvindaraja T. G. Dilemmas in the diagnosis and treatment of intracranial tuberculomas // J. Neurol. Sci. 2017; 15; 381: 256–264.
М. Ю. Чучин, кандидат медицинских наук
ФГБОУ ДПО РМАНПО, Москва
К диагностике церебрального поражения нематодами/ М. Ю. Чучин
Для цитирования: Лечащий врач № 10/2018; Номера страниц в выпуске: 63-66
Теги: церебральный нематодоз, поражение мозга, серологический анализЧитайте также:

